|
EL ORIGEN MARINO DE
LAS ANOMALÍAS POR CROMO EN EL ESTADO DE CHIAPAS,
MÉXICO
Trabajo recibido el 15 de noviembre de 1980 y aceptado para
su publicación el 25 de agosto de 1981. El autor dedica este trabajo a
la memoria de Eduardo Schmitter Villada, insigne profesor e investigador en
mineralogía de la UNAM.
LISANDRO CASTELLANOS TRUJILLO
Universidad Nacional
Autónoma de México. Instituto de Ciencias del Mar y
Limnología. Contribución 274 del Instituto de Ciencias del Mar y
Limnología, UNAM.
Durante la
segunda mitad del año de 1978 y primera de 1979 se colectaron más
de 1000 muestras de arcilla en la parte alta del Estado de Chiapas con el fin
de estudiarlas principalmente por su contenido de alúmina soluble en
álcalis, detectándose en la mayoría la presencia del
cromo, constituyendo ésto una situación anómala.
El presente trabajo trata del origen de las anomalías de cromo
encontradas y después de discutir a que podrían deberse dichas
anomalías, se propone que éstas sean de origen marino. La
propuesta ánterior se ampara en los nódulos no bien definidos con
que eventualmente el explorador suele encontrarse, pero los existentes en el
distrito de la Trinitaria, como el artículo expresa, manifiestan origen
marino.
During the second half of 1978 and the first part of 1979, over 1000
clays samples were collected in the State of Chiapas in order to study the
alumina content soluble in alcalis. This led to the detection of an anomalous
cromium content in the majority of the clays.
This paper
deals with the origin of the cromium anomalies found in the clays and after
discussing the possibilities, the author proposes a rnarine origin. The
proposal is based on the not very well defined origin of certain nodule, others
in the Trinitaria district, as the artícle explains, are marine.
En la parte alta central del Estado de Chiapas, que se caracteriza por estar formado de rocas calizas del Cretácico que integran la sierra norte del mismo, se localizan suelos de espesores variables, siendo en algunas regiones notables por las anomalías en cromo que presentan. Este trabajo trata de explicar a que pudiera deberse la existencia de dichas anomalías y llega al desarrollo de una teoría que propone que son de origen marino. Los suelos que presentan las anomalías por cromo, son de aspecto arcilloso, con coloraciones en que predominan los matices rojos, pudiéndoseles encontrar amarillentos, ocres y grises, prácticamente estos suelos no contienen minerales primarios que son los formadores de rocas ígneas. En algunos casos, los suelos son abundantes en el mineral goethita y en otros se advierte la presencia de nódulos. El análisis térmico diferencial y la difracción de rayos X practicado a estas arcillas, ha reportado cuarzo, caolinita y gibsita principalmente; el análisis químico se ha mantenido constante en sus componentes, aunque estos manifiestan variabilidad en sus concentraciones porcentuales puede decirse que los principales formativos son: Oxido férrico Fe2O3; de aluminio Al2O3 de silicio SiO2; de Titanio TiO2 y agua de cristalización H20 +, como los reportados por Castellanos, Medina y Aguilera (1975). El aspecto y las características de estos suelos los hacen diferentes a los de la formación el Bosque con los que afloran alternativamente. Algunas de las muestras colectadas que estuvieron dentro del patrón anterior, al ser examinadas por cromo, indicaron la presencia de este elemento. ÁREA DE ESTUDIOLos suelos con las características antes mencionadas, pueden observarse aunque de manera no continúa desde la parte alta del cañón del Sumidero en Tuxtla Gutiérrez, hasta el municipio, de la Trinitaria y desde los municipios de Ocasingo al norte del estado hasta el de la Concordia al sureste del mismo casi al pie de la sierra del sur formada por rocas ígneas tipo granítico. Las localidades antes citadas forman los vértices que limitan una superficie de unos 15,000 km² y sobre ésta se encuentran algunas áreas cubiertas por suelos que son notables en la anomalía por cromo como lo confirman las muestras tomadas en la parte alta del cañón del sumidero en Tuxtla Gutiérrez; en el poblado de Oxchuc distrito de Ocosingo y en Ocosingo; en Yajalón; Chilón; Tenejada; Altamirano y en Monte Bello municipio de la Trinitaria que aparecen en la figura 1.
Fig. 1 MATERIALES Y MÉTODOSLas muestras de arcilla en que se localizaron anomalías de cromo fueron colectadas: 5 en la parte alta del cañón del sumidero en Tuxtla Gutiérrez; 5 en Yajalón; 5 en Chilón; 10 en Altamirano; 600 en el poblado de Oxchuc municipio de Ocosingo; 800 en Monte Bello municipio de la Trinitaria; 10 en Tenejada; 3 en la Concordia; 3 en el Río de Chiapa bajo el puente Belisario Domínguez y no se detectó el cromo en las muestras tomadas en Simojovel, Huistán, San Cristóbal Las Casas, Chanal, Las Rosas, Acala y Palenque, ni en el mismo Río de Chiapa a 2 km más arriba del puente Belisario Domínguez. En los lugares más muestreados que fueron Oxchuc y Monte Bello, se hicieron pozos hasta de 5m de profundidad para tomar muestras de metro en metro, utilizándose perforador manual tipo Auger, con extensiones de tubos de 1m de longitud y 2.54 cm de diámetro, galvanizados, mismos que se usan en la conducción doméstica de agua potable. La distancia de los puntos que formaron la retícula de muestreo para el caso de Monte Bello fue de 100 m; para Oxchuc de 10 m y en los demás casos la toma de las muestras obedeció más bien a cambios en la litología. El proceso que las muestras siguió en el laboratorio, consistió en secar aproximadamente 20 gr de cada una de ellas en estufa a la temperatura de 100-110°C durante una hora y después fueron molidas y pasadas por el tamíz de 80 mallas. A 2 gr de cada muestra en polvo se le hizo tentadura en vidrio de reloj para obtener la parte pesada y en esta se investigó el elemento cromo haciendo perlas de borax a la flama con la ayuda de un alambre de platino, obteniéndolas de color verde indicando este hecho la presencia del elemento cromo. La caolinita y gibsita, se determinaron en un aparato portátil como el mencionado por E. Schmitter (1962). Análisis térmico diferencial de Eberbach E. Son, Co., -de costo y mantenimiento muy reducidos, manipulación sencilla, rapidez de operación y fácil interpretación de sus curvas que fueron similares a la presentada en la figura 2. Las que se obtienen graficando las desviaciones de una aguja en un galvanómetro contra el incremento de temperatura indicado en un termopar. 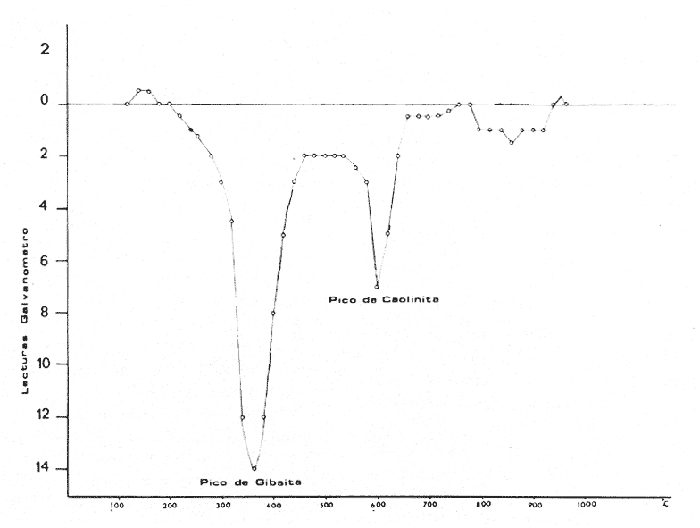 Fig. 2. Análisis término diferencial de una muestra de Monte Bello. Para el análisis químico practicado a las arcilas, se tomó un gramo de muestra seca y molida, se puso en crisol de platino con tapa, de 40 ml, se añadió 10 gramos de mezcla equimolecular de carbonatos de sodio y potasio, después de homogenizar la masa se fundió disolviéndola en 100 ml de ácido clorhídrico al 25% contenido en vaso pyrex de 250 ml, hasta disolución total de la masa. Después de extraer y lavar crisol y tapa, el contenido del vaso se evaporó a sequedad a 100°C, disolviéndose las sales con 100 ml al 25% de ácido clorhídrico y repitiendo la operación de secado a 100°C. Se disolvieron nuevamente las sales con 50 ml de solución clorhídrica al 25% calentando hasta la ebullición para poner en solución todas las sales menos la sílice que se aisló por filtración añadiendo pulpa de papel filtrando en papel Whatman 41 de 9 cm de diámetro. Después de lavar el precipitado con agua caliente al 2% clorhídrica, papel y precipitado se pasaron a crisol de platino previamente tarado y se calcinó calentándolo gradualmente hasta 1000°C; después de enfriado en secador con deshidratante y pesado el crisol se obtuvo la sílice por diferencia como el descrito por A. Obregón en métodos de análisis químicos de rocas y materiales similares. Separación de R2O3Las aguas filtradas y de lavados provenientes de la separación de la sílice, se llevaron a volumen de 200 ml, de aquí se tomó alicuota de 100 ml en vaso pyrex de 400 ml, se le añadieron 50 ml de solución precipitante preparada con 70 ml de hidróxido de amonio NH4OH (densidad 0.89 g/ml); 50 gr de nitrato de amonio y 100 gr de urea disolviendo todo en agua destilada hasta completar un litro. La solución problema con el reactivo precipitante se calentó hasta lograr una ebullición incipiente durante una hora. Se retiró del calor y se agregaron 5 gotas de hidróxido de amonio 1: 1 y unas gotas de rojo de metilo para asegurar un pH mayor a 5.5. El precipitado formado se filtró en papel filtro Whatman 41 lavándose con solución caliente de cloruro de amonio al 2%. Una vez escurrida totalmente la solución, filtro y precipitado se pasaron a crisol de por celana previamente tarado y se calcinó gradualmente hasta 1000°C manteniéndola así 10 minutos. Después de enfriado el crisol en secador provisto de deshidratante se pesó y por diferencia de peso se obtuvo el R2O3, representado por la suma de los óxidos de fierro Fe2O3; aluminio Al2O3 y titanio TiO2. En caso de haber fósforo se encontrará como P2O5. El peso de R2O3 es el contenido en 0.5 gr de muestra. La marcha anterior para R2O3, es la más recomendada por A. Obregón. Determinación del fierro como Fe2O3El precipitado R2O3 se pasa a un vaso pyrex de 100 ml se le añaden 2 gr de persulfato de potasio K2S2O8, se tapa con un vidrio de reloj y se calienta hasta que la masa funda y todo se haya disuelto en el persulfato de potasio fundido. Después de frío se añaden 50 ml de agua, se calienta hasta disolver la pasta y se pasa a matraz Erlenmeyer de 300 ml, al que se añaden 100 ml de agua destilada; 10 de ácido sulfúrico concentrado y 2 gr de granalla de cinc, se tapa con válvula de Bunsen y cuando toda la granalla ha sido atacada por el ácido, se valora el fierro contenido en la solución del matraz con permanganato de potasio KMnO4 0.1 N. (decinormal). % Fe2O3 = C.C.KMnO4xN0.07985x100/0.5 Determinación de óxido de titanio TiO2. De los 100ml de la solución restante se tomaron 10 ml pasándolos a matraz de 25ml. Se le agregaron 10 ml de una solución que se preparó disolviendo 25 gr de sulfato de berilo tetrahidratado BeS04.4H20 en 1400 ml de agua destilada a la que se añadieron 250 ml de ácido sulfúrico H2SO4 de densidad 1.84 g/ml y 25 ml de ácido fosfórico de densidad 1.8 g/ml, a esto se agregan 100 ml de agua oxigenada H2O2 al 30%. Esta solución es estable cuatro meses. Después de añadir 10 ml de esta solución a la muestra y completar el trazo del matraz de 25 ml con agua destilada, se desarrolla casi instantáneamente una coloración amarilla cuya densidad es susceptible de leerse en un foto colorímetro provisto de filtro de 420 mmc. El porciento de óxido de titanio se encuentra mediante el uso de una gráfica preparada previamente fundiendo 0.5 gr de TiO2 Q.P. en crisol de platino con 5 gr de persulfato de potasio K2S2O8conservando. el crisol tapado se deja enfriar y se disuelve en 500 ml de solución sulfúrica al 10%, esta solución fría se afora a un litro obteniéndose un patrón de 500 ppm de TiO2. Este método colorimétrico es usado por A. Obregón para cantidades no muy altas de TiO2 en rocas. Obtención de óxido de aluminio AL2O3Una vez que se tiene la suma de los óxidos de titanio y fierro, el de aluminio será la diferencia que existe entre la suma de aquellos y R2O3. Para poder efectuar el análisis químico a las arenas, primeramente se obtuvieron estas de las muestras secas y molidas colectadas en la misma región en que se encontraron los nódulos de manganeso (municipio de la Trinitaria). Para lo anterior se utilizaron embudos de separación y líquidos densos que en el presente caso fue bromoformo CHBr3, practicándose el análisis por óxidos de titanio TiO2; férrico Fe2O3; crómico Cr2O3 ; de zirconio ZrO2 y silicio SiO2, en la parte pesada. Análisis de óxido férrico. Por estar el fierro en presencia de cromo, se utilizo el método recomendado para este caso por la Comisión de Fomento Minero en Análisis de Minerales y consiste en fundir en crisol de níquel con tapa 0.5 gr de muestra con 5 gr de peróxido de sodio u oxilita Na2O2, después de la fusión pasar crisol y contenido a vaso de precipitados de 600 ml añadiendo 150 ml de agua destilada y 2 gr más de oxilita, hervir durante 15 minutos, dejar asentar el precipitado de hidróxido férrico, filtrar y lavar unas 8 veces con agua caliente para que el cromo pase a (la solución; pasar el precipitado de hidróxido férrico a vaso de 400 ml disolver con 100 ml de solución clorhídrica 1:1 y volver a precipitar el hidróxido férrico añadiendo indicador rojo de metilo y continuar el análisis como en el caso anterior usado para las arcillas. Determinación de óxido crómico Cr2O3A las aguas de lavado en donde se encuentra el cromo, se le añaden 15 a 20 gr de carbonato de amonio, se filtra y la porción filtrada en que se encuentra el cromo se recibe en matraz Erlenmeyer de un litro, se hierve y enfría añadiéndole cuidadosamente ácido clorhídrico concentrado hasta neutralizar la solución poniendo en exceso 25 ml se agrega agua destilada hasta 300 ml, un gramo de yoduro de potasio Kl y se titula con solución decinormal de tiosulfato de sodio usando almidón como indicador La cantidad de yodo liberado es proporcional a la cantidad de cromo presente. El método es el descrito en análisis de minerales por la Comisión de Fomento Minero. Determinación de óxido de ZirconioSe funden 0.5 gr de la muestra como en el caso anterior para cromo. La masa fundida se disuelve en vaso de precipitados de 400 ml con 30 ml de ácido clorhídrico y 100 ml de agita destilada, se separa el crisol y tapa y la solución del vaso se lleva a sequedad. Se recuperan las sales con 30 ml de clorhídrico concentrado Y 100 ml de agua destilada, se hierve durante 5 minutos y, se filtra para separar la sílice. Las aguas de lavado se diluyen a 300 ml se neutraliza la solución con hidróxido de amonio hasta la aparición de un precipitado el cual se redisuelve añadiendo 35 ml de H2SO4 concentrado (en presencia de titanio se añaden 10 ml de agua oxigenada al 3%) y se precipita el zirconio agregando 50 ml de solución de fosfato de amonio al 10% se lleva a ebullición durante 15 minutos dejándose reposar como mínimo 12 horas. El precipitado se filtra en papel filtro, se lava 10 veces con solución sulfúrica de fostato de amonio (0.1 g de fosfato de amonio y 20ml de ácido sulfúrico por litro). Se calcina en crisol de arcilla a 1000°C, se enfría y pesa como pirofosfato de zirconio ZrP2O7. El método anterior es el citado en Análisis de Minerales. Determinación de óxido de titanio. Para determinar el óxido de titanio en las arenas pesadas se eligió el método del azul de metileno citado en análisis de minerales debido a que dicho óxido deberá encontrarse en mayor cantidad que en las muestras de arcilla. Para lo anterior, se funde en crisol de fierro 0.5 o, de muestra con hidróxido de sodio NaOH y 2 g de peróxido de sodio Na2O2. Después de fundida y fría la pasta se disuelve en vaso de 400 ml con 200 ml de agua y 30 ml de ácido clorhídrico concentrado. Se hierve durante tres minutos se filtra recibiendo el filtrado en matraz Erlenmeyer de 500 ml se agregan a este 60 ml de ácido clorhídrico concentrado y se reduce con laminillas de aluminio puro. La solución se valora con azul de metileno 0.04 N a la temperatura cercana a la de ebullición en atmósfera de anhídrido carbónico. Determinación de sílice. La sílice SiO2, se determinó como en el caso de las arcillas. La pérdida al rojo o H2O+, se determinó por diferencia de pesada poniendo un gramo de muestra en crisol de porcelana previamente tarado y calentando gradualmente en mufla hasta 1000°C manteniendo esta temperatura 10 minutos más. En el caso de los nódulos de manganeso, estos después de secados a 100-110°C molidos en mortero de porcelana y pasados por el tamiz de 80 millas, se les practicó el análisis por los óxidos de silicio SiO2; férrico Fe2O3; manganeso MnO2; titanio TiO2 y pérdida al rojo o H2O+. Determinación de óxido de silicio SiO2. Se pesó 0.5 g de muestra, se fundió en crisol de platino como en el caso de las arcillas, únicamente la pasta fundida se desprende del crisol introduciendo este en vaso de 400 ml con solución nítrica al 25% en vez de usar ácido clorhídrico que en presencia de manganeso desprende cloro libre que ataca al platino. Salvo esta variante, el método se continúa igual. El óxido férrico se determinó atacando 0.5 g de muestra en vaso de 250 ml con 10 ml de ácido clorhídrico concentrado, calentando hasta estado sirupoco. Después se añade nítrico gota a gota y se sigue calentando hasta que la coloración oscura de aparezca. Se diluye el contenido del vaso en 100 ml de agua, se hierve, se añaden 5 g de cloruro de amonio y se precipita el hidróxido férrico con hidróxido de amonio precipitándose los hidróxidos de fierro y titanio, se hierve el precipitado, se filtra y lava 5 veces con agua caliente, se redisuelve con clorhídrico, se añaden 100 ml de agua, se vuelve a precipitar con hidróxido de amonio, se filtra y lava el precipitado que se transfiere al vaso original se redisuelve nuevamente con 10 ml de ácido clorhídrico, y se afora a 100 ml. De esta solución se toman 10 ml para determinación colorimétrica de titanio como TiO2, siguiendo los lineamientos ya descritos en el caso de las arcillas. A los 90 mil restantes, se les agregó granalla de plomo para reducir el fierro que se valora con solución tipo de dicromato de potasio K2Cr2O7, usando como indicador interno difenilamina. Determinación de bióxido de manganeso, MnO2. Se utilizó para esto el método de oxalato de Fresenius-Will modificado por Mohr. Citado en análisis de minerales. En un matraz Erlenmeyer de 500 m1 se pone 0.5 g de muestra, 60 ml, de ácido oxálico H2C2O4decinormal y 20 ml. de ácido sulfúrico 1:4, se caliente suavemente hasta que hayan desaparecido todas las partes oscuras, se diluye' con 200 ml más de agua caliente y se valora el exceso de oxálico con solución decinormal de permanganato de potasio KMnO4 En la pérdida al rojo o H2O+ se calentó la muestra a 1000°C como en los casos anteriores. RESULTADOS Y DISCUSIÓNEn estudios posteriores se ha encontrado que la causa de las anomalías de cromo en las muestras que los contienen, son unas arenas muy finas de color oscuro y aspecto metálico que son susceptibles de aislarse del resto de la muestra por medio de líquidos densos. El análisis de estas arenas ha reportado alto contenido en fierro y en titanio, siendo en ocasiones hasta más del 5 % de cromo en forma de Cr2O3. La tabla 1 muestra los resultados del análisis químico practicado a las arenas que se extrajeron por medio de líquidos densos, de muestras colectadas en Monte Bello, municipio de la Trinitaria. Si se observan las características de las muestras que contienen las arenas con cromo, se notará que éstas han estado sometidas a un proceso natural de edafisación que las ha conducido a una laterización, debiendo a esto sus contenidos en caolinita y gibsita.  TABLA 1 ANÁLISIS DE ARÉNAS SEPARADAS CON LÍQUIDOS DENSOS. D. Glinka explica que el proceso de laterización requiere de clima cálido, lluvioso y con vegetación, es decir que este proceso únicamente puede presentarse en ambiente continental. El problema se complica con la presencia ocasional de nódulos en dichas arcillas siendo los más característicos los encontrados en el municipio de la Trinitaria a 1.5 km al noreste del Lago Ensueño que se localiza en la región de Monte Bello, a una altura de 1,800 m.s.n.m. Dichos nódulos de manganeso concuerdan perfectamnete con los de origen marino y por ser éstos poco resistentes a la abrasión y compresión se puede pensar que no han sufrido transporte desde su formación y que es actualmente cuando están siendo removidos sin poder alcanzar grandes distancias antes de desintegrarse. La tabla 2 contiene el resultado del análisis químico de los nódulos de manganeso del municipio de la Trinitaria, Chiapas. Por la existencia tanto de los nódulos de manganeso como de la gibsita y coalinita en los suelosque nos ocupan, parece indicar que éstos han sido sometidos a dos procesos: uno marino que dio origen a los nódulos de manganeso y otro terrestre (e influenciado por el clima) que dio origen ala gibsita y caolinita conocido este último proceso como laterización, el cual no es lesivo a los nódulos de manganeso y por ello estos han podido subsistir a la fecha. La figura 2 muestra la existencia de gibsita y caolinita por análisis térmico diferencial practicado a una muestra tomada en la región de Monte Bello. 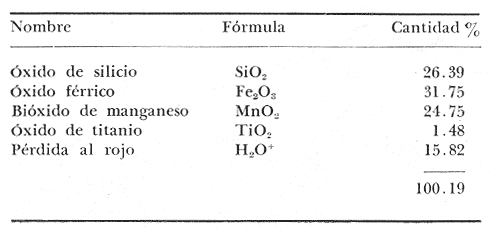 TABLA 2 ANÁLISIS DE ELEMENTOS MAYORES EN LOS NÓDULOS DE MANGANESO DEL MUNICIPIO DE LA TRINITARIA, CHIAPAS. Por la literatura referente a nódulos de manganeso que habla de su forma, color, composición química, dureza, etc., se puede adquirir algún conocimiento teórico para detectar la presencia de éstos en el campo. Por otra parte no esta fuera de toda lógica pensar que si tales nódulos son de procedencia marina y debido a una serie de sucesos se encuentran como en el presente caso en la meseta alta de Chiapas, otros materiales que también fueran de origen marino, por los mismos sucesos se pudieran encontrar en la misma situación. Volviendo al caso de las anomalías de cromo que como ya se dijo forman parte de las arenas finas de color oscuro y aspecto metálico, muy diseminadas en los suelos que los contienen, pueden deber su presencia a tres maneras: 1) que se hubieran formado por el proceso continental de laterización in situ; 2) que por proceso marino de lentas corrientes se depositaran junto con otros materiales en el lugar en que se encuentran y 3) que se formaran in situ por procesos marinos a partir de legias. De estas tres formas la primera es subárea y las otras dos restantes son submarinas. Para que la primera forma pudiera llevarse a cabo es indispensable la presencia del cromo en las rocas madres y luego por el proceso de laterización descomponerse éstas dando lugar a la acumulación de Fe2O3, Al2O3, TiO2 y Cr2O3 entre otros y dado que tales rocas con cromo no existen en el lugar, habrá que suponer que esas rocas con cromo existieron y que debido al proceso de laterización se han extinguido totalmente, exigiendo esto además un lapso largo, siendo que E. Ramos asigna a estas arcillas una edad geológica relativamente joven. Pero suponiendo que así sucediera, habrá que imaginar que las rocas que dieron origen al cromo y que debieron estar por encima de las calizas llegaron a acumularse sobre éstas por acarreos deltáicos o por corrientes marinas y depositarse antes o después de que se formaran los nódulos pero no al mismo tiempo pues las perturbaciones en el medio marino son contrarias a la formación de nódulos. De haber sucedido lo anterior deberían encontrarse en algunas partes horizontes enriquecidos en cromo como indicio de un estrato de rocas preexistentes, en lugar de la diseminación de arenas cromíferas en toda la masa arcillosa. En el segundo caso habrá que suponer únicamente la existencia de una corriente marina lo suficientemente lenta para no impedir la formación de los nódulos marinos pero con la competencia suficiente para llevar las arenas hasta el lugar en que se encuentran, pudiendo haber llegado éstas antes, después o al mismo tiempo en que se formaron los nódulos. El tercer caso se refiere a la genética de depósitos de minerales marinos y está ligado como lo indica E. Bonatti a la físico química, a la teoría de placas, a la actividad volcánica, a las corrientes de las aguas por debajo del fondo marino a las condiciones oxidantes de los fondos oceánicos y al aporte de las soluciones por aguas continentales al medio marino. En su esencia la teoría de placas explica que la corteza terrestre está dividida en "gajos" que forman placas litosféricas que se encuentran flotando sobre el magma caliente y fluido de la astenósfera. La actividad entre placa y placa depende del comportamiento que las une. Cuando dos placas chocan una de ellas se hunde nuevamente a la astenósfera y la otra se eleva para formar las montañas, dando lugar a zonas de subducción, si dos placas se friccionan paralelamente se formará una zona de desgaste por abrasión y si las placas tienden a separarse se abrirá una ventana por donde el magma tiende a salir, de cualquier manera en ambientes marinos se forman centros de expansión oceánica que dan origen a depósitos de minerales. La actividad volcánica que no se encuentra desligada de la teoría de placas, es importante porque es contribuyente de aguas hidroterminales, que al igual que las que circulan por debajo del piso oceánico a elevada temperatura y presión, por efectos físico químicos intercambian iones y disuelven minerales enriqueciéndose en metales, principalmente aquellos contenidos en los basaltos oceánicos. Estas aguas ricas en diversos elementos al salir al medio marino de aguas más frías, reducen sus productos de solubilidad y se forman depósitos de minerales cercanos a las zonas por donde estas salen, enriqueciéndose en minerales las aguas del medio oceánico. Esto se ha encontrado cerca de los centros de expansión. Las aguas oceánicas también pueden ser enriquecidas por los ríos que adquieren los elementos como resultado del intemperismo y la disgregación de las rocas continentales. Las condiciones oxidantes y alcalinas de las aguas marinas son de suma importancia porque de ello depende que en su seno se lleven a cabo los procesos de mineralización conocidos como hidrogénico y diagenético. Cuando se tienen las condiciones anteriores, como es el caso de las aguas marinas, el fierro, el manganeso y otros metales con productos de solubilidad muy pequeños, tienden a ser separados del medio acuoso. La extracción ocurre principalmente a través de reacciones inorgánicas dentro del campo de la físico química. Los metales con las anteriores características cuando están, en solución, son oxidados por el oxígeno disuelto en el agua formándose los óxidos e hidróxido correspondientes. Luego que los metales han sido extraídos, se depositan en el fondo oceánico como partículas finas o bien como películas que se adhieren a materiales sólidos que se encuentran sobre los fondos marinos. Es sabido que algunos organismos marinos acumulan ciertos metales concentrándose en las zonas que habitan siendo los más comunes los tunicados y las algas, de estas se ha reportado que pueden concentrar el cromo de 5 x 10-5 hasta 2 mg/kg. es decir 40,000 veces, cuando estos organismos mueren, se incorporan al sedimento. Un desarrollo como el anterior puede conducir a la extracción y concentración de los elementos. Cuando por el proceso hidrogénico (condiciones oxidante y alcalino) se han formado partículas coloidales de hierro y manganeso y en su recorrido se ponen en contacto con algunos cuerpos capaces de aprisionarlos aumentan estos su contenido de óxido de fierro y manganeso formando de esta manera los nódulos y explicándose la existencia en ellos de otros metales en menor concentración. Los procesos hidrogénicos incluyen la mayor parte de las concreciones de los fondos marinos conocidos como nódulos de manganeso que se desarrollan en regiones con muy poco aporte de materiales continentales, montañas marinas y bancos que forman playas aisladas. La dilución por los sedimentos detríticos y las lluvias constantes de partículas terrestres, inhiben también el crecimiento de los nódulos. Los depósitos diagenéticos (condición reductora) se forman en fondos marinos que contienen materia orgánica en los sedimentos que al descomponerse demandan el oxígeno disuelto por debajo del fondo marino. Cuando las partículas que se formaron por los procesos hidrogénicos caen y se hunden en el sedimento, al llegar a la zona reductora se disuelven y las soluciones del fierro y el manganeso se concentran fuertemente en los poros del sedimento, tendiendo a emigrar a la parte superior por difusión. Al llegar otra vez a la zona de oxidación forman nuevamente partículas sólidas, actuando la zona intermedia entre la de oxidación y reducción como medio concentrador de algunos metales pudiendo también formarse por este proceso concresiones en los fondos marinos. Los minerales diagenéticos son diferentes a los hidrogénicos por ejemplo la relación fierro-manganeso es mayor en los primeros, sin contar que cuando el ión sulfuro se presenta por la descomposición de la materia orgánica, retiene primeramente al fierro por ser más afín a este que al manganeso. La presencia de elementos de menor concentración está también en mayor cantidad en los depósitos hidrogénicos que en los diagenéticos. ConclusionesDada la existencia en el municipio de la Trinitaria de nódulos de manganeso que por sus características se clasifican como marinos y dado que de las tres maneras antes expuestas referentes a la existencia del cromo, lo difícilmente que sucediera la primera forma hace más elegibles las otras dos en que ha intervenido algún proceso marino, son el motivo por el cual el presente trabajo se titula "El origen marino de las anomalías por cromo en el Estado de Chiapas, México." Descripción de los nódulos de manganeso del municipio de la Trinitaria. Son esferas ligeramente ovoides de color café, puede decirse que están dentro de la clasificación que J. L. Mero designa con el nombre de "Wal", sus tamaños no son uniformes, las más grandes alcanzan 4 cm, estando la mayoría comprendidos entre 1.5 a 2 cm. Generalmente la razón entre el eje mayor y el menor es alrededor de 1 en los nódulos más chicos y 1.2 en los más grandes. La superficie es rugosa y lobulada, la dureza en la escala de Mohs es cercana a 3; por corte transversal pueden observarse capas concéntricas; en el centro tienen un núcleo de color negro seguido de una delgada capa de color menos oscuro, siguiendo nuevamente otra capa más gruesa de color negro rodeada ésta totalmente por otra delgada de color menos oscuro y por último la capa exterior, la más gruesa de todas, del mismo color del núcleo tornándose café en el exterior. El análisis químico (Tabla 2) por presentar la relación de 1.2 entre el fierro y el manganeso, la poca diferencia de éstos sugiere que dichos nódulos debieron haberse formado por proceso hidrogénico es decir, en mares con condiciones oxidantes, alejados de costas, montañas y bancos marinos, a los que no llegaba la perturbación de las corrientes y de los aportes continentales. La figura 3 corresponde a una fotografía de los nódulos descritos.  Fig. 3. Nódulos de manganeso del distrito de la Trinitaria, Chiapas. AgradecimientosA Eduardo Schmitter Villada, por sus valiosos consejos y sugerencias. A Juan Manuel Cruz, por su colaboración en el análisis químico de las muestras. LITERATURABONATTI, E.,Scientific American The origin of metal deposits in the oceanic lithosphere. 1978.54-61.238 (2) CASTELLANOS, L., V. M. MEDINA y N. AGUILERA Bol. Inst. Geol. Univ. Nal. Autón. México Los hidróxidos de aluminio en los suelos de Chiapas.1975.91-120.59 COMISIÓN DE FOMENTO MINERO Análisis de Minerales.Talleres Gráficos de Luysil de México, S. A. 1977. 200 p. GLINKA, K. D., Treatise on Soil Science. Translate from Rusian published by the Israel program for Scientific Translation:1963.341-366. MERO, T. J., The Mineral Resources of the Sea.Elsevier Publishing Company.Amsterdam1965.127-231. OBREGÓN-PÉREZ, A., Inst. Geol., Fac. Química, Univ. Nal. Autón. México.(mimeografiado). Métodos de análisis químicos de rocas y materiales similares. 2a. ed. 1977.92 p. RAMOS, L. E.,Geología de México.2a. edición.México, D. F.1979.49.Tomo III SCHMITTER, V. E., Bol. Inst. Geol. Univ. Nal. Autón. México Curvas de análisis térmico diferencial cualitativo, obtenidos de estudios de bauxitas, arcillas bauxiticas y otros minerales.1962.1-57.63
|

