|
BIOLOGÍA Y
ECOLOGÍA DEL BAGRE ARIUS MELANOPUS GÜNTHER EN LA LAGUNA DE
TÉRMINOS, SUR DEL GOLFO DE MÉXICO (PISCES: ARIIDAE)
Trabajo
recibido el 28 de agosto de 1980 y aceptado para su publicación el 18 de
noviembre de 1980.
ANA LAURÁ LARA-DOMÍNGUEZ
ALEJANDRO YÁÑEZ-ARANCIBIA
,FELIPE AMEZCUA LINARES
Universidad Nacional Autónoma de México,
Instituto de Ciencias del Mar y Limnología, Laboratorio de
Ictiología y Ecología Estuarina. Contribución 229 del
Instituto de Ciencias del Mar y Limnología, UNAM.
Arius melanopus Güntlier, se distribuye en
todos los ambientes (habitat) que componen el sistema ecológico de
Laguna de Términos. Tiene una gran capacidad euritermohalina, tolerando
rangos de salinidad de 0 a 26 ppm, temperatura de 19 a 35ºC y
transparencia de 20 a 80%. Su abundancia se manifiesta en un gradiente
altamente correlacionado con la salinidad, la temperatura y la turbidez. Esto
es, 1.38 gm-² en el interior de la Isla del Carmen y hasta 18.58
gm-² en los sistemas Fluvio-Lagunares.
Se presentan
dos poblaciones marcadas juveniles en los sistemas Fluvio-Lagunares y adultos
en toda la laguna, ambas durante todo el año. Son abundantes los machos
entre 160 y 222 mm LT incubando huevecillos y/o embriones en sus bocas, en
agosto y septiembre. La especie alcanza la madurez gonádica entre
160-165 mm LT y se reproduce en los sistemas Fluvio-Lagunares, en salinidades
menores de 12 ppm, temperaturas de ± 35ºC y transparencia de 20 a
40%. La relación sexual encontrada fue de (femenino) : (masculino) =
1.3:1. Completa todo su ciclo biológico en Laguna de
Términos.
Después del periodo de
incubación, la población adulta migra hacia las áreas de
la Isla del Carmen, en el sentido inverso al gradiente (mayores salinidades,
menor temperatura y menor turbidez). El espectro trófico es muy amplio.
Es un consumidor de Segundo Orden, preferentemente carnívoro,
incorporando importantes cantidades de detritus en su dicta. Presenta
variaciones de sus hábitos alimenticios de acuerdo con la
edad.
Se propone un modelo conceptual del ciclo
bio-ecológico de esta especie típicamente estuarina, destacando
sus estrategias reproductivas, alimenticias y patrón de
migración.
Arius
melanopus is distributed in all the habitats of the Terminos Lagoon
system. It was collected in waters with salinities ranging from 0 to 26 ppt,
temperatures from 19 to 35ºC and transparence from 20 to 80%. Abundance
was correlated with salinity, temperature and turbidity. Biomass ranged from
1.38 g wet Wt m-² in the interior of Carmen Island to 18.58 g wet Wt
m-² in the Fluvial-Lagoon systems (FLS).
There were
two distinct populations: juveniles in the FLS and adults throughout all the
lagoon. The species completes its total lífe cycle in the lagoon.
Spawíng takes place in the FLS in salinities less than 12 ppt,
temperature of about 35ºC in few transparency (20-24%). Adult males
(160-222 mm) incubate eggs and embryos in theirs mouth in August and September
in the FLS. juveniles reached peak abundance in the FLS during September and
October. The sex ration was 1.3 (masculino):19 (femenino).
After period of incubation, the adult population migrates to the
Carmen Island inner area with high salinity and water clarity and lower
temperature. The trophic spectrum is very wide. Both adults and juveniles are
second orden consumers. They are preferentially carnivorous but also consume
significan quantities of organic detritus. There is a change ¡a diet
with age: juveniles consume mainly meiobenthic organism. while adults consume
principally macrobenthos.
A conceptual model of the bio
ecological cycle of this species with respect to reproductive and feeding
strategy, and patterns of migration, is presented.
Los ecosistemas lagunares son áreas que presentan una complejidad ambiental que hacen que los estudios de su ecología sean extensos, multidisciplinarios y necesariamente integrativos. Distintas pesquerías dependen de estas áreas y por lo tanto son importantes en la producción de alimento (Smith et al., 1966). Por distintas razones de la trascendencia de los usos y recursos de las lagunas costeras, el Instituto de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México, inició en julio de 1976, un programa de investigación multidísciplinario en la Estación "El Carmen". Estas investigaciones forman parte del Programa denominado "Recursos Bióticos en Lagunas Costeras, Manglares y Áreas Adyacentes en América Latina (Proyectos Pilotos Comparativos en el Golfo de Nicoya, Costa Rica; Bahía de Puerto Viejo, Azua, República Dominicana; Laguna de Términos, Campeche, México"), proyecto del "Fondo Mar del Plata" del Programa Regional de Desarrollo Científico y Tecnológico de la Organización de los Estados Americanos (OEA). En los estudios ecológicos el análisis de la estructura de las comunidades de peces, proporcionan un conocimiento general del sistema lagunar. Este componente ecológico desarrolla un importante papel en la transformación, conducción, intercambio, almacenamiento y regulación energética en el ecosistema como lo han discutido YáñezArancibia y Nugent (1977) e indirectamente Mc Dowall (1976). En el laboratorio de Ictiología y Ecología Estuarina del Instituto de Ciencias del Mar y Limnología se están realizando estudios ecológicos en Laguna de Términos para tener una correcta interpretación y evaluación del ecosistema. Los primeros resultados de esas investigaciones se han reportado en los trabajos de Bravo-Núñez y Yáñez-Arancibia (1979), Yáñez-Arancibia y Day (1981), Amezcua-Linares y Yáñez-Arancibia (1980), Yáñez-Arancibia (1980), Yáñez-Arancibia et al. (1980) y Vargas Maldonado et. al.(1981). OBJETIVOSEl análisis y discusión de la ecología de poblaciones y de sistemas en el área, ha permitido precisar diferentes habitat en la Laguna de Términos y caracterizar comunidades con distintas poblaciones que han adaptado sus estrategias reproductivas y alimenticias a este ecosistema complejo. Entre estos últimos, la población del bagre marino,Arius melanopus Günther presenta una alta frecuencia de pesca y amplia distribución. La especie reviste gran importancia ecológica y económica y, de acuerdo a la introducción y a los antecedentes descritos, ello permite plantear el presente trabajo con los objetivos que ha continuación se puntualizan: 1. Caracterizar la distribución y abundancia de la especie en la Laguna de Términos y los posibles patrones de ellas. 2. Determinación de un modelo de regresión lineal de la especie para análisis de longitud/peso. 3. Análisis de la madurez gonádica y la reproducción. 4. Determinación del espectro trófico en base a su alimentación y hábitos alimenticios y discutir su ecología trofodinámica. 5. Establecer el comportamiento de la especie, así como su papel ecológico en la laguna, entregando algunos valores de su productividad secundaria. 6. Discutir un modelo de su cielo biológico. ANTECEDENTESDistintas especies de bagres marinos se han reportado en publicaciones recientes sobre estudios ecológicos ictiofaunísticos en la Laguna de Términos y áreas adyacentes. Cabe citar a Bravo-Núñez y Yáñez-Arancibia (1979) quienes describen la estructura de las comunidades nectónicas en la Boca de Puerto Real; Amezcua Linares y Yáñez-Arancibia (1980) que estudian la ecología de las comunidades de peces e interacciones del habitat en los sistemas Fluvio-Lagunares; Vargas Maldonado et al.(1981).y Yáñez-Arancibia (1980) describen las comunidades nectónicas en áreas de Rhizophora mangle y Thalassia testudinum; Yáñez-Arancibia et al. (1980) integran una discusión del conocimiento ecológico de la laguna y la incidencia de la estructura y función de las comunidades de peces; finalmente Sánchez Gil et al. (1981) en un trabajo sobre la Plataforma continental frente a la Laguna de Términos también incluyen en sus registros especies de bagres. En conjunto, todos estos estudios registran a Arius melanopus, Arius felis y Bagre marinus para ecosistemas costeros del sur del Golfo de México. Diferentes estudios existen sobre la familia Ariidae, en sus diversos aspectos. Gudger (1912, 1916, 1918), Lee (1931, 1937) y Luengo (1972, 1973) estudian algunos aspectos sobre la reproducción de Felichthys felis, Galeichthys felis y Arius felis (sinónimos algunos de ellos). Tavolga (1977) estudia los mecanismos de orientación enArius felis y Doermann et al . (1977) realiza estudios, en esta misma especie, sobre edad y crecimiento. González (1972) describe algunas especies de esta familia en las lagunas del Noroeste de México como Bagre panamensis, Galeichthys caerulescens, Galeichthys gilberti Netuma kessleri, Netuma platypogony Arius liropus. Una contribución sobre la taxonomía de la familia Ariidae es realizada por Mohammad (1974). Sobre estudios ecológicos Harris y Rose (1968) realizan un estudio sobre la predación del camarón por Galeichthys felis.En las costas del Pacífico, Amezcua Linares (1977) reporta para el sistema lagunar costero de Huizache Caimanero en Sinaloa, las especies Gale¡chthys caerulescens y Arius liropus, discutiendo, en la primera, algunos de sus aspectos biológicos. Yáñez-Arancibia (1978) realiza un estudio ecológico en las lagunas costeras con bocas efímeras reportando tres especies de esta familia i.e.,Galeichthys caerulescens, Galeichthys gilberti yArius liropus. Yáñez-Arancibia et al. (1976) realizan una prospección biológica y ecológica de Galeichthys caerulescens en el sistema lagunar de Guerrero. Yáñez-Arancibia y Leyton (1977) describen el desarrollo embrionario del otolito en Galeichthys caerulescens. Gracia Gasca y Lozano Álvarez (1980) analizan los hábitos alimenticios de Netuma platypogon y su relación ecológica como predador de larvas de langostas. Esta información es básica para los objetivos planteados en el presente trabajo. El análisis de esta literatura permite establecer la importancia que tiene esta familia de peces en los ecosistemas costeros, por su diversidad, distribución y abundancia. Asimismo, se puede establecer que la especie Arius melanoptts Günther nunca ha sido estudiada y sólo se conoce de ella los registros mencionados en la literatura específica del área, incluyendo la especieCathorops spixii (Agassiz, 1829) catalogada por Fisher (1978), la cual, aparentemente, es un sinónimo de la especie de este estudio. ÁREA DE ESTUDIOLa Laguna de Términos se localiza en el sur del Golfo de México frente a la Sonda de Campeche (Fig. 1). Es un área somera y amplia, con un promedio de 3.5 m de profundidad y 2,500 km² de superficie. El clima es tropical húmedo con un rango de precipitación anual de 1,100 a 2,000 mm. El rango de mareas es de 0.5 a 0.7 m. Dos bocas conectan la laguna con el mar y existe un fuerte flujo de agua hacia el oeste causado por los vientos predominantes del este, la corriente litoral, y la descarga de los ríos. Por este patrón de circulación se presenta un gradiente semipermanente de salinidad, turbidez, niveles de nutrientes, tipos de sedimentos, asociaciones de foraminíferos y de macrobentos, y migración de peces y camarones. 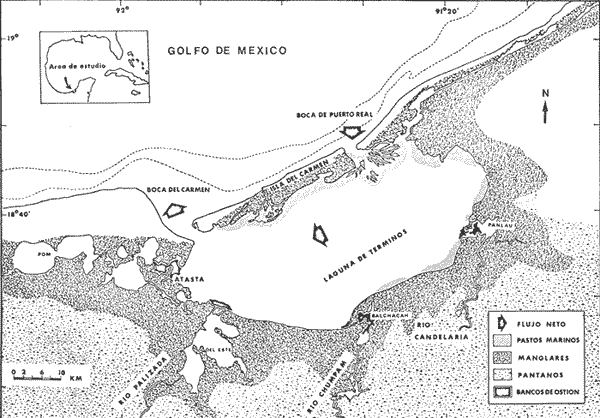 Fig. 1. Localización de la Laguna de Términos, Campeche. Se señala los rasgos geográficos y toponímicos principales y la distribución de los diferentes habitat ecológicos del sistema. Se destaca la dirección del flujo neto de las aguas y la zona de pastos marinos que indican áreas de mayor influencia marina. Se muestran los cuatro sistemas Fluvio-Lagunares principales asociados a la Laguna (Tomada de Yáñez-Arancibia et al, 1980). Hay tres épocas climáticas: la época de lluvias de junio a octubre, la época de "nortes" o tormentas de invierno de noviembre a febrero y la época de secas de febrero a mayo. La parte sur de la laguna recibe más del 50% del aporte de agua dulce. Existe gran diversidad de ambientes estuarinos (subsistemas o habitat) en la laguna, incluyendo pantanos de manglar salobre y de baja salinidad, pastos marinos, pastos de pantanos, áreas de alta sedimentación, arrecifes de ostión y la cuenca central oligohalina. Se presentan dos fuentes de sedimentos en la laguna: sedimentos fluviales y sedimentos calcáreos provenientes de las playas al este de la laguna. La salinidad es elevada al norte y noroeste de la laguna durante la época de secas. La química de los nutrientes en la laguna está determinada por la circulación, el flujo de los ríos, y la biología del complejo estuarino. La salinidad y el aporte fluvial son los factores principales que controlan el fósforo y las formas oxidadas del nitrógeno inorgánico durante la estación lluviosa. Durante la época de secas la concentración de compuestos inorgánicos parece estar correlacionada con las condiciones locales como la turbulencia, el tipo de sedimentos, la tasa reductora y la actividad biológica. Tanto la productividad de los manglares como del fitoplancton es mayor en las áreas de influencia fluvial. La sobresaturación de oxígeno en algunas áreas durante la época de lluvias también indica una producción neta. Poblaciones bénticas definidas se restringen a los diferentes habitat en la laguna y están controladas por la salinidad, el aporte fluvial, turbidez y el tipo de sedimentos. El análisis de la afinidad de las poblaciones de peces muestra un alto grado de significancia estadística relacionado con los habitat dentro de la laguna. Hay un patrón de migración y/o colonización comenzando en la Boca de Puerto Real. Por otra parte, los camarones parecen inmigrar principalmente a través de la Boca del Carmen. Amplios detalles de esta síntesis pueden encontrarse en los trabajos siguientes: Phleger y Ayala-Castañares (1971), Gierloff-Emden (1977), Yáñez-Arancibia y Day (1981), Bravo-Núñez y Yáñez-Arancibia (1979), Amezcua Linares y Yañez-Arancibia (1980), Vargas Maldonado et al., (1981). MATERIAL Y MÉTODOS
ACTIVIDADES DE CAMPOLas capturas de peces se efectuaron desde el mes de julio de 1976 a marzo de 1979 de la siguiente forma: 1976 muestreo mensual de julio a diciembre 1977 capturas en los meses de enero, marzo, mayo, julio y septiembre. 1978 capturas en los meses de enero, febrero, abril, junio, agosto y octubre. 1979 captura del mes de marzo. La disposición de las estaciones de colecta fue de forma tal que caracterizara áreas contrastantes de la Laguna de Términos; esto es, ambientes dulceacuícolas y de baja salinidad y ambientes marinos (Fig. 2). Como la especie es tan abundante de día como de noche, las colectas se realizaron durante el día, a profundidades que no excedieron los 4 m. Se empleó una embarcación de fibra de vidrio de 7 m de eslora y equipada con un motor de 40 H.P. El arte de pesca fue una red de prueba camaronera de 10 m de largo y 9 m de boca (abertura de trabajo de 5 m), puertas de 0.8 por 0.5 m y luz de malla de 3/4 de pulgada. Los arrastres fueron de 15 a 30 min. de duración. Conjuntamente en cada estación de muestreo se realizaron mediciones de los siguientes parámetros: temperatura, salinidad, oxígeno, profundidad y transparencia. Se realizaron observaciones respecto a: tipo de vegetación sumergida y circundante, macrofauna béntica, mareas y datos climáticos. Los organismos capturados fueron fijados en formalina al 10% previamente neutralizada con borato de sodio. A los peces se les realizó una incisión ventral para la fijación del contenido estomacal y gónadas. MATERIAL DE ESTUDIODe los 22 cruceros realizados (173 colectas), se obtuvieron un total de 1691 ejemplares de la especie Arius melanopus Günther (Fig. 3), distribuidos como se muestra en las tablas 1 y 2. La colección total tiene un rango de 40 a 280 mm de longitud total. La colección de referencia queda depositada en el Laboratorio de Ictiología y Ecología Estuarina del Instituto de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México.  TABLA 1 PERIDO DE SECAS 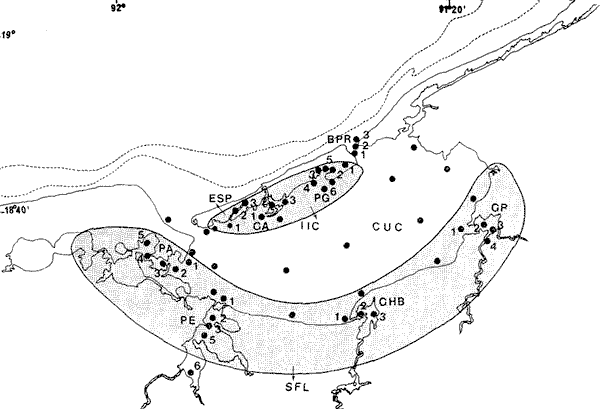 Fig. 2. Área de estudio. Localización de las zonas de muestreo. IIC = Interior de la Isla del Carmen. SFL = Sistemas Fluvio-Lagunares. CUC = Cuenca Central.  Fig. 3. Arius melanopus Günther, Macho de 276 mm LT. Catálogo CCML-PF 0,001569/1573 (Camp.)  TABLA 2. PERIODO DE LLUVIAS ACTIVIDADES DE LABORATORIOLos peces fueron lavados, separados, reetiquetados y envasados en frascos de vidrio con alcohol metílico al 70%. La posición taxonómica de la especie fue determinada por los métodos convencionales y el empleo de la literatura básica, principalmente los trabajos de Jordan y Evermann (1896-1900) y de Meek e Hildebrand (1923-1928); Reséndez (1970, 1973), Perry y Perry (1974), Castro Aguirre (1978) y Fisher (1978). Las mediciones de longitud fueron hechas con un ictiómetro convencional de 50 cm, y las de peso, sobre material fijado, en una balanza Ohaus Triple Beam de 0.1 g de precisión y 2,610 g de capacidad. RELACIÓN LONGITUD/PESOPara el análisis de regresión lineal se consideró la relación entre el peso en gramos y la longitud total en milímetros. La función resultante es una exponencial, por ser la relación que existe entre una dimensión lineal y otra cúbica. La fórmula es la siguiente: P = a · Lk donde: P = peso en gramos L = longitud en milímetros a y k = coeficientes a determinar La transformación logarítmica de la función (1) da una ecuación lineal del tipo: log P = log a + k log L (2) Para ajustar las rectas de regresión lineal se utilizó una rutina del paquete BASIS (Burroughs Advanced Statistical Inquiry System) llamada "Multiple Linear Regression Analysis" con instrucciones para el cálculo de logaritmos, con la finalidad de hacer lineal el modelo. DETERMINACIÓN DE SEXOS y ANÁLISIS GONÁDICOEn general, para muchos peces, no existen carácteres sexuales externos evidentes; por lo tanto es necesario proceder a disectarlos para reconocer el sexo. En las hembras las gónadas son de gran tamaño y de forma de saco presentando una luz central. En los machos las gónadas son consistentes, es decir no presentan luz. La escala de fases de desarrollo sexual considerada en el presente trabajo es la recomendada por Nikolsky (1963). RELACIONES TRÓFICASSe examinaron 137 estómagos incluyendo a individuos juveniles y adultos. El examen de los estómagos y el estado del pez se hizo siguiendo el criterio de Laevastu (1971). El grado de llenado de los estómagos fue determinado de acuerdo a si éste se encontraba: lleno, medio lleno, casi vacío o vacío. El estado del pez fue determinado de acuerdo a: delgado, si no presentaba rastro de grasa en el tracto digestivo; no muy gordo, si tenía un hilillo de grasa a lo largo del tracto digestivo; muy gordo, si se encontraba el tracto digestivo totalmente envuelto en grasa. Para el análisis de las fases de digestión del contenido estomacal se siguieron los siguientes criterios: Carranza (1969) el cual considera las 4 fases siguientes: Fase I material recién digerido. La digestión aun no se inicia, los organismos se pueden identificar. Fase II el proceso digestivo se ha iniciado pero no está muy avanzado, el contenido puede ser estudiado fácilmente. Fase III digestión bastante avanzada, pero aún se puede reconocer los organismos aunque muchas de las estructuras han desaparecido. Fase IV contenido estomacal muy digerido, irreconocible. El criterio de Yáñez-Arancibia (1975), toma en consideración sólo tres grados de digestión de acuerdo a si el alimento se encuentra fresco, medio digerido o digerido. De acuerdo al tamaño de los estómagos, al tamaño y tipo de alimento y el grado de digestión, es necesario combinar entre sí los diferentes métodos para obtener una información más clara sobre la preferencia alimenticia en determinadas áreas. Se eligieron los métodos volumétrico, gravimétrico, numérico, de frecuencia, el índice de importancia relativa de Pinkas et al. (1971), así como el índice de importancia relativa de Yáñez-Arancibia et al. (1976). La descripción detallada de estos métodos se encuentra en la referencia de Yáñez-Arancibia et al.(1976). El índice de importancia relativa (Pinkas et al ., 1971) consiste en las relaciones obtenidas por los métodos volumétrico, numérico y de frecuencia, ya que por sí solos pueden aportar muy poco en la verdadera evaluación del contenido estomacal y las relaciones tróficas de la especie. Este método es útil para interpretar la importancia relativa de algún alimento en específico constituido por elementos de tamaño homogéneo. Sin embargo, puede introducir errores, ya que pueden existir numerosos organismos pequeños que opaquen la importancia relativa de otros de gran tamaño; asimismo, la velocidad digestiva distorciona las medidas volumétricas y en lo que se refiere a la frecuencia ésta es sensible a los errores de muestreo. El cálculo del índice (IRI) se realiza por la suma del porcentaje numérico y el porcentaje volumétrico, multiplicados por el valor porcentual de la frecuencia, quedando la siguiente expresión: IRI = F (N+V) (3) donde: IRI representa el índice de importancia relativa, F representa el porcentaje de frecuencia, N el porcentaje numérico y V el porcentaje volumétrico. El índice de importancia relativa (Yáñez-Arancibia et al., 1976), permite la cuantificación de la importancia relativa de determinado grupo trófico dentro de la alimentación de cada especie. Relaciona la frecuencia y el volumen del alimento siendo los parámetros más importantes en la alimentación de los peces. La relación matemática es la siguiente: IIR = F·V ÷ 100 (4) donde: IIR representa el índice de importancia relativa, F el porcentaje de la frecuencia y V el porcentaje volumétrico. Esta expresión es porcentual presentando un rango natural de 0 a 100. Se descarta el parámetro numérico por cuanto otorga la misma importancia a organismos pequeños y grandes y en términos de ecología energética el error de interpretación puede ser muy grande. La combinación del índice de importancia relativa con la frecuencia y el volumen en una gráfica (Fig. 4), permite la representación del espectro trófico el cual queda delimitado por el porcentaje volumétrico y el porcentaje de frecuencia y evaluados por el índice de importancia relativa en relación a tres cuadrantes: Cuadrante I. (ABCD)Zona de grupos trófico accidentales o circunstanciales. Está definido por el rango combinado de frecuencia y volumen de 0 a 20% que representa grupos tróficos de importancia baja; y para el índice de importancia relativa se define el rango evaluativo de 0 a 10% que son grupos tróficos de importancia relativa baja. Cuadrante II. (DEFG)Zona que define los grupos tróficos secundarios, presentando un rango combinado de volumen y frecuencia de 20 a 40% que representa grupos tróficos de importancia secundaria y un rango evaluativo del índice de importancia relativa de 10 a 40% siendo grupos de importancia relativa secundaria. Cuadrante III. (HIJK)Zona de grupos preferenciales siendo determinados por un rango combinado de volumen y frecuencia de 40 a 100% que define grupos tróficos de importancia alta, y el rango evaluativo del índice de importancia relativa de 40 a 100% que representa los grupos tróficos de importancia relativa alta. 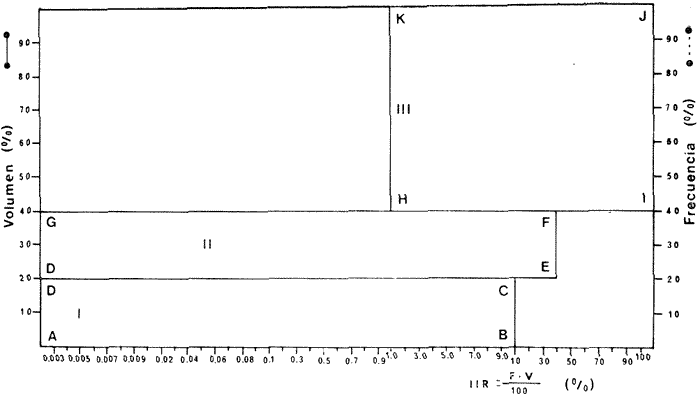 Fig. 4. Cuadro de relación de volumen, frecuencia e índice de importancia relativa, para representar y evaluar espectros tróficos cuantitativos. Diagrama Trófico Combinado. (Tomado de Yáñez-Arancibia et al., 1976). El índice de cantidad de alimento ingerido empleado por Aoyama (1953), Yakota (1956), Yasuda (1960), Yáfiez-Arancibia (1975) y Yáñez-Arancibia et al.(1976) expresan el peso del alimento en el estómago del pez con. la fórmula Ica = PCE ÷ PT (5) donde: Ica es el índice de cantidad de alimento ingerido, PCE representa el peso del contenido estomacal y PT representa el peso total del pez. En este trabajo también se estudia esta relación gravimétrica del alimento y puede discutirse su variación en relación al crecimiento de la especie. ABREVIATURAS UTILIZADAS EN TABLAS Y GRÁFICASAc = Acaro An = Anfípodos BPR = Boca de Puerto Real CA = Bajos del Cayo CHB = Sistema Chumpan-Balchacah Ci = Cirrípedos CO = Copépodos CP = Sistema Candelaria-Panlau Cu = Cumáceos CUC = Cuenca Central Eq = Equinodermos Es = Espículas Eu = Eufáucidos Esc = Escamas ESP = Estero Pargo Fo = Foraminíferos Ga = Gasterópodos HI = Huevos de invertebrados HP = Huevos de peces Is = Isópodos IIC = Interior de la Isla del Carmen LC = Larvas de crustáceos LI = Larvas de insectos LM = Larvas de moluscos MNG = Puntilla Manigua MOND = Materia orgánica no determinable Ne = Nemátodos OI = Oligoquetos OS = Ostrácodos PA = Sistema Pom-Atasta PC = Pelecípodos Pe = Sistema Palizada-del Este. Boca del Carmen PG = Punta Gorda Po = Poliquetos Pec = Peces PEC = Sistema Palizada- del Este. Boca del Carmen RA = Restos de anélidos RC = Restos de crustáceos RV = Restos vegetales SFL = Sistemas Fluvio-Lagunares Ta = Tanaidáceos RESULTADOS
DISTRIBUCIÓNAparentemente por la distribución en áreas poco conocidas como son el sur del Golfo de México y el noroeste del Caribe y por sus hábitos estuarinos, es que existen pocos registros para la especie y sus límites de distribución pueden estar poco precisados. Meek e Hildebrand (1923-1928) la ubican desde el río Papaloapan, México, hasta Panamá. Castro Aguirre (1978) amplía su distribución hasta Tampico, Tamaulipas, en el Golfo de México. Perry y Perry (1974) la reportan para la costa Atlántica de Costa Rica. Reséndez (1970, 1973) la reporta en las Lagunas de Tamiahua y de Alvarado en Veracruz. Castro Aguirre (1978) además, la reporta para las costas mexicanas de Tuxpan, Veracruz, el río Papaloapan, Veracruz; Laguna de Términos y río Champotón en Campeche. Además de los registros que menciona la literatura específica sobre los peces de la Laguna de Términos en la sección de antecedentes. En el área de estudio se registró en las localidades ESP, MNG-4, PG, CP, CHB, PE, PA, PEC y en el área central de la laguna CUC (Fig. 5). Ver las clases de abreviaciones en la sección de material y métodos. Es importante destacar que la especie no se encontró en la localidad de Puerto Real que es el área de persistente influencia marina en el sistema y que, aun cuando se distribuye en un amplio gradiente salino, está mejor representada en las sistemas Fluvio-Lagunares. ABUNDANCIALa productividad de Arius melanopus en la Laguna de Términos fue muy variable durante 1976-1977, dependiendo de la localidad y la época climática (Tablas 3 y 4). Vargas Maldonado et al.(1981) reportan para el interior de la Isla del Carmen en el periodo de secas, valores para la localidad ESP-1 de 1.38 gm-² con 18 individuos; siendo para ESP-2 de 0.52 gm-² con 2 ejemplares. En esta misma localidad, pero para época de lluvias la estación ESP-3 registró una biomasa de 0.08 gm-² con un ejemplar. Para los sistemas Fluvio-Lagunares, Amezcua Linares y Yáñez-Arancibia (1980) reportan para la época de secas en Pom-Atasta (PA-5) el máximo valor de 0.20 gm-² con un ejemplar; mientras que el mínimo valor de biomasa se registró en el sistema Palizada-del Este (PE-6) siendo de 0.06 gm-² con 5 individuos. Durante la época de lluvias en el sistema Candelaria-Panlau se registró una biomasa de 18.58 a 0.31 gm-² con 123 y 11 ejemplares (en los meses de septiembre 1976 y agosto 1977) respectivamente. Para el sistema Chumpan-Balchacah al biomasa estimada fue de 11.41 gm-² para la estación CHB-2 con 379 individuos mientras que para CHB-1 fue de 0.03 gm-² con 2 ejemplares. En Palizadadel Este el máximo valor registrado fue en PE2 de 2.43 gm-² con 79 ejemplares y el mínimo valor fue en PE-1 de 0.35 gm-² con 2 individuos. Finalmente, en Pom-Atasta el valor máximo registrado fue en PA-5 de 0.34 gm-² con 7 ejemplares y el mínimo en PA-3 siendo de 0.01 gm-² con un solo individuo. RELACIÓN LONGITUD/PESO Y FRECUENCIA DE TALLASEn la relación longitud/peso del modelo P = 10ª Lk, los valores para a y k son dados a continuación en función de la época climática (Tabla 5), y el análisis de tallas se sintetiza en la tabla 6. Estos resultados se muestran graficados en las figuras 6 a 12. 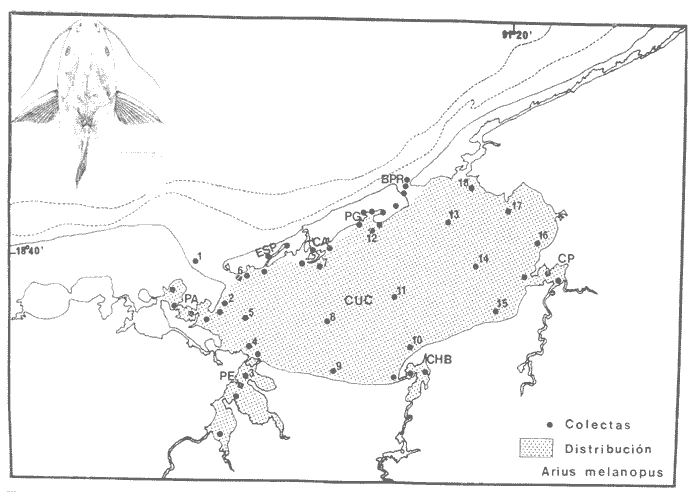 Fig. 5. Distribución de Arius melanopus Günther en la Laguna de Términos. Se presenta a lo largo de todo el gradiente salino, siendo más abundante en los sistemas Fluvio-Lagunares. MADUREZLa distribución de las fases sexuales se señala a continuación en la tabla 7, en función de la época climática y el análisis de la proporción de sexos se sintetiza en la tabla 8.  TABLA 3. ABUNDANCIA ESTIMADA DURANTE LA ÉPOCA DE SECAS (1976-1977) EN LAS DOS ÁREAS ESTUDIADAS 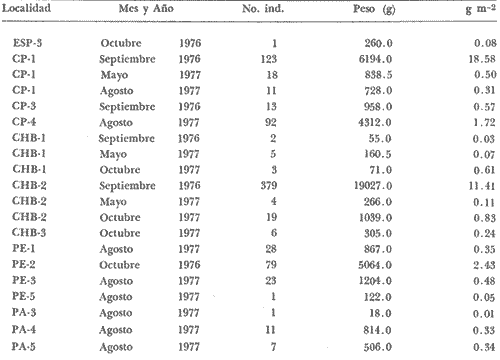 TABLA 4 ABUNDANCIA ESTIMADA DURANTE LA ÉPOCA DE LLUVIAS (1976-1977) EN LAS DOS ÁREAS ESTUDIADAS  TABLA 5  TABLA 6 Estos resultados se muestran graficados en las figuras 13 a 16. Las figuras 17 y 18 muestran la relación de la madurez gonádica y la talla de los individuos lo cual es fundamental para determinar el tamaño, al cual la población alcanza la madurez gonádica y es apta para reproducirse. Se nota que en el periodo de secas la población alcanza la madurez sexual (Fase III) después de los 165 mm de longitud total y un peso de 40 a 50 g. Para el periodo de lluvias se observan ejemplares maduros después de los 160 mm de longitud total y un peso entre 30 y 40 g. 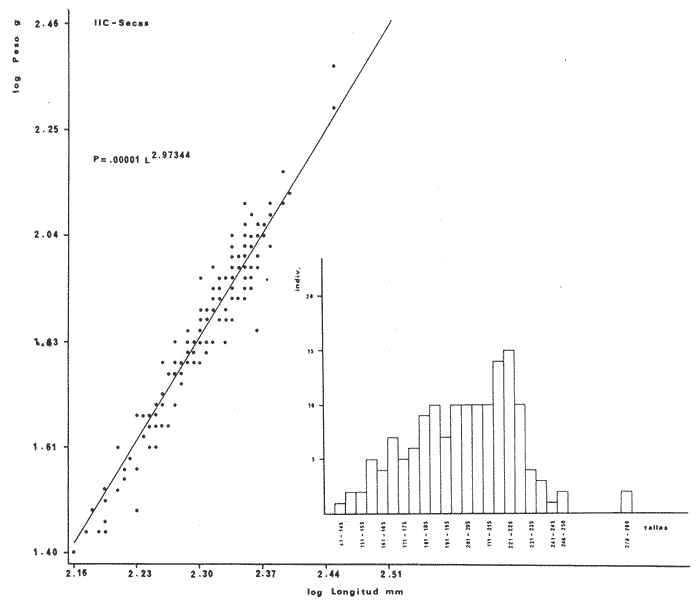 Fig. 6. Recta de regresión de la relación longitud/peso de Arius melanopus. Se señala la distribución de frecuencias de tallas. Interior de la Isla del Carmen. Época de secas ALIMENTACIÓNEl estudio de las relaciones tróficas de Arius melanopus se basó en el análisis de los contenidos estomacales de ejemplares juveniles (menos de 160 mm) y adultos (más de 160 mm), en función de las localidades estudiadas y la época climática. 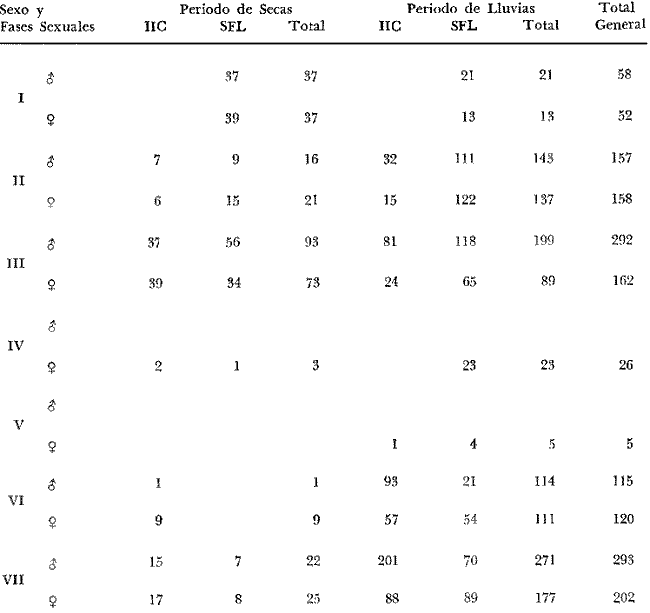 TABLA 7 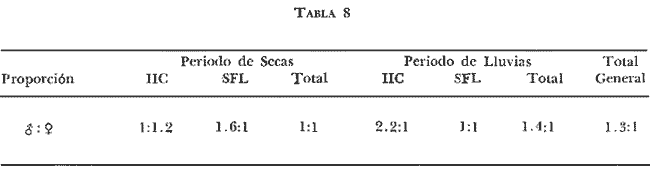 TABLA 8 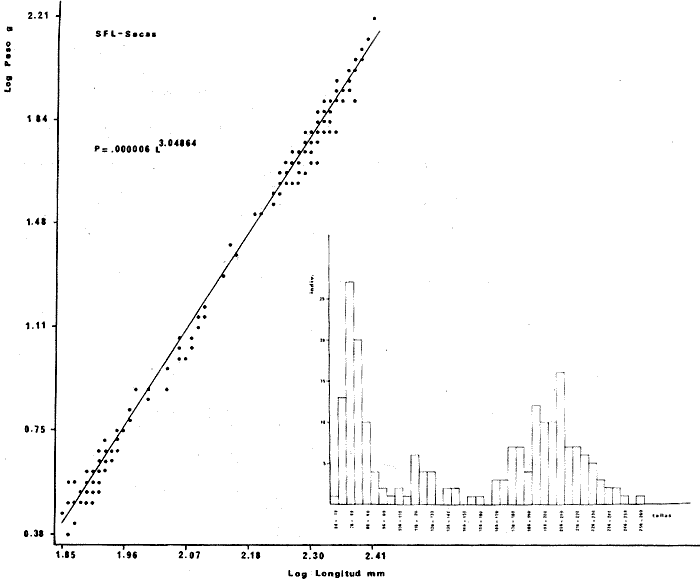 Fig. 7. Recta de regresión de la relación longitud/peso de Arius melanopus. Se señala la distribución de frecuencias de tallas. Sistema Fluvio-Lagunares. Época de secas. 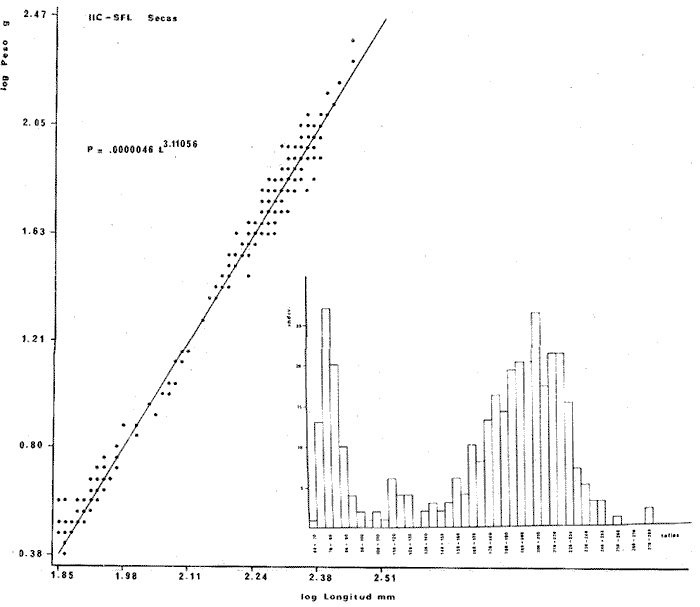 Fig. 8. Recta de regresión de la relación longitud/peso de Arius melanopus. Se señala la distribución de frecuencias de tallas. Época de secas para ambas localidades. 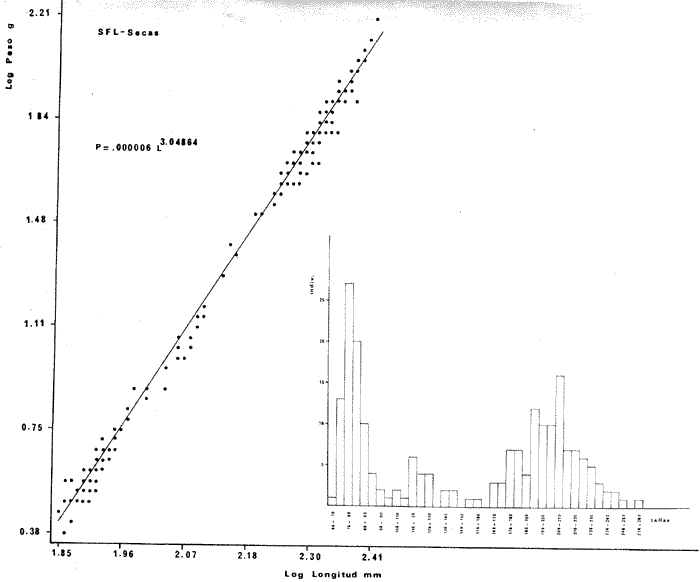 Fig. 9. Recta de regresión de la relación longitud/peso de Arius melanopus. Se señala la distribución de frecuencias de tallas. Interior de la Isla del Carme.Epocas de lluvias. 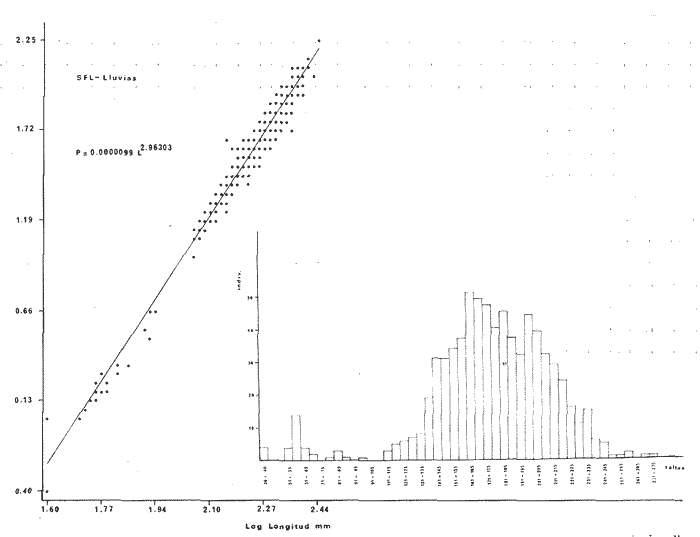 Fig. 10. Recta de regresión de la relación longitud/peso de Arius melanopus. Se señala la distribución de frecuencias de tallas. Sistema Fluvio-Lagunares. Época de lluvias. 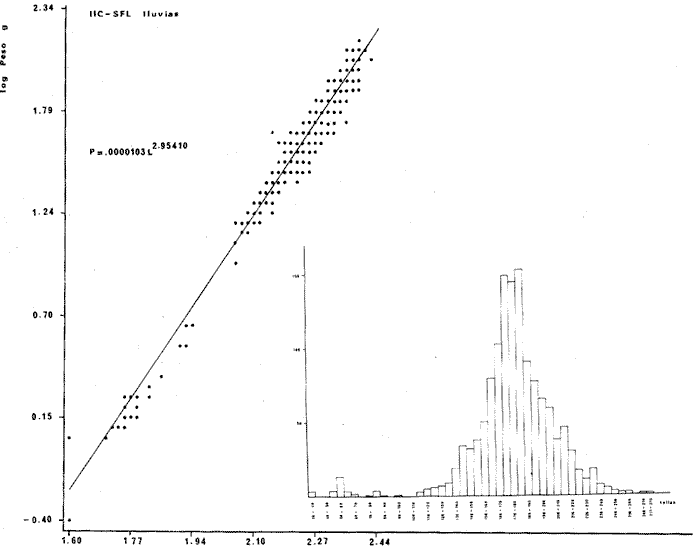 Fig. 11. Recta de regresión de la relación longitud/peso de Arius melanopus. Se señala la distribución de frecuencias de tallas. Época de lluvias para ambas localidades. 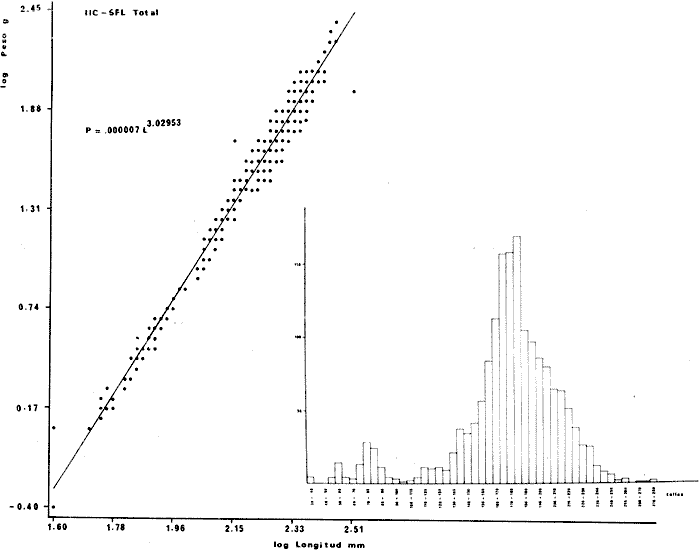 Fig. 12. Recta de regresión de la relación longitud/peso de Arius melanopus. Se señala la distribución de frecuencias de tallas. Para ambos periodos climáticos, independiente de la localidad. 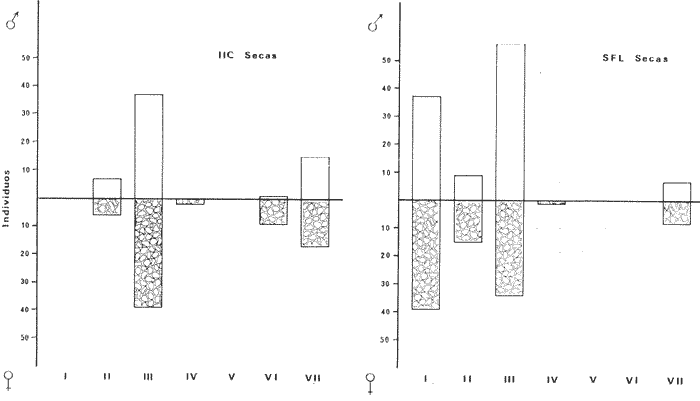 Fig. 13. Fase de desarrollo sexual y proporción de sexos en Arius melanopus para el periodo de secas en ambas localidades. Se nota la ausencia de fase V. 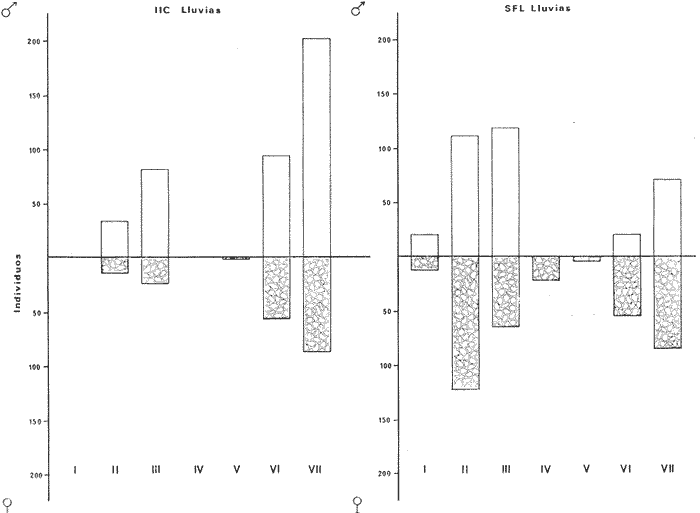 Fig. 14. Fases de desarrollo sexual y proporción de sexos en Arius malanopus para el periodo de lluvias en ambas localidades. Se nota la poca representatividad de fases IV y V. 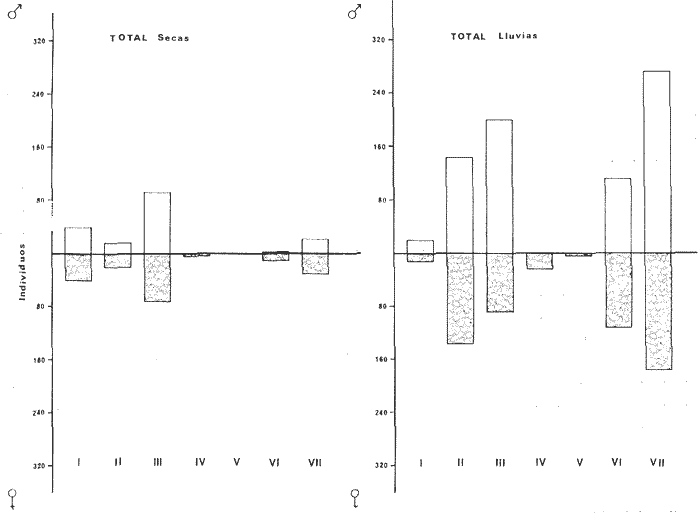 Fig. 15. Fase de desarrollo sexual y proporción de sexos en Arius melanopus para ambos periodos climáticos independiente de la localidad. Se aprecia la casi ausencia de fase V. 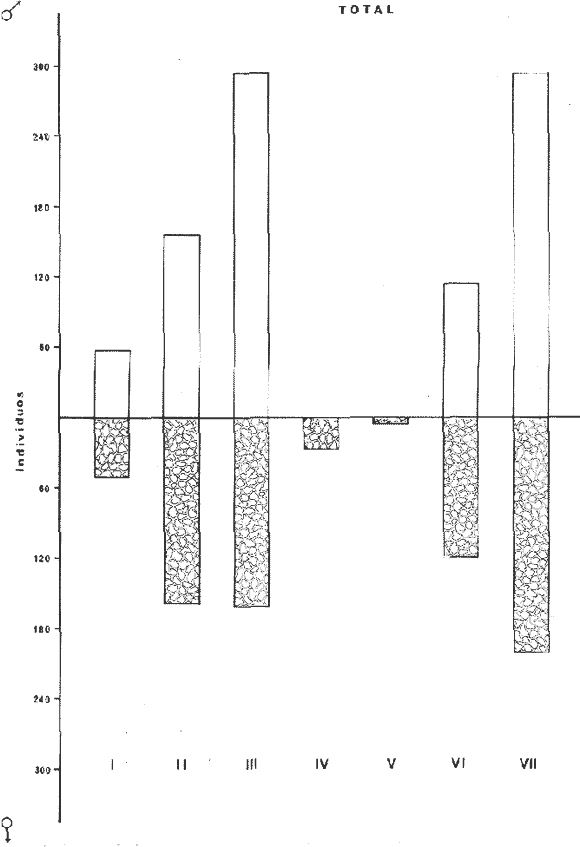 Fig. 16. Fases de desarrollo sexual y proporción de sexos para toda la colección estudiada de Arius melanopus, independiente del periodo climático y la localidad. Se aprecia la gran proporción de organismos maduros sexualmente(Fase III) y de organizmos en descanso posreproductivo (fase VII). 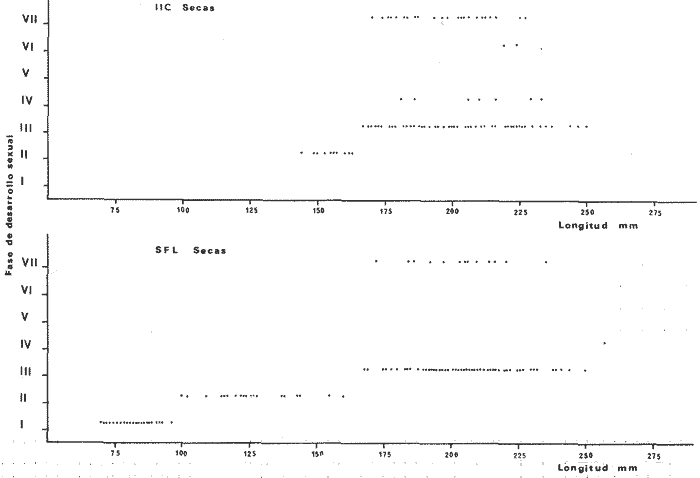 Fig.17. Relación de la longitud total y las fases de desarrollo sexual de Aruis melanopus en el periodo de secas de amboas localidades. 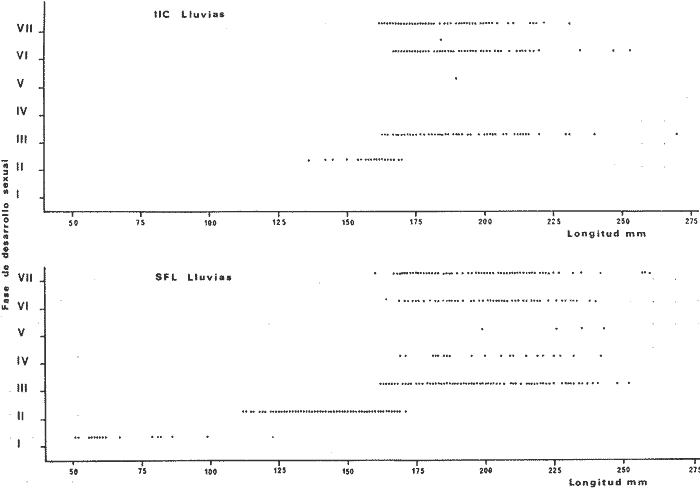 Fig.18. Relación de la longitud total y las fases de desarrollo sexual de Aruis malanopus en el periodo de lluvias de ambas localidades. Interior de la Isla del Carmen. SecasJuveniles. El espectro trófico (Fig. 19) señala que numéricamente el principal alimento lo constituyen Copépodos, y en menor proporción Ostrácodos y Tanaidáceos. Por la frecuencia, Copépodos, Tanaidáceos, materia orgánica, Ostrácodos y Nemátodos, constituyen el alimento importante. Volumétricamente, la materia orgánica, Copépodos, y Tanaidáceos son los grupos tróficos destacados. El análisis combinado de estos datos para cuantificar los índices de importancia relativa, muestra que Copépodos, materia orgánica, Tanaidáceos, Ostrácodos y Nemátodos presentan los índices más elevados. En relación a la figura 19 se puede establecer que el alimento principal es la materia orgánica, Copépodos y Tanaidáceos; el alimento secundario lo constituye Ostrácodos, y Nemátodos; y el alimento circunstancial está representado por los otros grupos tróficos de la figura 19. Adultos. El espectro trófico (Fig. 20) señala que numéricamente el principal alimento lo constituyen, Copépodos, Tanaidáceos y en menor proporción Pelecípodos y restos de peces. Por la frecuencia, materia orgánica, Tanaidáceos, Copépodos, Pelecípodos y restos de crustáceos constituyen el alimento importante. Volumétricamente, la materia orgánica Tanaidáceos y Pelecípodos son los grupos tróficos destacados, el análisis combinado de estos datos para cuantificar los índices de importancia relativa, muestra que Copépodos, materia orgánica, Tanaidáceos y Pelecípodos presentan los índices más elevados. En relación a la figura 20 se puede establecer que el alimento principal es la materia orgánica, Tanaidáceos y Copépodos; el alimento secundario lo constituye Pelecípodos y restos de crustáceos; y el alimento cir. cunstancial está representado por los otros grupos tróficos de la figura 20. Población total. La combinación de los datos cuantitativos de juveniles y adultospermite describir la alimentación de la población total. El espectro trófico (Fig. 21) señala que numéricamente el principal alimento lo constituyen Copépodos, y en menor proporción Tanaidáceos, Ostrácodos y Pelecípodos. Por la frecuencia, la materia orgánica, Tanaidáceos y Copépodos constituyen el alimento importante, Volumétricamente, la materia orgánica, Tanaidáceos, Copépodos y Pelecípodos son los grupos tróficos destacados. El análisis combinado de estos datos para cuantificar los índices de importancia relativa, muestra que la materia orgánica, Tanaidáceos, Copépodos, Pelecípodos y restos de crustáceos presentan los índices más elevados. En relación a la figura 21 se puede establecer que el alimento principal es la materia orgánica, Tanaidáceos y Copépodos; el alimento secundario lo constituye Pelecípodos, restos de crustáceos y Nemátodos; y el alimento circunstancial está representado por los otros grupos tróficos de la figura 21. Sistemas Fluvio-Lagunares.SecasJuveniles. El espectro trófico (Fig. 22) señala que numéricamente el principal alimento lo constituyen trocitos de restos vegetales, Copépodos y Nemátodos. Por la frecuencia, la materia orgánica, Copépodos, restos vegetales, Nemátodos y Pelecípodos, constituyen el alimento importante. Volumétricamente la materia orgánica y restos vegetales son los grupos tróficos destacados. El análisis combinado de estos datos para cuantificar los índices de importancia relativa muestra que la materia orgánica, restos vegetales, Copépodos y Nemátodos presentan los índices más elevados. En relación a la figura 22 se puede establecer que el alimento principal es la materia orgánica, restos vegetales y Copénodos; el alimento secundario lo constituyen Nemátodos, Pelecípodos y larvas de insectos; y el alimento circunstancial está representado por los otros grupos tróficos de la figura 22. Adultos.El espectro trófico (Fig. 23) señala que numéricamente el principal alimento lo constituye Tanaidáceos y en menor proporción larvas de insectos y Copépodos. Por la frecuencia, la materia orgánica, Tanaidáceos y larvas de insectos constituyen el alimento importante. Volumétricamente la materia orgánica, Tanaidáceos, larvas de insectos y restos de crustáceos son los grupos tróficos destacados. El análisis combinado de estos datos para cuantificar los índices de importancia relativa, muestra que la materia orgánica, Tanaidáceos, larvas de insectos, restos de crustáceos y restos vegetales presentan los índices más elevados. En relación a la figura 23 se puede establecer que el alimento principal es la materia orgánica, Tanaidáceos y larvas de insectos; el alimento secundario lo constituye restos de crustáceos y restos vegetales; y el alimento circunstancial está representado por los otros grupos tróficos de la figura 23. 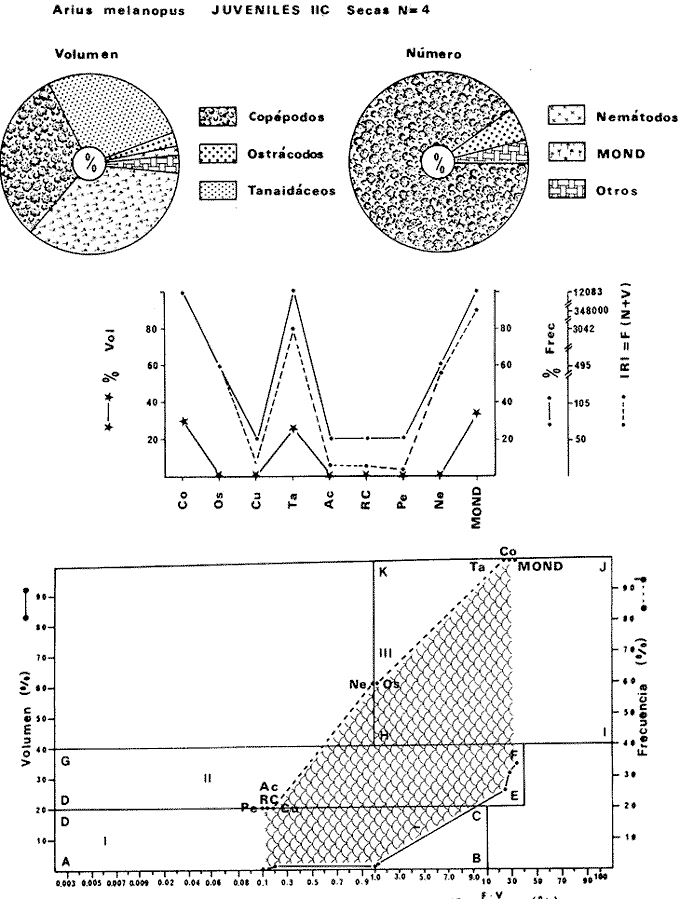 Fig. 19. Espectro trófico de la población juvenil de Arius melanopus en el periodo de secas del interior de la Isla del Carmen. 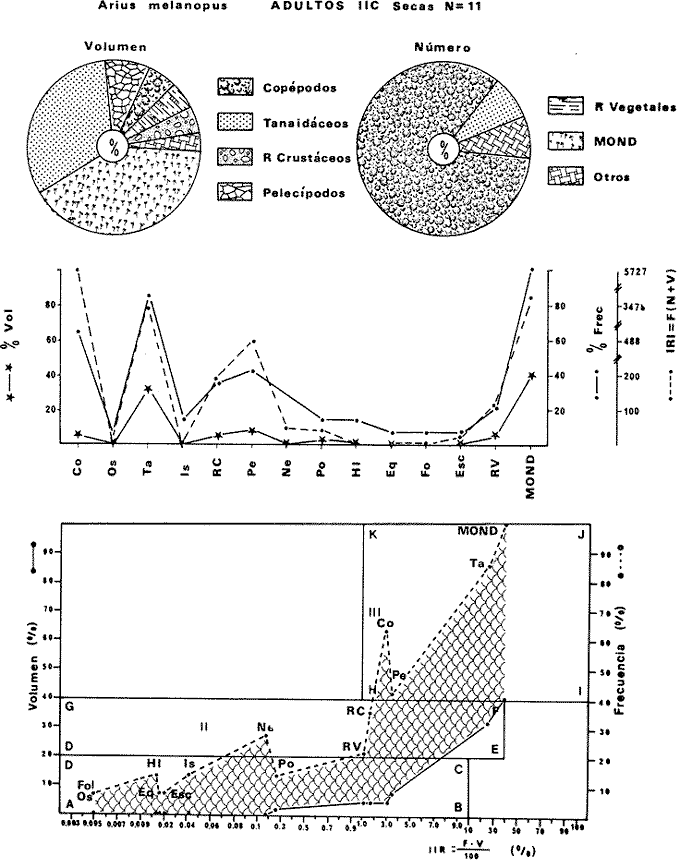 Fig. 20. Espectro trófico de la población adulta de Arius melanopus en el periodo de secas del interior de la Isla del Carmen 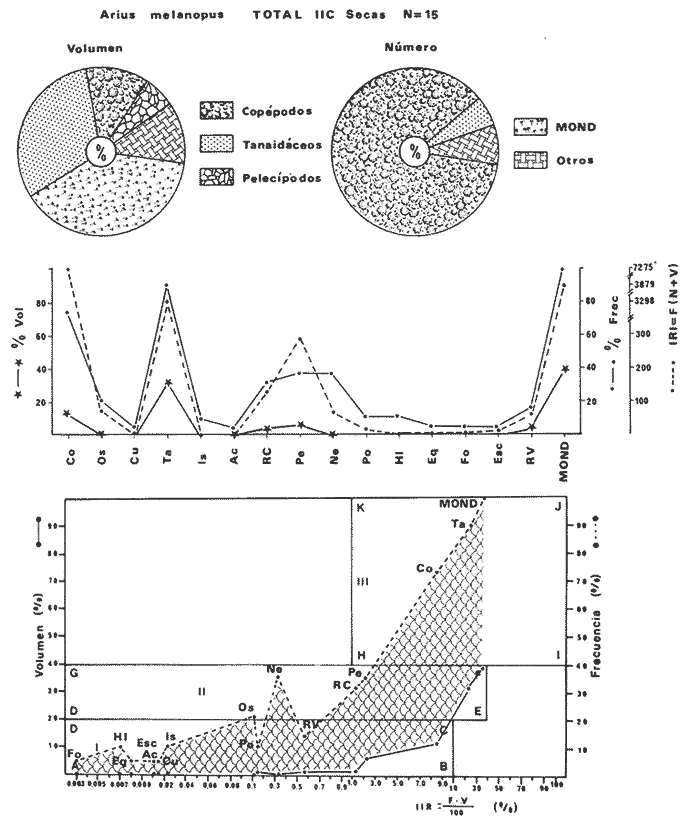 Fig. 21. Espectro trófico de la población total de Arius melanopus en el periodo de secas del interior de la Isla del Carmen. 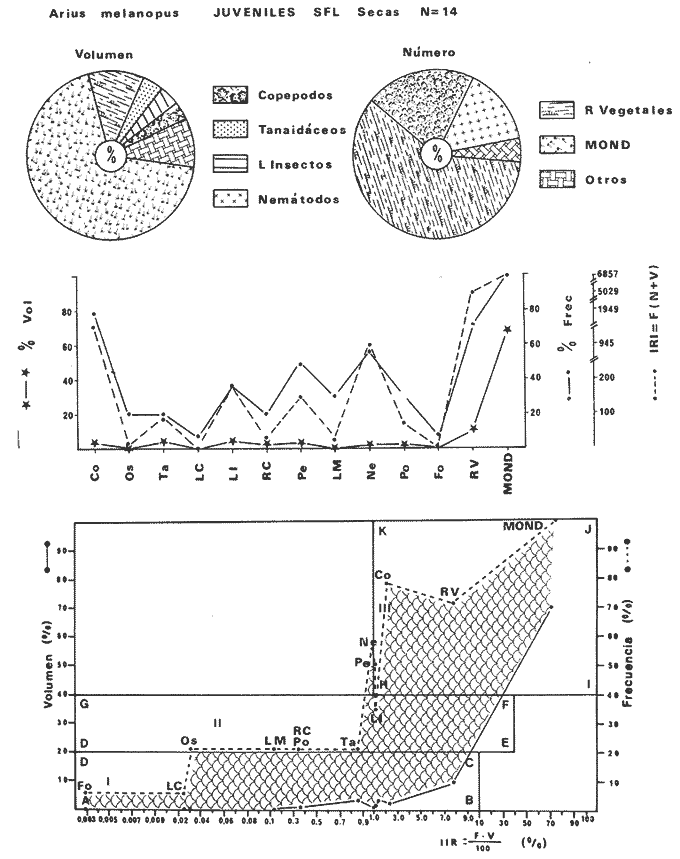 Fig. 22. Espectro trófico de la población juvenil de Arius melanopus en el periodo de secas de los sistemas Fluvio-Lagunares. Población total. La combinación de los datos cuantitativos de juveniles y adultos permite describir la alimentación de la población total. El espectro trófico (Fig. 24) señala que numéricamente el principal alimento lo constituye trocitos de restos vegetales, Copépodos y Nemátodos constituyen el alimento importante. Volumétricamente la materia orgánica, restos vegetales, Tanaidáceos y larvas de insectos son los grupos tróficos destacados. El análisis combinado de estos datos para cuantificar los índices de importancia relativa, muestra que la materia orgánica, restos vegetales, Copépodos, Tanaidáceos, Nemátodos y larvas de insectos presentan los índices más elevados. En relación a la figura 24 se puede establecer que el alimento principal es la materia orgánica, restos vegetales y Copépodos; el alimento secundario lo constituyen Nemátodos, larvas de insectos y Tanaidáceos; y el alimento circunstancial está representado por los otros grupos tróficos de la figura 24. Interior de la Isla del Carmen. LluviasJuveniles. El espectro trófico (Fig. 25) señala que numéricamente el principal alimento lo constituyen Copépodos y en menor proporción Gasterópodos. Por la frecuencia, Copépodos, materia orgánica, restos vegetales, Gasterópodos y Ostrácodos, constituyen el alimento importante. Volumétricamente, Copépodos, materia orgánica, restos de crustáceos y larvas de moluscos son los grupos tróficos destacados. El análisis combinado de estos datos para cuantificar los índices de importancia relativa, muestra que Copépodos, materia orgánica, Gasterópodos y restos de crustáceos, presentan los índices más elevados. En relación a la figura 25 se puede establecer que el alimento principal es Copépodos; el alimento secundario lo constituyen materia orgánica, restos vegetales, Gasterópodo, Ostrácodos y restos de crustáceos; y el alimento circunstancial son Cumáceos. Adultos. El espectro trófico (Fig. 26) señala que numéricamente el principal alimento lo constituyen Copépodos, Gasterópodos y en menor proporción Nemátodos. Por la frecuencia, la materia orgánica, Copépodos y en menor proporción Gasterópodos, constituyen el alimento importante. Volumétricamente la materia orgánica, Pelecípodos, restos de crustáceos, Copépodos y restos vegetales son los grupos tróficos destacados. El análisis combinado de estos datos para cuantificar los índices de importancia relativa, muestra que la materia orgánica, Copépodos y Gasterópodos presentan los índices más elevados. En relación a la figura 26 se puede establecer que el alimento principal es la materia orgánica y Copépodos; el alimento secundario lo constituye Gasterópodos; y el alimento circunstancial está representado por los otros grupos tróficos de la figura 26. Población total. La combinación de los datos cuantitativos dejuveniles y adultos permite describir la alimentación de la población total. El espectro trófico (Fig. 27) señala que numéricamente el principal alimento lo constituye Copépodos y en menor proporción Gasterópodos. Por la frecuencia, la materia orgánica, Copépodos y en menor proporción Gasterópodos, constituyen el alimento importante. Volumétricamente, la materia orgánica, Copépodos, restos de crustáceos, Pelecípodos y restos vegetales son los grupos tróficos destacados. El análisis combinado de estos datos para cuantificar los índices de importancia relativa, muestra que la materia orgánica, Copépodos, Gasterópodos y restos de crustáceos presentan los índices más elevados. En relación a la figura 27 se puede establecer que el alimento principal es la materia orgánica, y Copépodos; el alimento secundario lo constituyen Gasterópodos, larvas de moluscos y restos de crustáceos; y el alimento circunstancial está representado por los otros grupos tróficos de la figura 27. Sistemas Fluvio-Lagunares. LluviasJuveniles. El espectro trófico (Fig. 28) señala que numéricamente el principal alimento lo constituyen Copépodos y en menor proporción Ostrócodos. Por la frecuencia, la materia orgánica, Copépodos y en menor proporción Ostrácodos constituyen el alimento importante. Volumétricamente, la materia orgánica, Copépodos, Ostrácodos y Oligoquetos son los grupos tróficos destacados. El análisis combinado de estos datos para cuantificar los índices de importancia relativa muestra que Copépodos, materia orgánica, Ostrácodos, restos vegetales y Oligoquetos, presentan los índices más elevados. En relación a la figura 28 se puede establecer que el alimento principal es materia orgánica y Copépodos; el alimento secundario lo constituyen Ostrácodos y restos vegetales; y el alimento circunstancial está representado por los otros grupos tróficos de la figura 28. 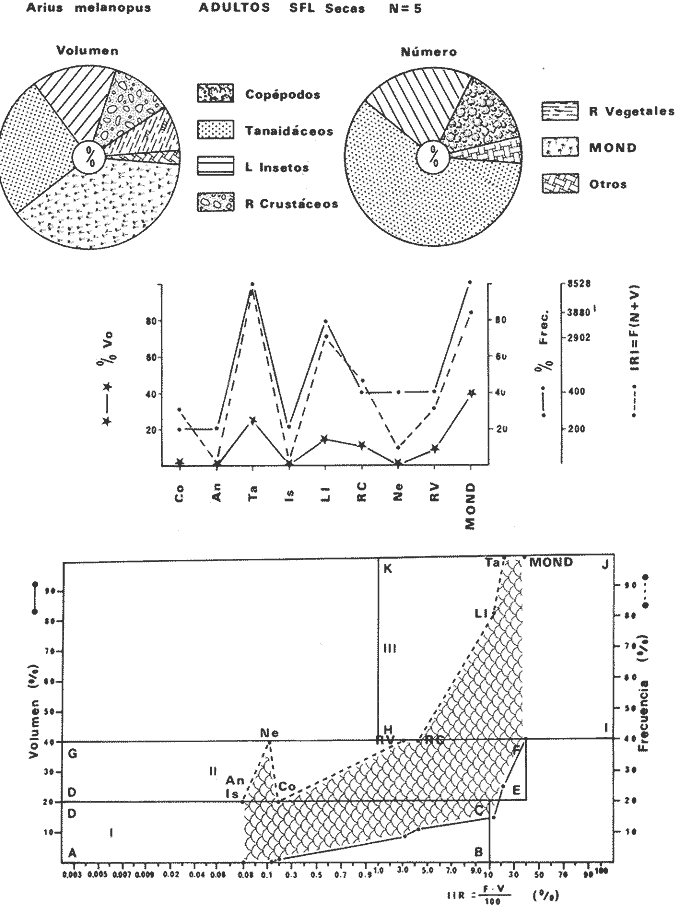 Fig. 23. Espectro trófico de la población adulta de Arius melanopus en el periodo de secas de los sistemas Fluvio-Lagunares. 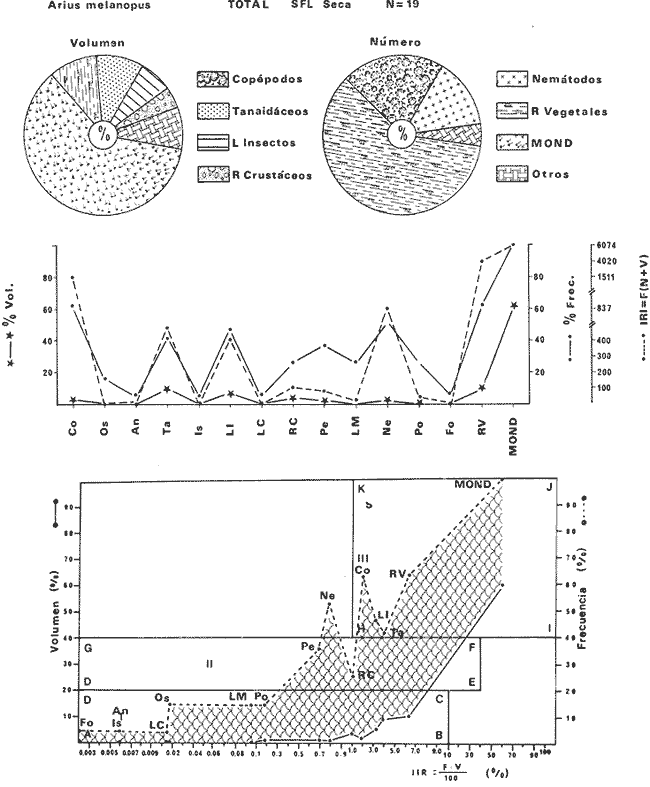 Fig. 24. Espectro trófico de la población total de Arius melanopus en el periodo de secas de los sistemas Fluvio-Lagunares. 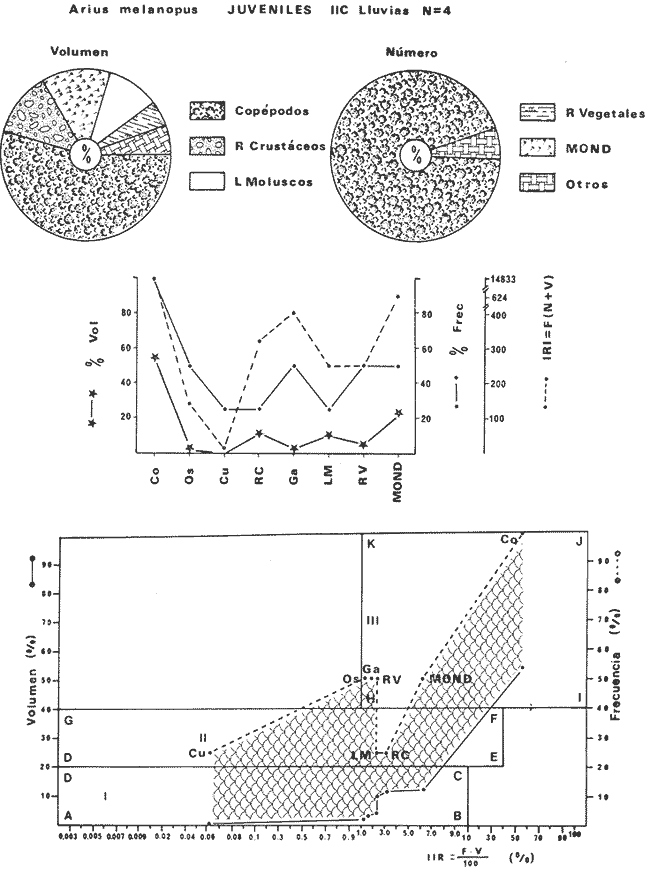 Fig. 25. Espectro trófico de la población juvenil de Arius melanopus en el periodo de lluvias del interior de la Isla del Carmen. 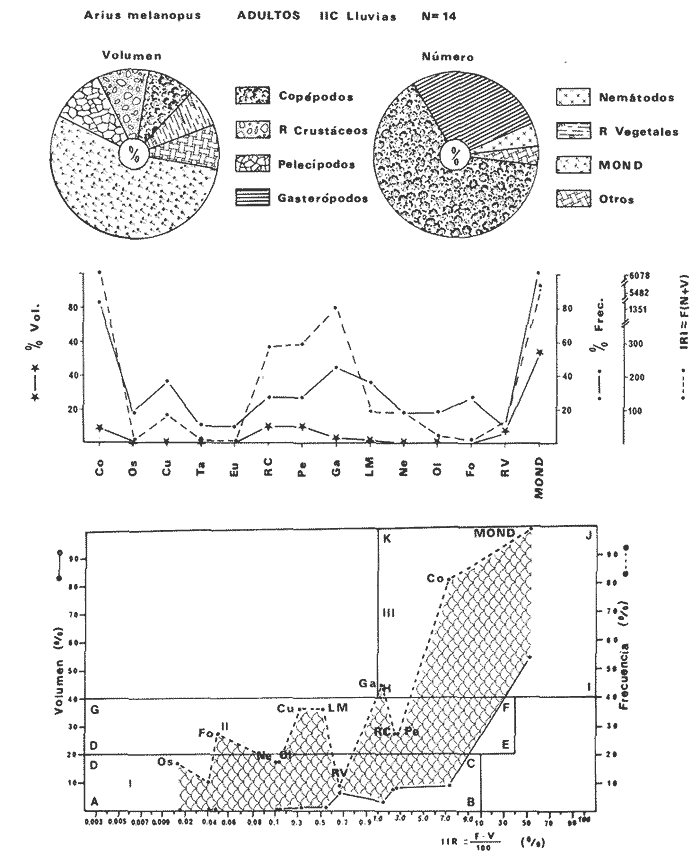 Fig. 26. Espectro trófico de la población adulta de Arius melanopus en el periodo de lluvias del interior de la Isla del Carmen. Adultos. El espectro trófico (Fig. 29) señala que numéricamente el principal alimento lo constituyen Ostrácodos y en menor proporción Copépodos. Por la frecuencia, la materia orgánica constituyen el alimento importante. Volumétricamente, la materia orgánica, Pelecípodos, Tanaidáceos y Ostrácodos son los grupos tróficos destacados. El análisis combinado de estos datos para cuantificar los índices de importancia relativa, muestra que la materia orgánica, Ostrácodos, Tanaidáceos, Pelecípodos y Copépodos presentan los índices más elevados. En relación a la figura 29 se puede establecer que el alimento principal es la materia orgánica; el alimento secundario lo constituyen Pelecípodos y Tanaidáceos; y el alimento circunstancial está representado por los otros grupos tróficos de la figura 29. Población total. La combinación de los datos cuantitativos de juveniles y adultos permite describir la alimentación de la población total. El espectro trófico (Fig. 30) señala que numéricamente el principal alimento lo constituyen Copépodos y en menor proporción Ostrácodos. Por la frecuencia, la materia orgánica es el alimento importante. Volumétricamente, la materia orgánica, Copépodos, Ostrácodos, Pelecípodos y Tanaidáceos son los grupos tróficos destacados. El análisis combinado de estos datos para cuantificar los índices de importancia relativa, muestra que la materia orgánica, Copépodos, Ostrácodos, Tanaidáceos y Pelecípodos presentan los índices más elevados. En relación a la figura 30 se puede establecer que el alimento principal es la materia orgánica; el alimento secundario lo constituyen Copépodos y Ostrácodos; y el alimento circunstancial está representado por los otros grupos tróficos de la figura 30. Interesantes resultados muestra el estudio de la relación gravimétrica del alimento ingerido por Arius melanopus (Fig. 31), independiente de la localidad. El análisis estadístico indica un comportamiento similar para los dos periodos climáticos; esto es, en los primeros estados de desarrollo, siendo el pez pequeño, consume mayor cantidad de alimento en relación a su peso total; conforme crece la especie y se incrementa en peso total, la necesidad gravimétrica en alimento es mucho menor. Esto es un aspecto económico interesante cuando se piensa en especies susceptibles de ser cultivadas y deben conocerse las necesidades económicas de alimento de la especie en cuestión conforme avanza su desarrollo en crecimiento. DISCUSIÓN Y CONCLUSIONES
HABITATUno de los rasgos más importantes en la Laguna de Términos es la alta diversidad de subsistemas o habitat estuarinos que en ella prevalecen, los cuales son el reflejo de fuertes gradientes semipermanentes causados por el patrón de circulación. El factor ecológico más importante en el estudio de una laguna costera, es su gradiente salino, de temperatura, de nutrientes y de turbidez. En general, en la Laguna de Términos existe un decremento de salinidad desde la Isla del Carmen hacia el continente, donde descargan los ríos asociados a ésta. Este parámetro, presenta variaciones estacionales de acuerdo a la precipitación pluvial. Los valores más altos de salinidad se localizan en la Boca de Puerto Real con un rango de 27 a 39 ppm, en las áreas internas de la Isla del Carmen los valores registrados van de 21 a 26 ppm o aún mayores, mientras que en los sistemas FluvioLagunares se observan rangos que van desde salobres (25 ppm) a casi dulceacuícolas (2 ppm). 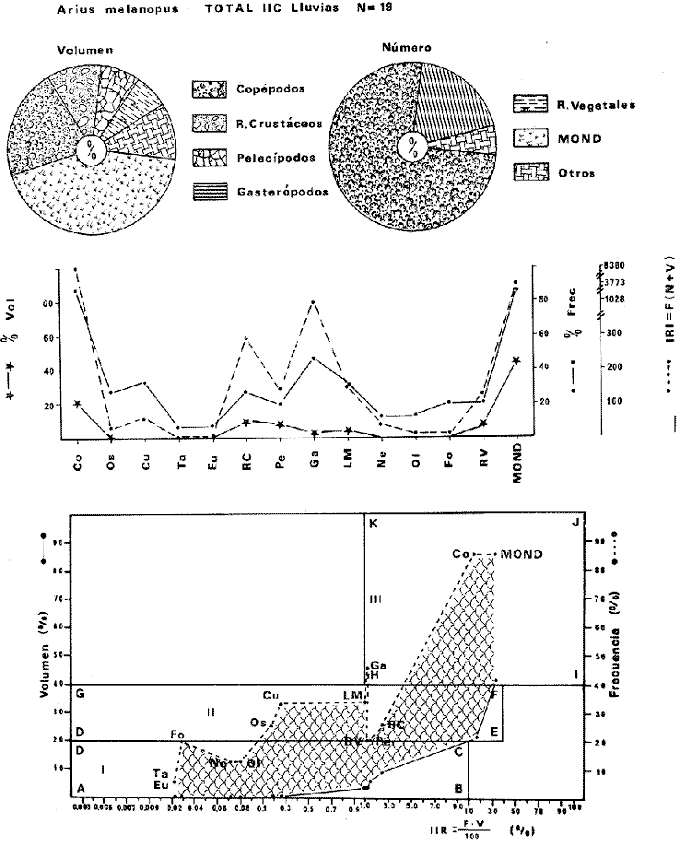 Fig. 27. Espectro trófico de la población total de Arius melanopus en el periodo de lluvias del interior de la Isla del Carmen. 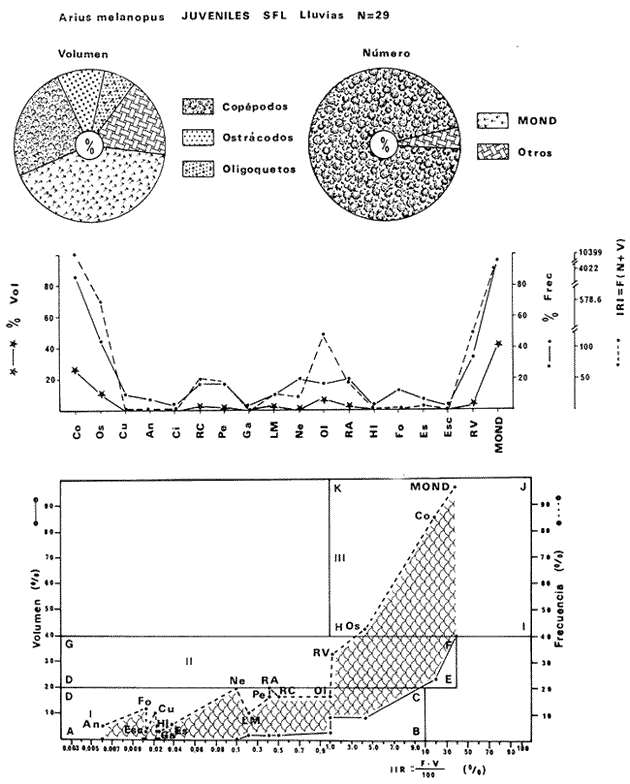 Fig. 28. Espectro trófico de la población juvenil de Arius malanopus en el periodo de lluvias de los sistemas Fluvio-Lagunares. 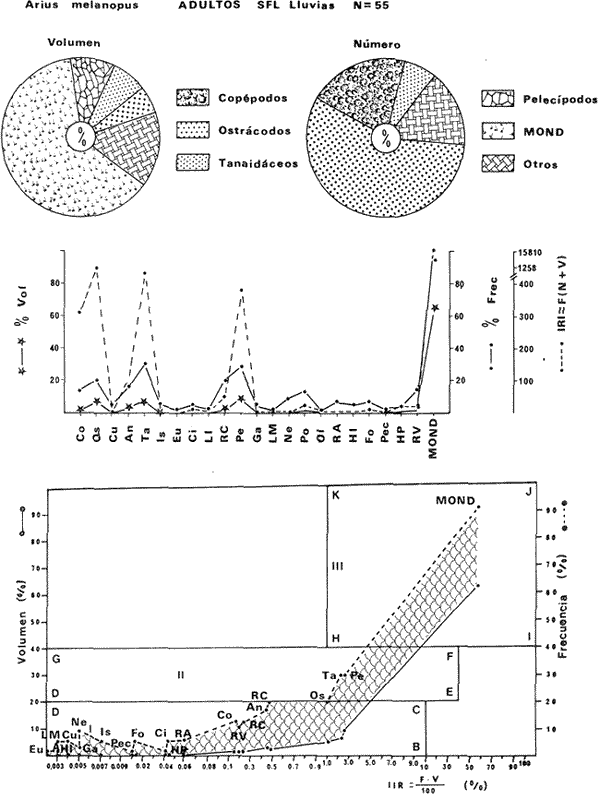 Fig. 29. Espectro trófico de la población adulta de Arius malanopus en el periodo de lluvias de los sistemas Fluvio-Lagunares. 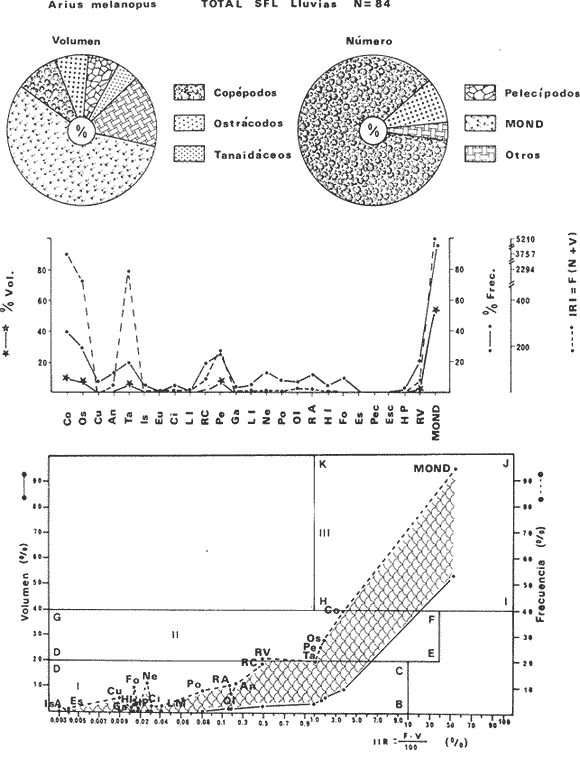 Fig. 30. Espectro trófico de la población total de Arius malanopus en el periodo de lluvias de los sistemas Fluvio-Lagunares. 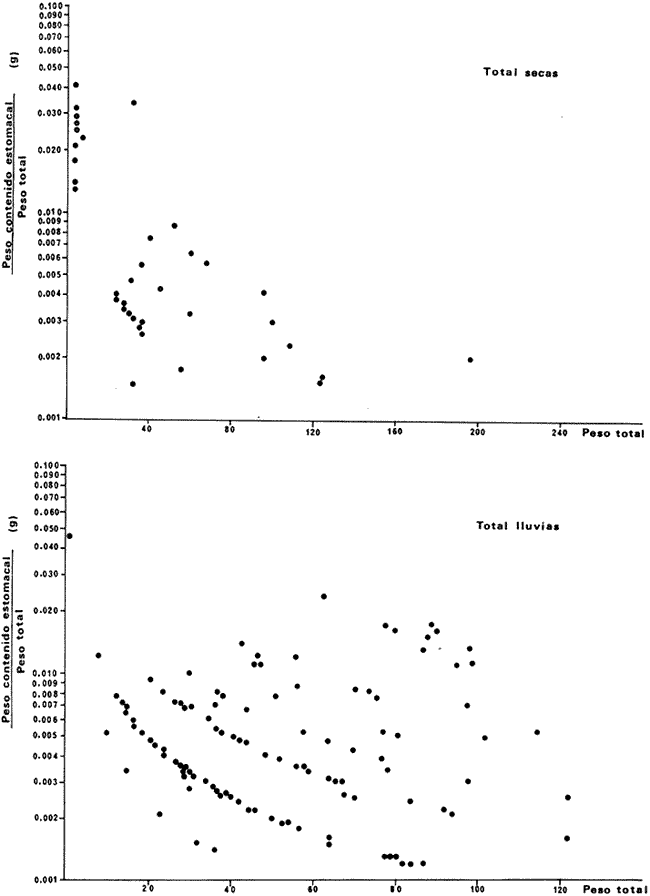 Fig. 31. Dispersión gravimétrica del alimento en relación al tamaño en peso de Arius melanopus. Periodo de secas N = 38. Periodo de lluvias N = 99. El rango de variación de temperatura es variable. En la Boca de Puerto Real se ha registrado un rango entre 22 y 29ºC. Para el interior de la Isla del Carmen el rango oscila entre 19 y 32ºC. En los cuatro sistemas Fluvio-Lagunares ha sido de 24 a 35ºC. Existen dos principales fuentes de sedimentos en la Laguna de Términos. El aporte del Golfo de México caracterizado por sedimentos arenosos que se distribuyen en el interior de la Isla del Carmen y en la Boca de Puerto Real; esta zona presenta condiciones relativamente uniformes de depositación lo que provoca una alta transparencia en el agua (80%) favoreciendo el establecimiento de vegetación sumergida de pastos marinos y macroalgas. La descarga de los ríos y lagunas interiores en la porción sureste y oeste de la laguna transporta gran cantidad de partículas en suspensión ocasionando una zona de alta turbidez (20 a 40%), por lo tanto carente de vegetación sumereida. En esta área predominan los sedimentos finos limo-arcillosos. Lo más notable en los cuatro sistemas Fluvio-Lagunares es la presencia de comunidades bénticas de arrefices de ostión, en las bocas. La vegetación costera emergente en toda la Laguna de Términos está casi por completo cubierta por asociaciones de Rhizophora mangle. Estos gradientes tienen una alta correlación con la productividad primaria y la concentración de nutrientes como lo han demostrado Yáñez-Arancibia y Day (1981). Esos autores y Phleger y Ayala-Castañares (1971) y Gierloff-Eniden (1977) integran los procesos físicos y biológicos esenciales por la comprensión ecológica de los habitat de la laguna, presentados en la figura 1. DISTRIBUCIÓN Y ABUNDANCIALa distribución y abundancia deArius melanopus en la laguna está influenciada tanto por las condiciones ambientales, principalmente la salinidad, como por su ciclo migratorio. Y aun cuando se distribuye en todos los ambientes estuarinos de la laguna (Figs. 2 y 5) las diferencias en abundancia de la especie en determinadas localidades son provocadas por los ciclos migratorios realizados a lo largo del año. Los patrones migratorios son una respuesta general a las condiciones ambientales. En los peces se conocen principalmente tres movimientos en el ciclo migratorio: periodo de reproducción, alimentación y migración de invierno (Nikolsky, 1963; Harden Jones, 1968). Durante la época de secas, cuando se registran los valores promedios más altos de salinidad en la laguna (35.5 ppm; Botello y Mandelli, 1975), la especie se encuentra escasamente representada, presentando en el interior de la Isla del Carmen (ESP-1) una máxima biomasa de 1.38 gm-² (13.8 KgHa-¹), pero el mayor número de individuos en ese periodo se registró en el sistema Palizada-del Este. En el periodo de lluvias, el valor promedio de salinidad es de 21.9 ppm (Botello y Mandelli, 1975) y se registraron los valores más altos en número de individuos y biomasa; resulta relevante los valores de biomasa de 18.58 gm-² (185.8 KgHa-1) y 11.41 gm-2 (114.1 KgHa-¹) durante el mes de septiembre en los sistemas Candelaria-Panlau y Chumpan-Balchacah respectivamente. El mayor número de individuos registrado durante el periodo de lluvias en el mes de octubre se observó en Punta Gorda. El patrón de circulación que prevalece en la laguna favorece la migración de los peces Yáñez-Arancibia y Day (1981), Arius melanopusmuestra esto claramente. Durante el periodo de lluvias ocurre la época de reproducción para esta especie en los sistemas Fluvio-Lagunares, como más adelante se discute, mientras que en el periodo de secas la especie se localiza muy cercana de la Boca del Carmen por donde, posiblemente, busca las salinidades menores y/o migra hacia las zonas más interiores de los sistemas Fluvio-Lagunares. RELACIÓN LONGITUD / PESO Y FRECUENCIA DE TALLASLa ecuación P = aLk, representa las variaciones de un organismo en peso con relación a sus cambios de longitud. El comportamiento del coeficiente exponencial define esta ecuación, ya que cuando presenta un valor de 3 describe un crecimiento isométrico, mientras que cuando es mayor o menor de 3 el crecimiento que describe es alométrico. En el presente trabajo los valores para el coeficiente exponencial osciló entre 2.93526 y 3.11056 por tanto la especie en estudio presenta un crecimiento alométrico. Las variaciones que sufre este coeficiente exponencial está en función de los cambios ambientales, la alimentación, el metabolismo individual, la madurez sexual, entre otros (Candia et al ., 1973). Haciendo cálculos para un peso teórico a una longitud de 165 mm para cada área y época climática, se observaron variaciones que no correspondían a los coeficientes exponenciales sino que variaba de acuerdo a toda la ecuación. En relación a esto, se observó el valor máximo del peso teórico para el periodo de secas en el interior de la Isla del Carmen, lo que correspondería a que los organismos están aumentando en peso más que en longitud. En los sistemas Fluvio-Lagunares, durante la época de lluvias, también se presentó el valor más alto por lo que se considera que los organismos presentaban muy desarrolladas las gónadas. Esto pudo comprobarse con el análisis directo del estado de los gónadas. La relación se puede utilizar como un complemento del ritmo de crecimiento, puesto que determina la velocidad de incremento del peso a lo largo de la vida del pez (Carles, 1967). También es interesante la ecuación desde el punto de vista de un posible cultivo, ya que se puede utilizar para calcular el peso cuando se conoce la longitud y viceversa. La frecuencia de tallas muestra un aspecto de la estructura de la población para las distintas épocas climáticas (Candia et al ., 1973). Para el presente estudio se observó que existen dos poblaciones, una constituida por juveniles, principalmente distribuida en los sistemas Fluvio-Lagunares a través de todo el año; y una población de adultos presentes en ambas localídades y épocas climáticas (Figs. 6 a 12). MADUREZEl tipo de reproducción enArius melanopus puede definirse de manera similar a la de Galeichthys caerulescens, esto es, como peces oviparos de gestación oral. Se reproducen sexualmente y después de la ovoposición, los huevos son fertilizados por el macho en un proceso de fecundación externa. Nada se conoce del mecanismo por el cual el macho llevaría los huevos a su boca después de la fertilización de los mismos (Yáñez-Arancibia et al., 1976). Gudger (1912) considera que los huevos no caen al fondo ya que si el desove fuera en fondos arenosos o de conchilla serían destruidos rápidamente por crustáceos o bien por otros peces, y si fuera en fondos fangosos, el considerable peso de los huevos provocaría su hundimiento siendo asfixiados por el lodo. Günther (1947) aparentemente acepta la idea de que los huevos necesitan un corto periodo en el agua para cementarse con una sustancia que los cubre inmediatamente después de ser expulsados por la hembra antes de ser llevados a la boca. La ubicación tropical de la Laguna de Términos trae complicaciones en los estudios ecológicos ictiofaunísticos desde el punto de vista de su reproducción, ya que es menos preciso el tiempo de desove (Cushings, 1975). La gestación oral característica de las especies de la familia Ariidae, facilita determinar la época de reproducción así como el área de desove. Para la época de reprodución, Lee (1937), considera dos criterios: 1) la abundancia y el grado de desarrollo de los huevos encontrados en la cavidad bucal y 2) el desarrollo gonádico en las hembras. En el presente estudio se observaron machos con huevecillos y/o embriones en sus bocas durante el periodo de lluvias, particularmente en los meses de agosto y septiembre. La talla de los machos incubando huevecillos y/o embriones osciló entre 160 a 222 mm LT. También, durante este periodo, se capturaron hembras en fase IV y V de desarrollo gonádico. Cabe destacar que durante esta época climática, se observó la mayor proporción de organismos maduros sexualmente (Fase III y IV) y en fase posreproductiva. (Fase VI y VII). El área de desove de Arius melanopusse localizó en los sistemas Fluvio-Lagunares, es decir, en áreas de baja salinidad (menos de 12 ppm) y alta temperatura (± 35ºC). Günther (1947) reporta paraGaleichthys (= Arius)felis áreas de desove lejos de la bahía donde la salinidad es baja (13 ppm). Yáñez-Arancibia et al. (1976) reportan paraGaleichthys caerulescens áreas de desove en salinidades menores de 15 ppm y temperaturas de ± 35ºC. Después del periodo de reproducción, cuando los juveniles son capaces de nadar libremente, sus progenitores migran hacia las áreas internas de la Isla del Carmen (Punta Gorda, en octubre); por lo cual se encuentran organismos inmaduros (Fase I) en los sistemas Fluvio-Lagunares en ambos periodos climáticos (Figs. 13 a 16). La mayor proporción de organismos en fase posreproductiva del sistema Fluvio-Lagunar, presentaron la región hiodea deprimida. En los machos, la región hiodea comienza a deprimirse conforme el periodo de reproducción se aproxima. Esto mismo puede suceder como proceso reversivo, o sea, que después de la época de incubación la región hiodea puede permanecer deprimida. La separación de áreas de desove, crianza y alimentación, reduce el gasto de energía para actividades de competencia interespecífica (Margalef, 1977). Los peces estuarinos que han separado sus áreas de reproducción, crianza y alimentación muestran adaptaciones que explican su gran abundancia al reducir la competencia interespecífica y ampliar su nicho ecológico. La mayoría de las especies de importancia comercial en la plataforma continental son dependientes estuarinos (Yáñez-Arancibia y Núgent, 1977). La longitud a la cual los organismos alcanzaron la madurez sexual, varío de acuerdo al periodo climático, siendo aproximadamente a 165 mm LT para el periodo de secas y 160 mm LT en el periodo de lluvias (Figs. 17 y 18). González (1972) reporta que Arius liropus , en las lagunas del noroeste de México, alcanza la madurez sexual a una longitud furcal de 143 mm en hembras y 165 mm en machos. Yáñez-Arancibia et al. (1976) reporta queGaleichthys caerulescens alcanza la madurez sexual a los 180-200 mm las hembras y 200-220 mm los machos. ALIMENTACIÓNEl conocimiento de la alimentación y los hábitos alimenticios en los peces es importante por diferentes razones. Por una parte muestra las relaciones tróficas de las diferentes especies y el flujo de energía en la comunidad; indica las relaciones presa-depredador en relación a las especies comerciales de peces e invertebrados; y finalmente muestra las relaciones trofodinámicas del ecosistema. En base a los resultados obtenidos, la especieArius melanopus se considera como un consumidor de Segundo Orden. Su espectro trófico está constituido principalmente de materia orgánica, crustáceos tales como Copépodos, Tanaidáceos, Ostrócodos y larvas de insectos; moluscos y restos vegetales. González (1972) indica que Arius liropus ,especie homóloga de Arius malonopus en las costas del Pacífico, es una especie carnívora alimentándose principalmente de crustáceos como Anfípodos y Copépodos. Amezcua Linares (1972) señala que Arius liropus en Nayarit se alimenta de pequeños peces y macroinvertebrados y aún de vegetales. El predominio de los grupos tróficos en la alimentación de los bagres está en función de la disponibilidad del alimento, la estación del año, la localidad dentro del estuario y la edad del pez (Yáñez-Arancibiaet al ., 1976). Del análisis de los índices de importancia relativa y los diagramas tróficos combinados, se observa que el alimento principal en ambas épocas climáticas y ambas localidades, lo constituye la materia orgánica y Copépodos. En el periodo de secas otros dos grupos tróficos principales se incorporan al espectro trófico y son Tanaidáceos en el interior de la Isla del Carmen y restos vegetales en los sistemas Fluvio-Lagunares. El alimento secundario lo constituyen una gran variedad de grupos tróficos dependiendo de la disponibilidad del alimento en cada localidad y periodo climático; ambas localidades en la época de secas presentaron Nemátodos como alimento secundario, y restos de crustáceos en el interior de la Isla del Carmen durante todo el año. En relación a los hábitos alimenticios de otros bagres, se ha sefialado que los juveniles deArius liropus presentan preferencia de pequeños crustáceos como Copépodos y Ostrócodos, y conforme aumenta de tamaño agregan en su dieta otros macro y micro-invertebrados de fondo e inclusive pequeños peces (González, 1972). Darnell (1958) encontró que Arius felis pasa por tres etapas alimenticias durante su vida; los ejemplares menores de 100 mm se alimentan principalmente de Copépodos, al aumentar de tamaño son importantes en su dieta los pequeños invertebrados del fondo, y después de los 200 mm los cangrejos y peces predominan en su régimen alimenticio. En este estudio se encontró en Arius melanopus ciertas variaciones alimenticias de acuerdo con la edad. En la población juvenil presenta como alimento principal la materia orgánica y Copépodos, y como alimento secundario Ostrácodos, Nemátodos y restos vegetales. La población adulta incluye como principal alimento materia orgánica, Tanaidaceos y Copépodos y el alimento secundario lo constituyen restos de crustáceos y Pelecípodos. Parece ser que los Nemátodos en los juveniles y los macroinvertebrados en los adultos constituyen una diferencia en los hábitos alimenticios (Fig. 19 a 30). Asimismo, los juveniles ingieren más alimento en relación a su peso total y conforme crece la especie la necesidad gravimétrica y energética de alimento es mucho menor (Fig. 31). De acuerdo al estado de repleción del tubo digestivo, se puede precisar si los peces fueron capturados en lugares de alimentación o no (Cabreraet al ., 1973). Muchos de los estómagos revisados se encontraron casi vacíos y otros con el alimento en avanzado estado de digestión; esto se debe quizá, a que en los peces depredadores tropicales la velocidad de digestión es más rápida en relación a los peces de zonas de altas y medianas latitudes (Reshetnikovet al ., 1974) En este caso se puede considerar que el estado del pez es un buen índice para indicar las áreas de alimentación ya que fue aquí donde se presentaron variaciones de acuerdo a la localidad y el periodo climático. Durante el periodo de secas en el interior de la Isla del Carmen, se encontraron individuos muy gordos pero sus estómagos casi vacíos. En los sistemas Fluvio-Lagunares, en este mismo periodo, el estado del pez era gordo pero el estado de repleción fue lleno en los juveniles y casi vacío en los adultos. Durante el periodo de lluvias, para el interior de la Isla del Carmen los juveniles eran muy gordos con el estómago casi vacío o medio lleno, mientras que los adultos fueron delgados y con los estómagos casi vacíos; esto último puede deberse a que se encontraban en época posreproductiva. En los sistemas FluvioLagunares ambas poblaciones presentaron la mayor proporción de individuos gordos y el tracto digestivo casi vacío. Esta última localidad se considera un área de desove e incubación de huevos y/o embriones; y Gudger (1912) y Yáñez-Arancibia et al.(1976) mencionan que, al parecer, durante el periodo de crianza los machos no se alimentan presentando gran cantidad de sustancias grasas de reserva. No se aprecia un patrón definido en relación al estado del pez y la repleción de sus estómagos vs los gradientes de los habitat analizados. Sin embargo, ha sido evidente la relación directa de la población reproductiva con sus estómagos vacíos y abundante tejido graso en su tracto digestivo, y la población posreproductiva delgada. CICLO BIO-ECOLÓGICOLa reproducción, crecimiento, alimentación y madurez son aspectos fundamentales para establecer un modelo del ciclo bio-ecológico de la especie; en función del tiempo y el espacio y con las migraciones involucradas. En términos generales, el patrón de migración de Arius melanopus obedece a estrategias reproductivas y alimenticias de su ciclo biológico, controlado por factores bióticos (edad y necesidades tróficas) y abióticos (salinidad, temperatura, turbidez y corrientes). Esto puede ilustrarse en el modelo de la figura 32: 1) Los sistemas Fluvio-Lagunares constituyen las áreas de reproducción y parte de la crianza durante el periodo de lluvias; 2) juveniles y adultos posreproductivos abandonan las áreas de reproducción, siendo la cuenca central de la laguna un gran área de tránsito donde se recluta la gran población de juveniles; 3) las áreas del interior de la Isla del Carmen son zonas de alimentación para adultos y juveniles preadultos; 2 y 3 durante el periodo de secas. Finalmente, la población adulta en proceso de maduración abandona las áreas del interior de la Isla del Carmen, dirigiéndose a las áreas de reproducción. Los gradientes de salinidad, temperatura y turbidez, parecen ser los factores más relevantes, correlacionados con el modelo propuesto. El movimiento reproductivo de 3-2-1 es en el sentido de la circulación prevaleciente en la laguna; y el movimiento alimenticio de 1-2-3 es en contra de la corriente (Fig. 1). Separar las áreas de reproducción del total de habitat diferentes que la especie es capaz de colonizar (Figs. 1 y 5) y, la amplitud de su espectro trófico son estrategias adaptativas muy ventajosas en la competencia interespecífica, lo que se refleja en su extraordinaria abundancia de la especie en la laguna. RELACIONES ECOLÓGICASArius melanopus es una de las especies más abundantes en número y biomasa y una de las mejores adaptadas fisiológica y morfológicamente a la Laguna de Términos. Es una especie típicamente estuarina, completa todo su ciclo de vida en el interior del ecosistema lagunar y realiza migraciones dentro de la laguna como estrategia reproductiva y alimenticia (Fig. 32). Se puede establecer que Arius melanopus vive sin dificultad entre rangos de salinidades de 0 a 26 ppm, rangos de temperatura de 19 a 35ºC y rango de transparencia de 20 a 80%. Sin embargo, son muy pocos los ejemplares que se colectan a salinidades mayores de 25 ppm y temperaturas menores de 20ºC. Esta capacidad euritermohalina le permite a la especie colonizar todos los habitat de la laguna descritos en la figura 1. Por su distribución en los diferentes ambientes ecológicos del área y la amplitud de su espectro trófico, juega un importante papel en la conducción, intercambio, transformación y almacenamiento de energía dentro de los límites del sistema ecológico estudiado; esto es en términos ecológico-adaptativos de Yáñez-Arancibia y Nugent (1977). 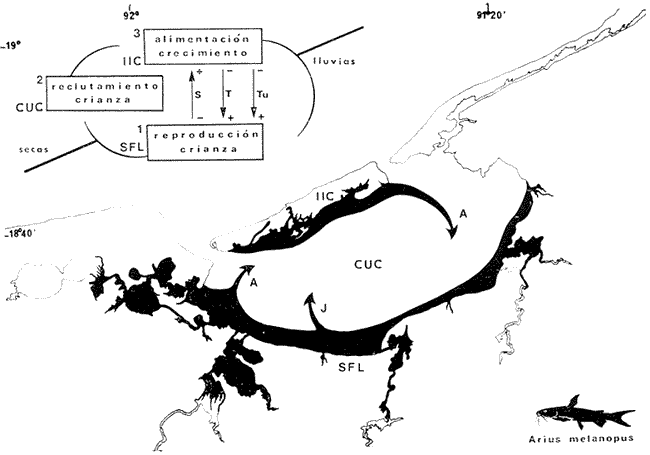 Fig. 32. Modelo conceptual del ciclo bio-ecológico de Arius melanopus en la Laguna de Términos. Se ilustra el patrón de migración de adultos (A) y juveniles (J) como adaptación a sus estrategias reproductivas y alimenticias, desde los sistemas Fluvio-Lagunares (SFL) hacia la cuenca central de la laguna (CUC) y el interior de la Isla del Carmen (IIC). El ciclo de la parte superior señala el comportamiento en relación al periodo climático y correlacionado con el gradiente de salinidad (S), temperatura (Ti y turbidez (Tu). Explicación en el texto. Es una especie preferentemente carnívora, pero como consumidor de Segundo Orden incluye importantes cantidades de detritus en su alimentación. No sufre gran presión de predación en su competencia interespecífica. Pero por sus hábitos gregarios compite ventajosamente por espacio y alimento con un gran número de otros consumidores de Segundo Orden en la laguna reportados por Yáñez-Arancibia et al. (1980). Es una especie abundante en los sistemas FluvioLagunares donde se reproduce a salinidades menores de 12 ppm, temperaturas ±: 35ºC y transparencia de 20 a 40%, durante la época de lluvias, en ambientes deRhizophora mangle y Crassostrea. virginicadescritos por Amezcua Linares y Yáñez-Arancibia (1980). La especie es un gran recurso económico potencial para el hombre a corto plazo. AgradecimientosLos autores agradecen a Agustín Ayala-Castañares, José Luis Rojas Galavíz, Alfredo Laptiarda Figueras y Antonio García-Cubas, por la cuidadosa lectura del manuscrito y por sus valiosos comentarios y sugerencias. Agradecen también a Irma Vargas Maldonado por los comentarios en las diferentes etapas del trabajo, asimismo por la elaboración de las gráficas. A los compañeros del Laboratorio de Ictiología y Ecología Estuarina por sus valiosas críticas a lo largo de la realización de este estudio. Al personal del Laboratorio de Oceanografía Física del Instituto de Ciencias del Mar y Limnología, por las facilidades en la realización del programa de computación y procesamiento de datos. El apoyo institucional y económico para la realización del presente trabajo fue brindado por el Instituto de Ciencias del Mar y Limnología (UNAM) y parcialmente el Programa Regional de Desarrollo Científico y Tecnológico de la Organización de los Estados Americanos (OEA) a través de su Oficina de Proyectos Especiales en Washington. LITERATURAAMEZCUA LINARES, F., Tesis profesional Aportación al conocimiento de los peces del sistema de Agua Brava, Nayarit. Fac. Ciencias, Univ. Nal. Autón. México, 1972. 209 p. _____, An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, Generalidades ictiológicas del sistema lagunar costero de Huizache-Caimanero, Sinaloa, México. 1977. 1-26. 4 (1): AMEZCUA LINARES, F. A. YÁÑEZ-ARANCIBIA,An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México Ecología de los sistemas fluvio-lagunares asociados a la Laguna de Términos. El habitat y la estructura de las comunidades de peces. 1980. 70-118.7 (1): AOYAMA, T., In: Japanese Materials. Concerning the survey of food habits specially the survey of food habits of benthos fishes which were caught at Yellow Sea and East China Sea. 1956. BOTELLO, A. V. E. F. MANDELLI, Final Tech. Report. Project - GU853. A study of variales related to the water quality of Terminos Lagoon and adjacent coastal arcas, Campeche, Mexico. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México (Informe mimeografiado),1975. 92 p. 25 tabl. BRAVO-NÚÑEZ, E. A. YÁÑEZ-ARANCIBIA An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México,Ecología de la Boca de Puerto Real, Laguna de Términos. 1. Descripción del área y análisis estructural de las comunidades de peces.1979.125-182.6 (1): CABRERA, S M. DE L. BAIZ C. R. CANDIA H. E. CHRISTIANSEN Algunos aspectos biológicos de las especies de ictiofauna de la zona de Punta Lara (Río de la Plata). II. Alimentación natural del bagre porteño (Parapimelodus valenciennesi). Servicio de Hidrología Naval 1973.147 (1029): CANDIA, C. R M. DE L. BAIZ S. CABRERAAlgunos aspectos biológicos de las especies de ictiofauna de la zona de Punta Lara (Río de la Plata). III. Estudio de la edad y crecimiento del bagre porteño (Parapimelodus valenciennesi) con algunos datos sobre su reproducción. Servicio de Hidrografía Naval 1973. 1-33.(1030): CARLES, C. A., Datos sobre la biología del banano Elops saurus Linnaeus (Teleostomi: Elopidae). Contr. Centr. Invest. Pesq. Cuba, 1967. 1-53.(27): CARRANZA, J., 3er. Informe del Contrato de Estudios No. EI-69-51, Informe preliminar sobre la alimentación y hábitos alimenticios de las principales especies de peces de la zona de los Planes Pilotos Yavaros y Escuinapa. Univ. Nal. Autón. México, Inst. Biol. y SRH, (mimeografiado).1969. 28 p., 5 figs. CASTRO AGUIRRE, J. L.,Catálogo sistemático de los peces marinos que penetran a las aguas continentales de México con aspectos zoogeográficos y ecológicos. Serie Cientifica, Dir. Gral. Inst. Nal. Pesca, México, 1978. 1-298.19: CUSHINGS, D. H., Marine Ecology and Fisheries. Cambridge University Press, Londres,1975. 278 p. DARNELL, R. M., Food habits of fishes and larger invertebrates of Lake Pontchartrain, Louisiana, an estuarine community. Publ. Inst. Mar. Sci.,, Univ. Texas, 1958.353-416. 5: DOERMANN, J. E D. J. HUDDLESTON S. H. THOMPSON Age and rate of growth of the sea catfish Arius felis in Mississippi coastal waters. J. Tenn. Acad. Sci,. 1977.148.52 (4): FISHER, W. (Ed.), FAO species identification sheets for fishery purposes. Western Central Atlantic (Fishing arca 31). FAO,Roma, 1978. 1-7. GIERLOFF-EMDEN, H. G., In: Orbital Remote Sensing of Coastal and Offshore Environments: A Manual of Interpretation. Laguna de Términos and Campeche Bay, Gulf of Mexico. Berlin:1977.78-89. GONZÁLEZ, L. I., Tesis profesional Aspectos biológicos y distribución de algunas especies de peces de la familia Ariidae de las lagunas litorales del noroeste de México.Fac. Ciencias, Univ. Nal. Autón. México, 1972.88 p. GRACIA GASCA, A. E. LOZANO ÁLVAREZ An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México Alimentación del bagre marino Netuma platypogon (Pisces: Arfidae) y su importancia como indicador de reclutamiento de post larvas de langostas (Decapoda: Palinuridae) en Zihuatanejo, Gro., México. 1980. 199-206.7 (2): GUDGER, E. W., Science, Oral gestation in the graff-topsail cat-fish, Felichthys felis. 1912. 192.35 (892): _____, Zoologica, The graff-topsail, Felichthys felis, a sea catfish that carries its eggs in its mouth.1916.123-158.2 (5): _____, Oral gestation in the graff-topsail catfish Felichthys felis. Carn. Inst. Wash. Publ., 1918.25-52. 252: GULLAND, J. A., Manual de Métodos para la Evaluación de las Poblaciones de Peces. Ed. Acribia España, Publicación FAO. 1971. 164 p. GUNTHER, G., Observations on breeding of the marine catfish, Galeichthys felis (Linnacus) Copeia, 1947.217-222. 4: HARDEN JONES, F. R., Fish Migration. Edward Arnold (Publishers) Ltd. London, 1968. 326 p. HARRIS, A. H. C. D. ROSE, Shrimps predation by the sea catfish Galeichthys felis. Trans. Am. Fish. Soc., 1968. 503-504.97 (4): HARVEY, E. J., Observations on the distribution of the sea catfish Arius felis larvae with and without chorion with respect to salinity in the Biloxi Bay, Mississippi Sound Arca. J. Miss. Acad. Sci. 1972. 77 p.17: JORDAN, D. S. B. W. EVERMANN, Bull. U.S. Nat. Mus., The fishes of north and midle America. 1896-1900. 1-3313, 398 láms., 958 figs. 1-1 (47): LAEVASTU, T., Manual de Métodos de Biología Pesquera. Ed. Acribia España, Publicación FAO.1971. 243 páginas. LEE, G., Oral gestation in the marine six-whiskcred catfish,Galeichthys felis. Ant. Rec.,1931. 60.51 (1): _____, Copeia, Oral gestation in the marine catfish, Galeichthys felis.1937.44-56. 1: LUENGO, J. A., Acta Cient. Venez., Studies on the reproduction of some marine catfish. 1972.70. 23: _____, Bull. Zool. Mus. Univ. Amst., Notes on reproduction in several marine catfish. 1973.47-51.3 (8): MARGALEF, R., Ecología. Ed. Omega. Barcelona,951 p.1977. MC DOWALL, R. M., The role of estuaries in the life cycle of fisheries in New Zealand. Proc. New Zealand Ecol. Soc. 1976.27-32. 23: MEEK, E. S. S. F. HILDEBRAND, The marine fishes of Panama. Field. Mus. Nat. Hist. Publ., Zool. Ser., 1923-1928.1-4045, 118 láms.15 (215, 226 y 249): MOHAMMAD, T. S. QURERSHI, A contribution to the Taxonomy of Marine Catfishes of Family Ariidae. Proc. Pack. Sci. Conf. 1974.840.25 (3): NIKOLSKY, G. V The Ecology of Fishes. Academic Press Inc.,New York,1963. 352 p. PERRY, J. A. S. D. PERRY Los peces comunes de la costa Atlántica de Costa Rica. Facultad de Ciencias y Letras, Departamento de Biología. Ser. Cienc. Nat., 1974.17.1 (7): PHLEGER F. B. A. AYALA-CASTAÑARES Bull. Am. Ass. Petrol. Geol., Processes and history of Terminos Lagoon, Mexico. 1971.2130-2140.55 (2): PINKAS, L. M. S. OLIPHANT I. L. K. INVERSON Food habits of albacore, blue fin tuna and bonito in California waters.. Dept. Fish and Game Cal. Fish. Bull., 1971. 1-105.152: RESÉNDEZ, A., An. Inst. Biol. Univ. Nal. Autón. México. Ser. Cienc. del Mar y Limnol., Estudio de los peces de la Laguna de Tamiahua, Veracruz, México. 1970. 79-146.41 (1): _____, Revta. Soc. Mex. Hist. Nat., Estudio de los peces de la Laguna de Alvarado, Veracruz, México. 1973.183-281. 31: RESHETNIKOV, Y. S R. CLARO A. SILVA Ritmo alimentario y velocidad de digestión de algunos peces depredadores tropicales. Academia de Ciencias de Cuba Instituto de Oceanología Serie Oceanología,1974.1-13. 21: SÁNCHEZ-GIL, P. A. YÁÑEZ-ARANCIBIA F. AmEzCUA LINARESAn. Inst. Cienc. del Mar y Limnol. Univ. Nal. Autón. México, Diversidad, distribución y abundancia de las especies y poblaciones de peces demersales de la sonda de Campeche 1981.209-240.8 (1):(Verano, 1978). SMITH, R. F A. H. SWARTZ W. H. MASSMANN A Symposium on Estuarine Fisheries. Am. Fish. Soc. Spec. Publ., 1966. 11-54. 3: TAVOLGA, W. V., Mechanisms for directional in the sea catfish Arius felis. J. Exp. Biol., 1977.97-11667 (april): VARGAS MALDONADO, I. A. YÁÑEZ-ARANCIBIAF. AMEZCUA LINARES An. Inst. Cienc. del Mar y Limnol. Univ. Nal. Autón. México, Ecología y estructura de las comunidades de peces en áreas de Rhizophora mangle y Thalassia testudinum de la Isla del Carmen, Laguna de Términos, Sur del Golfo de México.1981.241-266. 8 (1): YÁÑEZ-ARANCIBIA, L. A., Relaciones tróficas de la fauna ictiológica del sistema lagunar costero de Guerrero y aspectos parciales de dinámica de poblaciones de los peces de importancia comercial. In: Informe Final de 2da. Etapa del Programa de Uso de la Zona Costera de Michoacán y Guerrero. Convenio Comisión del Río Balsas, SRH y Centro de Ciencias del Mar y Limnología, UNAM, México, 750 p. Contrato No. OCE-03-74. 1975. 230 p. 104 tablas, 71 figs. _____,Taxonomía, Ecología y Estructura de las Comunidades de Peces en Lagunas Costeras con Bocas Efímeras del Pacífico de México. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, Publ. Esp. 1978. 2:1-306. _____, Coastal Lagoon Research: Present and Future. II. Proceedings: Ecology in the entrance of Puerto Real, Terminos Lagoon. II. Discussion on trophic structure of fish communities in banks of Thalassia testudinum. In: Lasserre, P., H. Postman, J. Costlow y M. Steyert (Eds.). UNESCO/IABO Seminar, Duke Univ. Mar. Lab. (in Press).1980. Sept., 1978 YÁÑEZ-ARANCIBIA, A. R. S. NUGENT,An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, El papel ecológico de los peces en estuarios y lagunas costeras.1977.107-114.4 (1): YÁÑEZ-ARANCIBIA, A V. LEYTON An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, Desarrollo del otolito embrionario, patrón de su crecimiento y comparación morfológica con otolitos juveniles y adultos del bagre marino Galeichthys coerulescens (Gunther). 1977.115-124.4 (1): YÁÑEZ-ARANCIBIA, A. J. W. DAY, Jr. Ecological characterization of Terminos Lagoon, a tropical lagoon-estuarine system in the Southern Gulf of Mexico. Oceanologica Acta (en prensa). ISCOL-UNESCO '81, Bordeaux, Francia.1981. Sept. 7-14, 1981 YÁÑEZ-ARANCIBIA, A. J. CURIEL-GÓMEZ V. LEYTON An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, Prospección biológica y ecológica del bagre marino Galeichthys caerulescens (Gunther) en el sistema lagunar costero de Guerrero, México (Pisces: Ariidae).1976.125-180.3 (1): YÁÑEZ-ARANCIBIA, A. F. AMEZCUA LINARES J. W. DAY Estuarine Perspectives. Fish community structure and function in Terminos Lagoon a tropical estuary in the Southern Gulf of Mexico. The Fifth Biennal International Estuarine Research Federation Conference. Jeckyll Island, Georgia, In: Kennedy, V. (Ed.) Academic Press Inc., New York: 1980.465-482. Oct. 7-12, 1979. YASUDA, F., Bull. Japanese Soc. Sci. Fish., The type of food habits of fishes assured by stomach contents examination. 1960. 653-662.26 (7): YAKOTA, T., In: Japanese Materials. The construction of fish community at Nankai Regional area from the viewpoint of their food habits. 1956.
|

