|
ECOLOGÍA Y ESTRUCTURA DE LAS COMUNIDADES DE PECES EN
ÁREAS DE RHIZOPHORA MANGLE Y THALASSIA TESTUDINUM DE LA ISLA DEL CARMEN,
LAGUNA DE TÉRMINOS, SUR DEL GOLFO DE MÉXICO
Trabajo
recibido el 28 de agosto de 1980 y aceptado para su publicación el 18 de
noviembre de 1980.
IRMA VARGAS MALDONADO
ALEJANDRO YÁÑEZ-ARANCIBIA
FELIPE AMEZCUA LINARES
Universidad Nacional
Autónoma de México, Instituto de Ciencias del Mar y
Limnología. Laboratorio de Ictiología y Ecología
Estuarina. Contribución 228 del Instituto de Ciencias del Mar y
Limnología, UNAM.
Se discuten las
características ecológicas del habitat en la asociación
deRhizophora mangle y Thalassia
testudinumde la Isla del Carmen -Laguna de Términos- y de las
poblaciones de peces, haciendo énfasis en la estructura de la comunidad
durante las dos épocas climáticas marcadas del área
(lluvias y secas).
Fueron analizados 1987 individuos de 27
familias, 33 géneros y 46 especies, desde el punto de vista de los
componentes comunitarios, diversidad (H', D, J') abundancia (indiv. m-²,
g.m-²), especies dominantes, categorías ictiotróficas,
relación longitud peso de las especies típicas con el modelo P =
a Lb, y análisis "cluster" de las diferentes colectas para determinar el
grado de afinidad ecológica entre los componentes del
ecosistema.
Se concluye que no existen diferencias
ambientales para dos épocas climáticas marcadas. Las variaciones
en la diversidad para ambas épocas no son el reflejo de la riqueza de
especies, sino que dependen de la heterogeneidad y la biomasa. La:
distribución del "standing crop" y el número de individuos se ve
influenciado por el predominio de juveniles. Las especies típicas a
través de todo el año son: Archosargus rhomboidalis,
Arius felis, Bairdiella chrysura, Cichlasoma urophthalmus, Diapterus rhombeus,
Eucinostomus gula y Sphoeroides testudineus, los
consumidores de segundo orden y los visitantes cíclicos predominan en la
comunidad.
El análisis "cluster" con dendrogramas de
similaridad (pasos de 0.01) permite establecer que el interior de la Isla del
Carmen es una unidad ecológica, subsistema o habitat particular dentro
del complejo ecosistema de Laguna de Términos.
The
ecological characteristics of habitats in the Rhizophora mangle
and Thalassia testudinum association in El Carmen Island Terminos
Lagoon-, and fish populations, are discussed with emphasis on community
structure during dl-y and rainy seasons. 1987 individual fish were studied from
27 families, 33 genera and 46 species, from the point of view of community
inhabitants, diversity (H', D, J'), abundance (indiv. m-², gm-²),
dominant species, ichthyotrophic categories, lenght-weight regressions of
typical species using the model P = a Lb, and cluster analysis of all
collections ir order to determine ecological affinities among ecosystem
components.
It is concluded that there are no environmental
differences between the two climatic periods. Variations in diversity in both
periods were not the consequence of species richness, but depended on species
heterogeneity and biomass. The distribution of standing crop and number of
individuals were affected by abundance of juveniles. Typical species throughout
all the year are: Archosargus rhomboidalis, Arius felis, Bairdiella
chrysura, Cichlasoma urophthalmus, Diapterus rhombeus, Eucinostomus gula,
Sphoeroides testudineus. Second orden consumers and cyclical
inhabitants are abundant in the community.
Cluster analysis
with affinity dendrograms (steps of 0.01) showed the El Carmen Island inner
areas as an ecological unit, subsystem or particular habitar, inside the larger
ecosystem of Terminos Lagoon.
El Instituto de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México y su Estación "El Carmen" Campeche, junto con la Organización de los Estados Americanos (OEA) a través del Proyecto Multinacional en Ciencias del Mar en su Programa Regional de Desarrollo Científico y Tecnológico, auspiciaron el presente trabajo. Esta contribución forma parte a su vez de un amplio programa de investigaciones denominado "Recursos Bióticos en Lagunas Costeras, Manglares y Áreas Adyacentes de América Latina (Proyectos Piloto Comparativos en el Golfo de Nicoya, Costa Rica; Bahía de Puerto Viejo, República Dominicana; y Laguna de Términos, Campeche, México)". Diferentes investigaciones sobre ecología de comunidades de peces se están realizando en Laguna de Términos, con la finalidad de establecer una panorámica general de la ecología de la laguna, su ciclo anual y sobre todo conocer aspectos de la estructura de las comunidades. Estos aspectos ecológicos, sirven como marco de referencia para evaluar un sistema en estado natural y detectar cambios provocados por la contaminación en general. Además, la información es valiosa por sí misma dado que se obtiene en un área estratégica del punto de vista ecológico (Phleger y Ayala-Castañares, 1971) y pesquero (Sánchez Gil et al., 1981). Siendo los complejos estuarinos desde el punto de vista físico, muy cambiantes, resultan ideales para observar la influencia que tiene el ambiente en las poblaciones como resultado de las mutuas interacciones; en este sentido la Laguna de Términos es un lugar interesante por las siguientes razones, puntualizadas por Yáñez-Arancibia y Day (1981): 1) Por su localización tropical no sufre cambios estacionales severos. 2) Presenta dos bocas que la conectan con el Golfo de México. Debido a la naturaleza de los vientos regionales, corrientes costeras y descarga de los ríos, hay un flujo neto a través de una boca y una salida neta a través de la otra. Este patrón de circulación, tiene como consecuencia gradientes casi permanentes de salinidad, turbidez, tipos de sedimento, nutrientes y otros factores ambientales. 3) Existen diferentes habitat (subsistemas) en la laguna, que incluyen zonas oligohalinas, arrecifes de ostras, áreas de alta sedimentación, áreas de persistente influencia marina, pastos de pantano, pastos marinos y manglares. En muchos países, es altamente valorada la existencia de pastos marinos y manglares en los ecosistemas costeros. En ciertas áreas, diversas pesquerías pueden depender directa o indirectamente de estos sistemas costeros (McRoy, 1973). Esto se debe, a que los pastos marinos son uno de los sistemas más productivos del mundo; su producción se acerca al límite teórico máximo por unidad de área y va de 10 a 20 gm-² día-¹ (McRoy et al., 1977). En circunstancias favorables su productividad primaria neta es comparable a la de un bosque tropical lluvioso (Mann, 1973). Otro aspecto importante de los pastos marinos y manglares es, que al contrario de otros sistemas ecológicos, en que los niveles tróficos superiores se alimentan principalmente de seres vivos, los sistemas de pastos marinos y manglares son grandes productores de detritus, esta fuente potencial de energía, es uno de los principales puntos de partida de la transfreencia energética de las estructuras tróficas involucradas (Odum y Heald, 1972 y 1975; Odum et al .,1973). Además de esto, la multiplicidad de sus funciones ecológicas les confiere importancia priortiaria en los habitat costeros (Ferguson Wood et al ., 1969). OBJETIVOSDe las consideraciones anteriores surge la necesidad de evaluar algunos aspectos de estos sistemas, por lo que los objetivos planteados al inicio de esta investigación fueron: 1) Determinar qué similitud ecológica en términos de especies, existe en dos zonas de la Laguna de Términos; Estero Pargo y Bajos del Cayo, cuyos productores primarios son comunes. 2) Determinar algunos aspectos de la estructura de las comunidades tales como diversidad, abundancia, relaciones tróficas, componentes comunitarios y relación peso-longitud de algunas de las especies dominantes, en las épocas de lluvias y secas. 4) Obtener un panorama general del área, con énfasis en el litoral interno de la Isla del Carmen, integrando sus características químicas, físicas y biológicas. ANTECEDENTESEl número de publicaciones que se refieren a la ecología de lagunas costeras del Golfo de México y Mar Caribe, es bajo, pero se aprecia un incremento en los últimos años. Entre los trabajos recientes cabe citar a Phleger y Ayala-Castañares (1971), Edwards (1973), Villalobos et al. (1975), Chávez et al.(1976), Jordán et al. (1978), Yáñez-Arancibia y Day (1981) y Yáñez-Arancibiaet al. (1980), siendo este último un estudio global de la estructura de comunidades de peces en la Laguna de Términos, que integra la información de diversas publicaciones ecológicas de esa área. Por otra parte, enfocando la atención en áreas protegidas, existen diversas publicaciones sobre pastos marinos, cabe citar entre otros a: den Hartog (1970), Zieman (1975) y D'Croz (1977), sobre distribución y ecología. Como diversos autores lo enfatizan, es necesario un mayor número de estudios acerca de comunidades de pastos marinos; según McRoy (1973) y otros, esta necesidad se deriva de que el significado global que tienen los pastos marinos, a la contribución de la ecología de las zonas costeras, no puede evaluarse aun en base al conocimiento disponible. Para que su significancia sea enteramente apreciada, Thayer et al.(1975) proponen que los pastos marinos sean considerados en términos de su interacción con otras fuentes de producción primaria. Sobre bosques de manglar la literatura es también abundante, sobre todo acerca del papel que desempeñan en la cadena trófica como formadores de detritus (Odum et al., 1973; Healdet al., 1974) y ecología en general (Kuenzler, 1974; Lugo y Snedaker, 1974). El estudio más detallado que existe se efectuó en la zona Indopacífica y abarca comunidades asociadas al manglar, incluyendo zonaciones (vertical y horizontal) además de adaptaciones (Macnae, 1968). En México existen ciertos trabajos de manglares, entre ellos puede citarse un plan de investigaciones sobre los mismos en México, especialmente con relación a su importancia en producción pesquera (Rollet, 1974). Sobre comunidades animales están los trabajos de Chávez (1979) y Yáñez-Arancibia (1978a). Se ha puntualizado ya la importancia de pastos Marinos (McRoy, 1977) y manglares (Heald et al ., 1974) como fuente de energía directa a macroconsumidores, además se ha tratado de evaluar dichas zonas como áreas de alimentación, crianza, reproducción y protección temporal para peces. Estos antecedentes, permiten suponer razonablemente que la interacción pastos marinos-manglar tiene un papel preponderante, en la ecología de los sistemas internos de la laguna. ÁREA DE ESTUDIOLa Laguna de Términos es una de las más grandes del litoral mexicano (aproximadamente 2,500 km²), presenta una topografía muy plana, sin elevaciones, y que en cuanto a su desarrollo morfológico se encuentra en plena evolución. Se localiza a los 91º10' - 92º00' oeste y 18º20' - 19º00' norte. Hacia el norte la delimita la Isla del Carmen de 37.5 km de largo por 3 km de ancho Ayala-Castañares, 1963), en cuyos extremos laterales se ubican dos bocas que la comunican permanentemente con el mar: Boca de Puerto Real y Boca del Carmen (Fig. 1). Se encuentra en la zona de transición entre las calizas de la península de Yucatán y los terrenos aluviales del sistema Grijalva-Usumacinta y limita con las aguas del Golfo de México (Coll de Hurtado, 1975). Se encuentra situada frente a una extensa franja de plataforma continental de una amplitud promedio de 120 km desde el litoral hasta su margen interno (Gutiérrez-Estrada, 1977). Esta zona conocida como Sonda de Campeche soporta una de las más grandes pesquerías marinas de México (Yáñez-Arancibia y Day, 1981). La laguna es somera, su profundidad media es de 3.5 m y en áreas protegidas es de 1.9 m o menos (Ley Lou, 1979; Amezcua-Linares y Yáñez-Arancibia, 1980). 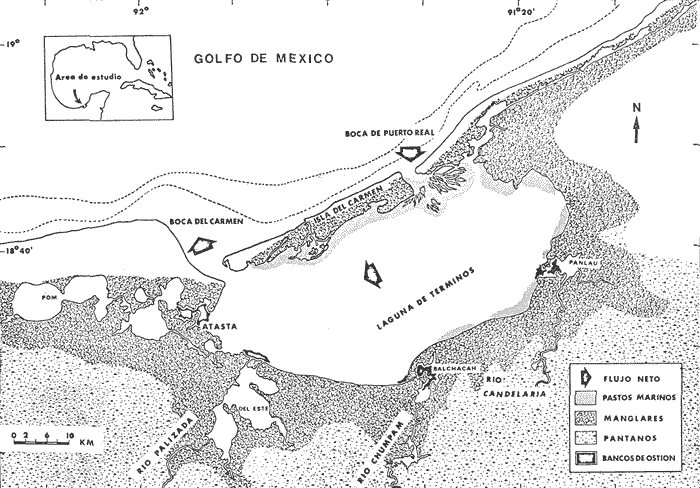 Fig. 1. Laguna de Términos, Campeche. Se señala fisiografÍa general y habitat principales. (Tomada de Yáñez-Arancibia et al., 1980). CLIMAEl clima del área es del tipo Amw (García, 1973), cálido húmedo isotermal con una estación lluviosa durante los meses de abril a octubre y una estación de vientos "nortes" secos e intermitentes de noviembre a marzo que son generados por el desplazamiento hacia el sur de masas de aire frío. Estos vientos alcanzan velocidades de 50 a 72 nudos y llegan a durar hasta 5 días (Vargas, 1977). La temperatura ambiental oscila entre 17 y 32ºC (Ayala-Castañares, 1963). HIDROLOGÍA Y CORRIENTESLas temperaturas en el agua fluctúan entre 27 y 33ºC y en áreas protegidas varían de 24 a 28ºC (Tabla 1). La precipitación media anual es de 1,600 mm. Tres grandes ríos llevan un gran volumen de agua y acarrean sedimentos a la laguna, estos son: el Río Palizada, Río Chumpan, Río Candelaria y en parte el sistema Atasta. No existen datos publicados para Chumpán y Palizada, pero su patrón de flujo es similar al Usumacinta, del cual el Río Palizada es distributario (Yáñez-Arancibia y Day, 1981). El escurrimiento medio anual para el río Grijalba es de 9,600.10/6 m³, Usumacinta 50,719.10/6 m³, Chumpán 434.10/6 m³ y Candelaria 1,692.10/6 m³ (Gutiérrez-Estrada, 1977). La descarga promedio anual de los ríos que desembocan en la laguna se estima en 6.10/9 m³ (Phleger y Ayala-Castañares, 1971). Los vientos dominantes del este, la corriente litoral y la descarga de los ríos provocan que el agua del Golfo entre a la laguna por la Boca de Puerto Real y salga por la Boca del Carmen. Esta afirmación se basa en los patrones de foraminíferos, la distribución de la salinidad, la turbidez, la batimetría de las áreas de las bocas, así como la productividad y distribución de las comunidades Ayala-Castañares, 1963; Yáñez Correa, 1963; Yáñez-Arancibia y Day, 1981; Yáñez-Arancibia et al ., 1980); Mancilla y Vargas (1980) reportan un flujo neto de 1,350 m³/seg en sentido oriente-occidente. SALINIDADLas características químicas están determinadas por la circulación, el flujo de los ríos y la biología de la laguna (Yáñez-Arancibia y Day, 1981). Esto trae como consecuencia que la laguna presente un rango de salinidades muy amplio. Diversos autores han reportado diferentes salinidades para la laguna, entre ellos Phleger y Ayala-Castañares (1971) reportan salinidades de 25 a 36.5 ppm en la parte nor-este cerca de la boca de Puerto Real y de 28 ppm en las partes oeste y sur; Bravo-Núñez y Yáñez-Arancibia (1979) reportan 26 a 39 ppm en la boca de Puerto Real durante 1976-1977; Ley-Lou (1979) reporta 40 ppm en áreas protegidas; Amezcua-Linares y Yáñez-Arancibia (1980) registraron desde 0 hasta 28 ppm en los sistemas fluvio lagunares de Términos; Carvajal (1973) registro promedios de 33 ppm en la época de secas y de 26 ppm en la época de lluvias; Botello y Mandelli (1975) reportan para 1974, 33.5 ppm y 21.9 ppm respectivamente para las épocas mencionadas. En la tabla 1 se muestran las salinidades registradas en las áreas protegidas de este estudio durante 1976-1977. GEOLOGÍA Y SEDIMENTOSLa Laguna de Términos tuvo su origen en la regresión del Holoceno por sedimentación terrígena diferencial (Lankford, 1977). Por su tipo de sedimentos se localiza en el límite de una zona de depósitos biogénicos, en la parte este y una zona de depósito de detritus terrígenos aportados por los ríos (Phleger y Ayala-Castañares, 1971). Presenta un delta interno de sedimentos calcáreos hacia el lado de la laguna en la boca de Puerto Real y otro muy marcado hacia el Golfo en la Boca del Carmen. El área correspondiente a Bajos del Cayo parece haber sido el delta de una boca en otros tiempos (Phleger y Ayala-Castañares, 1971). Los tipos de sedimento existentes en la laguna son: arenas, arcillas, limos, fragmentos de conchas de moluscos así como combinaciones de estos (Yáñez-Correa 1963). En las zonas del litoral interior de la Isla del Carmen, los sedimentos son en un gran porcentaje arenas de transición con un contenido de 40 a 50% de CaCO 3 y alto contenido orgánico (Tabla 1). 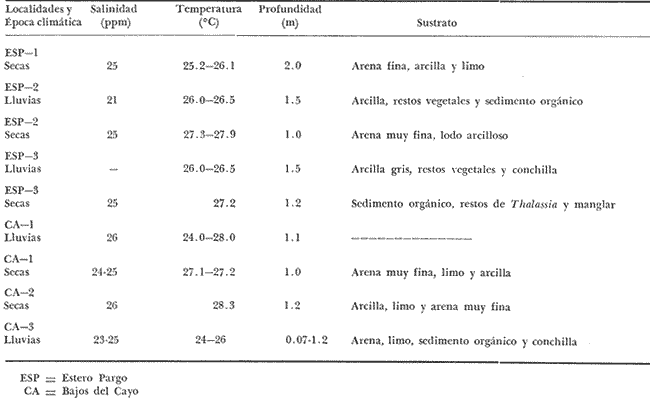 TABLA 1 PARÁMETROS AMBIENTALES Y CARACTERISTICAS GENERALES DEL HABITAT EN LAS ÁREAS DE THALASSIA TESTUDINUM Y RHIZOPHORA MANGLE ESTUDIADAS VEGETACIÓNLa distribución de la vegetación parece estar íntimamente ligada con la transparencia del agua y el contenido de CaCO3 del sedimento En las zonas protegidas de Estero Pargo y Bajos del Cayo (Fig. 2), se observan aguas claras con vegetación sumergida (Fig. 3) formando praderas deThalassia testudinum, Halodule wrigtii ySiringodium filiforme, siendo la primera la más abundante y posiblemente la más significativa geológicamente por su papel como acumuladora de sedimentos Ayala-Castañares, 1963). Otro aspecto muy importante de Thalassia es su alta producción. Hornelas (1975) reporta 382 g.m-² de biomasa total deThalassia en el interior de la Isla del Carmen. La vegetación circundante está representada por mangle, constituido por plantas bien adaptadas a aguas de salinidad elevada. Los mejores representados en áreas protegidas son: Rhizophora mangle (mangle rojo) y Avicenia germinans (mangle negro), ocasionalmente se encuentran Laguncularia racemosa(mangle blanco) y Conocarpus erectus. En términos generales los manglares rojos son más comunes en áreas de mayor salinidad y los negros en áreas cercanas a los ríos, sin embargo ambos existen en las dos áreas y no hay una zonación clásica como se ha reportado por Zarur-Menez en 1962 (Yáñez-Arancibia y Day, 1981). Hedgpeth (1957) cita que los manglares crecen en terrenos arenosos y que en sus proximidades existen densos campos de Thalassia, esta afirmación se cumple para el interior de la Isla del Carmen (Fig. 3). MACROFAUNA BÉNTICAEl bentos típico asociado en áreas protegidas está formado por camarones (Signoret, 1974), poliquetos (Marrón, 1975), epifauna de manglar (Espinoza, 1976), poríferos (Núñez, 1978), equinodermos (Caso, 1980), decápodos (Ibarra, 1979), así como otros grupos bénticos menores (Yáñez-Arancibia, 1978b) constituyendo una excelente disponibilidad de alimento para la fauna nectónica. 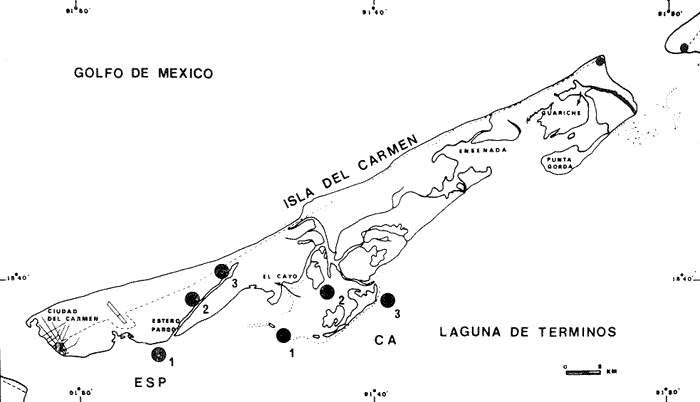 Fig. 2. Área de estudio. Localización de las zonas de muestreo. ESP = Estero Pargo. CA = Bajos del Cayo.  Fig. 3. Ambiente típico del área de estudio. Praderas de Thalassia testudinum y bosques de Rhyzophora mangle. MATERIAL Y MÉTODOS
ACTIVIDADES DE CAMPOLos peces fueron colectados durante el día en los meses de octubre de 1976 y marzo de 1977, para las temporadas de lluvias y secas respectivamente. Se usó una red de arrastre de prueba camaronera ("chango") de las siguientes dimensiones: 10 m de longitud, 9 m de amplitud de boca, 5 m de abertura de trabajo y malla de 3/4. Las colectas fueron 9 en total con una estación de muestreo cada una. Las estaciones se distribuyeron en las áreas protegidas de la Isla del Carmen, correspondientes a Bajos del Cayo y Estero Pargo, como se muestra en la figura 2. En cada estación se hicieron mediciones de profundidad, transparencia, salinidad, temperaturas, oxígeno, se colectaron muestras de sedimento, vegetación y macroepifauna béntica. Para las estimaciones de transparencia, salinidad y oxígeno se utilizaron los métodos convencionales. Como resultado de las colectas se obtuvieron 1987 ejemplares con el siguiente detalle. 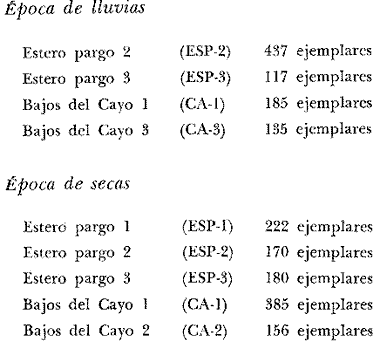 SISTEMÁTICA DE LAS ESPECIESLos ejemplares se identificaron usando los criterios de Cervigón (1966); Jordan y Evermann (1896-1900); Meek e Hildebrand (1923-1928); Hildebrand (1943); Reséndez (1970 y 1973); Toral y Reséndez (1974) y Fisher (1978). Para la ordenación sistemática se siguió el criterio de Greenwood et al . (1966 y 1967). COMPOSICIÓN, DIVERSIDAD, ABUNDANCIA, ESPECIES DOMINANTES y CATEGORÍAS ICTIOTRÓFICASLa composición de la fauna por lo que respecta a tipos de habitantes, fue determinada por la frecuencia de aparición de las especies, su procedencia, su estado de desarrollo gonádico, sus hábitos alimenticios y sus rangos de tallas, entre otras características. Las especies con frecuencia de 1-30% se consideraron visitantes ocasionales. Visitantes cíclicas aquellas especies con 31-70% de frecuencia y finalmente como sedentarias y/o típicamente estuarinas las especies con 71-100% de frecuencia. Las especies residentes permanentes se encuentran en la laguna en todas las épocas. Las visitantes ocasionales usan la laguna regularmente y parece ser que dependen de ella para completar algún estadío de su ciclo de vida. La categorización descrita es similar a la propuesta por Kikuchi (1966), en la cual reconoce para comunidades de pastos marinos: 1) residentes permanentes, 2) residentes estacionales, 3) visitantes temporales y 4) especies migratorias ocasionales, basándose en la frecuencia de aparición de las especies en los muestreos. También es similar a la propuesta por Subrahmanyam y Drake (1975) que reconoce cuatro categorías para comun idades de peces, en base a su presencia como juveniles y/o adultos en marea alta y/o baja: 1) especies residentes permanentes, 2) especies que utilizan los pantanos salobres como áreas naturales de crianza, 3) especies que utilizan los pantanos salobres para alimentarse y 4) especies esporádicas que presentan movimientos erráticos. Los índices de diversidad calculados fueron: el índice de diversidad (H') de Shannon y Weaver (1963); el índice de equitabilidad (J') de Pielou (1966); el índice de biomasa (H'w) de Wilhm (1968) y el índice de diversidad (D) de Margalef (1968). Todos los cálculos se efectuaron con logaritmos base e. La abundancia de las especies fue determinada por su número, densidad (ind.m-²) y biomasa o "standing crop" (g peso húmedo m-²), estas características junto con la frecuencia de especies, sirvieron para determinar aquellas que fueron dominantes. Las categorías ictiotróficas se determinaron fundamentalmente siguiendo el criterio de Yáñez-Arancibia y Nugent (1977). Las categorías son: 1) Consumidores de primer orden, que incluye planctófagos (fito y/o zoo), detritívoros y omnívoros (detritus vegetales y fauna de pequeño tamaño) 2) Consumidores de segundo orden, son peces predominantemente carnívoros, aunque incorporan en su dieta cantidades pequeñas de vegetales y detritus. 3) Consumidores de tercer orden, son peces exclusivamente carnívoros en los cuales los vegetales y detritus son alimentos accidentales. RELACIONES LONGITUD-PESO DE LAS ESPECIES DOMINANTESPara determinar estas relaciones se usó el modelo: P = a · Lb · ε donde P = peso L =longitud total a y b = constantes a determinar ε = error la ecuación anterior se transforma para obtener un modelo lineal de la forma: y = α + βx + ε' de la siguiente manera: In P = Im a + b in L + In ε si: y = In P α = In a β = b x = In L ε' = In ε entonces: In P = y = α + βx + ε' = In a + b 1n L + In ε una vez estimadas α y β, los valores correspondientes para a y para b son: 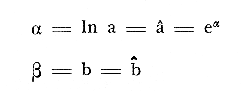 quedando la ecuación: 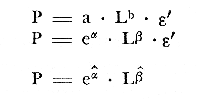 Para ajustar las rectas de regresión se utilizó una rutina del paquete BASIS (Burroughs Advanced Statistical Inquiry System) llamada MULTR con instrucciones para el cálculo de logaritmos, con la finalidad de hacer lineal el modelo. SIMILARIDAD Y ANÁLISIS "CLUSTER"Diversos autores han aplicado el análisis "cluster" al estudio de las comunidades de peces: Horn y Allen (1976); Warburton (1978); Chávez (1979); Daniels (1979) y Yáñez-Arancibiaet al. (1980), entre otros. Con el fin de conocer el grado de similaridad entre las distintas colectas, en términos de su ictiofauna, se realizó un análisis "cluster" como se indica a continuación: Cada especie representó un carácter y cada estación un individuo, la presencia de una especie en una estación dada, tenía un valor de 2 y su ausencia un valor de 1. La suma de las características compartidas por dos estaciones entre sí, proporcionó el grado de similaridad entre ambas, este grado de similaridad tomó valores de 0 (ninguna especie en común) hasta 1 (todas las especies en común), de aquí que el grado de disimilaridad tomó valores de 1 (ninguna especie en común) hasta 0 (todas las especies en común). El procedimiento se repitió por pares de estaciones hasta quedar todas comparadas entre sí. Al comparar cada estación consigo misma, el coeficiente de similaridad fue de 1. Una vez calculados todos los coeficientes se elaboró un diagrama de enrejado (Trellis) esto es, una matriz simétrica m.m con una diagonal principal de similaridades de 1 (Davies, 1971). La segunda etapa correspondió al análisis "cluster" propiamente: se buscó el mayor índice de similaridad después de 1 y las estaciones que lo compartieron formaron el primer grupo ("cluster"). Los grupos resultantes de estaciones parecidas fueron nuevamente agrupadas a un nivel de similaridad menor, este procedimiento se repitió por pasos de 0.01 disminuyendo cada vez el nivel de similaridad en esta proporción, encontrándose cada vez grupos con similaridades menores. El proceso se detuvo cuando se formó el grupo final en el cual quedaron agrupadas todas las estaciones. Se efectuaron dos "clusters", uno considerando la presencia /ausencia de las especies y otro en el que además de esto, se consideraron sus abundancias relativas. Los análisis se efectuaron con dos programas de computación. Los resultados se presentaron en un dendograma dicotómico de estaciones vs especies. RESULTADOSIdentificados y analizados 1987 ejemplares fueron determinados: 1 clase, 2 divisiones, 6 superórdenes, 10 órdenes, 11 subórdenes, 25 familias, 33 géneros y 46 especies. El ordenamiento sistemático que se enlista a continuación sigue el criterio de Greenwood et al.(1966 y 1967) para categorías supragenéricas. LISTA SISTEMÁTICA DE LOS PECES COLECTADOSPhylum Chordata Subphylum Vertebrata Clase Osteichthyes División Taeniopaedia Superorden Clupeomorpha Orden Clupeiformes Suborden Clupeoidei Familia I Clupeidae Género 1 SardinellaCuvier y Valenciennes 1847 Especie 1)Sardinella macrophthalmus(Ranzani, 1842) Familia II Engraulidae Género 2Anchoa Jordan y Evermann, 1927 Especie 2) Anchoa mitchilli mitchilli (Cuvier y Valenciennes, 1848) Género 3Cetengraulis Günther, 1868 Especie 3) Cetengraulis edentulus (Cuvier, 1821 División Euteleostei Superorden Protacanthopterygii Orden Salmoniformes Suborden Myctophoidei Familia III Synodontidae Género 4Synodus(Gronow) Scopoli, 1777 Especie 4)Synodus foetens(Linnaeus,1766) Superorden Ostariophysi Orden Siluriformes Familia IV Ariidae Género 5 Arius Cuvier y Valenciennes, 1840 Especie 5) Arius felis (Linnaeus, 1766)
Especie 6) Arius melanopus (Günther, 1864)
Superorden Paracanthopterygu Orden Batrachoidiformes Familia V Batrachoididae Género 6 Opsanus Rafinesque, 1818 Especie 7) Opsanus beta (Goode y Bean, 1879) Superorden Atherinomorpha Orden Atheriniformes Suborden Cyprinodontoidei Familia VI Poeciliidae Superorden Acanthopterygii Orden Gasterosteiformes Suborden Syngnathoidei Familia VII Syngnathidae Género 7 Syngnathus Linnaeus, 1758 Especie 8) Syngnathus scovelli(Evermann Kendall, 1895) Orden Scorpaeniformes Suborden Scorpaenoidei Familia VIII Triglidae Género 8Prionotus Lacépède, 1802 Especie 9) Prionotus sp. Orden Perciformes Suborden Percoidei Familia IX Centropomidae Género 9CentropomusLacépède, 1802 Especie 10)Centropomus parallelus (Poey,1861) Especie 11) Centropomus undecimalis (Bloch, 1792) Familia X Serranidae Género 10 Epinephelus Bloch, 1793 Especie 12)Epinephelus guttatus (Linnaeus, 1758) Familia XI Carangidae Género 11Caranx Lacépède, 1802 Especie 13) Caranx hippos (Linnaeus, 1766) Género 12 ChIoroscombrusGirard, 1858 Especie 14) Chloroscombrus chrysurus (Linnaeus, 1766) Género 13Oligoplites Gill, 1863 Especie 15)Oligoplites saurus (Bloch y Schnei der, 1801) Familia XII Lutjanidae Género 14Lutjanus Bloch, 1790 Especie 16)Lutianus analis (Cuvier y Valenciennes, 1828) Especie 17) Lutjanus griseus (Linnaeus, 1758) Familia XIII Gerridae Género 15 Diapterus Ranzani, 1842 Especie 18)Diapterus evermanni (Meeke Hildebrand, 1925) Especie 19) Diapterus rhombeus (Cuvier, 1829) Género 16 Eucinostomus Baird y Girard, 1854 Especie 20) Eucinostomus argenteus (Baird y Girard, 1854) Especie 21)Eucinostomus gula (Cuvier, 1830) Especie 22) Eucinostomus melanopterus (Bleeker, 1863) Género 17 Eugerres Jordan y Evermann, 1927 Especie 23) Eugerres plumieri(Cuvier, 1830) Género 18GerresCuvier, 1824 Especie 24)Gerres cinereus (Walbaum, 1792) Familia XIV Pomadasydae Género 19 HaemulonCuvier, 1829 Especie 25) Haemulon bonariense (Cuvier, 1830) Especie 26)Haemulon plumieri(Lacépède, 1802) Género 20Orthopristis Girard, 1859 Especie 27)Orthopristis chrysopterus (Linnaeus, 1766) Especie 28) Orthopristissp. Familia XV Sparidae Género 21Archosargus Gill, 1865 Especie 29)Archosargus probatocephalus (Walbaum, 1792) Especie 30) Achosargus rhomboidalis(Bloch, 1792) Familia XVI Scianidae Género 22 Bairdiella Gill, 1861 Especie 31)Bairdiella chrysura (Lacépède, 1802) Especie 32)Bairdiella ronchus (Cuvier y Valenciennes, 1830) Género 23Cynoscion Gill, 1861 Especie 33)Cynoscion nebulosus (Cuvier y Valenciennes, 1830) Género 24 Equetus Rafinesque, 1815 Especie 34) Equetus acuminatus (Bloch y Schneider, 1801) Familia XVII Ephippidae Género 25 ChaetodipterusLacépède, 1803 Especie 35)Chaetodipterus faber (Broussonet, 1782) Familia XVIII Cichlidae Género 26Cichlasoma Swainson, 1839 Especie 36)Cichlasoma urophthalmus (Günther, 1862) Suborden Scombroidei Familia XIX Trichiuridae Género 27 Trichiurus Linnaeus, 1758 Especie 37) Trichiurus lepturus(Linnaeus, 1758) Orden Pleuronectiformes Suborden Pleuronectoidei Familia XX Bothidae Género 28 Citharichthys Bleeker, 1862 Especie 38) Citharichthys spilopterus (Günther, 1862) Suborden Soleoidei Familia XXI Soleidae Género 29 Achirus Lacépéde, 1802 Especie 39) Achirus lineatus(Linnaeus, 1725)
Orden Tetraodontiformes Suborden Balistoidei Familia XXII Monacanthidae Género 30Alutera Cuvier, 1817 Especie 40)Alutera schoepfi (Walbaum, 1792) Familia XXIII Ostraciidae Género 31Lactophrys Swainson, 1839 Especie 41)Lactophrys tricornis (Linnaeus, 1758) Suborden Tetraodontoidei Familia XXIV Tetraodontidae Género 32SphoeroidesLacépède, 1798 Especie 42)Sphoeroides marmoratus (Ranzani, 1840) Especie 43) Sphoeroides nephelus(Goode y Bean, 1882) Especie 44)Sphoeroides sp. Especie 45)Sphoeroides testudineus(Linnacus, 1758) Familia XXV Diodontidae Género 33Chilomycterus Bibron, 1846 Especie 46)Chilomycterus schoepfi(Walbaum, 1792) ESTRUCTURA DE LAS COMUNIDADES
DIVERSIDADEl rango de diversidad (H'n) para la época de secas fue de 1.01 a 2.30 con un promedio de 1.62; en términos generales las especies que aportaron mayor información al sistema fueron: Eucinostomus gula, Cichlasoma urophthalmus, Diapterus rhombeus, Archosargus rhomboidalis, Bairdiella chrysura, Sphoeroides testudineus y Arius felis. Para la época de lluvias el rango de diversidad numérica (H'n) fue de 0.99 a 1.60 con un promedio de 1.33, las especies que aportaron mayor información al sistema fueron:Eucinostomus gula, Archosargus unimaculatus, Bairdiella chrysura, Caranx hippos ySphoeroides testudineus. Por lo que respecta al índice de equitabilidad J', su promedio fue de 0.52 para la época de lluvias y de 0.58 para la época de secas. El índice de Margalef tuvo promedios de 2.37 y 2.81 para lluvias y secas respectivamente. Para ambas épocas tomando en consideración la biomasa, hubo un patrón muy diferente a H'n, la mayor o menor información que las diferentes especies aportaron al sistema estuvo dada por sus pesos. Por ejemplo: para la época de lluvias en CA-3 Archosargus rhomboidalis con 48 individuos y Lutjanus griseus con 7 individuos aportaron valores muy cercanos de H'w, por tener estos últimos mayores tallas. Este caso se observó repetidas veces en las distintas localidades; un ejemplo sobresaliente lo constituyeron Lutjanus griseus con 4 individuos y Eucinostomus gula con 52 individuos y valores de 0.22 de H'w para ambas especies, en la estación ESP-3 de la época de secas. Los rangos de H'w fueron de 0.99 a 1.9 con un promedio de 1.59 para la época de lluvias y de 0.99 a 2.29 con un promedio de 1.9 para la época de secas.Por lo que se refiere a fluctuaciones de la diversidad en el ciclo anual, los índices H'n, H'w y J' siguen un comportamiento inverso en la época de lluvias con relación a la de secas, lo que no sucede con el índice D (Fig. 4). Analizando la diversidad por zonas en el área de estudio, se encontró que las máximas diversidades en Estero Pargo fueron: H'n = 2.3, H'w = 2.28, D = 4.0 y J' = 0.73 (Fig. 5). En la zona de Bajos del Cayo, las máximas diversidades registradas fueron: H'n = 1.6, H'w = 2.0, D = 2.8 y J' = 0.64 (Fig. 6). 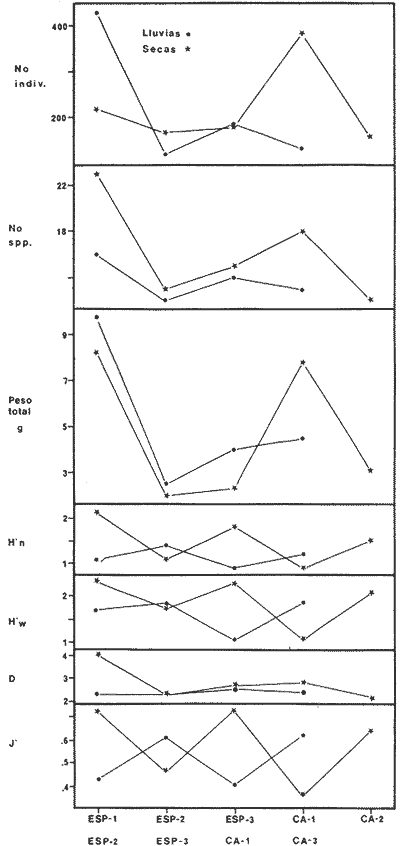 Fig. 4. Relación y variación temporal entre la diversidad, abundancia, temperatura y salinidad para las épocas de lluvias y secas; en Estero Pargo y Bajos del Cayo.  Fig. 15. Distribución y abundancia de: Synodus foetens en la Sonda de Campeche. Crucero OPLAC-1, verano de 1978. 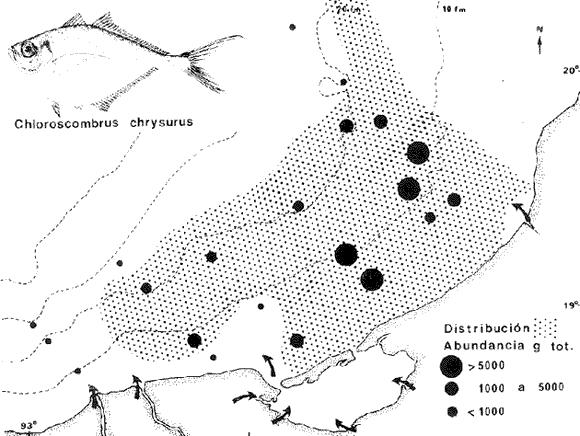 Fig. 16. Distribución y abundancia de: Chloroscombrus chrysurus en la Sonda de Campeche. Crucero OPLAC-1, verano de 1978. 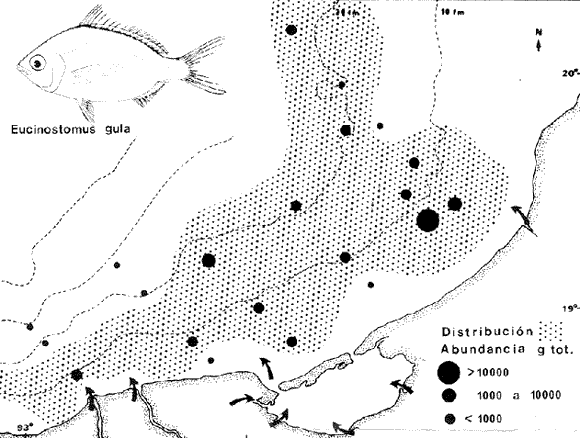 Fig. 17. Distribución y abundancia de: Eucinostomus gula en la Sonda de Campeche. Crucero OPLAC-1, verano de 1978. 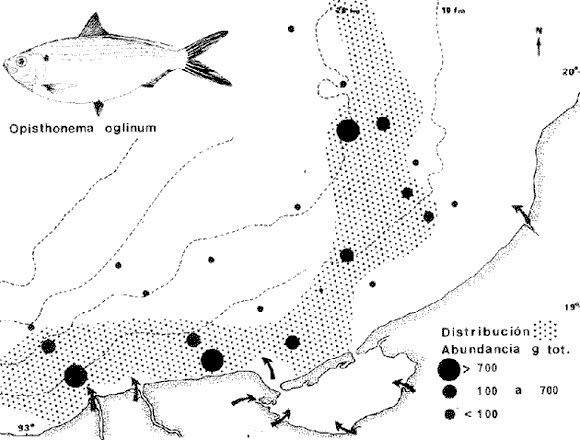 Fig. 18. Distribución y abundancia de: Ophisthonema oglinum en la Sonda de campeche. Crucero OPLAC-1, verano de 1978. 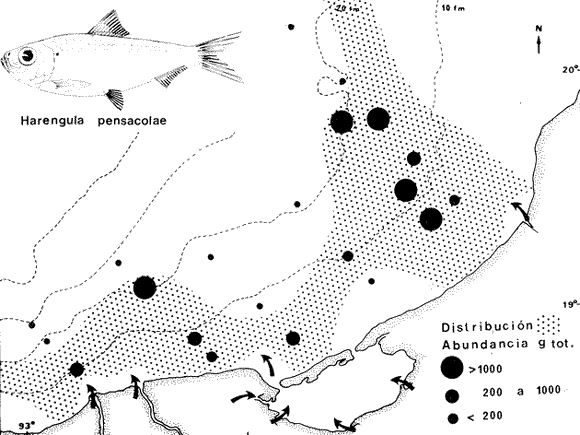 Fig. 19. Distribución y abundancia de: Harengula pensacolae en la Sonda de Campeche. Crucero OPLAC-1, verano de 1978. 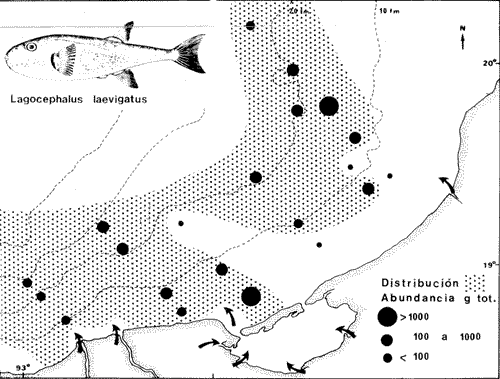 Fig. 20. Distribución y abundancia de: Lagocephalus laevigatus en la Sonda de campeche. Crucero OPLAC-1, verano de 1978. 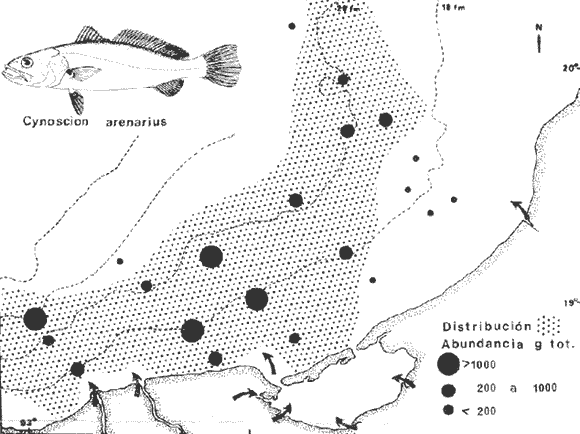 Fig. 21. Distribución y abundancia de: Cynoscion arenarius en la Sonda de Campeche. Crucero OPLAC-1, verano de 1978. 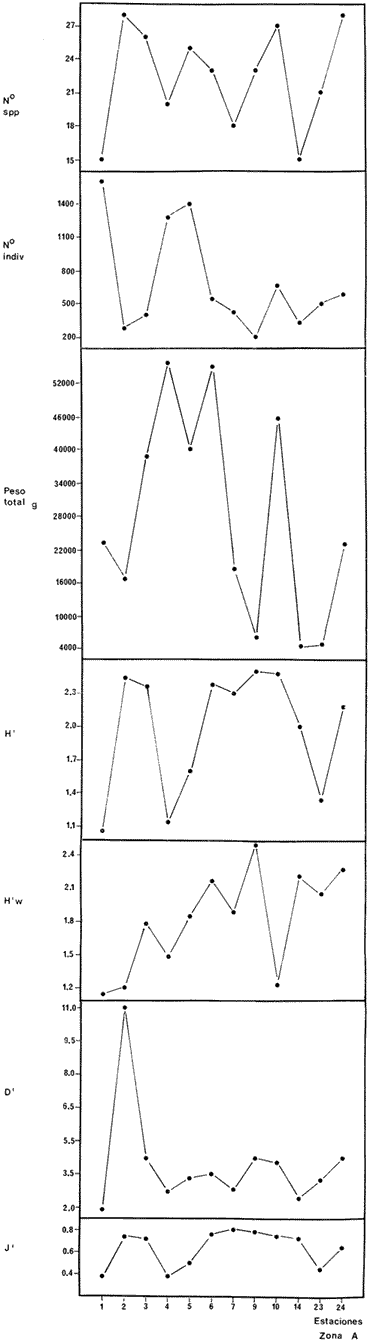 Fig. 22. Comparación entre la diversidad, densidad, biomasa y los índices respectivos de las estaciones que componen a la Zona A. 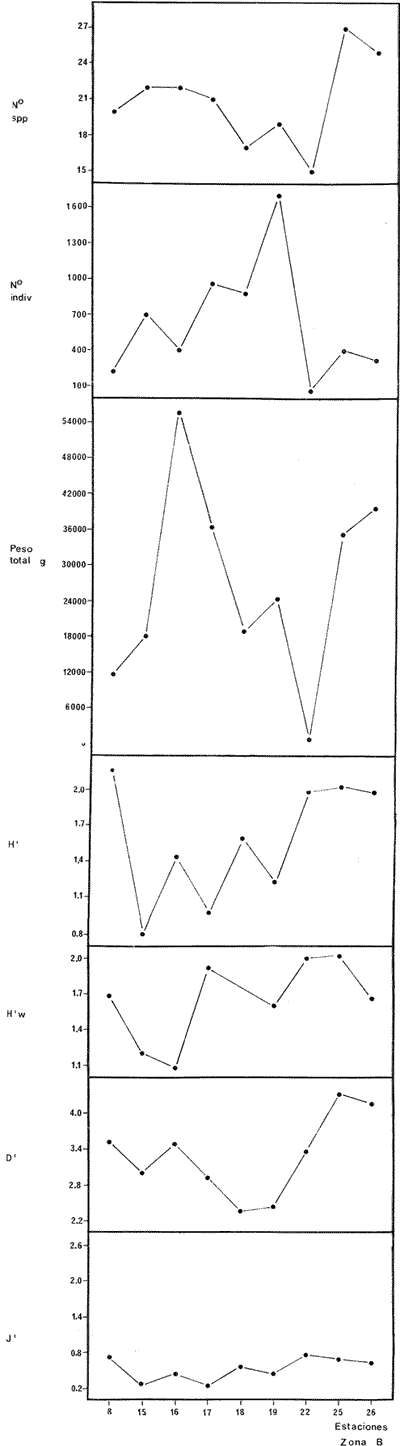 Fig. 23. Comparación entre la diversidad, densidad, biomasa y los índices respectivos de las estaciones que componen a la Zona B. 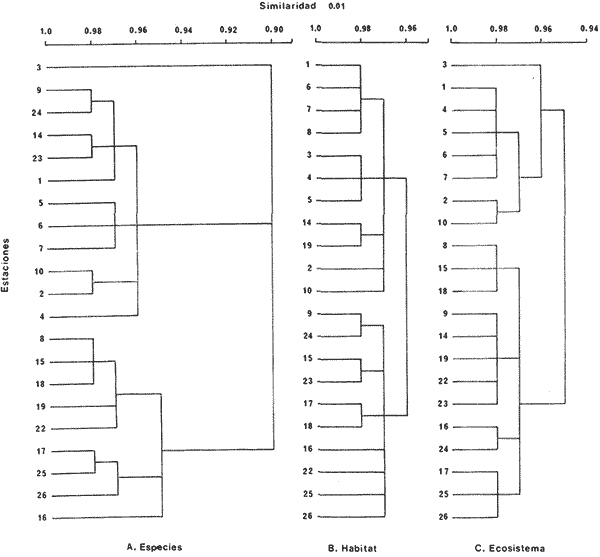 Fig. 24 Dendograma del agrupamiento de las estaciones de colecta. A= Basado en la composición de las especies y su abundancia numérica. B = Parámetros ambientales (Tabla 1). C = Suma ecológica der las características anteriores. El rango de similaridad es de 0 a 1, en pasos de significancia de 0.01. Se muestra la formación de dos zonas o grupos de estaciones generados con el análisis de "cluster".  Fig. 25. Diagrama Trellis. Se señala la relación porcentual de afinidad ecológica entre las estaciones de colecta, basada en la presencia y abundancia numérica de las especies. 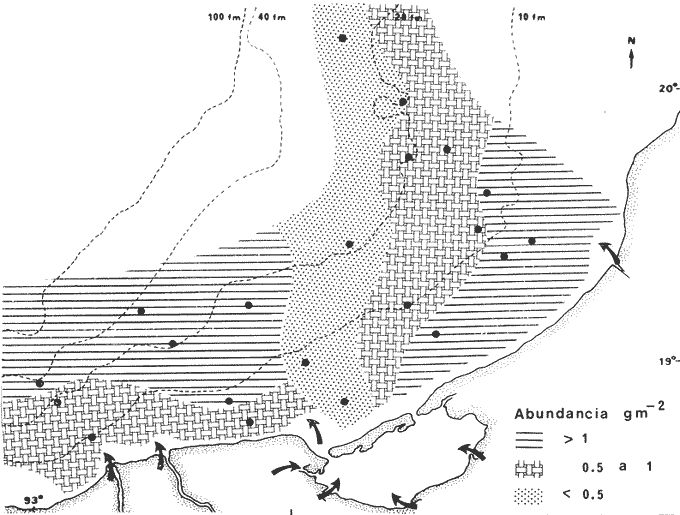 Fig. 26. Abundancia (g. m-2) de los peces demersales en el área de estudio. Se señalan la distribución del "standing crop" en dos gradientes definidos A y B El análisis estadístico para comparar diferencias entre ambas épocas (lluvias y secas) en términos de índices, no reveló diferencias significativas en ninguno de los casos mencionados. 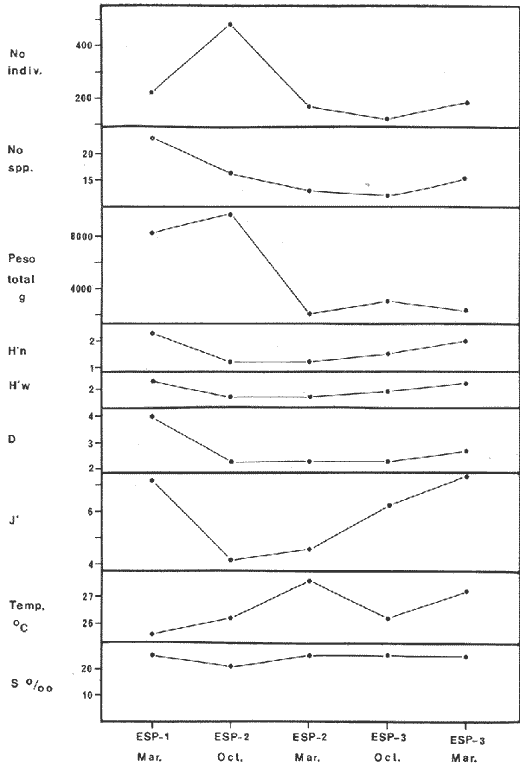 Fig. 5. Variacion temporal y relación entre la diversidad, abundancia, temperatura y salinidad de Estero Pargo. ABUNDANCIA Y ESPECIES DOMINANTESLa distribución y abundancia numérica de las especies se muestra en detalle para las épocas de lluvias y secas en las tablas 2 y 3, respectivamente. Para las dos épocas analizadas el número de individuos por colecta y el peso total de éstos fluctuó irregularmente (Fig. 4). Sin embargo se aprecia una mayor riqueza de especies para todas las colectas de la época de secas en relación a la de lluvias. El mayor número de especies registrado fue de 25 en la estación ESP-1 Marzo (Fig. 5). Analizando por áreas, el número total de individuos fue de 1126 y 821 para las colectas totales de Estero Pargo y Bajos del Cayo respectivamente (Figs. 5 y 6). Por lo que se refiere a biomasa, densidad y especies dominantes: en lluvias la biomasa tuvo un rango de 0.08 a 5.86 con un promedio de 2.28 g.m-² La densidad fluctuó entre 0.046 y 1.77 con un promedio de 0.53 indiv.m-². En lluvias las especies dominantes fueron: Eucinostomus gula (389 individuos, 100% de frecuencia); Archosargus rhomboidalis (296 individuos, 89% frec.); Bairdiella chrysura (35 individuos, 67% de frec.) Arius felis (16 individuos, 100% frec.) ySphoeroides testudineus. (9 individuos, 100% frec.). Por lo que se refiere a estas dos últimas especies, aunque presentan pocos individuos, se consideran dominantes por la frecuencia que presentan (100%). Además se han reportado en estudios previos como especies muy frecuentes así como abundantes (Yáñez-Arancibia et al. 1980). Para la época de secas la biomasa varió de 1.84 a 9.88 con un promedio de 4.1 g.m-². La densidad oscilo entre 0.14 y 0.26 con un promedio de 0.2 indiv. m-² . Las especies dominantes para esta época fueron: Eucinostomus gula (267 individuos, 100% de frecuencia); Diapterus rhombeus (169 individuos, 56% frec.); Archosagus rhomboidalis (139 individuos, 89% frec.); Bairdiella chrysura (135 individuos, 67% frec.); Cichlasoma urophthalmus (130 individuos, 45% frec.); Sphoeroides testudineus (53 individuos, 100% frec.) y Arius felis (35 individuos, 100% frec.) 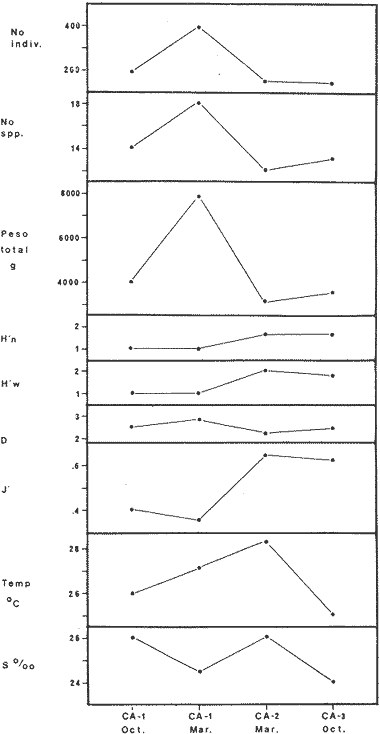 Fig. 6. Variación temporal y relación entre la diversidad, abundancia, temperatura y salinidad en Bajos del Cayo. Es importante aclarar que no se encontraron diferencias significativas por lo que se refiere a biomasa y densidad entre una y otra época climática. COMPONENTES COMUNITARIOSLa distribución de los componentes se muestra en la figura 7. En las tablas 2 y 3 se detalla el tipo de componente al que pertenece cada una de las especies encontradas para las épocas de estudio. Para lluvias la mayor parte de los individuos de la comunidad estuvo compuesta por visitantes cíclicos, con 16 especies (54%), le siguieron los visitantes ocasionales con 11 especies (35%); por último los peces sedentarios y/o típicamente estuarinos con 4 especies (13%). 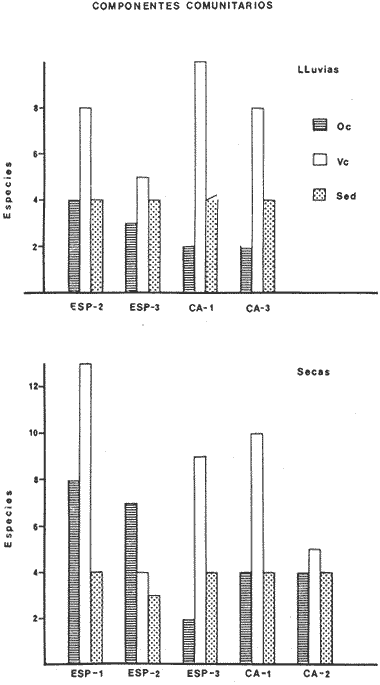 Fig. 7. Proporciones de los tres tipos de componentes comunitarios dentro de la estructura de las comunidades nectónicas en Estero Pargo y Bajos del Cayo. Época de secas Marzo 1977. Época de lluvias Octubre-1976. Oc = Visitantes ocasionales; Vc = Visitantes cíclicos; Sed = Sedentarios o típicamente estuarinos, Para la época de secas predominaron los visitantes ocasionales: 20 especies (49%), en orden decreciente los visitantes cíclicos, con 17 especies (11%) y los sedentarios con 4 especies (10%). En términos generales considerando todas las colectas en el área de estudio, los componentes predominantes fueron los visitantes ocasionales con 26 especies (54%) en orden decreciente las especies visitantes cíclicas con 18 especies (38%) y por último las especies sedentarias con 4 especies (8%). CATEGORÍAS ICTIOTRÓFICASLas categorías ictiotróficas se muestran en las tablas 2 y 3 para lluvias y secas respectivamente. Para época de lluvias, las especies quedaron agrupadas de la siguiente manera: consumidores de segundo orden 15 especies (37.5%); siendo éstos los predominantes para la época citada, consumidores de tercer orden 8 especies (20%). Algunas especies pueden cambiar de primero a segundo orden o bien de segundo a tercero, dependiendo de la disponibilidad de alimento y edad, lo cual explica que se hayan encontrado 5 especies (12.5%) que se comportan como consumidores de segundo o tercer orden, y una especie (2.5%) que se comporta como consumidor de primero o segundo orden. En la figura 8 se muestra esquemáticamente la distribución de las especies por categorías en las diferentes localidades, para su elaboración, las especies que se comportaron como consumidores de primero o segundo orden quedaron agrupadas en ambas categorías lo mismo para las especies que funcionaron como consumidores de segundo o tercer orden. Para la época de secas los resultados son los siguientes: consumidores de primer orden 8 especies (27%); consumidores de primero o segundo orden 1 especie (3%); de segundo orden 12 especies (40 %); de segundo o tercer orden 4 especies (13%), por último de tercer orden 5 especies (17%). Las diferentes proporciones se muestran en la figura 8. 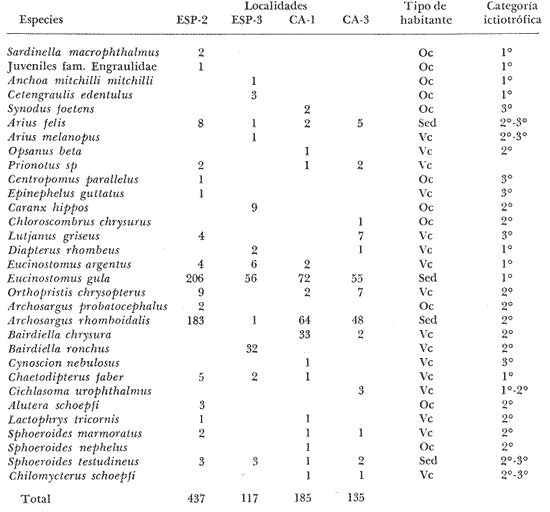 TABLA 2 DISTRIBUCIÓN, ABUNDANCIA NUMÉRICA, TIPOS DE COMPONENTES Y CATEGORÍAS ICTIOTRÓFICAS PARA LA EPOCA DE LLUVIAS. Las localidades se muestran en la figura 2. Ocespecies visitantes ocasionales o accidentales. Cv especies visitantes cíclicos. Sed sedentarios y/o típicamente estuarinos. lº, 2º y 3º consumidores de primero, segundo y tercer orden respectivamente. RELACIONES LONGITUD-PESO DE LAS ESPECIES DOMINANTESSe encontró que la relación longitud-peso se pudo estimar en todos los casos de las especies dominantes con el modelo de la forma P = a. L b donde P = peso, L = longitud total, a y b son las constantes a determinar, siendo a = eα y b = β, e = base de los logaritmos naturales. Los valores de α y βse presentan a continuación, fueron determinados (estimados) en aquellas especies dominantes, donde el número de individuos fue lo suficientemente grande, para ajustar sus longitudes y pesos correspondientes como puntos de una recta de regresión. A continuación se muestran los valores obtenidos para las constantes y rangos de tallas (longitud total) en milímetros de las especies dominantes. 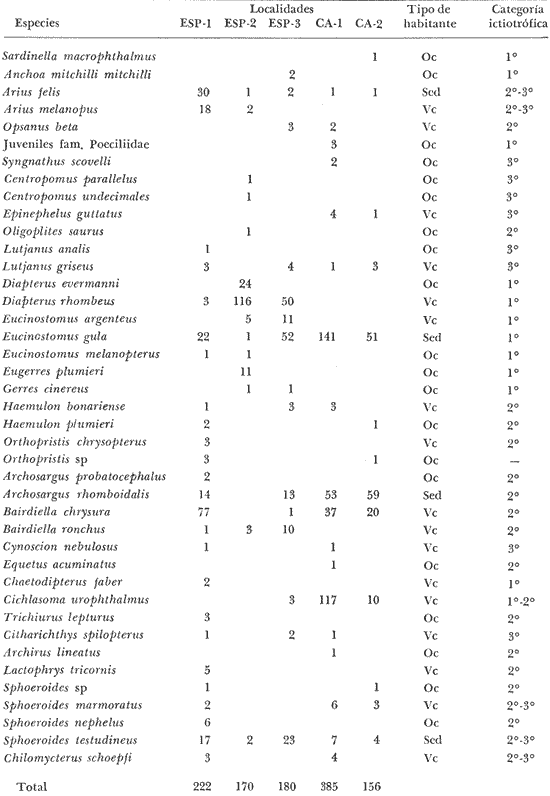 TABLA 3 DISTRIBUCIÓN, ABUNDANCIA NUMÉRICA, TIPOS DE COMPONENTES Y CATEGORÍAS ICTIOTRÓFICAS PARA LA ÉPOCA DE SECAS Las localidades se muestran en la figura 2. Oc especies visitantes ocasionales o accidentales. Cv especies visitantes cíclicos. Sed sedentarios y/o típicamente estuarinos. 1º 2º y 3º consumidores de primero, segundo y tercer orden respectivamente. 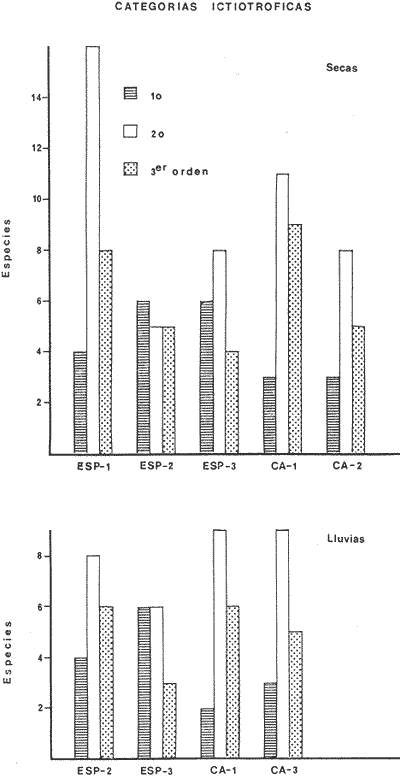 Fig. 8. Proporciones entre las tres categorías ictiotróficas dentro de la estructura de las comunidades nectónicas en Estero Pargo y Bajos del Cayo. Época de secas Marzo-1977. Época de lluvias Octubre-1976. 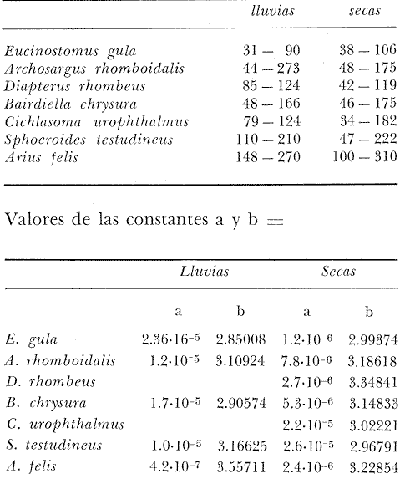 Para un mayor detalle se presentan las rectas de regresión longitud-peso en las figuras 9 a 20. SIMILARIDAD Y ANÁLISIS "CLUSTER"La similitud faunística de las estaciones resultó ser muy alta para todas las combinaciones. La figura 21 muestra un agrama de enreja o Trellis con las similaridades de todas las estaciones entre sí (los valores están redondeados). El menor valor de similaridad observado fue de 0.46 = 50% de similaridad entre las estaciones ESP-1 y ESP-2 de la época de secas; la mayor similaridad con 0.79 = 80% se observó entre CA-2 secas y CA-2 lluvias. De aquí que el dendograma de presencia/ausencia de especies sea bastante homogéneo (Fig. 22), en el cual el grupo mayor, es decir, aquel que reunió todas las estaciones, se formó a un nivel de 0.64 de similitud = 60%. Por lo que respecta al "cluster" de estaciones considerando las abundancias relativas de las especies, resultó aún más homogéneo, el nivel de similitud que reunió todas las estaciones fue de 0.86 (Fig. 22). 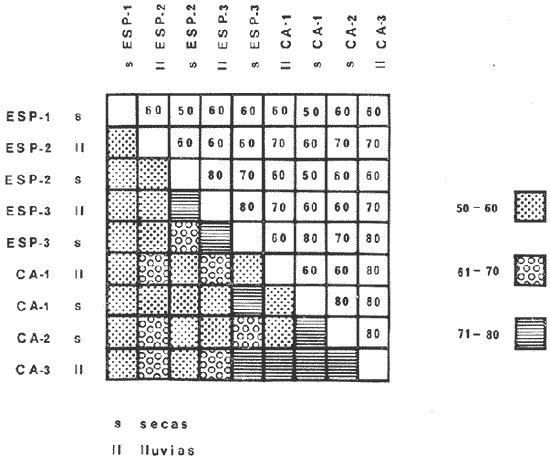 Fig. 21. Diagrama Trellis mostrando la similaridad porcentual entre las diferentes estaciones de colecta. 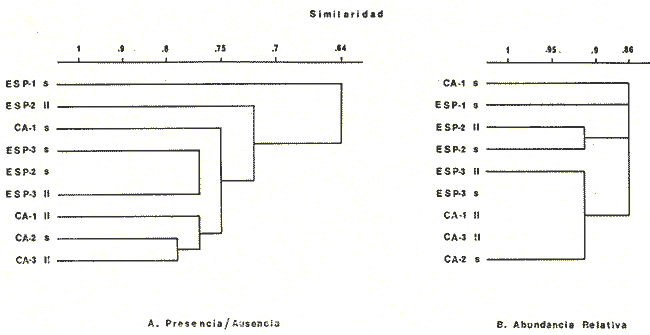 Fig. 22. Dendrograma de agrupamiento de las distintas localidades. A. Basado en presencia/ausencia de las especies. B. Basado en sus abundancias relativas. DISCUSION Y CONCLUSIONESLos datos climáticos presentados muestran variaciones estacionales relacionadas con dos épocas meteorológicas diferentes; sin embargo dichas variaciones no son notables ni marcan diferencias significativas para la salinidad, temperatura, tipo de sustrato y corrientes (Tabla I). No obstante que no se cuantificó el oxígeno, es claro que no actúa como factor limitante, puesto que la circulación, la poca profundidad de la zona de estudio (al menos en las estaciones de muestreo) y los productores primarios, permiten una oxigenación continua, además que en los estuarios los valores letales de oxígeno para los peces, son menores de 1.8 ml/l (Muss, 1967). Los resultados muestran que el sustrato es el mismo durante las dos épocas estudiadas y presumiblemente permanece constante todo el año (Tabla I); con esto y lo ya expuesto puede concluirse que la zona de estudio posee características ambientales más o menos estables a lo largo de dos épocas diferentes del año. Dicha estabilidad en términos de sustrato tiene mucho que ver con la vegetación preponderante y con la química de los sedimentos y el agua. Es importante observar que no existe un mayor número de individuos para una y otra época, a diferencia de lo que reportan para otras latitudes Springer y McErlean (1962) en Matecumbe, Florida, cuyos registros más abundantes son en verano y otoño. Por otro lado es parecido a lo reportado por Subrahmanyam y Drake (1975) que no asocian la presencia de un mayor número de individuos a una estación particular del año. La presencia de un gran número de Juveniles en ambas épocas, parece estar asociada con el reclutamiento de los mismos y no con variaciones de salinidad o temperatura, como reportan Gunter (1961) y Moore (1958); ellos suponen que las fluctuaciones en dichos parámetros influyen positivamente en la reproducción, quizá esto último, sí suceda en otras zonas de la laguna, donde las salinidades y temperatura tienen mayores fluctuaciones, o bien en la plataforma adyacente. No obstante la heterogeneidad de la fauna, puede concluirse que la comunidad tiene un grupo de especies que se hayan presentes todo el año, representado principalmente por cuatro especies sedentarias o típicamente estuarinas que son:Eucinostomus gula., Archosargus rhomboidalis, Sphoeroides testudineus, Arius felis y tres especies visitantes cíciclas que son:Diapterus rhombeus, Bairdiella chrysura yCichlasoma urophthalmus. Otros trabajos como los de Dahlberg y Odum. (1970), Harima y Mundy (1974), Allen y Borra (1975), Subrahmanyam y Drake (1975) y Yáñez-Arancibia (1978c) muestran que la abundancia y dominancia de algunas pocas especies de peces, puede ser común en la estructura de comunidades de lagunas costeras; observación también encontrada en este trabajo. Por lo que se refiere a la biomasa, existen casos donde es inversa al índice de biomasa (H'w) esto se debe a que la distribución por pesos es muy desigual especialmente en el caso de CA-1 secas donde grandes ejemplares de las especies Archosargus rhomboidalis, Epinephelus guttatus yCichlasoma urophthalmus hacen aumentar significativamente el peso total. La riqueza de especies tiene un rango de fluctuaciones estrecho, siendo ligeramente menor para la época de lluvias, lo que se ve claramente reflejado en el índice de Margalef (D), que toma valores menores para esta época, de aquí que si este componente de la diversidad tiene un rango de fluctuaciones estrecho, en realidad lo que está haciendo variar la diversidad, son los otros componentes de la misma, el peso de los individuos, como ya se vio, además de la distribución cuantitativa de los individuos por especies. En relación a esto último, la tendencia general es que el número de individuos es proporcional al peso para las dos épocas, pero esta tendencia es ve interrumpida para lluvias (en CA-3) donde la especie Archosargus rhomboidalis tiene ejemplares muy grandes, lo mismo sucede para secas en ESP-1 dondeSphoeroides testudineus y Archosargus probatocephalus tienen gran influencia en el aumento del peso total. Eso significa que para una interpretación de eficiencia ecológica, lo más conveniente sería utilizar una pirámide con unidades de energía y no de biomasa o números, lo cual se hace evidente por la desigual distribución de los individuos. 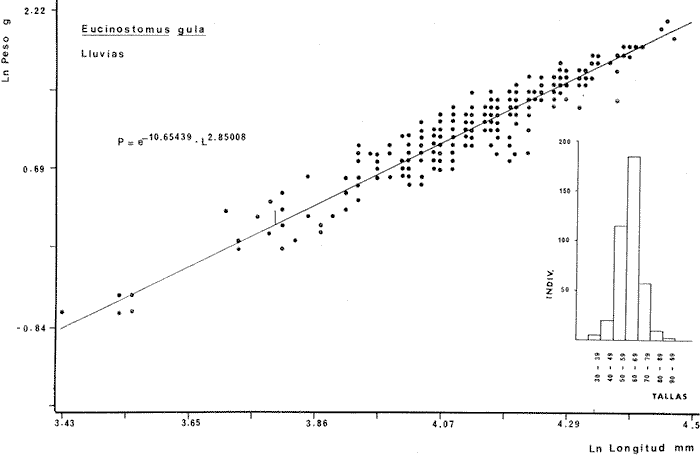 Fig. 9 Recta de regresión de la relación longitud-peso de Eucinostomus gula. Se señala la distribución de frecuencias de tallas. Época de lluvias. 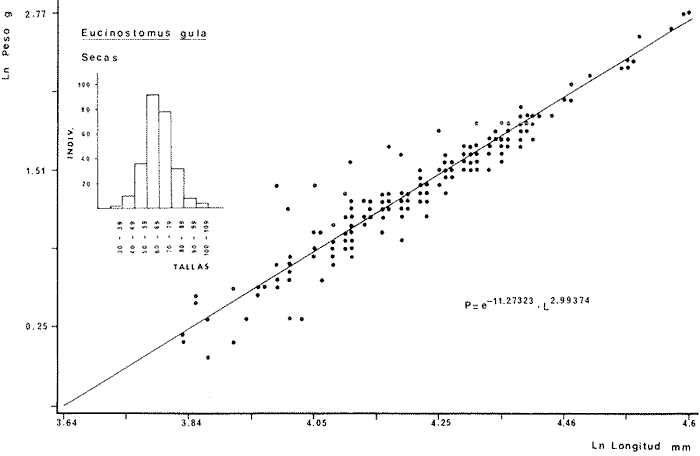 Fig 10. Recta de regresión de la relación longitud-peso de Eucinostomus gula. Se señala la distribución de frecuencias de tallas de la población. Época de secas. 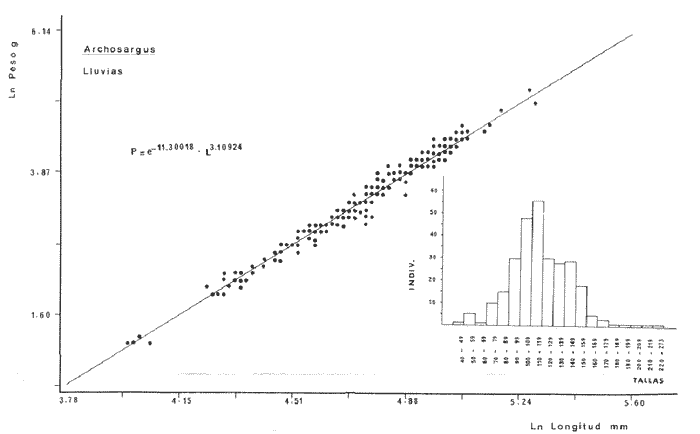 Fig. 11. Recta de regresión de la realción longitud-peso de Archosargus rhomboidalis. Se señala la distribución de frecuencias de tallas de la población. Época de lluvias. 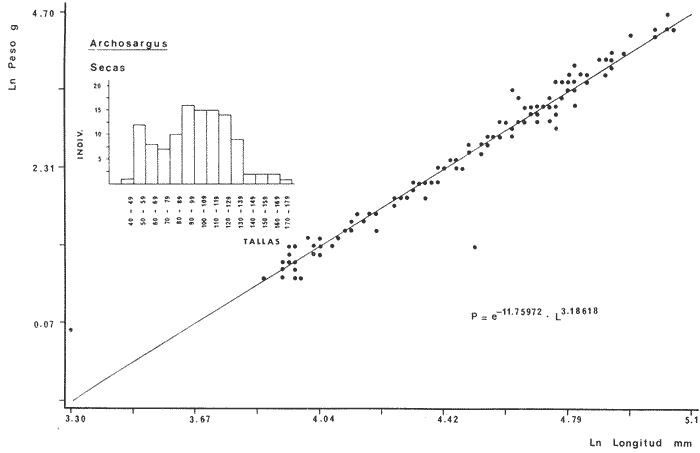 fig. 12. Recta de regresión de la relación longitud-peso de Archosargus rhomboidalis. Se señala la distribución de frecuencias de tallas de la población. Época de secas. 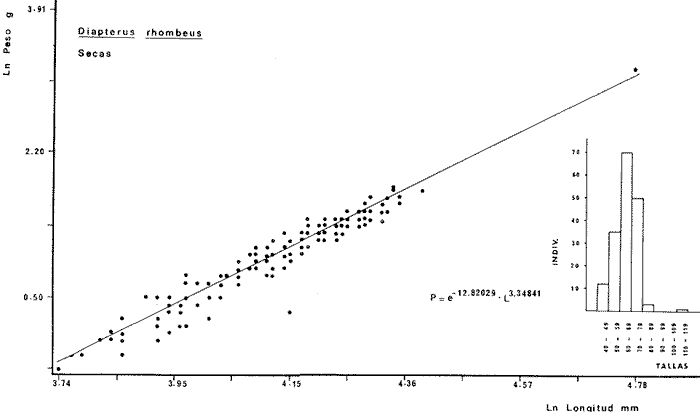 Fig. 13. Recta de regresión de la relación longitud-peso de Diapterus rhombeus. Se señala la distribución de frecuencias de tallas de la población. Época de secas. 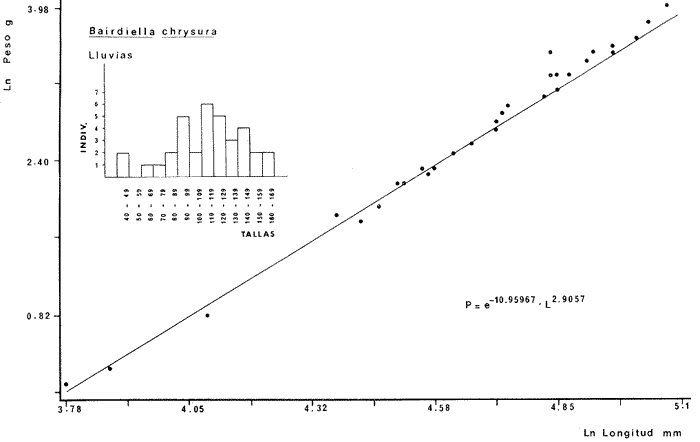 Fig. 14. Recta de regresión de la relación longitud-peso de Bairdiella chrysura. Se señala la distribución de frecuencias de tallas de la población. Época de lluvias. 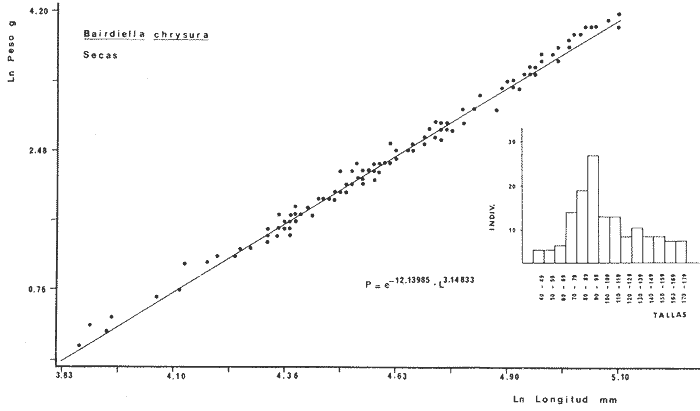 Fig. 15. Recta de regresión de la relación longitud-peso de bairdiella chrysura. Se señala la distribución de frecuencias de tallas de la población. Época de secas. 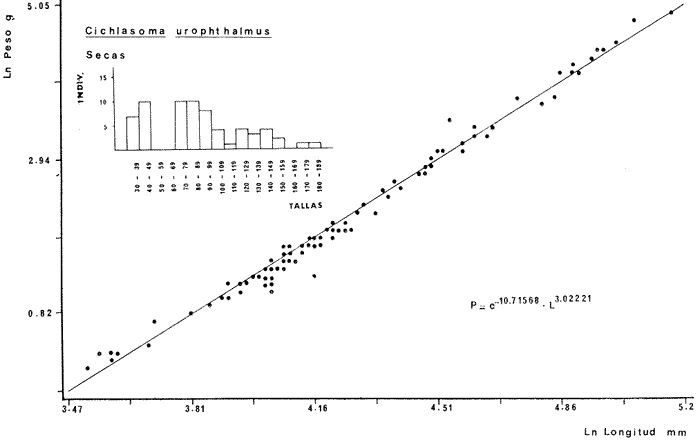 Fig. 16. Recta de regresión de la relación longitud-peso de Cichlasoma urophthalmus. Se señala la distribución de frecuencias de tallas de al población. Época de secas. 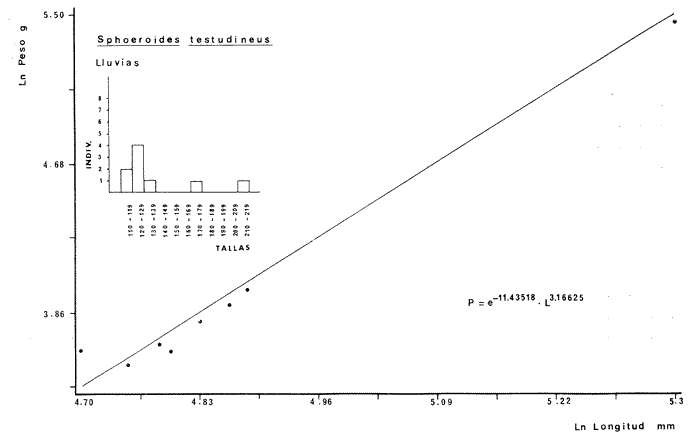 Fig. 17. Recta de regresión de la relación longitud-peso de Sphoeroides testudineus. Se señala la destribución de frecuencias de tallas de la población. Época de lluvias. 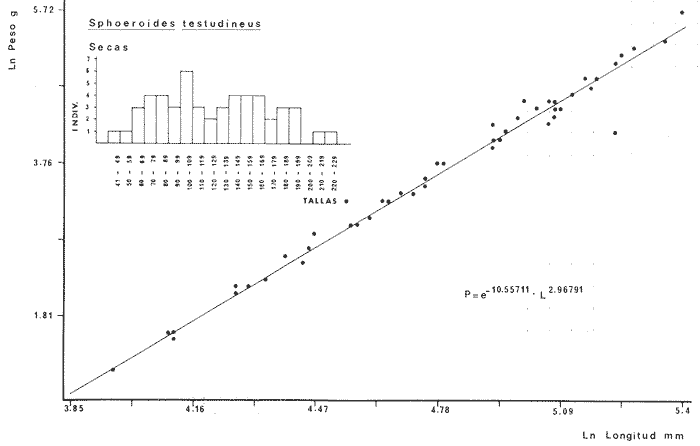 Fig. 18. Recta de regresión de la relación longitud-peso de Sphoeroides testudineus. Se señala la distribuación de frecuencias de tallas de la población. Época de secas. 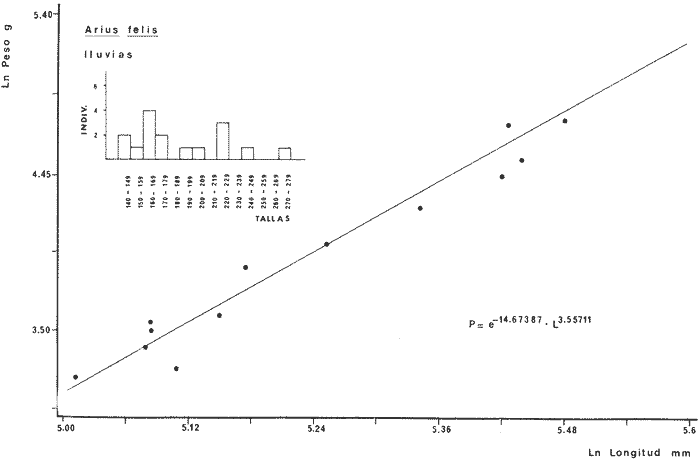 Fig. 19. Recta de regresión de la relación longitud-peso de Arius felis. Se señala la distribución de frecuencias de tallas de la población. Época de lluvias. 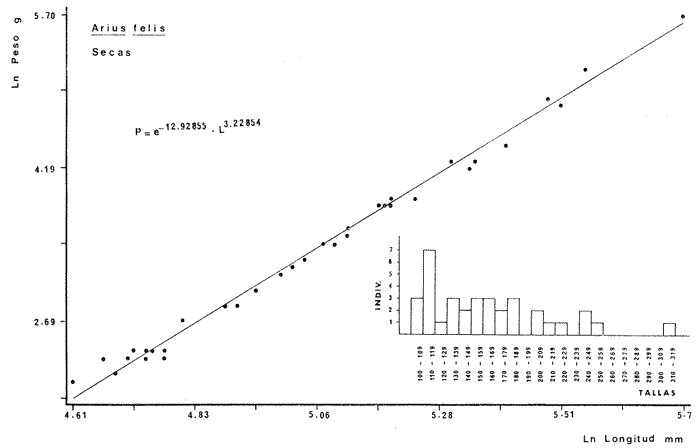 Fig. 20. Recta de regresión de la relación longitud-peso de Arius felis. Se señala la distribución de frecuencias de tallas de la población. Época de secas. La presencia de un mayor número de especies para la época de secas, implica el uso de estas zonas por un grupo adicional de especies, que aumenta el número de componentes típicos. Este grupo está formado en su mayoría por especies visitantes ocasionales, que son un 49% en total. Este hecho no debe confundirse con el predominio de especies visitantes cíclicas para la época de secas (como lo muestra la figura 8) ya que varias de las especies se repiten en las diferentes capturas, haciendo parecer que son las predominantes para esta época. Tomando aisladamente cualquiera de las dos épocas (secas o lluvias) las variaciones estacionales de H'n y de H'w siguen la misma tendencia, lo que implica que las relaciones entre peso y número permanecen constantes a lo largo del ciclo, aunque esto no implica que la distribución por pesos sea homogénea, como ya se discutió anteriormente. Las oscilaciones inversas de H'n para las capturas de lluvias con relación a la de secas, implica que el número de individuos como componente de la diversidad, está oscilando en la misma manera. Los valores de diversidad obtenidos para la ictiofauna están dentro del rango de variación observado para diferentes estuarios en condiciones normales, como se observa en la tabla 4. No existen variaciones entre una y otra época para categorías ictiotróficas, la preponderancia de consumidores de segundo orden confirma una alta disponibilidad de macrofauna todo el año, apoyada por la estabilidad del sustrato, corrientes, temperatura y salinidad. De no ser así, los peces modificarían su comportamiento alimenticio a lo largo del año y habría un gran porcentaje de especies cambiando de primero a segundo orden o bien de segundo a tercero (que en realidad forman un porcentaje mínimo). Otra evidencia sería que los tipos de especies variarían mucho a lo largo del año, lo que se ha visto que no sucede, ya que las especies dominantes son las mismas para dos épocas climáticas marcadas, además la afinidad de las zonas es muy alta en términos de su ictiofauna. 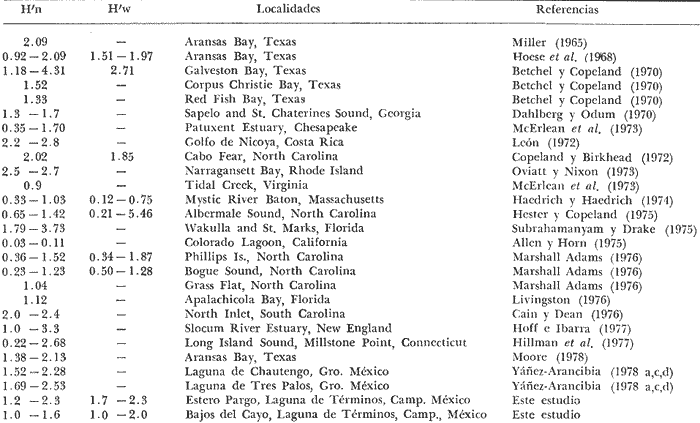 TABLA 4 VALORES DE DIVERSIDAD DE COMUNIDADES DE PECES EN SISTEMAS ESTUARINOS DE CENTRO Y NORTEAMÉRICA Es interesante que el modelo ajustado en este trabajo, siendo el mismo planteado por diferentes autores (Ricker, 1975; Weatherley, 1972), para la regresión longitud-peso, dio excelentes resultados usando base e en lugar de la acostumbrada 10 con una alta confiabilidad de ajuste (p=0.01). En este caso es correcto hablar de relaciones alométricas por haberse obtenido valores de b (β) desde 2.8 hasta 3.5. En realidad volviendo a la conclusión mencionada, las diferencias obtenidas para esta constante, con cada una de las especies para la época de lluvias con respecto a la de secas, seguramente se deben a diferencias de la relación alométrica, porque como ya se explicó, se están muestreando poblaciones que en términos generales son las mismas a lo largo de un ciclo anual. Las diferencias reflejan cambios de la relación alométrica que van mostrando los individuos a medida que crecen. Cabe decir que el crecimiento alométrico está influenciado por la época del año, por la disponibilidad de alimento, así como la época reproductiva (Ricker, 1975). Por lo que respecta a las especies dominantes, Eucinostomus gula se encuentra representado por tallas pequeñas todo el año y por tallas grandes en menor porcentaje; esta presencia de juveniles sugiere una alta fecundidad y la evidencia de que utilizan la zona interior de la laguna como área de crianza. Es muy probable que el desove se efectúe en la Sonda, muy cerca de la Boca de Puerto Real, ya que Flores-Coto y Álvarez-Cadena (1980) reportan gran abundancia de larvas cerca de las bocas, de la especieEucinostomus sp. Es razonable suponer que las larvas aludidas correspondan a Eucinostomus gula. Esta especie es residente permanente de la zona de estudio, como lo denotan su abundancia y frecuencia. Springer y McErlean (1962) la reportan para los Cayos de Matecumbe, Florida, durante un ciclo anual y siempre en un rango de tallas pequeñas. La ausencia de ejemplares de talla grande como la reportada por Cervigón (1966) de 227 mm, Fisher (1978) de 180 mm, y otros, refuerza la observación de que la especie migra para desovar en la zona nerítica. Reid (1954) reporta que esta especie prefiere aguas abiertas. Otro gérrido, Diapterus rhombeus, se registró abundantemente durante la época de secas, su poca representatividad en lluvias sugiere que el desove lo realiza por lo menos antes de octubre, además en secas se encuentran juveniles. Cervigón (1966) reporta longitudes totales máximas de 400 mm siendo 110 mm la mayor reportada en este estudio. Sphoeroides testudineus es otra especie que utiliza zonas protegidas como áreas de crianza, presumiblemente en la época de secas; además por su gran frecuencia y abundancia Flores-Coto y Álvarez-Cadena (1980) la consideran típicamente lagunar. Hay reportes previos de que Bairdiella chrysura se dirige en verano a los estuarios para alimentación y crianza (Fisher, 1978). Sin embargo su registro en el mismo rango de tallas para las dos épocas de estudio sugiere que, si existe migración, ésta debe ser de juveniles pero en dos épocas del año. Flores-Coto y Alvarez-Cadena (1980) la consideran típicamente lagunar. Archosargus unimaculatus alcanza mayores tallas en la época de lluvias, probablemente su desove sea antes de la época de secas, ya que en ésta se registraron los ejemplares más pequeños. Cichlasoma urophthalmus se registró en un amplio rango de tallas, es una especie eurihalina, ya que pertenece a una familia típicamente dulceacuícola (Toral y Reséndez, 1974). La gran abundancia de ejemplares registrada en este estudio durante la época de secas, hace pensar que esta especie eurihalina puede utilizar zonas protegidas para completar un estado de su ciclo de vida. La especie realiza migraciones dentro de la laguna. Por lo que respecta a los análisis "cluster" efectuados, puede afirmarse que el interior de la Isla del Carmen, constituye un mismo habitat que se está reflejando en una ictiofauna homogénea, que es la misma espacial y temporalmente, esto es, en dos épocas del año que no son marcadamente diferentes desde el punto de vista ambiental, pero sí climáticamente, ya que existen dos épocas meteorológicas definidas, las épocas de lluvias y de secas. El registro de altos niveles de similaridad refuerza y cuantifica esta aseveración (Fig. 22). AgradecimientosLos autores expresan su agradecimiento a las siguientes personas: Agustín Ayala-Castañares, Antonio García-Cubas, José Luis Rojas Galaviz y Alfredo Laguarda Figueras del Instituto de Ciencias del Mar y Limnología (UNAM), la cuidadosa revisión crítica del manuscrito, haciendo valiosos comentarios y sugerencias. A, C. B. Subrahmanyam de Florida A&M University, Tallahassee, y John W. Day de Louisiana State University, Baton Rouge, sus comentarios y discusión de los resultados. A los compañeros del laboratorio de Ictiología y Ecología Estuarina, especialmente a Ana Láura Lara, Patricia Sánchez y Arturo Aguirre, por su ayuda en diferentes etapas del trabajo. A Arturo Gamietea, Rubén Chávez y Gilberto Montelongo su colaboración en el procesamiento de datos y ayuda en los programas de computación. Este trabajo fue apoyado institucionalmente y financiado por el Instituto de Ciencias del Mar y Limnología de la UNAM y el aporte parcial del Programa Regional de Desarrollo Científico y Tecnológico de la Organización de los Estados Americanos (OEA) a través de su Oficina de Proyectos Especiales en Washington. LITERATURAÁLVAREZ DEL VILLAR, J., Peces Mexicanos (Claves). Inst. Nal. Inv. Biol. Pesq., Com. Nal. Consult. Pes., 1970.166 p., 62. figs. ALLEN, L G. M. H. HORN, Abundance, diversity and seasonality of fishes in Colorado Lagoon, Alamitos Bay, California. Estuar. Coast. mar. Sci.,1975.371-380. 3: AMEZCUA-LINARES, F. A. YÁREZ-ARANCIBIA, An.Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, Ecología de los sistemas fluvio-lagunares asociados a Laguna de Términos. El habitat y estructura de las comunidades de peces.1980.69-118.7 (1): AYALA-CASTANARES, A., Bol. Inst. Geol. Univ. Nal. Autón. México, Sistemática y distribución de los foraminíferos recientes de la Laguna de Términos, Campeche, México.1963. 1-130.67 (3): BECHTEL, T. J. B. J. COPELAND, Fish species diversity indices as indicators of pollution in Galveston Bay, Texas. Publ. Inst. Mar. Sci. Univ. Texas, 1970. 103-132. 15: BRAVO-NÚÑEZ, E. A. YÁÑEZ-ARANCIBIA, An.Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México,Ecología de la Boca de Puerto Real, Laguna de Términos. 1. Descripción del área y análisis estructural de las comunidades de peces. 1979.125-182.6 (1): BOTELLO, A. V E. F. MANDELLI, Final Tech. Report Project-GU 853, A study of variables related to the water quality of Terminos Lagoon and adjacent coastal arcas, Campeche, México. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México (Informe mimeografeado) 1975. 92 p., 25 tabl. CAIN, R. L. J. M. DEAN, Annual occurrences, abundance and diversity of fish in a South Carolina intertidal creek. Mar. Biol., 1976. 369-379. 36: CARVAJAL, R. L., Condiciones ambientales y productividad de la Laguna de Términos, Campeche, México. Lagena,1973.35-38. 31: CASO, M. E., Los equinodermos (Ophiuroidea, Echinoidea, Asteroidea) de la Laguna de Términos, Campeche. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, Publ. Esp. 1980. 1-200.3: CERVIGON, M. F., Los Peces Marinos de Venezuela. Estación de Investigaciones Marinas de Margarita, Fundación La Salle de Ciencias Naturales, Monogr. 11 y 12:Caracas,1966. 961 p. CHÁVEZ, E. A., An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, Análisis de la comunidad de una laguna costera de la costa Sur Occidental de México. 1979.6 (2). CHÁVEZ, E. A. B. ANGUAS-VÉLEZ, F. ARREGUÍN-SÁNCHEZ SÁNCHEZ CHÁVEZ Prospección ecológica de la laguna de Mandinga, Veracruz. Mem. I. Reunión Lat. Cienc. Tecnol. Ocean. (México):1976.140-162. COLL DE HURTADO, A., El sureste de Campeche y sus recursos naturales. Serie Cuadernos, Inst. Geogr. Univ. Nal. Autón. México.1975. 85 p. COPELAND, B. J. W. S. BIRKHEAD, Some ecological studies of the lower Cape Fear River estuary, ocean out fall and Dutchman Greek, First Annual Report to Carolina Power and Hight Co., Raleigh, N. C., 1972.1-105. 71:1971. DAHLBERG, D. M E. P. ODUM, Annual cycles of species occurrence, abundance and diversity in Geor gia estuarine fish populations. Amer. Midl. Natur., 1970. 382-392.83 (2): DANIELS, K., Third Coastal Marsh and Estuary Management Symposium. Habitat designation based on cluster analysis of Ichthyofauna. Proc. In: Day Jr., J. W., D. D. Culley, R. E. Turner y A. J. Murphrey (Eds.). Louisiana State University Division of Counting Education, Baton Rouge, La.: 1979. 317-324. DAVIES, R. G., Computer Programming in Quantitative Biology. Academic Press. London: 420-430.1971. D'CROZ, L. J. B. DEL ROSARIO C. CHANG Y DE YEE, In: Mem. II Simposio Latinoamericano sobre Oceanografía Biológica, Ecología de las praderas de Thalassia en la costa atlántica de Panamá. Publ. Univ. Oriente Venezuela.Cumaná Venezuela.1977. Nov. 24-28, 1975. DEN HARTOG, C., The Seagrasses of the World. Tweede Reeks, Deel 59 No. 1 North-Holland Publishing Company Amsterdam London, 1970. 273 p. EDWARDS, R. R. C., Production ecology of two Caribbean marine ecosystems. 11 Metabolism. and energy flow. Estuar. Coast. mar. Sci. 1973.319-333. 1: ESPINOZA, M. E., Tesis profesional. La fauna sésil intermareal del manglar relacionada con algunos parámetros ambientales de la Laguna de Términos Campeche. Fac. Ciencias. Univ. Nal. Autón. México, 1976. 48 p. FERGUSON-WOOD, E. J. W. E. ODUM J. C. ZIEMANN, Lagunas Costeras un Simposio. Influence of sea grasses on the productivity of coastal lagoons. In: Ayala-Castañares, A. y F. B. PHLEGER (Eds.) Mem. Simp. Intern. Lagunas costeras UNAM-UNESCO. México, D. F.1969.495-502. Nov. 28-30, 1967: FISHER, W., FAO Species identification sheets for fishery purposes. FISHER, W. (Ed.), FAO Western Central Atlantic (Fishing area 31). Roma,1978.1-7. FLORES-COTO,C. J. ÁLVAREZ-CADENA, An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, Estudios preliminares de distribución y abundancia del ictioplacton en la Laguna de Términos, Campeche.1980.67-68.7 (2): GARCÍA, E., Modificaciones al Sistema de Clasificación Climática de Koppen (para adaptarlo a las condiciones de la República Mexicana). Univ. Nal. Autón. México. Instituto de Geografía,1973. 246 p. GARCÍA, E.,Modificaciones al Sistema de Clasificación Climática de Koppen (para adaptarlo a las condiciones de la República Mexicana). Univ. Nal. Autón. México. Instituto de Geografía, 1973. 246 p. _____, Moluscos de un sistema lagunar estuarino del Sur del Golfo de México (Laguna de Términos, Campeche). Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, Publ. Esp. 5 (en prensa). 1980. GREENWOOD, P. H. D. E. ROSEN S. H. WEITZMANN G. S. MYERS, Bull. Amer. Mus. Nat. Hist., Phyletic studies of Teleostean fishes, with a provisional classification of living forms.1966. 339- 456. 131(4): GREENWOOD, P. H. G. S. MYERS D. E. ROSEN S. H. WEITZMAN, Named main divisions of teleostean fishes. Proc. Biol. Soc. Wash.,1967. 227-228. 80: GUNTER, G., Limnol. Oceanogr., Some relations of estuarine organism, to salinity. 1961.182-190. 6: GUTIÉRREZ - ESTRADA M. A., Tesis M. en C. Sedimentología del área de transición entre las provincias terrígena y carbonatada del Suroeste del Golfo de México. Fac. Ciencias Univ. Nal. Autón. México,1977. 175 p. HAEDRICH,, R. L. S. O. HAEDRICH, A seasonal survey of the fishes in the Mystic River, a polluted estuary in downtown Boston, Massachusetts.Estuar. Coast. mar. Sci., 1974. 59-73. 2: HARIMA, H P. R. MUNDY, Diversity indices applied to the fish biofacies of a small stream. Trans. Amer. Fish. Soc.,1974.457-461. 3: HEALD, E. J. W. E. ODUM D. C. TABB Environments of South Florida: Present and PastMangroves in the estuarine food chain. In: Gleason, P. J. (Ed.) Miami Geological Society, Mem.1974.182-189. (2): HEDGPETH, J. W. Treatise on Marine Ecology and Paleoecology. Estuaries and Lagoons. II. Biological aspects. In: Hedgpeth, J. W. (Ed.) Geol. Soc. America, Mem.1957.673-750.67, 1: HESTER, J. W. B. J. COPELAND, Nekton population dynamics in the Albermal Sound and Neuse River estuaries. University of North Carolina. Sea Grant Program Publ. UNC-SG Tech. Rep.1975. HILDEBRAND, S. F., Bull. Bingham Oceanogr. Coll., A review of the american anchovies (Family Engraulidae). 1943.1-165.8 (2): HILLMAN, R E. N. W. DAVIES J. WENNEMER, Abundance, diversity and stability in shore zone fish communities in an area of Long Island Sound affected by the termal discharge of Nuclear Power Station. Estuar. Coast. mar. Sci., 1977.355-381. 5: HOESE, H. D. B. J. COPELAND F. N. MOSELEY E. E. LANE, Fauna of Aransas pass inIet, Texas. III. Diel and seasonal variations in trawlable organisms of the adjacent area. Tex. J. Sci., 1968.33-60. 20: HOFF, G. J. R. M. IBARRA, Factors affecting the seasonal abundance, composition and diversity of fishes in a Southeastern New England Estuary. Estuar, Coast. mar. Sci., 1977.665-678. 5: HORN H. M. L. G. ALLEN, Bull. South. Cal. Acad. Sci., Numbers of species and faunal resemblace of marine fishes in California Bays and estuaries. 1976. 159-170.75 (2): HORNELAS, Y., Tesis profesional. Comparación de la biomasa y de algunos aspectos morfométricos de la fanerógama Thalassia testudinum, Köning, 1805, en tres diferentes áreas del Golfo de México. Fac. Ciencias Univ. Nal. Autón. México,1975. 54 p. IBARRA, M. R., Tesis M. en C. Col. Cienc. Examen preliminar de la fauna de crustáceos decápodos de la Laguna de Términos, Campeche, México: Distribución y Zoogeografía. Hum. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, 1979. 80 p. JORDAN, D. S. B. W. EVERMANN, Bull. U.S. Nat. Mus., The fishes of Norht and Middle America.1896-1900.1-3313.1-4 (47): JORDAN, E. M. ANGOT R. DI, LA TORRE An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, Prospección biológica de la Laguna de Nichupté Cancún, Q. Roo, México: Nota Científica.1978.179-188.5 (1): KIKUCHI, T., An ecological study on animal communities of the Zostera marina belt in Tomioka Bay, Amakusa, Kyushu. Publ. Amakusa Mar Biol. Lab.,1966. 106. 1: KUENZLER, E. J., Coastal Ecologycal Systems of the United States. Mangrove swarap systems. In: Odum, H. T., B. J. Copeland y E. A. McMahan (Eds.). The Conservations Foundations, Wash. D.C.,1974.346-371. 1: LANKFORD, R. R., Estuarine Processes. Circulation, Sediments and Transfer of Material in the Estuary. Coastal lagoons of Mexico: Their origin and classification. In: Cronin, L. E. (Ed.) Academic Press Inc. New York, 1977.182-215. 2: LEÓN, E. P., Rev. Biol. Trop., Ecología de la ictiofauna del Golfo de Nicoya, Costa Rica, un estuario tropical. 1972.5-30.21 (1): LEY LOU, F., Tesis profesíonal. Algunos factores ecológico abióticos en Estero Pargo, Campeche. México. Fac. Ciencias Univ. Nal. Autón. México,1979. 39 p. LIVINGSTON, J. R., Diurnal and seasonal fluctuations of organisms in a North Florida estuary. Estuar. Coast. mar. Sci., 1976.373-400. 4: LUGO, A. E. S. C. SNEDAKER, Ann. Rev. Ecol. Sist., The ecology of mangroves. 1974.39-64. 5: MACNAE, W., A general account of the fauna and flora of mangrove swamps and forest in the indowest-pacific region. Adv. mar. Biol.,1968.73-270. 6: MANN, K. H., Science., Their productivity and strategy for growth. 1979.975-981. 182: MARSHALL ADAMS, S., The ecology of eelgrass, Zoostera marina (L.) fish communities. I. Structural analysis. J. exp. mar. Biol. Ecol.,1976 269-291. 22: MACERLEAN, A. J. S. G. O'CONNOR J. A. MIHUSKY CR. I. GIBSON Abundance, diversity and seasonal patterns of estuarine fish populations. Estuar. Coast. mar. Sci.,1973.19-36. 1: MCROY, C.P., Seagrass ecosystems: Research recommendations of the International Seagrass Workshop. Inter. Decade Ocean Explor., 1973. 62 p. MCROY, C. P. C. HELFFERICH Seagrass Ecosystems. A Scientific Perspective. MCROY, C. P. y C. HELFFERICH (Eds.) UNESCO/UNDP. Marcel Dekker, Inc. New York,1977. 313 p. MANCILLA, M. M. VARGAS, An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, Los primeros estudios sobre flujo neto de agua a través de la Laguna de Términos, Campeche. 1980. 142.7 (2): MARGALEF, R., Perspecti ves in Ecological Theory. The University of Chicago Press. Chicago, Illinois,1968. 111 p. MARRÓN AGUILAR, M. A., Estudio cuantitativo y sistemático de los poliquetos (Annelida, Polychaeta) bentónicos de la Laguna de Términos, Campeche, México. Tesis doctoralFac. Ciencias Univ. Nal. Autón. México,1975. 143 p. MEEK, E. S. S. F. HILDEBRAND, The marine fishes of Panamá. Field Mus. Nat. Hist. Publ., Zool. Ser., 1923-1928.1-1045.15 (215, 226, 249): MILLER, J. M., A trawl survey of the shallow gulf fishes near Port Aransas, Texas. Publ. Inst. Mar. Sci. Univ. Texas, 1965.80-107. 10: MOORE, H. B., Marine Ecology. John Wiley and Sons, Inc., New York.1958. 493 p. MOORE, H. R., Variation in the diversity of summer estuarine fish populations in Aransas Bay, Texas, Estuar. Coast. mar. Sci., 1978.495-501. 6:1966-1973. MUSS, B. J., The fauna of Danish estuaries and lagoons. Meddelson foa Danmarks Fiskeri-og Havundessolgelsen. Ny Serie 1967.5: 1-316. NUÑEZ., M., Tesis profesional.Estudio taxonómico de las esponjas de la alguna de Términos, Campeche. México. Fac. Ciencias Univ. Nal. Autón. México,1978 95 p. ODUM, W. E. E. J. HEALD, Bull. Mar. Sci., Trophic analysis of an estuarine mangrove community.1972.671-738.22 (3): _____, Estuarine Research. Chemistry, Biology and the Estuarine System The detritus-based food web of an estuarine mangrove community. In: Croníng, E. L. (Ed.) Academic Press Inc. New York, 1975.265-286. 1: ODUM, W. E. J. C. ZIEMAN E. J. HEALD Proc. Coastal Marsh and Estuary Management Simposium. The importance of vascular plant detritus to estuaries. In: Chabrek (Ed.) Louisiana State University Baton Rouge, La, 1973.91-114. jul. 1972, OVIATT, A. C. S. W. NIXON The demersal fish of Narraganset Bay: An analysis of community structure, distribution and abundance. Estuar. Coast. mar. Sci., 1973.361-378. 1: PHLEGER, F. B. AYALA-CASTAÑARES, Bull. Am. Ass. Petrol. Geol., Processes and history of Terminos Lagoon, México.1971.2130-2140. 55 (2): PIELOU, E. C., J. Theoret. Biol., The measurement of diversity in different types of biological collections.1966.131-144. 13: REID, G. K., Bull. Mar. Sci., An ecological study of the Gulf of México fishes in the vacinity of Cedar Key, Florida. 1954.1-94. 4: RESÉNDEZ, A., An. Inst. Biol. Univ. Nal. Autón. México, Estudio de los peces de la Laguna de Tamiahua, Veracruz, México.Ser. Cienc. del Mar y Limnol., 1970. 79-146.11 (1): _____, Revta. Soc. mex. Hist. Nat., Estudio de los peces de la Laguna de Alvarado, Veracruz, México. 1973. 183-281. 31: RICKER, W. E., Bull. Fish. Research Board Canada,Computation and interpretation of biological statistics of fish populations. Department of Environment Fisheries and Marine Service. 1975.382 p. (191): ROLLET, B., FAO Programa de investigaciones y fomento pesqueros, México Ecología y reforestación de los manglares en México. FI:SF/MEX 15. Informe técnico 1974. 126 p., 34 fotografías. 6, SÁNCHEZ-GIL, P. A. YÁÑEZ-ARANCIBIA F. AMEZCUALINARESAn. Inst. Cienc. del Mar y Limnol. Univ. Nal. Autón. México Diversidad, distribución y abundancia de las especies y poblaciones de peces demersales de la Sonda de Campeche (verano 1978). 1981.209-240.8 (1): SHANNON, C. E. W. WEAVER The Mathematical Theory of Communication. University of Illinois Press. Urbana. 1963. 117 p. S.I.C., Catálogo de Peces Marinos Mexicanos. Secretaría de Industria y Comercio, Subsecretaría de Pesca, Instituto Nacional de Pesca, México, 1976. 462 p. SIGNORET, M., An. Inst. Biol. Univ. Nal. Autón. México. Ser. Zoología,Abundancia, tamaño y distribución de camarones (Crustacea, Peneidae) de la Laguna de Términos, Campeche, México y su relación con algunos factores hidrológicos. 1974.119.45 (1): SPRINGER, V. G. yA. J. McERLEAN Bull. Mar. Sci. Gulf Caribb, Seasonalíty of fishes on a south Florida shore.1962.39-60. 12 (1): SUBRAHMANYAM, C. B. S. H. DRAKE Bull. Mar. Sci., Studies on the animal communities in two north Florida salt marshes. Part I. Fish communities. 1975. 445-465.25 (4): THAYER, G. W. D. A. WOLFE R. B. WILLIAMSThe impact of man on seagrass systems.Am. Scientist,1975.228-296. 63: TORAL, S. A. RESÉNDEZ, Rev. Biol. Trop., Los ciclidos (Pisces: Perciformes) de la Laguna de Términos y sus afluentes.1974.259-279.21 (2): VARGAS, F. M., Tesis profesional. Las corrientes y el transporte neto de agua en la Laguna de Términos, Camp. Fac. Ingeniería Univ. Nal. Autón. México,1977. 94 p. VILLALOBOS, A. S. GÓMEZ V. ARENAS J. CABRERAG. DE LA LANZA F. MANRIQUE. An. Inst. Biol. Univ. Nal. Autón. México. Ser. Zoología, Estudios hidrobiológicos en la Laguna de Alvarado 1975. 46 (1):(Febrero-Agosto, 1966). WARBURTON, K., Community structure, abundance and diversity of fish in a Mexican coastal lagoon system: Estuar. Coast. mar. Sci., 1978. 497-519. 7: WEATHERLEY, A. H., Growth and Ecology of Fish Populations. Academic Press Inc., New,York,1972. 293 p. WILHM, J. L.,Ecology, Use of biomass units in Shannon's formula. 1968.153-156.49 (1): YÁÑEZ-ARANCIBIA, A., Taxonomía, ecología y estructura de comunidades de peces en lagunas costeras con bocas efímeras del Pacífico de México. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, Publ. Esp.,1978a.1-306. 2 (1): _____, Coastal Lagoon Research: Present and Future. II. Proceedings. Ecology in the ínlet of Puerto Real, Terminos Lagoon. II Discussion on trophic structure of fish communities in banks of Thalassia testudinum. (en prensa). In: Lassere, P., H. Postma, J. Costlow y M. Steyert (Eds.). UNESCO/IABO Seminar, Duke University Mar. Lab. Tech. Pap. Mar. Sci. UNESCO,1978b. 33 Sep. 1978 _____, Coastal Lagoon Research: Present and Future. II. Proceedings. Fishes occurrence, diversity and abundance in two tropical coastal lagoons with ephemeral inlets on the Pacific Coast of Mexico. (en prensa) In: Lasserre, P., H. Postma, J. Costlow y M. Steyert (Eds.) UNESCO/IABO Seminar, Duke University Mar. Lab., Tech. Pap. Mar. Sci. UNESCO,1978c. 33 Sept. 1978. _____, An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México'Patrones ecológicos y variación cíclica de la estructura trófica de las comunidades nectónicas en las lagunas costeras del Pacífico de México 1978d. 287-306.5 (1): YÁÑEZ-ARANCIBIA, A. R. S. NUGENT,An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, El papel ecológico de los peces en estuarios y lagunas costeras. 1977.107-114.4 (1): YÁÑEZ-ARANCIBIA, A. J. W. DAY, Jr.Oceanologica Acta Ecological characterization of Terminos Lagoon, a tropical lagoon-estuarine system in the Southern Gulf of Mexico. (en prensa).ISCOL-UNESCO,Bordeaux France1981. Sept. 7-14, 1981. YÁÑEZ-ARANCIBIA, A. F. AMEZCUA-LINARES J. W. DAYEstuarine Perspectives. Fish community structure and function in Terminos Lagoon, a tropical estuary in southern Gulf of Mexico. The fifth Biennal International Estuarine Research Federation Conference. Jekyll Island, Georgia, In: Kennedy, V - (Ed.) Academíc Press Inc. New York: 1980.465-482. Oct. 7-12, 1979. YÁÑEZ-CORREA, A., Bol. Inst. Geol. Univ. Nal. Autón. México, Batimetría, salinidad, temperatura y distribución de los sedimentos recientes en la Laguna de Términos, Campeche, México. 1963.147.67 (1): ZARUR-MENEZ, A., Rvta. Soc. mex. Hist. Nat., Algunas consideraciones geobiológicas de la Laguna de Términos, Campeche. México. 1962. 51-70. 23: ZIEMANN, J. C., Estuarine Research. Chemistry, Biology and the Estuarine System. Quantitative and dynamic aspects of the ecology of turtle grass Thalassia testudinum. In: Cronin, L. E. (Ed.) Academic Press. Inc. New York,1975.541-563. 1:
|

