|
EVOLUCIÓN GONÁDICA A NIVEL
HISTOLÓGICO DE RANGIA CUNEATA (GRAY, 1831) DE LA LAGUNA POM, CAMPECHE,
MÉXICO (MOLLUSCA: BIVALVIA)
Trabajo recibido el 11 de junio de 1979
y aceptado para su publicación el 18 de agosto de 1980.
PATRICIA ROGERS
ANTONIO GARCÍA-CUBAS
Universidad Nacional Autónoma
de México, Instituto de Ciencias del Mar y Limnología,
Laboratorio de Malacología. Contribución 106 del Instituto de
Ciencias del Mar y Limnología, UNAM.
El presente
trabajo describe la evolución gonádica de Rangia
cuneata (Gray) que es la especie dominante de la comunidad
biológica integrada porRangia
(Rangianella) flexuosa (Conrad)
yPolymesoda caroliniana (Bosc) en la Laguna Pom. Se llevaron
a cabo muestreos quincenales y mensuales durante 27 meses, analizando a nivel
histológico cualitativo 593 ejemplares con promedio de 22 cortes por
mes. Se presentan histogramas y gráficas para cada una de las fases
gonádicas, las cuales no se encuentran confinadas a determinadas
épocas del año, como consecuencia del régimen
hidrológico que prevalece en este sistema. La fase de
gametogénesis en sus diversos grados se presentó de una manera
continúa, aún cuando inmediatamente después de un desove
masivo se aprecian procesos de reabsorción, algunas veces
simultáneamente con la fase de gametogénesis. Se identificaron
dos períodos de desoves masivos anuales, el primero (febrero-junio)
más largo que el segundo (septiembre-noviembre), a temperaturas de 22.0
a 30.5ºC y salinidades de 0 a 3%. El porcentaje de hermafroditismo es
bajo (0.1%). La proporción de machos-hembras es de
1:1.18.
This paper analyses the gonadic evolution of
Rangia cuneata(Gray) which is the dominant species in the
community composed byRangia (Rangianella) flexuosa (Conrad)
andPolymesoda caroliniana (Bosc) from Pom Lagoon into the
estuarine system Atasta Pom. With that objective, fortnightly and monthly
samples were collected during 27 months and analyzed histologically. There were
593 specimenes with an average of 22 sections taken per month. Each one of the
phases are presented in graphs and histograms. The phases are not confined to
certain periods of time of the year because of the prevailing hidrological
regime. Gametogenesis phase in its different grades was present in a
continuously form. Even inmediately after massive spawning periods resorption
was noted some times simultaneously with the gametogenic phase. Two annual
spawning periods are present; the first (February-June) longer than the second
(September-November), at salinities of 0-3% and temperatures of
22-30.5ºC. The percentage of hermapliroditism is low (0.1%). The sex
ratio males-females was 1:1.18.
Rangia cuneata (Gray, 1831) es la especie dominante de la comunidad biológica integrada por Rangia (Rangianella) flexuosa (Conrad,1839) y Polymesoda caroliniana(Bosc, 1839) en la laguna Pom. Habita enterrada en sustratos blandos de tipo limo arcilloso y para su supervivencia requiere de aguas dulces a salobres en determinada época del año no superiores a 18% de salinidad. Su distribución es reportada por diversos autores, desde la Bahía Chesapeake a Texas y Laguna de Alvarado, Veracruz en el Golfo de México (Abbott, 1974 y Andrews, 1971) su rango ha sido ampliado hasta la Laguna de Términos, Campeche, México (García-Cubas, 1982). Rangia cuneata es una especie muy significativa desde el punto de vista ecológico, por su capacidad de convertir los detritos en biomasa, siendo un eslabón importante en las cadenas tróficas de peces y crustáceos. Desde el punto de vista económico es una especie apreciada como alimento por lo que ha venido siendo explotada hasta agotar los bancos que existieron en las lagunas de Alvarado y Mandinga, Veracruz. En la actualidad se le captura intensamente en la laguna Pom por lo que se hace inaplazable el estudio biológico en sus diversos aspectos que permitan sentar las bases científicas tendientes a la conservación del recurso. Las observaciones histológicas a través de varios años permiten determinar la frecuencia y duración del ciclo reproductor en muchos invertebrados (Giese, 1959). No existe antecedente sobre la evolución gonádica de esta especie en México, la escasa información se refiere a otros aspectos. Sánchez (1969) hace un estudio de prospección de la pesquería de almeja en la laguna de Alvarado, Veracruz; Ruiz (1975) efectuó un estudio ecológico preliminar en las almejas comerciales del sistema lagunar de Términos, Campeche; Chávez (1979) estudia la evolución larvaria deRangia cuneata en la laguna Pom; contrastando con la amplia literatura extranjera. Fairbanks (1963) realizó un estudio en el Lago Pontchartrain, Lousiana (EUA), sobre su reproducción así como la dinámica de población, factores biológicos, físicos y químicos presentes en su habitat. Chanley (1965) describe su desarrollo larvario; Castagna y Chanley (1966) determinan en condiciones de laboratorio, los límites de tolerancia a la salinidad de los adultos; Cain (1973, 1974 y 1975) llevó a cabo estudios sobre la reproducción, reclutamiento así como del efecto de la temperatura y salinidad en embriones y larvas de esta especie. El presente trabajo tiene como objetivo principal investigar las épocas de reproducción mediante el estudio histológico cualitativo y su correlación con los parámetros ambientales señalados anteriormente, comparando los resultados con los reportados para la misma especie en aguas de latitud templada. DESCRIPCIÓN DEL ÁREALa laguna Pom forma parte del sistema fluvio-lagunar que desemboca a través de la Boca de Atasta en la Laguna de Términos, se localiza aproximadamente a 30 km al oeste de Ciudad del Carmen, entre los 18º30' y 18º38' de latitud norte; 92º02' y 92º19' de longitud oeste (Fig. 1). MATERIAL Y MÉTODOSPara efectuar el análisis cualitativo de la evolución cíclica anual de la gónada, se llevaron a cabo muestreos mensuales o quincenales durante 27 meses comprendiendo desde noviembre de 1972 a mayo de 1975, estudiando un total de 593 ejemplares con un promedio de 22 organismos por mes que corresponden a 22 cortes histológicos que se considera son suficientemente representativos para este tipo de estudios, pues al respecto no existe un criterio establecido, la mayoría de los autores sólo mencionan el número total de ejemplares utilizados, algunos como Shaw (1962 y 1965) señala 10 por muestra; Ropes (1965 y 1968) entre 10 y 20; así como Sevilla (1969) Penchaszadeh et al. (1975) utilizaron 20 almejas por mes. Los materiales fueron colectados por el personal de la estación El Carmen así como la información complementaria referente a parámetros ambientales. En la tabla 1 se indica el número de ejemplares estudiados, fecha de colecta y sexo de las almejas. 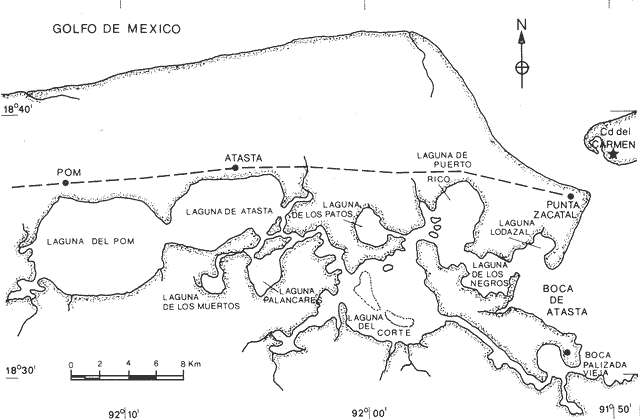 Fig. 1. Localización del área de estudio Los parámetros ambientales que se considera ejercen una influencia directa sobre la fisiología reproductora de estos organismos son la salinidad y temperatura del agua así como turbiedad y profundidad. El factor salinidad se determinó empleando un refractómetro American Optical. La temperatura del fondo fue medida mediante una botella Van-Dorn con termómetro acoplado y la de superficie directamente con termómetro de cubeta. La turbiedad del agua se valoró por medio del disco de Secchi y la profundidad con una sondaleza de mano. El material recién colectado se preservó mediante fijador Bouin y en estas condiciones fue transportado al laboratorio de Malacología del Instituto de Ciencias del Mar y Limnología en donde se seleccionó una porción representativa de la gónada siguiendo la técnica de deshidratación y montaje en parafina utilizada por Rogers (1970), obteniendo cortes de cinco micras de espesor, los que se tiñeron con hematoxilina-eosina de Harris. El reconocimiento de las fases gonádicas se realizó teniendo en cuenta en primer lugar, la abundancia y distribución del tejido conectivo vesicular, la cantidad de elementos sexuales existentes en los folículos, así como el aspecto de la cromatina y membrana nuclear. Debe señalarse que dentro de una misma fase se llegaron a reconocer diferentes grados o etapas, lo que permitió hacer un análisis preciso de cada una de ellas; así en al fase II o de gametogénesis se reconocen tres etapas, en la fase III o de reproducción, cuatro, en la fase IV o de postdesove tres etapas, lo cual se puede apreciar en las fotomicrografías obtenidas para tal fin, mediante un fotomicroscopio Carl-Zeiss. 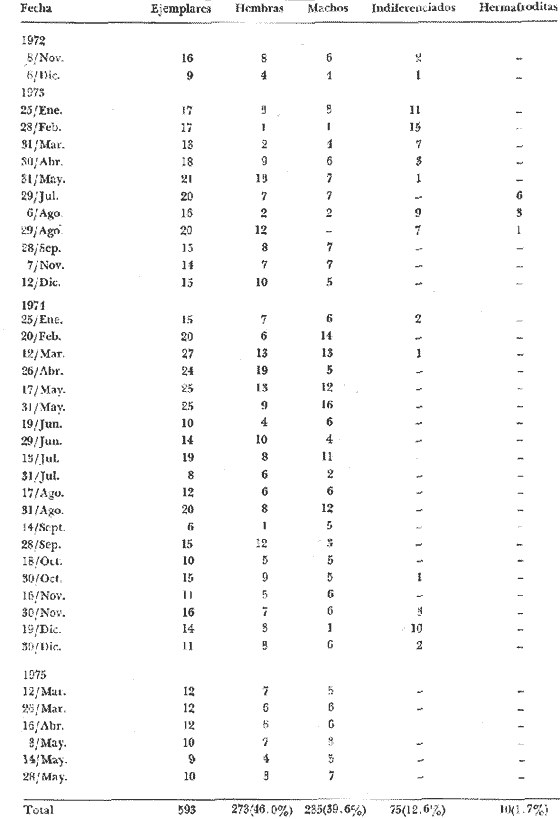 TABLA 1 NÚMERO DE EJEMPLARES, FECHA Y FRECUENCIA DE SEXOS DE LAS MUESTRAS UTILIZADAS EN EL ESTUDIO DEL CICLO GONÁDICO DE RANGIA CUNEATA (GRAY) EN LA LAGUNA POM, CAMPECHE. RESULTADOS
Parametros ambientalesLos datos ecológicos referentes a temperatura, salinidad, turbiedad y profundidad se concentran en la tabla 2. La temperatura promedio del agua varió de 28 a 29ºC las máximas (29-30ºC) se presentan entre los meses de julio a septiembre y las mínimas (23-27ºC) entre noviembre y enero. Las salinidades extremas son de 0 a 12%, manteniéndose estables desde mediados de la primavera hasta fines del verano con promedios entre 3 y 5% , y el resto del año corresponde a agua dulce. El grado de transparencia promedio fue de 0.80 m y la profundidad media de 2.60 m. 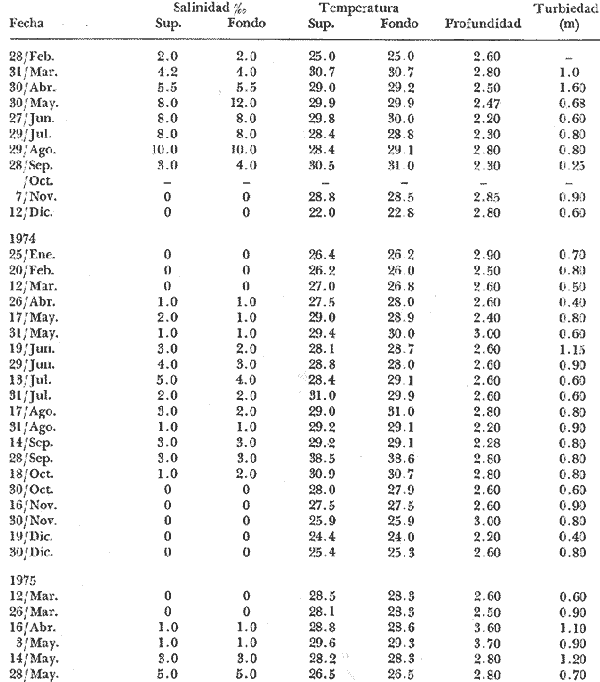 TABLA 2. DATOS HIDROLÓGICOS EN LA LAGUNA DE POM, DURANTE LOS MUESTREOS BIOLÓGICOS Fases gonádicasEl resultado de las observaciones histológicas permiten el reconocimiento de cuatro fases bien definidas, el análisis mensual de estas fases se representan en las figuras 2 y 3, notando en primer término, que no se encuentran confinadas a determinadas épocas del año, llegándose a reconocer dentro de una misma fase los grados o etapas intermedias ya señaladas anteriormente. En los individuos machos, las fases gonádicas son más difíciles de identificar, pues el epitelio germinal está en constante actividad y las espermatogonias proliferan más rápidamente que los ovogonias. La representación porcentual de cada una de ellas durante el periodo de estudio se ilustra en la tabla 3 y en las figuras 4 y 5. 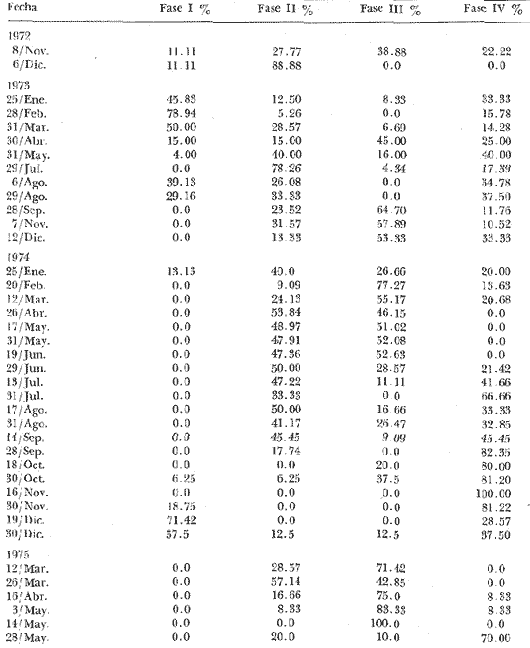 TABLA 3. FASES GONÁDICAS DE RANGIA CUNEATA (GRAY), EXPRESADAS EN VALORES PORCENTUALES (ENERO 1973 A MAYO 1975).
Figura 2 Figura 3 Figura 4 Figura 2 Figura 3 Figura 4 Figura 5 Fase I indiferenciada(Fig. 4A): Caracterizada por la ausencia de células por lo que no se puede determinar el sexo (Lám. 1 Fig. 1). Esta fase se representa con un valor de 11%, en los dos únicos meses que se observaron en el año 1972 (noviembre y diciembre), e inmediatamente asciende su porcentaje en el año 1973 durante los meses de enero y febrero, este ascenso corresponde al máximo registrado para esta fase durante el periodo de estudio y corresponde a 79.0%. Volviéndose a hacer evidente en la primera decena del mes de agosto de 1973 que se justifica por el valor alcanzado de 39.9% y se prolonga durante todo el mes. No se observó esta fase de febrero a octubre de 1974. Hacia el término del mes de noviembre se aprecia un proceso de indiferenciación bastante notable, resultando de 71.4% en diciembre. La fase indiferenciada fue evidente en 12.0% del número total de organismos estudiados. Los valores más altos observados (78.0% y 71.4%) coinciden con una temperatura de 25ºC que es de las más bajas registradas y con una salinidad de 0 y 2%. Fase II gametogénesis (Fig. 4B): Caracterizada por la gran actividad gametogénica con la consiguiente formación de células sexuales, las cuales se disponen uniformemente en la luz de los conductos (Lám. 1, Fig. 2; Lám. 2, Figs, 1 y 2). Esta fase se observó prácticamente durante todo el periodo de estudio con diferentes valores porcentuales que van de 6% a 89% los más altos índices porcentuales se presentaron en diciembre de 1972 (88.8%), julio 1973 (78.26%), en abril 1974 (53.8%), junio (50.0%) y agosto (50.0%); en 1975 en marzo (57.0%). De acuerdo con los resultados la temperatura de 28 a 30ºC y salinidad de 0-8% son factores que favorecen la presencia de la fase II. Además es frecuente observar la fase de gametogénesis y postdesove simultáneamente, predominando una de las dos, indicando que hay condiciones que favorecen la gametogénesis y que no permiten tener una característica fase IV (Lám. 3, Figs. 1 y 2). Fase III reproducción (Fig. 5C): Se reconocen cuatro grados; se considera la gónada en primer grado cuando los folículos presentan elementos sexuales maduros (Lám. 4, Figs. 1 y 2); en el grado dos ya se inicia una expulsión parcial (Lám. 5, Figs. 1 y 2); en el grado tres desove avanzado (Lám. 6, Figs. 1 y 2); en el grado cuatro se aprecian elementos sexuales que se considera ya no serán expulsados y sufrirán un proceso de autólisis o fagocitosis (Lám. 7, Figs. 1 y 2). Puede decirse que la fase III se hace evidente durante casi todo el periodo de estudio. Los valores más bajos se registran en el año 1973; en enero (8.3%), marzo (0.69%), julio (4.3%); en el año 1974; en primera quincena de septiembre (9.0%), en 1975; al término del mes de mayo (10.0%). La detección de valores porcentuales inferiores al 10% corresponden en general al final de desoves masivos. Los porcentajes más altos se presentaron en 1973: abril (45.0%) y septiembre (54.70%) noviembre (57.89%) en 1974: febrero (77.27%), mayo y junio (52.0%); en 1975: marzo (71.42%), abril (75.0%), primera quincena de mayo (100%). Se registraron 13 desoves durante el periodo de estudio; los rangos de temperatura y salinidad presentes fueron de 22 a 30.5ºC y 0 a 3% de salinidad. Se consideró como desove cuando la población estudiada presentaba valores superiores al cincuenta por ciento: 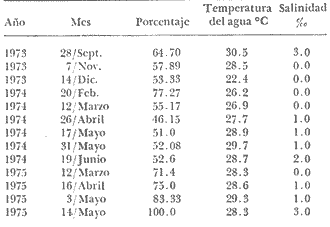 El primer desove se inició en la segunda quincena de septiembre de 1973, prosiguió a través de noviembre, diciembre disminuyendo notablemente en enero de 1974. En la segunda quincena de febrero 1974 se observa un segundo desove con un valor porcentual alto que se mantiene a través de mayo y junio hasta la primera quincena de julio, lo cual demuestra que los núcleos poblacionales desovan a tiempos desiguales. Se aprecia un tercer desove que se inicia en la segunda quincena de marzo de 1975, se acentúa en abril y mayo. Fase IV postdesove (Fig. 5D): Se caracteriza por una citólisis e invasión de fagocitos, es frecuente observarla simultáneamente con la fase II o III (Lám. 8, Figs. 1 y 2; Lám. 9, Fig. 1). Combinada con la reproducción: En noviembre de 1972 (22.2%), en abril de 1973 (25.0%) verificando en esta ocasión el primer desove masivo (abril-mayo); en diciembre de 1973 (33.3%), enero de 1974 (20.0%) justificando el segundo desove (septiembre-diciembre). En marzo 1974 (20.6%). En el cuarto desove febrero-julio de 1974 no se aprecian procesos de reabsorción durante la primera fase, pero a partir de junio a noviembre se registran valores ascendentes alcanzando 100% en noviembre de 1974. Hermafroditismo y proporción de sexosSe observaron diez casos de hermafroditismo que corresponde al 0.1% de la población muestreada (Lám. 9, Fig. 2). Los casos de hermafroditismo se reportan en el año 1973 en los meses de julio y agosto. La proporción de machos-hembras en el número total de organismos estudiados fue de 1.18:1. DISCUSIÓNEn la mayoría de los invertebrados estuarinos, la gametogénesis es cíclica, estos ciclos pueden ser anuales, mensuales o con una periodicidad lunar y se presentan lo mismo en latitud polar, templada o tropical (Giese, 1959; Moore, 1972). Moore (1972) afirma que en la latitud polar el desove predomina en verano, en primavera en latitud templada y nuevamente en el verano en latitud tropical. En el área estudiada que corresponde a una latitud tropical, se presentan dos desoves masivos anuales, uno de mayor duración de febrero a junio y el otro de septiembre a noviembre, con actividad gametogénica durante casi todo el tiempo de estudio y a temperaturas de 2.0 a 30.5ºC, y salinidades de 0 a 3%. El ciclo reproductor como se ha establecido en este estudio es similar al reportado por algunos autores para la misma especie en otras áreas geográficas: Fairbanks (1963) señala dos desoves masivos en el lago Pontchartrain, Louisiana (EUA), un primer desove masivo de marzo a mayo y un segundo más prolongado pero menos intenso que se inicia a el término del verano y se extiende hasta noviembre, con un rango de temperatura del agua de 15 a 34ºC y salinidades de 0.5-5.7%. Cain (1974) reporta un primer desove de corta duración (junio-julio) y otro más prolongado y menos intenso (octubre-enero); la actividad gametogénica la observó de abril a noviembre y a temperaturas de 0-29ºC y salinidades de 0-5%. En James River Va. (EUA) hay un primer desove masivo más tardío que en la laguna Pom y en el lago Pontchartrain en las cuales se efectúa en la primavera. En los tres casos hay dos desoves masivos anuales uno más largo y otro más corto e intenso. En la laguna Pom la gametogénesis ocurrió en un amplio rango de salinidad y temperatura, los porcentajes más bajos coinciden con los valores mínimos registrados en estos parámetros; indudablemente la temperatura ejerció un papel primordial en la actividad gametogénica. Existe correlación entre desoves masivos y los factores ambientales temperatura y salinidad, sin embargo los valores más bajos en salinidad coinciden con los valores porcentuales más altos en los desoves parciales detectados, por lo que habrá expulsión de productos sexuales siempre que haya un abatimiento de la salinidad, estas observaciones son similares a las aportadas por Fairbanks (1963) y Cain (1975). En su estudio efectuado en James River, Virginia, observó al igual que en este estudio que el desove no ocurre a salinidades mayores de 5.0%; por lo que esta baja salinidad es significativa para la sobrevivencia de las fases embrionarias y larvarias, asegurando un buen reclutamiento de juveniles a la población (Cain, 1973 y 1974). La proporción de hembras-machos fue de 1.18:1 semejante a lo reportado por Cain (1975). El porcentaje de hermafroditismo resulto muy bajo, observándose en fase temprana de gametogénesis, no hay indicaciones de hermafroditismo para la misma especie estudiada en el lago de Pontchartrain. ConclusionesCONCLUSIONES1. De acuerdo al análisis histológico de las gónadas de Rangia cuneatadurante un ciclo anual se observan fases bien diferenciadas, quedando establecidas de la siguiente manera: FASE I Indiferenciada noviembre-abril FASE II Gametogénesis enero-díciembre FASE III Reproducción Primer desove masivo: febrero-junio Segundo desove masivo: septiembre noviembre FASE IV Postdesove enero-diciembre. 2. La fase indiferenciada coincide generalmente con los menores valores de salinidad registrados 0 a 4‰. 3. La gametogénesis se evidenció durante casi todo el periodo de estudio. Los valores porcentuales superiores al 45% coinciden con temperaturas de 28-31‰ y salinidades de 0-8‰. 4. Rangia cuneatapresenta dos desoves masivos anuales, uno en primavera y otro en otoño, a temperaturas de 22 a 30.5ºC y salinidades de 0 a 3‰. 5. El porcentaje de hermafroditismo es muy bajo (0.1 %). 6. La proporción de sexos hembras-machos fue de 1.18:1. AgradecimientosA las autoridades del Instituto de Ciencias del Mar y Limnología, particularmente a Alfredo Laguarda Figueras, por su constante apoyo; al personal técnico de la estación "El Carmen" especialmente a Arturo Toledano Granados, por la oportuna realización de los muestreos periódicos y envío de los materiales al Laboratorio de Malacología; a Esperanza González por su eficaz asesoría técnica en el procesamiento histológico. LITERATURAABBOTT, R. T. American Seashells. Van Nostrand Co., Nueva York, 663 p. 1974. ANDREWS, J., Sea Shells of the Texas Coast. University of Texas Press, Austin and London. Austin, Texas, 1971. 298 p. CAIN, T. D., The combined effects of temperature and salinity on embryos and larvae of the clam Rangia cuneata. Mar. Biol., 1973.6 p. 21: _____ Combined effects of changes in temperature and salinity on early stages of Rangia cuneata. Va. Jour, Sci.,1974.30-31.(1): 25 _____, Fish. Bull. Reproduction and recruitment of the brackish water clam Rangia cuneata in the James River, Virginia. 1975. 412-430.(2): 73 CASTAGNA, M. P. E. CHANLEY Salinity tolerance and distribution of Spisula solidissima, Mulinia lateralis and Rangia cuneata, Familia Mactridae. Amer. Malacol. Union, Ann. Rept., 1966. p. 35. CHANLEY, P, Larval development of the brackish water, mactridae clam, Rangia cuneata, Chesapeake Sci., 1965.209-213.(4): 6 CHÁVEZ, E. M., Tesis de maestría en ciencias Univ. Nal, Auton. México, Desarrollo larvario de Crassostrea virginica Gmelin y Rangia cuneata (Gray, 1831) (Mollusca: Bivalvia): Procedentes del área Atasta-Pom de la Laguna de Términos, Campeche, México.1979. 72 p. FAIRBANKS, L. D.,Biodemographic studies of the clam, Rangia cuneata Gray, Tulane Stud. Zool., 1963. 10 (1):3-47. GARCÍA-CUBAS, A., Publicaciones Especiales Centro de Ciencias del Mar y Limnología, UNAM, en prensa. Moluscos de un sistema lagunar Tropical al sur del Golfo de México. 1980. GIESE, A. C., Ann. Rev. Physiol., Comparative physiology: Annual reproductive cycles of marine invertebrates. 1959. 547-576. 21: MOORE, H. B., Aspects of stress in the tropical Environment. Adv. mar. Biol. 1972.217-269. 10: PENCHASZADEH, P. E. S. R. OLIVIERMalacología, Ecología de una población de "Berberecho" (Donax hanleyanus) en Villa Gesell, Argentina. 1975.133-146.15 (1): ROGERS, N. P., Ciclo gonádico del "Ostión de Roca" Crassostrea iridescens, Hanley 1854, de Salina Cruz, Oaxaca. México. Tesis profesional, Univ. Nal. Autón. de México, 1970. 34 p. ROPES, J. W., Biol. Bull., Reproductive cycle of Mya arenaria in NE. England.1965.315-327.128 (2): _____, Biol. Bull., Reproductive cycle of the surf clam, Spisula solidissima, in offshore New Jersey. 1968. 349-365.135 (2): RUIZ, H. E., Tesis profesional, Univ. Nal. Autón. de México, Estudio ecológico preliminar de las almejas comerciales del sistema lagunar de Términos, Campeche, Rangia, cuneata (Gray, 1831). 1975. 80 p. SÁNCHEZ, G. Y., Tesis profesional, Univ. Nal. Autón. de México,Prospección de moluscos comerciales en Alvarado, Veracruz. 1969. 30 p. SEVILLA, J. L., Rev. Soc. Mex. Hist. Nat., Contribución al Conocimiento de la Madreperla Pinctata mazatlanica (Hanley, 1845). 1969. 223-262. 30: SHAW, W. N, Seasonal gonadal changes in female soft-shell clams, Mya arenaria, in Tred Avon River, Maryland. Proc. Natn. Shellfish. Assc., 1962121-132. 53: _____, Seasonal Gonadal Cycle of the male surf clam, Mya arenaria, in Maryland. U.S. Fish. Wildl. Serv., Spec. Sci. Rep. Fish., 1965. 5 p.508: LÁMINAS
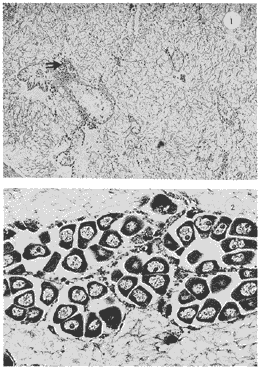 Lám 1 Fig 1.Fase I indiferenciada, mes de abril. Tejido conectivo abundante se aprecian fagocitos (*) . (98.4X). Fig. 2 Ejemplar hembra. mes de mayo. Fase II, gametogénesis en grado dos. Epilepto germinal en cavidad. Se muestran ovogonias adheridas a la pared del folículo, asi como ovocitos libres y adosados a la pared folicular. (250X). 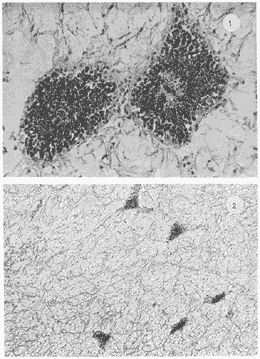 Lám. 2. Fig. 1. Ejemplar macho. Mes de abril. Fase II, gametogénesis en grado uno: (250X). Fig. 2 Ejemplar macho. Mes de abril. Fase II, gametogénesis en grado uno. (98.4X). 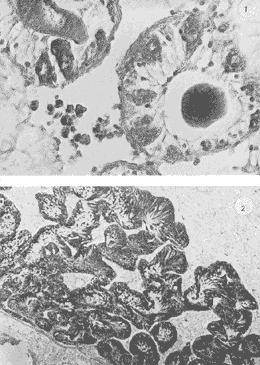 Lám. 3. Fig. 1. Ejemplar hembra. Mes de septiembre. Fase II, gametogénesis en grado uno, simultáneamente con fase de postdesove. (320X). Fig. 2. Ejemplar macho. Mes de noviembre, Fase II, gametogénesis, simultáneamente con fase de postdesove. (98.4X). 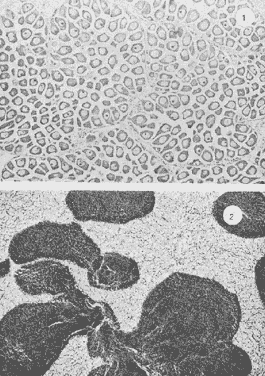 Lám. 4. Fig. 1. Ejemplar hembra. Mes de febrero. Fase III, reproducción en grado uno. Ovulos dispuestos uniformemente en la luz del folículo. Sin tejido conectivo interfolicular. (125X). Fig. 2. Ejemplar macho. Mes de Junio. Fase III, reproducción en grado uno, generalmente se observa tejido interfolicular. (125X). 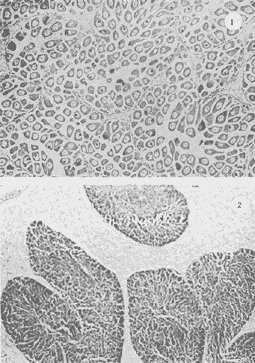 Lám. 5. Fig. 1. Ejemplar hembra. Mes de julio. Fase III, reproducción en grado dos, gónada con desove parcial. (98.4X). Fig. 2. Ejemplar macho. Mes de octubre. Fase III, reproducción en grado tres, gónada con desove parcial. (250X). 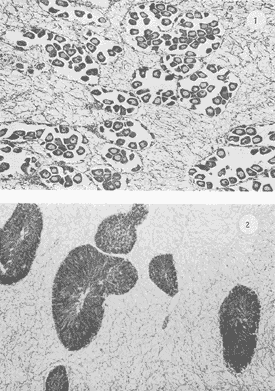 Lám. 6. Fig.1. Ejemplar hembra. Mes de mayo. Fase III, reproducción fase tres, gónada con desove avanzado. (98.4X). Fig. 2. Ejemplar macho. Mes de noviembre. Fase III, reproducción en grado tres, gónada con signos de desove avanzado, simultáneamente con gametogénesis. (98.4X). 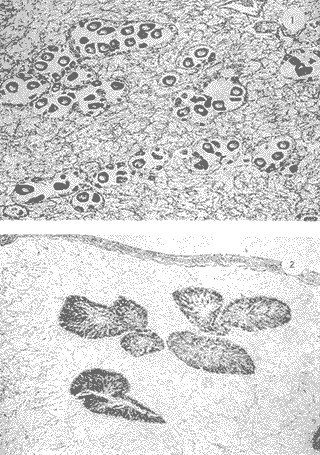 Lám. 7. Fig. 1. Ejemplar hembra. Mes de noviembre. Fase III reproducción en grado cuatro. Gónada desovada, se ilustra una clara reabsorción de la gónada. (98.4X). Fig., 2. Ejemplar macho. Mes de febrero. Fase III reproducción en grado cuatro. Gónada desovada. (98.4X). 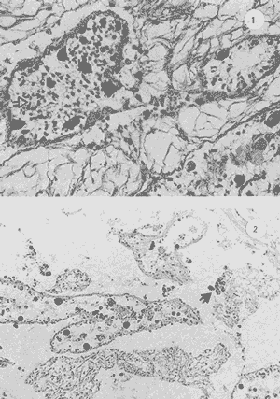 Lám. 8. Fig. 1. Ejemplar hembra. Mes de agosto. Fase IV postreproductiva en grado tres. Escasos óvulos residuales de aspecto degenerado. Abundantes fagocitos (*). (250X). Fig. 2. Ejemplar hembra. Mes de octubre. Fase IV postreproductiva en grado tres. Se observan fagocitos (*). (98.4X). 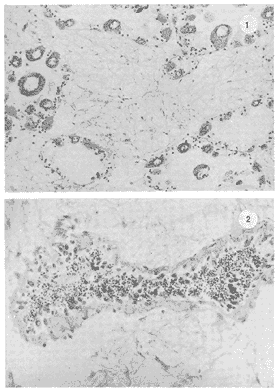 Lám. 9. Fig. 1. Ejemplar hembra. Fase IV postreproductiva en grado tres simultáneamente con fase de gametogénesis. (125X). Fig. 2. Ejemplar hermafrodita. Fase II gametogénesis en grado uno. (250X)
|

