|
LOS PECES DEMERSALES DE LA PLATAFORMA CONTINENTAL DEL SUR
DEL GOLFO DE MÉXICO. 1. CARACTERIZACIÓN AMBIENTAL,
ECOLOGÍA Y EVALUACIÓN DE LAS ESPECIES, POBLACIONES Y
COMUNIDADES
Trabajo recibido del 28 de febrero de 1985 y aceptado para su
publicación el 9 de noviembre de 1985.
Alejandro Yáñez-Arancibia
Patricia Sánchez-Gil
Universidad Nacional Autónoma de
México. Instituto de Ciencias del Mar y Limnología. Laboratorio
de Ictiología y Ecología Estuarina.
Este estudio de ecología de sistemas y
organización biológica de las comunidades de peces incluye los
resultados de seis Cruceros Oceanográficos entre junio de 1978 y marzo
de 1982, en la Sonda de Campeche, una amplia región de la plataforma
continental tropical frente a la Laguna de Términos, en el sur del Golfo
de México.
La estrategia de investigación se
inició con un diseño de muestreos estratificados por
batimetría, parcialmente al azar para cubrir estaciones de colecta en
áreas influenciadas por ríos, descargas de la Laguna de
Términos, fondos de sedimentos terrígenos y calcáreos,
litorales caracterizados por vegetación de pantanos, manglares
-Rhizophora mangle-, pastos marinos -Thalassia
testudinum-, y extendiéndose. hacia mar abierto hasta una
profundidad máxima de 80 m, Las interacciones físico-ambientales
y biológicas en las costas tropicales son evidentes hasta una
extensión en que la columna de agua tiene una profundidad de alrededor
de 20 m.
Para la discusión de la estructura de las
comunidades de peces demersales, el análisis biológico y
ecológico de las poblaciones, patrones de diversidad,
distribución y abundancia, familias tipo y especies dominantes, la
dinámica de la comunidad y la evaluación de los recursos, se
hicieron análisis biológicos, matemáticos y
estadísticos -espaciales y temporales- para 53 504 individuos obtenidos
de 160 colectas con redes de arrastre, en 81 estaciones de muestreo
distribuidas en 55familias, 102 géneros y 152 especies. La Sonda de
Campeche, frente a la Laguna de Términos, es un ecosistema de
comunidades de alta diversidad, donde se presentan más de 270 especies,
de las, cuales 152 son estudiadas cuantitativamente en este trabajo.
Los estudios de diversidad (H'n, D, J y H'w),
abundancia (ind m-2 y g .
m-2) distribución, gradiente de biomasa y
análisis de "cluster" de las diferentes colectas para determinar la
afinidad ecológica entre los componentes del ecosistema, mostraron la
presencia de dos conjuntos de poblaciones cuyos dendrogramas de afinidad tienen
alta correlación con los dendrogramas de los dos hábitats
previamente descritos en el área de estudio. Este patrón se
presenta durante todo el año con una mejor organización
ecológica durante la época de secas como consecuencia de
persistentes condiciones físico ambientales en gradientes espaciales. A
su vez, los conjuntos de poblaciones son más homogéneos al igual
que toda la comunidad de peces cuando no se presentan gradientes físico
ambientales, marcados, siendo esto durante el inicio de la época de
lluvias.
Esto permite proponer modelos de diversidad,
distribución y abundancia para especies, poblaciones y
comunidades.
El reemplazo de especies y el permanente
reclutamiento en los distintos hábitats de la Sonda de Campeche,
muestran para ambos subsistemas poca variación en la equitatividad de
las especies, pero existen variaciones en la riqueza de especies y el
número de individuos influenciado por la heterogeneidad de la biomasa
Esto es más evidente en una época del año que en otra con
una tendencia a la hornogeneizaci6n de la diversidad y densidad de las
poblaciones.
En este ecosistema de alta riqueza de ictiofauna, de
las 152 especies estudiadas 7 % son especies
pelágíco-oceánicas, 16% son pelágico-costeras, 41%
son de fondos calcáreos arrecifales y 36% típicas de fondos
blandos. Se destaca que el 49% del total de estas especies son marinas
eurihalinas y tienen algún tipo de relación bioecológica
con ecosistemas de aguas someras protegidas (por ejemplo Laguna de
Términos). En estas complejas comunidades, el análisis de
frecuencia, abundancia numérica y biomasa, para cada una de las 152
especies señala que 32 especies son consideradas típicas y
dominantes de la región de los estudios: Harengula jaguana,
Chloroscombrus chysurus, Polydactilus octonemus, Eucinostous gula, Diplectrum
radiale, Synodus foetens, Ariusfelis, Cynoscion nothus, Prionotus
punctatus/beani, Syacium gunteri, Trachurus lathami, Sardinella aurita,
Serranus atrobranchus, Priacanthus arenatus, Symphurus plagiusa, Cynoscion
arenarius, Lagocephalus laevigatus, Citharichthys spilopterus, Porichthys
porosissimus, Bagre marinus, Etropus crossotus, Eucinostomus argenteus, Upeneus
parvus, Lutjanus synagris, Stellifer colonensis/lanceolatus, Trichiurus
lepturus, Cetegraulis edentulus, Selene setapinnis, Stenotomus caprinus,
Opisthonema oglinum, Haemulon aurolineatum. Para estas especies se
hace un estudio detallado de distribución, relaciones ecológicas
y comportamiento biológico, encontrándose que más del 80%
en algún momento de su ciclo de vida utilizan los sistemas
lagunares-estuarinos adyacentes por estrategias alimentarias, reproductivas o
patrones de migración. Esto demuestra la trascendencia ecológica
de las interrelaciones estuario-mar y el papel de la Laguna de Términos
en la estructura y función de las comunidades de peces demersales de la
Sonda de Campeche.
Por otra parte, la distribución de la biomasa
(standing crop) y número de individuos de las comunidades, está
principalmente influenciada por la batimetría, el tipo de sedimentos y
el aporte de las aguas epicontinentales de la Laguna de Términos y
estuarios adyacentes. Para el estrato de menos de 20 m de profundidad, la
Captura por Unidad de Esfuerzo (CPUE) promedio fue de 51.5 Kg/ h. para el
estrato de más de 20 m de profundidad, la CPUE promedio fue de 55.8 Kg/
h. Con una CPUE total promedio de 47.8 Kg/ h. Métodos cuantitativos
convencionales y pruebas estadísticas, permiten establecer que los peces
demersales de la plataforma continental del sur del Golfo de México
-como fauna acompañante del camarónPenaeus
spp-, presentan una proporcionalidad promedio de peces/ camarón = 12:1,
con un rango de variación de 8: 1 (a mediados de la época de
lluvias) a 57:4 (durante la época de secas). Estos recursos dependen de
una dinámica ecológica propia de la zona costera tropical,
particularmente de ciertos mecanismos de producción que son variables
físicas que interactúan ecológicamente para controlar la
diversidad, distribución, abundancia y persistencia de las comunidades.
Con estos resultados se estima una potencialidad mínima de los recursos
demersales de 336 000 ton/año; recursos aún no utilizados en el
país. Con los elementos conceptuales de ecología y pesca, el
marco de referencia para el Golfo de México, las interacciones
ecológicas en la zona costera y la potencialidad y perspectivas de los
recursos, se analizan los elementos y criterios para la administración y
manejo de las poblaciones explotables, con criterio ecológico.
Finalmente, por la utilidad práctica, se
incluye un Anexo Taxonómico con el registro general de los peces
colectados en 11 campanas oceanográficas (junio, 1978 - Septiembre,
1985), precedido de un comentario zoogeográfico. Estos peces muestran
conjuntos de especies con afinidades templado-cálida, tropical y
subtropical, de 76% (178 spp) con la Provincia Carolineana, 64% (150 spp) con
la Provincia Caribeña y 3 % (6 spp) con la costa Pacífica de
América en su área de contacto Panámico-Califoniano. La
Provincia Caribeña de Hatteras a Florida y la Provincia Caribeña
del sur de Florida a Brasil, tienen complicados límites de contacto
ictiofaunístico por la influencia de las Antillas, los arrecifes de
corales, y los ecosistemas lagunares estuarinos con pantanos, pastos marinos y
manglares. En este complejo tropical del Atlántico de América
como foco de dispersión de especies, la heterogeneidad de ecosistemas,
la alta diversidad de habitats tropicales y subtropicales, y la elevada
dependencia biológica de los peces por los procesos costeros, pueden ser
factores que mantienen la alta diversidad peces y dificultan caracterizar
límites precisos de contacto Carolineano-Caribeño.
This study of the ecological systems and biological
organization of fish communities is based upon the results of six oceanographic
cruises made between June, 1978 and March, 1982, in Campeche Sound, a broad
region of the tropical continental shelf seaward of Terminos Lagoon in the
southern Gulf of Mexico.
Collecting stations were made out to a depth of 80 m,
and they were positioned to take account of depth, areas of riverine influence,
discharges from Terminos Lagoon, areas with calcareous and terrigenous bottom
sediments, and littorals characterized by swamp Vegetation, mangroves
(Rhizophora mangle), and seagrasses (Thalassia
testudinum). The physical and biological interactions along this
tropical coast were apparent from shallow water, seaward to a depth of about 20
m.
In the present study 160 trawl collections were made
at 81 sampling stations, and the catch included 53 504 individuals which
represented 55 families, 103 genera, and 152 species. Mathematical and
statistical (both spatial and temporal) analyses of these data provided the
basis for the discussion of demersal fish community structure; biologica and
ecological analysis of populations; diversity, distribution and abundance
patterns; family type and dominant fish species; community dynamics and
resource evaluation. The ecosystem of Campeche Sound seaward of Terminos Lagoon
includes more than 27O fish species of which 152 are studied quantitatively
here.
Studies of diversity (H'n, D, J, and H'w), abundance
(ind./m² and g/m²), distribution, biomass gradients and cluster
analysis of the different collections carried out to determine ecological
affinities between components of the ecosystem revealed the presence of two
populations groups whose affinity dendrograms are highly correlated with the
two habitats previously described in the study area. This pattern is found year
around with the highest ecological organization ocurring during the dry season
as a consequence of persistent physical environmental conditions in spatial
gradients. In turn, population groups and the fish community, in general, are
most homogeneous when there are no marked physical environmental gradients,
which occurs at the beginning of the rainy season. This permits the proposal of
diversity, distribution and abundance models for species, populations and
communities.
Species replacement and permanent recruitment in the
distinct habitats of Campeche Sound show little variation in species
equitability or evenness within either subsystem, but there does exist
variation in species richness and number of individuals, which are influenced
by the heterogeneity of the biomass. This is more apparent in one season of the
year than another with a tendency towards the homogenization of population
density and diversity.
Of the 152 species studied in this very rich
ichthyofaunal ecosystem, 7% are oceanic-pelagic, 16% pelagic-coastal, 41% from
calcareous reef bottoms, and 36% typical of soft bottoms. The fact that 49% of
the total species are euryhaline-marine and have some kind of bioecological
relationship with shallow protected water ecosystems (such as Terminos Lagoon)
stands out. In these complex communities the analysis of frequency, abundance
and biomass for each of the 152 species indicates that 32 species are typical
and dominant in the study are: Harengula jaguana, Chlorocombrus
chrysurus, Polydactylus octonemus Eucinostomus gula, Diplectrum radiale,
Synodus foetens, Arius felis, Cynoscion nothus, Prionotus puncatus/beani,
Syacium gunteri, Trachurus lathami, Sardinella aurita, Serrdanus atrobranchus,
Priacanthus arenatus, Symphurus plagiusa, Cynoscion arenarius, Lagocephalus
laevigatus, Citharichthys spilopterus, Porichthys porosissimus, Bagre marinus,
Etropus crossotus, Eucinostomus argenteus, Upeneus parvus, Lutjanus synagris,
Stellifer colonensis/lanceolatus, Trichurus lepturus, Cetengraulis edentulus,
Selene setapinniss Stenotomus caprinus, Opisthonema oglinum,
andHaemulon aurolinealum. For these species a detailed study
was made of their distribution, ecological relationships and biological
behavior which showed that more than 80% of them at some time in their life
cyles utilize the lagoon-estuarine systems in their feeding, reproduction, or
migration patterns. This highlights the ecological trascendence of
estuarine-shelf interrelationships and the role of Terminos Lagoon in the
structure and function of the demersal fish communities in Campeche
Sound.
Furthermore, the standing crop distribution, and
number of individuals in the communities, are mainly influenced by bathymetry,
sediment type, and the influx of epicontinental waters, of Terminos Lagoon and
adjacent estuaries. For the stratum of < 20 m the Catch per Unit Effort
(CPUE) was 51.5 Kg/ h as average. For the > 20 m stratum, the CPLJE was 55.8
Kg/h as average. The general average of the CPUE was 47.8 Kg/ h.
Conventional quantitative methods and statistical
tests demonstrate that the demersal fishes of the continental shelf of the
southern Gulf of Mexico (as by-catch fauna of the
shrimp,Penaeus spp, harvest) show an average ratio of fish/
shrimp = 12: 1, with ratios ranging from 8:1 (during the middle of the rainy
season) to 57:4 (during the dry season). These resources depend on the unique
ecological dynamics of the tropical coastal zone, particularly certain
production mechanisms which are physical variables that interact ecologically
to control the diversity, distribution, abundance and persistence of the
communities. The minimum potential of demersal resources was estimated to be
336 000 tons/year, resources not yet used by the country. The elements and
criteria for the administration and management of the exploitable populations
will be analyzed by ecological criteria, given the concepts of ecology and
fishery science, the referential framework of the Gulf of Mexico, the
ecological interactions in the coastal zone, and potential and perspectives of
the resources.
Finally, considering the practical utility of this
work, a Taxonomic Appendix has been included with a general list of the fishes
collected during 11 oceanographic cruises (June, 1978 - September, 1985), and
this is preceded by a zoogeographic commentary. The fishes show groups of
species with warm-temperate, tropical, and subtropical affinities, of 76% (178
spp) with the Carolinean Province, 64% (150 spp) with the Caribbean Province
and 3% (6 spp) with the Panamic-Califórnian are of the Pacific coast.
The Carolinean Province from Cape Hatteras to Florida and the Caribbean
Province from southern Florida to Brazil have complicated ichthyofaunistic
contact areas due to the influence of the Antilles, coral reefs, and
lagoon-estuarine ecosystems composed of marshes, seagrasses, and mangroves. In
this tropical region of the American Atlantic, as focal dispersion points of
species, the heterogeneity of the ecosystems, the high diversity of tropical
and subtropical habitats, and the high biological dependence of the fishes on
coastal processes, can be factors which maintain high fish species diversity,
and it is also difficult precise Carolinean-Caribbean contact limits.
Los peces son importantes para el hombre por muchas razones. Ellos proveen una de las fuentes más importantes de proteína en el mar y sus capturas son las mayores a nivel mundial; son motivo de distracción y esparcimiento donde la pesca deportiva es uno de los grandes apoyos al turismo; son importantes para la enseñanza y la educación sobre la vida acuática; son testigos evidentes que desaparecen con prontitud ante el avance de la contaminación; son transformadores de, energía desde fuentes primarias, porque en las estructuras tróficas aparecen alimentándose ya sea de materia orgánica, como de vegetales, zooplancton macroinvertebrados u otros peces; son reguladores energéticos en ecosistemas costeros por la habilidad de desplazarse, intra e interecosistemas; viven en estrecha vinculación con el marco físico ambiental del hábitat al cual han adaptado sus estrategias biológicas reproductoras y alimentarlas; además que sus perspectivas de manipulación tecnológica para acuicultura son reales. Aunque esto puede ser válido en cualquier latitud de¡ mundo costero oceánico, es particularmente significativo en las regiones cálido-templadas y tropicales, donde las interacciones ecológicas entre los pantanos y el mar son muy fuertes considerando procesos deltaicos, lagunas costeras y estuarios, bocas estuarinas y una plataforma continental conectada con pastos marinos, manglares, arrecifes de coral, bancos de ostión, por nombrar algunos de los subsistemas ecológicos más evidentes. Los peces han aprendido a vivir en esta complejidad ecológica que es estable pero con cierto grado de variabilidad y la organización biológica de las poblaciones están íntimamente ligado a estos procesos, dando como resultado comunidades demersales multiespecíficas o de alta diversidad, con complejas interacciones biológicas. Estas interacciones biológicas son muy difíciles de estudiar en el marco ambiental descrito; para ello se requiere de un conocimiento preciso de la taxonomía de la ictiofauna presente, estudios de campo y de laboratorio en la zona costera -entendida ésta como la región de interacciones entre la tierra, el mar, la atmósfera y las aguas epicontinentales-, pero esencialmente se requiere de una profunda observación de la naturaleza donde los peces viven, obteniéndose información durante largos periodos de tiempo, con buenas bases metodológicas de campo y de laboratorio manejado esto por un equipo de investigadores de buena formación científica a nivel de posgrado. Como clase zoológica, los peces representan el grupo de vertebrados más numeroso sobre la tierra y, aunque actualmente se reconocen muy bien cerca de 20 mil especies diferentes, se estima que antes del año 2000 el hombre habrá descubierto alrededor de 30 mil, de las cuales muchas habrán desaparecido del ecosistema marino por sobrepesca o contaminación. Los avances de las investigaciones en las grandes cuencas abisales y en la zona costera tropical, fundamentan las perspectivas de ese número de especies para fines de siglo. En el Golfo de México, los peces de la plataforma continental entre Florida, Louisiana y Texas tienen un registro de no menos de 500 especies bien conocidas. Probablemente toda la plataforma del Golfo de México puede ser la residencia de no menos de 1000 especies, bien adaptadas a la gran heterogeneidad de hábitats desde la Península de Florida hasta la Península de Yucatán. Parte de la respuesta, de por qué existen tantos miles de especies de peces -muchos más que mamíferos, aves, reptiles, anfibios-, es porque ellos representan un grupo de vertebrados que desarrollan todo su ciclo de vida en el agua, líquido que ocupa el 70% de la superficie del planeta. Además, los peces a diferencia de los otros vertebrados, viven en un medio ambiental de tres dimensiones, y dentro del medio líquido se encuentran desde las altas montañas hasta las grandes profundidades marinas. La variedad de formas y modalidades de cielos de vida que exhiben los peces, excede con creces lo que exhiben los peces, vertebrados terrestres; y aunque muy pocas especies de peces tienen un rango de distribución desde la superficie, del océano hasta las grandes profundidades o desde las aguas dulces hasta el mar, la fauna ictiológica ha desarrollado una gran capacidad de adaptaciones morfofisiológicas para explotar todos los hábitats disponibles en el agua en tres dimensiones, y así optimizar sus ciclos de vida. La región de los estudiosEn el Golfo de México hay tres regiones con importancia tradicional. La plataforma continental de la Península de Florida, la plataforma conitinental influida por el delta del Río Mississippi y la plataforma continental del sur del Golfo de México donde destaca la configuración fisiográfica de la Sonda de Campeche. Estas grandes regiones presentan diferencias significativas a nivel de procesos costeros y procesos ecológicos, pero también presentan homologías. El norte del Golfo de México comprende aguas templadas de los Estados Unidos, desde Florida a Texas. La parte norte se caracteriza, en cierta medida, por las temperaturas superficiales bajas, pocas áreas de arrecifes (le corales vivos, sistemas estuarinos con ambientes de manglares y algunos ríos que antes de llegar al mar se mezclan con aguas oceánicas en embahiamientos costeros. Estos corales y los sistemas lagunares-estuarinos con manglares, son todavía poco conocidos en la estructura de sus comunidades de peces y sus interacciones físicas y biológicas en la plataforma continental (Springer y Woodburn, 1960; Allyn, 1969; Beebe y Tee Van, 1970; Swingle, 1971; Walls, 1975; Moe y Martin, 1965; Smith, 1976). El gran delta del Río Mississippi ha depositado durante cientos de años gigantescas capas de sedimentos finos, así corno también se ha introducido profundamente en la plataforma continental. El delta y sus diferentes marcas han provocado una división aún no bien conocida entre la ictiofauna noroccidental del Golfo. Todavía es objeto de debate si esta división existe o no, pero no cabe duda que algunas especies de peces se presentan generalmente al este del delta, mientras que otras son encontradas comúnmente en el sector oeste. El delta y sus litorales de Alabama hasta Texas ha intervenido en la formación de pantanos, lagunas costeras y estuarios, una amplia plataforma continental con Gentes de playa antiguos y una gran actividad ecológica entre la planicie costera y las aguas neríticas de la plataforma continental; pero sólo en los últimos años el avance de las investigaciones de comunidades de peces ha intentado hacer compatibles las ciencias pesqueras con las ciencias ecológicas, observándose notorio avance en el estancamiento general (Gunter, 1945; Hildebrand, 1954; Miller, 1965; Moore et al., 1970; Pew, 1971; Frankset al., 1972; Chittenden y McEachran, 1976; Hoese y Moore, 1977; Ragan et al., 1977; Flint y Rabalais, 1981; Darnellet al., 1983). A este nivel del análisis regional, es necesario mencionar algunas referencias monográficas colaterales al Golfo de México que son fundamentalmente para la comprensión de la ictiología del Golfo, estas son: Cervigón (1966), Randall (1967), Dahl (1971), Perry y Perry (1974), Guitart (1974, 1975, 1977, 1978), Fischcr (1978), Munro (1983). Debido a que el Golfo de México encierra una plataforma continental relativamente somera y amplia, los procesos deltaicos, la influencia de los ríos hacia el mar y la presencia de grandes y numerosos sistemas estuarinos, es una característica que se comparte desde Florida hasta Yucatán. La Sonda de Campeche presenta similitudes con la plataforma de Florida por los pastos marinos, los manglares y la presencia de algunos aislados arrecifes de coral, y si bien es cierto, esto no se presenta en la región del Mississippi, aún hay más similitudes entre Campeche y la región de Louisiana-Texas por los procesos deltaicos, el avance de sedimentos terrígenos, y los yacimientos (le petróleo y gas. Las tres regiones del Golfo de México aquí analizadas sustentan importantes recursos pesqueros de crustáceos, moluscos y peces. El enfoque sistémico de las investigaciones de comunidades de peces y el marco físico ambiental donde se organizan biológicamente, ha tenido un claro desarrollo desde los últimos años en la Sonda de Campeche y la región de Laguna de Términos en el sur del Golfo de México. Puesto que en los capítulos sucesivos de este trabajo se analiza y discute en detalle la extensa literatura de la región, en esta sección es adecuado mencionar sólo algunos trabajos que ilustran este planteamiento. La estructura y función de las comunidades de peces de la Laguna de Términos fue por primera vez analizada en el trabajo de Yáñez-Arancibia et al. (1980) integrando muchos años de investigaciones previas. El papel ecológico de las bocas estuarinas y sus comunidades de peces está planteado en los trabajos de Bravo-Núñez y Yánez-Arancibia (1979), Yáñez-Arancibia (1981a), Yánez-Arancibia y Lara-Domínguez (1983), Alvarez Guillén et al.(1985), Yáñez-Arancibia et al.(1982a, 1985a). Antes de referir los trabajos específicos en la Sonda de Campeche, deben destacarse las investigaciones que han correlacionado las interacciones peces-hábitat en la región de los estudios (Yáñez-Arancibia et al., 1982b, 1985b), resultados que han mostrado la afinidad de las especies y poblaciones de peces por subsistemas (hábitat) ecológicos específicos. En la Sonda de Campeche, el primer trabajo que analizó la diversidad, la distribución y abundancia de los peces demersales, fue Sánchez-Gil et al. (1981), donde se plantea que los patrones ecológicos de las especies y poblaciones depende de la batimetría, la distribución de sedimentos tipo y su efecto en la disponibilidad del alimento, y la influencia de los sistemas lagunares-estuarinos adyacentes. Este enfoque además de la afinidad peces-hábitat, fue posteriormente reforzado en los trabajos de Yáñez-Arancibia et al. (1983a, 1984a, 1985b). Las investigaciones mencionadas además de algunas referencias específicas y particulares sobre el ecosistema (Yáñez-Arancibia y Day, 1982; Yáñez-Arancibia y Sánchez-Gil, 1983; Yáñez-Arancibia et al.,1983b; Ayala-Castañares et al., 1984), permiten establecer que esta región es de gran importancia científica, social y económica, y están siendo estudiada intensamente debido a: 1) la gran diversidad de especies y de hábitats (subsistemas ecológicos), 2) los recursos bióticos y los pesqueros, 3) las interacciones ecológicas sobre la Laguna de Términos y la Sonda de Campeche, 4) el gran desarrollo industrial (petróleo y pesca) de la región,5) el desarrollo urbano y de infraestructura de la región y, 6) no se presentan todavía niveles críticos de contaminación. Planteamiento de la hipótesis y estrategia de investigaciónEcológicamente la Sonda de Campeche es una región amplia donde los procesos costeros y ecológicos están estrechamente interconectados. Los procesos climático-meteorológicos, la descarga de los ríos y los procesos sedimentarlos son las principales variables físicas que controlan a los procesos biológicos. Los principales hábitats (subsistemas o ambientes ecológicos) de la zona costera regional son los manglares, los arrecifes de ostión, los pastos marinos y la plataforma adyacente con algunos arrecifes coralinos. Los primeros ambientes mencionados sé sitúan en ecosistemas lagunares estuarinos altamente dinámicos, ecológicamente estables pero físicamente variables. Esta caracterización puede ser la explicación para plantear la hipótesis que la Sonda de Campeche, frente a la Laguna de Términos es un ecosistema de alta diversidad de Peces, como consecuencia de la gran adaptación morfofisiológica de los peces a un extenso ecosistema costero de alta heterogeneidad de hábitats, alta disponibilidad de alimento -i. e.,macroinvertebrados y otros peces-, y la integración de procesos físicos y biológicos a las estrategias reproductivas y alimentarias de los peces. Todo como consecuencia de una región de alta productividad costera provocando un gran potencial de recursos pesqueros disponibles. Zoogeográficamente la Provincia Carolineana de Hatteras a Florida y la Provincia Caribeña del sur de Florida a Brasil, tienen complicados límites de contacto ictiofaunístico en el sur del Golfo de México por la influencia de las Antillas, los arrecifes de corales, y los ecosistemas lagunares-estuarinos con pantanos, pastos marinos y manglares (Yáñez-Arancibia et al., 1984). En este complejo tropical del Mediterráneo americano corno foco de dispersión de especies la heterogeneidad de ecosistemas, la alta diversidad de hábitats tropicales y subtropicales, y la elevada dependencia biológica de los peces por los procesos costeros, pueden ser factores que mantienen el ecosistema demersal costero de alta diversidad. En la zona costera de estos estudios, el sistema lagunar-estuarino de la Laguna de Términos y la Sonda de Campeche, conjuntamente con las bocas del Carmen y Puerto Real, conforman un sistema ecológico muy complejo. Se involucran aquí procesos de transporte y mezcla, movimientos migratorios, cambios ontogenéticos en los ciclos biológicos de los peces y cambios trofodinámícos, energéticos y químicos. Los recursos bióticos han adaptado sus estrategias biológicas a este marco de referencia ambiental. La utilización de los hábitats por peces marinos o estuarinos no es al azar. Muchas especies (particularmente las dominantes) benefician significativamente su alimentación reproducción y estados juveniles, explotando tiempo y espacio de alta productividad en el sistema costero estudiado a través de importantes adaptaciones evolutivas. Interpretando ecológicamente la dinámica ambiental del sistema se encuentran las respuestas y explicaciones a los patrones de comportamiento de las comunidades y especies, a los mecanismos de su productividad y a las relaciones de interacción física y biológica entre la Sonda de Campeche y Laguna de Términos. El planteamiento de esta hipótesis fundamenta la estrategia de investigación que se ha seguido, incluyendo el análisis de la ecología y la caracterización estructural de las poblaciones de peces y sus comunidades, el análisis ecológico y biológico de las especies dominantes y su interacción estuario-plataforma, y el estudio de la dinámica de la comunidad ictiofaunística para encontrar las explicaciones al potencial de los recursos pesqueros y sugerir normas adecuadas para su aprovechamiento y protección. Identificación de los objetivosLos antecedentes señalados en las dos secciones anteriores de la Introducción, permiten destacar que la Sonda de Campeche corno área de importancia biológica y pesquera, es una región de interés para la realización de los estudios que ayuden a interpretar, desde un punto de vista ecológico, su gran potencial biótico. En esta zona se desconocen en muchos aspectos las características biológicas y ecológicas de las comunidades presentes y, por consecuencia, el conocimiento de aquellos recursos potencialmente explotables es incipiente en términos de su magnitud, distribución y abundancia. Ligado con esto, la relación ecológica entre los sistemas de Laguna de Términos y la Sonda de Campeche, está siendo objeto de gran interés, particularmente las interacciones estuario-plataforma desde el punto de vista del comportamiento ecológico y estrategias biológicas de las comunidades de peces. Por otra parte, es prioritario establecer la base de un marco de referencia para interpretar cuantitativamente la estructura y función de las comunidades de peces y su relación con el medio ambiente. Esto es fundamental por varias razones: a) para el conocimiento por sí mismo, de los recursos biológicos y pesqueros de la Zona Económica Exclusiva de México en el Golfo, b) para integrar avances y logros de investigación ecológica y pesquera, que permita en un futuro integrar modelos para toda la plataforma del Golfo de México, c) para entender, a diferentes escalas de magnitud los procesos naturales de la zona costera del sur del Golfo de México, d) para conocer los mecanismos de producción secundaria de la región, e) para conocer y comprender el efecto de la variabilidad natural del ambiente sobre la organización biológica de las especies, poblaciones y comunidades de peces demersales costeros, f) para cuantificar y evaluar ecológicamente la magnitud de los recursos, particularmente los recursos potenciales frente a los recursos convencionales y, g)aportar información científica integrada e interpretada, que pueda ser la base de orientación para administrar adecuadamente la zona costera y sus recursos. En base a estos antecedentes y planteamientos, este estudio establece los siguientes objetívos: 1. Analizar cuantitativamente las poblaciones de peces demersales de la Sonda de Campeche frente a la Laguna de Términos, desde un punto de vista comparativo de los principales parámetros ecológicos, en relación a los diferentes hábitats del sistema y su variabilidad temporal y espacial. 2. Análisis matemático de la caracterización y afinidad ecológica de las poblaciones, estableciendo modelos de la estructura y función de las comunidades. 3. Caracterizar las poblaciones dominantes de las comunidades de peces demersales de la Sonda de Campeche, en relación a sus patrones ecológicos de distribución, frecuencia, abundancia numérica y de biomasa, en las diferentes épocas climáticas. 4. Establecer modelos de distribución espacial de las poblaciones de peces demersales los gradientes de abundancia (biomasa), y el tamaño promedio de la población, en relación a las variaciones estacionales y características del hábitat. 5. Análisis bioecológico de la potencialidad de poblaciones dominantes que representan recursos bióticos con perspectivas de explotación. 6. Caracterizar aspectos de interacción entre la Sonda de Campeche y Laguna de Términos, desde el punto de vista de la estructura y función de las comunidades de peces y las principales estrategias de intercambio ecológico. 7. Evaluar ecológicamente los recursos de peces demersales como fauna acompañante del camarón y establecer aspectos para su manejo y aprovechamiento en el sur del Golfo de México sobre bases científicas. Antecedentes
Organización de comunidades, productividad y ecosistemas: interacciones ecológicas costerasDesde distintos puntos de vista -tanto biológicos, sociales, como económicos la zona costera es extremadamente valiosa y se sabe que más del 90% de las capturas pesqueras a nivel mundial, provienen de la plataforma continental. Sin embargo, la comprensión ecológica de los sistemas costeros requiere del análisis integrado de los procesos físico ambientales y biológicos. Diversos autores han podido relacionar directamente los procesos e interacciones físico-biológicas, y los mecanismos ecológicos de producción natural en sistemas costeros marinos con influencia lagunar estuarina. Estos estudios destacan la importancia de los sistemas costeros en la determinación de la composición de la comunidad y la alta productividad pesquera de algunas especies en la plataforma continental adyacente y, aún cuando no se ha definido un patrón final al respecto, los avances son significativos. Primeramente cabe mencionar una serie de estudios publicados que tratan aspectos de ecología de peces en bocas estuarinas asociadas a la plataforma continental, áreas de pantanos y sistemas estuarinos, los cuales de manera esencial se refieren a las interacciones entre estos sistemas, desde un punto de vista de las comunidades de peces: Simmons y Hoese (1959), Copeland (1965), Hoese et al., (1968), Kind (1971), Sabins y Truesdale (1974), Darnell y Soniat (979), Bravo Núñez y Yáñez-Arancibia (1979), Yáñez-Arancibia (1978, 198la, 1981b), Amezcua Linares y Yáñez-Arancibla (1980), Blaber (1980), Yáñez-Arancibla y Lara Domínguez (1983), Yáñez-Arancibia et al. (1982a, 1985a), Alvarez Guillén et al. (1985). Del mismo modo, otros investigadores se refieren a la importancia de las interacciones entre la variabilidad ambiental de la zona costera y su alta productividad como una consecuencia ecológica. Templeman y Fleming (1953) muestran interesantes datos entre la variación de las condiciones hidrológicas y los cambios correspondientes que se producen a largo plazo en la abundancia de organismos marinos. Moore et al.(1970) correlacionó la distribución de los peces demersales de las costas frente a Louisiana y Texas con la influencia del Río Mississippi encontrando resultados significativos. Sutcliffe (1972) encontró una correlación positiva entre la captura comercial de camarones peneidos y la descarga fluvial en el Golfo de St. Laurence y, en la misma área, Sutcliffe (1973) discute las correlaciones entre las descargas fluviales estacionales y los desembarques comerciales de langosta americana y lenguado del Atlántico. Por otro lado, Copeland et al. (1974) encuentran que existe una programación de las migraciones nectónicas con pulsos de alta productividad en las zonas templadas; Stone (1976) asoció el flujo del Río Mississippi con la Captura comercial de camarones peneidos y clupeidos, a su vez, Turner (1977) reporta que la captura comercial de peneidos está correlacionada con la latitud en áreas de vegetación intermareal en la zona costera, y con las condiciones hidrológicas que las controlan como clima y descarga fluvial. Stone et al. (1978) concluyen que las pesquerías neríticas están relacionadas con las áreas de pantanos intermareales. Son muy diversos los trabajos que correlacionan los distintos factores que influencian la producción de recursos acuáticos, algunos otros trabajos que cabe mencionar son Livingston (1976), Oviatt y Nixon (1973), Heck (1977) y Ogren y Brusher (1977) quienes correlacionan algunos parámetros específicos de las comunidades (como diversidad y abundancia) con variaciones ambientales como salinidad, temperatura, profundidad de áreas costeras en distintas regiones. Otros factores que han recibido especial atención a este respecto son tratados en los trabajos de Gunter (1967), Lauff (1967), Walne (1972), Odurri y Heald (1975), Dursma (1980), Livingston (1981), Arnistrong (1982), Darnell et al. (1983) donde se menciona la importancia del aporte fluvial, nutrientes y materia orgánica así como el material foliar de manglares y pastos marinos que tienen gran importancia en la productividad de la zona costera. En investigaciones colaterales sobre producción primaria y regiones biológicas específicas del Golfo de México Day et al. (1982, 1983); Deegan et al. (1983, 1984a, 1984b), hacen referencia a las variables físicas, químicas y la influencia de áreas de vegetación litoral sobre la proclucción prirriaria en el Golfo de México. Los peces demersales y el ecosistema en la región de los estudiosComplementarios con el planteamiento anterior, es importante mencionar que en la región de los estudios del presente trabajo se han realizado investigaciones en las que se establecen los parámetros biológicos de interacción entre la Sonda de Campeche y la Laguna de Términos, en base a la estructura de las comunidades de peces y las variables físicas que controlan su abundancia, magnitud y persistencia. Yáñez-Arancibia et al. (1980) reportan que la producción de peces en Laguna de Términos es mayor en las áreas fluvio-lagunares que en las áreas de mayor influencia marina; Sánchez-Gil et al. (1981) proponen que la diversidad, distribución y abundancia de las comunidades de peces de la Sonda de Campeche, están altamente relacionadas con la batimetría, tipos de sedimento y la influencia ecológica de la Laguna de Términos y otros sistemas estuarinos adyacentes, Yánez-Arancibia et al. (1985c) mencionan que algunos de los principales parámetros ecológicos de las poblaciones de peces como son diversidad, distribución y abundancia en la zona costera, están controlados por variables físicas diversas y complejas, y que sólo interpretando ecológicamente el sistema ambiental se pueden encontrar las explicaciones de los patrones de comportamiento alimentarlo y reproductivo de las comunidades de peces, así como a los mecanismos de la productividad de la plataforma continental. Por otra parte, dentro de estos estudios se han considerado como aspectos de gran interés, las relaciones de intercambio estuario-plataforma entre la Laguna de Términos y la Sonda de Campeche; para lo cual se tienen como referencia la información de la fauna ictiológica de la misma Laguna de Términos correspondientes a los estudios realizados desde 1976 hasta la fecha por Yánez-Arancibia (1978), Bravo-Núñez y Yáñez Arancibia (1979) Yáñez Arancibia y Amezcua Linares (1980), Vargas Maldonadoet al. (1981), Lara-Domínguez et al. (1981), Aguirre León et al. (1982), Díaz Ruiz et al. (1982), Mallard Colmeneroet al. (1982), Yáñez-Arancibia y Day (1982), Yáñez-Arancibia et al. (1982a). En estos trabajos se discuten tanto procesos físicos como aspectos biológicos y ecológicos de las poblaciones de peces de la Laguna de Términos. Como resultado de varios años de investigación sistematizada en la región de los estudios, Yáñez Arancibia y Sánchez-Gil (1983) por medio del análisis de características físicas, biológicas y ecológicas, han establecido preliminarmente la caracterización y comportamiento ambiental de la Sonda de Campeche, delimitando dos hábitat o subsistemas ecológicos que le dan al área una estructura y funcionamiento muy particulares. La dinámica de las aguas neríticas y sus relaciones con los sistemas estuarinos propias de la zona costera, determinan características hidrológicas muy especiales en el área. Otra característica sobresaliente de esta área son las dos provincias sedimentarias del sur del Golfo de México con las cuales se presenta una elevada correlación ecológica con los dos hábitat de la Sonda de Campeche. Estos dos ambientes interactúan con los ambientes ecológicos de la Laguna de Términos y en conjunto definen un complejo sistema en la zona costera del sur del Golfo de México (Yáñez-Arancibia y Day, 1982; Yáñez-Arancibia y SánchezGil, 1983 y Yáñez Arancibia et al., 1983a). Los estudios prospectivos de las poblaciones de peces demersales de la Sonda de Campeche, se iniciaron en el Instituto de Ciencias del Mar y Limnología de la UNAM, con el Programa OPLAC/ P (Oceanografía de la Plataforma Continental de Campeche/ Peces) en junio de 1978. Los resultados permitieron establecer premisas en la interpretación del sistema ecológico y los parámetros biológicos y ecológicos de la estructura de las comunidades de peces (Sánchez-Gil et al., 1981). Posteriormente, estas investigaciones continuaron desarrollándose consideradas como uno de los aspectos centrales del Proyecto de Investigación: "Análisis Comparativo de las Poblaciones de Peces de la Sonda de Campeche y de la Laguna de Términos, antes y después del Derrame Petrolero del Pozo IXTOC-1", entre mayo de 1980 y septiembre de 1982, el cual formó parte del Programa Coordinado de Estudios Ecológicos de la Sonda de Campeche, PEMEX (Yáñez Arancibia et al., 1982b). Ambos proyectos estuvieron auspiciados por la Universidad Nacional Autónoma de México (UNAM-ICML). Otras proyecciones de estas investigaciones se han encaminado hacia dar a conocer los recursos de peces demersales existentes en el área, con una visión general de su potencialidad como recursos en el Proyecto: "Inventario Evaluativo de los Recursos de Peces Marinos del Sur del Golfo de México (Los Recursos Actuales, los Potenciales Reales y Perspectivas)" entre, 1983 y 1984, auspiciado por el Programa Universitario de Alimentos (PUAL) y el propio Instituto de Ciencias del Mar y Limnología. El desarrollo de estas investigaciones enmarca, identifica y define el programa a largo plazo sobre: "Ecología y Evaluación de las Pob1aciones de Peces en Ecosistemas Tropicales Costeros del Sur del Golfo de México (Sonda de Campeche y Laguna de Términos)", con el cual además de contribuir al conocimiento de dichos recursos en términos de su composición de especies y patrones de distribución, han permitido evaluar la abundancia real de estas comunidades cuyo aprovechamiento se encuentra latente frente a los que ya son explotados en el área. Antecedentes en las costas de México para los peces demersales costerosEn México, los antecedentes que se encuentran en docuocumentos publicados y por, lo tanto accesibles para su consulta en las bibliotecas, se concen desde hace veinte años: En elOcéano Pacífico y elGolfo de California, probablemente los trabajos de Ramírez Hernández et al. (1964, 1965), deben considerarse pioneros proporcionando las primeras listas faunísticas de los peces comunes en los arrastres camaroneros. Chávez y Arvizu (1972) y Rosales (1976) ya sugieren (que esta pesca puede representar un recurso importante en el Golfo de California. Recientemente dos trabajos pueden considerarse importantes por, sus avances significativos en el Pacífico y Golfo de California: Pérez Mellado et al. (1983) y Hendrickxet al. (1984). Pérez Mellado et al. han integrado los resultados de las capturas de arrastres examinadas por Young y Romero (1979) y Pérez Mellado (1980), para reportar que los peces demersales como fauna acompañante están constituidos por 105 especies de 52 familias, con una proporción peces/ camarón = 9,8: 1 y un rendimiento promedio de 90 Kg/hr, concluyendo que la pesca acompañante potencial de la regiones de 1.6 x 105 ton/año. Hendrickx et al.(1984) señalan un rango de variación entre 2.4 y 327.5 Kg/ hr; en las aguas someras los peces pueden dominar hasta un 86% en biomasa pero a mayor profundidad los crustáceos dominan las capturas hasta con el 93% de la biomasa mientras que el resto de los invertebrados del fondo raramente superan el 20% de la biomasa; ellos reportan como relación fauna acompañante/camarón un rango de 11.76 hasta 34.6:1. Aun cuando los métodos usados en estos dios varían (en su esfuerzo y cálculos de captura máxima) los valores reportados indican una alta potencialidad de estos recursos en dichas áreas. Para las costas del país en elGolfo de México, Gunter (1952), Carranza (1959), Hildebrand et al. (1964), y Reséndez (1971), pueden ser referencias útiles. Deben considerarse algunos antecedentes fundamentales como el trabajo de Sauskan y Olachea (1974) sobre peces comunes de la fauna acompañante del camarón reportando resultados de los convenios cubano-soviéticos, Klima (1976) proporcionado datos primarios sobre evaluación de las poblaciones en la Sonda de Campeche con el auspicio de la FAO. Bullis y Carpenter (1968) destacando la potencialidad de las pesquerías no explotadas en el Atlántico centro-occidental y Moore et al. (1970) Chittenden y Mc Eachran (1976) y Darnellet al. (1983), que orientan las investigaciones sobre los recursos demersales con un fuerte fundamento ecológico más que pesquero pragmático, con lo que señala la orientación de la literatura contemporánea sobre el tema en el Golfo de México como recientemente lo indica Yáñez Arancibia (1984). El programa de investigaciones que desde 1978 desarrolla el Laboratorio de Ictiología y Ecología Estuarina (ICML, UNAM), mencionado en el inciso anterior de este trabajo, ha producido diversas investigaciones con las siguientes referencias: Sánchez-Gil et al. (1981), Yánez-Arancibia (1984, 1985a y et al. 198la, 1982a, 1982b, 1983b, 1984, 1986, 1985a, 19851), 1985c, 1985d). Recientemente, Yáñez-Arancibia (1985a) ha editado un libro sobre los recursos demersales asociados a pesquerías clásicas de camarones peneidos, analizando la magnitud, ecología y aprovechamiento de los recursos potenciales, las perspectivas biotecnológicas de su utilización, así como también discutiendo aspectos conceptuales y metodológicos de estos tópicos de ecología pesquera. El libro se refiere a las costas del Pacífico y del Golfo de México a través de investigaciones de Amezcua-Linares (1985), Hendricx (1985), Vander Heiden (1985), Pérez-Mellado y Findley (1985), incluyendo como marco comparativo algunas referencias internacionales Penchaszadeh (1985), Alvarez-León (1985), Allsopp (1,985) y Pauly y Neal (1985). Los diversos capítulos que se abordan coinciden en señalar que en México estos recursos tienen una potencialidad de alrededor de 200 mil toneladas anuales en el Pacífico, con más de 200 especies y una proporción de volumen promedio de 10 a 1 de fauna/ camarón; además de otra potencialidad adicional de cerca de 300 mil toneladas anuales en su costas de¡ Golfo de México con más de 250 especies y una proporción de volumen promedio de 12 a 1 fauna/camarón (Lám. 1). Estos resultados son un atractivo ejemplo para el país de la importancia a escala interregional de las nuevas opciones para futuras investigaciones, docencia, explotación y manejo de recursos Potenciales en costas tropicales. Más aún, cuando se conoce que a nivel mundial se requerirá para el año 2000 más de 150 millones de toneladas de recursos pesqueros; es decir, el doble de las capturas actuales en el mundo. Área de EstudioEl Golfo de México es una de las cuencas más grandes de los litorales del Océano Atlántico. Junto con el Mar Caribe, conforma una área dominada por procesos tropicales y subtropicales, y constituye una región definida corno el mediterráneo americano. Dentro de las principales características de la zona costera del Golfo de México, se destaca la presencia de ríos, lagunas costeras, ambientes estuarinos y zonas con vegetación costera. Yáñez Arancibla et al. (1985c) con datos de cartas y mapas oficiales han estimado una superficie total de estuarios y lagunas de 3 710 km² para el litoral mexicano del Golfo, 4 510 km² de vegetación de la zona costera en áreas predominantemente pantanosas y la descarga de ríos en un total de 146 x 109m³/año. Prácticamente en todo el este de la República Mexicana abundan los ríos que drenan hacia el Golfo, algunos de ellos son particularmente importantes como el Pánuco, el Papaloapan y el complejo del sistema Grijalva-Usumacinta, este último es la descarga fluvial más grande de América del Norte después del Río Mississippi. Asimismo, existen importantes lagunas costeras destacando por su extensión Laguna Madre (Tamaulipas), Laguna de Tamiahua (Veracruz), Laguna de Términos (Campeche). Una característica climática de esta región es la presencia de "nortes" Estos son vientos fuertes o tormentas de invierno, causados por frentes fríos anticiclónicos, predominando de octubre a febrero, en otras épocas del año los vientos predominantes son del este-sureste. Deegan et al. (1984a y 1984b) integran aspectos ecológicos del litoral del Golfo de México. La Sonda de CampecheLa Sonda de Campeche forma parte de la plataforma continental al noroeste de la Península de Yucatán, al sur del Golfo de México. Se extiende en un área de aproximadamente 90 000 Km², desde los 200 m de profundidad hasta la línea de playa. La zona donde se realizó este estudio, se localiza en el extremo oriental de la Plataforma Continental de Campeche frente a la Laguna de Términos, entre los 18º 30'-20º 15' N y 91º 00' - 93º 00' W. Se consideraron como límites convencionales para este estudio, la influencia fluviodeltaica del sistema Grijalva-Usumacinta en la región occidental, la Ciudad de Campeche y la influencia del Río Champotón en la región oriental, y desde la línea de costa hasta la isóbata de 8O m aproximadamente (Fig. 1). ClimaEn el sur del Golfo de México en los estados de Tabasco y Campeche, el clima es húmedo con lluvias abundantes en verano y una precipitación anual extrema hasta de 4 500 mm en las tierras bajas, por lo que se presenta aquí la vegetación costera mejor establecida mientras que hacia el sureste de la Península de Yucatán el clima es subhúmedo. Para la región de la Laguna de Términos y áreas adyacentes, de acuerdo principalmente al criterio de García (1973) la temperatura anual promedio supera los 26ºC y la precipitación anual varía entre los 1100 y 2000 mm. La radiación solar promedio (anual) en la zona costera de esta región, es de 400 langleys/ día (Almanza y López, 1975). Los vientos tienen una dirección dominante de E a SE durante todo el año con una intensidad máxima de 8 nudos, exceptuando el mes de octubre donde predominan del N a NW y varían de 50 a 72 nudos. Se caracterizan tres estaciones Climáticas definidas: de junio a septiembre la época de lluvias, de octubre a febrero la época de "nortes" o tormentas de invierno y de febrero a mayo la época de secas. 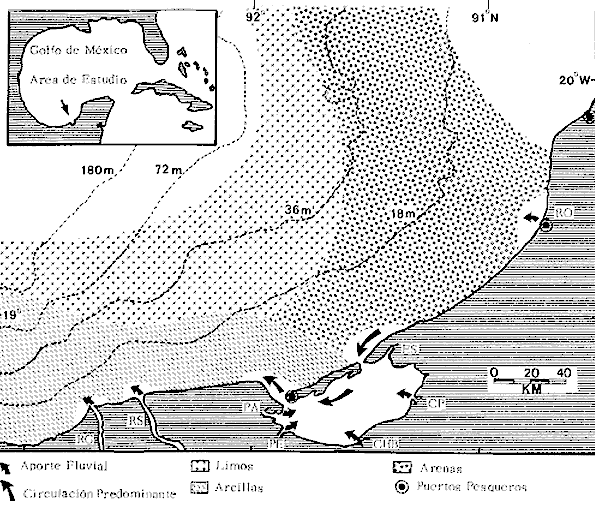 Fig. 1. Área de estudio. El mapa muestra la Sonda de Campeche frente a la Laguna de Términos. La zona donde se realizó este estudio se localiza en el extremo oriental de la Plataforma Continental de Campeche entre los 18°30'-20°15' N y 91°00'-93°00' W. Se señalan los principales rasgos fisiográficos, destacándose las fuentes de aporte fluvial; hacia el occidente el sistema Grijalva -Usimacinta (RG y RS) hacia la zona central los sistemas fluviolagunares dentro de la Laguna Términos: Pom Atasta ( PA), Palizada del Este ( PE), Chumpán Balchacah (CHB), Candelaria Panlau (CP) y Estero Sabancuy (ES); por último al extremo oriental el Río Champotón (RO). Se muestra gráficamente la distribución de los sedimentos tipo en el área y la unión de las provincias sedimentarias (terrígena y carbonatada) del sur del Golfo de México. Además se indican los principales rasgos batiméricos. Por su importancia en el área se señala el patrón de circulación predominante en la Laguna de Términos. Topografía, geomorfología y sedimentosLa planicie costera del Golfo de México desciende suavemente de la Sierra Madre Oriental como una planicie costera típica, ancha y de pocos relieves. La plataforma continental es muy angosta frente a Veracruz y en ciertas regiones tiene de 8 a 10 km pero se ensancha significativamente hacia el sureste, y frente a Campeche y Yucatán tiene más de 150 km. La superficie de la plataforma de Yucatán y parte de Campeche es carbonatada, la de Tabasco y parte de Campeche es terrígena. En la región de estos estudios, frente a la Laguna de Términos, se presenta el área de transición sedimentológica entre las provincias deltaica (al occidente) y carbonatada (al oriente) del Golfo de México, teniendo corno fuentes principales de aporte, el sistema fluvial Grijalva Usumacinta y la plataforma carbonatada de Yucatán respectivamente (Galsoff, 1954; Gutiérrez Estrada, 1977; Lankford, 1977). Esto se correlaciona con la climatología, descarga fluvial y procesos costeros (Fig. 1). HidrologíaLa dinámica de las aguas neríticas contribuye a determinar en el área de estudio una alta complejidad ambiental. El aporte de las aguas epicontinentales y estuarinas propias de la zona costera, la fisiografía costera y las corrientes litorales son los principales factores que la caracterizan hidrológicamente (Villalobos y Zamora, 1975 y 1977; Sánchez-Gil et al., 1981; Yáñez-Arancibia y Sánchez Gil, 1983). Mancilla y Vargas (1980) y Graham et al. (1981) han demostrado que a través de la Boca del Carmen se produce el flujo neto de la Laguna de Términos hacia la plataforma continental adyacente y son diversos los trabajos que hacen referencia a la trascendencia ecológica de este flujo en las interacciones entre estos sistemas, como son el intercambio físico, químico y biológico (Bravo Núñez y Yáñez-Arancibia, 1979; Sánchez-Gil et al., 1981; Yáñez-Arancibia y Lara-Domínguez, 1983; Yánez-Arancibia y Sánchez-Gil, 1983; Yáñez-Arancibia et al., 1982a, 1983a, 1985a, 1985b; Alvarez Guillén et al., 1985) (Fig. 1). Las mareas en el Golfo de México son predominantemente diurnas con excepción de la Sonda de Campeche. En Ciudad del Carmen la marca es mixta-diurna y en Campeche es mixta-semidiurna (Grivel Piña, 1969 y comunicación personal). Este autor ha establecido que el promedio del rango de las marcas para el sur del Golfo de México es de 0.48 m y la variación del nivel del mar anual promedio es de -0.0504 a + 0.0892 m. Emillsson (1976) indica que las corrientes litorales en el área de la Sonda de Campeche son de 6 cm/ seg y en general la velocidad de las corrientes a 90 km de la costa son de 1 a 2 nudos, especificando que las corrientes más cercanas o litorales son mayores. Producción primariaLa productividad de la zona lagunar-estuarina adyacente a la Sonda de Campeche varía en un rango de concentraciones de clorofila a de 0.3 a 8.2 mg/m³ (Day et al., 1982). En la zona marina se encuentran concentraciones más bajas, que van de 0.53 a 0.86 mg clorofila a/m³ (Licea Durán et al.,1982). Estas características de producción primaria de la zona costera, contrastan con los valores del océano abierto. Por ejemplo, para el Golfo de México los valores de productividad primaria son en general bajos con un valor promedio de 0. 1 gC/ m²/ día y son valores típicos para regiones tropicales (Margalef y Estrada, 1980). En relación a los datos de clorofila a, EL-Sayed (1972) indica un valor promedio para el Golfo de México de 0. 2 mg clorofilaa/m³, y este autor enfatiza que el valor más alto para la costa de México se localiza en el área de Veracruz-Tabasco con un valor de 2.35 mg clorofilaa/m³. Licea Durán et al.(1982 y comunicación personal) considera que los valores de biomasa fitoplanctónica más altos se encuentran en la zona costera, en especial en áreas de influencia fluvial; el rango que reporta este autor son valores promedios de 0.86 mg en época de nortes y 0. 53 mg clorofilaa/m³ en época de secas. Agrega este autor que la zona oceánica adyacente presenta valores promedio de 0.05 mg y sin fuertes cambios a través del año. Licea Durán indica que la productividad primaria de la Bahía de Campeche oscila en un rango entre 0.04 y 2.36 mg C/m³/hora. El-Sayed (1972) opina que la distribución de los valores de productividad primaria sigue un patrón de distribución similar a los valores de biomasa fitoplanctónica. Dinámica ambiental y aspectos ecológicosLa dirección e intensidad de la circulación costera cambia estacionalmente; sin embargo, no se presenta una fuerte variación estacional de la temperatura y la radiación que recibe. En estas condiciones, se establece un gradiente fisicoquímico semipermanente de salinidad, pH, oxígeno disuelto y materia orgánica, debido principalmente al aporte de aguas epicontinentales y estuarinas propias de la zona costera. Estos procesos y la distribución de los sedimentos, determinan la existencia de dos hábitats o subsistemas ecológicos claramente delimitados, denominados Zona A y Zona B, cuyo comportamiento ambiental es ampliamente discutido por Sánchez-Gilet al. (1981), Yáñez-Arancibia et al. (1981, 1982b) y Yánez-Arancibia y Sánchez-Gil (1983). Estos dos ambientes o subsistemas de la Sonda de Campeche frente a la Laguna de Términos, son definidos de acuerdo a la circulación litoral, descarga fluvial, condiciones físicas y químicas de las aguas y características sedimentarias, como sigue: Zona A:con influencia estuarina, aguas turbias, transparencia 7-42%, salinidad 35-37‰, temperatura 25-28ºC, sin vegetación béntica, sedimentos limo-arcilloso con 10-16% de CaCO3, alto contenido de materia orgánica ( > 10%), pH 6.5-8.4, y oxígeno disuelto < 4 ml/l. Zona B: típicamente marina, aguas claras, transparencia 53-99%, salinidad 36-37%, temperatura 26-29ºC, pastos marinos y macroalgas, arenas con 70-90% de CaCO3, bajo contenido orgánico < 10%), pH 7.7-8.9 y oxígeno disuelto > 4 ml /1 (Fig. 2). Deegan et al. (1984a, 1984b) establecen importantes modelos de macroescala, analizando los mecanismos de producción primaria en los litorales del Golfo de México, con una orientación de correlaciones entre variables fisicoquímicas con la productividad primaria y la vegetación costera, Al mismo tiempo, Soberón-Chávez y Yánez-Arancibla (1985) y Yánez-Arancibia et al. (1985c) implementan métodos para manejar paquetes de información con un enfoque integral del ecosistema del Golfo de México, analizando maternáticamente los mecanismos de producción secundaria de los peces demersales. Estas cuatro referencias analizan la ecología y dinámica de las costas del Golfo con un enfoque general a nivel de ecología de sistemas, y representan un marco de referencia para futuros estudios en la región y la comprensión del ambiente y sus comunidades bióticas en el litoral de la Sonda de Campeche. La diversidad, distribución y abundancia de la biota -incluyendo las poblaciones de peces-, dependen no sólo de su organización biológica, sino también de la influencia del marco físico-ambiental que actúa como mecanismo de producción natural. Material y Métodos
Actividades de campoEn el periodo comprendido entre junio de 1978 y marzo de 1982 fueron realizados seis Cruceros Oceanográficos denominados OPLAC/ P (Oceanografía de la Plataforma Continental de Campeche/ Peces). Estos cruceros cubrieron una amplia zona de la plataforma continental del sur del Golfo de México, frente a la Laguna de Términos, entre los 18º30'-20º15' de latitud norte y 91º00' - 93º00' de longitud oeste, y desde 15 hasta 80 m de profundidad. 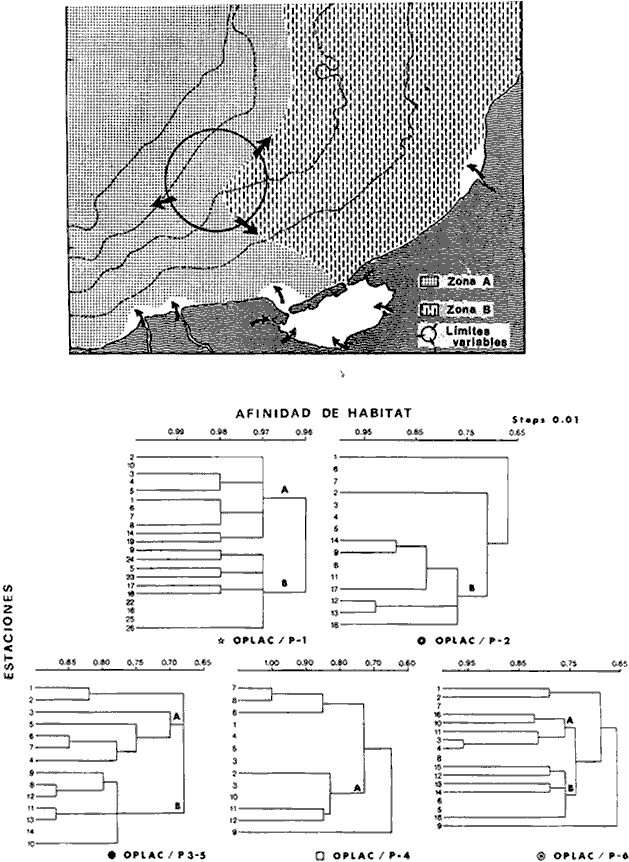 Fig. 2. El mapa muestra la distribución especial y temporal de las zonas o subsistemas ecológicos (A y B) propuestos para el ecosistema de la Sonda de Campeche, frente a la Laguna de Términos considerando la afinidad ecológica de las estaciones de colecta en base a las características ambientales. La Zona A muestra una elevada correspondencia con la provincia terrígena y el aporte de las aguas epicontinentales. La Zona B presenta correspondencia con la provincia carbonatada. Una frontera natural abierta y de límites variables se ubica en la zona de transición, indicándose con un círculo en el mapa. Los dendrogramas inferiores, corresponden a la agrupación de las estaciones de colecta ( para cada uno de los cruceros), indicando la afinidad ecológica del sistema. Por medio de método de "simple linkage clustering" se define en cada caso los subsistemas ( Zonas A y B ), que se delimitan especialmente en el cuadro superior a manera de modelo (ver explicación en el texto). Campañas oceanográficasEn estas campañas se realizó un total de 160 arrastres para captura de peces, en 81 estaciones de colecta. Para las capturas se utilizaron distintas embarcaciones equipadas con dos redes de fondo de tipo camaronero (redes comerciales) de 18 m (60 pies) de longitud y 9 m (30 pies) de abertura de trabajo y cada una con malla de 1 1/3 de pulgada. Estas redes operaron conjuntamente, arrastrando por las dos bandas de las embarcaciones, en lances de 1/2 hora para cada estación, a una velocidad media entre 2 y 3 nudos tanto de día como de noche. Los seis cruceros se distribuyeron temporalmente durante, las distintas épocas climáticas de la región como sigue (Fig. 3): - Crucero OPLAC/P-I. Efectuado en junio de 1978. Se realizó durante la época de lluvias a bordo de la embarcación camaronera "La Nueva Ley de Pesca", perteneciente a la Naviera Rex, S. A. Se muestreó un total de, 21 estaciones. - Crucero OPLAC/P-2. Efectuado en agosto de 1980, Se realizó durante la época de lluvias a bordo de la misma embarcación y con el mismo equipo de pesca. Se, cubrió una red de 18 estaciones similar al anterior con el fin de establecer comparaciones. - Crucero OPLAC/P-3. Efectuado en noviembre de 1980. Se realizó durante la época de nortes a bordo del B/O "Dragaminas-20" de la Secretaría de Marina. En este caso se usó una sola red de arrastre por popa pero de las mismas características. Se cubrió una red de 7 estaciones. En este crucero fueron realizadas capturas por duplicado (de día y de noche). El área muestreada se concentró hacia la zona oeste de la región de los estudios, puesto que allí se detectaron condiciones especiales influenciadas por el flujo de las aguas continentales procedentes de la Laguna de Términos (Sánchez-Gil et al., 1981). - Crucero OPLAC /P-4. Efectuado en julío de 1981. Se realizó durante la época de lluvias a bordo del buque de prácticas 'MARSEP-1' de la Secretaría de Educación Pública, con un equipo de pesca semejante a los anteriores. Se muestrearon 13 estaciones con un patrón de distribución semejante a los efectuados para los cruceros OPLAC/ P- 1 y OPLAC/ P-2. -Crucero OPLAC/P-5.Efectuado en octubre de 1981. Se realizó durante la época de nortes a bordo del buque de prácticas "MARSEP-1" de la Secretaría de Educación Pública. Se muestrearon 7 estaciones con un patrón de distribución concentrado hacia la zona este del área de estudio. La realización de este muestreo permitió complementar la información obtenida en el crucero OPLAC/P-3 durante la misma época climática. Las dos colectas específicas permiten disponer de una red de 14 estaciones consideradas en estos estudios en conjunto como el Crucero OPLAC/ P 3-5. - Crucero OPLAC/P-6. Efectuado en marzo de 1982, para concluir con las actividades de campo de este proyecto. Se realizó durante la época de secas a bordo del buque de prácticas "MARSEP-1", de la Secretaría de Educación Pública. En esta campaña se muestraron un total de 18 estaciones con un amplio patrón de distribución que abarcó el total del área delimitada para estos estudios. Registro de datos y obtención de parámetrosEn cada una de las estaciones de colecta de estos muestreos fue obtenido el registro de 13 parámetros principales, i. e., parámetros de referencia y ambientales: (Tablas 1 a 7). Parámetros de Referencia de la Estación 1. Posición geográfica. La posición de los lances de pesca se determinó mediante tres distintos métodos principales, dependiendo del equipo de, navegación con que contaron las distintas embarcaciones: a) navegación por estima, b) navegación por satélite y, c) radiogoneómetro. Tomándose siempre en consideración, corno referencia, la velocidad, el rumbo del transecto y el tiempo de navegación. 2. Hora local. 3. Tiempo de arrastre. El tiempo de arrastre fue de 30 minutos, y sólo en algunos casos se redujo por cambio desfavorables del fondo, Para todos los casos el tiempo efectivo de pesca se consideró corno aquel que transcurre entre el momento en que la red toca el fondo y comienza a pescar, hasta el momento en que se inicia la operación de recobrarla. 4. Velocidad de arrastre. La velocidad a lo largo de cada arrastre durante el tiempo efectivo de pesca, fue de 2 a 3 nudos. 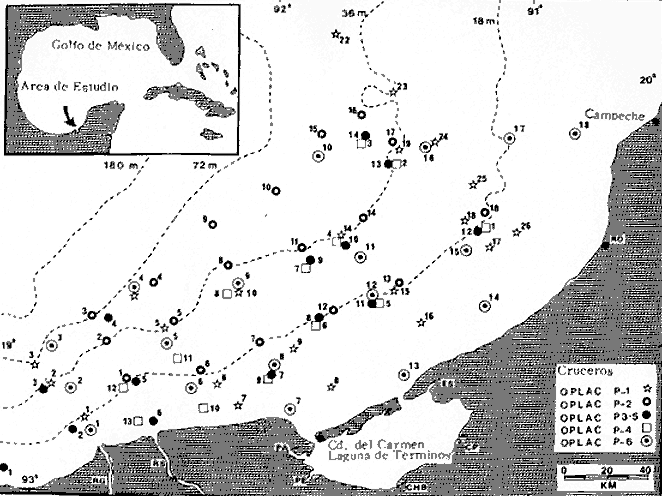 Fig.3 Se destaca el área de distribución de los seis cruceros realizados entre 1978 y 1982, teniendo como límites convencionales la influencia fluvio-deltaica del Sistema Grijalva-Usumacinta en la región Occidental, la Ciudad de Campeche y la influencia del Río Champotón en la región oriental desde la línea de costa hasta la isóbata de 80m. Los cruceros denominados OPLAC/P (Oceonografía de la Plataforma Continental de Campeche/ Peces. Los cruceros fueron distribuidos estacionalmente representadndo cada una de las épocas climáticas marcadas en el área.; OPLAC/P-1, junio de 1978 (lluvias); OPLAC/P-2, agosto de 1980 (lluvias); OPLAC/P-3, noviembre de 1980 (nortes); OPLAC/P-4, julio de 1981 (lluvias); OPLAC/P-5, octubre de 1981 (nortes) y PLAC/P-6, marzo de 1982 (secas). Las abreviaturas corresponden a los principales sistemas de aporte fluvial y/o estuarino; RG-Río Grijalva, RS-Río San Pedro, PA-Pom Atasta, PE-Palizada del Este, CHB-Chumpan-Balchacah, CP-Candelaria-Panlau, ES-Estero Sabancuy y RO-Río Champotón. 5. Area cubierta de arrastre. Para cada lance fue calculada el área de barrido de arrastre de acuerdo a la metodología de FAO para la región del Caribe y Golfo de México (Stevenson, 1982), de la siguiente manera: A = (v x T) L ... (1) donde A = área de arrastre; v = velocidad de arrastre; T = tiempo efectivo de arrastre y L = abertura de trabajo de la red (9 m). Para este método se asume que los arrastres tienen una abertura horizontal igual al 60% de la longitud de la relinga superior. Autores corno Chittenden y McEachran (1976) han utilizado el mismo método y redes similares, adoptado en estos estudios, estimando sus datos según la fórmula (1) en el norte del Golfo de México. Parámetros Ambientales 1. Profundidad. La profundidad fue considerada como la altura de la columna de agua a la que fueron realizadas las capturas de peces. Se midió utilizando una ecosonda de penetración y eventualmente estimaciones del patrón de pesca y estimaciones cartográficas de acuerdo a la ubicación latitudinal de la estación. 2. Transparencia. La transparencia del agua se consideró como una estimación cualitativa de la turbidez en la columna de agua y se expresa corno la relación porcentual entre la profundidad de la estación y la profundidad de extinción del disco de Secchi. Esta relación indirecta se usa como un índice ecológico en interpretación del ambiente en el estudio de la zona costera como sigue: T = (t/p) 100 ... (2) donde T = porcentaje de la transparencia, t = extinción del disco de Secchi en un muestreo, y p = profundidad en el muestreo correspondiente. 3. Sedimento tipo. La distribución de los sedientos tipo en el área de estudio, se realizó conforme al modelo propuesto por Yáñez-Arancibia y Sánchez-Gil (1983), el cual se desarrolló basándose en los trabajos de Price (1954), Lynch (1954), Gutiérrez-Estrada (1977) y Sánchez-Gil et al. (1981). Ellos destacan las dos áreas geológicas de la zona costera del sur del Golfo de México y las dos provincias sedimentarias de la plataforma continental que allí confluyen, i. e., carbonatada y terrígena. 4. Macrofauna béntica. Durante los arrastres de peces se obtuvo información complementaria de la fauna béntica asociada, la cual se considera de gran valor ecológico para la completa descripción ambiental del área y la ecología de las comunidades de peces en este estudio. Esta información fue ordenada numeralmente según los principales grupos presentes. En las Tablas 1 a 7 se señalan: 7 decápodos, 6 = moluscos, 5 = ascidias, 4 estomatópodos, 3 = Equinodermos, 2 = celenterados y 1 = otros. Los parámetros hidrológicos fueron obtenidos mediante métodos convencionales, usando una hidrocala estándar, registrándose para cada caso sólo los datos de superficie y fondo. 5. pH. El pH del agua se determinó mediante un potenciómetro Beckman. Los registros de este parámetro fueron complementados con los resultados obtenidos por Licea Durán 1980 y et al.,1982). 6. Salinidad. Los datos de salinidad fueron medidos utilizando tres distintos métodos principales: a) por el índice de refracción, utilizando un refractómetro, b) determinación de clorinidad, por medio del método de Knudsen (Strickland, 1958), y c) por conductividad, utilizando un salinómetro de inducción. 7. Temperatura. Los datos de temperatura fueron medidos utilizando dos métodos principales: a) termómetro de cubeta (básicamente para algunas muestras de superficie) y, b) termómetro reversible. 8. Oxígeno disuelto. Los datos de oxígeno disuelto fueron obtenidos en base a los métodos de: a) Winkler (modificado por Carrit y Carpenter 1966) y, b) por el método polarográfico, utilizando un oxímetro. Los resultados de los parámetros ambientales y su análisis ecológico se presentan en dendrogramas de similaridad de estaciones para las diferentes épocas muestreadas de manera comparativa (Fig. 3). Manejo de las capturas de pecesCada una de las capturas obtenidas fue analizada a bordo y procesada en su totalidad (100%) como sigue. Los peces fueron separados por especies tomándose como datos básicos de cada una: a) peso total en gramos, b) número total de individuos y c) rango de tallas en longitud total (LT), En los casos en que las capturas fueron muy abundantes, se procedió en primer término a: a) extraer las expecies raras; b) homogeneizar la captura; c)extraer una alícuota que siempre fue entre el 50 y 75%, esta alícuota fue procesada íntegramente y se implementó una estimación de peso, número y diversidad al total del volumen capturado; d) las especies dominantes fueron procesadas a bordo en biomasa, número de individuos y rango de tallas y, e) el resto de la captura fue trasladado al laboratorio (Láms. 2, 3 y 4). 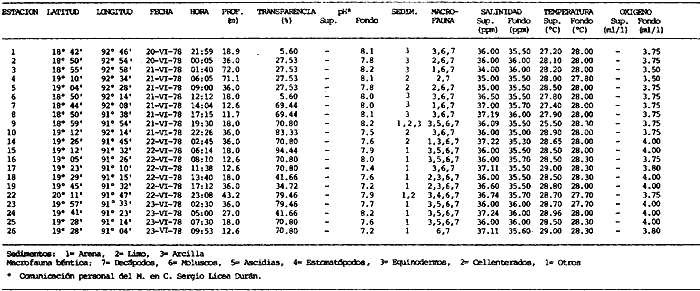 TABLA 1. CRUCERO OPLAC/P-1. ESTACIONES DE COLECTA DEL ÁREA DE ESTUDIO. PARÁMETROS AMBIENTALES Y CARACTERIZACIÓN DEL HÁBITAT. 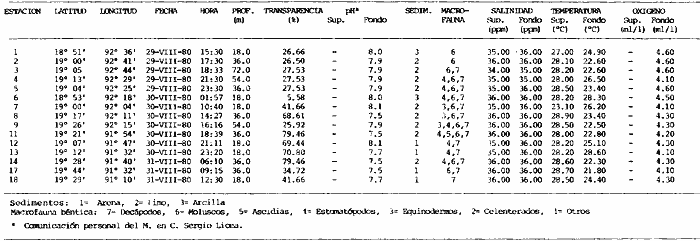 TABLA 2 . CRUCERO OPLAC/P-2. ESTACIONES DE COLECTA DEL ÁREA DE ESTUDIO PARA PARÁMETROS AMBIENTALES Y CARACTERIZACIÓN DEL HÁBITAT 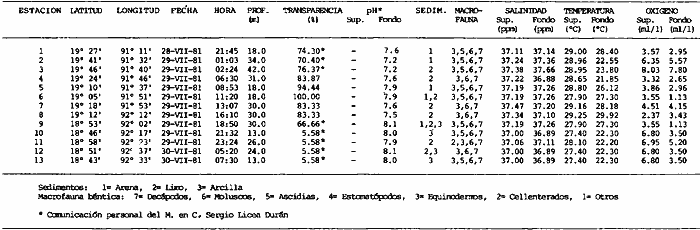 TABLA 3. CRUCERO OPLAC/P-4. ESTACIONES DE COLECTA DE ÁREA DE ESTUDIO PARÁMETROS AMBIENTALES Y CARACTERIZACIÓN DEL HÁBITAT. 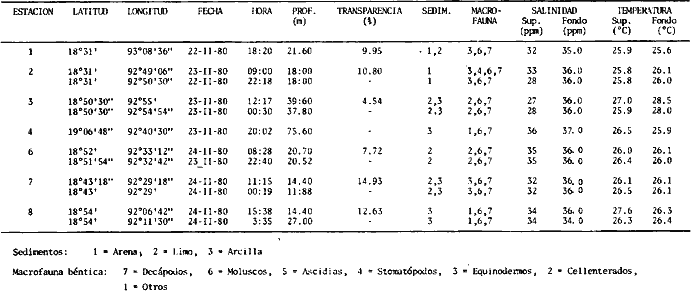 TABLA 4. CRUCERO OPLAC/P-3. ESTACIÓN DE COLECTA DE ÁREA DE ESTUDIO PARÁMETROS AMBIENTALES Y CARACTERIZACIÓN DEL HÁBITAT. 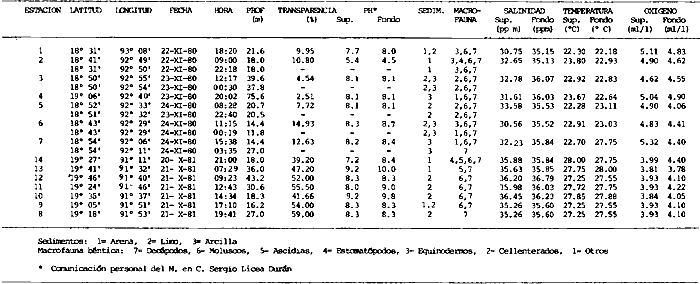 TABLA 5 CRUCERO OPLAC/P3-5. ESTACIONES DE COLECTA DE ÁREA DE ESTUDIO PARÁMETROS AMBIENTALES Y CARACTERIZACIÓN DEL ÁREA 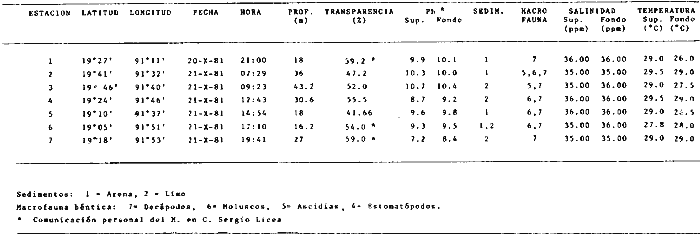 TABLA 6 CRUCERO OPLAC/P-5. ESTACIONES DE COLECTA DE ÁREA DE ESTUDIO PARÁMETROS AMBIENTALES Y CARACTERIZACIÓN DEL HÁBITAT. 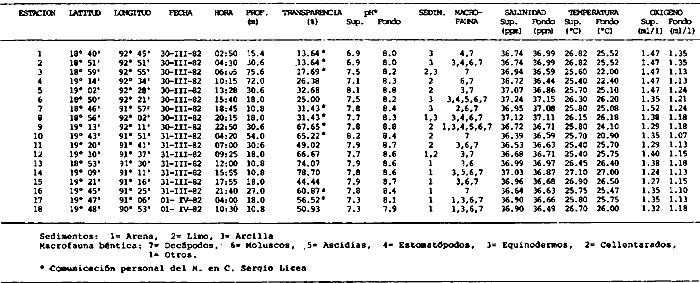 TABLA 7 CRUCERO OPLAC/P-6. ESTACIONES DE COLECTA DE ÁREA DE ESTUDIO PARÁMETROS AMBIENTALES Y CARACTERIZACIÓN DEL HÁBITAT.  Lám. 1. Recursos pesqueros potenciales. La lámina muestra una gran abundancia de recursos no convencionales en una típica captura demersal asociada a la pesca del camarón (penaeus spp). Se observa el calamar Lolliguncula brevis y los peces Raja texana Priacanthus arenatus, Synodus foetens, Lagocephalus leavigatus, entre otros.  Lám. 2. Manejo abordo de las capturas pesqueras demersales. Separación y procesamiento en fresco. Se observa Chloroscombus chysurus, Arius felis, Trichiurus lepturus, entre otros.  Lám. 3. Manejo abordo de las capturas pesqueras demersales. Separación y procesamiento en fresco. Se observan distintos macroinvertebrados bentónicos asociados a las capturas de peces demersales; Callinectes spp, Penaeus spp, Lytechinus variegatus, Echinaster serpentarius, Luidia clathrata y Porifera. En peces se observa el dorso de Porichthys porosissimum, el costado de Anchoa sp y Eucinostomus gula.  Lám. 4. Típica captura de comunidades de peces demersales en el Sur del Golfo de México, Entre macroinvertebrados se observan puestas de gasterópodos, Lychinus variegatos. En peces se observa Rhinobatus Lentiginosus, Prionotus evolans, Stephanolepis spp. Chaetodipterus faber. Archosargus rhomboidadis, Acanthostracion quadricornis, Equetus lansceolatus, Harmulon aurolineatum, Harmulon plumieri, Lutjanus capechanus, Arius felis, Chilomycterus schocpfy, Ogcocephalus raditans, Calamus penna, Sphoeroides spp. Todos los organismos fueron fijados con formalina al 10% neutralizada con borato de sodio, incluyendo la fijación de víceras por inyección. Fueron etiquetados y empacados para su traslado al laboratorio. Los invertebrados y otra fauna asociada de cada arrastre fue separado por grupos taxonómicos, obteniéndose el peso total de cada uno (Láms. 2, 3 y 4). Asimismo, fue trasladada al laboratorio una submuestra de fauna y flora asociadas, la cual fue fijada de manera semejante a los peces. Manejo de las colecciones
Análisis taxonómicoEn el laboratorio los peces, flora y macroinvertebrados fueron separados, lavados, hidratados durante 24 hr; reetiquetados y envasados en frascos de vidrio, usando como preservador alcohol metílico al 70%. Para el análisis preliminar de la ictiofauna se utilizaron instrumentos y técnicas diversas, entre los principales: microscopios estereoscópicos, balanzas granatarias y de reloj, ictiómetros convencionales. La identificación taxonómica de los peces se hizo empleando la literatura básica actualizada, principalmente los trabajos de Cervigón (1966), Randall (1970), Galawayet al.(1972), Topp y Hoff (1972), Franks et al. (1972), Perry y Perry (1974), SIC (1976), Hoese y Moore (1977), Fischer (1978), Castro Aguirre (1978), Guitart (1974, 1975, 1977 y 1978). Previo a esta literatura fue fundamental consultar en detalles técnicos los trabajos clásicos de Jordan y Evermann (1896-1900), Meek e Hildebrand (1923-1928), Norman (1934), Gunter (1945), Hildebrand (1954). Cada una de las especies, una vez identificadas, fueron catalogadas y debidamente etiquetadas se incorporaron a las colecciones de referencia de los peces demersales de la plataforma continental del sur del Golfo de México, depositadas en el Laboratorio de Ictiología y Ecología Estuarina del Instituto de Ciencias del Mar y Limnología (UNAM), con las claves ICML/ PSC 0293-0523. Análisis biológico de las poblaciones
Estructura tróficaLa posición trófica de las diferentes especies fue determinada en base al criterio utilizado por Yánez-Arancibia y Nugent (1977) y Yánez-Arancibia (1978); donde las categorías tróficas reconocidas son: 1)Consumidores de primer orden. En este grupo se incluyen organismos herbívoros, detritívoros y omnívoros, como son peces planctófagos (fito y/o zoo), filtradores, y consumidores de detritus vegetal y fauna de tamaño pequeño. 2)Consumidores de segundo orden. En este grupo se incluyen peces carnívoros, que consumen organismos del primer grupo incorporando en su dieta pequeñas cantidades de material vegetal y detritus. 3)Consumidores de tercer orden. En este grupo se incluyen los peces exclusivamente carnívoros, como son peces que se alimentan de los dos grupos anteriores, en los cuales los materiales vegetales y detritus son alimentos accidentales. Es muy difícil ubicar a los organismos con cierta exclusividad dentro de una categoría trófica específica dado que en el caso de los peces como en el de otros organismos, los hábitos alimenticios pueden cambiar con la edad, estación climática, disponibilidad de alimento y localidad. Madurez gonádicaEl estado de madurez gonádica se determinó de acuerdo a la escala de fases de desarrollo sexual para peces, propuesta por Nikolski (1963), donde las fases reconocidas son:  Análisis ecológico de las comunidadesPara la codificación y fácil manejo analítico, la información básica de cada una de las colectas totales de cada crucero, se concentró en tablas individuales, considerándose la distribución de especies, peso y número total de los individuos en cada estación de muestreo y en el total de la captura; así como su distribución porcentual de densidad, abundancia, y frecuencia total en la captura (Tablas 8 a 14). Esta información fue analizada estadísticamente desde distintos aspectos de la ecología, estructura y función de las comunidades estudiadas. Diversidad y abundanciaLa diversidad se consideró como el número de especies y la proporción de individuos por especie en cada una de las colectas. Para su estimación se utilizó la expresión matemática propuesta por Shannon y Weaver (1963): 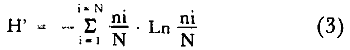 donde ni = número de individuos de cada especie en una colecta y N = número total de individuos de todas las especies en la colecta. Aún cuando esta función considera diversidad y abundancia, es recomendable utilizar también otros índices que tratan aspectos por separado. Así para el cálculo de la riqueza de especies como componente de la diversidad, se usó la siguiente expresión que ha sido utilizada por Margalef (1969) y otros autores:  donde S es el número de especies y N el número de individuos. El índice de equitatividad propuesto por Pielou (1966), obtiene información que permite estimar la desviación de la diversidad máxima e indirectamente estima la abundancia relativa. Se expresa como sigue:  donde Ln S es el valor máximo de H'. Entonces H' = H' max cuando las especies son igualmente abundantes. Del mismo modo se consideró un índice de biomasa que es una modificación a la expresión de Shannon y Weaver (1963), en la que se evalúa la diversidad por medio de la biomasa, reemplazando el número de individuos por su peso (Wilhin, 1968). La expresión matemática queda entonces: 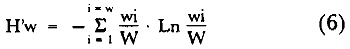 donde wi = gramos de una especie en una colecta y W = gramos totales de todas las especies de la colecta. Todos los cálculos de estos índices se efectuaron sobre la base de logaritmos naturales, lo que ha sido discutido por McErlean y Mihursky (1969). La abundancia de la ictiofauna fue determinada en términos de densidad de individuos por área (ind · m-2), y biomasa como "standing crop" (g peso húmedo · m-2). Para estimar la talla promedio de las poblaciones se calculó el índice de la proporción del peso por cada individuo (g · ind-1). FrecuenciaLa frecuencia (F) de aparición se consideró como la relación porcentual del número (N) de estaciones de muestreo en que apareció una especie determinada, con respecto al total (t) de estaciones de cada crucero, como sigue: F = (N/t) 100 ... (7) Distribución geográfica y área mínima de muestreoEl análisis de la distribución de las especies en el área fue desarrollado en base a su frecuencia de aparición en el total de las estaciones de muestreo, y sus variaciones durante las distintas épocas del año. Esta información se representa de dos maneras principales: a) curvas acumulativas de especies. Este análisis se realizó para cada una de las capturas totales o cruceros, determinándose en cada caso el área mínima, de muestreo, y b) se elaboraron mapas individuales de la distribución espacial y temporal de las especies dominantes. Este análisis permitió establecer modelos típicos de distribución de las especies y sus variaciones estacionales. Especies dominantesEn base a cuatro variables ecológicas principales, fueron determinadas las especies dominantes en las comunidades estudiadas: a) su abundancia numérica, b) su abundancia en peso, c) su amplia distribución y, d) su frecuencia de aparición. La magnitud cuantitativa de estas variables proporcionan el fundamento del criterio utilizado para establecer si una especie es dominante o no. Similaridad ecológicaCon la finalidad de conocer el grado de similaridad ecológica entre las distintas colectas, fue elaborado un programa de computación basado en los principios de "Cluster Analysis" (Davies, 1971). Dicho programa permitió efectuar dos análisis de agrupamiento por afinidad de las estaciones de muestreo con base en: a) la presencia y ausencia de especies y, b) las características ambientales, como se indica a continuación. Cada especie, y/o cada parámetro ambiental representaron un individuo y cada estación un carácter, la presencia de un individuo en una estación dada toma el valor de 2 y su ausencia un valor de 1. La suma de las características iguales compartidas por dos estaciones entre si, proporcionó el grado de similaridad entre ambas, este grado de similaridad tomó valores de 0 (ningún individuo en común) hasta 1 (todos los individuos en común), El procedimiento se repitió por pares de estaciones hasta, quedar todas comparadas entre sí. Al comparar cada estación con sí misma el coeficiente de similaridad fue de 1. Una vez calculados todos los coeficientes, se obtienen dos matrices de similaridad, esto es, una matriz simétrica entre individuos y otra entre caracteres, con una diagonal principal de similaridad de 1 (Davies, 1971). La segunda etapa correspondió al análisis "Cluster", específicamente para las especies y los parámetros ambientales en la Sonda de Campeche. Se buscó el mayor índice de similaridad después de 1 y las estaciones que lo compartieron formaron el primer grupo. Los grupos resultantes de estaciones parecidas fueron nuevamente agrupados a un nivel de similaridad menor. Este procedimiento se repitió por pasos de 0.01 disminuyendo cada vez el nivel de similaridad en esta proporción, encontrándose cada vez grupos con similaridades menores. El proceso se detuvo cuando se formó el grupo final en el cual quedaron agrupadas todas las estaciones. Los resultados se presentan en dendrogramas de estaciones vs especies y estaciones vs parámetros ambientales. Estos tipos de programas y algunas variantes han sido utilizados por Horn y Allen (1976), Warburton (1978), Chávez (1979), Daniels (1979), Yáñez-Arancibiaet al. (1980), Sánchez-Gil et al.(1981) y Vargas Maldonadoet al. (1981), en la delimitación de subsistemas o hábitats sobre la base de la afinidad ecológica de las poblaciones de peces y su correlación con los parámetros ambientales. Evaluación de las comunidades de peces como recursos: enfoque ecológicoCon el fin de establecer algunas consideraciones sobre la potencialidad de las comunidades de peces de estos estudios, las capturas fueron evaluadas desde el punto de vista ecológico de los recursos, utilizando métodos y modelos para pesquerías tropicales multiespecíficas convencionales. Se consideran como referencias selectas los trabajos de Saila y Roedel (1980), Pauly (1980), Pauly y Mines (1982), Pauly y Murphy (1982), Stevenson (1982), FA0-CIID-IDRC (1983). Captura por unidad de esfuerzoLa captura por unidad de esfuerzo (CPUE), depende de la densidad de peces y del coeficiente de capturabilidad, Klima (1976) y Stevenson (1982) realizaron el ajuste de diferentes tasas de captura de peces, en base a la longitud de la relinga superior, determinando el coeficiente de capturabilidad (q) de diferentes arrastres para peces, con una regresión empírica de la captura observada por unidad de área, versus el tamaño de la red expresado en el tamaño del largo de la relinga superior, Se encontró que no hubo diferencias en las tasas de CPUE para capturas de camarón, aun cuando los arrastres fueron hechos con redes de relinga superior de tamaños distintos, otorgándoseles el valor q = 1 para un arrastre estándar para peces con una relinga superior a 28.9 m de longitud. La CPUE entonces, se consideró para estos estudios como un índice de densidad de la población en valores de biomasa, en relación al esfuerzo de pesca por unidad de tiempo de arrastre, calculándose de la siguiente forma: CPUE = c/T ... (8) donde CPUE = captura por unidad de esfuerzo, c = densidad de la captura en biomasa (Kg) y T = tiempo de arrastre en horas. Distribución y abundancia de los recursos por estratos batimétricosLa composición de las capturas de recursos demersales se realizó para dos estratos, establecidos por criterio en base al comportamiento ecológico de los peces demersales en la zona costera, derivado de los estudios de Mooreet al. (1970), Sauskan y Olachea (1974), Chittenden y McEachran (1976), Klima (1976), Ehrhardt et al.(1977 y 1982), Sánchez-Gil et al. (1981), Stevenson (1982) y Darnell et al. (1983). Estos estratos son las isóbatas de < 20 m y > 20 m. De esta forma se calculó la captura por unidad de esfuerzo (Kg/hr) y la relación porcentual, para todas las estaciones de muestreo cubiertas para cada estrato. Este análisis se llevó a cabo por separado para: 1) las especies dominantes de mayor importancia comercial como son: corvinas, guachinangos, bagres, mojarras y, 2) para las capturas totales en las diferentes épocas climáticas muestreadas; esto es, la diversidad total de la comunidad. Biomasa por estratosLa evaluación de los "efectivos" de biomasa se realizó mediante una modificación de la fórmula propuesta por Ehrhardt et al. (1977) para efectivos de biomasa delimitados mediante isolíneas batimétricas de rendimiento de especies comerciales. Se calculó la biomasa media (Bi) para las dos colectas (i) ya delimitados para las estaciones de < 20 m y > 20 m, procediéndose de la siguiente manera: 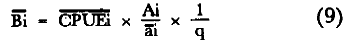 donde CPUEi = captura por unidad de esfuerzo promedio en el estrato i, Ai = área total del estrato i en metros cuadrados, ai = área promedio cubierta por un lance estándar en el estrato i en metros cuadrados y, q = al coeficiente de capturabilidad de arrastre de peces. Se consideró q = 0.5 basándose en los cálculos de estandarización de Klima (1976) y Stevenson (1982), donde todos los valores de q estaban basados en q = 1 para arrastres de peces con una relinga de 28.9 m de longitud. En estos estudios, la relinga superior fue de 15 m (aproximadamente la mitad de la longitud usada por los autores mencionados). Captura potencial máximaLa captura potencial máxima (CPM) fue calculada por medio de la ecuación de Gulland ( 1971), para poblaciones explotadas, de la siguiente manera: Ymáx = 0. 5 Z Bo ... (10) donde Ymáx, = captura potencial máxima (CPM), Z = tasa de mortalidad y Bo = biomasa de la población explotada. Con el fin de obtener datos comparativos en el análisis, la tasa de mortalidad se consideró como: a) Z = 0.20 basándose en una mortalidad por pesca nula y, b) Z = 0.40 basándose en una mortalidad por pesca mínima; según el criterio utilizado por Stevenson (1982) para capturas de peces demersales en la plataforma continental del sur del Golfo de México y Mar Caribe. El análisis detallado de esta metodología se encuentra desarrollado en Sánchez-Gil y Yánez-Arancibia (1985). En ese trabajo se señala que por lo general hay limitantes metodológicas para el estudio de comunidades tropicales de alta diversidad, y esto ha sido una generalidad previo al trabajo de Sánchez-Gil y Yánez-Arancibia (1985). Eso se refiere a: a) la falta de estadísticas de volúmenes de capturas de la fauna acompañante del camarón en series largas de tiempo, b) la carencia de un procedimiento metodológico de investigación estandarizado para el país, c) el desconocimiento de las tendencias metodológicas actuales en áreas tropicales -normalmente adaptadas de trabajos clásicos de regiones templadas y frías-, d) la falta de recursos humanos calificados de buena formación académica en términos ecológico-pesqueros. Evaluación de los peces demersales como fauna de acompañamiento del camarónDurante estos estudios sistemáticos, junto con los muestreos de peces fue colectada información cuantitativa acerca de la fauna asociada. Esta información está compuesta por los datos de biomasa total de moluscos, camarón, jaibas y otros invertebrados. En base a esta información se estableció en términos de abundancia: a) la relación proporcional entre las capturas de peces demersales en relación a los principales grupos de invertebrados asociados, b) la relación proporcional entre la captura demersal de peces/ camarón para cada una de las épocas climáticas muestreadas en este estudio y, c) su relación proporcional promedio para el sur del Golfo de México. Para realizar estas estimaciones fueron utilizadas las estadísticas pesqueras de camarones penéidos reportados por la FAO (Stevenson 1982) y la Secretaría de Pesca de México entre 1956 y 1981. Sobre la base de estas capturas de camarón y de acuerdo con los métodos indicados por Doubleday y Rivard (1981), Stevenson (1982), FAO-CIID-IDRC (1983), Pellegrin (1983), Yánez-Arancibia (1984) fue estimado el equivalente mínimo de la captura de peces demersales que se han capturado anualmente sin que hayan sido aprovechadas cabalmente en el país. El método de proporción peces/ camarón es válido para la FAO en la estimación de las capturas de peces demersales por las embarcaciones camaroneras. El análisis estadístico de los seis cruceros en la Sonda de Campeche analizados en este trabajo, estableció en términos de abundancia una relación proporcional de peces/ camarón = 12:1. Con este análisis, para los propósitos de este trabajo se extrajo el modelo de Yánez-Arancibia (1984) para ser presentado aquí de manera integral. Así, se computan las relaciones peces/ camarón por zonas, multiplicándose los cálculos de los desembarques anuales de camarón en las zonas respectivas. El modelo incluye toda la plataforma del Golfo de México, y para Estados Unidos los cálculos se basan en estadísticas de 1971 a 1975 y para México de 1977 a 1981.  Lám. 4a. Camarones peinados. El principal interés comercial de los recursos pesqueros demersales en el sur del Golfo de México. 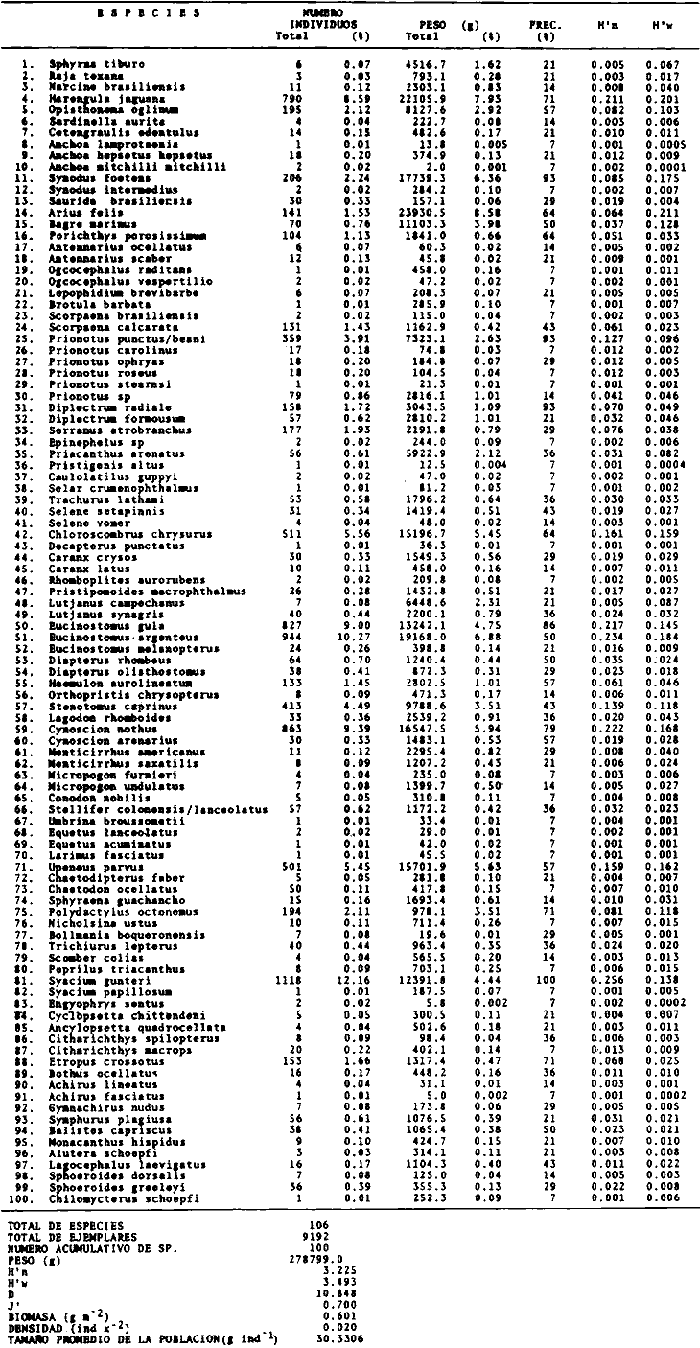 TABLA 12 . DISTRIBUCIÓN DE LA DIVERSIDAD, ABUNDANCIA NUMÉRICA, PESO Y FRECUENCIA DE LOS PECES DE LAS SONDA DE CAMPECHE OTOÑO 1980 Y 1981.
Tabla 13
Resultados y DiscusiónEcología y caracterización de las poblaciones de pecesEl análisis de las poblaciones de peces basado en el registro total de cada uno de los cruceros (Tablas 8 a 14), ha permitido establecer que en general existe un patrón semipermanente en la organización de las poblaciones de peces, cuya agrupación u ordenamiento se encuentra altamente correlacionado con las características ambientales del área durante las distintas épocas climáticas muestreadas. En el área de estudio han sido delimitados dos subsistemas ecológicos (Zonas Ay B) cuya definición ambiental presenta entre sí diferencias significativas como ha sido explicado anteriormente (ver Área de Estudio). Estos hábitats o subsistemas ecológicos también se definen en base a la composición y distribución de las especies. Los dos grupos de poblaciones que conforman a estos subsistemas, presentan variaciones estacionales caractereizadas por un reacomodo de las especies sujeto a las variaciones ambientales más evidentes en cada una de las épocas climáticas en el área. Uno de los factores ecológicos que evidencian este reacomodo biológico, es el movimiento migratorio de aquellas especies que realizan alguna fase de su ciclo de vida en el interior de los sistemas estuarinos adyacentes, y específicamente en la Laguna de Términos. Estos movimientos son una consecuencia directa o indirecta de la adaptación de estos organismos a las variaciones ambientales, Un gran porcentaje de las poblaciones que conforman las comunidades de peces de la Sonda de Campeche, realiza migraciones cíclicas y/o permanentes al interior de la Laguna de Términos, modificando así la función y estructura de las comunidades que permanecen en la plataforma continental adyacente de una forma periódica; sin embargo, la organización de los dos grupos de poblaciones son persistentes a través de todo el año. Con base en este razonamiento, se puede presentar el análisis individual para cada una de las capturas de peces realizadas para este estudio.
Figura 5 Figura 6 Figura 7 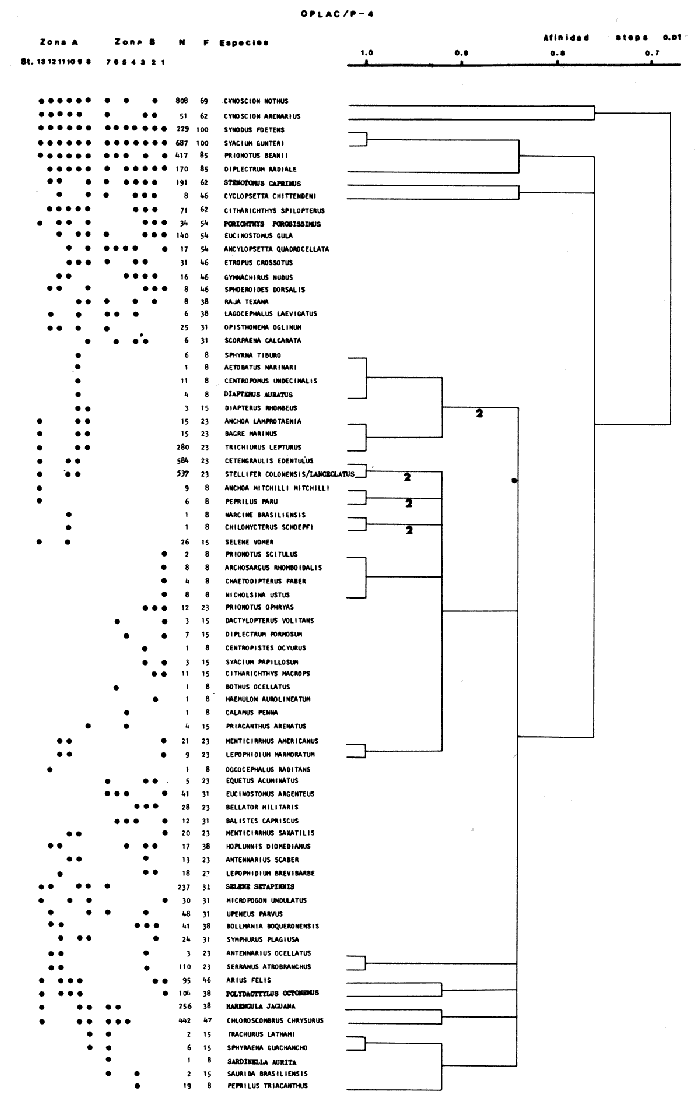 Fig. 8. Diversidad, abundancia numérica (N), frecuencia (F) y distribución de las especies (puntos negros) en las 2 zonas o subsistemas ecólogicos (A y B) de la Sonda de Campeche. El dendrograma cuantifica la relación de afinidad ecológica entre las especies de peces para el otoño de 1980 y 1981 (comienzo de la época de "nortes") en el sistema ecológico. Los grupos representan aquellas especies que co-ocurren espacial y temporalmente, en las estaciones de colecta y la época climática indicada (ver explicación en el texto , OPLAC/3-5).  Fig. 9. Diversidad, abundancia numérica (N), frecuencia (F) y distribución de las especies (puntos negros) en la Zona B de la Sonda de Campeche. El dendrograma cuantifica la relación de afinidad ecológica entre los peces para el otoño de 1981 (comienzo de la época de "nortes") en el sistema ecológico. Los grupos representan aquellas especies que co-ocurren espacial y temporalmente, en las estaciones de colecta y la época climática indicada (ver explicación en el texto , OPLAC/P-5).
OPLAC/P-1 Verano 1978Se registró un total de 100 especies de peces (Tabla 8), las cuales parecen responder al marco ambiental con una distribución particular a sus áreas que les son propicias (Fig, 4). Doce especies (12%) presentaron una amplia distribución en los dos subsistemas o zonas ecológicasA y B): Lago cephalus laevigatus, Synodus foetens, Syacium gunteri, Priacanthus arenatus, Eucinostomus gula, Trachurus lathami, Chloroscombrus chrysurus, Cynoscion arenarius, Harengula Jaguana, Diplectrum radiale, Symphurus plagiusa, Opisthonema oglinum. De éstas, el 83% son especies que presentan dependencia estuarina y se encuentran en la Laguna de Términos en algún momento de su ciclo de vida. De acuerdo al sistema operativo del análisis de computación estas especies presentaron los índices de similitud más bajos con respecto al resto de la comunidad, debido a su amplia distribución y frecuencia en el área. Estas especies integran el conjunto de poblaciones predominantes durante el inicio de la época de lluvias en las comunidades demersales de la Sonda de Campeche. El resto de las especies (88%) mostró una distribución más restringida por lo que sus índices de similitud fueron más altos. En estas poblaciones se destacaron 3 subgrupos: 1) conformado por 14 especies cuya distribución tiende a ocurrir en la Zona B; de estas especies el 71 % se encuentran en la Laguna de Términos en algún momento de su ciclo de vida y el conjunto de poblaciones puede estar caracterizado por la especieDiplectrum formosus, 2) conformado por 15 especies cuya distribución tiende a ocurrir en laZona A, de las cuales sólo el 6%(Epinephelus guttatus) puede encontrarse en la Laguna de Términos; este grupo de poblaciones puede ser caracterizado por la especie Serranus atrobranchus, 3) el resto que conforma un amplio grupo de poblaciones formado por 59 especies, sin presentar valores de frecuencia elevados, tienden a ocurrir tanto en laZona Acomo en la B; de éstas, el 58% se encuentra en la Laguna de Términos en algún momento de su ciclo de vida (Fig. 4, Tabla 8). OPLAC/P-2 Verano 1980Se registró un total de 80 especies de peces las cuales parecen responder al marco ambiental con una distribución particular a sus áreas que le son propicias (Fig. 5). Dieciséis especies (20%) presentan una amplia distribución en los dos subsistemas o zonas ecológicas(A y B): Syacuium gunteri, Eucinoslomus gula, Synodus foetens, Priacanthus arenatus, Stenotomus caprinus, Trachurus lathami, Diplectrum radiale, Prionotus punetatus-beani; Chloroscombrus chrysurus,Cynoscion arenarius, Etropuscrossotus, Serranus atrobranchus, Symphurus plagiusa, Harengula jaguana, Opisthonema uglinum, Bolmannia boqueronensi. De éstas, 63% son especies que presentan dependencia estuarina y se encuentran en la Laguna de Términos en algún momento de su ciclo de vida. De acuerdo al sistema operativo del análisis de computación estas especies presentaron los índices de similitud más bajos con respecto al resto de la comunidad, debido a su amplia distribución y frecuencia en el área. Estas especies integran al conjunto de poblaciones predominantes durante la época de lluvias en las comunidades demersales de la Sonda de Campeche (Lám. 5). El resto de las especies (80%) mostró una distribución más restringida por lo que sus índices de similitud fueron más altos (Lám. 5).
Figura 4 En estas poblaciones se detectan tres subgrupos: 1) conformado por 14 especies cuya distribución tiende a ocurrir en la Zona A,de éstas, ninguna se encuentra en la Laguna de Términos; este conjunto de poblaciones puede estar caracterizado por la especiePristipomoides macrophthalmus, 2) conformado por 16 especies cuya distribución tiende a ocurrir en la Zona B, de las cuales 69% pueden ser encontradas en la Laguna de Términos en algún momento de su cielo de vida; este grupo de poblaciones puede ser caracterizado por la especie Menticirrhus americanus, 3) el resto, que conforma un amplio grupo de poblaciones formado por 34 especies, que sin presentar valores de frecuencia elevados, tienden a ocurrir tanto en laZona A como en la B, de éstas, el 50% se encuentra en la Laguna de Términos en algún momento de su cielo de vida (Fig. 5, Tabla 9). OPLAC/P-4 Verano 1981Se registró un total de 75 especies de peces, las cuales parcen responder al marco ambiental con una distribución particular a sus áreas que le son propicias (Fig. 6). Ocho especies (11 %) presentan una amplia distribución: Cynoscion nothus, Cynoscion arenarius, Synodusfoetens, Syacum gunteri, Prionotus Punctatus beani, Sienotomus caprinus, Citharichthys spilopterus, Diplectrum radiale.De éstas, el 75% son especies que presentan dependencia estuarina y se encuentran en la Laguna de Términos en algún momento de su ciclo de vida. De acuerdo al sistema operativo del análisis de computación, estas especies presentaron los índices de similitud más bajos con respecto al resto de la comunidad, debido a su amplia distribución en el área. Estas especies integran el conjunto de poblaciones predominantes durante la época de lluvias en las comunidades demersales de la Sonda de Campeche. El resto de las especies (89%) mostró una distribución más restringida por lo que sus índices de similitud fueron más altos. En estas poblaciones se destacan 3 subgrupos: 1) conformado por 23 especies de las cuales 13 presentan una distribución que tiende a ocurrir en la Zona B;de éstas, el 69 % se encuentran en la Laguna de Términos en algún momento de su ciclo de vida y el conjunto puede estar caracterizado por la especie Prionotus ophryas, 2) conformado por 15 especies, cuya distribución tiende a ocurrir en laZona A de las cuales el 80% puede encontrarse en la Laguna de Términos; este grupo de poblaciones puede ser caracterizado por la especie Cetengraulis edentulus, 3) el resto que conforma un amplio grupo de poblaciones formado por 31 especies, sin presentar valores elevados de frecuencia, tienden a ocurrir tanto en la Zona Acomo en la B; de éstas, el 45% se encuentra en la Laguna de Términos en algún momento de su ciclo de vida (Fig. 6, Tabla 10). OPLAC/P-3 Otoño 1980Se registró un total de 82 especies de peces, las cuales parecen responder al marco ambiental con una distribución particular a sus áreas que les son propicias (Fig. 7). Seis especies (7%) presentan una amplia distribución en este sistema: Syacium gunteri, Prionotus Punctatus/beani, Porichthys Porosissimus, Cynoscion nothus, Diplectrum radiale y Eucinostomus gula. De éstas, el 67% son especies que presentan dependencia estuarina y se encuentran en Laguna de Términos en algún momento de su ciclo de vida. De acuerdo al sistema operativo del análisis de computación, estas especies presentaron los índices de similitud más bajos con respecto al resto de la comunidad, debido a su amplia distribución y frecuencia en el área. Estas especies integran el conjunto de poblaciones predominantes durante la época de nortes en las comunidades demersales de la Sonda de Campeche. El resto de las especies (83%) mostró una distribución más restringida por lo que sus índices de similitud fueron más altos. En estas poblaciones se destacaron 4 subgrupos: 1) conformado por 13 especies cuya distribución tiende a ocurrir en las áreas de mayor influencia de aporte continental en laZona A, de éstas 61 % se encuentran en la Laguna de Términos en algún momento de su cielo de vida, el conjunto de poblaciones puede estar caracterizado por la especie Prionotus carolinus, 2) conformado por 18 especies cuya distribución tiende a ocurrir hacia las áreas de mayor influencia marina de laZona A, de éstas el 11% puede encontrarse en la Laguna de Términos, este grupo de poblaciones puede estar caracterizado por Priacanthus arenatus, Trachurus lathami, Engyophrys sentus, 3) conformado por 10 especies cuya distribución tiende a presentarse en las áreas de mayor influencia de descarga de la Laguna de Términos, de éstas el 20% puede encontrarse en él interior de dicha laguna; este grupo puede estar caracterizado porChaetodipterus faber, 4) el resto que conforma un amplio grupo de poblaciones formado por 35 especies, sin presentar valores de frecuencia elevados, presenta una amplia distribución en laZona A sin un patrón definido, de éstas el 60% se encuentran en Laguna de Términos en algún momento de su cielo de vida (Fig. 7, Tabla 11). OPLAC/P3-5 Otoño 1980 y 1981Se registró un total de 100 especies de peces, las cuales parecen responder al marco ambiental con una distribución particular a sus áreas que le son propicias (Fig. 8). Dieciseis especies (16%) presentan una amplia distribución en los dos subsistemas o zonas ecológicas(A y B): Cynoscion arenarius, Syacium gunteri, Synodus foetens, Prionotus punctatus/beani, Diplectrum radiale, Eucinoslomus gula, Cynoscion nothus, Poydactylus octonemus, Harengula jaguana, Etropus crossotus, Arius felis, Porichthys porosissimus, Chloroscombrus chrysurus, Opisthonema oglinum, Haemulon aurolinealum y Upeneusparvus, de éstas, el 81% son especies que presentan dependencia estuarina y se encuentran en la Laguna de Términos en algún momento de su cielo de vida. De acuerdo al sistema operativo del análisis de computación, estas especies presentaron los índices de similitud más bajos con respecto al resto de la comunidad, debido a su amplia distribución y frecuencia. Estas especies integran el conjunto de poblaciones predominantes durante la época de nortes en las comunidades demersales de la Sonda de Campeche. El resto de las especies (84%) mostró una distribución más restringida por lo que sus índices de similitud fueron más altos. En estas poblaciones se destacaron 3 subgrupos muy aparentes: 1) constituido por 18 especies cuya distribución tiende a presentarse hacia la Zona B. En este grupo de poblaciones destacan Lagodon rhomboides, Lutjanus synagris y Diplectrum formosus. De este grupo 8 (44%) están en la Laguna de Términos en algún momento de su vida, 2) constituido por 37 especies cuya distribución tiende a presentarse hacia laZona A. En este conjunto de poblaciones destacan las especies Diapterus auratus, Sphoeroides greeleyi y Stellifer colonensis/lanceolatus. De este grupo, 14 (38%) están en la Laguna de Términos en algún momento de su ciclo de vida, 3) el resto, que conforma un grupo de poblaciones de 29 especies, que sin presentar valores de frecuencia elevados, poseen una distribución amplia sin un patrón definido; de éstas, 15 (52%) se encuentran en la Laguna de Términos en algún momento de su ciclo de vida. En este grupo destacan Eucinostomus gula, Stenotomus caprinus yScorpaena calcarata (Fig. 8, Tabla 12). OPLAC/P-5 Otoño 1981Se registró un total de 68 especies de peces, las cuales parecen responder al marco ambiental con una distribución particular a sus áreas que le son propicias (Fig. 9). Veintitrés especies (34%) presentan una amplia distribución: Synodus foetens, Diplectrum radiale, Syaclum gunteri, Opisthonema oglinum, Prionotus punctatus/beani, Chloroscombrus chrytsurus, Eucinostomus gula, Lutjanus gríseus, Lagodon rhomboides, Harengula Jaguana, Cynoscion nothus, Haemulon aurolinealum, Etropus crossotus, Stenotomus caprinus, Upeneus parvus, Eucinostomus argenteus, Arius felis, Trachurus lathami, Bagre marinus, Polydactylus octonemus, Balistes capriscus, Selene setapinnis, Lagocephalus laevigatus. De este grupo el 74% son especies que presentan dependencia estuarina y se encuentran en la Laguna de Términos en algún momento de su ciclo de vida. De acuerdo al sistema operativo del análisis de computación, estas especies presentaron los índices de similitud más bajos con respecto al resto de la comunidad debido a su amplia distribución y frecuencia en el área. Estas especies integran al conjunto de poblaciones predominantes durante la época de nortes en las comunidades demersales en el subsistema o Zona B de la Sonda de Campeche. El resto de las especies (66%) mostró una distribución más restringida por lo que sus índices de similitud fueron más altos. En estas poblaciones se destacaron los subgrupos: 1) constituido por 18 especies cuya distribución tiende a presentarse hacia la región oriental de laZona B incluyendo el área próxima a la desembocadura del Río Champotón, este conjunto de poblaciones puede estar tipificado por la especie Scorpaena calcarata.De este grupo, 4 (22%) están en la Laguna de Términos en algún momento de su ciclo de vida, 2) constituido por 9 especies cuya distribución tiende a presentarse hacia la región central que incluye el área de influencia de la Boca de Puerto Real, este conjunto de poblaciones puede estar caracterizado por la especie Citharichthys macrops. De este grupo, 5 (56%) están en la Laguna de Términos en algún momento de su ciclo de vida, 3) el resto, que conforma un grupo de poblaciones de 16 especies, que sin presentar valores de frecuencia elevados, poseen una amplia distribución sin un patrón definido; de éstas, 11 (69%) se encuentran en la Laguna de Términos en algún momento de su ciclo de vida. Este conjunto de poblaciones puede estar caracterizado por Caranx crysos, Priacanthus arenalus y Diplectrum formosus (Fig. 9, Tabla 13). OPLAC/P-6 Primavera 1982Se registró un total de 108 especies de peces, las cuales responden al marco ambiental con una distribución particular a sus áreas que les son propicias (Fig. 10). Catorce especies (13%), presentaron una amplia distribución en los dos subsistemas o zonas ecológicas(A y B): Eucinostomus gula, Chloroscombrus chrysurus, Diplectrum radiale, Syacium gunteri, Prionotus punctatus/beani, Synodus foetens, Arius felis, Polydactilus octonemus, Trichiurus lepturus, Lutjanus synagris, Haemulon aurolineatum, Etropus crossotus, Porichthys porosissimus y Cynoscion arenarius. De éstas, el 39.4% son especies que presentan dependencia estuarina y se encuentran en la Laguna de Términos en algún momento de su ciclo de vida. De acuerdo al sistema operativo del análisis de computación estas especies presentaron los índices de similitud más bajos con respecto al resto de la comunidad, debido a su amplia distribución y frecuencia. Estas especies integran el conjunto de poblaciones predominantes durante el inicio de la época de secas en las comunidades demersales de la Sonda de Campeche. El resto de las especies (87%) mostró una distribución más restringida por lo que sus índices de similitud fueron más altos. En estas poblaciones se destacaron 3 subgrupos muy aparentes: 1) constituido por 36 especies que tienden a presentarse hacia la Zona A. En este grupo se destacan Citharichthys spilopterus, Cyc1opsetta chittendeniy Equetus acuminatus, en el cual el 33.3% de las especies se han reportado en la Laguna de Términos, 2) constituido por 33 especies cuya distribución tiende a presentarse hacia la Zona B, Este conjunto de poblaciones puede estar identificado por:Acanthostracion quadricornis yDiplectrum formosus; en este grupo 61% están en la Laguna de Términos en algún momento de su ciclo de vida, 3) el resto, que conforma un grupo de poblaciones de 25 especies, sin presentar valores altos de frecuencia poseen una distribución amplia pero sin un patrón definido; de éstas, 16 (64%) se han reportado en la Laguna de Términos y puede destacar la presencia de Eucinostomus melanopterus y Scorpaena brasiliensis (Fig. 10, Tabla 14). Comportamiento ecológicoEl análisis de estos resultados permite hacer observaciones interesantes. Durante las distintas épocas climáticas del año un porcentaje muy alto de especies que componen las comunidades de peces demersales de la Sonda de Campeche, son especies que presentan dependencia estuarina. Durante la época de lluvia estas especies tienden a ocupar las áreas de la plataforma continental donde predominan las características típicamente marinas(Zona B). En esta época del año las especies que caracterizan a dichas comunidades son casi en su totalidad (63 a 80%) especies eurihalinas. Durante la época de nortes la distribución de las especies dependientes estuarinas es casi homogénea en ambos subsistemas (Zonas A yB) del área de estudio. En esta época climática entre el 60 y 70% de las especies predominantes presenta relación con las comunidades de peces de la Laguna de Términos. Durante la época de secas existe una tendencia de las especies estuarinas a ocupar nuevamente las zonas marinas(Zona B) de la plataforma adyacente. En esta época del año las especies que predominan en dichas comunidades sólo en un 39% están constituidas por especies eurihalmas.
Figura 10 Estas variaciones en la composición y distribución de las poblaciones están relacionadas al parecer con distintos procesos ecológicos. Day et al. (1982), mencionan que durante la época de lluvias en el área de la Laguna de Términos, se presenta un aumento en la productividad primaria cuyos efectos en la cadena trófica no son inmediatos, manifestándose a finales del periodo de lluvias y principio de nortes, correlacionado a las máximas descargas de los ríos y la alta exportación de nutrientes. En esta época un gran número de especies de la plataforma continental penetran a la Laguna de Términos a utilizar los subsistemas ecológicos como áreas de crianza, reproducción y/o alimentación (Amezcua Linares y Yáñez-Arancibia, 1980; Yáñez-Arancibia et al., 1980, 1985b). Así mismo, la época de secas se caracteriza por la presencia de una comunidad de peces de tallas mayores en el interior de la laguna, lo que implicaría la permanencia de un gran número de especies en maduración o reprodución por un lado, y por otro, la salida de juveniles hacia la plataforma adyacente se mantiene constante como reflejo de una marcada programación estacional de las poblaciones en cuyo ciclo de vida está incorporada la utilización de sistemas estuarinos. Otro factor que influye en la composición de las comunidades de peces en la Sonda de Campeche, se refiere a aquellas especies que no dependen de las aguas estuarinas aun cuando pueden ocuparlas ocasionalmente estas especies realizan su ciclo de vida completamente en aguas típicamente marinas. Estas especies componen un poco más del 35% del total de las comunidades de la plataforma continental, y sus variaciones estacionales están en función de migraciones altamente relacionadas con la profundidad, o bien con la composición de los sedimentos; ambos patrones asociados con la disponibilidad de alimento y la variación del espectro trófico con la edad. El análisis de la dinámica ecológica de las especies de peces, tanto espacial como temporal dentro de los sistemas Sonda de Campeche-Laguna de Términos, permite distinguir dos grandes grupos: 1) especies que son dependientes estuarinas, y 2) especies que no son dependientes estuarinas. Las especies que son dependientes estuarinas son aquellas que utilizan la Laguna de Términos y se pueden separar en tres grupos: a) las que se encuentran siempre en la Sonda de Campeche y que utilizan la Laguna de Términos como área de alimentación, reproducción y/o crianza (i. e., Harengula jaguana y Synodus foetens); b) las que se encuentran estacionalmente en la sonda, pasando parte de su ciclo de vida en la laguna donde crecen, se reproducen o se alimentan (i. e., Cetengraulis edentulus y Stellifer colonensis/lanceolatus); c) especies que son ocasionales, ya que presentan baja frecuencia en la sonda, y que se presentan en la laguna (i. e., Urolophus jamaicensisyBairdiella chrysoura). Las especies que no son dependientes estuarinas también se subdividen en tres grupos: a) las que se encuentran siempre en la Sonda de Campeche y no presentan fluctuaciones estacionales evidentes (i. e., Syacium gunteri, Priacanthus arenatus y Trachurus lathami); b) las que presentan un patrón estacional debido a actividades migratorias por cambios ambientales (i. e., Lutjanus campechanusyPristipomoides macrophthalmus); c) las que son ocasionales, que no presentan un patrón definido de presencia en la sonda(i. e., Lagodon rhomboides y Alutera monoceros). Relación peces-hábitatEl análisis de afinidad de la relación peces-hábitat (Figs. 11 a 15) fue significativo sobre la base del método estadístico empleado, encontrándose grupos o asociaciones de poblaciones de peces, altamente correlacionadas con la caracterización del hábitat (subsistemas: Zona A y B) de la Sonda de Campeche. Estos grupos están asociados directamente a la dinámica ambiental que prevalecen en cada una de las dos zonas; sin embargo, la integración de los dos grupos de poblaciones presentan pequeñas variaciones estacionales que se reflejan en el comportamiento y composición de las mismas, dando origen a una zona de transición entre la Zona A y la Zona B cuyo límites fluctúan de acuerdo a la época del año (Yáñez Arancibiaet al., 1982b, 1983a y 1986). En general en el área de estudio se presentó un patrón de salinidad y temperatura casi uniforme a excepción de variaciones estacionales relacionadas con el aporte de aguas epicontinentales a fines de la época de lluvias, y la alta turbulencia asociada a la época de nortes. Así mismo, se observó una gran heterogeneidad en la distribución de parámetros asociados, como Ph, oxígeno disuelto y materia orgánica. Esta situación se enfatizó hacia laZona A, la cual recibe la mayor descarga continental proveniente de los ríos Grijalva, San Pedro y las aguas de descarga de la Laguna de Términos. La diferente estructura y composición de las poblaciones típicas de cada zona, es evidente; se observa que las poblaciones de peces de la Zona Aestán caracterizadas por individuos generalmente de forma alargada, comprimidos y con coloraciones plateadas, lo que está directamente asociado con las características ambientales del subsistema, por ejemplo, aguas con poca transparencia (Láms. 5 y 6). En contraste, las poblaciones de la Zona B, están integradas por peces con gran variedad de formas y colores, asociados con características ambientales tales como aguas tranquilas y altamente trasnsparentes (Láms. 7 y 8). El análisis de la composición y estrructura de las poblaciones de cada una de las épocas climáticas permite describir esta relación peces-hábitat de una manera más detallada. Para el Crucero OPLAC/P-1, se observaron 2 agrupaciones de estaciones que corresponden a la Zona A (estaciones 1 a 7, 9, 10, 14, 22 y 23) con un 96% de similitud o afinidad ecológica y a laZona B (estaciones 8, 15 a 19, 24 a 26), en base a las especies presentes en cada área (Fig. 11). Sin embargo, existió un traslape de laZona A con la Zona Bdado por las estaciones 8, 14, 23 y 24 lo que indica que estas cinco estaciones componen una zona de transición entre los dos subsistemas. En base a análisis de las especies comunes entre la Zona A y la zona de transición, se calcula una afinidad del 31% representando por las especies Sardinella aurita, Cyclopsetta fimbriata, Chitharichthys spilopterus, Polydactylus octenemus, Antennarius scaber, Anchoa pectoralis y Porichthys porosissimus. Para el Crucero OPLAC/P-2, laZona A (estaciones 1 a 9) presentó un 75% de afinidad ecológica por su composición de especies y la Zona B (estaciones 11, 12, 13, 14 y 18) de 77% (Fig. 12). En el dendrograma, la zona de límite variables, se presentó poco definida; sin embargo, queda integrada en un grupo formado por las estaciones 7, 11 y 14. Aparentemente esta zona de transición presentó una mayor afinidad con la Zona A, con un 21% de afinidad debido a las especies que comparte, estas especies fueron: Congrina flava, Balistes capriscus, Diapterus auratus, Lutjanus campechanus, Bagre marinus, Serranus atrobranchus, Lagocephalus laevigatus, Selene setapinnis, yCitharichthys spilopterus; con respecto a la Zona B, se presentó una similitud del 13% con la zona de transición por la presencia de dos especies: Dactylopterus volitans ySphoeroides nephelus. Para el Crucero OPLAC/P 3-5, laZona A (estaciones 1 a 7) estuvo definida por una afinidad ecológica de 70% y la Zona B (estaciones 8 a 14) con un 76% dependiendo de la composición de especies de cada zona. En este caso la zona de transición se definió con las estaciones 7, 8 y 9; la afinidad de esta zona con los subsistemasA yB fue del 26%. La Zona A con las especies como: Narcine brasiliensis, Stellifer colonensis/lanceolatus, Menticirrhus americanus, Sphoeroides greeleyi, Cetengraulis edentulus, Lepophidium brevibarbe, Eucinostomus melanopterus, Pristipomoides macrophthalmus, Achirus lineatus, Antennarius scaberyDiapterus olisthostomus; y con la Zona B: Shyraena guachancho, Scober colias, Selene setapinnis, Lagocephalus laevigatus, Caranx chrysos y Chaetodipterus faber (Fig. 13). Para el Crucero OPLAC/P-4 se presentó un área formada por las estaciones 7 y 8 con una afinaidad del 76%, que representa el área de transición o de límites variables. Rodenado a esta zona de transición se encontró un grupo formado por las estaciones 1, 2, 3, 4, 5, 6, 11 y 12 con una afinidad del 74% el cual define en general el área de la Zona B. Una tercera agrupación estuvo integrada por las estaciones 9, 10 y 13 cercanas a la costa, con una afinidad del 72% dentro de los límites de laZona A. De acuerdo a esta agrupación, la zona que rodea el área de límites variables, presentó una afindiad del 31% debido a la presencia de especies en común tales como:Otrynter caprinus, Cyclopsetta chittendeni, Sphoeroides dorsalis, Scorpaena calcarata, Priacanthus arenatus, Equetus acuminatus, Upeneus Parvus YSaurida brasiliensis, Las estaciones cercanas a la costa presentaron una afinidad del 24% por la presencia de especies comoDiapterus rhombeus, Anchoa lamprotaenia, Bagre marinus yTrichiurus tepturus (Fig. 14). 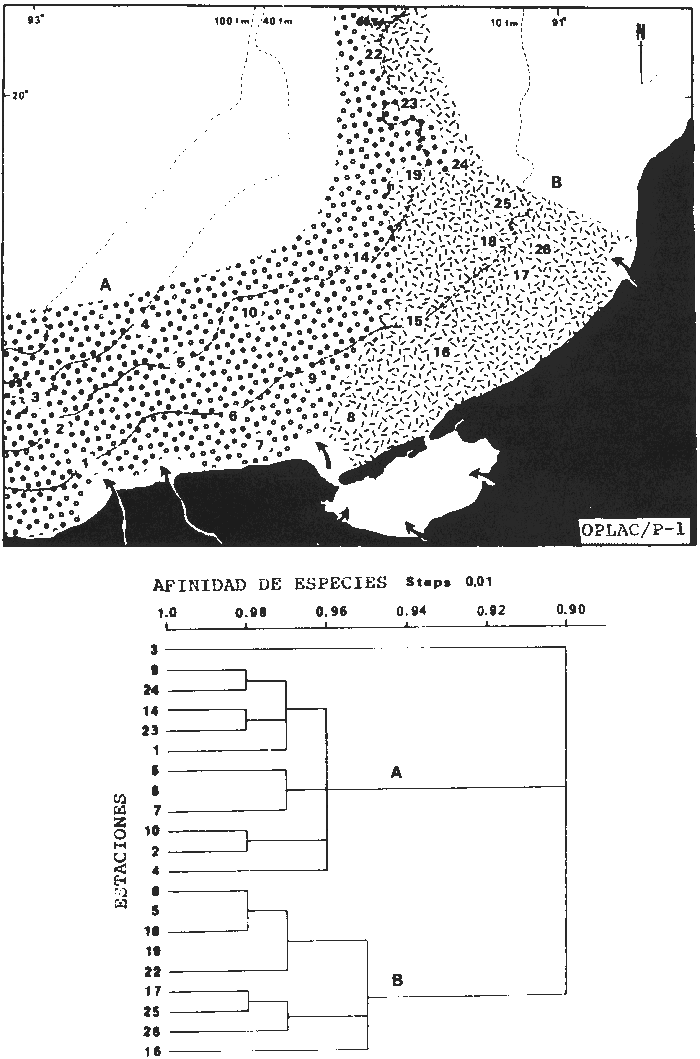 Fig. 11. El mapa muestra 2 zonas (A y B) que agrupan estaciones con similaridad ecológica elevada sobre la base de la composición de especies de peces que se presentan para el crucero OPLAC/P-1. La gráfica cuantifica esa relación en un dendrograma de similaridad. 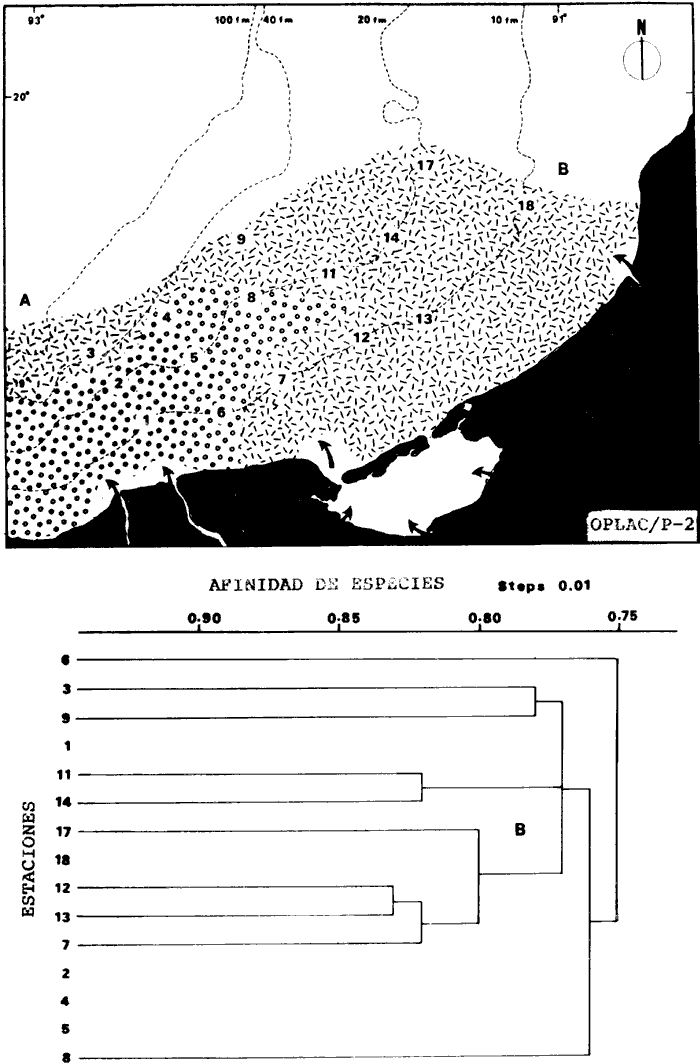 Fig. 12. El mapa muestra 2 zonas (A y B) que agrupan estaciones con similaridad ecológica elevada sobre la base de la composición de especies de peces que se presentan para el crucero OPLAC/P-2. La gráfica cuantifica esa relación en un dendrograma de similaridad. 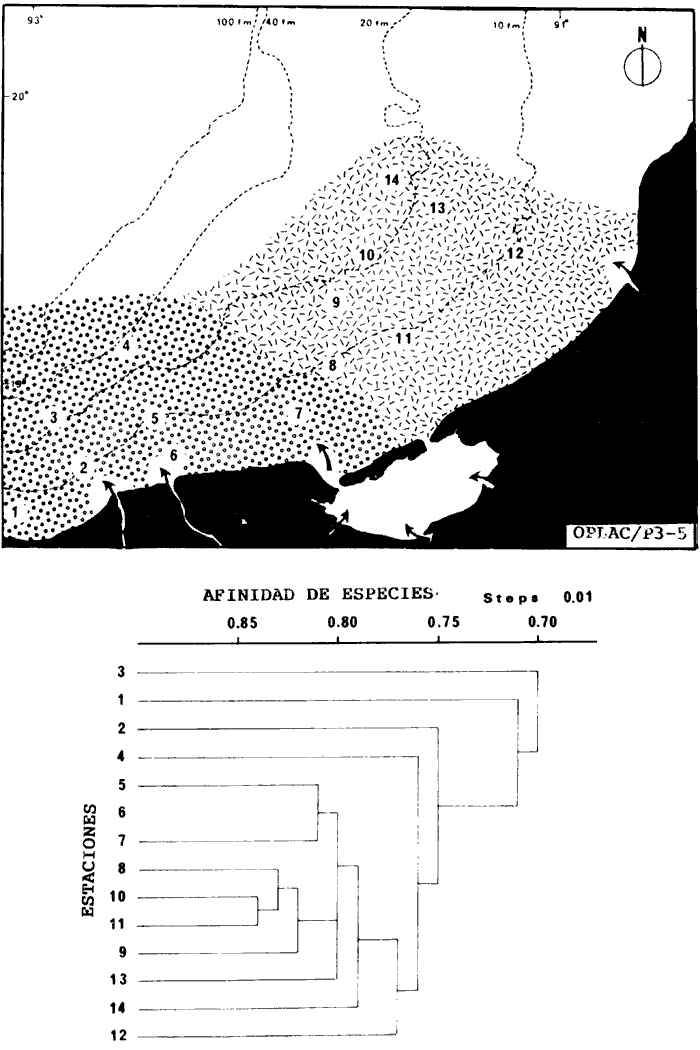 Fig. 13. El mapa muestra 2 zonas (A y B) que agrupan estaciones con similaridad ecológica elevada sobre la base de la composición de las poblaciones de peces que se presentan para el crucero OPLAC/P 3-5. La gráfica cuantifica esa relación en un dendrograma de similaridad. Para el Crucero OPLAC/P-6, la composición de las especies determinó una vez más la separación de dos agrupaciones de estaciones que corresponden a la Zona A (estaciones 1 a 11 y 16)con una afinidad ecológica del 79% y a la Zona B(estaciones 12 a 18) también con un 79% (Fig. 15). El traslape de ambos subsistemas difine a la zona de transición con las estaciones 10, 11, 12 y 16, estas estaciones mostraron un 35% de afinidad con la Zona A debido a la presencia de las especies que comparten:Cynoscion arenarius, Vomer setapinnis, Porichthis porosissimus, Celengraulis edentulus, Lutjanus campechanus, Citharichthys spitopterus, Bollmannia boqueronensis, Lepophidium brevibarbe, Sphoeroides greeleyi, Cyc1opsetta chittendeni, Menticirrhus americanus, Diapterus rhombeus, Eucinostomus argenteus, Trachurus lathami, Serranus atrobranchus, Caranx chrysos, Stenotomus caprinus, Opisthonema oglinum, Polydactylus octonemus y Trichiurus tepturus, presentando una afinidad del 13% con la Zona B por las especies compartidas como: Ogcocephalus raditans, Diplectrum formosum, Nicholsina ustus, Cyclopsetta fimbriata, Monacanthus hispidus y Alutera schoepfi. Las comunidades de peces: familias tipo, diversidad, distribución y abundancia
Diversidad de la comunidad y familias tipoLa cuantificación de los resultados está basada en el registro total de la captura para cada uno de los seis cruceros realizados. Se tiene un total de 53504 ejemplares de peces analizados, correspondientes a 152 especies de 102 géneros y 55 familias. El número de especies colectado en cada crucero varió entre 75 y 108 en las épocas de lluvias (OPLAC/P-4) y secas (OPLAC/P-6) respectivamente. El análisis de diversidad y área mínima de muestreo realizada para cada uno de los cruceros, mostró que la diversidad de las especies demersales de la Sonda de Campeche tiende a presentar una alta homogeneidad en toda el área, lo cual presenta variaciones dependiendo de los cambios ambientales estacionales. Durante la época de lluvias (Cruceros OPLAC/P-1 y OPLAC/P-2) se observó que más del 80% de las especies que componen el total de cada prospección, se alcanzó en las estaciones que cubren el área denominada comoZona A, es decir, hacia las áreas de mayor influencia estuarina (en un área de 470 y 310 km² respectivamente). Es importante señalar que si bien la diversidad tiende a ser alta, se encontró que la densidad es relativamente baja (entre 17 y 19 ind/ m²). En el Crucero OPLAC/P-4 este patrón es más evidente ya que las primeras estaciones muestreadas se ubican en laZona B y la mayoría de las especies (84%) se alcanzó sólo hasta el área de la Zona A, en este caso la densidad es aún menor (7.6 ind/m²) lo que hace pensar que durante la época de lluvias la generalidad es que la densidad sea baja en toda el área de estudio, pero es aún menor en las áreas de mayor persistencia marina (Fig. 16). 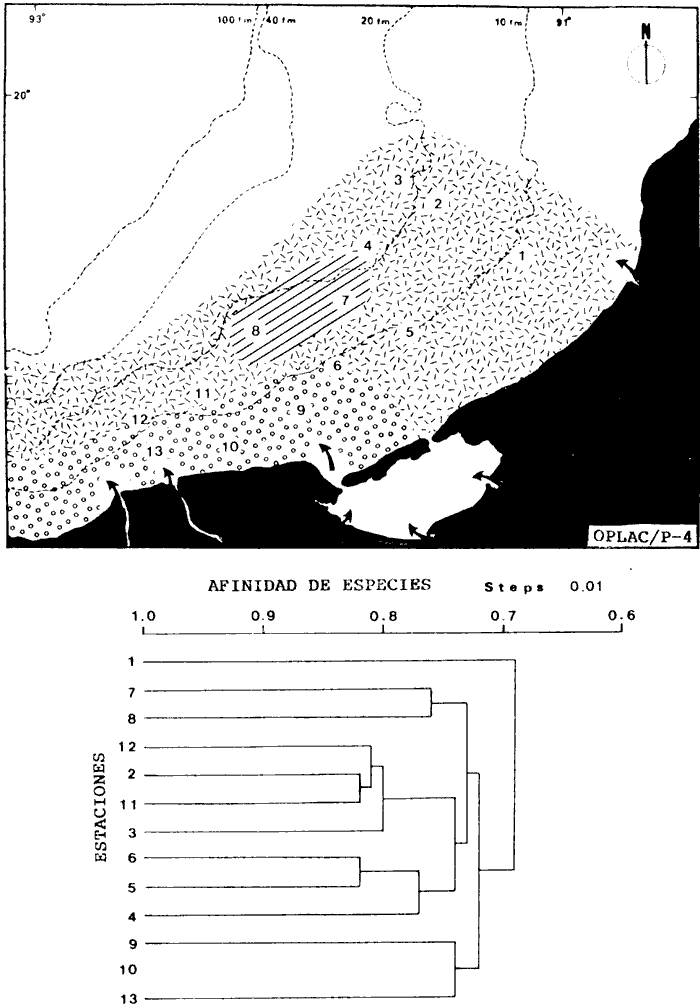 Fig. 14. El mapa muestra el agrupamiento de las estaciones con similaridad ecológica, sobre la base de la composición de especies de peces que se presentan para el crucero OPLAC/P-4. Se destaca la presencia de una zona central de transición bien definida, así como un grupo de estaciones asociados a la zona de mayor aporte continental. La gráfica cuantifica esa relación con un dendrograma de similaridad. 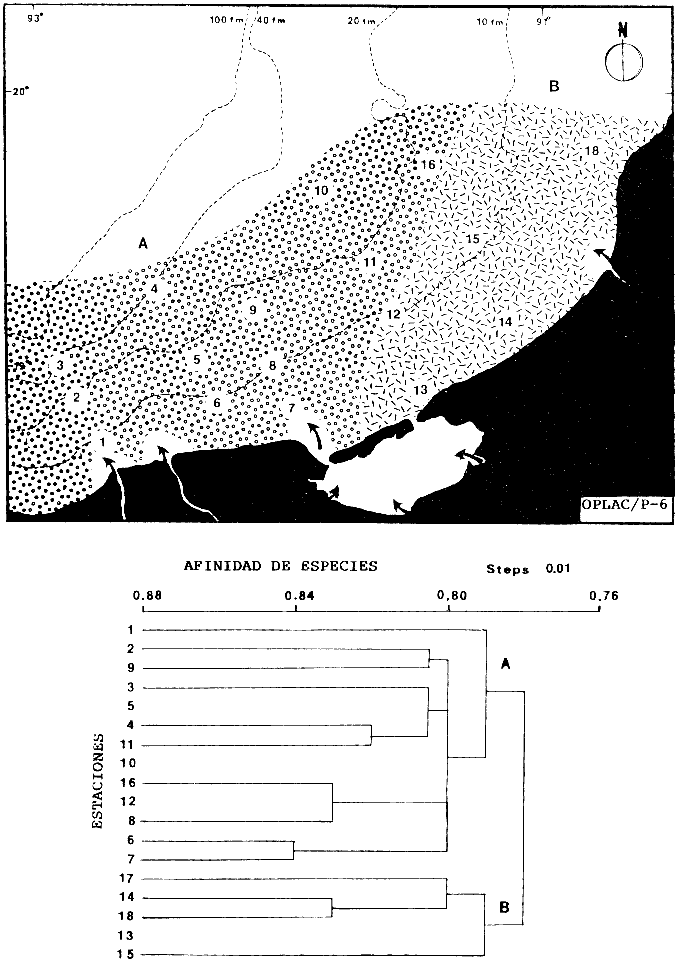 Fig. 15. El mapa muestra 2 zonas (A y B) que agrupan estaciones con similaridad ecológica elevada sobre la base de la composición de las poblaciones de peces que se presentan para el crucero OPLAC/P 6. La gráfica cuantifica esa relación en un dendrograma de similaridad. Durante el periodo de "nortes" o tormentas de invierno (Cruceros OPLAC/P-3 y OPLAC/P-5) se observó la mayor homogeneidad de la diversidad en el área. Cabe destacar que la red de estaciones de muestreo de cada uno de estos cruceros cubrió precisamente el área que corresponde a cada uno de los subsistemas ecológicos en discusión, lo que permitió un análisis individual. Se encontró que el 86% de las especies de cada zona fue colectada en un área muy semejante (110 y 130 km² respectivamente). Los valores de densidad fueron más altos que en la época de lluvias, siendo en este caso ligeramente mayores en las zonas marinas (21 y 25 ind/m² respectivamente); es decir, que aún cuando la estructura de cada subsistema fue diferente, sus parámetros de diversidad fueron muy similares (Fig. 16). Durante el periodo de secas (Crucero OPLAC/P-6) se observó un patrón diferente, encontrándose que un poco más del 80% de las especies se alcanzó sólo hasta cubrir un área de 406 km²; sin embargo, en esta época se presentó la mayor densidad en el área de estudio (27 ind/m²). Aparentemente, la diversidad durante este periodo es comparable con la época de lluvias, y en sus aspectos de densidad con la época de nortes (Fig. 16). En general, la diversidad de la comunidad estudiada está dada por una alta riqueza de especies. Un gran porcentaje de estas especies (entre el 50 y 70%) es aportado a la comunidad por un número reducido de familias (entre 24 y 40% de¡ total de las capturas) y cuyos valores de abundancia de biomasa, densidad de individuos además del número de especies, las caracterizan como familias típicas o dominantes de la región de estudio(Tablas 15 a 19), El comportamiento biológico y ecológico de estas familias tipo, principalmente sus hábitos alimenticios y relaciones tróficas, de terminan en gran medida la abundancia y diversidad de la comunidad. Con frecuencia se considera que la magnitud de los estocs de peces en una región determinada está en función de su potencialidad alimenticia (Venkataraman, 1960; Rao, 1967), de tal forma que el alimento es un factor importante en la biología de los peces de terminando además de su crecimiento y fecundidad, sus movimientos migratorios. Las variaciones estacionales y abundancia diurna de los organismos que son alimento preferencial de diferentes especies de peces en determinada región, tienen influencia directa en las migraciones horizontales y movimientos verticales de los estocs de peces. De allí que actualmente el correcto conocimiento de las relaciones tróficas de una comunidad es esencial para una buena evaluación y posterior explotación de los recursos, tomando encuenta la diversidad y la estructura del total de la pesquería. Estos planteamientos han cobrado tanta fuerza por su validez que recientemente son sugeridos como normas metodológicas y estrategias de investigación futura para recursos demersales de alta diversidad en las regiones costeras calidotempladas y tropicales; por ejemplo los trabajos de Sainsbury (1982, 1984); Darnellet al. (1983); Yáñez-Arancíbla (1984); y OSLR-IREP (1984). En el presente estudio el análisis de los principales hábitos de las familias que caracterizan a las comunidades, se enmarcan en diferentes grupos de peces cuyas relaciones definen su estructura y función. Como primer grupo es importante señalar a aquellas familias cuyos hábitos son pelágicos, y que, sin embargo, es muy común encontrarlas y capturarlas junto con las familias típicas del fondo, ejemplo de éstas son: Carangidae, Clupeidae, Engraulidae y Stromatidae. La mayoría de estas familias se capturan con frecuencia en actividades de arrastre generalmente asociados a pesquerías de camarón (Gunter, 1945; Hildebrand, 1954, 1955; Moore et al., 1970; Chittenden y McEachran, 1976; Fischer, 1978; Sánchez-Gil et al.,1981; Darnell et al., 1983). Aún cuando a todas se les considera como rápidonadadores, generalmente forman grupos o cardúmenes y se encuentran la mayor parte de su ciclo de vida en la columna de agua; por todo esto, no siempre logran esquivar la red en su ascenso. Por otro lado, diversos autores consideran a familias de este tipo como fauna asociada en su alimentación directamente con organismos Bentónicos, como algunos clupeidos que consumen fauna típica de los fondos como son anfípodos, bivalvos, gasterópodos, pleuronéctidos; o bien, las distinguen como carnívoros consumidores de un alto porcentaje de peces, como son una gran mayoría de carángidos (Rao, 1967; Randall, 1967; Franks et al., 1972; Fischer, 1978). Estas familias contribuyen a las comunidades con un número moderado de especies (predominando Carangidate), un alto número de individuos y por tanto valores altos de biomasa; sus variaciones estacionales son evidentes y están en función de su abundancia más que de su diversidad (Tablas 15 a 19). Otro grupo lo conforman familias en cuyos hábitos ecológicos se han desarrollado estrategias que las definen como demerso-pelágicas, ejemplo de éstas son: Sciaenidae, Serranidae, Gerreidae, Centropomidae, Sparidae, Pomadasyidae. La mayoría de estas familias también es frecuente capturarlas en actividades de arrastre. En este grupo se incluyen consumidores de segundo y tercer orden con un espectro trófico muy amplio dentro del cual es común encontrar desde foraminíferos, poliquetos, copépodos, moluscos, equinodermos, anémonas y una amplia variedad de crustáceos pequeños y peces, y un alto contenido de detritus.Estas familias contribuyen a las comunidades con un alto número de especies y debido al gran número de individuos en muchos casos el valor de su biomasa es más alto que en el grupo anterior; las variaciones estacionales de estas familias son menos evidentes y están en función de su diversidad más que de su abundancia, algunas de ellas presentan una clara sucesión estacional de especies, encontrándose bien representadas durante todo el año (Tablas 15 a 19).  Lám. 5. Captura demersal del Crucero OPLAC/P-2 en la Zona A para la época de lluvias. Se observan algunos macroinvertebrados como Luidia clatharata, Lolligunvula brevis, Penaeus spp, Callinectes spp. En peces predominan formas alargadas y plateadas Polydactylus octonemus, Cynoscion arenarius, Cynoscion nothus, Harengula jaguana, Diapterus rhombeus, Eucinostomus gula, y Trichiurus lepturus no presente en la fotografía. Además están presentes Porichthys porosissimum, Syacium gunteri y eventualmente Scorpaena spp.  Lám. 6. Captura demersal del Crucero OPLAC/P-6 en la Zona A para la época de secas. Se observan algunos macroinvertebrados com Luidia clathrata, Callinectes spp. En peces una gran variedad de familias, predominando nuevamente las formas alargadas y los colores plateados Trachurus lathami, Upeneus parvus, Sphyraena guachancho, Synodus foetens, Caulolatylus intermedius, ya algunas especies comprimidas dorsoventralmente como Syacium gunteri, Raja texana, entre otros.  Lám. 7. Captura demersal del Crucero OPLAC/P-6 en la Zona B para la época de secas. Se observan algunas puestas de gasterópodos y algunos equinodermos. En peces una gran variedad de formas y colores, predominando familias típicamente marinas, Chaetodipterus faber, Lutjanus synagris, Lutjanus campechanus, Priacanthus arenatus, Balistes capriscus, Haemulon plumieri, Acanthostracion quadricornis, Arius felis, Rhinobatus lentiginosus, entre otros.  Lám. 8. Captura demersal del Crucero OPLAC/-5 en la Zona B para la época de nortes. Se observan distintos macroinvertebrados, numerosos Strombus alatus, Turbunella angulata, esponjas, ascidias coloniales, Luidia clathrata, cangrejos; además de macroalgas. En peces una gran variedad de familias y formas, Cynoscion nothus, Cynoscion arenarius, Stellifer spp, Haemulon aurolineatum, Haemulon plumieri, Eucinostomus spp, Diapterus rhombeus, Polydactylus octonemus, Arius felis, Lutjanus synagris.
Figura 16 El grupo mejor representado es el compuesto por familias típicas demersales influido en gran medida por los métodos de pesca empleados; sin embargo, es importante señalar la gran cantidad de familias de este grupo que se presentan en el área, ejemplo de éstas son: Ariidae, Synodontidae, Bothidae, Trichiuridae, Mullidae, Triglidae. El total de estas familias se reporta como muy frecuente en los arrastres de camarón en diferentes áreas del Golfo de México (Gunter, 1945; Hildebrand, 1954, 1955; Moore et al., 1970; Klima, 1976; Smith, 1976; Chittenden y McEachran 1976; Fischer, 1978; Topp y Hoff, 1979; Sánchez-Gil et al.,1981; Darnell et al., 1983). En este grupo se incluyen en su mayoría familias de hábitos costeros cuyos patrones de alimentación se encuentran asociados a los cambios nictemerales en su mayoría presentan hábitos nocturnos, predominando los consumidores de segundo y tercer orden; estas familias presentan una gran variedad de grupos tróficos incluyendo poliquetos, moluscos, equinodermos, anémonas, crustáceos, estomatópodos, anfípodos, crustáceos y una gran variedad de peces. Estas familias constituyen un grupo permanente cuyas especies mantienen, en gran parte, la diversidad de las comunidades. Aún cuando algunas de estas familias sólo se encuentran representadas por una especie, la persistencia y predominancia de este grupo hace que contribuyan en total con un alto número de especies, un alto número de individuos y los valores más altos de biomasa por lo que sus variaciones estacionales, tanto en diversidad como en abundancia, son pocos evidentes en las comunidades. La mayoría de estas familias son eurihalinas, algunas de ellas tipifican las áreas litorales vegetadas como son: Gerreidae, Sciaenidae, Sparidae, Tetraodontidae (Aguirre Leónet al., 1982; Aguirre León y Yánez-Arancibia, 1985; Chavance et al.,1984, 1986; Mallard Colmeneroet al., 1982). Como una particularidad que cabe mencionar dentro de este mismo grupo son aquellas familias cuyos hábitos se encuentran relacionados con áreas de arrecifes coralinos o fondos de alto contenido calcáreo, éstas son: Priacanthidae, Pomadasyidae, Ostracidae, Balistidae, Scorpaenidae, Lutjanidae; estas familias presentan la mayor variedad de formas y colores. En áreas cálidotempladas y tropicales se ha observado la predominancia de familias de este tipo. Yánez-Arancibia (1986) menciona que un punto focal sobre la ictiofauna de estuarios y arrecifes de coral en los últimos años ha sido la documentación y calificación de la importancia de la zona costera en los ciclos de vida de estos peces. Un aspecto que ilustra este planteamiento es la frecuencia de estas familias en áreas costeras de alta actividad humana donde predominan zonas de desechos (depósitos de basura), arrecifes artificiales, plataformas de petróleo, incluyendo barcos abandonados, la mayoría de familias relacionadas a estas estructuras son residentes, aún cuando otra gran mayoría utilizan estas zonas de manera ocasional (Bright y Pequegnat, 1974; Smith, 1976; Darnell et al., 1983). Patrones de diversidad y abundanciaA lo largo de ese estudio se observó que las comunidades de peces se presentan en agrupaciones de poblaciones reflejando en su relación con el patrón ambiental una gran afinidad a las áreas o hábitats que les son propicias. En general esta es una comunidad homogénea en cuanto a su estructura general; sin embargo, a lo largo de las diferentes épocas climáticas muestreadas, la composición de especies varia en cada uno de los subsistemas ecológicos de la Sonda de Campeche y como consecuencia ecológica los valores totales de diversidad en número de especies y abundancia de biomasa de cada uno de estos hábitats, presenta variaciones en función del tiempo y el espacio. Durante la época de lluvias (verano de 1978, 1980 y 1981), el conjunto de poblaciones de peces parece distribuirse de manera homogénea en los dos hábitats principales, observándose ligeras diferencias relacionadas con la estabilidad ambiental. Hacia la zona costera y predominantemente hacia la Zona A se presenta la mayor diversidad de especies debido posiblemente a la mayor heterogeneidad ambiental (influencia epicontinental, turbulencia, mayor cantidad de materia orgánica). Sin embargo, los valores de abundancia de biomasa en ambas zonas es muy semejante (Tabla 20). De manera particular en el verano de 1981 (Crucero OPLAC/P-4), el número de especies y aporte de biomasa presentó un patrón ligeramente diferente. Se encontró un incremento de biomasa en ambos subsistemas con el valor más alto en la Zona A y el número de especies ligeramente menor que en la Zona B, esto sugiere una comunidad de menos especies pero de mayor tamaño. El análisis integrativo por zonas para esta época climática, presenta, en cuanto a número de especies, el valor más alto para laZona A, y las variaciones están dadas por el incremento de la biomasa, lo que determina un predominio de la Zona A sobre la B para ambos índices ecológicos. 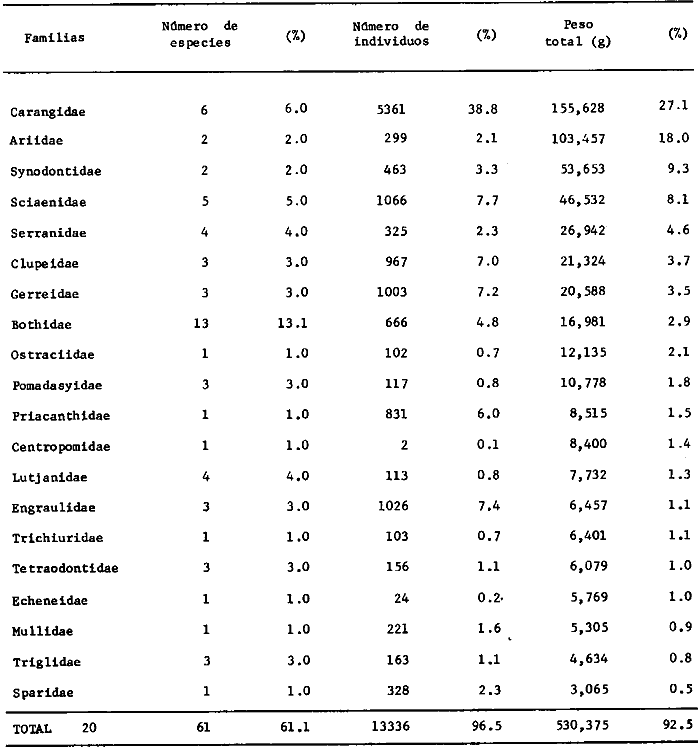 TABLA 15. DIVERSIDAD, DENSIDAD Y BIOMASA DE LAS FAMILIAS "TIPO" Y SU RELACIÓN CUANTITATIVA EN LA CAPTURA TOTAL DURANTE EL VERANO DE 1978 (CRUCERO OPLAC/ P-1) 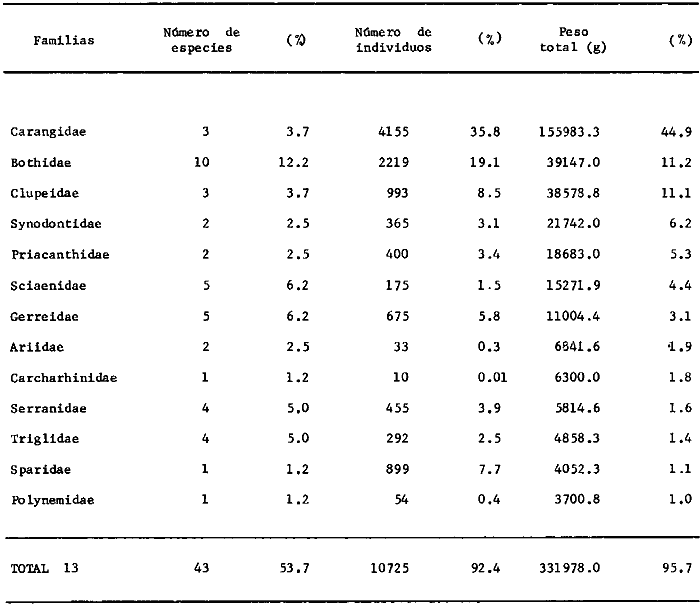 TABLA 16 DIVERSIDAD, DENSIDAD Y BIOMASA DE LAS FAMILIAS "TIPO" Y SU RELACIÓN CUANTITATIVA EN LA CAPTURA TOTAL DURANTE EL VERANO DE 1980 (CRUCERO OPLAC/P-2) 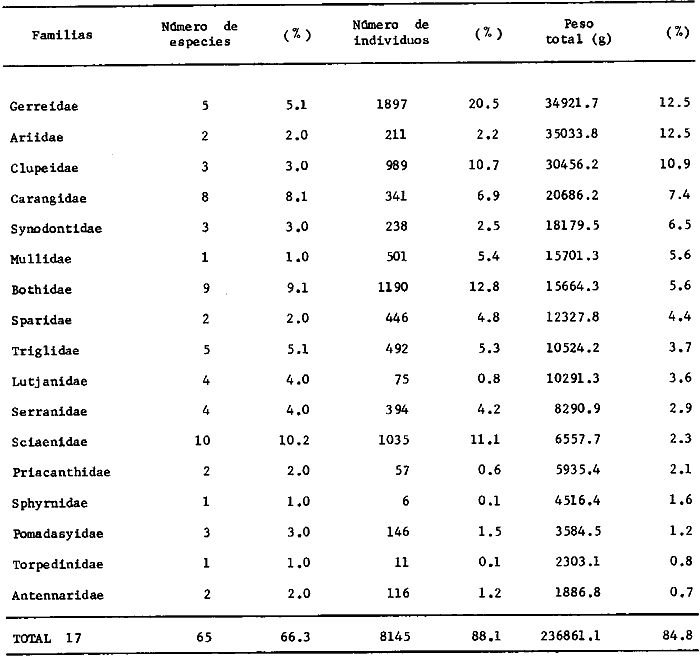 TABLA 17 DIVERIDAD, DENSIDAD Y BIOMASA DE LAS FAMILIAS "TIPO" Y SU RELACIÓN CUANTITATIVA EN LA CAPTURA TOTAL DURANTE EL OTOÑO DE 1980 y 1981 (CRUCERO OPLAC/ P 3-5) 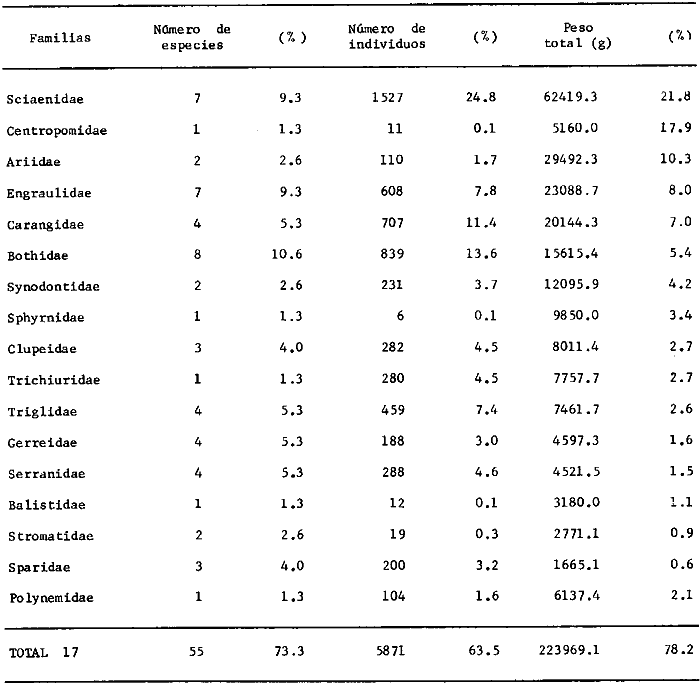 TABLA 18 DIVERSIDAD, DENSIDAD Y BIOMASA DE LAS FAMILIAS " TIPO " Y SU RELACIÓN CUANTITATIVA EN LA CAPTURA TOTAL DURANTE EL VERANO DE 1981 (CRUCERO OPLAC/ P-4) 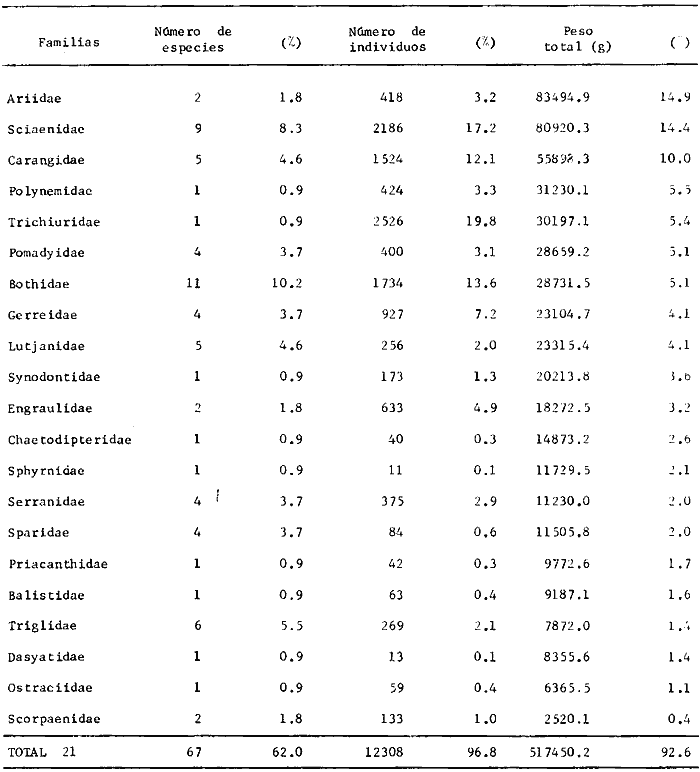 TABLA 19 DIVERSIDAD, DENSIDAD Y BIOMASA DE LAS FAMILIAS " TIPO" Y SU RELACION CUANTITATIVA EN LA CAPTURA TOTAL DURANTE EL INVIERNO DE 1982 (CRUCERO OPLAC/ P-6) Durante la época de "nortes" (otoño de 1980 y 1981), el conjunto de poblaciones de peces mostró en su análisis integrativo (crucero denominado como OPLAC/P 3-5) diferencias significativas definidas entre subgrupos de poblaciones correlacionadas con el comportamiento ambiental, comprobándose la existencia de las Zonas AyB ya mencionadas. El valor total del número de especies y aporte de biomasa en esta época climática, mostró un patrón muy semejante al observado para el área en la época de lluvias. Se presentó un alto número de especies; sin embargo, en este periodo la biomasa es comparativamente baja (pero mayor a la biomasa del verano de 1981) (Tabla 20). Este patrón puede deberse a un incremento tanto en el número de especies (probablemente especies migratorias que durante esta época se acercan a la línea de costa), como al tamaño y abundancia de las mismas. Durante la época de secas (invierno de 1982), el conjunto de poblaciones de peces mostró un patrón muy semejante al observado en el área durante el verano de 1981 (Crucero OPLAC/P-4), donde el aporte de biomasa es proporcionalmente mayor en laZona A, y en ambos casos, el número de especies resultó ser mayor en la Zona B (Tabla 20). Esto puede estar relacionado en primer término con un incremento aparente en el número de individuos (por reclutamiento de juveniles en áreas de mayor influencia estuarina) y por tanto un mayor aporte de biomasa hacia laZona A, mientras que en la Zona Bexiste un mayor número de especies representadas por menos individuos. Por último, el análisis que integra el número total de especies en cada una de las Zonas A y B, y la biomasa de la captura total respectiva durante las diferentes épocas muestreadas, presenta un patrón semejante en el comportamiento de ambos parámetros ecológicos en los dos subsistemas (Zonas A y B). En él, se observa una diversidad muy alta y semejante para cada una de las zonas, así como un alto valor de biomasa promedio. El número de especies resulta ser ligeramente mayor en la Zona B,mientras que la biomasa total es definitivamente mayor en la Zona A,como ha venido observándose a lo largo del análisis particular de cada época muestreada (Tabla 20). En términos generales, en el sistema estudiado, la distribución espacial de la biomasa mostró un patrón semejante para las diferentes épocas analizadas, donde los mayores valores se encuentran hacia la región costera. Este patrón parece estar controlado por la influencia estuarina en la Zona A y mecanismos ecológicos que operan en las praderas de Thalassia testudinum en la Zona B (Yánez-Arancibia, 198la; Vargas Maldonado et al., 1981). Es evidente que la distribución de la biomasa mostró un patrón espacial regular para las diferentes épocas analizadas (Fig. 17), observándose un gradiente donde los mayores valores tienden a presentarse hacia la región costera del área de estudio, y los más bajos a partir de la isóbata de los 10 m hacia la zona más profunda. Para la diversidad, la explicación del patrón de distribución espacial es complicada. Sin embargo, parecen presentarse algunas características evidentes. Dentro de la Zona A, los valores más bajos se sitúan en la zona costera por influencia de los sistemas estuarinos, aparentemente en relación con el estres de salinidad, turbidez y disponibilidad de alimento. En la Zona B, estos valores se restringen a pequeñas áreas sin un patrón uniforme. Los valores mayores de diversidad se localizan en: 1) la Zona B,2) la zona de transición entre la Zona Ay laZona B y, 3) hacia la región más profunda de ambos subsistemas. 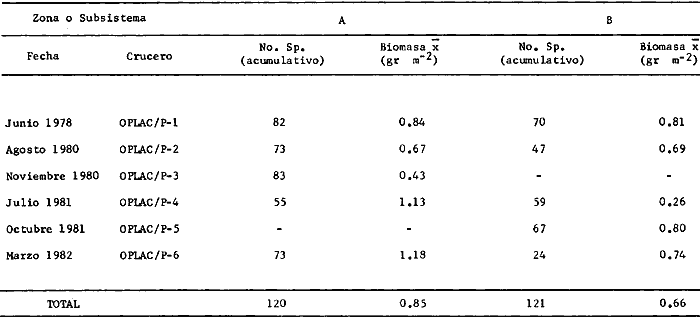 TABLA 20. DISTRIBUCIÓN TEMPORAL DEL NÚMERO DE ESPECIES Y LA BIOMASA EN LOS DOS SUBSISTEMAS ECOLÓGICOS DE LA SONDA DE CAMPECHE. 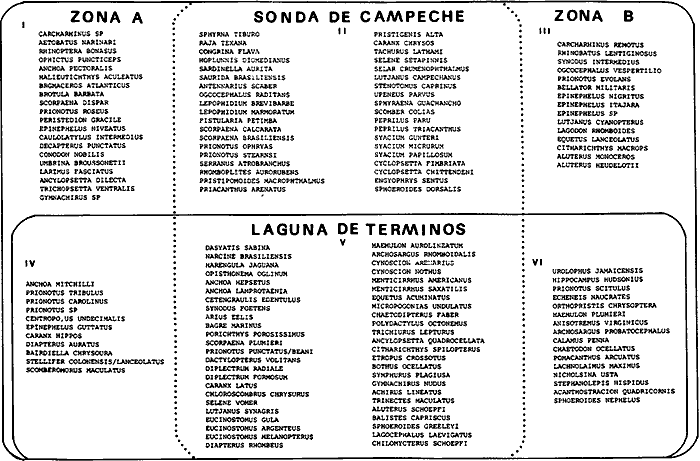 Fig. 17. Diagrama que muestra la distribución especial de las 152 especies de peces analizadas. Se destacan las interacciones de las asociaciones de especies tanto como en los subsistemas de la Sonda de Campeche, como su relación con la Laguna de Términos. En estos patrones de distribución espacial se hace evidente que los valores más bajos de diversidad tienden hacia las zonas donde existe mayor heterogeneidad ambiental; sin embargo, en estas mismas zonas se encontró la distribución de los más altos valores de biomasa. Esto significa que en dicha área se están detectando pocas especies pero que aportan una biomasa alta como posible respuesta a la alta productividad que prevalece en el área. En cambio hacia mar abierto a mayores profundidades, puede verse que aumenta la diversidad de las poblaciones dentro de ambientes de gran estabilidad disminuyendo la biomasa. El aumento o disminución de la biomasa está también determinado por los patrones de migración de las especies costeras de hábitos estuarinos. De esta manera puede explicarse los altos valores de biomasa en la región costera cerca de la Boca de Puerto Real (Laguna de Términos), donde pocos individuos pero de gran tamaño entran a la laguna para realizar funciones biológicas específicas (Bravo Núñez y Yánez-Arancibia, 1979) y hacia la salida de la laguna en la Boca del Carmen, como resultado de peces pequeños pero muy abundantes que salen del sistema hacia el mar, o utilizan estas áreas como zonas de crianza y protección (Alvarez Guillén et al., 1985). Aspectos más detallados de estas relaciones de interacción ecológica entre la Laguna de Términos Sonda de Campeche y la función de sus bocas de conexión se analizan en los trabajos de Yánez-Arancibiaet al., 1985a y 1985b. La distribución espacial de las 152 especies registradas en el área de estudio, permite presentar un modelo conceptual de interacción entre las poblaciones de peces (Fig. 17). I. Asociación de poblaciones distribuidas exclusivamente en laZona A. II. Asociación de poblaciones distribuidas en común para lasZonas A y B. III. Asociación de poblaciones distribuidas exclusivamente en laZona B. IV. Poblaciones exclusivas de la Zona A que son dependientes estuarinos (Laguna de Términos). V. Asociación de poblaciones comunes entre las Zonas A yB que son dependientes estuarinos. Esta figura muestra que la caracterización de especies, en base a su distribución y frecuencia dentro del sistema de la plataforma continental, presenta una alta y complicada interacción entre esta área y los sistemas estuarinos adyacentes (Laguna de Términos). Esto resulta de gran trascendencia para explicar las interrelaciones existentes entre dichos sistemas, desde el punto de vista de los mecanismos de intercambio de especies y la dinámica ecológica de las mismas. Los parámetros ecológicos de las comunidadesEl análisis comparativo de los diversos parámetros de las comunidades, para cada subsistema por épocas climáticas, mostró que los valores más altos de densidad y biomasa se registraron durante la época de secas y los más bajos durante la época de "nortes" Esto parece estar correlacionado con el patrón de descarga de los sistemas estuarinos adyacentes, donde se ha observado el comportamiento inverso. Yánez-Arancibia y Day (1982) y Day et al. (1982) mencionan que los niveles de nutrientes en el sistema estuarino de la Laguna de Términos, son significativamente altos durante las épocas de máxima descarga de los ríos (final de la época de lluvias y principio de la época de "nortes"). Durante este periodo Yánez-Arancibia et al. (1982b), reportan en este mismo sistema, los valores más altos de biomasa, número de especies y abundancia de juveniles (Fig. 18). El índice de riqueza de especies (D), mostró los valores más altos hacia el final de la época de lluvias y comienzos de la época de "nortes". Esta tendencia estacional aparentemente está definida por la heterogeneidad ambiental característica de dicho periodo, y se aprecia más claramente para la Zona A,la cual recibe el mayor aporte fluviolagunar (Fig. 18), En relación a los índices H'n y J' se aprecian pequeñas variaciones debidas principalmente a la presencia de especies dominantes. Los índices de diversidad tanto en número (H'n) como en biomasa (H'w) son comparativamente mayores que los valores de otras áreas de Centro y Norteamérica con características semejantes al sistema estudiado (Yánez-Arancibia et al., 1984), La magnitud y correlación entre H'n y H'w mostradas comparativamente, parecen estar controladas por la latitud geográfica, condiciones meteorológicas, procesos ecológico-costeros y los mecanismos de producción propios para cada sistema referido (Fig. 18). 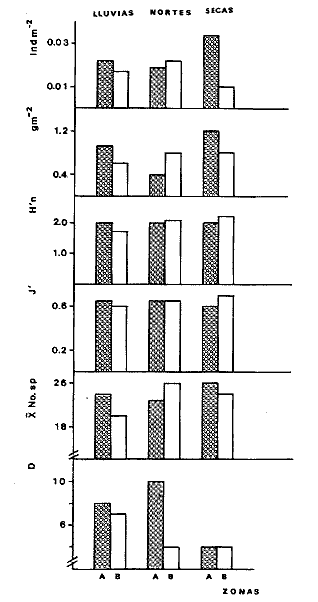 Fig. 18. Variación temporal y espacial de los distintos parámetros ecológicos de las poblaciones de peces (i.e., densidad, biomasa, índices de diversidad). Se muestra su distribución en los dos subsistemas ecológicos del área de estudio durante las tres épocas climáticas marcadas. Época de lluvias (junio a septiembre), época de nortes (octubre a enero) y época de secas (febrero a mayo). Poblaciones de peces dominantesEcología de especies dominantesLas aguas tropicales y subtropicales sostienen un mayor número de especies de peces que las aguas de zonas templadas (Yánez-Arancibia, 1978, 1986; Yánez-Arancibia et al., 1980; Saila y Roedel, 1980; Mercer, 1982, Pauly, 1979, 1980; Pauly y Mines, 1982: Pauly y Murphy, 1982). Las especies dominantes de zonas templadas se definen tradicionalmente por su abundancia numérica; sin embargo, existe poca información sobre el estudio de especies dominantes en áreas tropicales y subtropicales, donde las interacciones entre los organismos y el medio ambiente son muy sutiles y complicadas por encontrarse en un contexto de comunidades multiespecíficas o de alta diversidad. Ante esta complejidad de interacciones el concepto de especies dominantes en aguas tropicales y subtropicales debe incluir un mayor número de variables ecológicas. Yánez-Arancibia et al. (1985d) consideran que, además de: 1) la abundancia numérica, debe tomarse en cuenta, 2)abundancia en peso y, 3) su amplia distribución entre los límites convencionales del ecosistema en estudio. La fauna ictiológica de la plataforma continental de la Sonda de Campeche, está compuesta por no menos de 270 especies (Sánchez-Gil et al., 1981; Yánez-Arancibiaet al., 1985b y 1986). En este trabajo se analizan cuantitativamente 152 de estas especies. Por medio del análisis de los parámetros de distribución, frecuencia de aparición, abundancia numérica y abundancia en peso de estas especies; se determinaron 32 como típicas y dominantes de las comunidades en estudio. Estas especies presentaron los valores más altos de abundancia numérica y peso constituyendo entre 80-87% en número y entre 61-83% en peso de la captura total (Tabla 21), y presentaron la distribución más amplia en la región de estos estudios. Este análisis fue hecho para cada uno de los muestreos durante las diferentes épocas climáticas estudiadas, encontrándose que, dependiendo de las variaciones ambientales estacionales, un grupo compuesto por 14 y hasta 18 especies predominan y/o caracterizan a las comunidades dé peces demersales en la Sonda de Campeche. Este grupo de especies varía etacionalmente en su composición, estructura y función (hábitos) en el ecosistema. Las especies que caracterizan a las comunidades y su dominancia ecológica puede definirse en tres grupos principales según sus patrones de abundancia en peso y densidad, hábitos, Y estrategias biológicas: a) Aquellas especies cuyos parámetros ecológicos son dominantes a lo largo de todo el año. Este grupo está compuesto por especies de hábitos costeros, las cuales se distribuyen ampliamente en el área de estudio y cuyos patrones de abundancia tanto en peso como en número de individuos son muy homogéneos espacial y temporalmente. Algunas de estas especies presentan hábitos pelágicos como son: Harengula jaguana, Chloroscombrus chrysurus; otras son especies demersopelágicas como Polydactylus octonemus, Eucinostomus gulayDiplectrum radiale; sin embargo, es muy evidente la dominancia de especies típicamente demersales como son: Synodus foetens, Arius filis, Cynoscion nothus, Prionotus punctatus/beani, Syacium gunteri. Cabe mencionar que todas estas especies, con excepción de Syacium gunteri son especies con dependencia estaurina y han sido reportadas en el interior de la Laguna de Términos, donde también en su mayoría son especies consideradas como dominantes ecológicas (Yánez-Arancibia y Lara-Dominguez, 1983; Yánez-Arancibia et al., 1980 y 1982b, Alvarez Guillén et al., 1985). Para este grupo a) ver figuras 19 a 28. b)Aquellas especies que estuvieron presentes en el área de estudio en gran parte del año; sin embargo, por sus índices ecológicos resultaron ser dominantes sólo durante una de las épocas del año. Los patrones de distribución y abundancia de estas especies fue variable tanto espacial como temporalmente. Durante la época de lluvias predominaron especies de hábitos típicamente marinos, algunas de ellas pelágicas como: Trachurus lathami y Sardinella aurita, o típicas demersales como: Serranus atrobranchus y Priacanthus arenatus. Otras especies de este mismo grupo son especies de hábitos costeros, de aguas someras y de dependencia estuarina como son: Symphurus plagiusa, Cynoscion arenarius, Lagocephalus laevigatus y Citharichthys spilopterus; todas ellas típicamente demersales. Durante la época de "nortes" predominaron especies de hábitos costeros asociados a aguas someras Y de dependencia estuarina, típicamente demersales como son Porichthys porosissimus, Bagre marinus, Etropus crossotus; otras demersopelágicas como Eucinostomus argenteus y Upeneus parvus, esta última especie típicamente marina. Durante la época de secas, cabe destacar que sólo una especie fue claramente dominante;Lutjanus synagris, esta es una especie de hábitos marinos demersopelágicos, de dependencia estuarina; esta especie presentó variaciones muy evidentes en su abundancia numérica y de peso, espacial y temporalmente. Para este grupo b) ver figuras 29 a 42. c) Aquellas especies cuya dominancia ecológica fue observada durante dos de las tres épocas climáticas de la región. Este grupo se constituye de especies que en su mayoría estuvieron presentes en el área, durante todo el año; sin embargo, sus variaciones estacionales de distribución y abundancia fueron muy marcadas. Durante las épocas de lluvias y secas, predominaron especies de aguas someras asociadas a aguas estuarinas como son:Stellifer colonensis/lanceolatus y Trichiurus lepturus de hábitos típicos demersales, y de hábitos pelágicosCetengraulis edentulus ySelene setapinnis, aún cuando esta última especie es típicamente marina. Durante las épocas de lluvias y nortes se destacan Stenotomus caprinus de hábitos típicamente marinos demersales, y Opisthonema oglinumuna especie pelágica de dependencia estuarina. Por últimoHaemulon aurolineatum, de hábitos demersopelágicos, asociada a fondos arenosos y de dependencia estuarina ( Figs. 43 a 49 ) El análisis de estas variaciones estacionales de los parámetros ecológicos de distribución y abundancia de las distintas especies que tipifican a las comunidades estudiadas, permite resaltar las adaptaciones y estrategias ecológicas de las poblaciones cuyos patrones de migración relacionados a la reproducción, alimentación, protección, se encuentran altamente integrados a los procesos físicos y heterogeneidad ambiental de la zona costera. En el sur del Golfo de México, la estacionalidad en la descarga de ríos, consecuencia de la época de lluvias entre junio y noviembre, controla la abundancia de especies en la plataforma interna. De estas especies las típicamente marinas se mantienen alejadas de los procesos estuarinos; sin embargo, durante este periodo aumentan su abundancia en la plataforma continental y la mayoría de ellas reclutan juveniles a sus poblaciones (Figs. 29, 32 y 47). Las especies con dependencia estuarina durante esta época, tienden a acercarse y permanecer en la línea de costa, muchas de ellas llegan a penetrar a la Laguna de Términos (Figs. 36 y 44), o permanecen en alguna de las bocas de conexión y áreas de mayor influencia marina (Figs. 43 y 45) (Sánchez-Gilet al., 1981; Yánez-Arancibiaet al., 1985b.). Por otra parte, de noviembre a mayo, durante la época de secas y mayor frecuencia de nortes (entre octubre-noviembre y febrero-marzo), la abundancia y distribución de las comunidades de peces se encuentran controladas por las condiciones climático-meteorológicas predominantes; en este periodo las especies dominantes son típicamente demersales y de hábitos costeros, las cuales se acercan a la línea de costa donde permanecen, y en su totalidad por su dependencia estuarina penetran a la Laguna de Términos (Figs. 24, 25, 34 y 35) (Yánez-Arancibia et al., 1985b). Durante este estudio el 75% de las 32 especies que tipifican la estructura y función de las comunidades de peces de la plataforma continental presentan dependencia estuarina y se han colectado en el interior de la Laguna de Términos, siendo que muchas de ellas también se consideran dominantes ecológicos en este sistema estuarino. Esto sugiere la existencia de patrones de migración o colonización, y numerosas interrelaciones de peces entre la plataforma continental y dicho sistema estuarino. A este respecto, Bravo Núñez y Yánez-Arancibia (1979), Yánez-Arancibiaet. al. (1980 y 1982b, 1986, 1985a y 1985d), Yánez-Arancibia y Lara-Domínguez (1983) y Alvarez Guillénet al. (1985) presentan evidencia de que existen migraciones estacionales de especies con ciclos de vida dependientes-estuarinos. Esto pone en evidencia la trascendencia ecológica de la Laguna de Términos en la organización biológica y la productividad de peces de la Sonda de Campeche. Los peces de la zona costera (plataforma interna) poseen diversos hábitos alimenticios; planctónicos, carnívoros y omnivoros, un gran número de ellos son carnívoros (piscívoros) y el resto presentan un amplio espectro trófico. Diversos autores (Venkataraman, 1960; Srinivasa Rao,1967; Yánez-Arancibia et al., 1985d) han reportado la alta correlación entre la variación estacional de los hábitos alimenticios de estas especies y la disponibilidad de alimento en el medio ambiente. En el presente estudio, un gran número de especies de fondo (Figs. 27, 33, 37, 39 y 49) migran hacia la zona costera durante y después de la época de nortes, principalmente por la alta productividad, el aporte de materia orgánica y la disponibilidad de alimento. Estos factores constituyen los principales mecanismos que controlan los movimientos migratorios de la mayoría de los peces de hábitos costeros; asimismo, Yánez-Arancibia et al. (1985) mencionan que en la zona costera del sur del Golfo de México, recursos pesqueros específicos (de importancia comercial) pueden estar controlados en su abundancia y persistencia por condiciones climático-meterológicas, descarga fluvial y amplitud de marcas entre otros procesos o variables físicas que funcionan como mecanismos de producción pesquera natural en zona costera. Harengula jaguana. Goode y Bean 1879. N. v. "Sardina", "Scaled herring"Distribución Esta especie se distribuye en toda la costa este de los Estados Unidos, las Bahamas, Florida, todo el Golfo de México y Mar Caribe hasta el sur del Brasil (Perry y Perry, 1974; Hoese y Moore, 1977; Fischer, 1978; Sánchez-Gilet al., 1981; Yánez-Arancibiaet al., 1984, 1985e, 1986). Biología y Ecología Fue colectado un total de 2263 ejemplares de esta especie, con una frecuencia de aparición de 46% en el total de las estaciones de los seis cruceros muestreados. En cruceros individuales la frecuencia más alta fue en el mes de junio (15%) y la más baja en marzo (2%), durante las épocas de lluvias y secas respectivamente (Tabla 21),Se presentó ocupando tanto las zonas fangosas como arenosas del área de estudio(Zonas A yB), generalmente entre los 12 y 54 m de profundidad (Fig. 19, Tabla 22). Constituyó el 3.0% de la captura total en peso. En cruceros individuales fue más abundante durante la época de lluvias en el mes de agosto (27.1%); los valores más bajos de abundancia los presentó en marzo durante la época de secas (2.9%). Espacialmente se observó que durante la época de lluvias, la biomasa más alta estuvo asociada a laZona B entre los 20 y 36 m de profundidad, en las épocas de nortes y secas los valores más altos se observaron hacia las áreas más someras, menores de 20 m de profundidad (Fig. 19, Tabla 21). Representó el 4.2% de la captura total en números de individuos. En cruceros individuales la abundancia más alta se presentó en los meses de junio y octubre (29%), durante las épocas de lluvias y nortes respectivamente; los valores más bajos en marzo (2.8%), durante las secas (Tablas 21 y 22). Los ejemplares colectados se distribuyeron en un rango de tallas de 77 a 170 mm (LT), encontrándose individuos mayores de 150 mm, durante todas las épocas climáticas muestreadas. Sin embargo, los individuos más pequeños se capturaron hacia fines de la época de lluvias y principio de la época de nortes (Fig. 19). Se encontró una predominancia de hembras durante las diferentes épocas climáticas muestreadas, en una relación Hembra : Macho de 2:1 y 3:1. Las fases sexuales predominantes fueron II y III durante la época de nortes y II, III y IV durante las épocas de secas y lluvias. Esta especie, presenta hábitos pelágicocosteros; sin embargo, se encuentra muy relacionada a las especies típicas demersales. Es un consumidor de 1er orden (planctófago) cuyo alimento principal lo constituyen: copépodos, ostrácodos, pequeños moluscos, y larvas de crustáceos. Se le considera como una especie con dependencia estuarina. Otras Especies Afines en el Área de Estudio Sardinella auritaCuvier y Valenciennes; Opisthonema oglinumLe Sueur. Observaciones, Antecedentes y Perspectivas Se considera que esta es una especie muy común en aguas someras de fondos fangosos o arenosos del Atlántico. Siendo muy abundante durante el invierno y primavera desde Cabo Cod hasta Florida, donde se usa comúnmente como carnada de especies mayores (Allyn, 1969). Springer y Woodburn (1960) en la Bahía de Tampa y Reid (1955) en Cedar Key Florida, reportan haber colectado a esta especie abundantemente durante todo el año. En general, se le conoce muy bien en los Estados Unidos, considerándosele el más común de los clupéidos de la plataforma continental de Louisiana, Texas y costas adyacentes (Hoese y Moore, 1977) donde presenta patrones estacionales de distribución y abundancia muy marcados, lo que ha sido descrito ampliamente por Darnell et al. (1983). "Chittenden y McEachran (1976), reportan a H. jaguana como una especie muy frecuente en las capturas de camarón (penéidos) al noroeste del Golfo de México, asociándola preferentemente a las áreas de distribución del camarón blanco Peneus setiferus confirmando lo observado por Hildebrand (1954) en Port Aransas Texas donde fue colectada hasta los 34 m de profundidad. Fischer (1978), reporta a esta especie en toda el área del Atlántico Centro Occidental, siendo muy común en el Golfo de México, aguas costeras de Cuba (Guitart, 1974), y Republica Dominicana donde se consume en fresco. En estas áreas la FAO reporta para el año 1975 una captura de más de 1900 toneladas. Se le ha colectado con una talla máxima de 150 mm; sin embargo, en Costa Rica, Perry y Perry (1974) la reportan aunque no muy frecuente hasta de 155 mm. En general los distintos autores la consideran una especie marina presente en áreas de alta salinidad, pero es posible encontrarlas entre 19 y 37.5 ppm (Hoese y Moore, 1977; Franks et al., 1972). Se le ha colectado frente a la desembocadura de ríos (Cervigon, 1966; Walls, 1975), y en el interior de lagunas costeras y estuarios como es en New Port, USA (Turner y Johnson, 1973) y al sur del Golfo de México en el interior de la Laguna de Términos, Campeche, ocupando áreas de alta influencia marina (Yánez-Arancibia et al., 1980, 1985b). 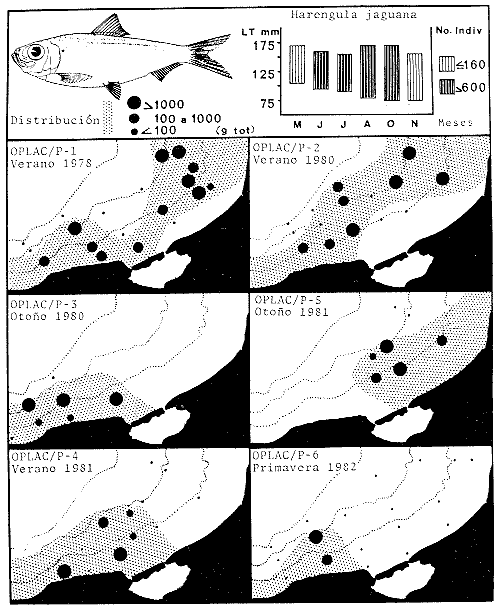 Fig. 19. Patrón de distribución espacial y temporal de Harengula jaguana en la Sonda de Campeche. Se muestra la abundancia de biomasa, densidad y distribución de tallas de las especies en los seis cruceros muestreados.
Tabla 21 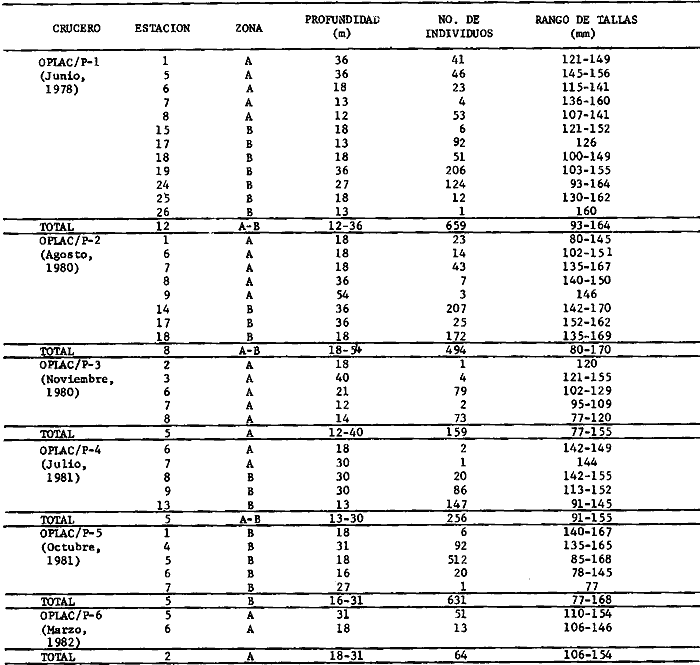 TABLA 22 DISTRIBUCIÓN, ABUNDACION NUMÉRICA Y RANGO DE TALLAS DE HARENGULA JAGUANA EN LAS POBLACIONES DOMINANTES DE LA SONDA DE CAMPECHE Harengula jaguana es una especie típica de las comunidades de peces de la Sonda de Campeche. Por su gran abundancia, frecuencia de aparición, y amplia distribución en el área, se considera que ecológicamente es una especie dominante en estas comunidades y representa un recurso real explotado en México. Se consume localmente en fresco; sin embargo, no se tiene estadísticas pesqueras en particular en el país. Se sabe que esta especie, además de su consumo, es muy útil como carnada de especies de importancia comercial y en la fabricación de subproductos (harinas), lo cual en México es una actividad incipiente. En el área de estudio se encuentran individuos adultos durante todo el año; sin embargo, las tallas pequeñas aún no factibles de ser capturadas se presentan a fines de la época de lluvias y principios de la época de nortes. Por el análisis ecológico de esta especie, sus características de especie dominante en la estructura de las comunidades de peces demersales, el papel ecológico que desempeña en la transferencia energética del sistema a través de sus relaciones tróficas y sus perspectivas como recurso pesquero explotado, es preciso recomendar que la especie sea objeto de estudio en sus aspectos biológicos y dinámica de sus poblaciones para el conocimiento adecuado de su aprovechamiento. Chloroscombrus chrysurus. (Linnaeus, 1776). N.v. "Peto", "Atlantic bumper"Distribución Esta especie se distribuye desde Cabo Cod, Massachusetts, las Bermudas, las Antillas, sur del Golfo de México, Brasil y hasta Uruguay (Beebe y Tee Van, 1970; Hoese y Moore, 1977; Fischer, 1978; Sánchez-Gilet al., 1981; Yánez-Arancibia et al., 1984, 1985e, 1986). Biología y Ecología Fue colectado un total de 5975 ejemplares de esta especie, con una frecuencia de aparición de 62% en el total de las estaciones de los seis cruceros muestreados. Fue una de las especies más frecuentes en el área de estudio. En cruceros individuales la mayor frecuencia la presentó en junio (17%) y la menor en noviembre (4%), durante las épocas de lluvias y nortes respectivamente (Tabla 21). Se colectó durante todas las épocas climáticas ocupando tanto fondos fangosos como arenosos (Zonas A y B),generalmente entre los 11 y 54 m de profundidad (Fig. 20, Tabla 23). Fue una de las especies más abundantes constituyendo el 8.0% de la captura total en peso. En cruceros individuales la abundancia más alta la presentó en junio (29.9%) y la más baja en noviembre (0.1%), durante las épocas de lluvias y nortes respectivamente. Espacialmente se observó que durante las épocas de lluvias y nortes, los valores más altos estuvieron asociados a las profundidades intermedias entre 18 y 36 m tendiendo hacia laZona B,durante la época de secas el patrón se invirtió presentándose los valores más altos cerca de la línea de costa en la Zona A (Fig. 20, Tabla 21). 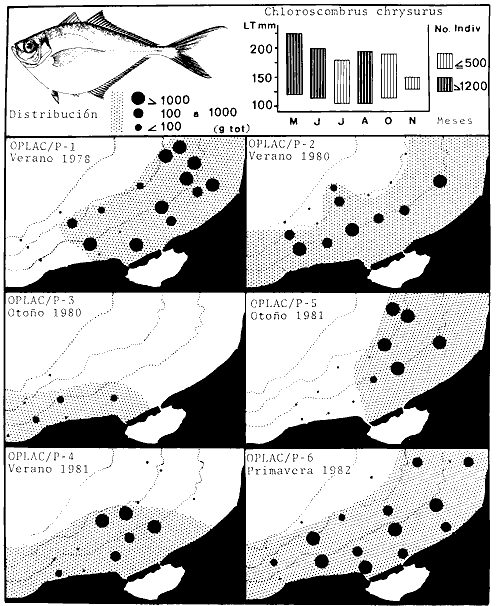 Fig. 20. Patrón de distribución espacial y temporal de Chloroscombrus chrysurus en la Sonda de Campeche. Se muestra la abundancia de biomasa, densidad y distribución de tallas de la especie en los seis cruceros muestreados. 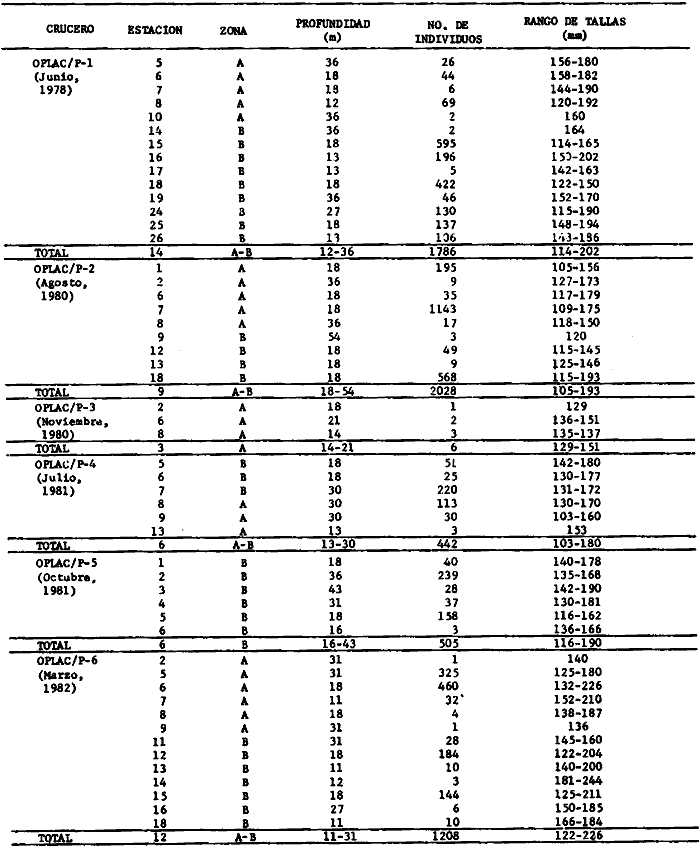 TABLA 23. DISTRIBUCIÓN, ABUNDANCIA NÚMERICA Y RANGO DE TALLAS DE CHLOROSCOMBRUS CHRYSURUS EN LAS POBLACIONES DOMINANTES DE LA SONDA DE CAMPECHE Por su abundancia numérica fue la especie más importante de las comunidades muestreadas, representó el 11.2% de la captura total en número de individuos. En cruceros individuales la abundancia más alta fue en agosto (33.9%) y la más baja en noviembre (0.1%), durante las épocas de lluvias y nortes respectivamente (Tablas 21 y 23). Los ejemplares colectados se distribuyeron en un rango de tallas de 103 a 226 mm (LT), observándose que los individuos mayores de 200 mm, sólo fueron colectados durante la época de secas y los individuos más pequeños se capturaron durante la época de lluvias (Fig.20). La distribución espacial de las diferentes áreas fue muy irregular durante las distintas épocas muestreadas. Durante la época de lluvias y nortes se encontró un predominio de individuos juveniles (en maduración, fase III) y durante la época de secas la mayoría de los individuos colectados fueron maduros (fase IV). Esta especie presenta hábitos pelágico-costeros, gregaria, es eurihalina; sin embargo, se encuentra muy relacionada a las comunidades demersales. Es un consumidor de 20 orden cuya alimentación la constituyen: organismos planctónicos en su mayoría, además de crustáceos, poliquetos, anfípodos y ostrácodos. Otras Especies Afines en el Área de Estudio Selar crumenophthalmus (Bloch). Observaciones, Antecedentes y Perspectivas Esta es una especie de hábitos gregarios que generalmente se encuentra en aguas someras tanto marinas como estuarinas en el Golfo de México, incluyendo áreas de manglar y el interior de lagunas costeras. Darnell et al.(1983), hace un análisis de las variaciones espaciales y temporales de esta especie frente a las costas centrales de Louisiana y Texas, donde se presenta durante el invierno en áreas aisladas entre los 50 y 60 m de profundidad, mientras que en primavera es un poco más abundante a profundidades menores a los 50 m. La mayor abundancia de esta especie en dicha región, se encuentra durante el verano al este de Louisiana y sur de Texas desde la línea de costa hasta los 60 m. En el área noreste del Golfo de México, Gunter (1945) y Hoese y Moore (1977) mencionan que esta especie generalmente ocupa ambientes de alta salinidad y alcanza una talla máxima de 300 mm (LT); por otro lado, diversos autores coinciden en reportar a C. chrysurus como especie de alta incidencia en el interior de aguas protegidas de caracter estuarino corno bahías y lagunas costeras (Cervigon, 1966; Chávez, 1979; Turner y Johnson, 1973; Fischer, 1978; Yáñez-Arancibia et al., 1980, 1983a 1985b, este patrón de dependencia estuarina ha sido observado con frecuencia en otras especies marinas demersales en diversas áreas del Golfo de México (Hildebrand, 1955); Topp y Hoff, 1972; Chittenden y McEachran, 1976, Sánchez-Gil et al., 1981; Yáñez-Arancibia et al.,1985a). Hildebrand (1954) y Chittenden y McEachran (1976), han analizado la distribución de esta especie en el norte del Golfo de México y mencionan su alta frecuencia en las capturas de camarones penéidos tanto café(Penaeus aztecus) como blanco (P. setiferus), siendo más abundante en las capturas de camarón café durante el verano y otoño, coincidiendo con la probable época de reproducción. En las costas del Mar Caribe esta especie alcanza 250 y 300 mm (LT), por lo que su carne se considra de buena calidad aún cuando su cuerpo comprimido le resta valor comercial (Guitart, 1977); sin embago, sus hábitos gregarios y su gran abundancia en países como Colombia y Venezuela permiten que se capture con facilidad y alcance valor económico como pesquería local (Dahl, 1971), se vende en fresco o congelado (Fischer, 1978). Chloroscombrus chrysurus fue una de las especies más frecuentes y mejor representadas en las comunidades de peces demersales en la Sonda de Campeche. Sus variaciones estacionales de distribución y abundancia no son marcados y es posible encontrarla en el área con alta frecuencia durante todo el año. Por su abundancia tanto en peso como en número de individuos, su alta distribución y frecuencia, esta especie se considera típica y ecológicamente dominante en estas comunidades a pesar de sus hábitos pelágicos. En México esta especie representa un recurso pesquero real explotado regionalmente; su consumo es en fresco y ahumado, su importancia radica además en su posible utilización en la fabricación de subproductos. Por el análisis ecológico de esta especie, sus características de especie dominante en la estructura de las comunidades de peces demersales, el papel ecológico que desempeña en la transferencia energética del sistema a través de sus relaciones tróficas y sus perspectivas como recurso pesquero explotado, es preciso recomendar que la especie sea objeto de estudio en sus aspectos biológicos y dinámica de sus poblaciones, para el conocimiento adecuado de su aprovechamiento. Polydactylus octonemusoctonemus (Girard, 1858). N.v. "Ratón", "Atlantic, threadfin"Distribución Esta especie se distribuye desde Massachussetts hasta Florida y toda la costa del Golfo de México, las Antillas, Mar Caribe y hasta Brasil (Hoese y Moore, 1977; Fischer, 1978; Sánchez-Gil et al., 1981; Yáñez-Arancibia et al.,1984, 1985e, 1986). Biología y Ecología Fue colectado un total de 854 ejemplares de esta especie con una frecuencia de aparición de 42% en el total de las estaciones de los seis cruceros muestreados. En cruceros individuales la frecuencia más alta la presentó en marzo (14%) y la más baja en agosto (4%), durante las épocas de secas y lluvias respectivamente (Tabla 21). Esta especie fue regularmente abundante durante todas las épocas climáticas muestreadas, ocupando tanto los fondos fangosos como arenosos del área de estudio (Zonas A y B), generalmente entre 11 y 54 m de profundidad (Fig. 21, Tabla 24). Constituyó el 2.7% de la captura total en peso. En cruceros individuales la mayor abundancia la presentó en marzo (57.2%) y la menor en agosto (2.3%)durante las épocas de secas y lluvias respectivamente. Espacialmente se observó que los valores más altos de abundancia en las épocas de nortes y secas correspondieron a la zona central del área en aguas someras de alta influencia estuarina; durante la época de lluvias el patrón de distribución de biomasa fue poco definido (Fig. 21, Tabla 21). Representó el 1.0% de la captura total en número de individuos. En cruceros individuales la abundancia más alta la presentó en marzo (49.6%) y la más baja en octubre (2.2%) durante las épocas de secas (Tablas 21 y 24). Los ejemplares colectados se distribuyeron en un rango de tallas de 105 a 252 mm (LT), observándose que los ejemplares mayores de 225 mm se colectaron durante las épocas de secas y nortes, y los ejemplares más pequeños sólo se encontraron al comienzo de la época de lluvias (Fig. 21). Esta especie de hábitos pelágico-costeros, gregaria y eurihalina, es muy frecuente en aguas someras y salobres. Se alimenta en fondos fangosos o arenosos, siendo un consumidor de 20 orden cuyo alimento lo constituyen: pequeños crustáceos, otros invertebrados y pequeños peces. Observaciones, Antecedentes y Perspectivas Se considera que P. octonemus es una especie común en aguas someras, marinas y estuarinas en diversas áreas del Golfo de México. En la región de Louisiana y Texas (Gunter, 1945 y 1959; Gowanloch 1965; Walls, 1975), se ha observado que los ejemplares pequeños de esta especie tienden a ocupar aguas someras y salobres durante primavera y verano, mientras que los adultos ocupan aguas marinas más profundas, lo que ha sido observado por otros autores en las costas de Texas (Allyn, 1969; Hoese y Wore, 1977). Chittenden y McEachran (1976) reportan a esta especie como muy abundante en las capturas de camarones peneidos en el noroeste del Golfo de México siendo más frecuente en áreas de camarón blanco(Penaeus seliferus). La mayor abundancia de esta especie en dichas áreas es durante los meses más cálidos (Gunter, 1945; Miller, 1965; Gallaway y Strawn, 1974). Aparentemente ha sido capturada muy abundante y frecuentemente en la Sonda de Campeche durante el mes de febrero (Hildebrand, 1954), la mayoría de los ejemplares capturados fue entre 100 y 156 mm (LT); Franks et al. (1972) reportan un ejemplar de 184 mm y más de 54 gramos de peso en las costas de Texas. Al sur del Golfo de México, en la región de Laguna de Términos y Sonda de Campeche, esta especie ha sido reportada como frecuente; en el interior de la laguna, se le ha colectado como un visitante ocasional en distintos hábitat desde aguas dulces hasta áreas de gran influencia marina (Yáñez-Arancibia et al., 1980 y 1985b). 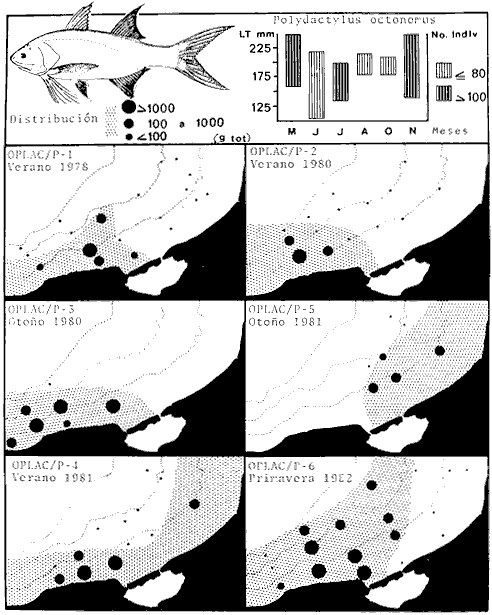 Fig. 21. Patrón de distribución espacial y temporal de Polydactylus octonemus en la Sonda de de Campeche. Se muestra la abundancia de biomas, densidad y distribución de tallas de la especie en los seis cruceros muestreados. 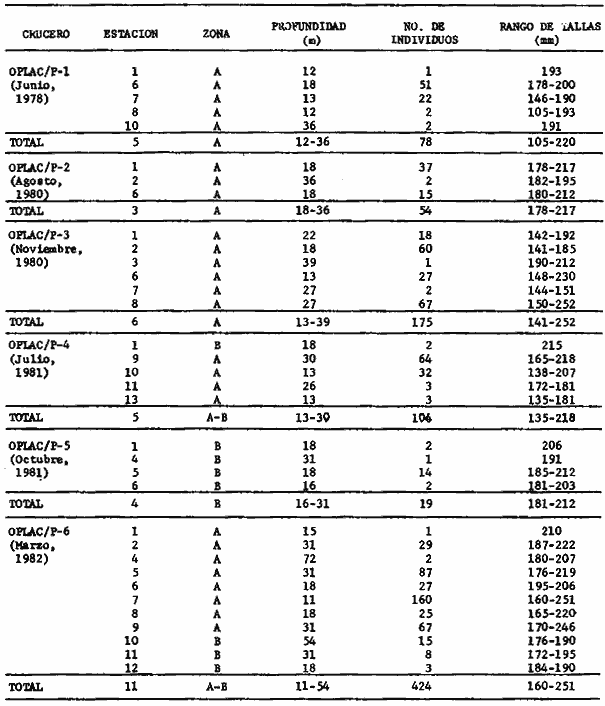 TABLA 24. DISTRIBUCIÓN, ABUNDANCIA NUMÉRICA Y RANGO DE TALLAS DE POLYDACTYLUS OCTONEMUS EN LAS POBLACIONES DOMINANTES DE LAS SONDA DE CAMPECHE. La reproducción de esta especie aparentemente tiene lugar fuera de la línea de costa a fines de invierno y principios de primavera (Gunter, 1945) y se calcula que el promedio de vida de esta especie es de un año (Chittenden y McEachran, 1976). Polydactilus octonemus es una especie frecuente en las comunidades de peces demersales de la Sonda de Campeche. Sus patrones estacionales de distribución y abundancia no son marcados y puede encontrársele durante todo el año. Por su alta frecuencia, amplia distribución y su alta abundancia en peso, esta especie se considera típica y ecológicamente dominante en estas comunidades. La captura de esta especie en México es incidental, ya que ocurre con mucha frecuencia en los arrastres de camarones peneidos y su consumo sólo es local; sin embargo, por su gran abundancia y tallas alcanzadas se considera que representa un recurso potencial con perspectivas para su explotación, puesto que en el país no se conocen estadísticas de su pesquería específica. Por el análisis ecológico de la especie, sus características de especie dominante en las comunidades demersales, el papel ecológico que desempeña en la transferencia energética del sistema a través de sus relaciones tróficas, y sus perspectivas como recurso pesquero potencial; es preciso recomendar que la especie sea objeto de estudio en sus aspectos biológicos y dinámica de sus poblaciones, para el conocimiento adecuado de su posible aprovechamiento. Eucinostomus gula (Cuvier, 1830). N.v. "Mojarra", "Silver jenny"Distribución Esta especie se distribuye desde Massachussetts, las Bermudas, Carolina, las Antillas, Golfo de México, Mar Caribe y hasta el sur de Argentina (Cervigon, 1966; Beebe y Tee Van, 1970; Perry y Perry, 1974; Hoese y Moore, 1977; Fischer, 1978; Sánchez-Gil et al., 1981; Yáñez-Arancibia et al., 1984, 1985e 1986). Biología y Ecología Fue colectado un total de 3 282 ejemplares de esta especie, con una frecuencia de aparición de 77% en el total de las estaciones de los seis cruceros muestreados. Fue una de las especies más frecuentes en el área de estudio. En cruceros individuales la frecuencia más alta la presentó en marzo (19%) y la más baja en octubre y noviembre (7%), durante las épocas de secas y nortes respectivamente (Tabla 21). Se colectó abundantemente durante las distintas épocas climáticas ocupando tanto fondos fangosos como arenosos (Zonas A y B), con una amplia distribución generalmente entre 11 y 54 m de profundidad (Fig. 22, Tabla 25). Fue una de las especies mejor representadas en el área, constituyendo el 3.1% de la captura total en peso, En cruceros individuales la mayor abundancia la presentó en junio (31.5%) y la más baja en noviembre (3.2%), durante las épocas de lluvias y nortes respectivamente. Espacialmente se observó que las áreas de mayor abundancia sí presentaron en aguas someras menores de 20 m cerca de la línea de costa, tendiendo en su mayoría hacia la Zona B de fondos arenosos, se encontraron algunas variaciones durante la época de secas (Fig. 22, Tabla 21). Númericamente esta especie fue una de las más abundantes, representó, el 6.1% de la captura total en número de individuos. En cruceros individuales la abundancia más alta se presentó en junio (28.3%) y la más baja en junio (4.3%) ambos casos durante la época de lluvias (Tablas 21 y 25). Los ejemplares colectados se distribuyeron en un rango de tallas de 57 a 166 mm (LT), observándose que los ejemplares mayores de 150 mm se colectaron sólo durante la época de secas (marzo) y los más pequeños, durante el comienzo de las épocas de lluvias (junio) y nortes (octubre) (Fig. 22). Esta especie presenta hábitos gregarios, es costera y con capacidad eurihalina, se localiza frecuentemente en aguas someras y se alimenta en fondos fangosos o arenosos tanto en áreas protegidas como en mar abierto. Es un consumidor de 1er orden cuyo espectro trófico es muy amplio y se constituye principalmente de invertebrados bentónicos, poliquetos, oligoquetos, copépodos, tanaidáceos, anfípodos y ostrácodos, e importantes cantidades de detritus (Aguirre León y Yáñez-Arancibia, 1986). 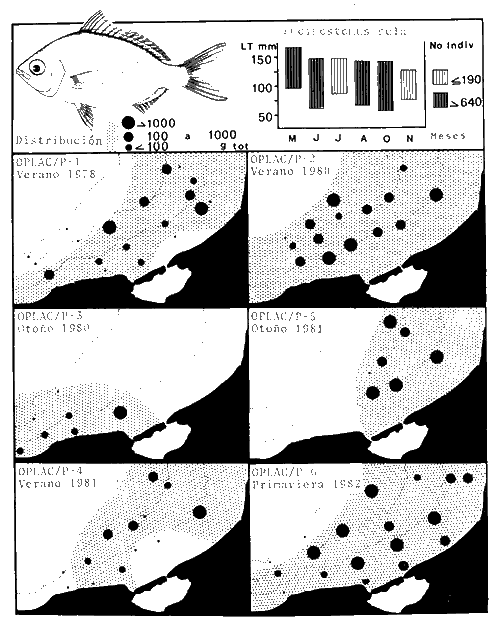 Fig. 22. Patrón de distribución espacial y temporal de Eucinostomus gula en la Sonda de Campeche. Se muestra la abundancia de biomasa, densidad y distribución de tallas de la especie en los seis cruceros muestreados. 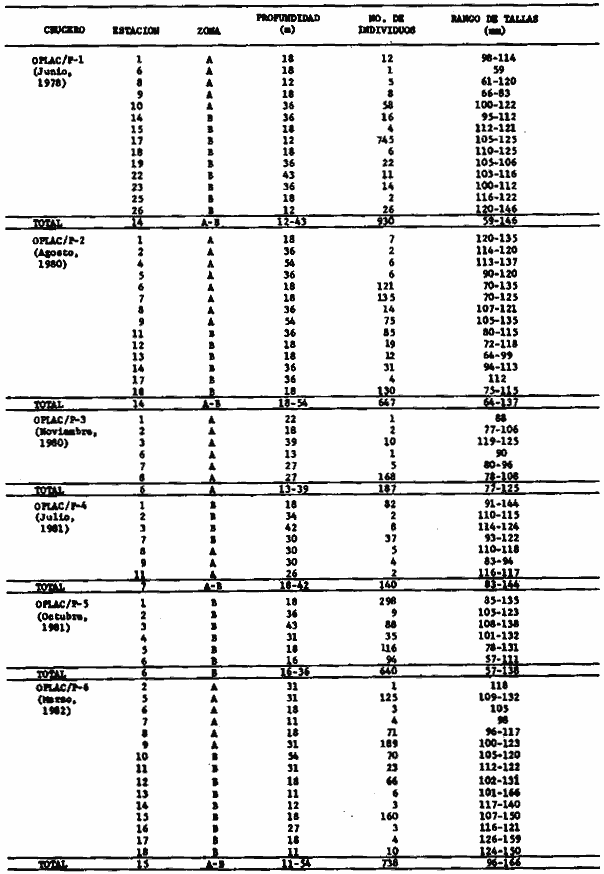 TABLA 25. DISTRIBUCIÓN, ABUNDANCIA NUMÉRICA Y RANGO DE TALLAS DE EUCINOSTOMUS GULA EN LAS POBLACIONES DOMINANTES DE LA SONDA DE CAMPECHE Otras Especies Afines en el Área de Estudio Eucionostomus argenteus Baird y Girard;E. melanopterus(Blecker); Diapterus rhombeus (Cuvier y Valenciennes);D. auratus(Ranzani). Observaciones, Antecedentes y Perspectivas Esta especie ha sido reportada como muy abundante en diversas áreas del Golfo de México y Mar Caribe, habita en aguas someras y es especialmente abundante sobre fondos lodosos. Generalmente los ejemplares pequeños tienden a ocupar áreas protegidas para su crianza y alimentación, considerándosele una especie eurihalina típica de aguas costeras como lagunas, estuarios, áreas de manglar y ambientes marinos vegetados; los adultos tienden en general a ocupar aguas profundas en mar abierto (Gunter, 1945; Hildebrand, 1955; Cervigon, 1966; Turner y Johnson, 1973; Walls, 1975; Chittenden y McEachran, 1976; Fischer, 1978; Aguirre León et al.,1982; Yáñez-Arancibia et al.,1980, 1985b). Hildebrand (1954) y Chittenden y McEachran (1976), la han reportado como una especie muy común en las áreas de distribución del camarón café (Penaeus aztecus) en el noroeste del Golfo de México. En aguas de Louisiana y Texas Hoese y Moore (1977), han observado que alcanza hasta 200 mm (LT) y en algunas áreas de Florida se usa comúnmente como carnada en la pesca de otras especies comerciales (Allyn, 1969); en estas áreas presenta patrones estacionales marcados de distribución y abundancia mismos que han sido descritos por Darnell et. al. (1983), quienes observan una frecuencia muy baja de esta especie en el otoño. Al sur del Golfo de México, en el área de Laguna de Términos y Sonda de Campeche, se le considera la mojarra más abundante y típica de las comunidades de peces que allí habitan (Sánchez-Gil et al.,1981). En el interior de la laguna se le considera como un residente permanente que ocupa aguas protegidas y someras como son áreas de manglares y pastos marinos(Rhizophora mangle y Thalassia lestudinum), ambientes oligohalinos y de arrecifes deCrassostrea virginica y zonas de vegetación sumergida de origen dulceacuícola (Aguirre León et. al.,1982, Yáñez-Arancibia et. al.,1980, 1985d; Aguirre León y Yáñez-Arancibia, 1986), En el Caribe, tanto en las costas de Cuba (Guitart, 1977), Costa Rica (Perry y Perry, 1974) y Colombia (Dahl, 1971), es muy abundante y común en aguas salobres donde se siente el efecto de mareas, en pastos marinos y áreas de fondos arenosos y alcanza entre 150 y 200 mm (LT) como talla máxima; en estas regiones su carne es apreciada y aún cuando no alcanza tallas de importancia comercial ni existen pesquerías específicas se le captura con frecuencia para su consumo. Datos de la FAO de 1975, reportan una captura de más de 5000 toneladas de estas especies en la región del Atlántico Centro Occidental (Fischer, 1978). Eucinoslomus gula es una de las epecies más frecuentes en las comunidades de peces demersales de la Sonda de Campeche. Sus variaciones estacionales de distribución y abundancia tanto en peso como en número de individuos son poco marcadas, encontrándose regularmente durante todo el año, presenta además una amplia distribución y altos valores de frecuencia por lo que se considera una especie típica y ecológicamente dominante en estas comunidades, Esta especie pertenece a una familia de gran importancia económica (Gerreidae) en aguas tropicales y subtropicales de América, y posee grandes perspectivas como recurso pesquero. En México se explota regionalmente y es apreciada como alimento consumiéndose localmente a pesar de que su talla es relativamente pequeña; sin embargo, no se conocen estadísticas de sus pesquerías ni de su rendimiento real en el país. Por el análisis ecológico de la especie, sus características de especie dominante en las comunidades de peces demersales, el papel ecológico que desempeña en la transferencia energética del sistema a través de sus relaciones tróficas, y sus perspectivas como recurso pesquero explotado; es preciso recomendar que la especie sea objeto de estudio en sus aspectos biológicos y dinámica de sus poblaciones, para el conocimiento adecuado de su aprovechamiento (Aguirre-León y Yáñez-Arancibia, 1986). Diplectrum radiale (Quoy y Gaimard, 1824). N.v. "Aguavina", "Sea bass"Distribución Esta especie se distribuye en todo el Atlántico Occidental desde las Islas Bermudas, Florida, Golfo de México, costas del norte del Caribe, Brasil y hasta Uruguay (Cervigón, 1966; Randall, 1968; Bcebe y Tee Van, 1970; Perry y Perry, 1974; Sánchez-Gil et. al., 1981; Yáñez-Arancibia et. al.,1984, 1985e, 1986). Biología y Ecología Fue colectado un total de 653 ejemplares de esta especie, con una frecuencia de aparición de 69% en el total de las estaciones de los seis cruceros muestreados. Siendo una de las especies más frecuentes en el área de estudio. En cruceros individuales la frecuencia más alta fue en marzo, junio y julio (14%) durante las épocas de secas y lluvias respectivamente y la más baja en noviembre (7%), durante la época de nortes (Tabla 21). Fue una de las especies más comunes en el área de estudio y de más amplia distribución, se presentó tanto en fondos fangosos como arenosos (Zonas A y B), generalmente entre 11 y 76 m de profundidad, pero con mayor frecuencia en profundidades mayores a 18 m (Fig. 23, Tabla 26). A pesar de su alta frecuencia constituyó el 0.6% de la captura total en peso. En cruceros individuales los valores más altos los presentó en julio (26,3%) y los mas bajos en octubre (6.6%), durante las épocas de lluvias y nortes respectivamente. Espacialmente se observó que durante las épocas de lluvias y nortes los valores más altos de abundancia se encontraron asociados a las áreas de más de 36 m de profundidad, tendiendo hacia la Zona B, durante la época de secas estos valores se ubicaron en la zona central del área (Fig. 23, Tabla 21). Representó el 1.2% de la captura total en número de individuos. En cruceros individuales la abundancia más alta la presentó en julio y agosto (26%) y la más baja en octubre (5.5%), durante las épocas de lluvias y nortes respectivamente (Tablas 21 y 26). Los ejemplares colectados se distribuyeron en un rango de tallas de 62 a 158 mm (LT), encontrándose individuos de 150 mm sólo a principios de la época de lluvias y durante la época de nortes; sin embargo, los individuos más pequeños se colectaron a mediados de la época de lluvias (Fig. 23). Todos los ejemplares capturados fueron hembras, en distintos estados de madurez. Esta especie presenta hábitos pelágico-costeros, gregaria, con capacidades eurihalinas, asociada alas comunidades demersales la cual al igual que otras especies de la familia Serranidae puede presentar hermafroditismo. Es un consumidor de 3er orden (predominantemente carnívoro) cuya alimentación se constituye de pequeños peces y crustáceos principalmente. Otras Especies Afines en el Área de Estudio Diplectrum formosus(Linnaeus). Observaciones, Antecedentes y Perspectivas Se ha reportado aD. radiale como una especie abundante en diversas áreas del Golfo de México y Mar Caribe; ocupando fondos fangosos, arenosos y zonas de arrecife de coral (Cervigon, 1966; Randall, 1968; Smith, 1976). Se ha observado que los ejemplares jóvenes ocupan las aguas más someras cercanas a las playas, y los adultos las de mayor profundidad, por lo que se hace más difícil su captura (Dahl, 1971; Fischer, 1978). Hoese y Moore (1977), mencionan que esta especie reemplaza a D. bivittatum(Valenciennes) en las aguas del sur de Texas. Esta especie es muy frecuente en las aguas del Mar Caribe; sin embargo, sus tallas son pequeñas, en las costas de Cuba alcanza como longitud máxima hasta 150 mm (LT) (Guitart, 1977), al igual que en Costa Rica donde es muy frecuente desde la línea de playa hasta los 70 m de profundidad (Perry y Perry, 1974). Cervigón (1966), observó en aguas del Caribe un fenómeno muy semejante al encontrado en este estudio, donde el 100% de los ejemplares analizados fueron hembras. En el sur del Golfo de México se considera que al menos durante el verano D. radiale es una especie dominante y típica de las comunidades demersales de la Sonda de Campeche (Sánchez-Gil et. al., 1981); por otro lado, Yáñez-Arancibia et. al. (1985b), consideran a esta especie como un visitante ocasional en las comunidades de peces de la Laguna de Términos, el cual es el único registro que se tiene de esta especie en el interior de aguas estuarinas en el Golfo de México. Diplectrum radiale es una de las especies más frecuentes en las comunidades de peces demersales de la Sonda de Campeche. Esta especie representó variaciones estacionales marcadas en sus patrones de distribución y abundancia, encontrándose en el área de manera regular durante todo el año. Por su abundancia tanto en peso como en número de individuos, su amplia distribución y frecuencia, esta especie se considera típica y ecológicamente dominante en estas comunidades a pesar de sus hábitos pelágicos. Esta especie pertenece a una familia de gran importancia económica (Serranidae); sin embargo, su talla es relativamente pequeña por lo que es poco apreciada como alimento en fresco. En México esta especie representa un recurso potencial, el cual mediante, el procesamiento industrial adecuado puede ser aprovechado para su consumo humano aún cuando en el país esta actividad es todavía incipiente. 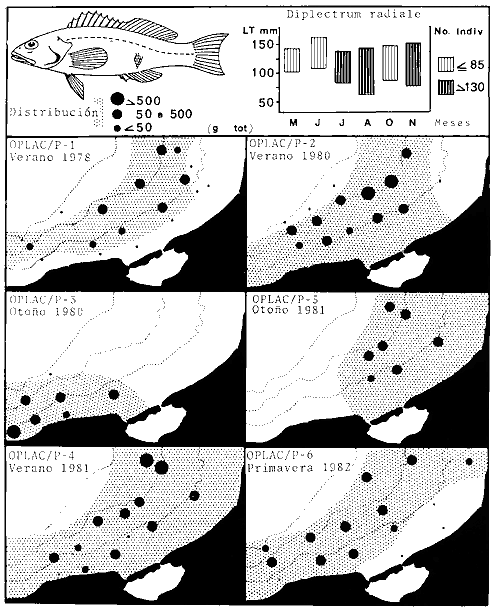 Fig. 23. Patrón de distribución espacial y temporal de Diplectrum radiale en la Sonda de Campeche. Se muestra la abundancia de biomasa, densidad y distribución de tallas de la especie en los seis cruceros muestreados. 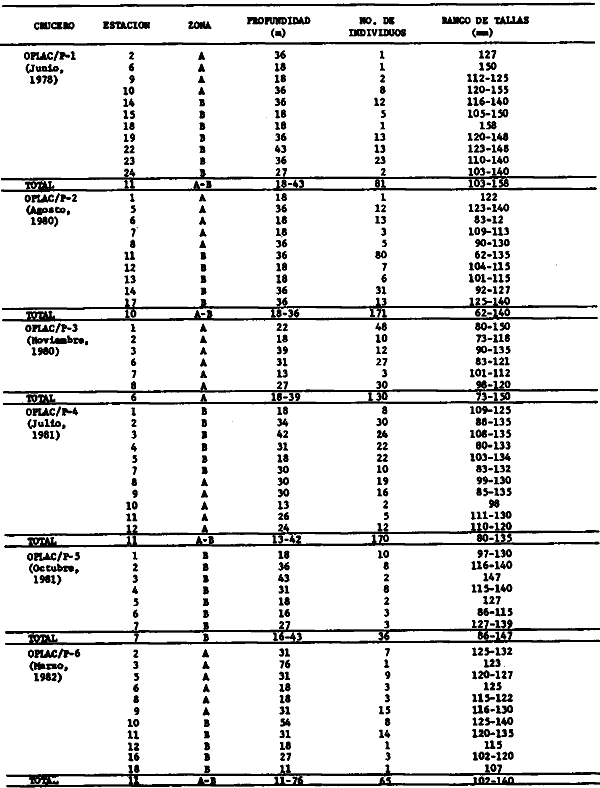 TABLA 26. DISTRIBUCIÓN, ABUNDANCIA NUMÉRICA Y RANGO DE TALLAS DE LA DIPLECTRUM RADIALE EN LAS POBLACIONES DOMINANTES DE LA SONDA DE CAMPECHE Por el análisis ecológico de esta especie, sus características de especie dominante en la estructura de las comunidades de peces demersales, el papel ecológico funcional que desempeña en la transferencia energética del sistema a través de sus relaciones tróficas, y sus perspectivas como recurso pesquero potencial; es preciso recomendar que la especie sea objeto de estudio en sus aspectos biológicos y dinámica de sus poblaciones, para el conocimiento adecuado de su posible aprovechamiento. Synodus foetens (Linnaeus, 1766). N.v. "Chile","Lizard-fish"Distribución Esta especie se distribuye desde Cabo Cod, Massachussets, Bermudas, Antillas, todo el Golfo de México y Mar Caribe hasta el Brasil (Springer y Woodburn, 1960; Cervigon, 1966; Randall, 1968; Allyn, 1969; Bebee y Tee Van, 1970; Perry y Perry, 1974; Fischer, 1978; Sánchez-Gil et. al.,1981; Yáñez-Arancibia et. al.,1984, 1985e, 1986). Biología y Ecología Fue colectado un total de 1494 ejemplares de esta especie, con una frecuencia de aparición de 84% en el total de las estaciones en los seis cruceros muestreados siendo la segunda especie más frecuente de este estudio. En cruceros individuales la frecuencia más alta fue en el mes de junio (20%) y la más baja en noviembre (7%), durante las épocas de lluvias y nortes respectivamente (Tabla 21). Fue una de las especies más comunes en el área de estudio y de más amplia distribución, se presentó ocupando tanto fondos fangosos como arenosos (Zonas AyB), generalmente entre los 12 y 76 m de profundidad (Fig. 24, Tabla 27). Constituyó el 6,1% de la captura total en peso, siendo una de las especies más abundantes. En cruceros individuales los valores más altos los presentó en junio (42.8%) y los más bajos en noviembre (1.9%), durante las épocas de lluvias y nortes respectivamente (Tabla 21). Espacialmente se observó que durante las épocas de lluvias y secas los valores más altos de abundancia corresponden a las áreas más. profundas donde fue colectada esta especie entre 36 y 76 m, en tanto que durante la época de nortes el patrón de distribución de biomasa fue más irregular (Fig. 24, Tabla 21). Representó el 2.8% de la captura total en número de individuos, estando aún representado en todas las épocas del año. En cruceros individuales la abundancia más alta la presentó en junio (31%) y la más baja en noviembre (3%), durante las épocas de lluvias y nortes respectivamente (Tablas 21 y 27). Los ejemplares colectados se distribuyeron en un rango de tallas de 61 a 378 mm (LT), encontrándose individuos mayores a los 370 mm durante todas las épocas climáticas muestreadas; sin embargo, los individuos más pequeños se capturaron con mayor frecuencia en la época de lluvias (Fig. 24). Se colectaron ejemplares juveniles y adultos durante todas las capturas analizadas, encontrándose durante la época de lluvias una relación hembra : macho de 1:1 y durante la época de nortes de 1.5:1 con predominio en ambos casos de individuos jóvenes, durante la época de secas fue de 2:1 predominando ejemplares adultos. Esta especie presenta hábitos costeros, gregarios y con capacidades eurihalinas, es típica demersal. Es un consumidor de 3er orden (carnívoro) cuyo alimento principal lo constituyen: peces, crustáceos y poliquetos. Se ha observado en su ciclo de vida dependencia estuarina. Otras Especies Afines en el Área de estudio Synodus intermedius Agassiz; S. poeyi Jordan;Saurida brasiliensis (Gregan);Trachinocephalus myops (Forster). 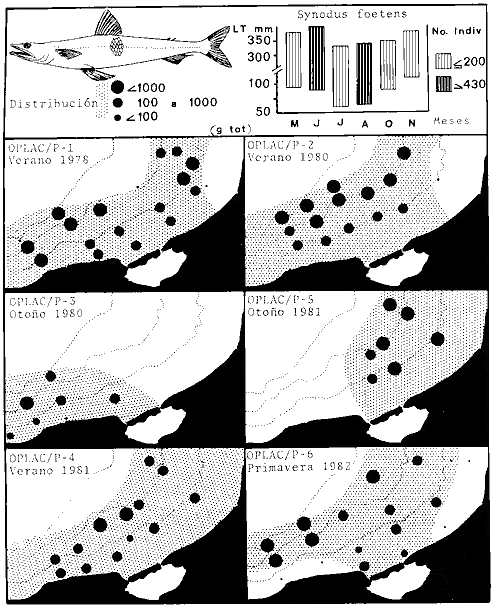 Fig. 24. Patrón de distribución espacial y temporal de Synodus foetens en la Sonda de Campeche. Se muestra la abundancia de biomasa , densidad y distribución de tallas de la especie en los cruceros muestreados. 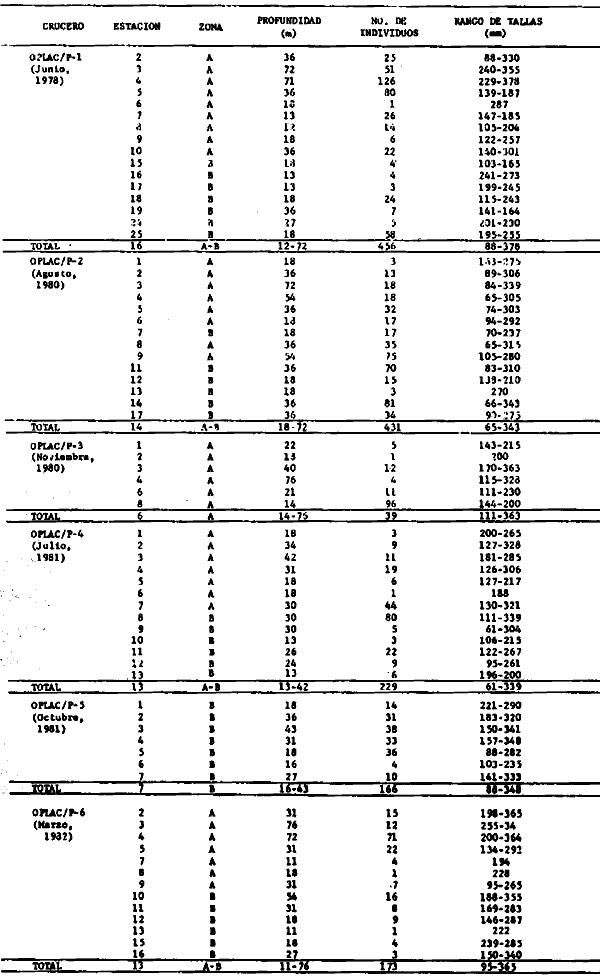 TABLA 27. DISTRIBUCIÓN, ABUNDANCIA NUMÉRICA Y RANGO DE TALLAS DE SYNODUS FOETENS EN LAS POBLACIONES DOMINANTES DE LA SONDA DE CAMPECHE Observaciones, Antecedentes y Perspectivas Es una especie muy común en aguas someras del Golfo de México. En las costas de los Estados Unidos se le considera muy abundante aunque algunos autores reportan que su concentración es menor durante los meses fríos en el área de la Florida y las Bermudas (Springer y Woodburn, 1960; Beebe y Tee-Van, 1970). Es muy frecuente en fondos arenosos, aunque existen autores que sólo la han colectado en fondos fangosos (Reid, 1955; Cervigón, 1966); sin embargo, otros autores reportan haberla colectado indistintamente con gran abundancia en fondos arenosos o fangosos durante todo el año, incluyendo el invierno en las áreas de Mississippi, Texas y otras áreas del norte del Golfo de México (Gunter, 1945; Randall, 1968; Franks et. al., 1972; Walls, 1975). En general, la mayoría de los autores la reportan ocupando áreas entre 40 y 80 m de profundidad, puesto que a profundidades mayores esta especie es reemplazada por S. intermedius y/oS. poeyi (Miller, 1965). Darnellet. al. (1983), hace un análisis detallado de las variaciones estacionales de S. foetens en el área de Texas, Louisiana y regiones adyacentes, señalando que se registran épocas de alta densidad en profundidades mayores a los 40 m durante el otoño e invierno, mientras que en verano es común capturarla en aguas de 20 m, aparentemente los movimientos de esta especie están relacionados con los cambios de temperatura (Miller, 1965). En Florida, Allyn (1969) reporta a esta especie como un gran predador de peces y crustáceos principalmente, lo que está muy relacionado a lo observado por Chittenden y McEachran (1976), quienes encuentran una alta afinidad entre la distribución de esta especie y las áreas de distribución del camarón café (Penaeus aztecus) en el norte del Golfo de México. Por otro lado, en las costas de Colombia se reporta que esta especie alcanza hasta 300 mm (LT); sin embargo, por su baja frecuencia en esta área no se considera de importancia económica (Dahl, 1971), lo mismo que en las costas de Cuba, donde se ha colectado con una talla máxima de 405 mm (LS) (Guitart, 1974). En Costa Rica se reporta que esta especie es común en aguas turbias y someras menores de 50 m muy abundante cerca de la línea de costa (Perry y Perry, 1974). Esto mismo se ha observado en diferentes áreas del Golfo de México, donde es muy frecuente en lagunas costeras y estuarios, encontrándose ejemplares pequeños en áreas de Thalassia testudinum(Hildebrand, 1954; Randall, 1968; Thomas et al., 1971), En el sur del Golfo de México, en el área de Laguna de Términos, Campeche, esta especie se considera un residente permanente o cíclico de diversos ambientes, de la laguna (Yáñez-Arancibia et. al., 1980, 1985b). Synadus foetens fue la segunda especie más frecuente de las comunidades de peces demersales de la Sonda de Campeche. Por su abundancia en peso y número de individuos durante todo el año, su amplia distribución y frecuencia esta especie se considera típica y ecológicamente dominante en estas comunidades. Esta especie es comestible y dada la talla que alcanza es muy apreciada como alimento; sin embargo, en México se consume sólo localmente y no se conocen estadísticas de su pesquería en particular, a pesar de su alta incidencia en las capturas de camarones peneídos. Esta especie representa un recurso potencial real, aún no aprovechado en el país. Por el análisis ecológico de esta especie, sus características de especie dominante en la estructura de las comunidades demersales, el papel ecológico funcional que desempeña en la transferencia energética del sistema a través de sus relaciones tróficas y sus perspectivas como recurso pesquero potencial; es preciso recomendar que la especie sea estudiada en sus aspectos ecológicos y dinámica de sus poblaciones para el conocimiento adecuado de su posible aprovechamiento. Arius felis (Linnaeus, 1766). N.v. "Bagre", "Hard head seacatfish"Distribución Esta especie se distribuye en la costa Atlántica, desde Carolina del Norte, florida, todo el Golfo de México hasta Yucatán (Pew, 1971; Fischer, 1978; Sánchez-Gil et. al., 1981; Yáñez-Arancibia et. al., 1984, 1985e,1986). Biología y Ecología Fue colectado un total de 888 ejemplares de esta especie, con una frecuencia de aparición de 48% en el total de las estaciones de los seis cruceros muestreados. En cruceros individuales la frecuencia más alta fue en marzo (16%) y la más baja en noviembre (4%), durante las épocas de secas y nortes respectivamente (Tabla 21). Se encontró muy bien representada en toda el área de estudio ocupando tanto fondos fangosos como arenosos(Zonas A y B), generalmente a profundidades menores de 40 m en un rango de 11 a 17 m (Fig. 25, Tabla 28). Constituyó el 10.6% de la captura total en peso, siendo la especie más abundante en este estudio. Se encontró muy bien representada durante todas las épocas climáticas muestreadas. En cruceros individuales la mayor abundancia la presentó en junio (43.3%) y la menor en agosto (2.6%), durante la época de lluvias en ambos casos. Espacialmente se observó que la mayor abundancia de esta especie estuvo relacionada durante las distintas épocas del año con las áreas más someras menores de 18 m en el área muestreada (Fig. 25, Tabla 21). Representó el 1.7% de la captura total en número de individuos. En cruceros individuales la abundancia más alta se presentó en marzo (38.6%) y la más baja en el mes de agosto (3%) durante las épocas de secas y lluvias respectivamente (Tablas 21 y 28). Los ejemplares colectados se distribuyeron en un rango de tallas de 102 a 388 mm (LT), encontrándose individuos mayores a 350 mm durante todas las épocas climáticas muestreadas; sin embargo, los individuos más pequeños sólo se capturaron en noviembre durante la época de nortes (Fig. 25). Esta especie es de hábitos costeros, eurihalina, muy común en aguas someras con influencia de agua dulce, Posee un amplio espectro trófico, considerándose un consumidor de 20 orden cuya alimentación se constituye principalmente de crustáceos y peces. Su gestación es oral y se ha observado que se reproduce en bahías y estuarios considerándose como una especie con dependencia estaurina. Otras Especies Afines en el Área de Estudio Bagre marinus(Mitchill). Observaciones, Antecedentes y Perspectivas Es una especie de amplia distribución muy común en aguas costeras y someras del Golfo de México. Ha sido estudiada por diversos autores quienes la señalan como una especie muy abundante, que además de tener un amplio espectro trófico, presenta una gran variedad de hábitos alimenticios. En las costas de Florida, Louisiana y Texas, esta especie se ha colectado entre los 10 y 100 m de profundidad durante las diferentes épocas climáticas; sin embargo, Gunter (1945), Hildebrand (1954), Allyn (1969), Franks et al. (1972) y Darnell et al.(1983), coinciden en que existe una disminución en la abundancia deA. felis en aguas profundas (mayores a 40 m) durante el invierno, incrementándose en los meses cálidos de primavera y verano donde la mayor abundancia se presenta a profundidades menores a 20 m. Pew (1971), menciona que esta especie es muy abundante en las costas de Texas y que durante el verano es común encontrarla en el interior de bahías, estuarios y bocas de lagunas formando grandes grupos, lo que se asocia principalmente con fines de alimentación. Esta especie se presenta en un amplio rango de salinidades, alcanzando los 132 y 361 mm (LT); sin embargo, se ha observado una relación entre las tallas y la salinidad de las aguas ya que las tallas pequeñas tienden a ubicarse en áreas de menor salinidad (49 mm, en 3.7 a 4.2 0/00) según explican Springer y Woodburn (1960) y los ejemplares más grandes en las áreas de más de 3 0/00 (Simmons, 1957; Franks et al., 1972) aunque la mayor abundancia se encuentra en aguas salobres (Gunter, 1945). Esta especie aparentemente se reproduce en bahías y estuarios o áreas protegidas, entre principios de mayo y mediados de agosto (Gowanloch, 1936; Gunter, 1945; Franks et al., 1972; Christmas y Waller, 1973; Gallaway y Strawn, 1974). Los machos adultos presentan gestación oral abandonando las bahías y estuarios en el otoño cuando tienden a ocupar la plataforma continental y regresan a las aguas internas durante la primavera (Franks et al., 1972; Darnell et al., 1983). Nakamuraet al. (1980), menciona a A. felis como una de las especies que se ha encontrado en todos sus estadios de vida en los estuarios del Golfo de México en las costas de los Estados Unidos, siendo también muy abundante en la plataforma continental en las áreas de distribución del camarón café(Penaeus aztecus) según ha sido reportado por Chittenden y McEachran (1976). En la región del Altántico Centro Occidental se le considera abundante en las costas de aguas turbias y de fondos fangosos, observándose que los ejemplares adultos son menos frecuentes en ríos y estuarios, ya que prefieren aguas salobres y marinas. En esta región alcanzan hasta 350 mm (LT) y ocasionalmente se consume en fresco. En el sur del Golfo de México se considera que por su distribución y abundancia A. felis es una especie dominante y típica de las comunidades demersales en la Sonda de Campeche durante el verano (Sánchez-Gil et al., 1981) y que su distribución se encuentra muy relacionada a la línea de costa a profundidades menos de los 18 m. Por otro lado, Lara-Domínguezet al. (1981), Yánez-Arancibiaet al. (1980), reportan que esta especie es abundante en el interior de la Laguna de Términos donde aparentemente realiza etapas importantes en el desarrollo de su ciclo de vida (Yánez-Arancibia y Lara-Domínguez 1986). 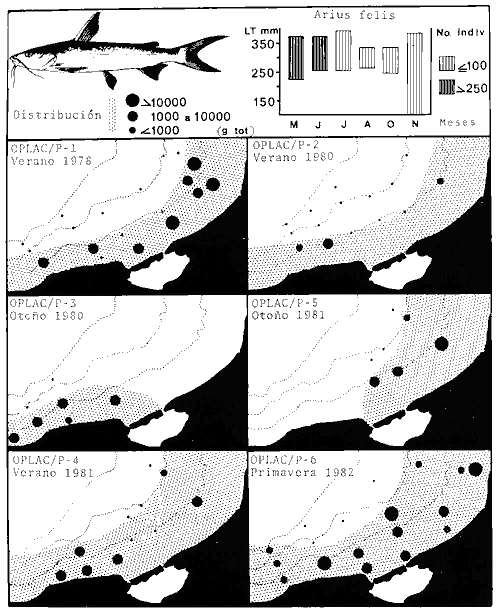 Fig. 25. Patrón de distribución espacial y temporal de Arius felis en la Sonda de Campeche. Se muestra la abundancia de biomasa, densidad y distribución de tallas de la especie en los seis cruceros muestreados. 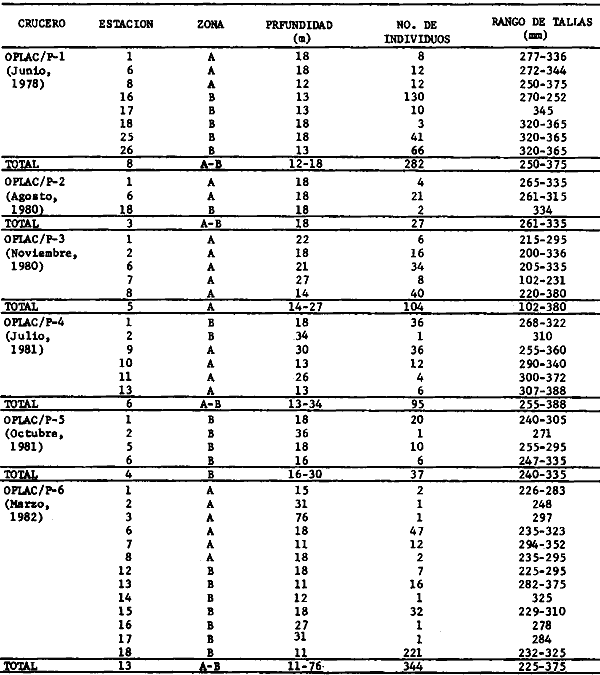 TABLA 28 DISTRIBUCIÓN, ABUNDANCIA NUMÉRICA Y RANGO DE TALLAS DE ARIUS FELIS EN LAS POBLACIONES DOMINANTES DE LAS SONDA DE CAMPECHE Arius felis es una especie muy común en las comunidades de peces demersales de la Sonda de Campeche. Por su gran abundancia tanto en peso como en número de individuos, su amplia distribución y frecuencia presentes en todo el año, esta especie se considera típica y ecológicamente dominante en estas comunidades. Es una especie comestible la cual alcanza tallas que la hacen muy apreciada como alimento; sin embargo, su consumo en México es local y no se conocen estadísticas de su pesquería en particular. Esta especie representa un recurso potencial real cuya presencia es muy frecuente en las capturas de camarones penéidos y del cual su aprovechamiento es muy reducido en el país. Por el análisis ecológico de esta especie, sus características de especie dominante en la estructura de las comunidades demersales, el papel ecológico funcional que desempeña en la transferencia energética del sistema a través de sus relaciones tróficas, y sus perspectivas como recurso pesquero potencial real es preciso recomendar que la especie sea objeto de estudio en sus aspectos biológicos y dinámica de sus poblaciones, para el conocimiento adecuado de su aprovechamiento (Yánez-Arancibia y Lara-Domínguez, 1986). Cynoscion nothus (Holbrook, 1855). N.v. "Corvina plateada", "Silver seatrout"Distribución Esta especie se distribuye en el sureste de la costa Atlántica de los Estados Unidos, desde Chesapeake Bay, sur de Florida y las costas del Golfo de México (Pew, 1974; Fischer, 1978; Sánchez-Gil et al., 1981- Yánez-Arancibia et al., 1984, 1985e, 1986), Biologia y Ecología Fue colectado un total de 3800 ejemplares de esta especie, con una frecuencia de aparición de 41% en el total de las estaciones de los seis cruceros muestreados. Fue una de las especies más frecuentes en el área de estudio. En cruceros individuales la mayor frecuencia la presentó en junio (9%) y la menor en agosto (4%), durante la época de lluvias (Tabla 21). Se colectó abundantemente durante las distintas épocas climáticas muestreadas, encontrándose mejor representada en laZona A de fondos fangosos, generalmente entre los 18 y 39 m de profundidad (Fig. 26, Tabla 29). Constituyó el 6.4% de la captura total en peso. En cruceros individuales la mayor abundancia la presentó en marzo (42.4%) y la menor en noviembre (1.9%) durante las épocas de secas y nortes respectivamente. Espacialmente se observó que durante las distintas épocas muestreadas, la especie estuvo asociada a la Zona A de mayor influencia estuarina, encontrándose que los valores más altos de biomasa se distribuyeron en las áreas más someras alrededor de 18 m; durante la época de nortes, la especie se presentó con una distribución más amplia, ocupando la Zona Bcuyas características son típicamente marinas (Fig. 26, Tabla 21). Representó el 7.1% de la captura total en número de individuos, siendo una de las especies con más alto número de ejemplares. En cruceros individuales la mayor abundancia la presentó en marzo (41.6%) y la menor en agosto (1.8%) durante las épocas de secas y lluvias respectivamente (Tablas 21 y 29). Los ejemplares colectados se distribuyeron en un rango de tallas de 33 a 294 mm (LT), observándose que los ejemplares mayores de 250 mm se colectaron durante el inicio de la época de lluvias y los individuos más pequeños se colectaron tanto en la época de secas como en la de nortes (Fig. 26). Durante todas las épocas del año se presentó una relación hembra : macho de 1:1; durante las épocas de lluvias y secas se presentaron individuos en descanso, en maduración y ya maduros (fases II, III y IV), mientras que en la época de nortes se encontraron individuos tanto maduros, como juveniles aún no determinados sexualmente. 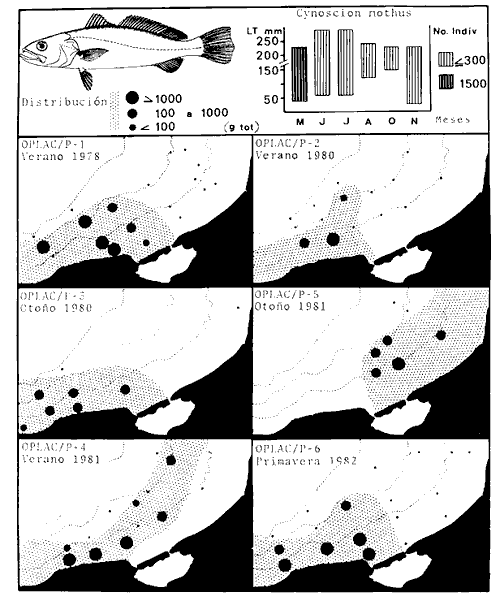 Fig. 26. Patrón de distribución espacial y temporal de Cynoscion nothus en la Sonda de Campeche. Se muestra la abundancia de biomasa, densidad y distribución de tallas de la especie en los seis cruceros muestreados. 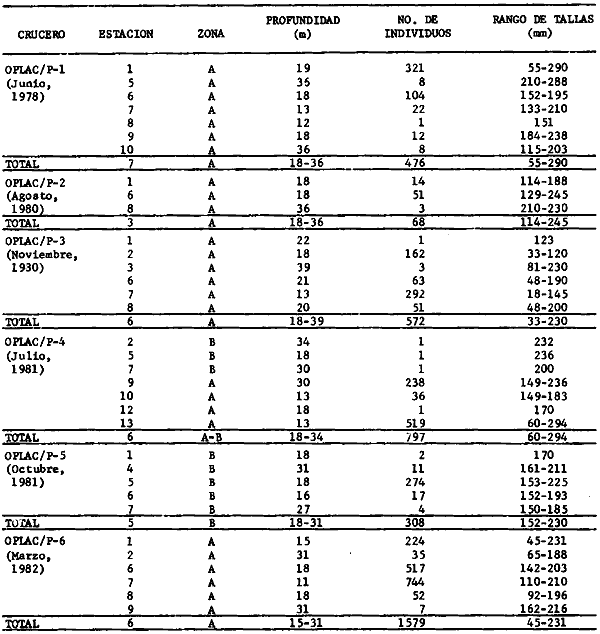 TABLA 29. DISTRIBUCIÓN, ABUNDANCIA NUMÉRICA Y RANGO DE TALLAS DE CYNOSCION NOTHUS EN LAS POBLACIONES DOMINANTES DE LA SONDA DE CAMPECHE Esta es una especie de hábitos pelágico-costeros; sin embargo, se encuentra muy relacionada a las especies típicas demersales. Es eurihalina y es muy común encontrarla en aguas someras de fondos arenosos o fangosos a lo largo de playas y bocas de ríos. Es un consumidor de 3er orden predominantemente carnívoro, cuya alimentación se constituye de peces y crustáceos principalmente. Otras Especies Afines en el Área de Estudio Cynoscion arenarius Gingsburg Observaciones, Antecedentes y Perspectivas Es una especie muy común y una de las más abundantes en las costas del Golfo de México, se le encuentra generalmente en aguas más profundas que otras especies afines como es C. arenarius. Hoese y Moore (1977), mencionan que C. nothus gradualmente reemplaza aC. arenarius conforme aumenta la profundidad y hace la observación de que es la única especie de este género que se encuentra a grandes profundidades. En los meses más fríos esta especie tiende a ocupar aguas protegidas y es posible encontrarla en las bahías y estuarios de Texas y Louisiana; Darnell et al. (1983), observaron que durante el invierno y primavera, esta especie es muy abundante en las áreas cercanas a la línea de costa y pocos son los individuos que se presentaron en profundidades mayores a 80 m, durante el otoño la especie tiende a ocupar zonas de mayor profundidad (hacia 90 m al sur de Texas), observándose áreas de alta densidad en profundidades de 20 m en Louisiana y Texas. Hildebrand (1945), y Chittenden y McEachran (1976), reportan que esta especie es muy abundante en las capturas de camarón, tanto blanco(Penaeus setiferus) como café (P. aztecus), lo que está de acuerdo a lo mencionado por otros autores (Gunter, 1945; Miller, 1965; Roithmayr, 1965; Moore et al., 1970; Franks et al., 1972), aún cuando es más frecuente en las áreas de distribución de camarón blanco durante el invierno llegando a constituir el 50% de las capturas. La reproducción de esta especie ocurre a fines de primavera y se prolonga hasta el otoño, presentando movimientos migratorios hacia la línea de costa durante los meses fríos. Los ejemplares más pequeños (28 mm LT) se han colectado en junio y fines de octubre (Christmas y Waller, 1973), y se han capturado hembras maduras en mayo (Miller, 1965). La vida promedio de esta especie se calcula de un año, alcanza hasta 360 mm pero lo más común es de 250 mm (LT) (Fischer, 1978) en toda el área de su distribución. Pew (1974), la reporta como una especie muy abundante en las costas de Texas donde puede encontrarse durante todo el año, y las mejores pesquerías se realizan entre octubre y mayo. En el sur del Golfo de México en el área de la Laguna de Términos y Sonda de Campeche, se le ha reportado como una especie típica de las comunidades demersales (Sánchez-Gil et al., 1981; Tapia Garcíaet al., 1986), en el interior de la laguna, se le ha colectado en las áreas de mayor influencia de agua dulce donde soporta salinidades bajas (9 a 26‰), considerándose un visitante cíclico (Yánez-Araricibia et al., 1980 y 1985b). Cynoscion nothus es una especie muy común en las comunidades de peces demersales de la Sonda de Campeche. Sus variaciones estacionales de distribución y abundancia tanto en peso como en número de individuos no son marcadas, presentándose con regularidad en el área durante todo el año, considerándose una especie típica y ecológicamente dominante en estas comunidades. Al igual que C. arenarius esta especie es muy frecuente en las capturas de camarones penéidos y su carne es apreciada como alimento; sin embargo, sólo se explota regionalmente y no se tienen estadísticas de su pesquería en particular, ni de su rendimiento como recurso pesquero, por lo que no se aprovecha adecuadamente en el país. Por el análisis ecológico de la especie, sus características de especie dominante en la estructura de las comunidades demersales, el papel ecológico que desempeña en la transferencia energética del sistema a través de sus relaciones tróficas, y sus perspectivas corno recurso pesquero explotado; es preciso recomendar qué la especie sea objeto de estudio en sus aspectos biológicos y dinámica de sus poblaciones, para el conocimiento adecuado de su aprovechamiento (Tapia García et al., 1986). Prionotus "grupo" punctatus/beani. Prionotus punctatus Bloch 1793. Prionotus beani Goode y Bean, 1896. N.v. "Sea robins"Distribución Prionotus puncatus se distribuye desde Georgia hasta Argentina incluyendo Colombia, Costa Rica y el Golfo de México (Cervigón, 1966; Dahl, 1971; Perry y Perry, 1974; Fischer, 1978; Sánchez-Gil, 1981; Yánez-Arancibia et al.,1984, 1985e, 1986). Prionotus beani se distribuye desde el norte del Golfo de México, Panamá y hasta Brasil (Gunter, 1945; Miller y Kent, 1972; Sánchez-Gil, 1981; Yáñez-Arancíbía et al., 1984, 1985e, 1986). Biología y Ecología Fue colectado un total de 1385 ejemplares de este grupo con una frecuencia de aparición de 77% en el total de las estaciones de los 6 cruceros muestreados. En cruceros individuales la frecuencia más alta la presentó en marzo (19%) y la más baja en octubre (7%) durante las épocas de secas y nortes respectivamente (Tabla 21). Este grupo se colectó frecuentemente durante las distintas épocas climáticas y presentó una distribución muy amplia, ocupando tanto los fondos fangosos como arenosos del área de estudio (Zonas AyB) generalmente entre los 16 y 70 m de profundidad (Fig. 27, Tabla 30). Fue un grupo muy bien representado, constituyó el 1.5% de la captura total en peso. En cruceros individuales la mayor abundancia la presentó en julio (23.6%) y la más baja en octubre (11.1 %) durante las épocas de lluvias y nortes respectivamente. Espacialmente se observó que las áreas de mayor abundancia en las diferentes épocas climáticas correspondió a las zonas de profundidad intermedia, entre 36 y 50 m, observándose durante la época de lluvias una tendencia de los valores más altos en abundancia, hacia la Zona B (Fig. 27, Tabla 21). Numéricamente este grupo también estuvo muy bien representado, constituyó el 2.0% de la captura total en número de individuos. En cruceros individuales la abundancia más alta la presentó en julio (30.1 %) y la más baja en junio (7.4%) ambos casos durante la época de lluvias (Tablas 21 y 30). Los ejemplares colectados se distribuyeron en un rango de tallas de 24 a 272 mm (LT), observándose que los ejemplares mayores de 250 mm se colectaron sólo durante la época de secas y nortes, y los más pequeños durante la época de lluvias (Fig. 27). Este grupo presenta hábitos bentónicos gregarios, y capacidad curihalina, se localiza frecuentemente en aguas someras aún cuando puede presentarse en profundidades mayores a 10 m tanto en fondos fangosos como arenosos, de áreas protegidas o mar abierto. Este grupo se considera un consumidor de 2º orden cuyo espectro trófico es muy amplio; sin embargo preferentemente se alimenta de crustáceos, decápodos, anfípodos y peces pequeños (Gobiidae). Otras Especies Afines en el Área de Estudio Prionotus scitulus Jordan y Gilbert, P. ophryas Jordan y Swain, P. roseus Jordan y Everman, P. tribulus Cuvier y Valenciennes, P. carolinus(Linnaeus),P. Stearnsi Jordan y Swain, P.c.f.evolans (Linnaeus). Observaciones, Antecedentes y Perspectivas La identificación de los Triglidos del géneroPrionotus en las costas del Atlántico Americano, es muy difícil. Las revisiones taxonómicas de la familia Triglidae más recientes fueron realizados por Gingsburg (1980), Teague (1981), Ross (1983). Teague considera que un grupo de los Prionotusde las costas de Texas están compuestos por variedades taxonómicas de la especiePrionotus beani (Goode); a su vez, Gingsburg considera la presencia de otra especie P. paralatus (Gingsburg), llamado el "searobin" mexicano. La American Fisheries Society Checklist (1960) considera la presencia de ambas especies para las costas de los Estados Unidos; sin embargo, en la actualidad la identificación taxonómica de este grupo es muy compleja, sobre todo cuando se trata de ejemplares pequeños.  Fig.27. Patrón de distribución espacial y temporal de Prionotus punctatus/beani en la Sonda de Campeche. Se muestra la abundacia de biomasa, densidad y distribución de tallas de la especie en los seis cruceros muestreados. 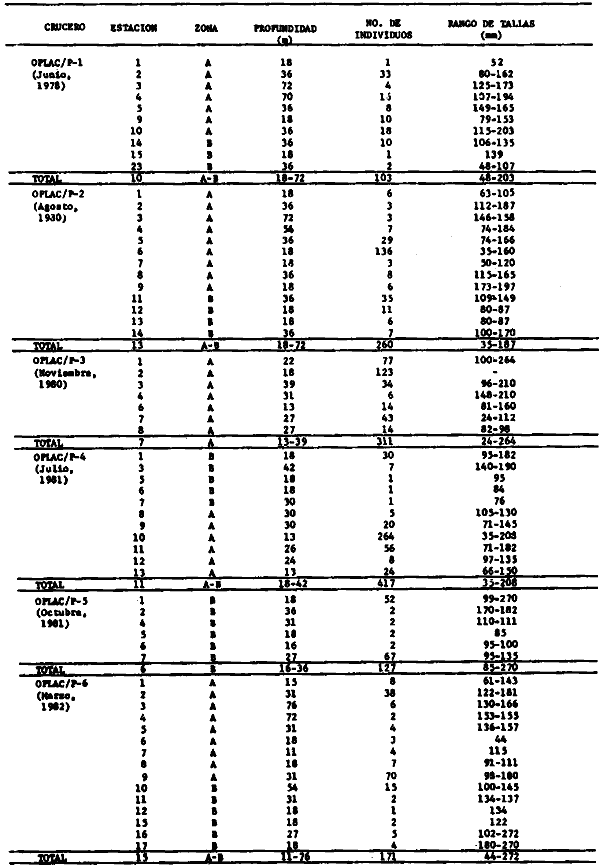 TABLA 30. DISTRIBUCIÓN, ABUNDANCIA NUMÉRICA Y RANGO DE TALLAS DE PRIONOTUS PUNCTATUS/BEANI EN LAS POBLACIONES DE LA SONDA DE CAMPECHE En el sur del Golfo de México, específicamente en el área de estos estudios se presenta un grupo del géneroPrionotus el cual se distingue de otras especies existentes en el Atlántico por la combinación de caracteres tales como: a) las aletas pectorales con el borde distal emarginado, b) los rayos pectorales inferiores elongados (en los juveniles), c) escamación incompleta del pecho (en los adultos) y d) la aserración de las 3 a 5 primeras espinas dorsales. El traslape de estas características determina una diagnosis muy semejante para los distintos ejemplares de este grupo analizados; sin embargo, es difícil determinar que se trata de una sola especie, porque dichas características involucran la descripción de varias especies como son: P. punctatus y especies que se derivan deP. beani o que en su caso se encuentra muy relacionadas como son: P. paralatus y P. alatus (Goode y Bean). Miller y Kent (1972), discuten esta problemática y denominan a este grupo como especies P. alatus para las costas del Atlántico de los Estados Unidos, por ser la especie que se considera representativa de este grupo en la costa Atlántica de los Estados Unidos. En el sur del Golfo de México, en el área de estudio de este trabajo, y para fines de manejo y análisis de los datos, se ha denominado a este grupo referido comoPrionotus punctatus/beani, por considerar que sus características taxonómicas se acercan a la descripción de estas especies. El grupo Prionotus punctatus/beani,constituye un grupo muy importante en las comunidades de peces demersales de la Sonda de Campeche. Sus variaciones estacionales de distribución y abundancia tanto en peso como en número de individuos son poco marcadas, presentándose regularmente durante todo el año. Por su amplia distribución, altos valores de frecuencia y abundancia, se considera que este grupo es el más representativo de la familia Triglidae en, estas comunidades considerándose típico y ecológicamente dominante. Este grupo aún cuando pertenece a una familia de poca importancia para el consumo humano, en países como Colombia (Dahl, 1971) y Costa Rica (Perry y Perry, 1974) se considera un buen alimento. En México posee perspectivas como recurso pesquero, como alimento o bien mediante el procesamiento industrial adecuado puede ser aprovechado en la fabricación de subproductos protéicos. Por el análisis ecológico de este grupo, sus características de grupo dominante en las comunidades de peces demersales, el papel ecológico que desempeña en la transferencia energética del sistema a través de sus relaciones tróficas, y sus perspectivas como recurso pesquero potencial; es preciso recomendar que sea objeto de estudio en sus aspectos taxonómicos, biológicos y dinámica de sus poblaciones, para el conocimiento adecuado de su aprovechamiento. Syacium gunteri Gingsburg, 1933. N.v. "Lenguado", "Shoal flounder"Distribución Esta especie se distribuye desde Florida, todo el Golfo de México, Mar Caribe, Venezuela y hasta la Guyana Francesa (Cervigón, 1966; Hoese y Moore, 1977; Sánchez-Gil et al., 1981; Yánez-Arancibia et al., 1984, 1985e, 1986). Biología y Ecología Fue colectado un total de 5735 ejemplares de esta especie con una frecuencia de aparición de 90% en el total de las estaciones de los seis cruceros muestreados, siendo la especie más frecuente en el área de estudio; no presentó variaciones significativas en las distintas épocas climáticas muestreadas caracterizándose por una amplia distribución, ocupó tanto fondos fangosos como arenosos(Zonas Ay B), generalmente entre 11 y 76 m de profundidad (Fig. 28, Tabla 31). Se colectó abundantemente durante todas las épocas climáticas muestreadas, constituyó el 4.1% de la captura total en peso. En cruceros individuales la mayor abundancia se presentó en agosto 638.8%) y la menor en octubre (2.1%), durante las épocas de lluvias y nortes respectivamente. Espacialmente se observó que durante la época de lluvias los valores más altos de peso se presentaron hacia la zona central del área a profundidades mayores de 36 m, durante las épocas de nortes y secas, dichos valores tendieron a presentarse hacia la Zona A de fondos fangosos, en áreas cercanas a la línea de costa entre 11 y 30 m de profundidad (Fig. 28, Tabla 21). S. gunteri fue la especie que aportó a las capturas un mayor número de ejemplares, representando el 10.7% de la captura total en número de individuos. En cruceros individuales la abundancia más alta la presentó en agosto (34.5%) y la más baja en octubre (2.6%), durante las épocas de secas y nortes respectivamente (Tablas 21 y 31).  Fig. 28. Patrón de distribución espacial y temporal de Syacium gunteri en la Sonda de Campeche. Se muestra la abundancia de biomasa, densidad y distribución de tallas de la especie en los seis cruceros muestreados. 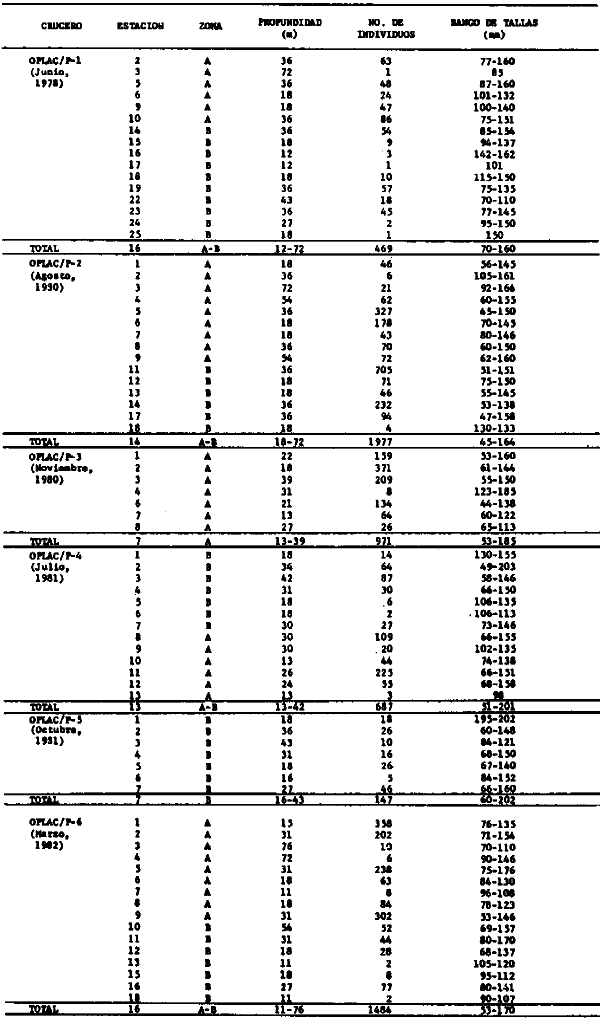 TABLA 31. DISTRIBUCIÓN, ABUNDANCIA NUMÉRICA Y RANGO DE TALLAS DE SYACIUM GUNTERI EN LAS POBLACIONES DOMINANTES DE LA SONDA DE CAMPECHE. Los ejemplares colectados. Se distribuyeron en un rango de tallas de 45 y 202 mm (LT), observándose que se colectaron individuos mayores de 150 mm durante todas las épocas climáticas muestreadas, y los ejemplares más pequeños sólo se colectaron durante la época de lluvias (Fig. 28). Durante las épocas de lluvias y nortes, la relación hembra : macho fue de 1:1, predominando durante la primera individuos en maduración (fase III) y durante los nortes, individuos en descanso (fase II); para la época de secas, se observó un predominio de machos en relación 1:1.4, encontrándose en su mayoría individuos en maduración y ya maduros (fases III y IV), Esta es una especie marina de hábitos gregarios, íntimamente relacionada al fondo. Es un consumidor de 2º orden cuyo alimento lo constituyen una gran variedad de grupos como son poliquetos, anfípodos, copépodos, ostrácodos y pequeños peces entre otros. Otras Especies Afines en el Área de Estudio Syacium papillosum(Linnaeus); S. micrurumGinsburg. Observaciones, Antecedentes y Perspectivas Esta es una de las especies que con más frecuencia se reporta en las aguas del Golfo de México y Mar Caribe (Cervigón, 1966; Walls, 1975), se ha observado que presenta capacidades eurihalinas y es comúnmente asociada a fondos fangosos y arenosos (Cervigón, 1966; Springer y Woodburn, 1960; Fischer, 1978), es muy común entre 18 y 100 m de profundidad. Darnell et al. (1983), la mencionan como una de las especies más abundantes de las costas de los Estados Unidos, desde el Río Mississippi hasta el Río Grande, su presencia es muy frecuente en áreas de profundidad intermedia (entre 10 y 60 m); sin embargo, puede encontrársele en un amplio rango de profundidad siendo más frecuente en las áreas someras, Hoese y Moore (1977), la reportan como común y abundante en aguas de Louisiana y Texas entre 20 y 80 m de profundidad. Es el lenguado más frecuente en las capturas de camarón en el área de Texas donde alcanza una talla máxima de 280 mm (LT), de acuerdo con esto, Chittenden y McEachran (1976), mencionan que esta especie se presenta tanto en las áreas de distribución de camarón blanco (Penaeus setiferus) como de camarón café (P. aztecus), siendo más abundante en las capturas de éste último; consideran que esta especie migra hacia la línea de costa durante el invierno cuando es posible encontrarla en áreas del camarón blanco, lo que ha sido observado por otros autores en diversas áreas al norte del Golfo de México (Hildebrand, 1954; Moore et al., 1970; Frankset al., 1972). En el sur del Golfo de México, en la región de la Laguna de Términos y Sonda de Campeche, esta especie se considera una de las más abundantes y típicas de las comunidades demersales que allí habitan (Sánchez-Gil et al., 1981; Yánez-Arancibia et al., 1985a, 1985b, García-Abad et al., 1986). Al igual que otros lenguados en las costas de Costa Rica, esta especie habita en aguas poco profundas, de fondos rocosos y cubiertos de grava (Perry y Perry-, 1974). Syacium gunteri es la especie más frecuente de las comunidades de peces demersales de la Sonda de Campeche. Sus variaciones estacionales de distribución y abundancia no fueron marcadas, presentándose en el área de estudio durante todo el año. Por su abundancia tanto en peso como en número de individuos, su distribución y alta frecuencia, esta especie se considera típica y ecológicamente dominante en estas comunidades. Esta especie incide con alta frecuencia en los arrastres comerciales de camarones penéidos en el país y a pesar de su gran abundancia y de ser una especie comestible, su consumo en fresco en México es muy raro. Su talla es relativamente pequeña; sin embargo, puede considerarse un recurso pesquero cuya potencialidad es evidente, ya sea como alimento o bien en la industria en la fabricación de subproductos. Por el análisis ecológico de esta especie, sus características de especie dominante en la estructura de las comunidades demersales, el papel ecológico que desempeña en la transferencia energética del sistema a través de sus relaciones tróficas, y sus perspectivas como recurso pesquero potencial; es preciso recomendar que la especie sea objeto de estudio en sus aspectos biológicos y dinámica de sus poblaciones, para el conocimiento adecuado de su posible aprovechamiento(García-Abad et al.1986). Trachurus lathami Nichols, 1920. N.n. "Macarela", "Rough sead"Distribución Esta especie se distribuye desde Main, todo el Golfo de México, las Antillas, Venezuela y hasta Argentina (Cervigón, 1966; Hoese y Moore, 1977; Fischer, 1978; Sánchez-Gil et al., 1981; Yánez-Arancibiaet al., 1984, 1985e, 1986). Biología y Ecología Fue colectado un total de 5529 ejemplares de esta especie, con una frecuencia de aparición de 41% en el total de las estaciones de los seis cruceros muestreados., En cruceros individuales la mayor frecuencia la presentó en junio (16%) y la menor en noviembre (1%), durante las épocas de lluvia y nortes respectivamente (Tabla 21). Esta especie presentó variaciones estacionales marcadas disminuyendo notablemente durante la época de nortes; sin embargo, durante la época de lluvias y secas su distribución fue muy amplia ocupando tanto fondos fangosos como arenosos (Zonas A y B),generalmente entre los 20 y 72 m de profundidad dentro de las áreas de menor influencia continental (Fig. 29, Tabla 32). Fue una de las especies más abundantes constituyendo el 10,3% de la captura total en peso, considerándose una de las especies mejor representadas durantes la época de lluvias. En cruceros individuales la mayor abundancia fue en agosto (51 %) y la menor en marzo (0.2%), durante las épocas de lluvias y nortes respectivamente. Espacialmente se observó que durante las diferentes épocas climáticas muestreadas los valores más altos de biomasa estuvieron asociados a las áreas de mayor profundidad entre 30 y 60 m tendiendo hacia laZona B de características típicamente marinas (Fig. 29, Tabla 21). Fue una de las especies mejor representadas en cuanto a su abundancia numérica, representó el 10.3% de la captura total en número de individuos, En cruceros individuales la abundancia más alta fue en junio (61.6%) y la más baja en julio (0.03%), durante la época de lluvias en ambos casos (Tablas 21 y 32). Los ejemplares capturados se distribuyeron en un rango de tallas de 71 a 208 mm (LT), observándose que los individuos mayores de 200 mm sólo fueron colectados durante la época de lluvias (excepto en julio) y principios de la época de nortes en las áreas más profundas; los individuos más pequeños sólo se colectaron en junio durante la época de lluvias (Fig. 29) ocupando las regiones más someras del área de estudio. Durante las épocas de lluvias y nortes se encontró predominancia de hembras sobre los machos en una relación hembra : macho de 1.5:1 y 2:1 respectivamente, representadas en alta frecuencia por (las fases sexuales II y III) individuos en descanso y en maduración, y durante la época de secas la proporción fue de 1:1 predominando ejemplares maduros (fase IV). Esta especie presenta hábitos pelágico-costeros y gregarios; sin embargo, por sus hábitos alimenticios se encuentra muy relacionada a la fauna típica demersal. No se tiene conocimiento de que esta especie penetre en sistemas costeros como son lagunas y estuarios, aparentemente es típicamente marina. Es un consumidor de 3er orden preferentemente carnívoro, cuya alimentación la constituyen: peces, moluscos y zooplancton principalmente. Otras Especies Afines en el Área de Estudio Decapterus punctatus (Agassiz); D. tabl Berry; Selar crumenophthalmus (Bloch) Observaciones, Antecedentes y Perspectivas Esta es una especie muy común en distintas áreas de la Plataforma Continental del Golfo de México y Mar Caribe, ocupa aguas costeras pero generalmente ambientes de aguas salobres relativamente profundas entre 20 y 90 m (Walls, 1975; Hoese y Moore, 1977; Fischer, 1978), es pelágica aunque generalmente se encuentra cerca del fondo donde se alimenta. Sus hábitos son gregarios y se le ha colectado hasta de 200 mm (LT), es un predador principalmente de peces (Cervigón, 1966; Randall, 1968). Algunos autores le han encontrado con frecuencia en las áreas de distribución de camarones penéidos en el noroeste del Golfo de México; Chittenden y McEachran (1976) señalan que la ocurrencia de esta especie es más frecuente en áreas de camarón café(Penaeus aztecus) lo que ha sido observado por Hildebrand (1954). En la región de Louisiana y Texas, Darnellet al. (1983) han hecho un análisis descriptivo de la distribución temporal y espacial de T. lathami, donde se menciona que durante el invierno la especie presenta la densidad más baja restringiéndose a las zonas de más de 60 m de profundidad; durante primavera y verano la mayor abundancia se presenta en aguas más someras alrededor de 20 m, lo que ha sido observado por otros autores en Texas (Gunter; 1945), durante el otoño su distribución es más irregular presentándose en grupos aislados.  Fig. 29. Patrón de distribución espacial y temporal de Trachurus lathami en la Sonda de Campeche. Se muestra la abundancia de biomasa, densidad y distribución de tallas de la especie en los seis cruceros muestreados. 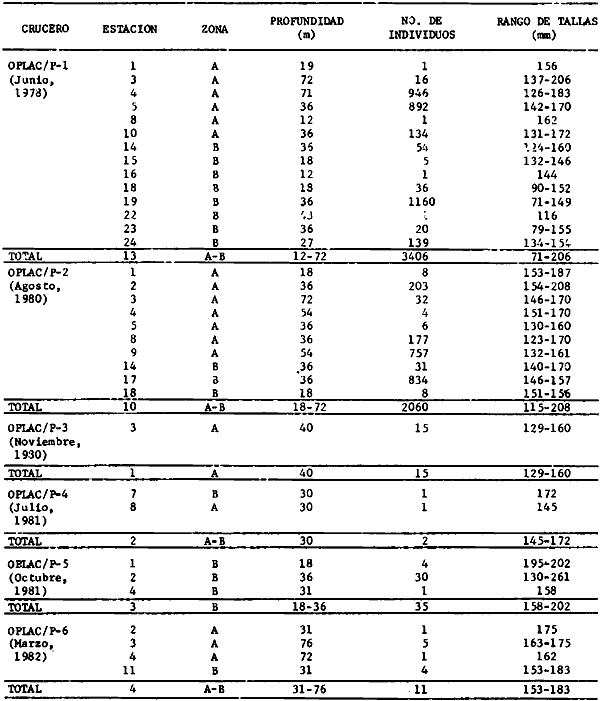 TABLA 32. DISTRIBUCIÓN, ABUNDANCIA NUMÉRICA Y RANGO DE TALLAS DE TRACHURUS LA THAMI EN LAS POBLACIONES DOMINANTES DE LA SONDA DE CAMPECHE Fischer (1978), menciona que la reproducción de esta especie probablemente es fuera de la costa entre abril y junio en la región del Atlántico Centro Occidental. Trachurus lathami fue la segunda especie más abundante de las comunidades de peces demersales de la Sonda de Campeche a pesar de tener hábitos pelágicos. Sus variaciones estacionales de distribución fueron marcadas encontrándose con poca frecuencia durante la época de nortes y mediados de la época de lluvias; sin embargo, su abundancia tanto en peso como en número, su amplia distribución y frecuencia en el resto del año, esta especie se considera típica y ecológicamente dominante en estas comunidades. Esta especie generalmente incide en los arrastres comerciales de camarones penéidos y su carne es comestible en otros países; sin embargo, a pesar de su gran abundancia en México aparentemente no existen pesquerías específicas para su captura y explotación, representando un recurso pesquero potencial con grandes perspectivas aún no aprovechado en el país. Por su análisis ecológico de esta especie, sus características de especie dominante en la estructura de las comunidades de peces demersales, el papel ecológico funcional que desempeña en la transferencia energética del sistema a través de sus relaciones tróficas, y sus perspectivas como recurso pesquero potencial; es preciso recomendar que la especie sea objeto de estudio en sus aspectos biológicos y de dinámica de sus poblaciones, para el conocimiento adecuado de su posible aprovechamiento. Sardinella aurita ( = Clupanodon pseudohispanicus) Cuvier y Valenciennes, 1847. N.v. "Sardina de España"Distribución Esta especie se distribuye en todo el Atlántico y Mediterráneo. Desde Woods Hole, Massachusetts, todo el Golfo de México, Mar Caribe hasta el sur de Río de Janeiro, Brasil (Fischer, 1978; Sánchez-Gilet al., 1981; Yánez-Arancibia et al., 1980, 1984, 1985e, 1986). Biología y Ecología Fue colectado un total de 252 ejemplares de esta especie, con una frecuencia de aparición de 16% en el total de las estaciones de los seis cruceros muestreados. En cruceros individuales la frecuencia más alta fue en los meses de junio y agosto (6%) y la más baja en julio (1%), ambos durante la época de lluvias (Tabla 21). Esta especie presentó variaciones estacionales marcadas y sólo se colectó durante la época de lluvias. Se capturó tanto en las zonas fangosas como arenosas (Zonas A yB), generalmente a profundidades mayores de 18 m entre 20 y 70 m. (Fig. 30, Tabla 33). Constituyó el 0.5% de la captura total en peso siendo más abundante en agosto (59.1 %); los valores más bajos de abundancia en peso los presentó en julio (0.5 %). Espacialmente se observó que durante los meses de junio y agosto la abundancia más alta estuvo asociada a las áreas de profundidad intermedia, entre 30 y 40 m, mientras que durante los meses de julio y noviembre se presentó en grupos aislados de baja abundancia (Fig. 30, Tabla 21). Representó el 0.5% de la captura total en número de individuos, la abundancia más alta se presentó en agosto (59,1%) y la más baja en julio (0.4%) (Tablas 21 y 33). Los ejemplares colectados se distribuyeron en un rango de tallas de 132 a 212 mm (LT), encontrándose individuos mayores a los 200 mm tanto en la época de lluvias como en la época de nortes; sin embargo, los individuos más pequeños se capturaron sólo hacia fines de la época de lluvias (Fig. 30). Se observó una tendencia de los individuos más grandes a ocupar laZona A (Tabla 33).  Fig. 30. Patrón de distribución espacial y temporal de Sardinella aurita en la Sonda de Campeche. Semuestra la abundancia de biomasa, densidad y distribucion de tallas de la especie en los seis cruceros muestreados. 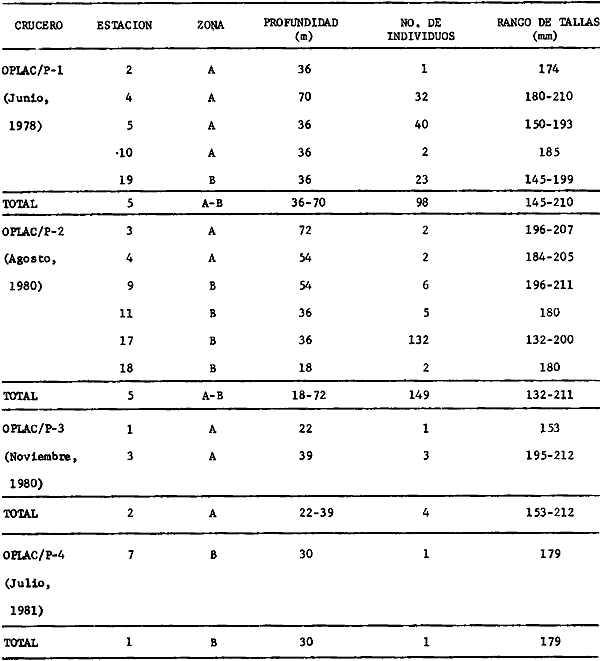 TABLA 33. DISTRIBUCIÓN, ABUNDANCIA NUMÉRICA Y RANGO DE TALLAS DE SARDINELLA AURITA EN LAS POBLACIONES DOMINANTES DE LA SONDA DE CAMPECHE Esta es una especie típicamente marina, de hábitos pelágicos, gregaria, pero muy relacionada a las especies demersales. Es un consumidor de ler orden (planctófago), cuyo alimento principal lo constituyen formas fito y zooplanctónicas. Otras Especies Afines en el Área de Estudio Harengula jaguanaGoode y Bean; Ophisthonema oglinum Le Sueur. Observaciones, Antecedentes y Perspectivas A pesar de ser considerada como una especie común en las costas este de los Estados Unidos y Golfo de México, son pocos los antecedentes que se tienen de esta especie en dichas áreas, se sabe que en Floridad se le usa como carnada (Fischer, 1978). Sin embargo, se le ha reportado en el área del Atlántico Centro Occidental como una especie muy abundante en la Plataforma Continental norte de Venezuela (Golfo de Cariaco, Península de Araya y las Islas Margarita), donde presenta importancia comercial, ya que alcanza hasta 290 mm (LT) (Fischer, 1978). También se le ha reportado en las aguas cubanas como regularmente abundante, alcanzando hasta 200 mm (LT) (Guitart, 1974). Datos de la FAO para el año de 1975, reportan una captura de S. aurita de más de 30000 tons., de las cuales el 40% fue capturado en las Costas de Venezuela, donde se le consume ampliamente como alimento en fresco o enlatado. Sardinella aurita es una especie común en las comunidades de peces de la Sonda de Campeche, Su presencia en el área es importante sólo durante la época de lluvias, cuando por su distribución y frecuencia se considera típica de dichas comunidades. Esta especie es comestible y por sus tallas alcanzadas puede considerarse como un recurso potencial estacional; sin embargo, en México no se tienen pesquerías específicas a su respecto. Su utilidad puede ser como alimento, como carnada de otras especies o bien en la fabricación de subproductos. Por el análisis ecológico de esta especie, sus características de especie dominante en la estructura de las comunidades de peces demersales, el papel ecológico que desempeña en la transferencia energética del sistema a través de sus relaciones tróficas y sus perspectivas como recurso pesquero potencial, es preciso recomendar que la especie sea objeto de estudio en sus aspectos biológicos y dinámica de sus poblaciones para el conocimiento adecuado de su posible aprovechamiento. Serranus atrobranchus (Cuvier, 1982). N.v. "Aguavina", "Blackear sea bass"Distribución Esta especie se distribuye desde el norte del Golfo de México y Mar Caribe hasta el Brasil (Hildebrand, 1954; Cervigón, 1966; Hoese y Moore, 1977; Sánchez-Gil et al., 1981; Yánez-Arancibiaet al., 1984, 1985e, 1986). Biología y Ecología Fue colectado un total de 904 ejemplares de esta especie, con una frecuencia de aparición de 32% en el total de las estaciones de los seis cruceros muestreados. En cruceros individuales la frecuencia más alta fue en agosto (11%) y la más baja en octubre (2%), durante las épocas de lluvias y nortes respectivamente (Tabla 21). Es una especie cuya distribución estuvo muy relacionada con las características batimétricas y sedimentológicas del área de estudio, se colectó tanto en fondos fangosos como arenosos pero estuvo mejor representada en la Zona A de fondos suaves, generalmente a profundidades mayores a 18 m en un rango de 11 a 76 m (Fig. 31, Tabla 34). Presentó variaciones estacionales en su patrón de abundancia y distribución de biomasa, por lo que su abundancia en peso no fue muy significativa, constituyó el 0.5% de la captura total en peso. En cruceros individuales, los valores más altos de abundancia los presentó en marzo (25%) y la más baja en octubre (2.8%), durante las épocas de secas y nortes respectivamente. Espacialmente se observó que durante las épocas de lluvias y secas los valores altos de peso se asociaron a las áreas de más de 30 m de profundidad, durante la época de nortes la abundancia de esta especie fue muy baja y sin un patrón de distribución definido (Fig. 31, Tabla 21). Representó el 1.7% de la captura total en número de individuos. En cruceros individuales, la abundancia más alta la presentó en agosto (29.6%) y la más' baja en octubre (2.4%), durante las épocas de lluvias y nortes respectivamente (Tablas 21 y 34). 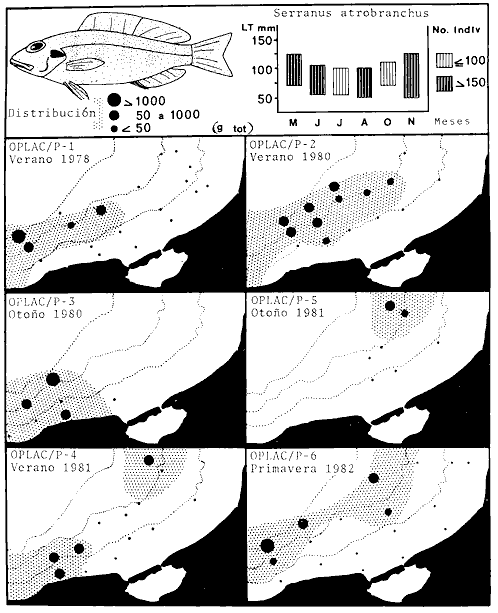 Fig. 31. Patrón de distribución espacial y temporal de Serranus atrobranchus en la Sonda de Campeche. Se muestra la abundancia, densidad y distribucion de tallas de la especie en los seis cruceros muestreados. 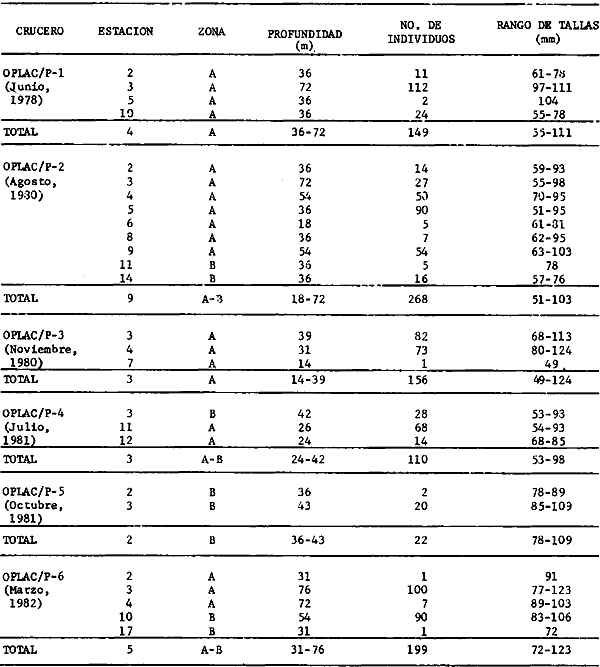 TABLA 34. DISTRIBUCIÓN, ABUNDANCIA NUMÉRICA Y RANGO DE TALLAS DE SERRANUS ATROBANCHUS EN LAS POBLACIONES DOMINANTES DE LA SONDA DE CAMPECHE Los ejemplares colectados se distribuyeron en un rango de tallas de 49 a 124 mm (LT), encontrándose individuos mayores de 120 mm a fines de la época de nortes y principio de la época de secas, durante todo el año se colectaron individuos juveniles (de las tallas más pequeñas) (Fig. 31). Esta es una especie típicamente marina, gregaria y de hábitos pélagico-costeros; sin embargo, se encuentra muy relacionada a las especies típicas demersales, Es un consumidor de 20 orden cuyo alimento se constituye de pequeños crustáceos y peces. Otras Especies Afines en el Área de Estudio Diplectrum radiale(Quoy y Gaimard); Diplectrum formosus(Linnaeus),Serranus phoebePoey. Observaciones, Antecedentes y Perspectivas Se considera que esta especie es muy común al norte del Golfo de México, en las costas de Louisiana y Texas se le ha reportado en aguas de 10 y hasta 100 m de profundidad, pero se encuentra mejor representada alrededor de los 40 m (Walls, 1975; Hoese y Moore, 1977) en salinidades de 24.6 a 38.6% (Franks et al., 1972). Chittenden y McEachran (1976), consideran que esta especie es una de las más abundantes (en el mes de septiembre) en las capturas de camarón café (Penaeus aztecus) al noroeste del Golfo de México, cuya distribución se encuentra muy asociada a las condiciones batimétricas, lo que ha sido observado por otros autores en otras áreas del Golfo (Hildebrand, 1954; Franks et al., 1972) y este estudio. Las tallas reportadas por estos autores van en general desde 50 hasta 130 mm (LT) aun cuando se han colectado individuos hasta de 150 mm en las costas de Louisiana y Texas (Hoese y Moore, 1977). Chittenden y McEachran (1976) reportan individuos de 35 mm durante enero, suponiendo que la reproducción de esta especie ocurre en el otoño y principios de invierno, estimando un periodo de vida de 2 años; sin embargo, Darnell et al. (1983), encontraron grandes concentraciones de esta especie en aguas profundas de las costas de Louisiana y Texas durante todas las épocas climáticas, lo que indicaría que la reproducción se lleva a cabo durante todo el año, estos autores hacen además un análisis detallado de las variaciones estacionales correspondientes. En aguas del Caribe los ejemplares que han sido capturados entre 3 y 50 m de profundidad, son generalmente más pequeños que los del Golfo de México, presentándose en un rango de 108 a 115 mm (LT), por lo que a pesar de ser muy abundante no representa una pesquería de importancia económica (Cervigón, 1966). Serranus atrobranchus es una especie muy común en las comunidades demersales en la Sonda de Campeche a pesar de sus hábitos pelágicos. Sus variaciones estacionales en sus patrones de distribución y abundancia son marcadas encontrándose con poca frecuencia durante la época de nortes; sin embargo, por su abundancia en número de individuos y su alta frecuencia en las épocas de lluvias y secas, esta especie se considera típica y ecológicamente dominante en estas comunidades. Esta especie pertenece a una familia de gran importancia económica (Serranidae); sin embargo, su talla es relativamente pequeña por lo que no se aprecia como alimento en fresco. En México esta especie puede considerarse como un recurso potencial, el cual mediante el procesamiento industrial adecuado puede ser aprovechado para el consumo humano, aún cuando en el país esta actividad es todavía incipiente. Por el análisis ecológico de esta especie, sus características de especie dominante en la estructura de las comunidades de peces demersales, el papel ecológico funcional que desempeña en la transferencia energética del sistema a través de sus relaciones tróficas, y sus perspectivas como recurso pesquero potencial; es preciso recomendar que la especie sea objeto de estudio en sus aspectos biológicos y dinámica de sus poblaciones, para el conocimiento adecuado de su posible aprovechamiento. Priacanthus arenatus Cuvier y Valenciennes, 1878 N.v. "Catalucía", "Atlantic bigeye"Distribución Esta especie se distribuye a ambos lados del Atlántico. Desde el norte de Massachusetts, las Bermudas, las Antillas, Rhode Island, Golfo de México y Mar Caribe hasta el sur de Argentina (Cervigón, 1966. Beebe y Tee Van, 1970; Hoese y Moore, 1977; Fischer, 1978; Sánchez-Gil et al., 1981; Yáñez-Arancibia et al.,1984, 1985e, 1986). Biología y Ecología Fue colectado un total de 1 326 ejemplares de esta especie, con una frecuencia de aparición de 52% en el total de las estaciones de los seis cruceros muestreados, siendo una de las especies más frecuentes en el área. En cruceros individuales la mayor frecuencia se presentó en junio (19%) y la más baja en julio (2%), durante la época de lluvias (Tabla 21). Fue una de las especies más comunes en el área de estudio, se presentó ocupando tanto fondos fangosos como arenosos pero estuvo mejor representada en la Zona A de fondos suaves y mayor influencia estuarina, se colectó entre los 11 y 76 m de profundidad (Fig. 32, Tabla 35). Presentó variaciones estacionales en sus patrones de abundancia y distribución de biomasa; sin embargo, fue un de las especies más abundantes, constituyó el 3% de la captura total en peso. En cruceros individuales los valores más altos de abundancia los presentó en agosto (43.3%) y los más bajos en julio (0.4%), durante la época de lluvias. Espacialmente se observó que durante las épocas de lluvias y nortes los valores más altos de abundancia se encontraron en las áreas de más de 36 m de profundidad tendiendo siempre hacia la Zona B, durante la época de secas el patrón se invirtió encontrándose una pequeña región de alta abundancia en la línea de costa frente a la Laguna de Términos (Fig. 32, Tabla 21). Representó el 2.5% de la captura total en número de individuos. En cruceros individuales la abundancia más alta fue en junio (62.7%) y la más baja en julio (0.3%) ambos casos durante el principio de la época de lluvias (Tablas 21 y 35). Los ejemplares colectados se distribuyeron en un rango de tallas de 42 a 336 mm (LT), observándose que los individuos de mayor talla ocuparon las áreas donde se registró una mayor abundancia de biomasa. Los individuos mayores de 300 mm sólo fueron colectados durante la época de secas, los individuos más pequeños se colectaron durante la época de secas y principio de la época de lluvias (Fig. 32). Durante las épocas de lluvias y nortes predominaron los ejemplares jóvenes y en maduración (fases II y III) y en la época de secas se encontró que la mayoría eran ejemplares maduros (fase IV). Esta es una especie típicamente marina, en cuyos hábitos posiblemente nocturnos tiende a formar cardúmenes, no se ha reportado que tenga dependencia estuarina. Es un consumidor de 3er orden (predominantemente carnívoro) cuyo alimento se constituye principalmente de una gran variedad de peces, algunos crustáceos y poliquetos. Otras Especies Afines en el Área de Estudio Pristigenis altus (Gill). Observaciones, Antecedentes y Perspectivas Esta especie se ha colectado en una banda continua desde el Río Mississippi hasta el Río Grande en las costas de los Estados Unidos donde se le considera muy abundante durante todas las épocas del año, principalmente durante primavera y el otoño, la mayoría de los individuos reportados en esta región ha sido entre los 40 y 80 m de profundidad, pero se sabe que ocupan un rango de 30 a 120 m (Darnell et al., 1983). En las costas de Louisiana y Texas esta especie al igual que toda su familia (Priacanthidae) se encuentra ocupando aguas relativamente más profundas donde predominan los fondos arenosos (Hoese y Moore, 1977). En los arrecifes de las Antillas se ha observado que presenta ciertas inclinaciones a alimentarse de larvas de crustáceos y peces en sus formas planctónicas, con más frecuencia que de las formas bénticas; sin embargo, Hildebrand (1954), y Chittenden y McEachran (1976), reporta a P. arenatus como una especie que incide con cierta frecuencia en las áreas de distribución del Camarón café (Penaeus aztecus) en la plataforma continental del noroeste del Golfo de México. En la región del Atlántico Centro Occidental se le encuentra generalmente en áreas de arrecifes coralinos y fondos rocosos en un rango de 15 a 75 m de profundidad (Fischer, 1978), reforzando lo observado en las costas del norte del Golfo de México por diversos autores en el sentido de que esta especie difícilmente se encuentra a profundidades mayores a los 100 m (Cervigón, 1966; Randall, 1968; Franks, 1972; Walls, 1975). Tanto en aguas del Golfo de México como del Caribe se le considera una especie típica de fondos rocosos que alcanza hasta 400 mm (LT), aunque la generalidad es de 350 mm (Cervigón, 1966; Smith, 1976; Guitart, 1977; Fischer, 1978) por lo que se considera un recurso apreciado como alimento el cual se consume en fresco; sin embargo, no siempre es muy abundante, como sucede en Colombia, donde por su baja frecuencia no alcanza gran importancia comercial (Dahl, 1971). 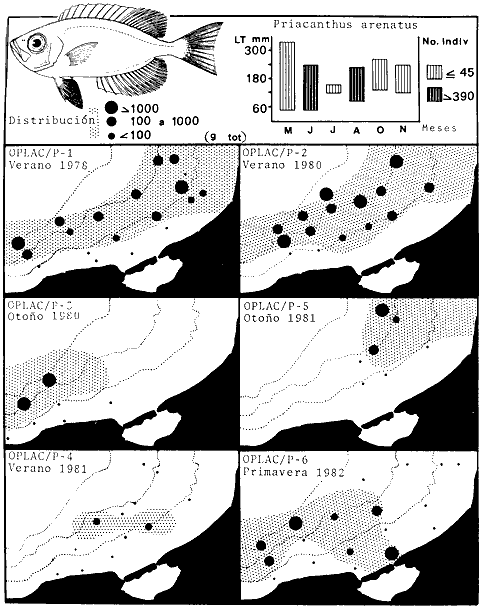 Fig. 32. Patrón de distribución espacial y temporal de Priacanthus arenatus en la Sonda de Campeche. Se muestra la abundancia de biomasa, densidad y distribucion de tallas de la especie en los seis cruceros muestreados 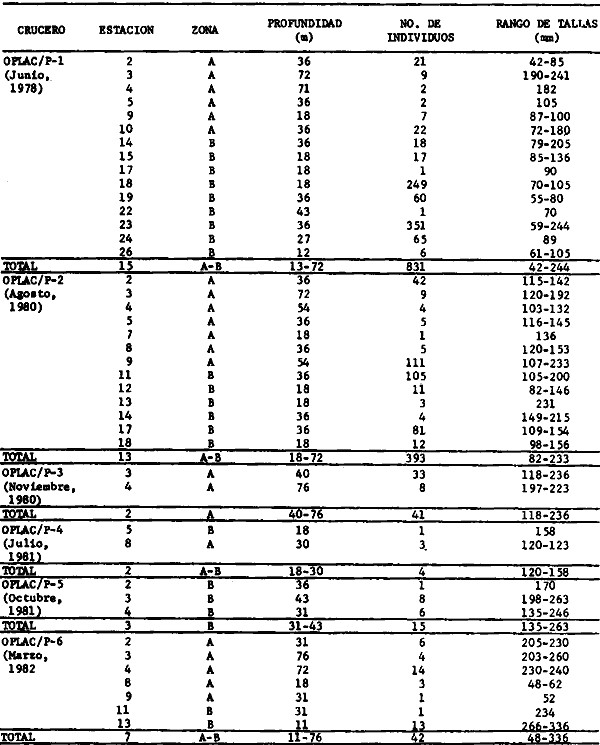 TABLA 35. DISTRIBUCIÓN, ABUNDANCIA NUMÉRICA Y RANGO DE TALLAS DE PRIACANTHUS ARENATUS EN LAS POBLACIONES DOMINANTES DE LA SONDA DE CAMPECHE Priacanthus arenatus fue una de las especies más frecuentes en las comunidades de peces demersales de la Sonda de Campeche, Sus variaciones estacionales en sus patrones de distribución, y abundancia son marcadas, encontrándosecon poca frecuencia durante la época de nortes y mediados de la época de lluvias, sin embargo, por su abundancia en número de individuos y su alta frecuencia en el resto del año, esta especie se considera típica y ecológicamente dominante en estas comunidades. Esta especie es comestible y dada la talla que alcanza es apreciada como alimento. En México se consume sólo localmente y no se conocen estadísticas de su pesquería en particular, a pesar de que se captura con alta frecuencia en los arrastres de camarones peneidos. Por estas características, esta especie se considera un recurso pesquero potencial con grandes perspectivas para su aprovechamiento como alimento en el país. Por el análisis ecológico de esta especie, sus características de especie dominante en la estructura de las comunidades de peces demersales, el papel ecológico funcional que desempeña en la transferencia energética del sistema a través de sus relaciones tróficas, y sus perspectivas como récurso pesquero potencial; es preciso recomendar que la especie sea objeto de estudio en sus aspectos biológicos y dinámica de sus poblaciones, para el conocimiento adecuado de su aprovechamiento. Symphurus plagiusa (Linnaeus, 1766). N.v. "Lengua de vaca", "Tonguefish"Distribución Esta especie se distribuye en la costa Atlántica de los Estados Unidos, Long Island, las Bahamas, Golfo de México, Antillas, Cuba y hasta Brasil (Topp y Hoff, 1972; Hoese y Moore, 1977; Fischer, 1978; Sánchez-Gilet al.,1981; Yáñez-Arancibia et al., 1984, 1985e, 1986). Biología y Ecología Fue colectado un total de 219 ejemplares de esta especie con una frecuencia de aparición de 41% en el total de las estaciones de los seis cruceros muestreados, En cruceros individuales la frecuencia más alta fue en el mes de junio (12%) y la más baja en octubre (1%), durante las épocas de lluvias y nortes respectivamente (Tabla 21). Es una especie que presentó una amplia distribución colectándose tanto en fondos fangosos como arenosos del área de estudio (Zonas A yB),generalmente a profundidades mayores de 15 m, entre 11 y 43 m (Fig. 33, Tabla 36). Esta especie fue regularmente abundante, constituyó el 0.2% de la captura total en peso. En cruceros individuales la mayor abundancia se presentó en agosto (32.5%) y la menor en octubre (2.5%), durante la época de lluvias y nortes respectivamente, Espacialmente se observaron variaciones estacionales, durante la época de lluvias los valores más altos de biomasa se presentaron hacia la zona central del área de estudio a profundidades mayores de 20 m; durante la época de secas los valores más altos se presentaron en una franja de profundidad intermedia a todo lo largo de la costa y durante la época de nortes no se encontraron áreas de alta abundancia (Fig. 35, Tabla 21). Representó el 0.4% de la captura total en número de individuos. En cruceros individuales la abundancia más alta se presentó en agosto (31.1%), durante la época de lluvias, y la más baja en octubre (1.8%), durante la época de nortes (Tablas 21 y 36). Los ejemplares colectados se distribuyeron en un rango de tallas de 53 a 210 mm (LT), encontrándose individuos mayores a 150 mm durante las distintas épocas climáticas muestreadas. Sin embargo, los individuos más pequeños sólo se colectaron durante la época de secas (Fig. 33), Durante la época de lluvias se observó un predominio de machos sobre las hembras en una relación hembra : macho, de 1:2 y 1:3, correspondientes a las fases III y IV de maduración; durante las épocas de nortes y secas las hembras predominaron sobre los machos en una relación hembra : macho de 1.5:1 y 1:0 durante nortes, con predominio de las fases II y III de maduraci6n y durante la época de secas la relaci6n fue de 3.5A predominando individuos indeterminados sexualmente e individuos maduros en fase IV. 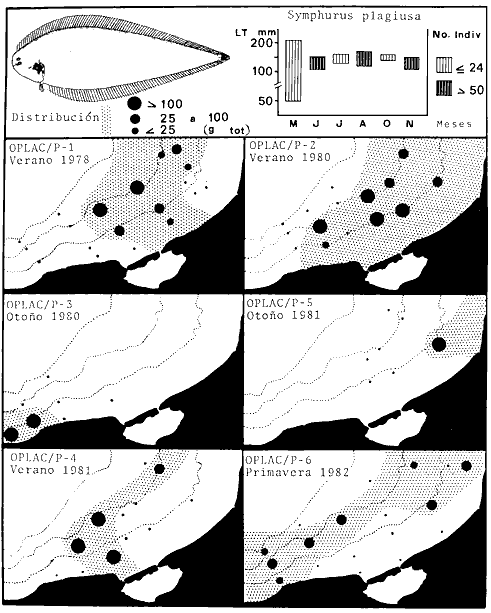 Fig. 33. Patrón de distribución espacial y temporal de Symphurus plagiusa en la Sonda de Campeche. Se muestra la abundanicia de biomasa, densidad y distribución de tallas de la especie en los seis cruceros muestreados. 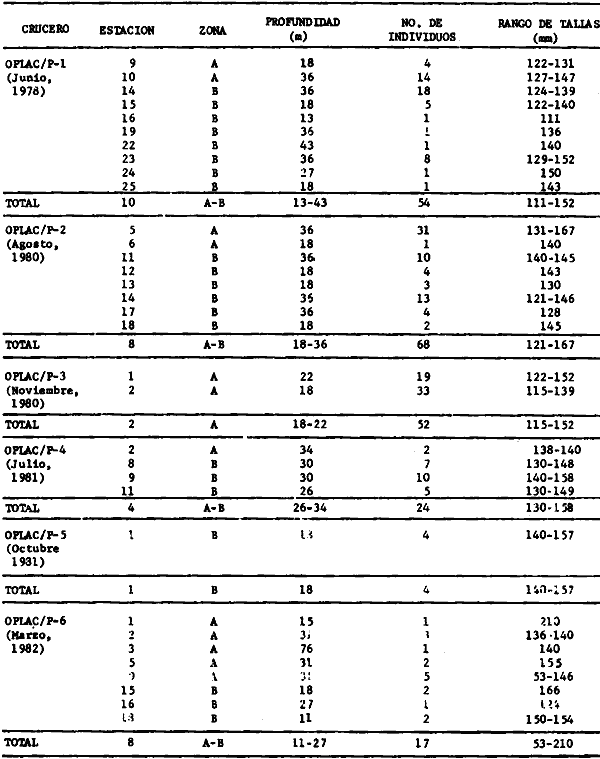 TABLA 36. DISTRIBUCIÓN, ABUNDANCIA NUMÉRICA Y RANGO DE TALLAS DE SYMPHURUS PLAGIUSA EN LAS POBLACIONES DOMINANTES DE LA SONDA DE CAMPECHE. Esta es una especie costera, Eurihalina, íntimamente ligada al fondo. Es muy común encontrarla en el interior de aguas protegidas como lagunas costeras y estuarios. Es un consumidor de 2° orden cuyo alimento lo constituyen: poliquetos, copépodos, ostrácodos, anfípodos y pequeños crustáceos. Otras Especies Afines en el Área de Estudio Symphurus civitatusGinsburg; S. diomedianus (Goode y Bean) Observaciones, Antecedentes y Perspectivas Esta especie es muy común en diversas áreas del Golfo de México. En las costas de los Estados Unidos se reporta como frecuente ocupando aguas someras tanto marinas como estuarinas, comúnmente en los 18 m de profundidad y raramente se le encuentra en profundidades mayores a 40 m (Gingsburg, 1945; Topp y Hoff, 1972; Walls, 1975; Hoese y Moore, 1977). En las costas de Louisiana y Texas se le ha colectado en áreas de aguas turbias, ocupando fondos arenosos o fangosos en rangos de salinidad muy variable, Gunter (1945) menciona que los individuos adultos prefieren aguas de alta salinidad pero se han colectado en un rango de 17.1 a 37‰. Topp y Hoff (1972) y Moe y Martin (1965) reportan la gran abundancia de esta especie en las costas de Florida, observando que es posible encontrarla durante todas las épocas del año y la reproducción ocurre en los meses de primavera y verano comenzando en marzo, durante los meses de diciembre y febrero la abundancia de esta especie disminuye; esta especie ha sido capturada en aguas estuarinas en diversas áreas de las costas de los Estados Unidos (Frankset al., 1972; Turner y Johnson, 1973). En Louisiana y Texas esta especie tiende a ocupar sistemas estuarinos durante el invierno y regresa a la plataforma durante los meses de primavera (Darnell et al.,1983). En el sur del Golfo de México en el área de la Sonda de Campeche, esta especie se ha capturado en el interior de la Laguna de Términos, ocupando ambientes de alta influencia marina y se le considera un visitante cíclico de dicho sistema en áreas de fondos fangosos y alta turbidez (Yáñez-Arancibia et al.,1985b). También en las costas de Costa Rica esta especie es abundante en bahías y esteros generalmente en fondos fangosos (Perry y Perry, 1974). Comúnmente esta especie alcanza hasta 190 y 220 mm (LT), pero en los datos de la FAO para la región del Atlántico Centro Occidental, reportan que no existen estadísticas pesqueras específicas para S. plagiusa; sin embargo, se captura con mucha frecuencia en los arrastres camaroneros y se consumen localmente (Fischer, 1978) en costas como Colombia donde tiene importancia comercial (Dahl, 1971). En las costas de Estados Unidos esta especie se encuentra integrando el grupo de pesquerías de peces planos destinados a la industria (Roithmayr, 1965). Symphurus plagiusa es una de las especies demersales más comunes en la Sonda de Campeche, la cual presenta variaciones estacionales de abundancia, pero por su amplia distribución y frecuencia en el área de estudio se considera una especie típica de dichas comunidades. En México como en otros países, esta especie es muy común en las capturas de camarón; sin embargo, su captura es incidental y no existen pesquerías específicas a su respecto. Por su talla relativamente pequeña no es muy apreciada como alimento, por tanto representa un recurso potencial cuya importancia económica radica en su uso como alimento elaborado, o bien en la fabricación de subproductos. Por el análisis ecológico de la especie, sus características de especie dominante en las comunidades demersales, el papel ecológico que desempeña en la transferencia energética del sistema a través de sus relaciones tróficas, y sus perspectivas como recurso pesquero potencial; es preciso recomendar que la especie sea objeto de estudio en sus aspectos biológicos y dinámica de sus poblaciones, para el conocimiento adecuado de su posible aprovechamiento. Cynoscion arenarius Gingsburg, 1929 N,v. "Corvina de arena", "Sand seatrout"Distribución Esta especie se distribuye desde Chesapeake Bay, Florida, Texas y toda la costa noreste del Golfo de México hasta la Bahía de Campeche (Gowanloch 1965, Pew, 1971; Hoese y Moore, 1977; Fischer, 1978; Sánchez-Gil et al., 1981; Yáñez-Arancibia et al.,1984, 1985e, 1986). Biología y Ecología Fue colectado un total de 820 ejemplares de esta especie con una frecuencia de aparición de 59% en el total de las estaciones de los seis cruceros muestreados, siendo una de las especies más frecuentes en el área de estudio. En cruceros individuales, la frecuencia más alta la presentó en junio (13%) y la más baja en octubre y noviembre (65%), durante las épocas de lluvias y nortes respectivamente (Tabla 37). Se colectó abundantemente durante las distintas épocas climáticas muestreadas con una amplia distribución ocupando tanto fondos fangosos como arenosos (Zonas A y B), generalmente entre 13 y 76 m de profundidad (Fig. 34, Tabla 37). Fue una de las especies mejor representadas en el área constituyendo el 2.4% de la captura total en peso. En cruceros individuales la mayor abundancia la presentó en junio (51.4%) y la más baja en noviembre (1.7%), durante las épocas de lluvias y nortes respectivamente. Espacialmente se observó que durante las diferentes épocas climáticas muestreadas, los valores más altos de biomasa se presentaron en las áreas de profundidad intermedia mayor a los 18 m, concentrándose durante las épocas de lluvias y secas hacia la zona central del área de estudio, en la época de nortes se presentó un desplazamiento de las áreas de mayor biomasa hacia las zonas más profundas (Fig. 34, Tabla 21). Representó el 1.5% de la captura total en número de individuos. En cruceros individuales la abundancia más alta la presentó en junio (69.0%) y la más baja en octubre (1.2%), durante las épocas de lluvias y nortes respectivamente (Tablas 21 y 37). Los ejemplares colectados se distribuyeron en un rango de tallas de 33 a 330 mm (LT), observándose que los ejemplares mayores de 300 mm sé colectaron durante las épocas de secas y lluvias, y los ejemplares más pequeños sólo se colectaron en junio al comienzo de la época de lluvias (Fig. 34). Durante las diferentes épocas climáticas muestreadas, se encontró un predominio de hembras en la relación hembra : macho de 3:1 y 1.5:1 durante la época de lluvias; durante la época de secas fue de 2:1 y en nortes de 3:0 y 1:1. La mayoría de los ejemplares colectados se encontraban. en maduración o completamente maduros (fases III y IV); durante la época de nortes se encontraron individuos en fase II, lo que puede interpretarse como resultado de una reproducción hacia fines de la época de lluvias. Esta especie presenta hábitos pelágico-costeros; sin embargo, se encuentra muy relacionada a las especies típicas demersales, presenta capacidades curihalinas, es muy común encontrarla en aguas costeras y tiende a formar cardúmenes cerca de estuarios donde realiza funciones de crianza y afimentación. Es un consumidor de 3er orden predominantemente carnívoro cuya alimentación la constituyen principalmente peces y crustáceos. Otras Especies Afines en el Área de Estudio Cynoscion nothus (Holbrook, 1855). Observaciones, Antecedentes y Perspectivas Esta especie es muy frecuente en el Golfo de México, se le encuentra generalmente en fondos arenosos en las aguas someras cercanas a la línea de costa, aún cuando es relativamente abundante en la línea de rompiente (Fischer, 1978). Comúnmente se le confunde con otra corvina (C. nothus) cuya distribución es muy semejante. Walls (1975), menciona que a pesar de que ambas especies son muy comunes en aguas someras,C. nothus tiende a ocupar las aguas de mayor profundidad; en las costas de Louisiana Hoese y Moore (1977), reportan queC. nothus es la única especie de este género que puede encontrarse más allá de 22 m de profundidad; sin embargo, Chittenden y McEacharan (1976), encontraron que C. arenariuses muy abundante a profundidades mayores de 58 m entre enero y marzo, estos datos corresponden en mucho a la información reportada por Darnellet al. (1983), quienes han estudiado y analizado la distribución espacial y temporal de esta especie en el área de Louisiana y Texas. Chittenden y McEachran (1976) consideran a esta especie como muy abundante en las capturas de camarón al noroeste del Golfo de México, tanto de camarón blanco (Penaeus setiferus) como de camarón café (P. aztecus), lo que ha sido observado por otros autores (Hildebrand, 1954; Moore et al., 1970; Franks et al., 1972); sin embargo, es más abundante en las áreas de camarón blanco entre junio y septiembre (20 m) y en áreas de camarón café entre enero y marzo (58 m) lo que sugiere movimientos migratorios estacionales de la especie Darnell et al. (1983), observaron también variaciones estacionales de la distribución y abundancia de esta especie, mencionan que en invierno es muy abundante frente a Louisiana entre 10 y 40 m y al sur de Texas entre 10 y 60 m; en el verano, es muy rara y hasta ausente en las zona central de Texas pero ocurre en zonas cercanas a las costas este de Louisiana; en el otoño, se distribuye ampliamente a lo largo de las áreas más someras en la zona sur central de esta región. 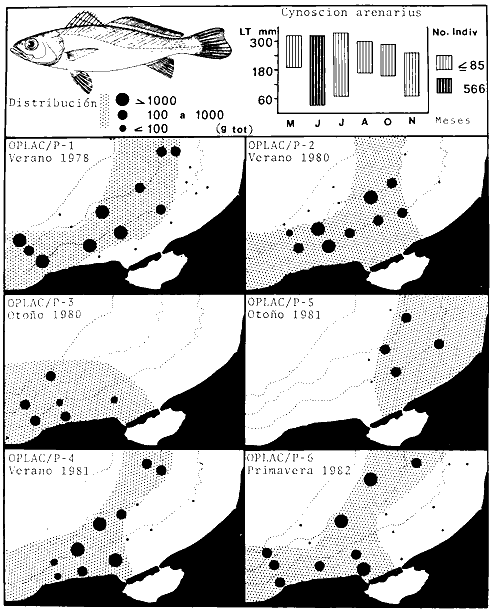 Fig. 34. Patrón de distribución espacial y temporal de Cynoscion arenarius en la Sonda de Campeche. Se muestra la abundancia de biomasa, densidad y distribución de tallas de la especie en los seis cruceros muestreados. 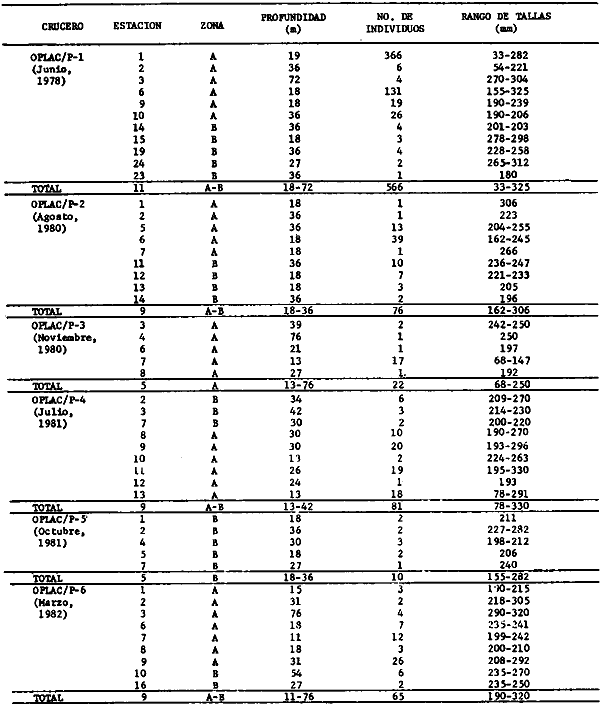 TABLA 37. DISTRIBUCIÓN, ABUNDANCIA NUMÉRICA Y RANGOS DE TALLAS DE CYNOSCION ARENARIUS EN LAS POBLACIONES DOMINANTES DE LA SONDA DE CAMPECHE. Según la mayoría de los autores la reproducción de esta especie en el norte del Golfo de México, ocurre durante los inicios de la primavera y fines del verano encontrando migraciones durante el invierno posiblemente por cambios de temperatura (Gunter, 1938; Springer y Woodburn, 1966); Gunter (1945), Springer y Woodburn (1960) y Franks et al. (1972), han capturado individuos adultos o muy cerca de serlo en febrero y marzo y ejemplares de 25 a 35 mm (LT) entre abril y octubre (Reid, 1955; Swingle, 1971; Christmas y Waller, 1973; Gallaway y Strawn, 1974). Aparentemente el promedio de vida de esta especie es de 1 a 2 años (Chittenden y McEachran, 1976). En el área de Texas, Reid (1958), suponen que la reproducción de esta especie es dentro de las bahías, mientras que Hoese y Moore (1977) mencionan que esta especie se reproduce en canales profundos de la plataforma del Golfo en las costas de Louisiana y Texas, donde los pequeños se asocian a los fondos fangosos. Moffet et al. (1979), mencionan que se reproduce en estuarios y aguas someras del Golfo, y que los jóvenes se desarrollan en bahías y estuarios hasta los 50 o 60 mm (LT), abandonando las aguas someras durante la época fria (Pew, 1971; Chittenden y McEachran, 1976; Fischer, 1978). Al sur del Golfo de México, en el área de la Laguna de Términos y Sonda de Campeche, esta especie se considera muy abundante y típica de las comunidades demersales (Sánchez-Gil et al., 1981; Tapia-García et al. 1986). En el interior de la laguna se le ha reportado en las áreas de mayor influencia de agua dulce donde soporta salinidades muy bajas (9 a 26‰). Ocurre de manera cíclica en estas áreas y sus crías permanecen como residentes, utilizando el sistema como áreas de protección, crianza y alimentación (Yáñez-Arancibiaet al., 1980, 1985b). Cynoscion arenarius es una de las especies más frecuentes en las comunidades de peces demersales de la Sonda de Campeche. Sus variaciones estacionales de distribución y abundancia tanto en peso como en número de individuos no son muy marcadas, presentándose con regularidad durante todo el año, considerándose una especie típica y ecológicamente dominante en estas comunidades (Tapia-García et al.1986). Esta especie pertenece a una familia de alto valor económico(Sciaenidae) y es muy frecuente en los arrastres de camarones penéidos. En México este recurso es explotado regionalmente, ya que las tallas que alcanza la hacen muy apreciada como alimento; sin embargo, no se conocen estadísticas de su pesquería en particular ni su rendimiento, y aquellos ejemplares que son capturados incidentalmente no son aprovechados debidamente. Por el análisis ecológico de la especie, sus características de especie dominante en la estructura de las comunidades demersales, el papel ecológico funcional que desempeña en la transferencia energética del sistema a través de sus relaciones tróficas, y sus perspectivas como recurso pesquero explotado; es preciso recomendar que la especie sea objeto de estudio en sus aspectos biológicos y dinámica de sus poblaciones, para el conocimiento adecuado de su aprovechamiento. Lagocephalus laevigatus (Linnaeus, 1766) N.v. "Botete", "Puffer"Distribución Esta especie se distribuye desde Massachussetts, Nueva Inglaterra, las Bermudas, Golfo de México y hasta Argentina (Cervigón", 1966; Fischer, 1978; Sánchez-Gilet al., 1981; Yáñez-Arancibia et al., 1984, 1985e, 1986). Biología y Ecología Fue colectado un total de 198 ejemplares de esta especie con una frecuencia de aparición de 55% en el total de las estaciones de los seis cruceros muestreados. Fue una de las especies más frecuentes en el área. En cruceros individuales, la mayor frecuencia la presentó en junio (21%) y la más baja en noviembre (2%), durante las épocas de lluvias y nortes respectivamente (Tabla 21). Presentó una amplia distribución en el área, se colectó tanto en fondos fangosos como arenosos (Zonas A y B), generalmente en estaciones cercanas a 18 m en un rango de 12 a 76 m de profundidad (Fig. 35, Tabla 38). Constituyó el 0.4% de la captura total en peso. En cruceros individuales los valores más altos de abundancia se presentaron en junio (62%) y los más bajos en julio (2.2%), durante la época de lluvias. Espacialmente se observó que durante las distintas épocas climáticas muestreadas, los valores más altos de biomasa tendieron a presentarse en las regiones de más de 40 m de profundidad, en forma de un gradiente relacionado con la batimetría (Fig. 35, Tabla 21). Representó el 0.4% de la captura total en número de individuos. En cruceros individuales la abundancia más alta se presentó en junio (59.6%) y la más baja en noviembre (1%), durante las épocas de lluvias y nortes respectivamente (Tablas 21 y 38). Los ejemplares colectados se distribuyeron en un rango de tallas de 33 a 405 mm (LT), se observó que los individuos mayores a 350 mm sólo fueron colectados durante la época de secas, encontrándose individuos pequeños durante las distintas épocas climáticas muestreadas (Fig. 35). Esta especie presenta hábitos pelágico-costeros, es solitaria y se considera típicamente marina aún cuando es muy común en la zona costera. Es un consumidor de 2° orden cuya alimentación la constituyen en gran número de grupos tróficos como son crustáceos, moluscos, restos vegetales, peces pequeños y gran cantidad de materia orgánica. Otras Especies Afines en el Area de Estudio Sphoeroides greeleyi(Gilbert); S. spengleri (Block);S. nephelus (Goode y Bean); S. dorsalisLongley;S. pachigaster (Muller y Troschel). Observaciones, Antecedentes y Perspeclivas Esta especie es muy común en áreas muy cercanas a la línea de costa, en aguas someras de rangos amplios de salinidad (Franks et al., 1972). Se presenta indistintamente en fondos fangoso o arenosos generalmente en profundidades no mayores a 60 m y aún cuando no es una especie típica de corales se le ha reportado ocasionalmente en ambientes adyacentes a éstos (Randall, 1968; Fischer, 1978). Por otro lado, Hildebrand (1954), hace notar ciertas preferencias de esta especie por las áreas marinas profundas, relacionadas a las capturas de camarón café (Penaeus aztecus) en la costa de Texas. Esta especie presenta variaciones estacionales marcadas en sus patrones de distribución y abundancia en las costas de Louisiana, Texas y áreas adyacentes, lo que ha sido ampliamente analizado por Darnellet al. (1983), quienes encuentran patrones de desplazamiento estacional relacionados con la profundidad. En la región del Atlántico Centro 0ccidental, la FAO reporta que esta especie alcanza hasta 1000 mm (LT) pero que en general presenta una talla de 600 mm, su consumo en fresco es frecuente y su comercialización es eventual (Fischer, 1978). En el sur del Golfo de México, en el área de Laguna de Términos, Campeche, Mallard Colmenero et al. (1982) reportan un ejemplar de más de 900 mm (LT). Lagocephalus laevigalus es una de las especies más frecuentes en las comunidades de peces demersales de la Sonda de Campeche. Sus variaciones estacionales de frecuencia y abundancia en el área no son marcadas y por su amplia distribución esta especie se considera típica y ecológicamente dominante en estas comunidades. Es una de las especies de la familia Tetraodontidae que puede consumirse (filetes) después de ser cuidadosamente procesada evitando su autocontaminación con la toxicidad de sus víceras, por la talla alcanzada es apreciada como alimento en fresco. En México no se conocen estadísticas de su pesquería particular; sin embargo, es muy común su pesca incidental en las capturas de camarones peneidos. Por dichas razones esta especie representa un recurso potencial con características de explotación aún no aprovechado en el país. Por el análisis ecológico de la especie, sus características de especie dominante en las comunidades demersales, el papel ecológico que desempeña en la transferencia energética del sistema a través de sus relaciones tróficas, y sus perspectivas como recurso pesquero potencial; es preciso recomendar que la especie sea objeto de estudio en sus aspectos biológicos y dinámica de sus poblaciones, para el conocimiento adecuado de su posible aprovechamiento. 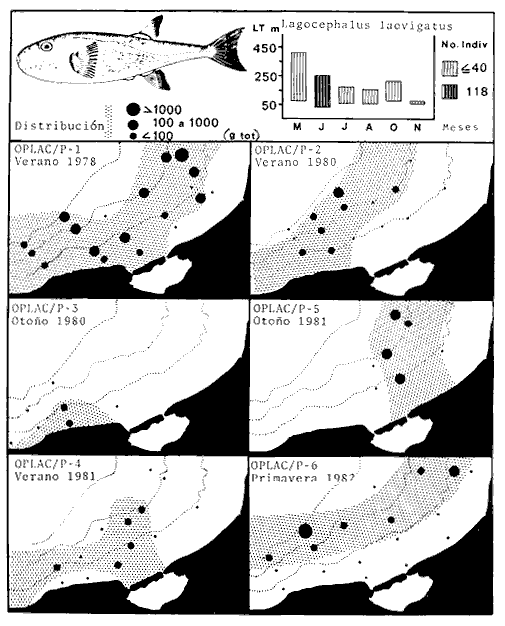 Fig. 35. Patrón de distribución espacial de Lagocephalus laevigatus en la sonda de Campeche. Se muestra la abundancia de biomasa, densidad y distribución de tallas de la especie en los seis cruceros muestreados. 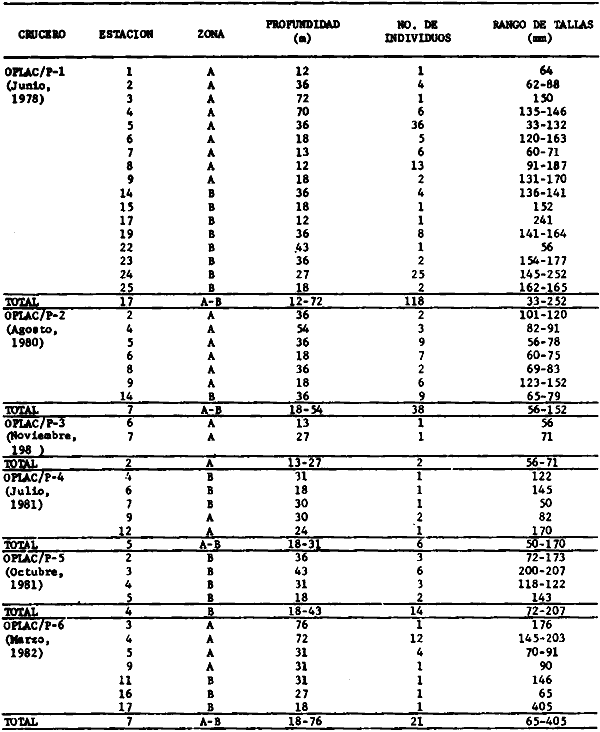 TABLA 38. DISTRIBUCIÓN, ABUNDANCIA NUMÉRICA Y RANGO DE TALLAS DE LA GOCEPHALUS LSEVIGATUS EN LAS POBLACIONES DOMINANTES DE LA SONDA DE CAMPECHE. Citharichthys spilopterus Gunther, 1862 N.v. "Lenguado", "Bay whiff"Distribución Esta especie se distribuye desde Nueva jersey, todo el Golfo de México, Mar Caribe y las Antillas, hasta Santos, Brasil (Perry y Perry, 1974; Sánchez-Gil et al., 1981; Yáñez-Arancibia et al., 1984, 1985e, 1986). Biología y Ecología Fue colectado un total de 274 ejemplares de esta especie con una frecuencia de aparición de 41% en el total de las estaciones de los seis cruceros muestreados. En cruceros individuales la frecuencia más alta se presentó en agosto (10%) y la más baja en octubre (1%), durante las épocas de lluvias y nortes respectivamente. (Tabla 21). Esta especie fue común en el área y de amplia distribución, presentándose tanto en los fondos fangosos como arenosos (Zonas AyB), generalmente entre 12 y 76 m de profundidad (Fig. 26, Tabla 39). Su abundancia no fue muy significativa, constituyó el 0.3% de la captura total en peso. En cruceros individuales la mayor abundancia se observó en agosto (37.9%) y la menor, en octubre (0.5%), durante las épocas de lluvias y nortes respectivamente. Espacialmente se observó que durante las distintas épocas climáticas, los valores más altos de abundancia se presentaron en las áreas someras más cercanas a la línea de costa, generalmente en la Zona A, de fondos fangosos y de mayor influencia estuarina (Fig. 36, Tabla 21). Representó el 0.5% de la captura total en número de individuos. En cruceros individuales la mayor abundancia de esta especie se observó en agosto (31.5%) y la menor en octubre (0.4%), durante las épocas de lluvias y nortes respectivamente, coincidiendo con las épocas de mayor y menor frecuencia y abundancia (Tablas 21 y 39). Los ejemplares colectados se distribuyeron en un rango de tallas de 66 a 177 mm (LT), observándose que los individuos mayores de 150 mm se colectaron sólo durante la época de lluvias y los ejemplares más pequeños se colectaron durante la época de nortes (Fig. 36). Esta es una especie costera, eurihalina, íntimamente ligada al fondo, muy común en aguas someras y áreas de aporte continental. Es un consumidor de 2° orden, cuyo alimento lo constituyen pequeños crustáceos y poliquetos principalmente. Otras Especies Afines en el Área de Estudio Citharichthys macrops Dresel; C. cornutus Bullis y Thompson. Observaciones, Antecedentes y Perspectivas Es una especie común en las costas del Golfo de México y Mar Caribe la cual se colecta con frecuencia en el interior de aguas protegidas salobres como lagunas y estuarios, en salinidades hasta de 2.5‰ (Gunter, 1945; Cervigón, 1966; Turner y Johnson, 1973; Walls, 1975; Yáñez-Arancibia,et al. 1980). Hildebrand (1954), y Chittenden y McEachran (1976), reportan a esta especie como frecuente en las áreas de distribución de camarón café(Penaeus aztecus) y camarón blanco (P. setiferus) en el noroeste del Golfo de México, estos autores observaron que presenta variaciones estacionales de abundancia tanto en peso como en número de individuos, lo que ha sido descrito por Darnellet al.(1983) en el área de Louisiana y Texas, señalando que es más abundante durante la primavera y el otoño, y que no se le encuentra a profundidades mayores a los 60 m. En el sur del Golfo de México, en la Laguna de Términos, Campeche, esta especie se ha reportado ocupando diversos ambientes, desde áreas dulceacuícolas hasta áreas vegetadas de gran influencia marina, considerándosele un residente permanente de una de las bocas de comunicación del sistema (Yáñez-Arancibia et al., 1980 y 1985b). También es muy abundante en las costas del Caribe, en Venezuela se ha colectado tanto en lagunas y áreas de manglar como en mar abierto (Cervigón, 1966). En aguas costeras de Costa Rica (Perry y Perry, 1974) y Colombia (Dahl, 1971), se reporta como una especie muy abundante en aguas someras de fondos blandos o arenosos, y alcanza hasta 170 mm (LT), en Cuba esta especie alcanza hasta 150 mm (Guitart, 1978). La reproducción de esta especie ocurre en la línea de costa durante el invierno, y tiende a migrar hacia aguas protegidas (internas) durante la primavera (Darnell et al., 1983). 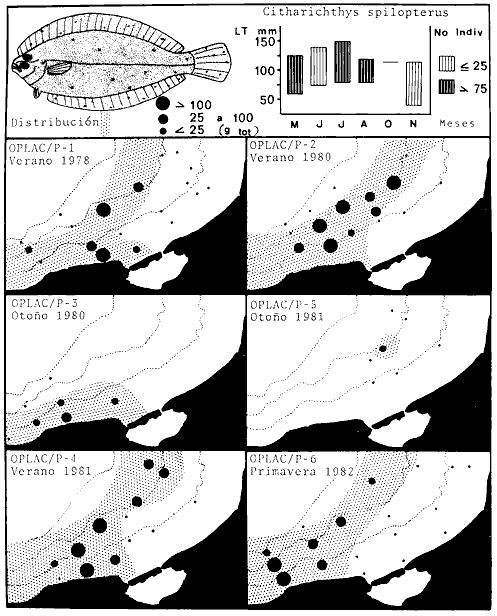 Fig. 36. Patrón de distribución espacial y temporal de Citharichthys spilopterus en la Sonda de Campeche. Se muestra la abundancia de biomasa, densidad y distribución de tallas de la especie en los seis cruceros muestreados. 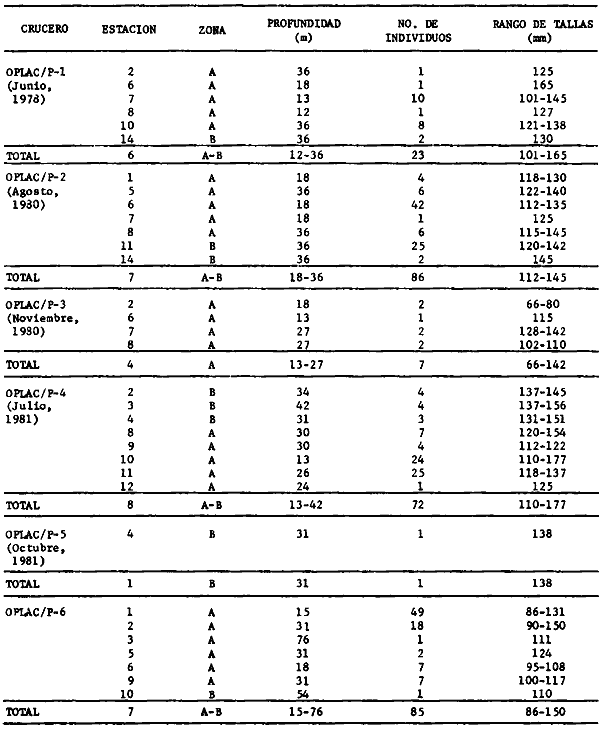 TABLA 39. DISTRIBUCIÓN, ABUNDANCIA NUMÉRICA Y RANGO DE TALLAS DE CITHARICHTHYS SPILOPTERUS EN LAS POBLACIONES DOMINANTES DE LA SONDA DE CAMPECHE Citharichthys spilopterus es una especie común en las comunidades de peces demersales en la Sonda de Campeche. Sus variaciones estacionales de distribución y abundancia indican que la especie disminuye considerablemente en el área durante la época de nortes; sin embargo, por su alta frecuencia, amplia distribución y abundancia numérica en el resto del año se considera que esta especie es típica y dominante en estas comunidades. Por su talla relativamente pequeña esta especie no representa un recurso como alimento en fresco. En México no se reconocen pesquerías específicas pero su frecuencia en capturas incidentales es muy común, por lo que pudiera ser aprovechada en la industria como materia prima de subproductos protéicos. Por el análisis ecológico de la especie, sus características de especie dominante en las comunidades demersales, el papel ecológico que desempeñan en la transferencia energética del sistema a través de sus relaciones tróficas, y sus perspectivas como recursos pesqueros potencial; es preciso recomendar que la especie sea objeto de estudio en sus aspectos biológicos y dinámica de sus poblaciones, para el conocimiento adecuado de su posible aprovechamiento. Porichthys porosissimus (Cuvier y Valenciennes, 1837). N.v. "Pez sapo", "Singing fish"Distribución Esta especie se distribuye en el Atlántico Americano, desde Virginia y todo el Golfo de México, Hasta Argentina (Gervigón, 1966; Perry y Perry, 1974; Hoese y Moore, 1977; Sánches-Gil et al., 1981; Yáñez-Arancibia et al.,1984, 1985e 1986). Biología y Ecología Fue colectado en total de 285 ejemplares de esta especie, con una frecuencia de aparición de 46% en el total de las estaciones en los seis cruceros individuales la frecuencia más alta fue en junio y marzo (10%) durante las épocas de lluvias y secas respectivamente; la más baja en octubre (2%) durante la época de nortes (Tabla 21). Se encontró distribuida en toda el área de estudio, ocumpando tanto fondos fangosos como arenosos; sin embargo, estuvo mejor representada en la Zona A de fondos más suaves, generalmente entre 11 y 76 m de profundidad (Fig. 37, Tabla 40). La abundancia de esta especie no fue muy significativa, constituyó el 0.2% de la captura total en peso. En cruceros individuales los valores más altos en abundancia se presentaron durante la época de nortes en noviembre (38.4%) y la más baja en agosto (4.9%) durante la época de lluvias. Espacialmente, la distribución de la biomasa parece estar relacionada con el gradiente de profundidad, encontrándose que durante la época de lluvias y nortes los valores más altos se encontraron en las estaciones más profundas del área de estudio tendiendo hacia la Zona A, y los valores más bajos asociados a las estaciones más cercanas a la línea de costa; durante la época de secas, el patron fue muy irregular (Fig. 37, Tabla 21). Representó el 0.5% de la captura total en número de individuos. En cruceros individuales la abundancia más alta se presentó en Noviembre (32.2%) y la más baja en octubre (4.2%), ambos durante la época de secas, el patrón fue muy irregular (Tablas 21 y 46). Los ejemplares colectados se distribuyeron en en un rango de tallas de 51 a 180 mm (LT), encontrándose individuos mayores a los 170 mm durante todas las épocas climáticas muestreadas; sin embargo, los individuos más pequeños se capturaron durante la época de secas y al inicio de la época de lluvias (Fig. 37). Generalmente los individuos más grandes se encontraron en profundidades menores a 36 m, excepto en la época de nortes. Esta es una especie de hábitos costeros, típicamente marina, común en aguas someras y se reporta con poca frecuencia en áreas de influencia de agua dulce. es un consumidor de 3er. orden (predominantemente carnívoro), cuyo alimento lo constituyen pequeños peces y crustáceos. Especies Afines en el Área de Estudio Opsanus beta (Gode y Bean). Esta es una especie poco frecuente en las costas, del oeste de los Estados Unidos: sin embargo, ha sido reportado por Gunter (1945) en las bahías de Texas, y por Hildebrand (1945) en las capturas de camarón café (Penaeus aztecus) y camarón blanco (P. setiferus) en el noroeste del Golfo de México. Se le ha encontrado ocupando fondos arenosos (Randall, 1968) pero en general aparece con mayor frecuencia en fondos suaves y/o fangosos en aguas someras, raramente en bahías (Cervigón, 1966; Walls, 1975; Hoese y Moore, 1977). En Florida se le conoce como una especie común de la costa oeste, donde alcanza hasta 400 mm (Allyn, 1969). Son casos muy especiales donde se ha reportado a P. porosissimuscomo una especie presente en áreas estuarinas, como es en Carolina del Norte donde se le ha encontrado en el Río Newport entre 11 y 28 o/oo (Turner y Johnson, 1973) y en Costa Rica, ocupando fondos fangosos en aguas salobres (Perry y Perry, 1974). Otero et al. (1982), mencionan a P. porosissimus dentro del sector costero bonarense y patagónico norte entre 10 y 50 m de profundidad, en las temporadas de otoño y primavera. Forma parte de las especies que le dan a este sector una alta diversidad; sin embargo, no se le considera de interés comercial o potencial debido a su baja concentración de biomasa.  Fig.37. Patrón de distribución espacial y temporal de Porichthys porosissimus en la sonda de Campeche. Se muestra la abundancia de biomasa, densidad y distribución de tallas de la especie en los seis cruceros muestreados.  TABLA 40. DISTRIBUCIÓN, ABUNDANCIA NUMÉRICA Y RANGO DE TALLAS DE PORICHTHYS POROSISSIMUS EN LAS POBLACIONES DOMINANTES DE LA SONDA DE CAMPECHE Porichthys porosissimus es una especie frecuente en las comunidades de peces demersales de la Sonda de Campeche. Sus variaciones estacionales de distribución y abundancia no son muy marcadas y es posible encontrarla con regularidad durante todo el año. Por su amplia distribución y frecuencia se considera que esta especie es típica y ecológicamente dominante en estas comunidades demersales a pesar de sus hábitos pelágicos. Esta especie es muy frecuente en la captura de camarones penéidos; sin embargo, su talla es relativamente pequeña y no es objeto de consumo humano. En México esta especie representa un recurso potencial de carácter industrial, que pudiera ser utilizado en la fabricación de subproductos. Por el análisis ecológico de esta especie, sus características de especie dominante en la estructura de las comunidades de peces demersales, el papel ecológico funcional que desempeña en la transferencia energética del sistema a través de sus relaciones tróficas, y sus perspectivas como recurso potencial; es preciso recomendar que la especie sea objeto de estudio en sus aspectos biológicos y dinámica de poblaciones, para el conocimiento adecuado de su posible aprovechamiento. Bagre marinus (Mitchill, 1815). N.v. "Bagre bandera", "Catfish"Distribución Esta especie se distribuye a lo largo del Atlántico Americano, desde Cabo Cod, Massachusetts, Cabo Hatteras, Carolina del Norte; Costas del Golfo de México, Panamá y Mar Caribe, Venezuela, Guyana hasta el Brasil (Pew, 1971; Perry y Perry, 1974; Hoese y Moore, 1977; Fischer, 1978; Sánchez-Gil et al., 1981; Yáñez-Arancibia et al., 1984, 1985e, 1986). Biología y Ecología Fue colectado un total de 183 ejemplares de esta especie, con una frecuencia de aparición de 25% en el total de las estaciones de los seis cruceros muestreados. En cruceros individuales la frecuencia más alta fue en marzo (7%) y la más baja en junio y agosto (2%), durante las épocas de secas y lluvias respectivamente (Tabla 21). Se encontró en toda el área de estudio ocupando tanto fondos fangosos como arenosos (Zona Ay B), generalmente a profundidades menores a los 35 m, en un rango de 11 a 31 m (Fig. 38, Tabla 41). Constituyó el 2.0% de la captura total en peso, siendo una especie muy común en el área. En cruceros individuales la mayor abundancia en biomasa la presentó en marzo (35.6%) y la menor en noviembre (2.0%), durante las épocas de secas y nortes respectivamente. Espacialmente se observó que durante la época de lluvias la distribución de esta especie se concentró en la Zona A de mayor influencia marina y durante todas las épocas climáticas muestreadas, los valores más altos de biomasa se localizaron en las áreas más someras de ambas Zonas, asociadas a profundidades menores de 20 m (Fig. 38, Tabla 21). Representó el 0.3% de la captura total en número de individuos. En cruceros individuales la abundancia más alta se presentó en marzo (41%) y la más baja en agosto (3.3%) durante las épocas de secas y lluvias respectivamente (Tablas 21 y 41). Los ejemplares colectados se distribuyeron en un rango de tallas de 94 a 550 mm (LT), encontrándose individuos mayores a los 470 mm durante todas las épocas climáticas muestreadas; sin embargo, los individuos más pequeños sólo se capturaron durante la época de nortes en octubre (Fig. 38). Generalmente los individuos más grandes se encontraron en las aguas mayores de 20 m, excepto en la época de secas, cuando se localizaron muy cerca de la 1ínea de costa frente a la Boca del Carmen en Laguna de Términos (Alvarez Guillén et al. 1985). 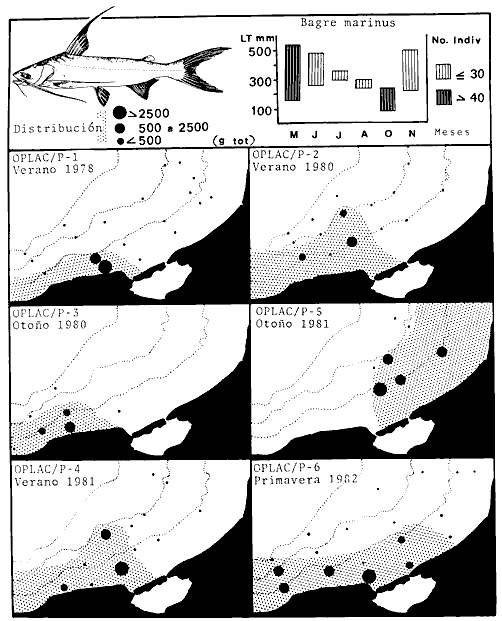 Fig. 38. Patrón de distribución espacial y temporal de Bagre marinus en la Sonda de Campeche. Se muestra la abundancia de biomasa, densidad y distribución de tallas de la especie en los seis cruceros muestreados. 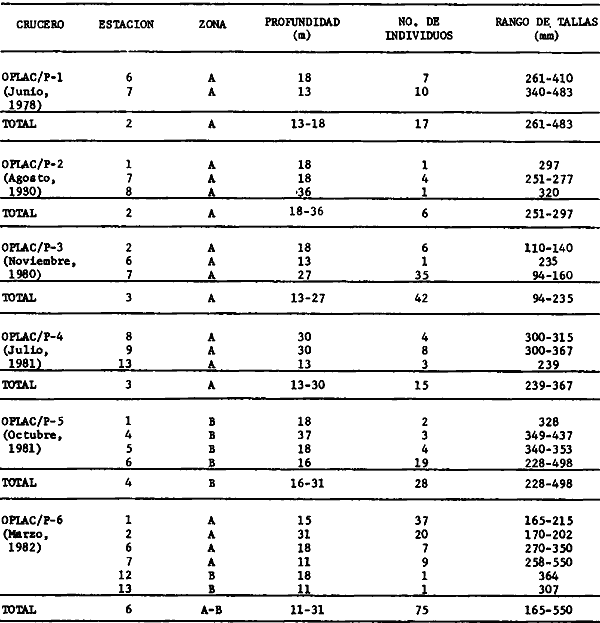 TABLA 41. DISTRIBUCIÓN, ABUNDANCIA NUMÉRICA Y RANGO DE TALLAS DE BAGRE MARINUS EN LAS POBLACIONES DOMINANTES DE LA SONDA DE CAMPECHE Esta especie es típica de hábitos costeros, eurihalina, gregaria, la cual es muy común en aguas someras de gran aporte continental. Posee un amplio espectro trófico y se le considera un consumidor de 2° - 3er orden, cuya alimentación se constituye de pequeños crustáceos, poliquetos, restos vegetales, moluscos y pequeños peces, La gestación la presentan oralmente los machos, y se ha observado que se reproduce en aguas protegidas como lagunas costeras y estuarios, por lo que se considera con dependencia estuarina. Otras Especies Afines en el Área de Estudio Arius felis(Linnaeus) Observaciones, Antecedentes y Perspectivas Esta especie aún cuando es predominantemente marina, se le ha reportado como frecuente en aguas neríticas ocupando fondos fangos o arenosos generalmente asociados a aguas estuarinas como son bocas de ríos, lagunas costeras y estuarios a donde penetra. Se considera que es poco frecuente en las costas de los Estados Unidos durante las distintas épocas del año, excepto en el otoño donde ha alcanzado hasta el 85% de las capturas comerciales (Darnell et al.,1983). En las áreas de Louisiana y Texas, se presenta en baja densidad a lo largo de la línea de costa y su mayor abundancia es alrededor de los 20 m; sin embargo, los ejemplares adultos de esta especie se consideran un buen alimento en áreas muy locales de esta región donde alcanza hasta 610 mm (LT) (Hoese y Moore, 1977), Así mismo, en áreas como el Mississippi se han reportado grandes capturas de esta especie, que de manera incidental han ocurrido durante las pesquerías de otras especies como son las de "menhaden" y peces demersales que tienen importancia en la industria (Franks et al., 1972), por otro lado, esta es una especie que comúnmente se le captura en áreas donde se distribuye el camarón café(Penaeus aztecus) en la región occidental del Golfo de México (Hildebrand, 1954). En Texas la reproducción de esta especie tiene lugar durante principios de mayo y los huevos son llevados oralmente por los machos hasta el comienzo de julio, los jóvenes se desarrollan rápidamente en bahías, las cuales abandonan en el otoño (Gunter, 1945) por lo que son más comunes en bahías y bocas estuarinas durante la primavera y el verano (Pew, 1971). En la región del Atlántico Centro 0ccidental, es común en estuarios y áreas de manglar, penetrando algunas veces hasta aguas dulces (en el tropico), alcanza hasta 1000 mm, pero comúnmente se encuentra de 500 mm lo que favorece su consumo en fresco. En el sur del Golfo de México en el interior de la Laguna de Términos, se le ha reportado por su alta frecuencia como un componente cíclico, ya que aparentemente realiza parte de su ciclo de vida utilizando ecológicamente los distintos ambientes del sistema, desde las aguas semidulces hasta las áreas de mayor influencia marina (Yáñez-Arancibia et al., 1980 Yáñez-Arancibia y Lara-Domínguez, 1986). En las aguas costeras de Costa Rica, se le ha reportado a profundidades menores a 20 m, ocupando fondos fangosos y asociada a la fauna de arrecife de coral, por su fácil captura y gran abundancia se le considera de alto valor comercial (Perry y Perry, 1974). Bagre marinus es una especie común en las comunidades de peces demersales en la Sonda de Campeche (Yáñez-Arancibia y Lara Domínguez, 1986). Sus variaciones estacionales de distribución no son muy marcadas presentándose regularmente en todo el año. Por su abundancia en peso y su amplia distribución se considera que esta especie es típica y dominante en estas comunidades. La presencia de esta especie en aguas muy cercanas a la línea de costa facilita su captura, además de ser muy frecuente en los arrastres de camarones penéidos; sin embargo, su consumo en México es muy local a pesar de alcanzar tallas de apreciable valor como alimento. Su aprovechamiento es muy reducido y no existen pesquerías específicas a su respecto, representando un recurso potencial real para el país aún no explotado óptimamente. Por el análisis ecológico de esta especie sus características de especie dominante en la estructura de las comunidades demersales, el papel ecológico funcional que desempeña en la transferencia energética del sistema a través de sus relaciones tróficas, y sus perspectivas como recurso pesquero potencial real; es preciso recomendar que la especie sea objeto de estudio en sus aspectos biológicos y dinámica de sus poblaciones, para el conocimiento adecuado de su aprovechamiento (Yáñez-Arancibia y Lara-Domínguez, 1986). Etropus crossotus Jordan y Gilbert, 1882. N.v. "Lenguado", "Fringed flounder"Distribución Esta especie se distribuye desde la Bahía de Chesapeake, Golfo de México y Mar Caribe, las Antillas hasta Trinidad, la Guayana Francesa y Venezuela hasta el sur de Brasil (Topp y Hoff, 1972; Hoese y Moore, 1977; Sánchez-Gil et al., 1981; Yáñez-Arancibia et al.,1984, 1985c, 1986). Biología y Ecología Fue colectado un total de 374 ejemplares de esta especie, con una frecuencia de aparición de 49% en el total de las estaciones de los seis cruceros muestreados. En cruceros individuales la mayor frecuencia la presentó en agosto (11%) y la más baja en octubre y noviembre (6%) durante las épocas de lluvias y nortes respectivamente (Tabla 21). Su distribución fue muy amplia, ocupando tanto fondos fangosos como arenosos (Zona Ay B) generalmente entre 12 y 54 m de profundidad (Fig. 39, Tabla 42). Esta especie fue regularmente abundante en el área, constituyó el 0.3% de la captura total en peso. En cruceros individuales la mayor abundancia la presentó en agosto (43%) y la menor en julio (5.7%), durante la época de lluvias. Espacialmente, se observó que durante la época de lluvias los valores más altos de biomasa se concentraron en áreas someras cercanas a la Zona Ade fondos fangosos y mayor influencia estuarina. Durante las épocas de nortes y secas, la mayor biomasa se presentó en profundidades intermedias mayores a 18 m en la Zona B de fondos gruesos (Fig. 39, Tabla 21). Representó el 0.7% de la captura total en número de individuos. En cruceros individuales la mayor abundancia la presentó en noviembre (30%) y la menor en junio (6%), durante las épocas de nortes y lluvias respectivamente (Tablas 21 y 42). Los ejemplares colectados se distribuyeron en un rango de tallas de 50 a 140 mm (LT). Observándose que se colectaron individuos mayores a 125 mm durante las distintas épocas climáticas. Los ejemplares más pequeños se colectaron durante las épocas de lluvias y nortes (Fig. 39). Esta es una especie costera, eurihalina, relacionada íntimamente al fondo. Es un consumidor de 2° orden cuyo alimento lo constituyen: poliquetos, pequeños moluscos y detritus orgánico. Otras Especies Afines en el Área de Estudio Engyophrys sentaGinsburg. Observaciones, Antecedentes y Perspectivas E. crossotus ha sido reportada por distintos autores como una especie costera, común en diversas áreas del norte del Golfo de México, donde es muy abundante durante todo el año (Hildebrand, 1954; Topp y Hoff, 1972; Franks et al., 1972). Gunter (1945), menciona que la mayor abundancia de esta especie en la Bahía de Aransas Texas, fue entre octubre y enero, encontrando pequeñas variaciones estacionales asociadas al gradiente de profundidad. Esto mismo ha sido observado por Darnellet al. (1983), quienes mencionan que esta especie puede ser colectada durante todo el año a lo largo de la línea de costa, desde el este de Louisiana hasta el sur de Texas pero a diferentes profundidades. Se encuentra con alta frecuencia en aguas someras (entre 30 y 40 m), y es más irregular en aguas profundas. Hoese y Moore(1977), consideran que esta especie generalmente ocupa aguas someras entre 10 y 70 m de profundidad y tiende a presentarse en las bahías de las costas de Louisiana y Texas, durante los meses cálidos. Esta especie puede presentarse en áreas de muy diversos rangos de salinidad, en el área de Texas se le ha encontrado en aguas hasta de 1.2 ‰ (Schultz, 1962) y valores tan altos como 45 ‰ (Simmons, y Hoese, 1959). En general, se ha observado que existe una relación estrecha entre la salinidad y la talla de los individuos de esta especie, encontrándose que los ejemplares pequeños tienden a ocupar aguas estuarinas, mientras que los adultos en su mayoría se encuentran en aguas típicamente marinas (Gunter, 1945; Topp y Hoff, 1972; Walls, 1975). Chittenden y McEachran (1976), reportan a esta especie como presente en las capturas de camarón tanto blanco (Penaeus setiferus)como café (P. aztecus), en el noroeste del Golfo de México. 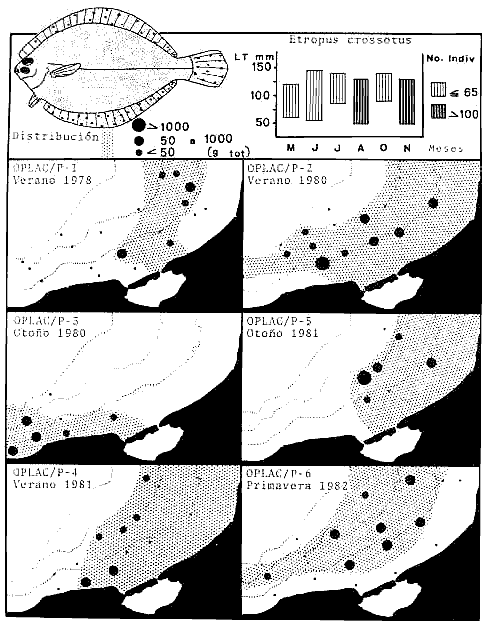 Fig.39. Patrón de distribución espacial y temporal de Etropus crossotus en la Sonda de Campeche. Se muestra la abundanicia de biomasa, densidad y distribución de tallas de la especie en los seis cruceros muestreados. 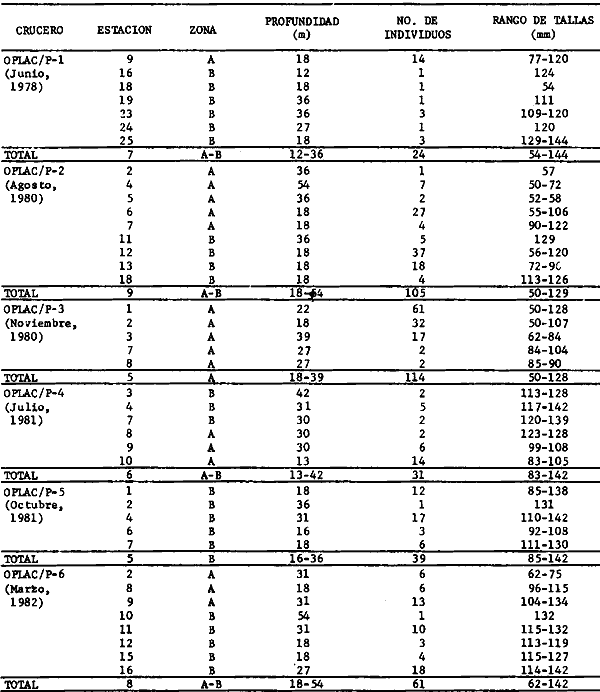 TABLA 42. DISTRIBUCIÓN, ABUNDANCIA NUMÉRICA Y RANGO DE TALLAS DE ETROPUS CROSSOTUS EN LAS POBLACIONES DOMINANTES DE LA SONDA DE CAMPECHE En el sur del Golfo de México, en el área de Laguna de Términos Campeche, esta especie es muy frecuente, se le ha encontrado en ambientes muy diversos que van desde las aguas dulces de alta turbidez, hasta las áreas de mayor influencia marina (Yáñez-Arancibiaet al., 1980 y 1985b). Etropus crossotus es una especie demersal muy común en la Sonda de Campeche a la cual es posible encontrar durante todo el año. Por su amplia distribución y frecuencia de aparición en el área, se considera como una especie típica de dichas comunidades. No se tiene registro de que esta especie sea utilizada en México como alimento, dado que su talla es relativamente pequeña y su carne no es muy apreciada; sin embargo, su captura incidental es tan común que pudiera representar un recurso potencial en el campo de la industria y fabricación de subproductos. Por el análisis ecológico de la especie, sus características de especie dominante en las comunidades demersales, el papel ecológico que desempeñan en la transferencia energética del sistema a través de sus relaciones tróficas, y sus perspectivas como recurso pesquero potencial; es preciso recomendar que la especie sea objeto de estudio en sus aspectos biológicos y dinámica de sus poblaciones, para el conocimiento adecuado de su posible aprovechamiento. Eucinostomus argenteus Baird y Girard, 1854 N.v. "Mojarra", "Spotfin mojarra"Distribución Esta especie se distribuye en arribas costas tropicales de América. En el Atlántico, desde Nueva jersey, Bermudas, Golfo de México hasta el sur del Brasil (Fischer, 1978; Sánchez-Gilet al.,1981; Yáñez-Arancibia et al., 1984, 1985e, 1986). Biología y Ecología Fue colectado un total de 1 104 ejemplares de esta especie con una frecuencia de aparición de 32% en el total de las estaciones de los seis cruceros muestreados. En cruceros individuales la frecuencia más alta la presentó en junio (10%) y la más baja en noviembre (2%), durante las épocas de lluvias y nortes respectivamente (Tabla 21). Esta especie presentó una amplia distribución ocupando tanto fondos fangosos como arenosos en el área de estudio (Zona A yB),generalmente entre 12 y 54 m de profundidad (Fig. 40, Tabla 43). Esta es una especie regularmente abundante en el área, constituyó el 1.0% de la captura total en peso. En cruceros individuales la mayor abundancia la presentó en octubre (12.1%) y la mayor en noviembre (0.2%), durante la época de nortes. Espacialmente se observó que la mayor abundancia tendió a presentarse hacia laZona B, de fondos arenosos, en áreas de más de 36 m de profundidad en la mayoría de las épocas muestreadas; sin embargo, en la época de lluvias las zonas de alta abundancia (en julio y agosto) se encontraron asociadas a las áreas más someras cercanas a la línea de costa (Fig. 40, Tabla 21). Numéricamente esta especie fue abundante y representó el 2.1% de la captura total en número de individuos. En cruceros individuales la abundancia más alta se presentó en octubre (35.1%) y la más baja en noviembre (0.5%), durante la época de nortes (Tablas 21 y 43). Los ejemplares colectados se distribuyeron en un rango de tallas de 42 a 153 mm (LT), observándose que los ejemplares mayores a 150 mm se colectaron al principio de las épocas de lluvias y nortes, los ejemplares más pequeños se colectaron sólo al inicio de la época de lluvias (junio) (Fig. 40). Esta especie presenta hábitos gregarios, es costera y con capacidad eurihalina, es muy frecuente en aguas someras o de profundidad intermedia, se alimenta en fondos tanto fangosos como arenosos, tanto en áreas protegidas como en mar abierto. Es un consumidor de 1er orden cuya alimentación la constituyen en gran número de grupos como son: copépodos, ostrácodos, anfípodos, poliquetos, y detritus orgánico, entre otros. Otras Especies Afines en el Área de Estudio Eucinostomus gula (Cuvier), E. melanopterus(Bleecker) Diapterus rhombeus (Cuvier y Valenciennes);D. auratus (Ranzani). Observaciones, Antecedentes y Perspectivas Esta especie ha sido reportada por diversos autores en otras áreas del Golfo de México (Springer y Woodburn, 1960; Walls, 1975) y Mar Caribe (Randall, 1968; Fischer, 1978) como un habitante común de aguas someras y salobres en sistemas lagunares y estuarinos, a los cuales utiliza como áreas de protección y alimentación (Aguirre Leónet al., 1982) por lo que es común colectarla a lo largo de todo el año. Esta especie es muy semejante a E. gulala cual también es muy abundante en el Golfo de México, los juveniles de ambas especies tienden a ocupar distintos hábitats por lo que es posible hacer una separación ecológica de los mismos (Aguirre León y Yáñez-Arancibia, 1986). Se ha reportado aE. argenteus en el área sur central de Florida y en algunas áreas profundas de la zona central de Louisiana y Texas entre 27 46 m de profundidad y aunque se considera que es poco frecuente, se le colecta en las diferentes épocas del año (Darnell et al.,1983). Esta especie es particularmente abundante al sur de Florida, las Bahamas y Antillas, donde alcanza hasta 200 mm (LT), generalmente ocupa aguas someras y se alimenta en el fondo (Fischer, 1978). En Carolina del Norte, Turner y Johnson (1973), la reportan como una especie común en la boca del Newport River. En Laguna de Términos al sur del Golfo de México, ésta es una de las mojarras más abundantes, la cual junto conE. gula ocupan aguas someras en áreas protegidas en ambientes de pastos marinos (Rizophora mangleyThalassia lestudinum), arrecifes deCrassostrea virginica y ambientes oligohalinos (Aguirre León et al., 1982; Yáñez-Arancibia et al., 1985b; Aguirre León y Yáñez-Arancibia, 1986). También en las costas de Colombia es muy numerosa, se le reporta en ciénegas y se ha observado que penetra hasta aguas dulces (Dahl, 1971). 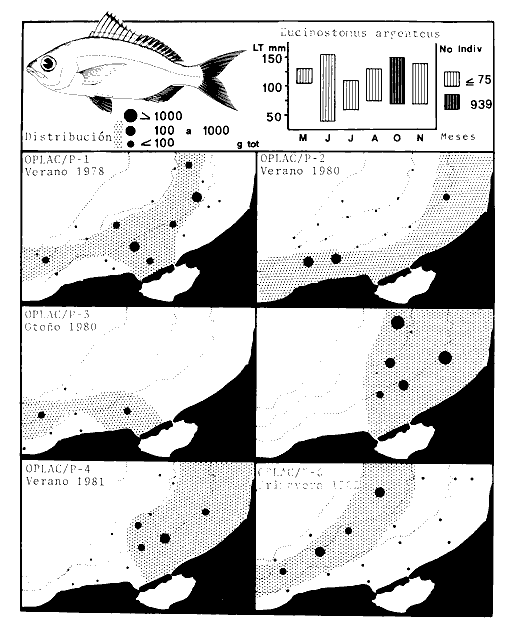 Fig. 40. Patrón de distribución espacial y temporal de Eucinostomus argenteus en la Sonda de Campeche. Se muestra la abundancia de biomasa, densidad y distribución de tallas de la especie en los seis cruceros muestreados. 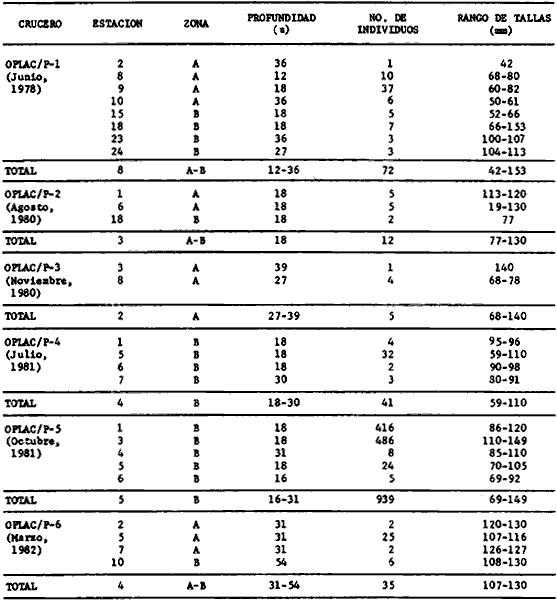 TABLA 43. DISTRIBUCIÓN, ABUNDANCIA NUMÉRICA Y RANGO DE TALLAS DE EUCINOSTOMUS ARGENTEUS EN LAS POBLACIONES DOMINANTES DE LA SONDA DE CAMPECHE Eucinostomus argenteus es una especie muy frecuente en las comunidades de peces demnersales de la Sonda de Campeche. Sus variaciones estacionales de distribución y abundancia tanto en peso como en número de individuos, son poco marcadas, encontrándose regularmente durante todo el año; por ello, y su amplia distribución y frecuencia se considera una especie típica y dominante en estas comunidades. Esta especie pertenece a una familia de gran importancia económica (Gerreidae) en aguas tropicales y subtropicales de América, y posee perspectivas reales como recurso pesquero. En México se explota regionalmente y su carne es apreciada como alimento a pesar de que su talla es relativamente pequeña, se consume localmente; sin embargo, no se conocen estadísticas de su rendimiento real en el país. En otros países se usa como carnada de otras especies como es en la pesca de pargos. Por el análisis ecológico de la especie, sus características de especie dominante en las comunidades demersales, el papel ecológico que desempeña en la transferencia energética del sistema a través de sus relaciones tróficas, y sus perspectivas como recurso pesquero explotado; es preciso recomendar que la especie sea objeto de estudio en sus aspectos biológicos y dinámica de sus poblaciones, para el conocimiento adecuado de su aprovechamiento (Aguirre-León y Yáñez-Arancibia, 1986). Upeneus parvus (Poey, 1953). N.v. "Chivo", "Goatfish"Distribución Esta especie se distribuye desde Carolina del Norte, Florida, las Islas Tortugas, Cuba, Puerto Rico, Tobago, Golfo de México, Venezuela y hasta Brasil (Cervigón, 1966; Perry y Perry, 1974; Sánchez-Gil et al. 1981; Yáñez-Arancibia et al.1984, 1985e, 1986). Biología y Ecología Fue colectado un total de 895 ejemplares de esta especie con una frecuencia de aparición de 41% en el total de las estaciones de los seis cruceros muestreados. En cruceros individuales la frecuencia más alta la presentó en junio (11%) y la más baja en noviembre (4%), durante las épocas de lluvias y nortes respectivamente (Tabla 21). Esta especie se presentó tanto en fondos fangosos como arenosos, encontrándose mejor representada en laZona A de fondos fangosos, generalmente a profundidades mayores a 18 m, entre 11 y 72 m (Fig. 41, Tabla 44). Constituyó el 1.3% de la captura total en peso. En cruceros individuales la mayor abundancia la presentó en octubre (37.5%) y la menor en marzo (3,5%), durante las épocas de nortes y secas respectivamente. Espacialmente se observó que durante las diferentes épocas climáticas muestreadas, los valores más altos de biomasa se localizaron hacia la zona central del área a profundidades mayores de 20 m (Fig. 41, Tabla 21).  Fig. 41. Patrón de distribución espacial y temporal de upeneus parvus en la Sonda de Campeche. Se muestra la abundancia de biomasa, densidad y distribución de tallas de la especie en los seis cruceros muestreados.  TABLA 44. DISTRIBUCIÓN, ABUNDANCIA NUMÉRICA Y RANGO DE TALLAS DE UPENEUS PARVUS EN LAS POBLACIONES DOMINANTES DE LA SONDA DE CAMPECHE No fue una especie numéricamente muy abundante, representó el 1.7% de la captura total en número de individuos, En cruceros individuales la mayor abundancia la presentó en el mes de octubre (30.8) y la más baja en marzo (3.7%), durante las épocas de nortes y secas respectivamente (Tablas 21 y 44). Los ejemplares colectados se distribuyeron en un rango de tallas de 63 a 178 mm (LT), observándose individuos mayores de 150 mm durante todas las épocas climáticas muestreadas; los ejemplares más pequeños se colectaron al inicio de la época de lluvias y durante la época de nortes (Fig. 41). Esta es una especie típicamente marina, de hábitos gregarios, asociada al fondo donde se alimentan, Es un consumidor de 3er orden cuyo alimento lo constituyen pequeños invertebrados, crustáceos y peces. Otras Especies Afines en el Área de Estudio Pseudopeneus maculatus(Bloch). Observaciones, Antecedentes y Perspectivas Es muy común en diversas áreas del Golfo de México y Mar Caribe, donde ocupa aguas de profundidad intermedia o muy profundas entre 40 y 100 m, tanto de fondos fangosos como arenosos (Fischer, 1978). Las formas larvarias de esta especie son planctónicas, los juveniles tienden a ser pelágicos durante la primavera, y los adultos se encuentran muy ligados al fondo, teniendo una vida promedio de un año (Cervigón, 1966; Randall, 1968; Walls, 1975; Chittenden y McEachran, 1976). Chittenden y McEachran (1976), reportan a esta especie como un componente muy común en las áreas de distribución de camarón blanco (Penaeus setiferus) y café (P. aztecus) en el noroeste del Golfo de México; sin embargo, ha sido observado con mayor frecuencia en las capturas de camarón café (Hildebrand, 1954; Miller, 1965), capturándose ejemplares de 90 a 145 mm (LT). En las costas de Cuba esta especie alcanza hasta 200 mm (Guitart, 1974), al igual que en Costa Rica, donde tiende a ocupar fondos lodosos (Perry y Perry, 1974). Darnell et al. (1983) han realizado el análisis de la distribución espacial y temporal deU. parvus en la región de Louisiana y Texas, observando que la especie presenta migraciones batimétricas estacionales; encuentran que durante el invierno y primavera, esta especie se limita a ocupar áreas cercanas a 30 m, mientras que durante el verano y otoño tiende a ocupar áreas más profundas encontrándosele entre 80 y 110 m. Hoese y Moore (1977), mencionan que los ejemplares adultos tienden a ocupar las zonas externas de la plataforma continental de Texas y es muy común encontrarles en grupos durante los meses de verano cuando es posible que ocurra la reproducción. Upeneus parvus es una especie muy común en las comunidades de peces demersales de la Sonda de Campeche. Sus variaciones estacionales de distribución y abundancia tanto en peso como en número de individuos no son muy marcadas. Por su amplia distribución y su gran abundancia en peso, esta especie se considera típica y dominante en estas comunidades. En algunos países esta especie se consume considerándose un buen alimento en fresco. En México, a pesar de su abundancia y su alta incidencia en los arrastres de camarones peneidos, no se conoce su aprovechamiento como alimento o como materia de subproductos industriales; sin embargo, se considera que es un recurso pesquero factible de ser aprovechado en el país. Por el análisis ecológico de la especie, sus características de especie dominante en las comunidades demersales, el papel ecológico que desempeña en la transferencia energética del sistema a través de sus relaciones tróficas, y sus perspectivas como recurso pesquero y potencial; es preciso recomendar que la especie sea objeto de estudio en sus aspectos biológicos y dinámica de sus poblaciones, para el conocimiento adecuado de su posible aprovechamiento. Lutjanus synagris (Linnaeus, 1758). N.v. "Pargo", "Lane snapper"Distribución Esta especie se distribuye desde Carolina del Norte, las Bermudas, Florida, Golfo de México, las Antillas, oeste del Mar Caribe hasta el Brasil (Randall, 1968; Beebe y Tee Van, 1970; Pew, 1971; Perry y Perry, 1974; Bullis y Jones, 1976; Fischer, 1978; Sánchez-Gil et al., 1981; Yáñez-Arancíbia et al., 1984, 1985e' 1986). Biología y Ecología Fue colectado un total de 174 ejemplares de esta especie con una frecuencia de aparición de 22% en el total de las estaciones de los seis cruceros muestreados. En cruceros individuales la frecuencia más alta la presentó en marzo (11%) y la más baja en junio (5%) durante las épocas de secas y lluvias respectivamente (Tabla 21). Esta especie se encontró ocupando tanto fondos fangosos como arenosos; sin embargo, la mayor frecuencia fue en laZona B durante las distintas épocas climáticas muestreadas, generalmente entre 11 y 43 m de profundidad (Fig. 42, Tabla 45). Esta es una especie relativamente abundante en el área y cuya presencia obedece a un patrón temporal restringido; constituyó el 0.9% de la captura toal en peso. En cruceros individuales la mayor abundancia la presentó en marzo (83.8%) y la más baja en junio (4.5%). Espacialmente se observó que las áreas de mayor abundancia fueron siempre cerca de la línea de costa y hacia laZona B de fondos arenosos siguiendo un patrón muy semejante durante las diferentes épocas muestreadas (Fig. 42, Tabla 21). Esta especie fue poco abundante numéricamente y representó el 0.3% de la captura total en número de individuos. En cruceros individuales la abundancia más alta fue en marzo (71.3%) y la más baja en junio (5.7%), durante las épocas de secas y lluvias respectivamente (Tablas 21 y 45). Los ejemplares colectados se distribuyeron en un rango de tallas de 95 a 337 mm (LT), observándose que los ejemplares mayores a 300 mm se colectaron durante la época de secas en áreas muy cercanas a la línea de costa, los ejemplares más pequeños se encontraron también asociados a las zonas someras, durante la época de nortes (Fig. 42). Es una especie de hábitos gregarios, costeros, muy frecuentes en zonas someras o de profundidad intermedia, aguas claras y fondos arenosos, aún cuando ha sido reportada en fondos fangosos. Presenta características eurihalinas y ha sido colectada en el interior de sistemas lagunares y estuarinos, a pesar de sus hábitos pelágicos se encuentra muy relacionada a las especies demersales. Es un consumidor de 3er orden preferentemente carnívoro, cuyo alimento lo constituyen crustáceos, portúnidos, stomatópodos, pequeños peces (anchoas), anélidos y moluscos. Otras Epecies Afines en el Área de Estudio Lutjanus cyanopterusJordan; Lutjanus campechanus(Poey) Observaciones, Antecedentes y Perspectivas Se le conoce como una especie común en diferentes áreas del Golfo de México, la cual se encuentra en todo tipo de fondos, pero muy frecuentemente cerca de arrecifes coralinos (Walls, 1975; Fischer, 1978) y en áreas de pastos marinos (Springer y Woodburn, 1960; Yáñez-Arancibia et al., 1980, 1985b) se considera una especie que ocupa una gran variedad de hábitat desde aguas claras someras hasta aguas turbias, o profundas de fondos fangosos, por lo que su espectro trófico es muy amplio (Randall, 1968). Hildebrand (1954), menciona que esta especie es poco frecuente en áreas de distribución de camarón café,(Penaeus aztecus) en el noroeste del Golfo de México, En las costas de Florida se ha encontrado a esta especie en septiembre y noviembre entre 65 y 110 mm (LT), observándose que los juveniles tienden a ocupar aguas protegidas durante el otoño (Moe y Martin, 1965), asimismo Springer y Woodburn (1960) han observado variaciones temporales de abundancia de esta especie en la Bahía de Tampa. Darnellet al. (1983), reportan que esta especie es poco frecuente en áreas cercanas al Río Mississippi; sin embargo, se ha reportado hacia la Bahía de Galveston entre los 10 y 70 ni de profundidad aún cuando no se destacan áreas de alta densidad. Esta especie es explotada comercialmente en áreas de gran abundancia como es el norte del Golfo de México, Banco de Campeche, Colombia, Guyana, Mar Caribe y frente a las costas de Panamá y las Antillas, donde alcanza hasta 340 mm (LT) y más de 3 kg de peso 1976; Fischer, 1978) y aún cuando algunos autores reportan que en las costas de los Estados Unidos los ejemplares más grandes no son comunes en aguas someras sino en aguas mayores a los 20 m (Cervigón, 1966; Randall, 1968), en aguas costeras sobre la plataforma continental del Mar Caribe y áreas adyacentes, esta especie es objeto de importantes pesquerías; en el sur de Cuba especialmente en abril a junio la FAO ha reportado una captura de más de 13,000 toneladas en el año de 1973. 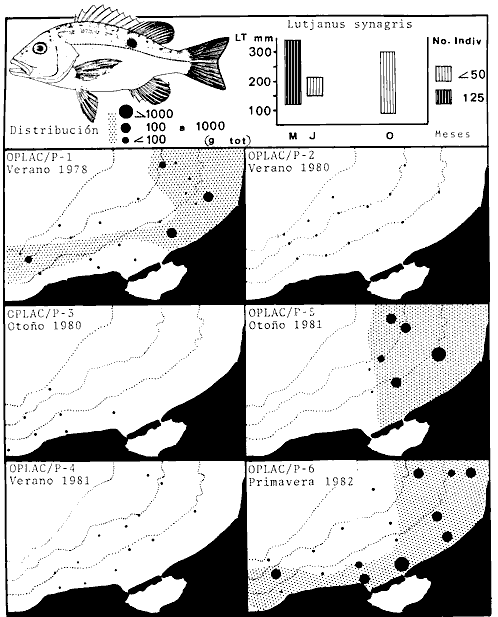 Fig. 42. Patrón de distribución espacial y temporal de Lutjanus synagris en la Sonda de Campeche. Se muestra la abundancia de biomasa, densidad y distribucion de tallas de la especie en los seis cruceros muestreados. 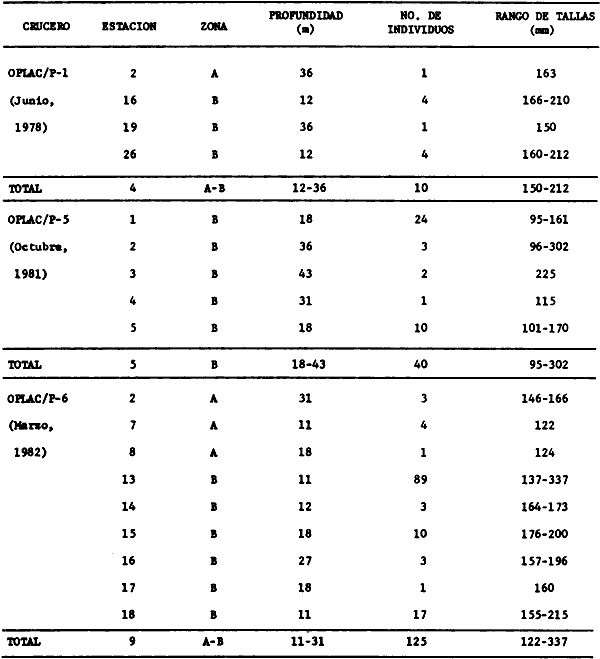 TABLA 45. DISTRIBUCIÓN, ABUNDANCIA NUMÉRICA Y RANGOS DE TALLAS DE LUTJANUS SYNAGRIS EN LAS POBLACIONES DOMINANTES SE LA SONDA DE CAMPECHE Lutjanus synagris es una especie común en las comunidades de peces demersales en la Sonda de Campeche a pesar de sus hábitos pelágicos. Sus variaciones estacionales de distribución y abundancia en peso son muy marcadas por los posibles movimientos migratorios que realiza, de ahí que aún cuando está presente en las diferentes épocas del año, su presencia en el área es verdaderamente importante sólo en la época de secas; sin embargo, por su abundancia en peso y su amplia distribución en el área, esta especie se considera típica y dominante de estas comunidades temporalmente. En México este recurso es explotado regionalmente, es muy apreciado como alimento y presenta un alto valor económico; sin embargo, no se conocen estadísticas específicas de sus pesquerías ni de su rendimiento en el país. Por el análisis ecológico de la especie, sus características de especie dominante en la estructura de las comunidades demersales, el papel ecológico que desempeña en la transferencia energética del sistema a través de sus relaciones tróficas, y sus perspectivas como recurso pesquero explotado, es preciso recomendar que la especie sea objeto de estudio en sus aspectos biológicos y dinámica de sus poblaciones, para el conocimiento adecuado de su aprovechamiento. Stellifer "grupo" colonensis/lanceolatus. Stellifer colonensis Meek e "Hildebran, 1925. Stellifer lanceolalus Holbrook, 1855. N.v. "Corvina", "Drummer"Distribución Stellifer colonensis se distribuye desde el sur del Golfo de México, Panamá, Costa Rica, incluyendo Puerto Rico y Haití (Perry y Perry, 1974; Chao, 1978; Sánchez-Gil, 1981; Yáñez-Arancibia et al., 1984, 1985e, 1986). Stellifer lanceolatus se distribuye en las costas del Atlántico de los Estados Unidos hasta el sur del Golfo de México (Chao, 1978; Yáñez-Arancibiaet al., 1984, 1985e, 1986). Biología y Ecología Fue colectado un total de 1173 ejemplares de este grupo con una frecuencia de aparición de 17% en el total de las estaciones de los cruceros muestreados. En cruceros individuales la frecuencia más alta fue en marzo (6%) y la más baja en junio (21), durante las épocas de secas y lluvias respectivamente (Tabla 21). Este grupo presentó una distribución muy localizada, ocupando sólo las áreas que corresponden a la Zona A de fondos fangosos en profundidades menores a 35 m, generalmente entre 12 y 31 m (Fig. 43, Tabla 46). La abundancia de este grupo no fue muy alta, constituyó el 0.9% de la captura total en peso. En cruceros individuales la mayor abundancia la presentó en marzo (46.2%) y la más baja en junio (1.4%), durante las épocas de secas y lluvias respectivamente. Espacialmente se observó un patrón de distribución claramente asociado a las áreas de mayor influencia estuarina Zona A muy cercanas a la costa (Fig. 43, Tabla 21). Representó el 2.2% de la captura total en número de individuos. En cruceros individuales la abundancia más alta la presentó en julio (48.8%) y la más baja en junio (1.1%) durante la época de lluvias (Tablas 21 y 46). Los ejemplares colectados se distribuyeron en un rango de tallas de 35 a 149 mm (LT), observándose que los ejemplares mayores a 140 mm se colectaron durante las épocas de secas y nortes, y los ejemplares más pequeños se colectaron durante las épocas de secas y lluvias (Fig. 43). Este es un grupo de especies de hábitos costeros, demerso-pelágico y eurihalino. Este grupo está formado por consumidores de 20 orden cuyo alimento principal lo constituyen: pequeños crustáceos, larvas de camarón, detritus. Observaciones, Antecedentes y Perspectivas La revisión taxonómica más reciente de la familia Sciaenidae ha sido realizada por Chao (1978). Este autor considera que dentro del género de Stellifer en las costas del Atlántico oeste, existe un total de 11 especies cuyas características taxonómicas se encuentran bien definidas. En el sur del Golfo de México específicamente en el área de estos estudios, se presenta un grupo de este género en el cual se presenta un traslape de características cuya diagnosis resultante es muy semejante para los distintos ejemplares analizados; sin embargo, es difícil determinar que se trata de una sola especie, porque dichas características involucran la descripción de dos especies:Stellifer colonensis y S. lanceolatus.Haciendo un análisis de la distribución geográfica de estas especies, es posible considerar que ambas se presentan en el área de estudio, como resultado de la convergencia de las dos provincias zoogeográficas conocidas como Provincia carolineana que se extiende desde las costas de Hatteras hasta Florida y la caribeana la cual se extiende desde el sur de Florida hasta Brasil (Yáñez-Arancibia et al.,1984). 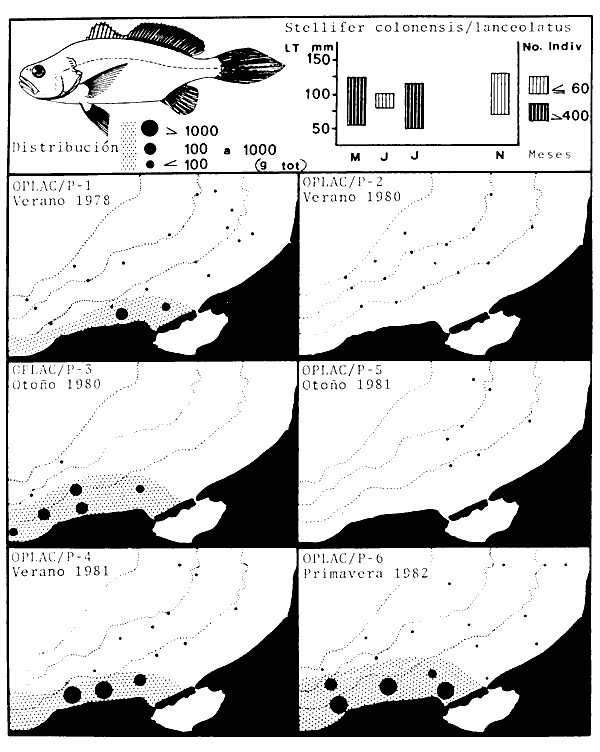 Fig. 43. Patrón de distribución espacial y temporal de Stellifer colonensis/lanceolatus en la Sonda de Campeche. Se muestra la abundancia de biomasa, densidad y distribución de tallas de la especie en los seis cruceros muestreados.  TABLA 46. DISTRIBUCIÓN, ABUNDANCIA NUMÉRICA Y RANGO DE TALLAS DE STELLIFER COLONENSIS/LANCEOLATUS EN LAS POBLACIONES DOMINANTES DE LA SONDA DE CAMPECHE Estos planteamientos parecen una explicación sencilla; sin embargo, la complejidad para entender la dispersión y distribución de poblaciones y comunidades de peces, como en este caso, abre las puertas a investigaciones futuras en el aspecto de la zoogeografía en el sur del Golfo de México. Para fines de manejo y análisis de los datos de este caso particular, se ha denominado a este grupo como Stellifer colonensis/ lanceolatus. El grupoStellifer colonensis / lanceolatus es común en las comunidades de peces demersales de la Sonda de Campeche. Sus variaciones estacionales de distribución y abundancia son marcados, disminuyendo significativamente en el área de estudio a fines de la época de lluvias y principio de la época de nortes; sin embargo, por su abundancia en número de individuos y su alta frecuencia en el resto del año, se considera que este grupo es típico y dominante en estas comunidades. Este grupo pertenece a una familia de gran importancia económica (Sciaenidae) y su carne es comestible, sin embargo, su talla es pequeña y no se aprecia como alimento en fresco. En México este grupo puede considerarse como un recurso potencial, el cual mediante el procesamiento industrial adecuado puede ser aprovechado como alimento humano o bien, usado en la fabricación de subproductos. Por el análisis ecológico de este grupo, sus características de grupo dominante en la estructura de las comunidades demersales, el papel ecológico que desempeña en la transferencia energética del sistema a través de sus relaciones tróficas, y sus perspectivas como recurso pesquero potencial, es preciso recomendar que sea objeto de estudio en sus aspectos taxonómicos, biológicos y dinámica de sus poblaciones, para el conocimiento adecuado de su posible aprovechamiento. Trichiurus lepturus (Linnaeus, 1758). N.v. "Pez cinta", "Cutlass fish"Distribución Esta es una especie cosmopolita de aguas tropicales y templadas, en el Atlántico se distribuye desde Massachussetts, Virginia, todo el Golfo de México, Mar Caribe, Panamá y hasta Argentina (Cervigón, 1966; Hoese y Moore, 1977; Fischer, 1978; Sánchez-Gil et al., 1981; Yánez-Arancibia et al., 1984, 1985e, 1986). Biología y Ecología Fue colectado un total de 2956 ejemplares de esta especie con una frecuencia de aparición de 35% en el total de las estaciones en los seis cruceros muestreados. En cruceros individuales la mayor frecuencia la presentó en marzo (11%) y la menor en octubre (2%), durante las épocas de secas y nortes respectivamente (Tabla 21). Fue una especie regularmente abundante durante todas las épocas climáticas muestreadas, se presentó tanto en fondos fangosos como arenosos del área de estudio (Zona Ay B),aunque estuvo Mejor representada en la Zona A de fondos fangosos y mayor influencia estuarina, generalmente ocupó las áreas someras pero se colecté entre 11 y 76 m de profundidad (Fig. 44, Tabla 47). Constituyó el 2.2% de la captura total en peso. En cruceros individuales la mayor abundancia la presentó en marzo (66.3%) y la menor en agosto (0.5%), durante las épocas de secas y nortes respectivamente. Espacialmente, se observó que durante las distintas épocas climáticas muestreadas, los valores más altos se localizaron en las áreas más someras y de mayor influencia estuarina (Fig. 44, Tabla 21). Representó el 5.5% de la captura total en número de individuos. En cruceros individuales la mayor abundancia fue en marzo (85.5%) coincidiendo con la época de mayor abundancia en peso, y la menor en agosto (0.2%), durante la época de lluvias (Tablas 21 y 47). Los ejemplares colectados se distribuyeron en un rango de tallas de 123 a 690 mm (LT), observándose que los individuos mayores de 600 mm se colectaron tanto en la época de secas como en la de lluvias, y los ejemplares más pequeños se colectaron sólo en la época de nortes (Fig. 44). 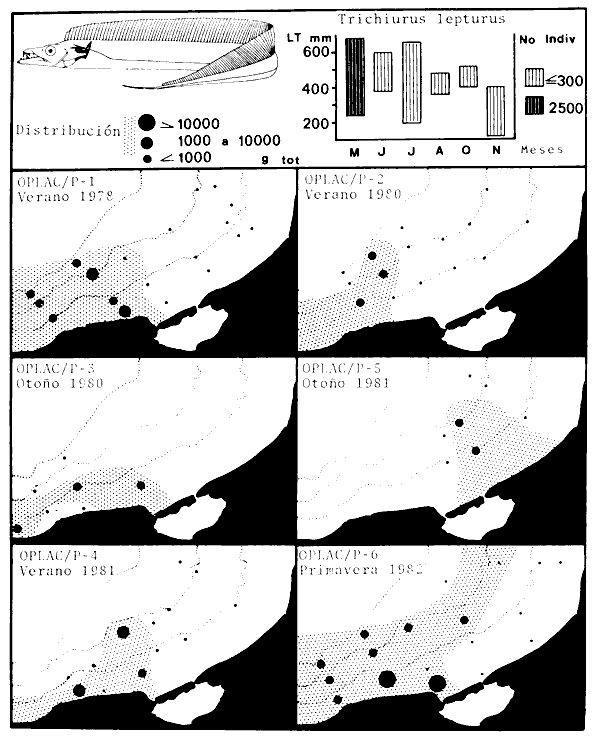 Fig. 44. Patrón de distribución espacial y temporal de Trichiurus lepturus en la Sonda de Campeche. Se muestra la abundancia de biomasa, densidad y distribución de tallas de la especie en los seis cruceros muestreados. 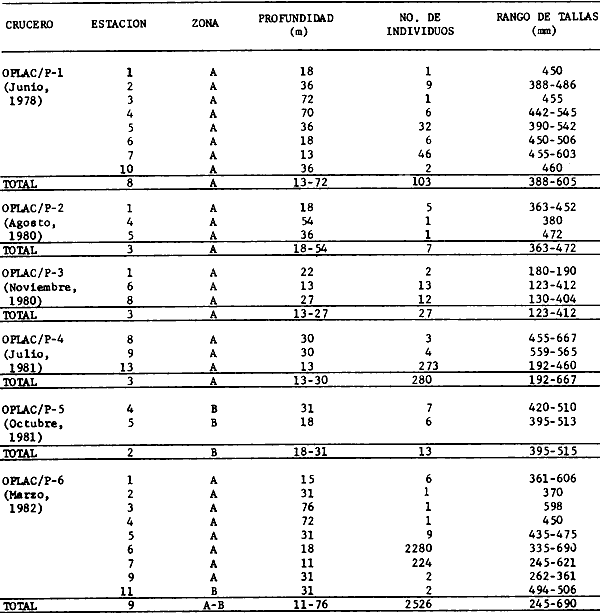 TABLA 47. DISTRIBUCIÓN, ABUNDANCIA NUMÉRICA Y RANGO DE TALLAS DE TRICHIURUS LEPTURUS EN LAS POBLACIONES DOMINANTES DE LA SONDA DE CAMPECHE Esta es una especie costera, eurihalina, que presenta hábitos nocturnos, Se le colecta generalmente en el fondo de aguas someras donde habitan generalmente los ejemplares pequeños. Los ejemplares grandes no fueron muy frecuentes en las colectas. Es un consumidor de 3er orden, predominantemente carnívoro, cuyo alimento lo constituyen pequeños peces y crustáceos principalmente. Observaciones, Antecedentes y Perspectivas Esta es una especie muy común en aguas costeras del Golfo de México y Mar Caribe, ocupa tanto los fondos como las zonas pelágicas, pero generalmente ocurre en aguas someras de fondos lodosos y penetra en áreas protegidas como lagunas costeras y estuarios durante los meses cálidos (Cervigón, 1966; Springer y Woodburn, 1960; Franks et al., 1972; Turner y Johnson, 1973; Hoese y Moore, 1977). Esta especie realiza migraciones por lo que sus capturas son irregulares, alcanzando en ocasiones grandes volúmenes como sucede en las costas de Tampa, Florida (Springer y Woodburn, 1960). Darnell et al., (1983), analizan las variaciones estacionales y la distribución de esta especie en la región de Louisiana y Texas, encontrando que a pesar de disminuir notablemente la densidad de esta especie" durante el otoño, T. lepturus es muy frecuente durante las distintas épocas climáticas muestreadas, ocupando siempre las zonas más someras que van desde los 20 a los 80 m de profundidad. Hildebrand (1954), y Chittenden y McEachran (1976), reporta a esta especie como muy abundante en las capturas de camarón al noroeste del Golfo de México, siendo más frecuentes en las áreas de distribución de camarón blanco (Penaeus setiferus), predominando en el invierno alrededor de los 75 m de profundidad y en el verano a 35 m, lo que está de acuerdo con lo reportado por otros autores (Gunter, 1945; Miller, 1965; Dawson, 1967). Se encuentra a todo lo largo de las costas de Cuba (Guitart, 1974), Costa Rica (Perry y Perry, 1974) y Colombia donde es muy abundante y alcanza hasta 1500 mm (LT), su carne es apreciada y se le consume en fresco, y aunque no es muy importante posee valor económico (Dahl, 1971). En el sur del Golfo de México, en el área de Laguna de Términos, Campeche, esta es una especie que frecuenta el interior de la laguna, ocupando ambientes desde dulceacuícolas hasta típicamente marinas (Yánez-Arancibiaet al., 1980 y 1985b). La reproducción de esta especie ocurre durante el invierno y principios de primavera en profundidades cercanas a 36 m, los juveniles migran hacia aguas protegidas durante el verano y regresan a las aguas profundas en el invierno; se han reportado tallas hasta de 1525 mm (LT), el promedio de vida de esta especie se calcula de 1 año (Dawson, 1967). Las áreas de pesca más importante de esta especie, se localizan en Cuba (Bahía de Cienfuegos), las Guyanas y Jamaica, en Venezuela en el año de 1976, se capturaron más de 1500 toneladas según datos de la FAO (Fischer, 1978); sin embargo, su importancia econórnica es local y depende de la región. Trichiurus lepturus es una especie frecuente en las comunidades de peces demersales de la Sonda de Campeche. Sus variaciones estacionales de distribución y abundancia no son muy marcadas presentándose en el área durante todo el año. Por su abundancia tanto en peso como en número de, individuos, su amplia distribución y frecuencia, se considera que esta especie es típica y ecológicamente dominante en estas comunidades. Esta especie es común en las capturas de camarones penéidos en México, se consume sólo localmente, aún cuando representa un recurso potencial ya que no se tienen en el país estadísticas de su pesquería; la importancia de esta especie está en sus perspectivas ya sea como alimento humano procesado, o en la fabricación de subproductos proteicos. El análisis ecológico de esta especie, sus características como especie dominante en la estructura de las comunidades demersales, el papel ecológico que desempeñan en la transferencia energética del sistema a través de sus relaciones tróficas y sus perspectivas como recurso pesquero potencial; es preciso recomendar que la especie sea objeto de estudio en sus aspectos biológicos y de dinámica de sus poblaciones, para el conocimiento adecuado de su posible aprovechamiento. Cetengraulis edentulus (Cuvier, 1829). N.v. "Anchoveta del Golfo", "Pelona"Distribución Esta especie se distribuye desde el sur del Golfo de México, Mar Caribe, hasta el Brasil (Cervigón, 1966; Fischer, 1978; Sánchez-Gilet al., 1981; Yánez-Arancibiaet al., 1984, 1985e, 1986). Biología y Ecología Fue colectado un total de 2023 ejemplares de esta especie con una frecuencia de aparición de 19% en el total de las estaciones en los seis cruceros muestreados. En cruceros individuales la frecuencia más alta fue en los meses de junio y marzo (5%), durante las épocas de lluvias y secas respectivamente, y la más baja en octubre y julio (3.7%) durante las épocas de nortes y lluvias respectivamente (Tabla 21). Se colectó siempre asociada a laZona A de fondos fangosos, generalmente entre 12 y 54 m de profundidad (Fig. 45, Tabla 48). Constituyó el 2.3% de la captura total en peso, presentó variaciones asociadas en su distribución y abundancia, encontrándose mejor representada durante la época de lluvias. En cruceros individuales los valores más altos de abundancia fueron en julio (48.9%), y los más bajos en noviembre (1.0%) durante la época de nortes (Tabla 21). Espacialmente se observó que durante las diferentes épocas climáticas en las cuales fue colectadaC. edentulus presentó la mayor abundancia en aguas someras entre 11 y 18 m de profundidad, en áreas muy cercanas a la mayor influencia fluvial y estuarina del sistema como son los ríos San Pedro y San Pablo, y la Boca del Carmen en Laguna de Términos (Fig. 45, Tabla 21). Representó el 3.8% de la captura total en número de individuos. En cruceros individuales la abundancia más alta se presentó en junio (40.7%), y la más baja en noviembre (0.7%), durante las épocas de lluvias y nortes respectivamente (Tablas 21 y 48). Los ejemplares colectados se distribuyeron en un rango de tallas de 108 a 211 mm (LT), los ejemplares mayores a 200 mm se capturaron a fines de la época de lluvias, y los individuos más pequeños durante la época de secas. Las tallas más grandes coinciden con la época de menor densidad y la mayor profundidad a que esta especie fue colectada (50 m) (Fig. 45). Esta especie es gregaria y tiende a formar grandes grupos facilitando su pesca, a pesar de sus hábitos pelágico-costeros se encuentra muy relacionada a las comunidades de peces demersales, es un consumidor de 1er orden (esencialmente filtrador), cuyo alimento principal lo constituyen: diatomeas. Se le considera como una especie con dependencia estuarina. Observaciones, Antecedentes y Perspectivas Es una especie común en aguas marinas cercanas a la línea de costa. Sin embargo, se conoce muy poco acerca de su biología y ecología. En el sur del Golfo de México se le ha reportado como una especie muy abundante, cuyo patrón de distribución y abundancia está relacionado a las características batimétricas y tipo de sedimento (Sánchez-Gil et al., 1981). Asimismo en el Mar Caribe se le reporta como una especie muy abundante cuyos patrones estacionales son muy marcados. En Cuba (Guitart, 1974), Colombia (Dahl, 1971) y Venezuela (Cervigón, 1966), alcanza hasta un máximo de 165 mm (LT), siendo una de las especies más grandes de la familia Engraulidae en las áreas costeras. Su consumo no es en fresco, pero se considera de gran importancia económica como subproducto. En datos de la FAO, se reporta una captura de más de 800 toneladas para el año de 1975, capturadas sólo en costas de Venezuela, donde se usa principalmente en la fabricación de harinas de pescado (Fischer, 1978). Cetengraulis edentulus es una especie común en las comunidades de peces demersales de la Sonda de Campeche. Presenta variaciones estacionales marcadas en el área de estudio, encontrándose con una frecuencia relativamente baja especialmente durante la época de nortes; sin embargo, debido a su gran abundancia tanto en peso como en número de individuos, su frecuente captura en los arrastres comerciales de camarones penéidos y sus tallas alcanzadas, esta especie representa un recurso de gran importancia en México, ya sea como alimento en fresco o bien como materia prima en la fabricación de subproductos como harinas y concentrados protéicos. En México este recurso es explotado regionalmente, pero a pesar de ello, no existen estadísticas de su pesquería en particular y se desconoce su rendimiento y aprovechamiento en el país. Por el análisis ecológico de la especie, sus características de especie dominante en la estructura de las comunidades demersales, el papel ecológico funcional que desempeña en la transferencia energética del sistema a través de sus relaciones tróficas, y sus perspectivas como recurso pesquero explotado; es preciso recomendar que la especie sea objeto de estudio en sus aspectos biológicos y dinámica de sus poblaciones, para el conocimiento adecuado de su aprovechamiento. 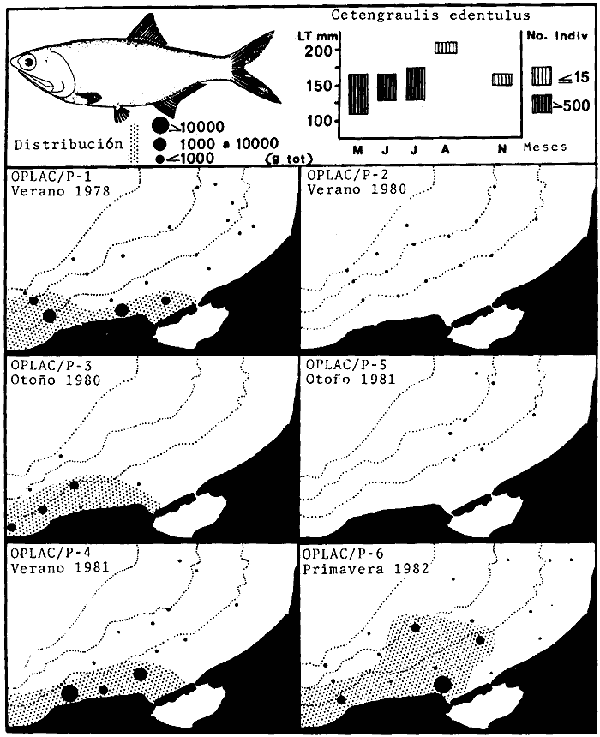 Fig. 45. Patrón de distribución espacial y temporal de Centengraulis edentulus en la Sonda de Campeche. Se muestra la abundancia de biomasa, densidad y distribución de tallas de la especie en los seis cruceros muestreados.  TABLA 48. DISTRIBUCIÓN, ABUNDANCIA NUMÉRICA DE RANGO DE LAS TALLAS DE CETENGRAULIS EDENTULUS EN LAS POBLACIONES DOMINANTES DE LA SONDA DE CAMPECHE. Selene setapinnis ( = Vomer setapinnis). (Mitchill, 1815). N.v. "Papelillo", "Atlantic moonfish"Distribución Esta especie se distribuye en ambas costas tropicales de América. En el Atlántico, desde el oeste de Nueva Escocia, Canadá, las Bermudas, Golfo de México hasta el Mar de la Plata, Argentina (Perry y Perry, 1974; Sánchez-Gilet al., 1981; Yánez-Arancibia et al., 1984, 1985e, 1986). Biología y Ecología Fue colectado un total de 759 ejemplares de esta especie, con una frecuencia de aparición de 35% en el total de las estaciones de los seis cruceros muestreados. En cruceros individuales la mayor frecuencia la presentó en junio y agosto (7%) y la menor en noviembre (2%), durante las épocas de lluvias y nortes respectivamente (Tabla 21). Esta especie se encontró ocupando tanto los fondos arenosos como fangosos en el área de estudio (Zona A y B),generalmente a profundidades de 11 a 70 m (Fig. 46, Tabla 49). Es una especie regularmente abundante en el área y constituyó el 1.4% de la captura total en peso. En cruceros individuales la mayor abundancia la presentó en marzo (42.2%) y la menor en noviembre (0.6%), durante las épocas de secas y nortes respectivamente. Espacialmente se observó que durante las épocas de lluvias y secas fue colectada exclusivamente en estaciones correspondientes a laZona A de fondos fangosos en manchones asociados a las áreas de mayor influencia estuarina y aguas más someras, durante la época de nortes fue colectada en ambas Zona AyB en general con una frecuencia baja, pero mejor representada en la Zona B de fondos gruesos hacia las aguas de mayor profundidad (Fig. 46, Tabla 21). No fue una especie muy numerosa pero representó el 1.4% de la captura total en número de individuos. En cruceros individuales la abundancia más alta fue en marzo (40%) y la más baja en noviembre (0.7%), durante las épocas de secas y nortes respectivamente (Tablas 21 y 49). Los ejemplares capturados se distribuyeron en un rango de tallas de 40 a 230 mm (LT), observándose que los individuos mayores a 200 mm sólo fueron colectados en junio, y los más pequeños en julio ambos casos a principios de la época de lluvias, ocupando generalmente las áreas más someras del área de estudio (Fig. 46). Esta es una especie de hábitos gregarios, costeros, curihalina, la cual penetra a aguas protegidas como lagunas costeras y estuarios. Es un consumidor de 2º orden en cuya alimentación se incluyen poliquetos, pequeños peces y crustáceos. Otras Especies Afines en el Área de Estudio Selene vomer(Linnaeus). Observaciones, Antecedentes y Perspectivas Se ha reportado aS. setapinnis como una especie costera de hábitos gregarios que se encuentra cerca del fondo en aguas salobres someras, pero como en la mayoría de los carángidos, los adultos tienden a ocupar las aguas más profundas (Randall, 1968; Walls, 1975), los más pequeños (30 mm) se presentan cerca de la línea de costa y los juveniles ocupan bahías y bocas de ríos (Perry y Perry, 1974; Dahl, 1971; Fischer, 1978). Gunter (1945), reporta haber colectado a esta especie en aguas de Texas entre 17 y 37‰. Darnellet al. (1983), reportan que en el área de Louisiana y Texas esta especie se distribuye en pequeños grupos aislados de baja densidad desde el Río Mississippi hasta el sur de Texas en áreas de menos de 20 m, estos autores hacen un análisis espacial y temporal de la especie encontrando que la mayor densidad se presenta durante el verano en aguas de 60 y 100 m, y la más baja en otoño en grupos aislados de baja densidad entre 20 y 40 m de profundidad. Chittenden y McEachran (1976), reportan a esta especie como un componente común en áreas de distribución de camarón blanco (Penaeus setiferus) en el noroeste del Golfo de México, mientras que Hildebrand (1954) menciona que esta especie es el carángido más común en las capturas de camarón café (Penaeus aztecus). 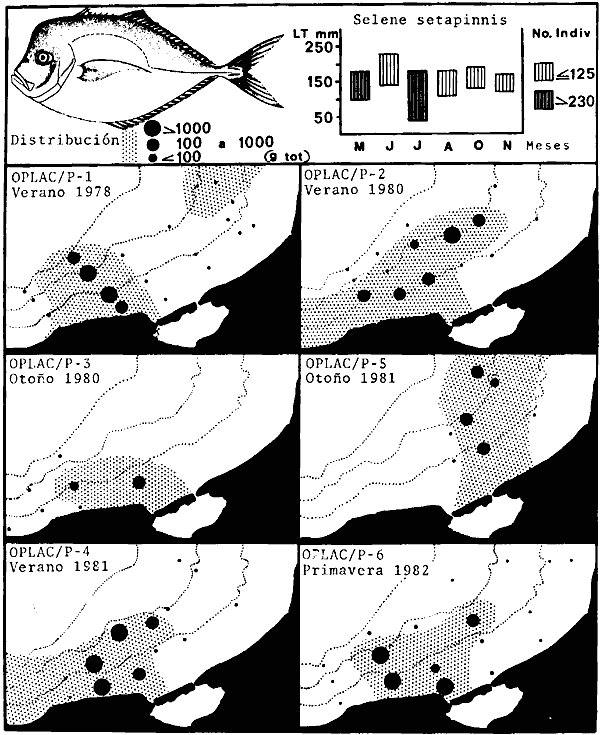 Fig. 46. Patrón de distribución espacial y temporal de Selene satapinnis en la Sonda de Campeche. Se muestra la abundancia de biomasa, densidad y distribución de tallas de la especie en los seis cruceros muestreados. 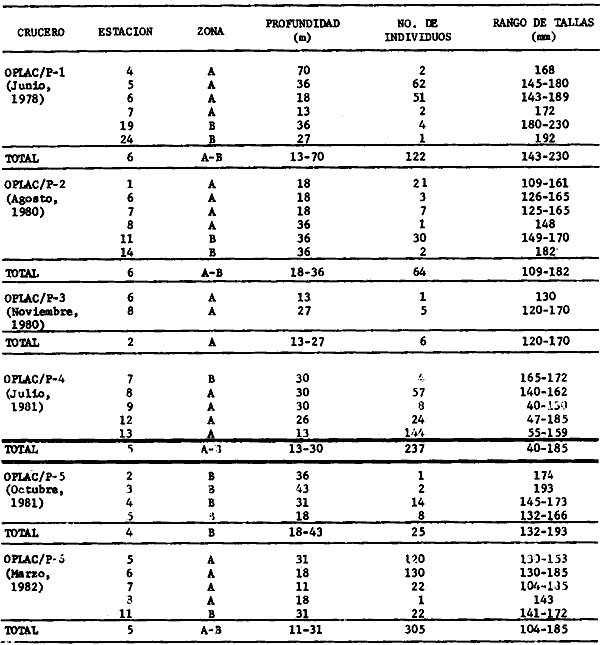 TABLA 49 .DISTRIBUCIÓN, ABUNDANCIA NUMÉRICA Y RANGO DE TALLAS DE SELENE SETAPINNIS EN LAS POBLACIONES DOMINANTES DE LA SONDA DE CAMPECHE Esta especie alcanza hasta 380 mm (LT); sin embargo, se sabe que llega a la madurez sexual cuando rebasa los 130 mm (Fischer, 1978). En las costas de Cuba alcanza sólo hasta 200 mm (Guitart, 1977) y en Colombia hasta 300 mm donde se presenta en cardúmenes relativamente grandes; por su talla y carne de sabor agradable presenta en estas áreas, valor comercial (Dahl, 1971). Selene setapinnis es una especie muy común en las comunidades de peces demersales de la Sonda de Campeche a pesar de sus hábitos pelágicos, sus variaciones estacionales de distribución y abundancia son poco marcadas, siendo regular su presencia durante, todo el año. Por su abundancia tanto en peso como en número de individuos y su frecuencia, se considera que esta especie es típica y dominante en las comunidades estudiadas. Esta especie pertenece a una familia de gran importancia económica (Carangidae). Sin embargo, su talla es relativamente pequeña y en México se explota regionalmente, su consumo es local, no se conocen estadísticas de su pesquería en particular. Por el análisis ecológico de esta especie, sus características de especie dominante en la estructura de las comunidades de, peces demersales, el papel ecológico que desempeña en la transferencia energética del sistema a través de sus relaciones tróficas y sus perspectivas como recurso pesquero explotable, es preciso recomendar que la especie sea objeto de estudio en sus aspectos biológicos y dinámica de sus poblaciones, para el conocimiento adecuado de su aprovechamiento. Stenotomus caprinus (Goode,y Bean, 1882). N.v. "Sargo de espina", "Longspine porgy"Distribución Esta especie se distribuye desde la costa este de Florida, Louisiana y Texas hasta el sur del Golfo de México (Hoese y Moore, 1977; Fischer, 1978; Sánchez-Gilet al., 1981; Yánez-Arancibia, 1984, 1985e, 1986). Biología y Ecología Fue colectado un total de 1818 ejemplares de esta especie con una frecuencia de aparición de 43% en el total de las estaciones de los seis cruceros muestreados. En cruceros individuales la frecuencia más alta fue desde Junio hasta agosto (11%) y la más baja fue en noviembre (1%) durante las épocas de lluvias y nortes respectivamente (Tabla 21). Se presentó ocupando tanto los fondos fangosos como arenosos del área de estudio (Zona Ay B), generalmente a profundidades mayores a 18 m entre 20 y 76 m (Fig. 47, Tabla 50). Fue una especie abundante, constituyó el 0.8% de la captura total en peso. En cruceros individuales la mayor abundancia la presentó en octubre (56.9%) y la más baja en noviembre (0.4%), durante la época de nortes. Espacialmente se observó un patrón semejante durante las diferentes, épocas muestreadas, donde los valores más altos de biomasa se presentaron entre 36 y 70 m de profundidad tendiendo hacia laZona B de fondos arenosos (Fig. 47, Tabla 21). Representó el 3.4% de la captura total en número de individuos. En cruceros individuales la abundancia más alta la presentó en agosto (49.4%) y la más baja en noviembre (0.2%) durante las épocas de lluvias y nortes respectivamente (Tablas 21 y 50). Los ejemplares colectados se distribuyeron en un rango de tallas de 38 a 175 mm (LT), observándose que los ejemplares mayores de 150 mm sólo se colectaron durante la época de secas y los ejemplares más pequeños durante la época de lluvias (Fig. 47). Esta especie es típicamente marina, presenta hábitos gregarios y no ha sido reportada en ambientes salobres o en áreas protegidas. Es un consumidor de 2º orden cuya alimentación se constituye principalmente de pequeños crustáceos y peces. Otras Especies Afines en el Área de Estudio Calamus penna (Cuvier y Valenciennes); Calamus leucosteusJordan y Gilbert; Calamus nodosusRandall y Caldwell. Observaciones, Antecedentes y Perspectivas Esta especie se considera muy abundante en toda el área noroeste del Golfo de México, donde puede encontrársele durante todo el año ocupando distintas profundidades preferentemente entre 18 y 120 m. Algunos autores quienes han realizado el análisis de su distribución en estas áreas consideran a S. caprinus como una de las especies demersales más abundantes en la región de Louisiana y Texas, la cual tiende a presentarse en aguas muy someras y de fondos gruesos (cuarzos) (Darnellet al., 1983). Walls (1975), menciona que es muy raro encontrar a esta especie cerca de la línea de costa al norte del Golfo de México. Chittenden y McEachran (1976), reportan a esta especie como la más abundante en las áreas de distribución de camarón café (Penaeus aztecus) al noroeste del Golfo de México, según estos autores constituye entre el 30 y 43 % de las capturas de cada arrastre; este fenómeno ha sido observado por diversos autores quienes han hecho el análisis de la fauna asociada al camarón café en distintas áreas del Golfo de México (Hildebrand, 1954; Roithmayr, 1965; Moore et al., 1970; Franks et al., 1972), y aunque con baja frecuencia Chittenden y McEachran (1976) lo han colectado en aguas someras que corresponden a las áreas de distribución de camarón blanco(Penaeus setiferus). Se ha colectado en un rango de tallas de 5 a 185 mm (LT) aún cuando Fischer (1978) reporta que puede alcanzar hasta 220 mm. La reproducción de esta especie aparentemente ocurre en primavera, en Texas Hildebrand (1954) colectó individuos maduros entre 95 y 139 mm en el mes de febrero y Miller (1965), encontró ejemplares de 26 y 37 mm en mayo y junio y se calcula que tiene un promedio de vida de 2 años.  Fig. 47. Patrón de distribución espacial y temporal de Stenotomus caprinus en la Sonda de Campeche. Se muestra la abundancia de biomasa, densidad y distibución de tallas de la especie en los seis cruceros muestreados.  TABLA 50. DISTRIBUCIÓN, ABUNDANCIA NUMÉRICA Y RANGO DE TALLAS DE STENOTOMUS CAPRINUS EN LAS POBLACIONES DOMINANTES DE LA SONDA DE CAMPECHE Stenotomus caprinus es una especie frecuente en las comunidades de peces demersales de la Sonda de Campeche, la cual a pesar de sus hábitos pelágicos no presenta variaciones marcadas en su distribución y abundancia tanto en peso como en número de individuos, por lo que se considera una especie típica y ecológicamente dominante en estas comunidades. Esta especie pertenece a una familia de gran importancia económica como es Scaridae, sin embargo, la talla que alcanza esta especie es pequeña, aún cuando su carne es comestible. Dada la gran abundancia numérica que presenta S. caprinus en la Sonda de Campeche, puede considerarse que es un recurso pesquero potencial cuyo aprovechamiento en México puede realizarse mediante el procesamiento adecuado de su carne, o en la fabricación de subproductos de importancia industrial. Por el análisis ecológico de la especie, sus características de especie dominante en la estructura de las comunidades demersales, el papel ecológico funcional que desempeña en la transferencia energética del sistema a través de sus relaciones tróficas, y sus perspectivas como recurso pesquero potencial; es preciso recomendar que la especie sea objeto de estudio en sus aspectos biológicos y dinámica de sus poblaciones para el conocimiento adecuado de su posible aprovechamiento. Ophistonema oglinum (Le Sueur, 1817). N.v. "Sardina", "Herring"Distribución Esta especie se distribuye desde el Golfo de Maine, Massachussetts, Carolina del Norte, las Bermudas, las Antillas y todo el Golfo de México hasta el sur del Brasil (Randall, 1968; Hoese y Moore, 1977; Fischer, 1978; Sánchez-Gilet al., 1981; Yánez-Arancibiaet al., 1984, 1985e, 1986), Biología y Ecología Fue colectado un total de 813 ejemplares de esta especie, con una frecuencia de aparición de 43% en el total de las estaciones de los seis cruceros muestreados. En cruceros individuales la frecuencia más alta fue en el mes de junio (11%) y la más baja en noviembre (2.5%), durante las épocas de lluvias y nortes respectivamente (Tabla 21). Fue igualmente abundante en fondos fangosos como en arenosos (Zona Ay B),generalmente entre 13 y 36 m de profundidad (Fig. 48, Tabla 51). Constituyó el 1.5% de la captura total en peso, siendo más abundante en agosto (28.6%); los valores más bajos de abundancia se presentaron en julio (3,9%). Espacialmente se observó que durante las épocas de lluvias y secas, la biomasa más alta estuvo asociada a las áreas someras y de mayor influencia estuarina en laZona A entre 10 y 30 m. Durante la época de nortes fue más abundante en la Zona B (Fig. 48, Tabla 21). Representó el 1.5% de la captura total en número de individuos. En cruceros individuales la abundancia más alta se presentó en agosto (43.0%) durante la época de lluvias y los valores más bajos en noviembre (1%) durante la época de nortes (Tablas 21 y 51). Los ejemplares colectados se distribuyeron en un rango de tallas de 76 a 205 mm (LT), encontrándose individuos de la talla máxima, al menos en un mes de cada una de las épocas climáticas muestreadas. Los individuos más pequeños se capturaron sólo al inicio de las épocas de lluvias y nortes (Fig. 48). Durante las diferentes épocas climáticas se encontró un predominio de hembras en la relación hembra : macho de 2:1. 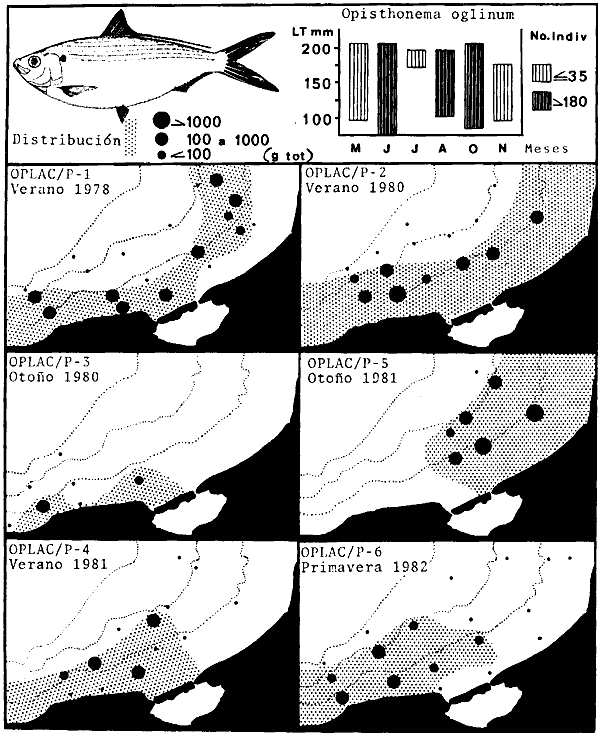 Fig. 48. Patrón de distribución espacial y temporal de Opisthonema oglinum en la Sonda de Campeche. Se muestra la abundancia de biomasa, densidad y distribución de tallas de la especie en los seis cruceros muestreados. 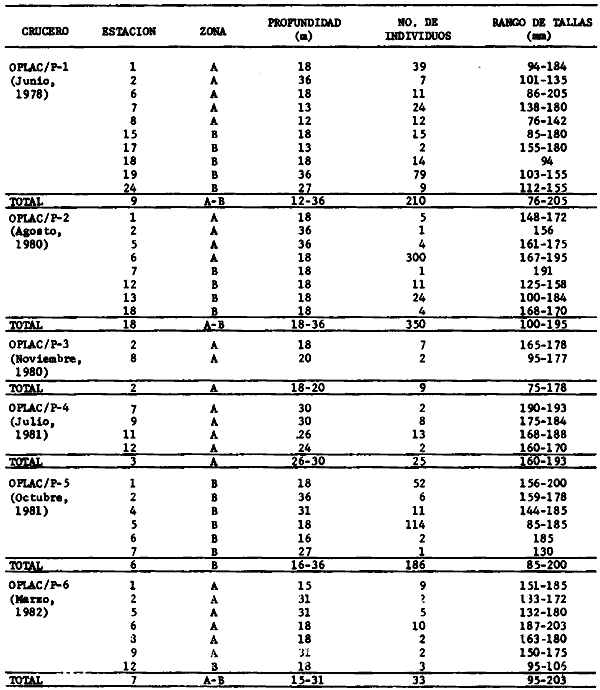 TABLA 51. DISTRIBUCIÓN, ABUNDANCIA NUMÉRICA Y RANGO DE TALLAS DE OPISTHONEMA OGLINUM EN LAS POBLACIONES DOMINANTES DE LA SONDA DE CAMPECHE Esta especie presenta hábitos pelágico-costeros; sin embargo, se encuentra muy relacionada a las especies típicas demersales. Es un consumidor de 1er orden (planctófago) cuyo alimento principal lo constituyen: ostrácodos, copépodos, poliquetos, larvas de crustáceos, de peces y de moluscos. Se le considera una especie con dependencia estuarina. Otras Especies Afines en el Área de Estudio Harengula jaguana Goode y Bean; Sardinella aurita Cuvier y Valenciennes, Observaciones, Antecedentes y Perspectivas De acuerdo a distintos autores esta especie es muy común en el Golfo de México. Springer y Bullis (1956), la reportan en florida ocupando áreas muy cercanas a la línea de costa, asociada a aguas de alta salinidad, Esto también ha sido observado en las costas de Louisiana y Texas donde sus variaciones estacionales han sido bien determinadas por Darnell et al.(1983). En dichas áreas Hoese y Moore (1977) consideran que es una pesquería potencial no explotada ya que alcanza hasta 250 mm (LT); sin embargo, en las costas de Florida se considera de poco valor comercial por alcanzar sólo hasta 125 mm y ser menor abundante, ya que generalmente tiende a habitar aguas más cálidas (Allyn, 1969). Fischer (1978) la reporta en toda el área del Atlántico Centro Occidental, especialmente en el norte del Golfo de México y frente a las costas de Venezuela; también se conoce como muy común en las aguas atlánticas de Costa Rica (Perry y Perry, 1974), en todas estas áreas se ha colectado con una talla entre 200 y 250 mm. En las costas de Cuba se considera a esta especie de gran importancia comercial, ya que alcanza hasta 300 mm (Guitart, 1974). Datos de la FAO reportan una captura de 5714 toneladas en el año de 1975, obtenidas entre Venezuela, Colombia, República Dominicana y la URSS, donde se consume en fresco y se comercia con ella en salado o congelada; sin embargo, tiene mayor importancia en la industria de harinas de pescado (Fischer, 1978). En Colombia, se usa generalmente seco, salado o enlatado, considerándosele de gran importancia económica (Dahl, 1971). A pesar de su gran importancia en aguas marinas, se le ha colectado en áreas de salinidades menores a 30‰ en Texas y Mississippi (Gunter, 1945; Franks et al., 1972) y es común encontrarla frente a la desembocadura de ríos y zonas estuarinas (Turner y Johnson, 1973). Al sur del Golfo de México en la Laguna de Términos, esta especie se considera un visitante cíclico del sistema, donde se presenta en diversos ambientes, desde típicamente marinos hasta salobres (Yánez-Arancibia et al., 1980, 1985b). Opisthonema oglinum es una especie muy común en las comunidades de peces de la Sonda de Campeche. Sus variaciones estacionales de distribución y abundancia no son muy marcadas, presentándose durante todo el año. Por su abundancia tanto en peso como en número de individuos, su amplia distribución y frecuencia se considera que esta especie es típica y ecológicamente dominante en estas comunidades. A pesar de su hábitos pelágicos, es muy frecuente en las capturas de camarones penéidos. En México esta especie representa un recurso pesquero real explotado regionalmente; sin embargo, no se tienen en el país estadísticas pesqueras específicas, su consumo es en fresco y también es enlatado, su importancia radica además en la fabricación de subproductos. Por el análisis ecológico de esta especie, sus características de especie dominante en la estructura de las comunidades de peces demersales, el papel ecológico que desempeña en la transferencia energética del sistema a través de sus relaciones tróficas y sus perspectivas como recurso pesquero explotado, es preciso recomendar que la especie sea objeto de estudio en sus aspectos biológicos y dinámica de sus poblaciones, para el conocimiento adecuado de su aprovechamiento. Haemulon aurolineatum (Cuvier y Valenciennes, 1830). N.v. "Ronco", "White grunt"Distribución Esta especie se distribuye desde Cabo Cod, Chesapeake Bay, las Bermudas, todo el Golfo de México hasta el Brasil (Randall, 1968; Beebe y Tee Van, 1970; Fischer, 1978; Yánez-Arancibia et al., 1980; Sánchez-Gilet al., 1981; Yánez-Arancibia et al., 1984, 1985e, 1986). Biología y Ecología Fue colectado un total de 548 ejemplares de esta especie, con una frecuencia de aparición de 27% en el total de las estaciones de los seis cruceros muestreados. En cruceros individuales la frecuencia más alta fue en el mes de marzo (11%) y la más baja en julio (1%), durante las épocas de secas y lluvias respectivamente (Tabla 21). Se presentó ocupando tanto las zonas fangosas como arenosas del área de estudio(Zona Ay B,) generalmente entre 11 y 54 m de profundidad (Fig. 49, Tabla 52). La distribución temporal de esta especie presentó variaciones marcadas, siendo muy poco frecuente durante la época de lluvias; sin embargo, se colectó durante todas las épocas climáticas muestreadas. Constituyó el 1.4% de la captura total en peso. En cruceros individuales la mayor abundancia la presentó en marzo (73.7%) y la menor en julio (0.04%), durante las épocas de secas y lluvias respectivamente. Espacialmente se observó que los valores más altos de biomasa se presentaron en las áreas más cercanas a la línea de costa en profundidades menores a 20 m, tendiendo a la Zona B de fondos arenosos y características predominantemente marinas, excepto durante la época de nortes (Fig. 49). Esta especie no fue muy abundante numéricamente, representó el 1.1 % en número de individuos de la captura total. En cruceros individuales la abundancia más alta la presentó en marzo (61.0%) y la más baja en julio (0.3%), durante las épocas de secas y lluvias respectivamente (Tablas 21 y 52). Los ejemplares colectados se distribuyeron en un rango de tallas de 80 a 242 mm (LT), observándose que los ejemplares mayores de 200 mm sólo se colectaron durante la época de secas y se colectaron individuos pequeños durante todas las épocas climáticas muestreadas (Fig. 49). Esta especie es de hábitos costeros, con capacidades eurihalinas, la cual ocupa aguas someras salobres, y tiende a introducirse en áreas protegidas como sistemas lagunares y estuarios donde realiza parte de su cielo de vida. Es un consumidor de 2º orden, su alimentación es muy variada e incluye principalmente pequeños crustáceos, moluscos, poliquetos, algas y detritus, entre otros. Otras Especies Afines en el Área de Estudio Haemulon plumieri(Lacépède);Haemulon boshmae Metzalaar;Orthopristis chrysopterus (Linnaeus). Observaciones, Antecedentes y Perspectivas Se le conoce como una especie común de ambientes de fondos rocosos y/o arenosos asociados a zonas de arrecifes de coral, se le ha reportado en diversas áreas del norte del Golfo de México (Springer y Woodburn, 1960; Beebe y Tee Van, 1970; Walls, 1975) y Mar Caribe (Cervigón, 1966; Fischer, 1978). Estos autores han observado que es una especie que se reproduce todo el año, encontrándose desde juveniles hasta adultos maduros durante las diferentes épocas climáticas. Darnell et al.(1983), encontraron que en el área de Louisiana y Texas, la época de mayor abundancia de esta especie es en invierno, predominando en las zonas centrales de la plataforma entre 20 y 80 m de profundidad. Fischer (1978), menciona que en la región del Atlántico Centro Occidental es muy abundante localmente, en áreas como Tortugas, Golfo de México y Venezuela donde alcanza hasta 250 mm (LT); sin embargo, no existen estadísticas específicas en datos de la FAO al respecto de su pesquería. En el sur del Golfo de México en el área de la Laguna de Términos y Sonda de Campeche, se considera que es uno de los pomadásidos más abundantes de las comunidades de peces, se le considera un visitante cíclico de la laguna, el cual ocupa las áreas de mayor influencia marina, de aguas claras y vegetación sumergida (Yánez-Arancibia et al., 1980, 1985b, 1985d; Díaz-Ruiz et al.,1982). Haemulon aurolineatum es una especie común en las comunidades de peces demersales de la Sonda de Campeche. Sus variaciones de distribución y abundancia son marcadas durante la época de lluvias presentando una disminución considerable en el área de estudio; sin embargo, por su alta abundancia tanto en peso como en número de individuos, su amplia distribución y frecuencia en la época de secas, se le considera como una especie típica y dominante de estas comunidades a pesar de sus hábitos Pelágicos. Esta especie es apreciada como alimento y en México se explota regionalmente; sin embargo, no se tienen estadísticas de sus pesquerías en específico y no se conoce cuál es su rendimiento como recurso pesquero.  Fig. 49. Patrón de distribución espacial y temporal de Haemulon aurolineatum en la Sonda de Campeche. Se muestra la abundancia de biomasa, densidad y distribución de tallas de la especie en los seis cruceros muestreados. 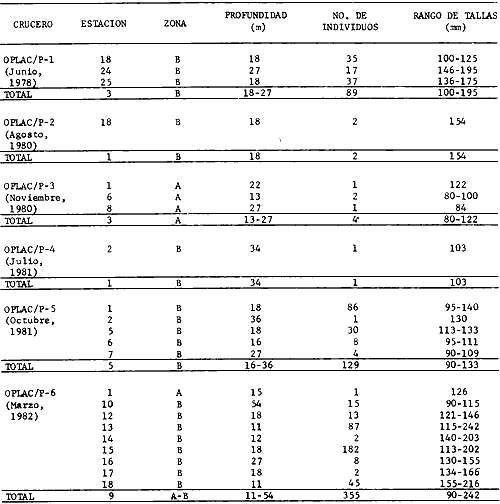 TABLA 52. DISTRIBUCIÓN, ABUNDANCIA NUMÉRICA Y RANGO DE TALLAS DE HAEMULON AUROLINEATUM EN LAS POBLACIONES DOMINANTES DE LA SONDA DE CAMPACHE Por el análisis ecológico de esta especie, sus características de especie dominante en la estructura de las comunidades demersales, el papel ecológico funcional que desempeña en la transferencia energética del sistema a través de sus relaciones tróficas, y sus perspectivas como recurso pesquero explotado; es preciso recomendar que la especie sea objeto de estudio en sus aspectos biológicos y dinámica de sus poblaciones, para el conocimiento adecuado de su aprovechamiento. Dinámica de la comunidades, evaluación ecológica y potencialidad de los recursos
Dinámica de los recursos de comunidades de alta diversidadLa información de la dinámica de las comunidades de peces demersales en áreas tropicales y subtropicales es limitada. El problema es difícil de abordar por situarse en un contexto de comunidades de alta diversidad, donde las interacciones ecológicas de sus poblaciones son muy complejas. La investigación pesquera en las costas tropicales y subtropicales presenta aspectos contrastantes con lo que sucede en las zonas frías y templadas (Pope y Knights, 1982; Mercer, 1982), por ejemplo: 1) el gran numero de especies presentes en la comunidad, 2) la paradójica dominancia de algunas especies y su definición de concepto, 3) las dificultades en la determinación de la edad y tasas de crecimiento en los peces de ciclos de vida cortos, 4) la carencia evidente sobre la ecología trofodinámica de las especies, desde el punto de vista de interacciones tróficas, transferencia y eficiencia energética (Jones, 1982; Yánez-Arancibia, 1984 y et al.1985d). En los sistemas marinos tropicales, los peces crecen rápidamente madurando, la mayoría de ellos en menos de un año. El crecimiento de las especies se mantiene durante largos periodos y los peces juveniles forman un recurso disponible -por reclutamiento- durante todo el año. Otras especies presentan dependencia estuarina y permanecen la mayor parte de su ciclo de vida en la plataforma continental interna, incrementando el rendimiento pesquero de estas áreas (Yánez-Arancibia et al., 1980). Estas poblaciones de peces se sostienen entre otros factores, por la alta disponibilidad de alimento de la zona costera, resultado del intercambio ecológico con bahías, estuarios y lagunas que bordean la línea de costa, manteniendo la producción y alta diversidad de la plataforma marina adyacente. El avance científico en la evaluación de estos recursos aún es lento. El diseño de modelos sobre pesquerías demersales tropicales, actualmente carece de información generalizada que Permita profundizar en el problema de evaluación con buenas bases metodológicas, como lo han señalado Pauly (1980), Saila y Roedel (1980), Pauly y Mines (1982), Pauly y Murphy (1982). Yánez-Arancibia (1984)comenta que ningún enfoque provee un modelo adecuado de la dinámica de las comunidades demersales tropicales de pesca acompañantes del camarón, y que aún disponiendo de una gran cantidad de parámetros poblacionales bien estimados, los modelos predictivos se dificultan si no se dispone de una Profunda base ecológica. En ecosistemas tropicales, los recursos pesqueros requieren de una estrategia distinta de investigación e interpretación (Pauly 1979; Doubleday y Rivard, 1981; Yánez-Arancibia et al., 1985c) Las bases ecológicas que deben considerarse prioritarias para fundamentar las evaluaciones de los recursos, la dinámica de sus poblaciones y su explotación y manejo se concentran en el conocimiento de: 1) la diversidad delas especies de las comunidades de alta diversidad, 2) la distribución de los recursos Y sus patrones ecológicos de variación espacial y temporal, 3) la abundancia numérica y en peso del recurso y sus cambios ante la variabilidad ecológica del sistema, para precisar la estabilidad y persistencia de las especies explotables, 4) las interacciones peceshábitat para cuantificar la dependencia del recurso por las variables físicas del ecosistema (Yánez-Arancibia, 1984). El análisis del ecosistema y su dinámica (Yánez-Arancibia y Day, 1982; Yáñez-Arancibia y Sánchez-Gil, 1983, Yánez-Arancibia et al., 1983b) y las correlaciones peces-hábitat en el estudio de la estructura de las comunidades en base a su diversidad, distribución espacial y temporal, frecuencia de aparición, número de individuos y peso de las distintas especies colectadas y asociaciones faunísticas, permite establecer las áreas de mayor diversidad y productividad pesquera potencial. Yánez-Arancibia et al.(1985c) discuten que estas pesquerías son la consecuencia de interacciones ecológicas en la zona costera y su disminución, aumento o estabilidad, es el reflejo de la variabilidad natural de los procesos físicos y biológicos en los litorales. Los cambios dentro de las comunidades multiespecíficas generalmente son difíciles de predecir y aún más difícil de controlar, pero aún así es posible diseñar modelos numéricos descriptivos y predictivos con relativa validez y buena aproximación cuantitativa (Yánez-Arancibia 1986 y et al., 1985c). Estos autores han establecido que las variables físicas más evidentes que actúan como mecanismos de producción por su dinámica ecológica son: 1) las condiciones físico-químicas del agua, i.e., transparencia, nutrientes, salinidad, temperatura, 2) latitud geográfica, 3) batimetría y tipo de sedimentos, 4) meteorología y clima, 5) descarga de los ríos, 6) rango de marcas, 7) áreas de vegetación costera i.e., pantanos, lagunas y estuarios adyacentes y, 8) la dinámica de interacción entre los estuarios y el mar. Desde el punto de vista de ecología del sistema y sus comunidades de peces se observa que, interpretando ecológicamente la dinámica ambiental se encuentran las respuestas y explicaciones a los patrones de comportamiento de las poblaciones de especies en comunidades de alta diversidad, a los mecanismos de su productividad, y a las relaciones de interacción física y biológica propias de la zona costera. En el campo del manejo de los recursos marinos renovables, la literatura reciente ha hecho énfasis en el concepto de pesquerías multiespecíficas (FAO, 1978; Pauly, 1980; Mercer, 1982), lo que puede ser aplicado al panorama pesquero en el sur del Golfo de México (ver último Capítulo de Resultados). Este concepto se refiere a la estimación de las pesquerías basada en un agrupamiento funcional de especies -por ejemplo, distribución de especies y su abundancia-, y no en divisiones arbitrarias sin bases científicas -por ejemplo, jurisdicción política de los estados ribereños- (Doubleday y Rivard, 1981; Dikie y Kerr, 1982; Sheldon et al., 1982; Silvert y Dikie, 1982; Yánez-Arancibia et al.,1986). El manejo de las pesquerías costeras multiespecíficas se dificulta principalmente al querer extrapolar el conocimiento y modelos clásicos usados en las pesquerías monoespecíficas de latitudes frías y/o templadas. Las comunidades de alta diversidad son ecológicamente frágiles a las actividades de pesca por periodos prolongados. Se ha observado que es difícil regresar a la composición original de las especies aún con una subsecuente reducción en el esfuerzo de pesca, Una caracterización operacional para propósitos de manejo para estas comunidades, debe estar dado por una unidad de producción compuesta por un grupo de peces residentes y de hábitos tróficos relacionados. Para diseñar modelos de producción en una pesquería de alta diversidad es necesario conocer el gran número de especies presentes en el área, y tomar en cuenta la interacción entre las poblaciones de peces, así como sus patrones temporales y geográficos para lo cual es fundamental conocer los procesos ecológicos costeros que son los mecanismos naturales de control de la producción. Desde un punto de vista esencialmente ecológico, las comunidades de peces asociadas al fondo se incorporan al concepto de comunidades de alta diversidad implicando por sí mismas la necesidad de cambios en el desarrollo científico y tecnologías de su manejo como recurso. Un marco de referencia de los recursos de peces acompañantes del camarón en el sur del Golfo de MéxicoLas estimaciones de la FAO para el año 2000 indican que el hombre requerirá de 1.0 x 108 ton/año de recursos pesqueros para su consumo; esto es, el doble de la demanda de la década de los setentas. Una alternativa viable son los peces demersales que se capturan eventualmente como fauna de acompañamiento en las pesquerías de camarón y que en ínfima parte se usa actualmente para alimento animal y en su inmensa mayoría se arroja de vuelta al mar. Se calcula que en términos generales de estas capturas incidentales se descartan entre 3 y 5 x 106 ton/año, lo que representa el mayor y más diverso recurso potencial que el mar ofrece para fines del siglo XX. Los cálculos globales actuales de la fauna acompañante del camarón, varían entre 5 y 16 x 106 ton/año con una proporción promedio de peces/camarón = 5:1 en la plataforma marina templada o subtropical, y un promedio peces/camarón = 10:1 en las costas tropicales, donde la pesca de escama no sólo es mayor a la de camarón sino que es mucho más variada en número de especies. La utilización de esta pesca incidental es una actividad en desarrollo en diferentes regiones del mundo como se aprecia en los trabajos de Sánchez-Gil et al., (1981), Pauly y Murphy (1982), FAO CIID-IDRC (1983), Pérez Mellado et al. (1983), Penchaszadeh et al. (1984), Darnell et al. (1983). La zona geográfica de mayor actividad es el Golfo de México, el Atlántico Occidental tropical y algunos países de América Latina como México, Guyana, Colombia y Venezuela entre otros. En Africa Occidental, el Océano Indico, el Mar del Sur de China y el Indo Pacífico en el Sudeste Asiático, se estudian actualmente estos recursos desde su evaluación ecológica hasta su explotación y procesamiento. En el sur del Golfo de México, la principal pesquería y mejor establecida es la de camarón y en segundo término están las pesquerías de peces de grupos específicos como son: corvinas, meros, pargos, guachinangos, robalos, sardinas, entre otros, cuyo valor comercial es muy alto. Sin embargo, sólo hasta esta década se empieza a conocer la gran variedad de especies de peces que no son explotadas actualmente y cuya riqueza potencial requiere de estudios especiales sobre su ecología, cuantificación de su potencial real y perspectivas de manejo como recurso (Yánez-Arancibia, 1984 y Yánez-Arancibiaet al. (1986). Como avance significativo de estos estudios en la región de la Sonda de Campeche entre 1978 y 1985, se han obtenido resultados preliminares en las investigaciones de los recursos de peces demersales en las costas mexicanas del Golfo de México permitiendo presentar el siguiente panorama. La figura 50, resume el análisis comparativo de estos datos observándose la gran predominancia de la abundancia de los peces sobre cualquier otro grupo de recursos alimenticios. De acuerdo a la época del año, la relación proporcional peces/ camarón varió entre 8:1 en la época de lluvias y 57:4 en la época de secas con un promedio de 23:1. Las estadísticas de estos datos experimentales establecen en términos de abundancia una relación proporcional peces/ camarón = 12:1 en promedio. Las estadísticas de la FAO y de la Secretaría de Pesca de México (Tabla 53) reportan una captura media anual de camarón de 22 962 toneladas métricas en el Golfo de México para los años de 1956 a 1981. Sobre la base de estas capturas y de acuerdo a los métodos indicados en Stevenson (1982), FAO-CIID-IDRC (1983) y Pellegrin (1983), se puede estimar que un mínimo de 275 000 toneladas de peces demersales se han capturado anualmente en los últimos 24 años, sin que hayan sido aprovechadas cabalmente en el sur del Golfo de México. Cabe mencionar que de estas capturas, más del 50% fueron aportadas por los estados de Tabasco y Campeche, dos de los puertos más importantes de la región. De la misma manera se puede establecer que en los últimos cinco años (entre 1972 y 1981) se capturaron 128 734 toneladas de camarón (Tabla 53), lo que permite estimar una captura de 1 544 808 toneladas de peces demersales, los cuales no fueron aprovechados integralmente en el país aún cuando representan un recurso pesquero potencial real. La pesquería de camarón en la Sonda de Campeche (Tabla 53) es una actividad continua desde la década de los 40s. La FAO señala que la captura por unidad de esfuerzo (CPUE) de los Estados Unidos sobrepasa casi el doble de la CPUE de México entre los años 1956 y 1974, promediando una captura de 22 962 ton/ año, La especie predominante en estas capturas es el camarón rosado(Penaeus duorarum) pero también se captura el camarón blanco (P. setiferus) y el café(P. aztecus). Los modelos experimentales de producción han estimado una captura máxima sostenible (CMS) de 22 900 ton/ año, sugiriendo que las capturas actuales están a nivel o ligeramente por debajo de la captura máxima (CPM), lo que debe ser tomado con precaución ya que la CPUE puede estar estimada sobre la base de pequeñas variaciones o errores de muestreo (Stevenson, 1982). Klima (1976) y Stevenson (1982) han destacado en términos muy generales que entre 1972 y 1974 Estados Unidos desechó entre 0.6 y 1.0 millones de toneladas de peces demersales en el norte del Golfo de México como resultado de las proporciones de peces/ camarón = 7.0 a 8.3:1 Stevenson estimó estos desechos entre 1.0 y 1.5 millones de toneladas y se asume que de todas las capturas de peces acompañantes del camarón, sólo se utiliza como alimento el 10% y el resto es devuelto al mar. Klima revisó y estandarizó los datos de encuestas de arrastre para el Golfo de México en las costas de Estados Unidos y estimó una biomasa total de 2.7 ( ± 0.8) millones de toneladas en profundidades menores a 110 m. Las capturas habituales están alrededor de 700 a 1.10 millones de toneladas estimando una captura potencial máxima de 1.03 a 1.23 millones de toneladas, por lo cual Estados Unidos puede soportar un incremento en sus capturas de aproximadamente 500 000 ton/ año. 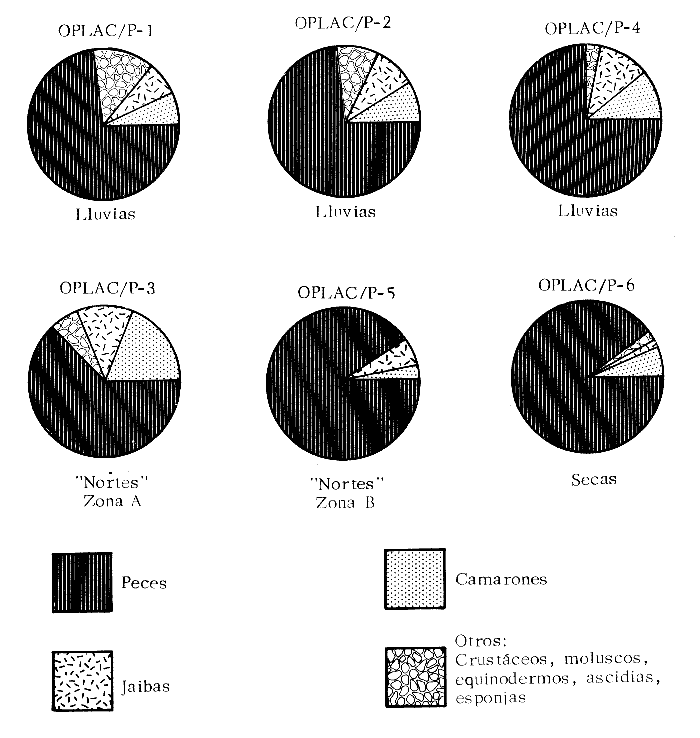 Fig. 50. Se presenta la relación porcentual de los diferentes grupos macrofaunísticos representados en cada uno de los cruceros realizados, y su variación en las tres épocas climáticas marcadas en el área de estudio. Se señala la predominancia de los peces sobre cualquier otro grupo presedente durante toda la épocas muestreadas. 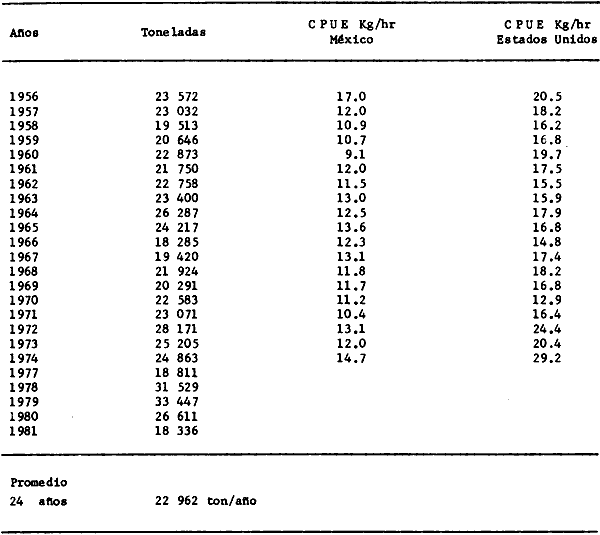 TABLA 53 CAPTURA TORAL DE CAMARONES EN LAS PEQUERÍAS DEL SUR DEL GOLFO DE MÉXICO-SONDA DE CAMPECHE Existen estadísticas pesqueras de la Sonda de Campeche realizadas por Estados Unidos para los años 1958-1959, y por Cuba entre 1964 y 1972, y 1974-1975. Sin embargo, estos datos son muy variables debido a que: 1) la pesca estuvo dirigida exclusivamente hacia estoc de pargos durante las encuestas de 1958-1959 de los Estados Unidos y hacia los estoc de peces demersales en general por los cubanos, y 2) los tipos de arrastre utilizados y la captura fueron evaluados de forma muy diferente por los distintos investigadores. De los peces de fondo de la Sonda de Campeche, tradicionalmente han representado mayor interés los pargos y chernas. Aún cuando son comunes en los arrastres camaroneros, su hábitat preferente son los fondos irregulares y zonas de arrecifes. Las estimaciones de biomasa y captura potencial de estas especies se refieren a Klima (1976) y Stevenson (1982), Klima reportó estimaciones de biomasa de 250 000 a 2 millones de ton/ año para todas las especies demersales en los bancos pero usando dos coeficientes de capturabilidad diferentes. Así las estimaciones más conservadoras de biomasa de pargos/ chernas de Estados Unidos son de 136 000 toneladas, pero las encuestas cubanas pronostican una biomasa máxima de pargos/ chernas de 300 000 ton/ año. Buques de arrastre cubanos y soviéticos capturaron en la Sonda de Campeche un promedio de 20 000 ton/ año de peces demersales entre 1966 y 1974 y un récord de 70 000 ton/ año en 1972 y 1975, predominando roncos (Pomadasyidae), meros (Serranidae) pargos y guachinangos (Lutjanidae). Sauskan y Olachea (1974) estimaron una biomasa total de 807 000 ton/ año en una primera estadística, y en dos análisis de una segunda encuesta dan estimaciones de peces demersales promedio de 608 000 y 1.5 millones de ton/ año dependiendo del coeficiente de capturabilidad usado; con una estimación de biomasa total del estoc de peces demersales para todas las estadísticas de 800 000 ton/ año (Klima, 1976; Stevenson, 1982). Siguiendo el razonamiento de Klima (1976 y 1977) y utilizando los datos de abundancia de las comunidades demersales de la Sonda de Campeche en el presente trabajo, se calcula para esta región una biomasa promedio para el total de peces demersales de 847 720 ton/ año, en profundidades menores a 80 m; calculándose una captura potencial máxima de 169 544 ton/ año utilizando el coeficiente de capturabilidad (q) y el valor de mortalidad total, empleados por Stevenson (1982), estos datos resultan ser muy cercanos a lo calculado por Sauskan y Olachea (1974). Por otro lado, los cálculos de biomasa promedio para los grupos de especies de mayor importancia comercial (Tabla 54), permiten estimar una biomasa promedio de 139 591 ton/ año. Estos resultados establecen que más del 16% de la biomasa de peces demersales estimada, corresponde a especies que representan un recurso pesquero actual en el país. Este aspecto sólo cubre un pequeño renglón dentro del enfoque global de los estudios de este trabajo, y por tanto se considera que sólo es un patrón de referencia que abre posibilidades a estudios futuros, ya que se trata de una estimación basada en datos experimentales donde la CPUE no es comparable con la de capturas comerciales, las cuales probablemente son mucho mayores. Otro aspecto importante del análisis de los datos se muestra en la Tabla 55, la cual indica que los valores estimados de la captura por unidad de esfuerzo total promedio (CPUE) en el área de estudio fue de 47.98 Kg/h, observándose variaciones en las distintas épocas climáticas muestreadas en un rango de 14.32 a 69.20 Kg/h. La menor eficiencia de captura fue durante la época de nortes, y la mayor durante la época de lluvias. Distintos autores han observado que la abundancia de biomasa de peces demersales, está en íntima relación con las características batimétricas (Moore et al., 1970; Sauskan y Olachea, 1974; Chittenden y McEachran, 1976; Klima, 1976; Sánchez-Gil et al.,1981; Darnell et al., 1983; entre otros), Así, Furnell (1983) menciona que la CPUE de los peces demersales de las costas de Guyana, disminuye a medida que aumenta la profundidad de las aguas, encontrando la mayor densidad dentro de las primeras 10 brazas (20 m); en contraste, la abundancia de camarón es más baja en las comunidades cercanas a la costa, constituyendo el 5% de la captura total en un arrastre promedio. 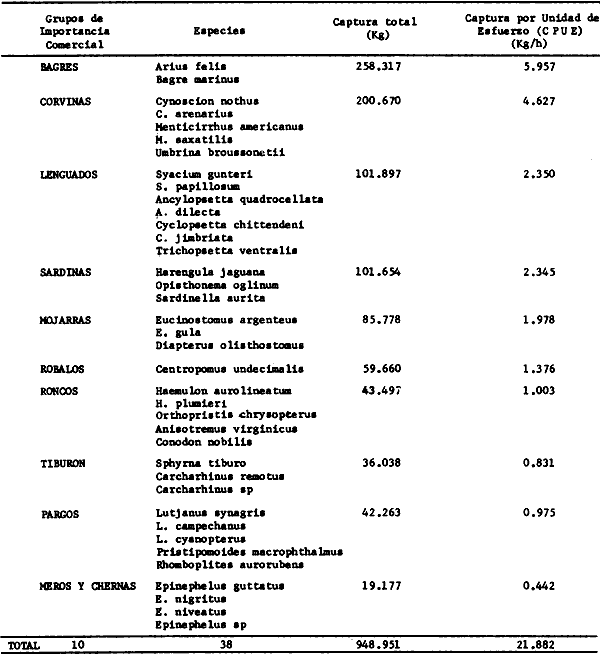 TABLA 54. ABUNDANCIA RELATIVA Y CAPTURA POR UNIDAD DE ESFUERZO (C P U E) DE LOS PRINCIPALES GRUPOS DE PECES DE IMPORTANCIA COMERCIAL EN CAPTURAS EXPERIMENTALES ( ESPECIES SELECTAS) 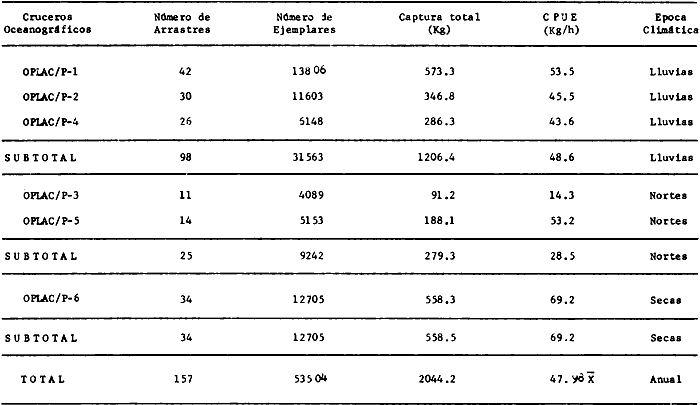 TABLA 55. ABUNDANCIA NUMÉRICA, ABUNDANCIA EN PESO Y CAPTURA POR UNIDAD DE ESFUERZO (C P U E) DE LAS CAPTURAS TOTALES DE LOS PECES DEMERSALES DE LA SONDA DE CAMPECHE La implementación de análisis por estratos batimétricos para la evaluación de recursos pesqueros demersales, ayuda a determinar las áreas, de distribución y concentración de biomasa espacial y temporalmente. Este método se ha implementado en diversas áreas de la plataforma continental de] Golfo de México, Mar Caribe y Sudamérica (Ehrhardt et al., 1977 y 1982; Otero et al., 1982; Alexanderet al.,1981; Furnell, 1983; Yánez-Araricibiaet al., 1983a, 1986; Darnell et al.,1983). La Tabla 56, indica los volúmenes de captura en número de individuos y peso, y su distribución por estratos en el área de estos estudios. La CPUE señala para el estrato de menos de 20 m de profundidad, un amplio rango de variación de acuerdo a la época del año, con un promedio anual de 51.5 Kg/h. A su vez para profundidades mayores de 20 m también es característica la variación anual con un promedio de 55.8 Kg/h. No se aprecian diferencias significativas de CPUE anual entre los estratos batimétricos, pero debe destacarse que la composición de especies y su talla promedio en cada estrato es marcadamente diferente. El análisis por estrato de la CPUE de grupos específicos compuestos por especies de importancia comercial como son bagres, corvinas, sardinas, mojarras; mostró que en general existe un mayor rendimiento en las aguas más someras (menores a 20 m), aún cuando existen pequeñas variaciones en la distribución de las especies en cada estrato batimétrico (Fig. 51). En la figura 51, se observa la predominancia de estos cuatro grupos en el estrato de menos de 20 m, destacándose la mayor abundancia de bagres y corvinas influenciado por la talla promedio de las especies la cual fluctúa entre 94-550 mm los primeros y 33-330 mm los segundos. En cuanto al grupo de sardinas y mojarras, la predominancia en el estrato de menos de 20 m es menos evidente, debido quizá a la talla promedio de las especies la cual es más homogénea y fluctúa entre 76-212 mm en los primeros y 42-166 mm en los segundos. Cabe mencionar que las especies que constituyen estos grupos específicos, representaron un alto porcentaje de la captura total de todos los muestreos de este estudio. Estas especies han sido determinadas como dominantes ecológicas en estas comunidades y en su totalidad son especies dependientes estuarinas. La alta productividad de las zonas de la plata forma continental interna, ha sido frecuentemente observado por diversos autores como: Templeman y Fleming (1953), Mooreet al., (1970), Sutcliffe (1972 y 1973), Copelandet al. (1974), Turner (1977), Stone et al. (1978), Yánez-Arancibia et al. (1980), Sánchez-Gil et al. (1981).Todos ellos destacan la importancia de distintos procesos costeros (como son las condiciones hidrológicas, influencia de la descarga de ríos y sistemas lagunares estuarinos adyacentes, latitud y clima, entre otros) en la determinación de la composición y productividad pesquera de especies de crustáceos y peces de importancia comercial, en la plataforma continental adyacente, Yánez-Arancibla et al. (1985c) han desarrollado una interesante hipótesis, en la que se establecen los principales procesos ecológico-costeros que presentan correlación con la productividad de los recursos pesqueros en la región del sur del Golfo de México, denominándolos como mecanismos de producción, esto es, variables físicas de interacción ecológica que controlan la distribución, la abundancia y la persistencia de los recursos. Perspectivas de los recursos de peces demersales de la Sonda de Campeche y la integración a un modelo para el Golfo de MéxicoLa potencialidad mínima de los peces demersales acompañantes del camarón en el Golfo de México que se señala en la figura 52 es de 980 136 ton/ año lo que corresponde casi exactamente con las 800 000 ton/ año que estiman Klima (1976) y Stevenson (1982). Solamente las costas mexicanas del Golfo (zonas 5, 6 y 7) tienen una potencialidad mínima de 336 333 ton/ año de peces acompañantes del camarón que aún no son utilizados en el país. Pero por el análisis de las referencias discutidas y de las estimaciones basadas en los datos de este estudio, la potencialidad de los recursos demersales puede ser mucho mayor. 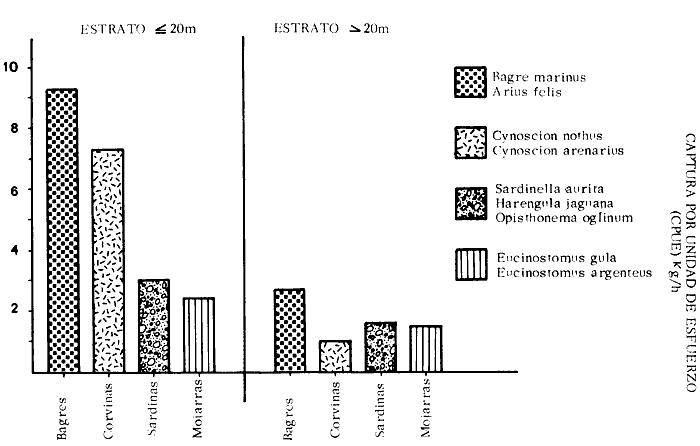 Fig. 51. Se presenta la captura por unidad de esfuerzo (CPUE), de los principales grupos de peces que tienen importancia económica actual cuya frecuencia fue muy alta en los arrastres (muestreos) de este estudio. Se compara su abundancia (Kg/h) en los dos estratos batimétricos analizados: A) menores o igualesa 20 m y, B) mayores de 20 m de profundidad 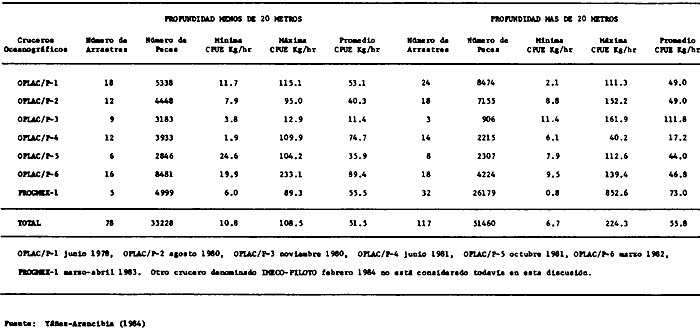 TABLA 56. ABUNDANCIA NUMÉRICA, ABUNDANCIA EN PESO Y CAPTURA POR UNIDAD DE ESFUERZO (C P U E) DE LOS PECES DE MARSALES ACOMPAÑANTES DEL CAMARÓN EN LA PLATAFORMA INTERNA DEL SUR DEL GOLFO DE MÉXICO En el Atlántico Centro Occidental, una estimación conservadora de la FAO para la cantidad de peces demersales desechados por los buques arrastreros de camarón, es de 1 millón de ton/ año basado en las estadísticas proporcionales de peces/ camarón = 3:1 a 20:1. Las principales áreas de pesca están localizadas sobre la plataforma continental del norte del Golfo de México (Estados Unidos), la Sonda de Campeche (México) y la plataforma Nor-Noreste de América del Sur (Colombia y Venezuela). De acuerdo a la FAO las áreas con las mayores potenciales para incrementar la producción de peces demersales son el sur del Golfo de México y algunas áreas localizadas en Colombia y Venezuela. Las consideraciones teóricas que sostienen la potencialidad de la Sonda de Campeche se vieron corroboradas cuando buques de arrastre cubanos capturaron 70 000 toneladas y soviéticos 75,000 toneladas en 1972 y 1975; además que las estadísticas de arrastre en el Golfo de México, en general, indican que incluso Estados Unidos tienen capturas ligeramente inferiores a la captura potencial máxima (Ymax) (Stevenson, 1982). Yánez-Arancibia (1984) comenta que no obstante que los recursos de peces demersales acompañantes del camarón son un recurso pesquero potencial real, la producción incrementada requeriría: 1) investigación científica ecológica pesquera de alto nivel, 2) infraestructuras pesqueras y portuarias adecuadas, 3) una utilización más completa de los desechos de los buques camaroneros existentes, 4) desarrollo tecnológico de procesamiento y elaboración de productos y, 5) desarrollo de una demanda de mercado y comercialización. La figura 52 muestra en un modelo integrativo para el Golfo de México basado en las estimaciones combinadas de Pellegrin (1983) para Estados Unidos y de Yánez-Arancibia (1984) para México, sobre la base de los cruceros científicos y datos experimentales de este estudio. Fueron analizadas las relaciones peces/ camarón por zonas y multiplicados los cálculos de los desembarques anuales de camarón y las zonas respectivas. Para Estados Unidos los cálculos se basaron en estadísticas de 1971 a 1975 y para México de 1977 a 1981. Para Estados Unidos las zonas están divididas con base en las densidades de peces/ camarón y para México en base a definición de hábitat o subsistemas ecológicos, La zona 1 se caracteriza por bajas concentraciones de peces y altas de camarones, la zona 2 por concentraciones altas tanto de peces como de camarones, la zona 3 tiene concentraciones bajas tanto de peces como de camarones y la zona 4 tienen desembarcos mayores que la 3 pero densidades más bajas de peces (Pellegrin, 1983). La zona 5 aún no es objeto de estudio ecológico-pesqueros en México, la zona 6 refleja en gran medida la definición ecológica de un subsistema A influido por procesos estuarinos, sedimentos terrígenos y la zona 7 refleja en gran medida la definición ecológica de un subsistema B influido por procesos marinos y sedimentos calcáreos (Sánchez-Gilet al., 1981; Yánez-Arancibia y Sánchez-Gil, 1983). Particularmente lo que se refiere a investigación científica ecológico-pesquera y la comprensión de los conceptos, principios y métodos que involucran un ecosistema de alta diversidad íctica, se explica resumido en el modelo conceptual de la figura 52, propuesto por Yánez-Arancibia (1984). La figura 52 resume las interacciones tróficas de distintos componentes del ecosistema de la Sonda de Campeche. En términos amplios, puede interpretarse como una pirámide de biomasa donde el comportamiento de pesquerías es el punto clave de obtención de energía por el hombre y los compartimientos basales son críticos en la conservación de los recursos. Estas pesquerías son la consecuencia de interacciones ecológicas en la zona costera y su disminución, aumento o estabilidad es el reflejo de la variabilidad de los procesos físico y biológicos de los hábitats naturales. Los cambios dentro de las comunidades de alta diversidad son difíciles de predecir y aún más difíciles de controlar, pero aún así es posible diseñar modelos númericos descriptivos y predictivos con relativa validez y buena aproximación cuantitativa, En ésta dirección deberán ser encaminados los estudios futuros de la ecología del sistema y sus recursos bióticos en el Sur del Golfo de México. 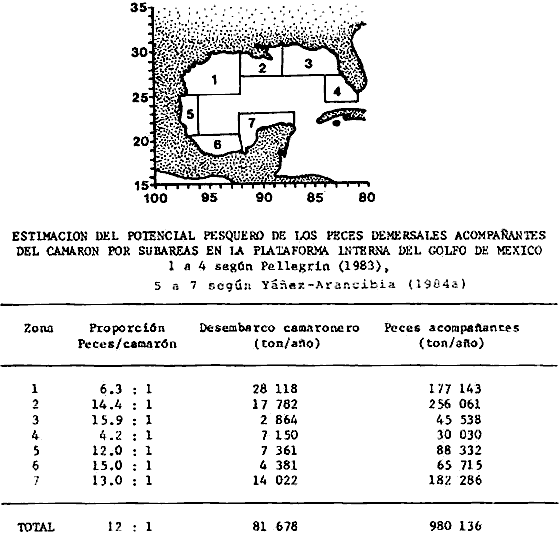 Fig. 52. Modelo que muestra la relación Peces/Camarón y la estimación del volúmen de peces acompañantes en las capturas demarsales de la plataforma continental interna del Golfo de México (Yáñez-Arancibia, 1984a). Aspectos de manejo de los recursos de peces demersales en el sur del Golfo de MéxicoEl hombre es el agente transformador de primera magnitud en la zona costera. La manipulación tecnológica desordenada que efectúa, provoca efectos negativos como el cambio de la magnitud y la dirección de las interacciones en el sistema ecológico. Un ejemplo lo fue el derrame petrolero del Pozo IXTOC-1 en la Sonda de Campeche entre el 3 de junio de 1979 y el 24 de marzo de 1980, como uno de los derrames más espectaculares del mundo ocurridos en el mar. Muy pocos antecedentes existían para eventos similares en áreas tropicales, e incluso sólo en años recientes se ha publicado sobre la ecología de la contaminación por petróleo sobre recursos de peces en mares cálidos (Yánez-Arancibia et al., 1982a; Ramamurthy y Sreenivasan, 1983). Ante la carencia de antecedentes previos hubo sorpresas e incertidumbres ante el impacto ambiental instantáneo, que fue evidente, La Universidad Nacional Autónoma de México, a través del Programa Coordinado de Estudios Ecológicos de la Sonda de Campeche, estableció un marco de referencia adecuado diseñando una estrategia de investigación comparativa -producto de experiencias de años de estudios en la región- Para medir cuantitativamente los efectos esperados de impacto ambiental sobre los peces. Pudo establecerse que por diversos factores ecológicos naturales de la Sonda de Campeche, entre otros: 1) el sistema de circulación de las aguas, 2) la meteorología, 3) el metabolismo de la columna de agua con temperaturas tropicales, 4) los ciclos de vida cortos de los peces en el sur del Golfo de México, 5) los cambios energéticos rápidos del sistema ecológico, 6) las estrategias reproductivas y alimentarias de las poblaciones de peces; no había evidencias de impacto ambiental severo sobre los recursos pesqueros a tres años del derrame petrolero (Yánez-Arancibia et al., 1982b). Esto pudo cuantificarse comparando parámetros ecológicos de las comunidades de peces, como: 1) números de especies, 2) índices de diversidad, 3) índices de biomasa, 4) densidad poblacional, 5) tamaño promedio de las poblaciones para antes y después del derrame petrolero, con datos de 1976 a 1982. Se probó además que la industria petrolera, la industria pesquera y los ecosistemas costeros en el sur del Golfo de México, están en un frágil equilibrio que todavía no se desvía a un impacto ambiental caótico. Yánez-Arancibia (1984 y et al., 1982b, 1985c) discute información para establecer que el ecosisterna es estable, productivo, complejo y frágil, y circunstancialmente reaccionó favorablemente a las perturbaciones instantáneas sobre los recursos pesqueros, con el derrame del Pozo IXTOC-1. Pero no puede asegurarse que volverá a sobreponerse a un manejo tecnológico desordenado en el futuro y reviste gran importancia continuar con investigaciones de monitoreo ecológico de los hábitats y sus recursos vulnerables, especialmente por las perspectivas de la Sonda de Campeche. Las perspectivas de la potencialidad de los recursos de peces demersales acompañantes del camarón en la zona costera, deben ser observados con un profundo criterio ecológico que implique la conciencia racional de administración y manejo de las poblaciones explotables (Yánez-Arancibia, 1984); en especial: 1) mantenimiento de los hábitats pantanosos de los litorales, i.e., lagunas, pantanos, estuarios, 2) protección de hábitats especiales de la plataforma continental, i.e., áreas costeras de crianza, bocas estuarinas, arrecifes, bocas de ríos, 3) mantenimiento de la integridad de las poblaciones locales, de los estoc máximos de captura y los estoc mínimos de las poblaciones para su recuperación óptima, 4) protección litoral de los dragados y el relleno de ecosistemas de aguas protegidas, 5) protección de la vegetación costera,i.e., pastos marinos, pastos pantanosos, manglares, 6) desarrollo de actividades de construcciones portuarias y canales sobre bases científicas con el máximo de cuidado y protección de los ecosistemas costeros, 7) comprensión del efecto ecológico de la pesca de arrastre en los fondos de la plataforma, 8) comprensión de las interacciones biológicas de la actividad de extracción de petróleo con las especies y poblaciones naturales en el ecosisterna marino costero, 9) control del desecho de contaminantes químicos en ríos y cuencas de la zona costera e incluso en la plataforma continental, 10) comprensión de los efectos acumulativos a largo plazo de los contaminantes y actividades relacionadas con el petróleo, 11) necesidad del conocimiento de la caracterización ecológica, el comportamiento ambiental y la dinámica del ecosistema de la plataforma y el control físico de los recursos de peces adaptados a este ecosistema. La mayoría de estos puntos, requieren del desarrollo de una actitud de investigación ecológico-pesquera de alto nivel en el país y de manera continua. Resumen EstadísticoSe colectó un total de 53 504 ejemplares de peces en la Sonda de Campeche a lo largo de seis cruceros realizados entre junio de 1978 y marzo de 1982. 1. Existen no Menos de 270 especies de peces demersales en el área. En este estudio se presenta un análisis especial para 152 especies correspondientes a 102 géneros y 55 familias. 2. Este registro corresponde a una captura total de 2 044 071.5 gramos. 3. El standing-crop promedio del área total es de 0.77 g m-2 (7.7 Kg Ha-1). El comportamiento de estos parámetros considerados de manera individual en cada uno de los subsistemas ecológicos del área (Zonas A yB) presenta el siguiente esquema. 4. Para laZona A: a) Se tiene un registro total de 31829 ejemplares de peces correspondientes a 120 especies. b) Este registro corresponde a una captura total de 1178312.2 gramos. c) El standing-crop promedio de esta zona es de 0.85 g m-2 (8.5 Kg Ha-1). 5. Para la Zona B: a) Se tiene un registro total de 21675 ejemplares de peces correspondientes a 121 especies. b) Este registro corresponde a una captura total de 865759.3 gramos. c) El standing-crop promedio de esta zona es de 0.72 g m-2 (7.2.Kg Ha-1). Los antecedentes 4 y 5 permiten establecer algunos de los siguientes parámetros de las comunidades muestreadas. 6. Para la Zona A: a) Una diversidad (H'n) promedio de 3.2. b) Una biomasa (H'w) promedio de 3.4. c) Un promedio de gramos por individuo de 37.0 7. Para laZona B: a) Una diversidad (Hn) promedio de 3.3, b) Una biomasa (H'W) promedio de 3,4, c) Un promedio de gramos por Individuos de 39.9. Los antecedentes 4a) y 5a) permiten establecer algunos de los aspectos de interacción entre los subsistemas de la Sonda de Campeche. 8. a) De las 120 especies presentes en la Zona A:31 especies son exclusivas de esta área. b) De las 121 especies presentes en laZona B: 32 especies son exclusivas de esta área. d) Un total de 88 especies son comunes a ambas áreas. 9. Del total de las 55 familias que componen a las comunidades de peces de este estudio, 30 (54%) resultaron ser las familias más frecuentes en las capturas. Dentro de éstas últimas el 13 % corresponde a familias típicamente pelágicas (con alta frecuencia en las capturas demersales); 30% fue compuesto por familias demerso-pelágicas y el resto 67%, por familias típicas de fondo. El análisis de frecuencia, distribución y abundancia de las poblaciones, permitió caracterizar a las especies típicas y/o dominantes de la comunidad. 10. Del registro total de 152 especies, 31 (21%) son dominantes por su frecuencia y constituyen el 92% de la captura numérica y el 79% de la captura total en peso. 11. De estas 31 especies, 23 (74%) se consideran dependientes estuarinos y se han reportado en la Laguna de Términos en algún momento de su ciclo de vida. 12. A su vez, de estas 23 especies, 2 (8%) también resultan ser dominantes en la Laguna de Términos, considerándose los mismos parámetros ecológicos. Los antecedentes 11 y 12, permiten establecer algunos de los aspectos de interacción entre la estructura y función de las comunidades de peces de la Sonda de Campeche y de la Laguna de Términos. 13. Del registro total de 152 especies de la fauna ictiológica de la Zonda de Campeche, 75 (50%), se han reportado en el sistema lagunar-estuarino de la Laguna de Términos. 14. En las costas mexicanas del Golfo de México existe una gran predominancia de la abundancia de peces sobre cualquier otro grupo de recursos alimenticios. En relación a la captura de camarón se presenta el siguiente panorama: a) Como resultados preliminares en la evaluación de los recursos de peces demersales, de acuerdo a la época del año la relación proporcional peces/ camarón varió entre 8:1 y 57.4:1 durante las épocas de lluvias y secas respectivamente. b) Las estadísticas de estos datos experimentales establecen en términos de abundancia una relación proporcional peces/ camarón de 12:1 en promedio. 15. La abundancia de estas especies de peces como recurso potencial en la región, y basado en los datos experimentales de este trabajo, se calcula una biomasa promedio de 847 720 ton/ año, con una potencialidad máxima de 169 544 ton/ año, adicional a la biomasa promedio. 16. Los grupos de especies con mayor importancia comercial actual en estas comunidades, representaron el 16% de la biomasa total estímada, éstas son el orden de abundancia: bagres, corvinas, sardinas y mojarras. 17. La captura por unidad de esfuerzo total promedio para estas comunidades fue de 47.9 Kg/ h, con variaciones tanto estacionales como espaciales en un rango de 14.3 a 69.2 Kg/ h. 18. La implementación del análisis de biomasa por estratos batimétricos permite establecer que: a) Para el estrato de menos de 20 m de profundidad se calcula una CPUE promedio anual de 51.5 Kg/ h. b) Para el estrato de más de 20 m de profundidad se calcula una CPUE promedio anual de 55.8 Kg/ h. Conclusiones1. En la Sonda de Campeche hacia la plataforma continental adyacente a la Laguna de Términos, se presenta durante las diferentes épocas del año, la existencia de dos hábitats o subsistemas bien definidos denominados Zona A yB. 2. Las comunidades de peces del área de estudio, están directamente asociadas a la dinámica ambiental que caracteriza a cada una de las dosZonas; provocándose en cada cambio estacional, el reacomodo de la estructura y distribución de dos conjuntos de poblaciones, detectados en las diferentes épocas del año. 3. La delimitación de estas dos zonas varía estacionalmente, detectándose un área de transición entre las Zona A yBdenominada "zona de límites variables". 4. Dependiendo de la época climática existen variaciones internas en la afinidad ecológica de cada Zona A controlada por los patrones ambientales típicos del hábitat y la gran correlación de la distribución de las poblaciones de peces. 5. El área de transición entre lasZonas A y B presentó durante cada una de las épocas climáticas variaciones en la composición de especies, detectándose cambios en la afinidad ecológica por mayor o menor similitud con alguna de las dosZonas,demostrándose que los límites variables de esta área de transición oscilan estacionalmente. 6. El análisis cuantitativo de algunos parámetros ecológicos promedio de las comunidades de peces en el área para las Zonas A y B respectivamente diversidad (H'n), biomasa (H'w), número de individuos, número de especies y la relación de gramos por individuos (g/ ind) permiten establecer que la estructura y función de ambos grupos de poblaciones es muy homogéneo. Sin embargo, existen diferencias significativas entre lasZona A y B que prevalecen a lo largo de las distintas épocas climáticas, Estas diferencias están asociadas a: a) la composición de las especies (menos del 60% de las especies son comunes a ambas zonas), b) la composición por tallas de los individuos y, c) el standing-crop correspondiente a cada una de ellas, siendo mayor en la Zona A. 7. Con base en el análisis de las variaciones de los distintos parámetros ecológicos de estas especies, fue posible determinar cuantitativamente que existe una alta correlación ecológica de las comunidades de peces con su medio ambiente. 8. La naturaleza de las capturas analizadas en este estudio permite establecer la presencia de comunidades de alta diversidad en el área de estudio y por consecuencia en el sur del Golfo de México. Estas comunidades implican por sí mismas la necesidad de cambio en el desarrollo científico y tecnológico para su manejo como recurso. 9. Es posible establecer que de las familias que predominan en la composición de un arrastre de tipo camaronero en el sur del Golfo de México, el mayor porcentaje lo constituyen familias típicas de fondo como son: Ariidae, Synodontidae, Bothidae, Triglidae, Balistidae, entre otras; en segundo término familias demerso-pelágicas donde destacan Sciaenidae, Serranidae, Pomadasyidae, Lutjanidae, Polynemidae, principalmente; por último, se encuentra una gran relación con, familias típicamente pelágicas cuya incidencia en las capturas es muy alta: Clupeidae, Carangidae, Engraulidae, Stromatidae. Un alto porcentaje de estas familias actualmente representan en el país una importante fuente económica. 10. El análisis de la composición de las diversas familias en las capturas para la región del sur del Golfo de México, revela que la mayor parte de éstas depende biológicamente (en diferente grado) de los sistemas estuarinos adyacentes. Esto evidencia la integración de las estrategias ecológicas de las comunidades a los procesos físicos y heterogeneidad ambiental de la zona costera. 11. Ante la complejidad de las interacciones ecológicas en una comunidad de alta diversidad como la de este estudio, el concepto de especies dominantes debe manejarse bajo un amplio criterio ecológico. La determinación y caracterización de las especies típicas y/o dominantes de las comunidades, permitió en un análisis individual conocer a las comunidades de peces demersales de la Sonda de Campeche, sus variaciones estacionales, su estructura y función (hábitos) en el ecosistema. 12. El análisis de las variaciones estacionales de los parámetros ecológicos de distribución y abundancia de las distintas especies que tipifican a las comunidades estudiadas, permitió resaltar la existencia de numerosas interrelaciones de peces entre la plataforma continental y la Laguna de Términos. Así, los patrones de migración relacionados a la reproducción, alimentación y crianza de la mayoría de estas especies, pone de manifiesto la trascendencia ecológica de este sistema en la organización biológica y la alta productividad de la Sonda de Campeche. 13. El conocimiento del ecosistema y su dinámica, y las correlaciones peces/ hábitat en base al estudio de la estructura de las comunidades espacial y temporalmente, permitió conocer las áreas de mayor abundancia y productividad pesquera. Esta información es básica para establecer modelos de evaluación y rendimiento de estas comunidades como un recurso potencial. 14. Los peces acompañantes del camarón pertenecen a comunidades de alta diversidad y comprenden una mezcla compleja de especies, de ahí que su estudio requiera de la implementación de nuevas metodologías, dentro de una estrategia de investigación con un profundo criterio ecológico. 15. El avance científico en la evaluación de los recursos no convencionales como la fauna demersal, aún es lento en el país. Es necesaria la realización de estudios sistemáticos sobre la dinámica y variaciones en la composición de la fauna acompañante de los arrastres camaroneros en el Golfo de México, con el fin de evaluar el rendimiento y en general el potencial en dichas comunidades como recurso alimenticio. Esta es información básica necesaria antes de cualquier esfuerzo para utilizar adecuadamente el recurso. AgradecimientosLa realización de este trabajo fue posible gracias al apoyo institucional y financiero brindado por el Instituto de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México (ICML-UNAM). Estas investigaciones formaron parte del Programa Coordinado de Estudios Ecológicos en la Sonda de Campeche (PCEESC), auspiciado por la Secretaría de Marina, la Secretaría de Pesca y Petróleos Mexicanos (entre 1980 y 1983); dentro del proyecto titulado: Análisis Comparativo de las Poblaciones de Peces de la Sonda de Campeche y de la Laguna de Términos antes y después del Derrame Petrolero del Pozo Ixtoc-I, que se desarrolló en el Laboratorio de Ictiología y Ecología Estuarina. Los resultados también son parte del proyecto de investigación: Ecología y Evaluación de las Poblaciones de Peces en Ecosistemas Tropicales Costeros del Sur del Golfo de México (Laguna de Términos y Sonda de Campeche), el cual es un proyecto permanente que se lleva a cabo en el Laboratorio de Ictiología y Ecología Estuarina desde 1978, con la Clave 601. El apoyo logístico fue brindado por la Naviera Rex, S.A. con el buque camaronero "La Nueva Ley de Pesca" (crucero OPLAC/P-1 y OPLAC/ P-2); la Secretaría de Marina con el buque "Dragaminas-20 " (crucero OPLAC/ P-3), y la Secretaría de Educación Pública con el buque de prácticas "Marsep-1" (crucero OPLAC/P-4, OPLAC/P-5 y OPLAC/P-6), estas facilidades permitieron el desarrollo de las actividades de campo. A los compañeros del Laboratorio de Ictiología y Ecología Estuarina, por su participación en la obtención de datos Y el trabajo de campo, en especial a los Biólogos Hernán Alvarez Guillén, Margarito Tapia-García, Margarito Alvarez Rubio y M. en C. Felipe Amezcua Linares, Domingo Flores Hernández y Arturo Aguirre-León. Se agradece particularmente a la M. en C. Ana Laura Lara-Domínguez, Biól. Ma. de la C. García-Abad y Biól. Margarito Tapia-García, por su ayuda en el procesamiento de datos y análisis taxonómico, presentación gráfica y discusión de los resultados. Todos ellos identificados en un gran grupo de trabajo. Al Fís. Eduardo Sáinz Hernández, su colaboración para coordinar el proceso editorial de este libro. Al Ing. Rodolfo del Arenal Capetillo, Secretario Académico del Instituto de Ciencias del Mar y Limnología, por su apoyo y facilidades en aspectos logísticos para obtener este manuscrito. Un reconocimiento especial a los siguientes investigadores que revisaron el manuscrito para comentarlo, sugerir aspectos que lo enriquecieron, y cambiar detalles técnicos apropiados para lograr la estructura final del libro: Dr. Agustín Ayala Castañares, Dr. Manuel Gallardo Cabello, Dr, Alfredo Laguarda Figueras, Dr. Ingvar Emilsson, Dr. Antonio García-Cubas, y del Instituto Mexicano del Petróleo el Dr. Eduardo Aguayo E. Además revisaron este documento el Dr, Richard Robins de University of Miami/ Rosenstiel School of Marine and Atmospheric Science, Florida, y el Dr. Rezneat M. Darnell de Texas A & M University/Department of Oceanography, quien además colaboró en la revisión final del "abstract" y la nomenclatura taxonómica utilizada en este libro como también revisó los resultados biológicos, ecológicos y pesqueros. LITERATURAAGUIRRE LEÓN, A. Y A. YÁÑEZ-ARANCIBIA An. Inst. Cienc. del Mar y Limnol. Univ. Nal. Autón. México Las mojarras de la Laguna de Términos, Campeche: Taxonomía, biología, ecología y dinámica trófica (Pisces: Gerreidae). 1986. 369-444. (1) : 13 AGUIRRE-LEÓN, A., A. YÁÑEZ-ARANCIBIA y F. AMEZCUA LINARES An. Inst. Cienc. del Mar y Limnol. Univ. Nal. Autón. México Taxonomía, diversidad, distribución y abundancia de las mojarras de la laguna de Términos, Campeche (Pisces: Gerreidae). 1982 213-250 (1) : 9 ALEXANDER, S. K., P. N. BOTTHE, R. W. FLINT, C. S. GIAM, J. S. HOLLAND, G. NEFF, W. E. PEQUEGNAT, P. POWELL, N.N. RABALAIS, J. R. SCHWARZ, P. J. SZANISZLO, C. VENN, D. E. WOHLSCHLAG Y R. YOSHIYAMA Environmental Studies of Marine Ecosystem, south Texas Outer Continental Shelf. Benthic biota. Flint, R. W. y N. N. Rabalais (Eds.) University of Texas Press Austin. 1981. cap. 5 : 83-136. ALLYN, R. Florida Fishes: Salt and Fresh Water Fishes Great Outdoor Press 1969. 90 p. ALMANZA, R. y S. LÓPEZ Radiación solar global en la República Mexicana mediante datos de insolación. Instituto de Ingenieria, Universidad Nacional Autónoma de México 1975 1-10. 357 ALVAREZ GUILLÉN, H., A. YÁÑEZ-ARANCIBIA y A. L. LARA-DOMIÍNGUEZ, An. Inst. Cienc. del Mar y Limnol. Univ. Nal. Autón. México Ecología de la Boca del Carmen, Laguna de Términos: El habitat y análisis estructural de las comunidades de peces. 1985. 107-144. (1): 12 ALVAREZ-LEÓN, R. Recursos pesqueros Potenciales de México: La Pesca Acompañante del Camarón. Progr. Univ. de Alimentos, Inst. Cienc. del Mar y Limnol, Inst. Nal. de Pesca. Evaluación de los recursos demersales del Caribe y Pácifico Colombiano A. Yáñez-Arancibia, (Ed.) UNAM México D.F. 1985 748 p., Cap. 11:511-570. AMEZCUA LINARES, F. Recursos Pesqueros Potenciales de México: La Pesca Acompañante del Camarón. Pogr. Univ. de Alimentos, Inst. Cienc. del Mar y Limnol., Inst. Nal. de Pesca. UNAM Recursos potenciales de peces capturados con redes camaroneras en la costa del Pacífico de México A. Yáñez-Arancibia, (Ed.) México D. F. 1985. 748 p., Cap. 2: 39-94. AMEZCUA LINARES, F. y A. YÁÑEZ-ARANCIBA An. Centro Cienc. del Mar y Limol. Univ. Nal. Autón. México Ecología de los sistemas fluvio lagunares asociados a la Laguna de Términos. El habitat y la estructura de las comunidades de peces. 1980. 69-118 (1): 7 ANGEL, M. V. Zoogerography Scientist Publishers Zoogeography of the Atlantic Ocean van der Spoel, S. y A. C. Pierrot-Bults (Eds.) London 1979. 410 p., p. 168-190. ARMSTRONG, N. E. Estuarine Comparisons. Responses of Texas estauries to freswater inflows Kennedy, V. S. (Ed.). Academic Press. Inc. New York 1982. p. 103-120., 710 p. AYALA-CASTAÑARES, A., A. YÁÑEZ-ARANCIBA, P. SÁNCHEZ-GIL y A. L. LARA-DOMÍNGUEZ, Inst. Cienc. del Mar y Limnol. Univ. Nal. Autón. México, Inf. Tec. UNAM-ICML/COI-UNESCO Catálogo Bibliografico: Laguna de Términos y Sonda de Campeche (Sur del Golfo de México). 1984. 136 P. BAUGHMAN, J. L. Texas, Journal of Science Random notes, on Texas fishes. 1950. 117-138. (1): 2 BEEBE, W. y J. TEE VAN, Field Book of the Shore Fishes of Bermuda. Putnam's Sons New York 1970. 337 p. BECHTEL, T. J. y B. J. COPELAND Publs. Inst. Mar. Sci. Univ. Texas Fish especies diversity indicies as indicators of pollution in Galveston Bay, Texas. 1970. 103-132. 15: BLABER, S. J. M. Aust. J. Mar. Freshw. Res. Fishes of the inlet system of North Quinsland with notes on the ecology of fish faunas of Tropical Indo-pacific estuaries. 1980. 137-146. 31: BOHLKE, J. E. y C. C. G. CHAPLIN, Wynnewood, Acad. Nat. Sci. Philadelphia Fishes of the Bahamas and adjacent tropical waters. Livingston Publ. Co. 1968. 771 p. BRAVO-NUÑEZ, E. y A. YÁÑEZ-ARANCIBIA, An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México Ecología de la Boca de Puerto Real, Laguna de Términos. I. Descripción del área y análisis estructural de las comunidades de peces. 1979. 125-182. (1): 6 BRIGGS, J. C. Biol. Sci. A list of Florida fishes and their distribution Bulletin Florida State Museum 1958. 223-318. (8): 2 BRIGGS, J. D. Systematic Zoology A faunal history of the North Atlantic Ocean. 1970. 19-34. (1): 19 BRIGGS, J. C. A Summary of Knowledge of the Eastern Gulf of Mexico, 1973. The continental shelf and estaurine environmerits. J. Jones (Ed.). The State Unviersity System of Florida Intitute of Oceanography 1973. 1-9. IIIh: BRIGGS, J. C. Marine Zoogeography. Series in Population Biology. McGraw-Hill New York 1974. 475 p. Biota of the West Flower Garden Bank. BRIGHT, T. J. y L. H. PEQUEGNAT (Eds.) Gulf. Publ. Co. Houston 1974 435 p. BULLIS, H. R., Jr. y J. S. CARPENTER The Future of the Fishing Industry of the United States. Latent fishery resou8rces of the Cen tral West Atlantic Region. Univ. of Washington publ. Fish. New. Ser. G. De Witt, (Ed.). 1968. 4. Texas A. & M University Sea Grant College, Mississippi-Alabama Sea Grant Consortium. Florida Sea Grant Program Rep. Proceedings: Colloquium on snaper-grouper fishery resources in the Western Central Atlantic Ocean. BULLIS, H, R. Jr. y A. C. JONES (Eds.) 1976. 333 p. (17): CARRIT, D. E. y J. H. CARPENTER, J. Mar. Res. Comparison and evaluation of currently employed modifications of the Winkler method for determining dessolved oxygen in sea water. 1966. 226-318. (3): 24 CASO M. E. Centro. Cienc. del Mar y Limnol. Univ. Nal. Autón. México Los Equinodermos (asteroidea, Ophiuroidea y Echinoidea) de la laguna de Términos, Campeche. , Publ. esp. 1979. 1-186. 3: CASTRO-AGUIRRE, J. L. Dir. Gral. Inst. Nal. Pesca, México, Serie Cientifica, Cátalogo sistemático de los peces marinos que penetran a las aguas continentales de México con aspectos zoogeográficos y ecológicos. 1978. 1-298. 19: CERVIGÓN, F. Los Peces Marinos de Venezuela. Monogr. Estación de Investigaciones Marinas de Margarita, fundación La Salle de ciencias naturales Caracas 1966. 1-438. 11: CERVIGÓN, F. Los Peces Marinos de Venezuela. Monogr. Estación de Investigaciones Marinas de Margarita, fundación La Salle de Ciencias Naturales Caracas 1966. 439-951. 12: CERVIGÓN, F. Ecología Marina. Los peces. R. Margalef, (Ed). Fundación La Salle de ciencias naturales Caracas 1967. Cap. 10: 308-355 CHAO, L. N. NOAA Tech. Rep. NMFS. Circ. A basis for classifying Western Atlantic Sciaenidae (Teleostei: Perciformes). 1978. 1-64. 415: CHAVANCE, P., D. FLORES HERNANDEZ, A. YÁÑEZ-ARANCIBIA y F. AMEZCUA LINARES An. Inst. Cienc. del Mar y Limnol. Univ. Nal. Autón. México Ecología biología y dinámica de las poblaciones de Bairdiella chrysoura (lácèpede 1803) en la Laguna de Términos, sur del Golfo de México (Pisces: Sciaenidae). 1984. 123-161 (1): 11 CHAVANCE, P., A. YÁÑEZ-ARANCIBIA, D, FLORES HERNÁNDEZ, A. L. LARA-DOMINGUEZ y F. AMEZCUA LINARES An. Inst. Cienc. del Mar y Limnol. Univ. Nal. Autón. México Etology biology and population dynamics of Archosargus rhomboidalis (pisces: Sparidare) in a tropical coastal lagoon southern Gulf of México 1986. (2). 13 CHÁVEZ. E. A. An. Centro Cienc. del Mar y Limnol. Univ. Nal. Auton. Mexico Análisis de la comunidad de una laguna costera en la costa sur occidental de México. 1979. 15-44. (2): 6 CHÁVEZ, H. y J. ARVIZU, Mem. IV. Congr. Nac, Ocean. (México), Nov. 17-19, 1969 Estudio de los recursos pesqueros demersa-les del Golfo de California, 1968-1969. III, Fauna de Acompañamiento del Camarón (peces finos y "basura"). J. Carranza, (Ed.). 1972. 361-378. CHITTEDEN, M. E. Jr., y J, D. McEACHRAN, Texas A & M University Pres. Sea Grant Program Composition, ecology and dynamics of demersal fish communities on the Northwestern Gulf of México continental shelf, with a similar synopsis for the entire Gulf. 1976. 1-104. (208): 76 CHRISTMAS, J. Y. y R. S. WALER, Coperative Gulf of Mexico Estuarine Inventory ana Stuay, Mississippi. Estuarine vertebrates, Mississippi J.Y. Christmas, (Ed.). Gulf Coast. Res. Lab. Ocean Springs. M. S. 1973. p. 320-434. COI-UNESCO-OSLR First Session of the IOC-FAO Guiding GrouP of the Experts on the Programme on Ocean Science in Relation to Living Resources (OSLR). Paris, France, 16-28 july 1984, Intergovernmental Oceanographic Comission UNESCO, Report SC-85/WS 18 1984. 1-20. Annex I-IV. COPELAND, B. J. Publ. Inst. Mar. Sci. Univ. Texas Fauna of the Aransas Pass Inlet, Texas. I. Emigration as shown by tide trap collections. 1965. 9-21. 10: COPELAND, B. J., H. H. ODUM y F. N. MOSELEY, Coastal Ecological System of the United States. Migrating subsystems Odum, H. T., B. J. Copeland y E. A. McMahan (Eds.). The Conservation Foundation Washington, D. C. 1974. 2000 p. , p. 346-371. 1: DAHL, G. Los Peces del Norte de Colombia. Instituto de Desarrollo de los Recursos Naturales Renovables (INDERENA) Bogotá 1971. 391 p. DANIELS, K. Proc. Third Coastal Marsh and Estuary Management Symposium. Habitat designation based on cluster analysis of Ichthyofauna Day Jr., J. W., D. D. Culley, R. E. Turner y A. J. Murphrey (Eds.) Louisiana State Universisty, Division of Countynuing Education Baton Rouge, La. 1979. 317-324. DARNELL, R. M. y T. M. SONIAT, Ecological Processes in Coastal and Marine Systems. The estuary/shelf as an interactive system. R. J. Livingston, (Ed.) Plenum Press. New York 1979. 548 p. , p. 487-526. DARNELL, R. M., R. E. DEFENBAUGH y D. MOORE, Open File Report No. 82-04. Metaire, L. A.: Mineral Management Service, Gulf Of Mexico O. C. S. Regional Office Northwestern Gulf Shelf Bio-Atlas; a Study of the Distribution of Demersal Fishes and Penaeid Shrimp of Soft Bottoms of the continental Shelf From the Rio Grande to The Mississippi River Delta. 1983. 438 p. DAVIES, R. G. Computer Programing in Quantitative Biology. Academic Press Inc. London 1971. 492 p. DAWSON, C. E. Trans. Amer. Fish. Soc. Contributions to the biology of the cutlass fish (Trichiurus lepturus) in the Northern Gulf of Mexico. 1967. 117-121. 96: DAY, Jr., J. W., R. H. DAY, M. T. BARREIRO, F. LEY-LOU y C. J. MADDEN, Coastal Lagoons. Oceanologica Acta Primary production in the Laguna de Terminos, a tropical estuary in the Southern Gulf of Mexico Lasserre, P. y H. Postma (Eds.) 1982. 462 p., p. 269-276. (4): Vol. Spec. 5 DAY, Jr., J. W., L. A. DEEGAN, W. B. JOHNSON, J. G. GOSSELING, E. TURNER, R. DARNELL y A. YAÑEZ-ARANCIBIA, Estuaries Coastal biotic provinces of the Gulf of Mexico. 1983. 263. (3): 6 DEEGAN, L. A., J. W. DAY, Jr. y A. YÁÑEZ-ARANCIBIA, Final Report to Man and Biosphere Programme. Relationships of vegetation to climate, river discharge and geomorphology in Gulf of Mexico estuaries. Center for Wetland Resources. Louisiana State University. Baton Rouge, La. 1984a. 38 p. 16 figs. DEEGAN, L. A., W. B. JOHNSON, J. W. Jr. J. G. GOSSELINK y A. YÁÑEZ-ARANCIBIA, Final Report. Off. Mar. Poll. CELFI Relationships between primary productivity and physical characteristics in eight Gulf of Mexico estuaries. Louisiana State Univ. Baton Rouge, La. 1984b. 63 p., 10 figs. DEEGAN, L. A., W. B, JOHNSON,J. G. GOSSELINK, J. W. DAY, Jr., A. YÁÑEZ-ARANCIBIA, G. WOODSUM y M. DUEVER, Estauries Estuarine primary production in the Gulf of Mexico: A complex responses to physiographic, climatic and marine processes. 1983. 284-285. (3): 6 DEEGAN, L.A., J.W. DAW Jr, J.G. GOSSELINK, A. YÁNEZ-ARANCIBIA, G. SOBERÓN CHÁVEZ, y P. SÁNCHEZ-GIL, Estuarine Variability. Relationships among physical characteristics, vegetation distribution and fisheries yield in Gulf of Mexico estuaries A.D. Wolf (Ed.) Academic Press. 1986. 509 p., p. 83-100. DÍAZ RUÍZ, S., A. YÁÑEZ-ARANCIBIA y F. AMEZCUA LINARES, An. Inst. Cienc. del Mar y Limnol. Univ. Nal. Autón. Mexico Taxonomía, diversidad, distribución y abundancia de los pomadásidos de la Laguna de Términos, Campeche. (Pisces: Pomadasyidae). 1982. 251-278. (1): 9 DICKIE, L. M. y S. R. KERRE Multispecies Approaches to Fisheries Management Advice. Can. Fish. Aquat. Sci. Altenative approaches to fisheries management M.C. Mercer, (Ed.). 1982. 169 p., p. 18-23. 59: Can. Spec. Publ. Fish. Aquat. Sci. Bottom Trawl Surveys. DOUBLEDAY, W. T. y D. RIVARD (Eds.) 1981. 273 p. 58: DUURSMA, E. K. River Inputs to Ocean Systems River inputs and other pathways of organic materials in costal zone Martin J.M., D. Burton y D. Eisma (Eds.). UNEP/UNESCO Suiza 1980. 348 p., p. 352-359. EHRHARDT, N. M., G. J, ARENA, A, J. ABELLA, C. A. RÍOS, N. B. de MORATORIO y M. A. REY Institulo Nacional de Pesca. Informe Tecnico Evaluación preliminar de los recursos demersales en el área común de pesca Argentino-Uruguaya. MAP. 1977. 186 p. 13: EHRHARDT, N. M., E. M. RAMÍREZ AGUILERA, P. JACQUEMIN, M. LOZANO e I. ROMO Progarama de Investigación y Desarrollo Pesquero Integrado. México/PNUD/FA0.INP/Serie Científica Evaluación de los recursos demersales accesibles a redes de arrastre de fondo en la plataforma continental de la costa occidental de la Península de Baja California, México, durante 1979 y 1980. 1982. 46 p. 23: EL-SAYED, S. Z., W. M. SACKETT, L. M. JEFFREY, A. D. FREDERICKS, R. P. SAUNDERS, P. S. CONGER, G. A. FRYXELL, K. A. STEIDEINGER y S. A. EARLE Serial Atlas of the Marine Environment, Amer. Geogr. Soc Chemistry, primary productivity and benthic algae of the Gulf of Mexico. 1972. 1-22. 22: EMILSSON, I. La oceonografía regional con respecto a los problemas actuales, y futuros de la contaminación y los recursos vivos, Golfo de México. Reunión Internacional de Trabajo COI/PNUMA, Sobre Contaminación Marina en el Caribe y Regiones Adyacentes, 13-18 diciembre, 1976 1976. 1-24. FAO-CIID-IDRC Pesca Acompañante del Camarón -Un Regalo del Mar. Informe de una consulta técnica sobre utilización de la pesca acompañante del camarón celebrada en Georgetown, Guyana, 27-30 octubre de 1981. Ottawa, Ont., CIID, 1983. 1983 175 p. FAO Fish, Tech. Pap. Some Scientific Problem of Multispecies Fisheries. Report of the Expert Consultation on Management of Multispecies Fisheries, Rome, 20-23 Sept, 1977, FA0 1978. 42 p. (181): FAO Species Indetification Sheets for Fishery Purposes Western Central Atlantic (fishing area 31). FISCHER, W. (Ed.) FAO Roma 1978. Vols. 1-7. FLINT, R. W. y N. N. RABALAlS (Eds.) Environmental Studies of a Marine Ecosystem: South Texas Outer Continental Shelf. University of Texas Press Austin 240 p. 1981. FRANKS, J. S., J. Y. CHRISTMAS, W. L. SILER, R. ComBs, R. WALER, y C. BURNS, Gulf Res. Rep A study of the nektonic and benthic faunas of the shallow Gulf of Mexico off the State of Mississippi. 1972 1-148. 4: FURNELL, D. J., Pesca Acompañante del Camarón Un Regalo del Mar. Informe de una consulta técnica obre la utilización de la pesca acompañante del camarón celebrada en Georgetown, Guyana, 27-30 octubre 1981. Ottawa, Ont., CIID, 1983 1983 175 p., p. 47-55. GALLAWAY, B. J. y k STRAWN, Contr. Mar. Sci. Univ. Texas Seasonal abundance and distribution of marine fishes al hot-water discharge in Galveston Bay, Texas. 1974. 71-137. 18: GALLAWAY, B. J., J, C. PARKER y D. MOORE, Key To the Estuarine and Marine Fishes of Texas. Texas A & M University Press 1972. 117 p. U. S. Fish Wildl. Serv. Gulf of Mexico: Its Origin, Waters an d Marine Life. Fish. Bull. 89. GALTSOFF, P. S., (Ed.) 1954 1-604. 55: GARCIA, E. Instituto de Geofísica. Univ. Nal. Autón. México Modificaciones al Sistema de Clasificación Climatica de Köppen (para adaptarlo a las condiciones de la República Mexicana). 1973. 246 p. GARCÍA-ABAD, MA. DE LA C., A. YÁÑEZ-ARANCIBIA, P. SÁNCHEZ-GIL y M. TAPIA GARCÍA, Rev. Biol. Trop. (enviado a publicación). Aspectos biológicos y ecológicos de Syacium gunteri Gingsburg, en las comunidades demersales de la plataforma continental del sur del Golfo de México. (Pisces: Bothidae). 1986. GINGSBURG, I. Texas J. Sci. Review of the Western Atlantic Triglidae (fishes). 1950. 489-527. (4): GOWANLOCH, J. N. Fishes and Fishing in Louisiana. La. Dept. Conser. Bull. 23:638 p. Reprint Baton Rouge: Claitor's Bookstore, 1965. 1965 GRAHAM, D. S., J. P. DANIELS, J. M. HILL y J. W. DAY, Jr. An. Inst. Cienc. del Mar y Limnol. Univ. Nal. Auton. Mexico A preliminary model of the circulation of Laguna de Terminos, Campeche, Mexico. 1981. 51-62. (1): 8 GRIVEL PIÑA, F. An. Inst. Geof. Univ. Nal Autón. México Constantes armónicas de 23 estaciones mareográficas instaladas en las costas de México. 1969. 45-69. (1028): 14 GUITART, D. J. Sinopsis de los Peces Marinos de Cuba. Academia de Ciencias de Cuba. Inst. de Oceonología. La Habana 1974. 1-1363 1: GUITART, D. J. Sinopsis de los Peces Marinos de Cuba. Academia de Ciencias de cuba. Inst. de Oceonología. La Habana 1975. 137-322. 2: GUITART, D. J., Sinopsis de los Peces Marinos de Cuba. Academia de Ciencias de cuba. Inst. de Oceonología. La Habana 1975. 323-608. 3: GUITART, D. J., Sinopsis de los Peces Marinos de Cuba. Academia de Ciencias de cuba. Inst. de Oceonología. La Habana 1975. 609-801. 4: GULLAND, J. A., Manual de Métodos para Evaluacion de las Poblaciones de Peces. Publicación FAO. Ed. Acribia España 1971. 164. p. GULLAND, J. A. The Ecology of the Seas., Part IV Production and catches of fish in the sea Cushing, D. H. y J. J. Walsh (Eds.). Blackwell Scientific Publ. 1976. 467 p.Cap. 12: 283-314. GUNTER, G. Ecol. Monogr. Seasonal variations in abunance of certain estuarine and marine fishes in Louisiana with particular reference to life histories. 1938. 313-346. 8: GUNTER, G. Publ. Inst. Mar. Sci. Univ. Texas Studies on marine fishes of Texas. 1945. 1-190. 1: GUNTER, G. Copeia Records of fishes from the Gulf of Campeche, México. 1952. 38-39. (1): GUNTER, G. Copeia Population studies of the shallow water fishes on outer beach South Texas. 1959. 186-193 5: GUNTER, G., Estuaries Am. Ass. Adv. Sci. Publ. Spec. Some relationships of estuaries to the fisheries of the Gulf of Mexico Lauff, G. A. (Ed.). 1967. 83-757 p. , p. 621-638. GUTIÉRREZ-ESTRADA, M., Sedimentología del área de transición entre las provincias terrígena y carbonatada del suroeste del Golfo de México. Tesis M. en C. (Geología) Fac. ciencias, Univ. Nal. Autón. México 1977. 175 p. HECK, K. L. Jr. Mar. Biol. Comparitive species richness, composition and abundance of invertebrates in Caribbean seagrass (Thalassia testudinum) meadows (Panama). 1977. 335-348. 41: HEDGPETH, J. W. Publ. Inst. Mar. Sci. Univ. Texas An introduction to the zoogeography of the North western Gulf of Mexico with reference to the invetebrate fauna. 1953. 111-124. (1): 3 HEDGPETH, J. W. Gulf of Mexico: Its Origin, Waters and Marine Life. Fish. Bull. 89. U. s. Fish Wildl. Serv. Bottom Communities of the Gulf of Mexico. P.S. Galtsoff. (Ed.) 1954. 203-214. 55: HENDRICKX, M. E. Recursos pesqueros Potenciales de México: La pesca Acompañante del Camarón. Diversidad de los macroinvertebrados bentonicos acopañantes del camarón en el área del Golfo de California y su importancia como recurso potencial, A. Yáñez-Arancibia, (Ed.) Prog. Univ. de Alimentos, Inst. Cienc. del Mar y Limnol., Inst. Nal. de Pesca. UNAM México D. F. 1985. 748 p.. Cap. 3: 95-148. HENDRICKX, M. E., A. M. VAN DER HEIDEN y A. TOLEDANO GRANADOS, An Inst. Cienc. del Mar y Limnol. Univ. Nal. Autón. México Resultados de las Campañas SIPCO SUR DE Sinaloa, México) a bordo del B/O "El Puma". III. Hidrología y composición de las capturas efectuadas en los arrastres. 1984. 107-122. (1): 11 HILDEBRAND, H. H. Publ. Inst. Mar. Sci. Univ. Texas A stduy of the fauna of the brown shrimp (penaeus aztecus ives) grounds in the western Gulf of Mexico. 1954. 233-366. (2): 3 HILDEBRAND, H. H. Publ. Inst. Mar. Sci. Univ. Texas. A study of the pink shrimp (Penaeus dourarum Burkenroad) ground in the Gulf of Campeche. 1955. 169-232. (1): 4 HILDEBRAND, H., H. CHAVES, H. COMPTON Ciencia, México Aporte al conocimiento de los peces del Arrecife Alacranes, Yucatán (México). 1964. 107-134. (3): 23 HOESE, H. D. y R. H. MOORE, Fishes of the Gulf of Mexico. Texas, Louisiana, and Adjacent Walters. Texas A & M University Press 1977. 376 p. HOESE, H. D., B. J. COPELAND, F. N. MOSELEY y E. D. LANE, Texas J. Sci. Fauna of the Aransas Pass Inlet, Texas. III. Diel and seasonal variations in trawlable organisms of the adjacent area. 1968 33-60. 20: HORN, M. H. y L. G. ALLEND, Bull. South. Cal. Acad. Sci. Number of species and faunal resenblance of marine fishes in California Bays and estuaries. 1976. 159-170. (2): 75 JONES, R. Theory and Management of Tropical Fisheries. ICLARM Conference Proceedings 9, Manila Philippines Ecosystems, food chains and fish yields Pauly, D. y G. I. Murphy (Eds.). 1982. 360 p., p. 195-239 JORDAN, D. S. y B. W. EVERMANN, Bull. U. S. Nat. Mus. The Fishes of North and Midle America. 1896-1900. 1-3313. (14): 1-4 KIND, B. D. III. Tex. parks, Wild. Dept. Austin. Tech. Ser. Study of migratory patterns of fish and shellfish thorough a natural pass. 1971. 1-54. 9: KLIMA, E. F. UNESCO-FAO. WECAF Stud. FAO Fish. Rep. An Assessment of the fish stocks and fisheries of the Campeche Bank. CICAR-II Symposium Progress in Marine Research in the Caribbean and Adjacent Regions 1976 1-24. 5: KLIMA, E. F., Proceedings of the CICAR-II Symposium, Caracas, Venezuela, 12-16 julio 1976. Progress in Marine Researche in the Caribbean and Adjacent Regions An overview of the fishery resources of the West Central Atlantic Region. 1977. 231-252. (200): LANKFORD, R.R Estuarine Processes. Circulation, Sediments and Transfer of Material In the Estuary. Costal lagoons of Mexico: Their origin and classification L.E. Cronin, (Ed.). Academic Press Inc. New York 1977. 428 p. 215., p. 182-215. 2: LARA DOMÍNGUEZ, A. L., A. YÁÑEZ-ARANCIBIA y F. AMEZCUA LINARES An. Inst. Cienc. del Mar y Limnol. Univ. Nal. Auton. México Biología y ecología del bagre Arius melanopus (Günther) en la Laguna de Términos, sur del Golfo de México (pisces: Ariidae). 1981. 267-304. (1): 8 LAUFF, G. H. (Ed.) Estuaries. Amer. Ass. Adv. Sci., Spec. Publ. 1967. 757 p. 83: LICEA-DURÁN, S., R. LUNA, P. TORRES y C. TREJO, Informe Final. Proyecto de Investigación Evaluación de los Posibles Efectos del derrame del Pozo IXTOCI-I, Sobre las Comunidades de Fitoplancton y la Pproducción Primaria. PCEESC/UNAM/ICML (IF). 1982. 48 p., 11 tabls., 16 figs. LIVINGSTON, R. J. Estuar. Coast. Mar. Sci. Diurnal and seasonal fluctuations of organisms in a North Florida estuary. 1976. 373-400. 4: LIVINGSTON, R. J. Proceedings of the National Symposium on Freshwater Inflow to estuaries. U. S. Fish and Wildl. Serv. Off. Biol. Serv., FWS/OBS-81/04, River derived imput of detritus into the Apalachicola estuary Gross, R. y D. Williams (Eds.) 1981. 525 P., p. 320-329. 1: LINCH, S. A. Gulf of Mexico: Its Origin, Waters and Marine Life. Fish. Bull. 89. U. S. Fish and Wildl. Serv. Geology of the Gulf of Mexico P.S. Galtsoff, (Ed.) 1954. 604 p., p. 67-138. 55: MALLARD COLMENERO, L., A. YÁÑEZ-ARANCIBIA y F. AMEZCUA LINARES An. Inst. Cienc. del Mar y Limnol. Univ. Nal. Autón. México Taxonomía, diversidad, distribución y abundacia de los tetraodontidos de la Laguna de Términos, sur del Golfo de México. (Pisces: Tetraodontidae). 1982. 161-211. (1): 9 MANCILLA PERAZA, M. Y M. VARGAS FLORES, An. centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México Los primeros estudios sbre la circulación y el flujo neto de agua a través de la Laguna de términos, Campeche. 1980. 1-12 (2): 7 MARGALEF, R. Perspectives in Ecological Theory. The University of Chicago Press Chicago 1969. 111 p. MARGALEF, R. y M. ESTRADA, Investigación y Ciencia Las áreas oceánicas más productivas. 1980. 8-20. (49): McERLEAN. A. J. y J. A. MIHURSKY, Proc. Twenty-Second Ann. Conf., Southeastern Association of Game and Fish Commissioners Species diversity, species abundance of fish populations: an examination of various methods. 1969. 372. 367: MEEK, E. S. y S. F. HILDEBRAND, Field Mus. Nat. Hist. Publ. Zool. Ser. The marine fishes of Panama. 1923. 1-330. (226): 15 MEEK, E. S. y S. F. HILDEBRAND, Fiedl Mus. Nat. Hist. Publ. Zool. Ser. The marine fishes of Panama. 1925. 330-707. (226): 15 MEEK, E. S. y S. F. HILDEBRAND, Field Mus. Nat. Hist. Publ. Zool. Ser. The marine fishes of Panama. 1928 708-1045. (249): 15 MERCER, M. C. (Ed.) Can. Spec. Publ. Fish. Aquat. Sci. Multispecies Approaches to Fisheries Management advise. 1982. 169 p. 59: MILLER, J. S. Publ. Inst. Mar. Sci. Univ. Texas A trawl study of the shallow Gulf fishes near Port Aransas, Texas. 1965. 80-107. 10: MILLER, G. C. UNESCO, FAO, Rept. and Abst. Fish Rep. of Paps. A revision of zoogeographical regions in the warm-water area of the western Atlantic. Proc. symp. Investig. and Resour. Caribean Sea and Adj. Reg. 1969. 165 p. (1): 71 MILLER, C. Y D. M. KENT., Quart. J. Florida Acad. Sci. Redescription of Prionotus beani (pisces, Triglidae). 1972. 223-242. (3): 34 MOE. M. A. Jr. y G. T. MARTIN, Tul. Stud. Zool. Fishes taken in monthly trawl samples offshore of pinellas County, Florida, with new additions to the fish fauna of the Tampa Bay area. 1965. 129-151 (4): 12 MOFFETT, A. W., L. W. McEACHRAN y J. G. KEY, Contgr. Mar. Sci. Univ. texas Observations on the biology of san seatrout (Cynoscion arenarius) in Galveston and Trinity Bays, Texas. 1979. 163-172. 22: MOORE. D., H. A. BRUSHER y L. TRENT Contr. Mar. Sci. Univ. Texas Relative abundance, seasonal distrbution and species composition of demersal fishes off Louisiana and Texas, 1962-1964. 1970. 45-70. 15: MUNRO, J. L. (Ed.) Caribbean coral Reef Fishery Resources. ICLARM Studies and Revieus, 7. Manila, Phillippines 1983. 276 p. NAKAMURA, E. L. J. R. TAYLOR y I. K. WORKMAN, NOAA. Tech. Mem. NMFS-SEFC-45: The occurrence of life stages of some recreational marine fishes in estuaries of the Gulf of Mexico. 1980. 1-53. NIKOLSKY, G. V. The Ecology of Fishes. Academic Press Inc. New York 1963. 352 p. NORMAN, J. R. The Trustees of the British museum (Natural History) A Sistematic Monography of the Flat Fishes (Heterosomata). psettodidae, Bothidae, Pleuronectidae. London 1934. 1-459. 7: ODUM. W. E. y E. J. HEALD, Estuarine Research. The detritus based food web of an estuarine mangrove community L.E. Cronin, (Ed.). Academic Press Inc. New York 1975. 309 p., p. 265-286. 1: OGREN, L. H., y H. A. BRUSHER, Northeast Gulf Science The distribution and abundance of fishes caught with tawl in the St. Andrew Bay System, Florida. 1977. 83-105. (2): 1 OTERO, H. 0., S. I. BEZZI, M. A. KENZI y G. A. Atlas de los Recursos pesqueros Demersales del Mar Argentino. Serie Contribuciones Instituto Nacional de Investigación y Desarrollo pesquero (INIDEP) Mar del Plata, Argentina 1982. 248 p. (423): OVIATT, A. C. y S. W. NIXON, Estuar. Coast. Mar. Sci. The demersal fish of Narraganset Bay: An analysis of community structure, distribution and abundance. 1973. 361-368. 1: PAULY, D. Theory and management of tropical multispecies stocks: A review, with emphasis on the Southeast Asian demersal fisheries. ICLARM. Manila 1979. 35 p. PAULY, D. FAO Fish. CIRC. A selection of simple methods for the assess-ment of tropical fish stocks. 1980. 1-54. 729: PAULY, D. y A. N. MINES (Eds.) ICLARM Technical Report, 7. Small-scale Fisheries of San Miguel Bay, Philippines: Biology and Stock Assess-ment. Manila Philippines 1982. 124 p. PAULY, D. y G. I. MURPHY (Eds.) ICLARM Conference Proceeding, 9. Theory and Managemet of Tropical Fisheries. Manila Philippines 1982. 360 p. PAULY. D. y R. NEAL, Recursos Pesqueros Potenciales de México: La Pesca Acompañante del Camarón. Progr. Univ. de Alimentos, Inst. Cienc. del Mar y Limnol., Inst. Nal. de Pesca. UNAM. Shrimp vs fish in Southeast Asian fisheries: The biological, technological and social problems. A. Yáñez-Arancibia, (Ed.) México, D. F. 1985. 748 p., cap. 10: 487-510. PELLEGRIN, Jr., G., Pesca Acompañante del Camarón - Un Regalo del Mar. Informe de una consulta técnica sobre la utilización de la pesca acompañante del camarón celebrada en Georgetown, Guyana, 27-30 octubre 1981. Otawa, Ont., CIID, 1983 Descarte de pescado en la pesquería de camarón en el Sudeste de Estados Unidos 1983. 175 p., p. 56-60. PENCHASZADEH, P. E. y J. J. SALAYA, Recursos Pesqueros Potenciales de Mexico: La Pesca Acompañante del Camarón. Estructura y ecología trófica de las comunidades demersales en el Golfo Triste, Venezuela, Cap. 12 A. Yáñez-Arancibia, (Ed.). Prog. Univ. de Alimentos, Inst. Cienc. Mar y Limnol., Inst. Nal. de Pesca, UNAM México D. F. 1985. 748 p., 571-598. PENCHASZADEH, P. E., J. J. SAYALA, R. GUZMAN y R. MOLINET Inst. Tec. Cienc. Mar., Caracas Estructura de la Pesquería de arrastre de Golfo Triste, Región Centro Occidental de Venezuela, con especial referencial al material de descarte o broza. Univ. Simón Bolivar 1984. 31 p., 17 figs., 2 Apéndices. PÉREZ-MELLADO, J. Análisis de la fauna de acompañamiento del camarón capturado en las costas de Sonora y Sinaloa, México. Tesis M. en C. ITESM Guaymas, México 1980. 98 p. PÉREZ-MELLADO, J. y L. T. FINDLEY, Recursos Pesqueros Potenciales de México: La Pesca Acompañante del Camarón. Evaluación de la ictiofauna acompañante del camarón capturado en las costas de Sonora y Norte de Sinaloa, México. A. Yáñez-Arancibia, (Ed.) Progr. Univ. de Alimentos, Inst. Cienc, del Mar y Limnol., Inst. Nal. de Pesca. UNAM México D. F. 1985. 748 p., Cap. 5: 201-254. PÉREZ-MELLADO, J., J. M. ROMERO, R. H. YOUNG y L. T. FINDLEY, Pesca Acompañante del Camarón, Un Regalo del Mar. Informe de una consulta técnica sobre la utilización de la pesca acompañante del camarón celebrada en Georgetown, Guyana, 27-30 octubre 1981. 0ttawa, 0nt., CIID, 1983 Rendimientos y composición de la pesca acompañante del Golfo de California, 1983. 175 p., p. 61-63 PERRY, J. A. III y S. D. PERRY, Universidad de Cosla Ríca, Serie Ciencías Naturales Los Peces Comunes de Ia Costa Atlántica de Cósta Rica. 1974. 225 p. (7): PEW, P. (Ed.) Texas Parks and Wildlife Departament. Bull. Food and Game Fishes of Texas Coast. Ser. (IV), Mar. Lab. 1971. 70 p. (33) PIELOU, E. C. J. Theoret. Biol. The measurement of diversity in different types of Biological collections. 1966. 131-144 p. 13: POPE, J. G. y B. J. KNIGHTS, Multispecies Approaches to Fisheries Management Advice. Can. Spec. Publ. Fish. Aqua. Sci. Composition of length distribution of combined catches of all demersal fishes in surveys in the North Sea and at Faroe Bank Mercer, M. C. (Ed.). 1982. 169 p., p. 116-118 59: PRICE, W. A. Gulf of México: Its Origin, Waters and Marine Life. Fish. Bull. 89, U. S. Fish Wildl. Serv. Shorelines and coast of the Gulf of México Galtsoff, P. S. (Ed.) 1954. 604 p., p. 39-66. 55: RAGAN, J.G., E. J. MELANCON, A. H. HARRIS, R. N. FALGOUT, J. D. GANN, y J. H. GREEN, Prop. Paps. Biol. Bottom fishes of the continental shelf of Louisiana Nichols State Unviersity. 1977. 1-33. 2: RAMAMURTHY, V. D. y J, SREENIVASAN, An. Inst. Cienc. del Mar y Limnol. Univ. Nal. Auton. México Sources of oil pollution along Indian coast of Arabian Sea, Bay of Bengal, Indian Ocean, and its impacts on commercial fisheries. 1983. 281-286. (1): 10 RAMÍREZ HERNÁNDEZ. E. y J. ARVIZU, An, Inst. Nal. Inv. Biol. Pesq. México Investigaciones ictiologicas en las costas de Baja California. I 1965 293-324. 1: RAMÍREZ HERNÁNDEZ, E. y J. PÁEZ, An. Inst. Nal. Inv. Biol. Pesq. México Investigaciones ictiológicas en las costas de Guerrero. I. 1965. 327-358. 1: RAMÍREZ HERNÁNDEZ, E., G. CARRILLO y D. LLUCH, Publ. Inst. Nal. Inv. Biol, Pesq. Investigaciones ictiologicas en las costas de Chiapas. Lista de especies colectados en las capturas camaroneras (agosto-septiembre, 1959; abril-mayo-junio, 1960). Secretaría de Industria y Comercio, Dir, Gral. Pes, Ind. Con. México 1964. 1-17. 5: RAMÍREZ HERNÁNDEZ, E., N, VÁZQUEZ, R. MARQUEZ y C. GUERRA, Publ. Inst. Nal. Inv. Biol. Pesq. Investigaciones ictiológicas en las costas de Sinaloa. I. Listas de peces colectados en las capturas camaroneras (agosto, 1961; abril-octubre, 1962; mayo-septiembre, 1963). Secretaría de Industria y Comercio. Dir. Gral. Pes. Ind. Con. México 1965. 1-36. 12: RANDALL, J. E. Stud. Trop. 0ceanogr. Miami. Food Habits of Reef Fishes of the West Indies. 1967 487 p. (20): 5 RANDALL, J. E. Caribbean Reef Fishes. T. F. H. Publications Inc. New York 1968. 318 p. RAO, S. K. Indian. J. Fish. Food and feeding habits of fishes from traw1 catches in the bay of Bengal with observations on diurnal variation in the nature of the feed. 1967. 277-134. (1): 11 REID, G. K. Jr. Texas. J. Sci. A summer study of the biology and ecology of East Bay, Texas. Part II. 1955. 430-453. 7: REID, G. K. Jr. Cupeia Size distribution of fish in Texas estuary. 1958. 225-231 (3): RESENDEZ, MEDINA, A. An. Inst. Biol. Univ, Nal. Autón, México 42 Serv. Cienc. del Mar y Limnol. Peces colectados en el Arrecife la Blanquilla, Veracruz, México. 1971 7-30. (1): ROE, R. B. Proc. Colloquium on Snaper-Grouper Fishery Resources of the Western Central Atlantic Ocean. Contr. Pap. Florida Sea Grant Program. Rep. Distribution on snapers and groupers in the Gulf of México and Caribbean Sea as determined from exploratoring fshing data Bullis, H. R, Jr. y A. C. Jones (Eds.). 1976. 333 p., p. 129-164. (17): ROITHMAYR, C. M. U. S. Fish. Wildl, Serv., Spec. Sci Rep. Fish. Industrial bottomfish fishery of the Northern Gulf of Mexico, 1959-1963. 1965. 1-23. (518): ROSALES JUÁREZ, F. Mem. Reunión sobre los Recursos, de la Pesca Costera de México. Veracruz Nov. 1976. Instituto Nacional de Pesca. Contribución al conocimiento de la fauna de acompañamiento del camarón en alta mar, frente a las costas de Sinaloa, México Inst. Nal. de Pesca (Ed.): 1976. p. 25-80. ROSENBLATT, R, H. Proceedings of the International Conference on Tropical Oceanography, Stud. Trop. Oceanogr. The zoogeographic relationships of the marine shore fishes of tropical America. 1968. 579-592. (5): SABINS. D. S. y F. M. TRUESDALE, W.A. Rogers, (Ed.). Proc. Twenty-eigth Ann. S. E. Assoc, Game and Fish Comm., White Sulfure Spring, W. V. Diel and seasonal occurrence of inmature Fishes in a Louisiana tidal pass 1974. p. 161-170. SAILA, S. B. y P. M. ROEDEL (Eds.), International Center for Marine Resource Development Stock Assessment for Tropical Small-scale Fisheries. Proceedíngs of an in ternational workshop held at the University of Rhode Island, Kingston, R. I., September 19-21, 1979. 1980. 198 p SAINSBURY, K. J. Theory and Management of Tropical Fisheries ICLARM Conference Proceeding 9, Manila Philippines The ecological basis of tropical fisheries managment Pauly, D. y G. I. Murphy (Eds.). 1982. 360 p., p. 169-194. SANCHEZ-GIL, P. y A. YAÑEZ-ARANCIBIA, Recursos Pesqueros Potenciales de México: La Pesca Acompañante del Camarón, Progr. Univ. de Alimentos, Inst. Cienc, del Mar. y Limnol., Inst. Nal. de Pesca. UNAM. Evaluación ecológica de recursos demersales costeros tropicales: Un enfoque metodológico en el Sur del Golfo de México, Cap. 7 A. Yáñez-Arancibia, (Ed.) México D. F. 1985. 748 p., 275-314. SÁNCHEZ-GIL., P., A. YÁNEZ-ARANCIBIA F. AMEZCUA LINARES. An. Inst. Cienc. del Mar. y Limnol, Univ. Nal. Auton. México Diversidad, distribución abundancia de las especies y poblaciones de peces demersales de la Sonda de Campeche (Verano 1978). 1981. 209-240. (1): 8 SAUSKAN, V. 1. y A. OLACHEA, An. Invest. Pesq. Cuba Ietiofauna bentónica del Banco de Campeche. Resum. Invest. Inst. Nal, Pesca. 1974. 102-106. 1: SCHULTZ-RUIZ, L. E. y E. A. CHAVEZ, Contribución al conociento de la biología pesquera del camarón blanco (Penaeus setiferus (L.)) del Golfo de Campeche, México. Mem. Simpisio sobre Biología y Dinámica Poblacional de Camarones. Guaymas, So., 8-13 agosto 1976: 1976. 58-73. SHANNON, E. C. y W. WEAVER, The Mathematical Theory of Communication University of lllinois Press Urbana 1963. 119 p. S.I.C. Catálogo de Peces Marinos Mexicanos. Secretaría de Industria y Comercio, Subsecretaría de Pesca, Instituto Nacional de Pesca México 1976. 462 p. SILVERT, W. y L. M. DIKIE, Multiespecies Approaches to Fisheries Management Advice. Can. Spec. Publ. Fish. Aquat. Sci. Multispecies interactions between fish and fishermen Mercer, M.C.(Ed.). 1982. 169 p. , p. 163-169. 59: SIMMONS, E. G. y H. D. HOESE, Publ. Inst. Mar. Sci. Univ. Texas. Studies on the hydrography and fish migrations of Cedar Bayon, a natural tidal inlet on the central Texas coast. 1959. 56-80. 6: SMITH, G. B. Fla. Mar. Res. Publ. Ecology and distribution of Easter Guff of México reef fishes. 1976 1-78 19: SOBERÓN-CHÁVEZ, G. y A. YÁÑEZ-ARANCIBIA, Recursos Pesqueros Potenciales de Méxíco: La Pesca Acompañante del Camarón. Prog. Univ. de Alimentos, Inst. Cienc. del Mar y Limnol., Inst. Nal. de Pesca. UNAM Control ecológico de los peces demersales: variabilidad ambiental de la zona costera y su influencia en la producción natural de los recursos pesqueros, Cap. 9 A. Yánez Arancibia, (Ed.) México D.F. 1985. 748 p., 399-486. SPRINGER, S. y H. R. BULLIS, Jr. U. S. Fish. and Wild, Serv., Spec. Sci. Rept. Collections by the Oregon in the Gulf of México. 1956 1-134. 196: SPRINGER, V. G. y K. D. WOODBURN, Fla. St. Bd. Prof. Pap. Serv. An ecological study of the fishes of Tampa Bay area. 1960. 1-104. 1: STEVENSON, D. K., FAO Documentos Técnicos de Pesca Una revisión de los recursos marinos de la reglón de la región de comisión de Pesca para el Atlántico centro-occidental (COPACO). 1982 1-146. 211: STARCK, W. A., II Undersea Biology A list of fishes of Alligator Reef, Florida with comments on the nature Florida reef fish fauna. 1968. 4-40. (1): 1 STONE, J. H. Environmental factors related to Louisiana menhaden harvest. Louisiana menchaden harvest. Luisiana State University, Center for Wetland Resources, Baton Rouge, La. Final Rept. U. S Dept. Comm., NOAA, Nat. Nar. Fish. Serv., St, Petersburg, Fla. 1976. STONE, J. H., J. W. DAY Jr., L. M. BAHR Jr., y R. A. MULLER, Estaurine Interations. The impact of possible climatic changes on estuarine ecosystems M.L. Wiley, (Ed.). Academic Press Inc. New York 1978 604 p., p. 305-322. STRICKIAND,J. D. H. y T. R. PARSONS, A Manual of Sea Water Analysis. Fish. Res, Bd. Canada, Ministry of Fisheries, Ottawa 1968. 310 p. SUTCLIFFE, W. H. J. Fish. Res. Bd. Canada Some relations of land drainagre, nutrients, particulate material, and fish catch in two Eastern Canadian bays 1972 357-362. (4): 29 SUTCLIFFE, W. H. J. Fish Res. Bd. Canada Correlation between seasonal river discharge and local landings of American lobster (Homarus americanus) and Atlantie halibut (Hippoglosus hippoglossus) in the Gulf of St. Lawrence. 1973. 856-859. (6): 30 SWINGLE, H. A. Ala. Mar. Res. Bull. Biology of Alabama estuarine areas Cooperative Gulf of Mexico estuarine inventory. 1971. 123 p. (5): TAPIA GARCÍA, M., A. YÁÑEZ-ARANCIBIA, P. SÁNCHEZ-GIL y MA. DE LA C. GARCÍA-BAD, Rev. Biol. Trop. (en prensa). Aspectos biológicos y ecológicos de Cynoscion arenarius Gingsburg, en las comunidades demersales de la plataforma continental del sur del Golfo de México (Pisces: Sciaenidae). 1986. TAPIA GARCÍA, M., A. YÁÑEZ-ARANCIBIA, P. SÁNCHEZ-GIL y MA. DE LA C. GARCÍA-ABAD, Rev. Biol. Trop. (en prensa). Aspectos biológicos y ecológicos de Cynoscion nothus Holbrook, en las comunidades demersales de la plataforma continental del sur del Golfo de México (Pisces: Sciaenidae). 1986. TEAGUE, G. W. Com. Zool. Mus. Hist. Nat. Montevideo The sea robins of America, A revision of the triglid fishes of genus Prionotus. 1951. 1-59. (61): 3 TEMPLEMAN, W., y A. M. FLEMING, ICNAF Annu. Proc. Long term changes in hydrographi conditions an corresponding chages in the abundance of marine animals. 1953. 79-86. 3: TOPP, R. W. y F. H. HOFF Jr., Fla. Dept. Nat. Res. Mem. Hourglass Cruises. Flatfishes (Pleuronectiformes). 1972. 1-135. (2): 4 TURNER, W. R. y G. N. JOHNSON, NOAA Tech. Rep. NMFS-SSRF-666 Distribution and relative abundance of fishes in New Port River, North Carolina 1973. 1-23. TURNER, R. E., Trans. Am Fish. Soc. Intertidal vegetation and commercial yields of Penaeid shrimps. 1977. 411-416. (5): 106 UYENO, T., K. MATSUURA y E. FUJII (Eds.), Fishes Trawled of Suriname and French Guiana. Japan Marine Fishery Resources Research Center Tokyo, Japan. 1983. 519 p. VAN DER HEIDEN, A. M., Recursos Pesqueros Potenciales de México: La pesca Acompañante del Camarón. Taxonomía, biología y evaluación de la ictiofauna demersal del Golfo de California, Cap. 4 Yáñez-Arancibia, A. (Ed.) Progr. Univ. de Alimentos, Inst. Cienc. del Mar y Limnol., Inst. Nal. de Pesca. UNAM México D. F. 1985. 748 p., 149-200. VARGAS MALDONALO, I., A. YÁÑEZ-ARANCIBIA y F. ANEZCUA LINARES, An. Inst, Cienc. del Mar y Limnol. Univ. Nal. Autón, México Ecología y estructura de las comunidades de peces en areas de Rhizophora mangle y Thalassia testudinum de la Isla del Carmen, Laguna de Términos, sur del Golfo de México. 1981. 241-266. (1): 8 VENKATARAMAN, G., Indian. J. Fish. Studies on the food and feeding relationships of the inshore fishes off Calicut on the Malabar Coast. 1960. 275-306. (2): 7 VILLALOBOS FIGUEROA, A. y MA. E. ZAMORA, Importancia biológica de la Bahía de Campeche. Mem. I. Simp. Latinoam. Oceonorg. Biol. México, 25-29 noviembre 1974 1975. 375-394. VILLALOBOS FIGUEROA, A. y MA. E. ZAMORA, Importancia biológica de la Bahía de Campeche y de la Península de Yucatán (Segunda parte), Mem. II Simp. Latinoam. Oceonogr. Biol. Cumaná Venezuela, 24-28 noviembre 1975, Publ. Univ. Oriente 1977. 79-117. WALNE, P. R. The Estuarine Environment. The importance of estuaries to comercial fisheries Barnes, R. S. K. y J. GREEN (Eds.) Applied Science Publishers Ltd. London 1972. 134 p., p. 107-118. WALLS, J. G., Fishes of the Northern Gulf of México. T. F. H. Publications Inc., Ltd. 1975. 432 p. WARBURTON, K. Estuar. Coast. Mar. Sci. Community structure, abundance and diversity of fish in a Mexican coastal lagoon system. 1978. 497-519. 7: WILHM, J. L. Ecology Use of biomass units in Shannon's formula. 1968. 153-156. (1): 49 YÁÑEZ-ARANCIBIA, A. Centro. Cienc. Del mar y limnol. Univ. Nal. Autón. México. Publ. Espec. Taxonomía, Ecología y Estructura de las Comunidades de peces en lagunas costeras con Bocas Efímeras del Pacífico de México. 1978. 306 p. 2: YÁÑEZ-ARANCIBIA, A. Castal Lagoon Research. Present and Future, II Proceedings. UNESCO / IABO, Tech. Pap, Mar. Sci. UNESCO Ecological studies in Puerto Real inlet, Terminos LagoOn, Mexico: Discussion on trophic structure of fish communities on Thalassia testudinum banks Lasserre, P., H. Postma, J. Costlow y M. Steyert (Eds.) 1981a. 349 p., p. 191-232. 33: YÁÑEZ-ARANCIBIA, A. Coastal Lagoon Research: Present and Future. II Proceedings. UNESCO/IABO, Tech. Pap. Mar. Sci. UNESCO The ocurrence, diversity and abundance of fish in two tropical, coastal lagoons with ephemeral inlets on the pacific coast of Mexico Lasserre, P., H. Postma, J. Costlow y M. Steyert (Eds.). 1981b. 349 p., p. 233-260. 33: YÁÑEZ-ARANCIBIA, A. Ciencia y Desarrollo CONACYT Usos, recursos y eculogía de la zona costera. 1982. 58-63. (VIII): 43 YÁÑEZ-ARANCIBIA, A. La Alimentación del Futuro (en prensa). Hacia el conocimiento de la ecología, la cuantificación y el manejo de los recursos pesqueros demersales. del sur del Golfo de México Carvajal, R. (Ed.) Editorial Universitaria, PUAL-UNAM México, D. F. 1983. 9 p. YÁÑEZ-ARANCIBIA, A. Ciencia y Desarrollo CONACYT Evaluación de la pesca demersal costera. 1984. 61-71. (X): 58 YÁÑEZ-ARANCIBIA, A. Recursos Pesqueros Potenciales de México: La Pesca Acompañante del Camarón. Progr. Univ. de Alimentos, Inst. Cienc. del Mar y Limnol., Inst. Nal. de Pesca. UNAM México D. F. 1985a. 748 p. YÁÑEZ-ARANCIBIA, A. Fish Community Ecology in Estuaries and Coastal Lagoons: Towards an Ecosystem Integration. UNAM-PUAL-ICML The estuarine nekton: Why and how an ecological munograph/Preface. Cap, 1. A. Yañez-Arancibia, (Ed.) Editorial Universitaria México 1985b. 654 p., 11-8 YÁÑEZ-ARANCIBIA, A. Fish Community Ecology in Estuaries and Coastal Lagoonsn: Towards an Ecosystem Integration. UNAM-PUAL-ICML Editorial Universitaria México D. F. 1985c. 654 p. YÁÑEZ-ARANCIBIA, A. Ecología de la Zona Costera: Análisis de Siete Trópicos ACT Editor, S.A. México D.F. 1986. 654 p. YÁÑEZ-ARANCIBIA, A. y R. S. NUGENT, An. Centro Cienc. del Mar y Limnol. Univ. Nal. Auton. México. El papel ecológico de los peces en estuarios, y lagunas costeras. 1977. 107-114. (1): 4 YÁÑEZ ARANCIBIA, y J. W. DAY, Jr. Coastal Lagoons. 0ceanologica Acta Vol. Spec. Ecological characterización of Terminos Lagoon, a tropical lagoon estuarine system the Southern Gulf of México Lasserre, P. y H. Postma (Eds.) 1982. 462 p., p. 431-440 (4): 5 YÁNEZ-ARANCIBIA. A. y A. LARA-DOMINGUEZ, An. Inst. Cienc. del Mar y Limnol, Univ. Nal. Atón. México Dinámica, ambiental de la Boca de Estero Pargo y estructura de sus comunidades de peces en cambios estacionales y crilos de 24-hrs (Laguna de Términos, sur del Golfo de México. 1983 85-116. (1): 10 YÁNEZ-ARANCIBIA, A. y P, SÁNCHEZ-GIL, An. Inst. Cienc. del Mar y Limnol. Univ. Nal. Autón. México Environmental behavior of Campeche Sound ecological system, off Terminos Lagoon, México: Preliminary results. 1983. 117-136. (1): 10 YÁÑEZ-ARANCIBIA, A. y A.L. LARA-DOMINGUEZ, Common Strategies of Anadromous and Catadromous Fishes. International Symposium. Trans. Am. Fis. Soc. (Abstract y Manuscrito). Biology and comparative ecology of three sea catfish species (Ariidae) with different life cycles in a tropical coastal ecosystem southerm Gulf of México. 1986. YÁÑEZ-ARANCIBIA, A., F. AMEZCUA LINARES J.W. DAY, Jr. Estuarine Perspetives Fish cormmunity structure and function in Terminos Lagoon, a tropical estuary in the Southern Gulf of Mexico V. Kennedy, (Ed.) Academic Press Inc. New York 1980 534 p., p. 465-482. YÁÑEZ-ARANCIBIA, A., F. AMEZCUA LINARES, P. SÁNCHEZ-GIL. I. VARGAS MALDONADO, A.L. LARA-DOMÍNGUEZ, S. DÍAZ RUIZ, A. AGUIRRE LEÓN y P. CHAVANCE, Estuaries Estuary -shelf fish community interactions in the southern Gulf of México: Fish-habitat comparison. 1981 295. (3): 4 YÁÑEZ-ARANCIBIA, A., A.L. LARA-DOMÍNGUEZ, P. SÁNCHEZ GIL, I. VARGAS MALDONADO, P. CHAVANCE, F. AMEZCUA LINARES, A. AGUIRRE LEÓN, S. DÍAZ RUIZ, Coastal Lagoons. Oceanologica Acta. Vol. Spec. Ecosystem dynamics and nichtemeral and seasonal programming of fish community structure in a tropical estuarine inlet, México Lasserre, P. y H. Postma (Eds.) 1982a. 462 p., p. 417 - 429. (4): 5 YÁÑEZ-ARANCIBIA, A., A,L. LARA-DOMÍNGUEZ, P. SÁNCHEZ GIL. H, ALVAREZ GUILLÉN, I: VARGAS MALDONADO, A. AGUIRRE LEÓN, M. TAPIA GARCÍA, MA. DE LA C. GARCÍA ABAD, D. FLORES HERNÁNDEZ, P. CHAVANCE, F. AMEZCUA LINARES, S. DÍAZ RUIZ, M. ALVAREZ, RUBIO y J.L. ROJAS GALAVIZ, Caracterización Ambiental del Sistema Ecológico y Análisis Comparativo de las Poblaciones de Peces de la Sonda de Campeche y, de la Laguna de Términos antes y después del Derrame Petrolero del Pozo IXTOC-I. (Informe Final). PCEESC / UNAM / ICML (IF), 4 partes 1982b. 211 p., 22 tabls., 49 figs. YÁÑEZ-ARANCIBIA, A., P. SÁNCHEZ-GIL, M, TAPIA GARCÍA y MA. DE LA C. GARCÍA ABAD, Ecology and community structure of demersal fish in Campeche Sound in the Southern Gulf of México: Ocean tropical resources. CNC / SCOR. Proceedings of the joint Oceanographic Assembli 1982 General Symposia. Canadian National Committee-Scientific Committee on Oceanic Research, Ottawa, Ont. 189 p. microfilm 3 1983a. 107. YÁÑEZ-ARANCIBIA, A., A.L. LARA-DOMÍNGUEZ, P. CHAVANCE y D. FLORES HERNÁNDEZ, An. Inst. Cienc. del Mar. y Limnol. Univ. Nal. Autón. México Environmental behavior of Terminos Lagoon ecological system, Campeche, México. 1983b. 137 - 176. (1): 10 YÁÑEZ-ARANCIBIA, A., P. SÁNCHEZ-GIL y A.L. LARA DOMÍNGUEZ, Patrón zoogeográfico de los peces demersales de la plataforma continental del sur del Golfo de México. In: Sympostum on the Biogeography of Mesoamerica, Mérida, 27-30 octubre 1984. (Resumenes). 1984 YÁÑEZ-ARANCIBIA, A., A.L. LARA-DOMÍNGUEZ y H, ALVAREZ GUILLÉN, Fish Community Ecology in Estuaries and Coastal Lagoons: Towards an Ecosystem Integration., UNAM-PUAL-ICML Fish community ecology and dynamic in estuarine inlets. Cap. 7 A. Yáñez Arancibia, (Ed.) Editorial Universitaria México 1985a. 654 p., 127-168 YAÑEZ-ARANCIBIA, A. y A. L. LARA-DOMÍNGUEZ, P. SÁNCHEZ-GIL, MA, DE LA C. GARCÍA ABAD, H. ALVAREZ GUILLÉN, M. TAPIA GARCÍA, D. FLORES HERNÁNDEZ y F. AMEZCUA LINARES, Fish Community Ecology in Estuaries and Coastal Lagoons: Towards an Ecosystem Integration., UNAM-PUAL-ICML Ecology and evaluation of fish community in coastal ecosystems: Estuary-shelf interrelationships in the Southern Gulf of México. Cap. 22 A. Yáñez-Arancibia, (Ed.) Editorial Universitaria México 1985b. 654 p., 475-498 YÁÑEZ-ARANCIBIA, A., G. SOBERÓN-CHÁVEZ, P. SÁNCHEZ-GIL, Fish Community Eco1ogy in Estuaries and Coastal Lagoons: Towards an Ecosystem Integration., UNAM-PUAL-ICM Ecology of control mechanisms of natural fish production in the coastal zone. Cap. 27 A. Yáñez-Arancibia, (Ed.) Editorial Universitaria México 1985c. 654 p., 571-594. YÁÑEZ-ARANCIBIA, A., A.L, LARA-DONÍNGUEZ, A. AGUIRRE LEÓN, S. DÍAZ RUIZ, F. AMEZCUA LINARES, D. FLORES HERNÁNDEZ y P. CHAVANCE, Fish Community Ecology in Estuaries and Coastal Lagoons: Towards an Ecosystem Integration. UNAM-PUAL-ICML Ecology of dominant fish population in tropical estuaries: Environmental factors regulating biological strategies and production. Cap. 15 A. Yáñez-Arancibia, (Ed,) Editorial Universitaria México 1985d. 654 p., 311-366. YÁÑEZ-ARANCIBIA, A., P. SÁNCHEZ-GIL, G. VILLALOBOS ZAPATA y R. RODRÍGUEZ-CAPETILLO, Recursos Pesqueros Potenciales de México: La Pesca Acompañante del Camarón. Distribución y abundancia de las especies dominantes en las poblaciones de peces demersales de la plataforma continental mexicana del Golfo de México, Cap. 8 A. Yánez-Arancibia, (Ed.) Progr. Univ. de Alimentos, Inst. Cienc. del Mar y Limnol., Inst. Nal. de Pesca. UNAM México D. F. 1985e. 748 p., 315-398. YÁÑEZ-ARANCIBIA, A., P. SÁNCHEZ-GIL, M. TAPIA GARCÍA y MA. DE LA C. GARCÍA ABAD, Cahiers de Biologie Marine Ecology, community structure and evaluation of tropical demersal fishes in the Southern Gulf of México. 1986. (El año de publicación es 1985). 137-163. 26 YOUNG, R.H., y J.M. ROMERO, Tropical Science Variability in the yield and composition of by-catch recovered from Gulf of California shrimping vessels. 1979. 249-269. (4): 21 ZETLER, B.D. y D.V. HANSEN, Contributions on the Physical Oceanography of the Gulf of Mexico. Tides in the Gulf of México. Capurro, L.R.A, and J.L. Reid (Eds.) Gulf Publishing Co. Texas A & M University Oceanographic Studies Houston, Texas 1972. 265-275. 2: Comentario Zoogeográfico y Anexo TaxonómicoEl sur del Golfo de México presenta una gran superficie de plataforma continental con complejas interacciones biológicas y físicas propias de la zona costera y alta diversidad de peces demersales y demerso-pelágicos. En el Prefacio de esta obra, se ha señalado que desde junio de 1978 hasta septiembre de 1985, se han efectuado 11 Cruceros Oceanográficos en la región. De esas capturas se han registrado más de 100 mil ejemplares de peces de 27O especies con 82 familias y 170 géneros. Estos peces muestran conjuntos de especies con afinidades templado-cálida, tropical y subtropical, de 76% (178 especies) con la Provincia Carolineana, 64% (150 especies) con la Provincia Caribeña y 3% (6 especies) con la costa del Pacífico de América en su área de contacto Panámico Californiano (Yánez-Arancibia et. al., 1984). La Provincia Carolineana de Hatteras a Florida y la Provincia Caribeña del sur de Florida a Brasil, tienen complicados límites de contacto ictiofaunístico por la influencia de las Antillas, los arrecifes de corales, y los ecosistemas lagunares estuarinos con pantanos, pastos marinos y manglares. Yánez-Arancibia et. al.(1984) han presentado evidencias sobre este. planteamiento, señalando que en este complejo tropical del Atlántico de América como foco de dispersión de especies, la heterogeneidad de ecosistemas, la alta diversidad de hábitats tropicales y subtropicales, y la elevada dependencia biológica de los peces por los procesos costeros, pueden ser factores que mantienen la alta diversidad de peces y dificultan caracterizar límites precisos de contacto Carolineano-Caribeño. El sur del Golfo de México presenta características ecológicas e ictiogeográficas que fundamentan esto. Para profundizar en aspectos de zoogeografía de los peces de la plataforma del Golfo de México, se sugiere consultar los trabajos de Gunter (1945), Baughman (1950), Hedgpeth (1953, 1954), Hildebrand (1954, 1955), Briggs (1958, 1970, 1973 y 1974), Springer y Woodburn (1960), Hildebrand et. al. (1964), Rosemblatt (1968), Starck (1968), Miller (1969), Chávez (1972), Hoese y Moore. (1977), Castro Aguirre (1978), Angel (1979), Darnell et al. (1983), Uyeno et. al. (1983), Yánez-Arancibia (1985a, 1985c y et al. 1984, 1986). Anexo taxonómico de los peces demersalesA. Clase Chondreichthys. Orden Squalifomes Suborden Galeoidei I. Familia Carcharhinidae 1. GéneroCarcharhinus Blainville, 1816 1.Carcharhinus remotus (Dumeril, 1865) II. Familia Sphyrnidae 2. GéneroSphyrna Rafinesque, 1810 2.Sphyrna fiburo (Linnaeus, 1758) Orden Rajiformes. Suborden Rhinobatoide III. Familia Rhinobatidae 3. GéneroRhinobatusBloch y Schneider, 1801 3.Rhinobatus lentiginosus (Garman, 1880) Suborden Rajidae IV. Familia Rajidae 4. Género Raja Linnaeus, 1758 4.Raja texana Chandler, 1921 5.Raja lentiginosa Bigelow y Schroeder, 1951 6. Raja olseni Bigelom y Schroeder, 1951 7. Raja eglanteria Bosc, 1800 V. Familia Dasyatidae 5. GéneroDasyatis Rafinesque, 1810 8.Dasyatis sabina (Le Sueur, 1824) 9.Dasyatis americana Hildebrand y Schroeder, 1928 Suborden Torpedinoidei VI. Familia Torpedinidae 6. GéneroNarcineHenle, 1813 10. Narcine brasiliensis (Olfers, 1813) 11. Narcinesp Suborden Myliobatoidei VII. Familia Myliobatidae 7. Género AetobatusBlainville, 1816 12. Aetobatus narinari(Euphrasen, 1790) VIII. Familia Urolophidae 8. Género Urolophus Muller y Henle, 1838 13. Urolophus jamacensis (Cuvier, 1817) IX. Familia Rhinopteridae 9. GéneroRhinoptera Cuvier, 1829 14.Rhinoptera bonasus Mitchill, 1815 X. Familia Squatinidae 10. GéneroSquatina Dumeril, 1806 15.Squatina dumerili Le Sueur, 1818 XI. Familia Muraenidae 11. GéneroGymnotoraxBloch, 1795 16.Gymnotorax nigromarginatus (Girard, 1859) XII. Familia Muraenesocidae 12. GéneroMuraenesox McClelland, 1844 17.Muraenesox savanna (Cuvier, 1829) 13. Género Paraxenomystax 18.Paraxenomystax bidentatus Reid, 1940 B. Clase 0steichthys. División I. Taenopaedia. Superorden Elopomorpha. Orden Anguilliformes. Suborden Anguilloidei XIII. Familia Congridae 14. GéneroCongrinaJordan y Hubbs, 1925) 19.Congrina flava(Goode y Bean, 1895) 15. GéneroAriosoma Swaison, 1838 20.Ariosoma balearicum de la Roche, 1809 21. Ariosoma sp XIV. Familia Nettastomatidae 16. GéneroHoplunnis Kaup, 1859 22.Hoplunnis diomedianus Goode y Bean, 1895 XV. Familia Ophichthidae 17. GéneroOphichthus Ahl, 1789 23.Ophichthus puncticeps (Kaup, 1859) 24.Ophichthus gomesii Castelnau, 1855 18. Género Echiopsis Kaup, 1856 25.Echiopsis mordax Kaup, 1860 Superorden Clupeomorpha. Orden Clupeiformes. Suborden Clupeoidei XVI. Familia Clupeidae 19. GéneroHerengula Cuvier y Valenciennes, 1847 26. Harengula jaguana Goode y Bean, 1879 20. Género Opisthonema Gill, 1861 27. Opisthonema oglinum (Le Sueur, 1817) 21. Género Sardinella Cuvier y Valenciennes, 1847 28. Sardinella aurita Cuvier y Valenciennes, 1847 22. GéneroBrevoortia Gill, 1861 29.Brevoorita gunteri (Hildebrand) XVII. Familia Engraulidae 23. GéneroAnchoa Jordan y Evermann, 1927 30.Anchoa hepsetus hepsetus (Linnaeus, 1758) 31. Anchoa lamprotaenia Hildebrand, 1943 32. Anchoa lyolepis (Evermann y Marsh, 1902) 24. GéneroCetengraulisGunther, 1868 33.Cetengraulis edentulus(Cuvier, 1829) División III. Euteleostei Superorden Protacanthopterygii. Orden Salmoniformes. Suborden Argentinoidei XVIII. Familia Argentinidae 25. GéneroArgentina Linaeus, 1758 34.Argentina striata Goode y Bean, 1895 Suborden Myctophoidei XIX. Familia Synodontidae 26. Género SynodusBloch y Schneider, 1801 35. Synodus intermedius(Agassiz, 1828) 36. Synodus foetens (Linnaeus, 1766) 37. Synodus poeyi Jordan, 1886 27. GéneroSaurida Cuvier y Valenciennes, 1849 38.Saurida brasiliensis (Norman y Regan, 1910) 28. Género Trachinocephalus Gill, 1861 39. Trachinocephalus myops Forster, 1801 Superorden Ostariophysi. Orden Siluriformes xx. Familia Ariidae 29. GéneroAriusCuvier y Valenciennes, 1840 40.Arius felis (Linnaeus, 1766) 30. GéneroBagre Oken, 1817 41.Bagre marinus (Mitchill, 1815) Superorden Paracanthopterygii. Orden Batrachoidiformes XXI. Familia Batrachoididae 31. GéneroPorichthys Girard, 1854 42.Porichthys porosissimus (Cuvier y Valenciennes, 1837) Orden Lophiiformes. Suborden Lophoioidei XXII. Familia Lophiidae 32. GéneroLophiodes 43.Lophiodes sp Suborden Antennaroidei XXIII. Familia Antennariidae 33. GéneroAntennariusLacépède, 1798 44. Antennarius scaber (Cuvier, 1817) 45. Antennarius ocellatus (Bloch y Schneider, 1780) XXIV. Familia Ogcocephalidae 34. GéneroOgcocephalus Fischer, 1813 46.Ogcocephalus raditans (Mitchill, 1818) 47. Ogcocephalus vespertilio(Linnaeus,1758) 48. Ogcocephalus nasustus(Cuvier y Valenciennes, 1837) 35. GéneroHalieutichihlysPoey, 1863 49.Haelleutichthys aculleatus (Mtchill, 1818) OrdenGadiformes. Suborden Gadioidei XXV. Familia Bregmacerotidae 36. GéneroBregmaceros Thompson, 1840 50.Bregmaceros atlanticus Goode y Bean, 1886 XXVI. Familia Gadidae 37. GéneroPhysculus Kaup, 1858 51.Physiculus kaupi Poey, 1866 38. Género Urophysis Gill, 1801 52.Urophycis cirratus Goode y Bean Suborden Ophidioidei XXVII. Familia Ophidiidae 39. Género Lepophidium Gill, 1863 53. Lepophidium brevibarbe (Cuvier, 1829) 54. Lepophidium marmoratum (Goode y Bean, 1885) 55. Lepophidium graellsi(Poey, 1861) 40. Génerootophidium Gill, 1885 56.Otophidium omostigma Jordan y Gilbert, 1882 41. Género BrotulaCuvier, 1829 57. Brotula barbata (Block y Schneider, 1801) 42. GéneroOphidium(Linnaeus, 1758) 58.Ophidion holbrookyPutnam, 1874 Suborden Macrouroidei XXVIII. Familia Macrouridae 43. GéneroSteindachneria Goode y Bean, 1888 59.Steindachneria argentea (Goode y Bean, 1896) Superorden Atherinomorpha. Orden Atheriniformes. Suborden Polymixioidei XXIX. Familia Belonidae 44. Género TylosurusCocco, 1829 60. Tylosurus acus(Lacépède, 1803) Superorden Acanthopterygii. Orden Beryciformes. Suborden Polymixioidei XXX. Familia Polymixiidae 45 Género PolymixiaLowe, 1838 61.Polymixia lowei Gunter, 1859 Suborden Berycoidei XXXI. Familia Trachichthydae 46. GéneroGephyroberyx Boulenger, 1902 62.Gephyroberyx darwinii (johnson, 1866) XXXII, Familia Holocentridae 47. GéneroHolocentrus Bloch, 1790 63.Holocentrus acencionis (Osbeck, 1765) 48. Género Adiorix Starks, 1908 64. Adiorix coruscus Poey, 1860 Orden Zeiformes XXXIII. Familia Antigoniidae 49. Género Antigonia Lowe,1843 65. Antigonia capros Lowe, 1843 Orden Gasterosteifomes. Suborden Aulostomoidei XXXIV. Familia Fistulariidae 50. GéneroFistularia Linnaeus, 1758 66.Fistularia petimba (Lacépède, 1803) XXXV. Familia Macrorhamphosidae 51 GéneroMacrorhamphosus Lacépède, 1803 67. Macrorhamphosus scolopax(Linaeus, 1758) Suborden Syngnatoidei XXXVI Familia Sygnathidae 52. GéneroHippocampus Rafinesque, 1810 68.Hippocampus hudsonius (De Kay, 1842) 53. Género Sygnathus Linnaeus, 1758 69. Sygnathus sp Orden Skorpaeniformes. Suborden Scorpaenoidei XXXVII. Familia Scorpaenidae 54. GéneroScorpaenaLinnaeus, 1738 70.Scorpaena plumieriBloch, 1789 71.Scorpaena calcarataGoode y Bean, 1882 72. Scorpaena disparLongley e Hildebrand, 1940 73. Scorpaena brasiliensis (Cuvier y Valenciennes, 1829 55. Género NeomerintheFowler, 1935 74. Neomerinthe hemingwayi 56. GéneroPontinus Poey, 1860 75.Pontinus longispinis Goode y Bean, 1895 XXXVIII, Familia Triglidae 57. GéneroPrionotusLacépède, 1802 76. Prionotus roseus Jordan y Evermann, 1886 77.Prionotus evolans (Linnaeus, 1766) 78.Prionotus tribulus Cuvier y Valenciennes, 1829 79. Prionotus punctatus Bloch, 1793 80. Prionotus beani Goode, 1896 81. Prionotus carolinus (Linnaeus, 1766) 82. Prionotus scitulus Jordan y Gilbert, 1882 83. Prionotus ophryasJordan y Swain, 1884 84. Prionotus stearnsiJordan y Swain, 1884 85.Prionotus salmonicolor (Fowler, 1903) 86. Prionotus martis Gingsburg, 1950 87.Prionotus griescens (Longley e Hildebrand, 1941) 88.Prionotus sp 1 89.Prionotus sp 2 58. GéneroBellator Jordan y Evermann, 1895 90.Bellator militaris Goode y Bean, 1896 91. Bellator sp 1 92.Bellator sp 2 93.Bellator sp 3 59. GéneroPeristedion Lacépède, 1802 94. Peristedion gracile Goode y Bean, 1896 Orden Dactylopteriformes XXXIX. Familia Dactylopteridae 60. GéneroDactylopterus Lacépède, 1802 95. Ddaylopterus volitans Linnaeus, 1758 Orden Perciformes. Suborden Percoidei XL. Familia Centropomidae 61. GéneroCentropomus Lacépède, 1802 96. Centropomus undecimalis (Bloch, 1792) XLI. Familia Serranidae 62. GéneroEpinephelus Bloch, 1793 97.Epinephelus nigritus Jordan y Gilbert, 1883 98. Epinephelus morio (Cuvier y Valenciennes, 1828) 99. Epinephelus niveatus(Valenciennes, 1828) 100.Epinephelus guttatus (Linnecusi, 1758) 63. GéneroMycteroperca Gill, 1862 101.Mycleroperca bonaci (Poey, 1861) 64. Género Diplectrum Holbrook, 1856 102. Diplectrum radiale (Qwoy y Gairmard, 1824) 103. Diplectrum formosus (Linnaeus, 1766) 65. Género Serranus Cuvier, 1817 104. Serranus atrobranchus (Cuvier, 1829) 105. Serranus phoebe Poey, 1852 106. Serranus subligarius(Cope) 66. GéneroCentropristisCuvier y Valenciennes, 1829 107. Centropristis ocyurus (Jordan y Evermann, 1886), 67. Género Hemanthias(Gingsburg) 108. Hemanthias leptus(Gingsburg, 1954) 68. Género PikeaSteindachner, 1874 109. Pikea mexicanaSchultz, 1958 69. GéneroParanthias Guichenot, 1868 110.Paranthias sp 70. GéneroSchultzea 111. Schultzea beta (Hildebrand) XLII. Familia Grammistidae 71. GéneroRypticusCuvier, 1817 112.Rypticus saponaceus(Bloch y Schneider, 1801) XLIII. Familia Priacanthidae 72. GéneroPristigenis Agassiz, 1835 113.Pristigenis alta (Gill, 1862) 73. Género Priacanthus Cuvier, 1817 114. Priacanthus arenatus Cuvier y Valenciennes, 1829 XLIV. Familia Percichthydae 74. Género Synagrops 115.Synagrops spinosa Schultz, 1940 116.Synagrops bellus (Goode y Bean, 1865) 75. Género Apogon Lacépède, 1802 117. Apogon maculatus (Poey, 1860) 118.Apogon pseudomaculatus Longley, 1940 XLV. Familia Branchiostegidae 76. Género Caulolatilus Gill, 1862 119. Cautolatilus intermedius Howell Rivero, 1936 XLVI. Familia Echeneidae 77. GéneroEcheneis Linnaeus, 1758 120.Echeneis naucrates Linnaeus, 1758 XLVII. Familia Carangidae 78. GéneroCaranx Lacépède, 1802 121.Caranx latus (Agassiz, 1829) 122.Caranx hippos (Linnaeus, 1766) 123.Caranx crysos (Mitchill, 1815) 124.Caranx ruber (Mitchill, 1845) 79. Género Chloroscombrus Girard, 1858 125. Chloroscombrus chrysurus(Linnaeus, 1766) 80. GéneroTrachuyusRafinesque, 1810 126.Trachurus lathamiNichols, 1920 81. Género SeleneLacépède, 1803 127. Selene vomer (Linnaeus, 1758) 128. Selene setapinnis (Mitchill, 1815) 129. Selene spixii (Swainson, 1839) 82. GéneroDecapterus Bleeker, 1855 130.Decapterus punctatus (Agassiz, 1829) 131. Decapterus tabl Berry, 1968 83. Género Selar Bleeker, 1850 132.Selar crumenophthalmus (Bloch, 1793) 84. Género HemicaranxBleeker, 1862 133. Hemicaranx amblyrhinchus (Cuvier, 1833) 85.Género Trachinotuslacépède, 1802 134. Trachinotus carolinus(Linnaeus, 1766) 135.Trachinotus falcatus (Linnaeus, 1758) 86. GéneroOligoplites Gill, 1863 136.Oligoplites saurus (Block y Schneider, 1802). XLVIII. Familia Imjanidae 87. GéneroRhomboplites Gill, 1862 137.Rhomboplites aurorubens (Cuvier y Valenciennes, 1862) 88. GéneroPristipomoidesBleeker, 1852 138.Pristipomoides macrophthalmus (Muller y Troschel, 1848) 89. Género Lutjanus Bloch, 1790 139.Lutjanus cyanopterus Jordan, 1886 140.Lutjanus synagris (Linnaeus, 1758) 141.Lutjanus campechanus (Poey, 1860) 142.Lutjanus analis (Cuvier, 1828) 90. Género Ocyurus Gill, 1862 143.Ocyurus chrysurus (Bloch, 1791) XLIX. Familia Gerreidae 91. GéneroEucinostomus Baird y Girard, 1855 144.Eucinostomus gula (Cuvier y Valenciennes, 1830) 145. Eucinostomus argenteus Baird y Girard, 146. Eucinostomus melanopterus(Bleeker, 1863) 92. GéneroDiapterus Ranzani, 1840 147.Diapterus rhombeus (Cuvier y Valenciennes, 1830) 148. Diapterus auratus (Ranzani, 1842) Familia Pomadasyidae 93. GéneroOrthopristi Girard, 1859 149.Orthopristis chrysoptera (Linnaeus, 1766) 94. Género Haemulon Cuvier, 1829 150. Haemulon aurolineatum Cuvier, 1829 151. Haemulon plumieri(Lacépède, 1802) 152. Haemulon boschmae Metzalaar, 1919 153. Haemulon striatum (Linnaeus, 1758) 154. Haemulon steindachneri(Jordan y Gilbert, 1882) 95. GéneroAnisotremas Gill, 1861 155.Anisotremus virginicus (Linnaeus, 1758) 96. Género Conodon Cuvier y Valenciennes, 1830 156. Conodon nobilis (linnaeus, 1758) 97. GéneroPomadasysLacépède, 1803 157.Pomadasys crocro (Cuvier y Valenciennes, 1830) LI. Familia Sparidae 98. Género Stenotomus Jordan y Evermann, 1896 158. Stenotomus caprinus (Bean, 1882) 99. GéneroArchosargusGill, 1865 159.Archosargus rhomboidalis(Linaeus, 1758) 160. Archosargus probatocephalus (Walbaum 1792) 100. GéneroLagodonHolbrook, 1855 161.Lagodon rhomboides(Linnaeus, 1766) 101. GéneroCalamus Swaison, 1839 162.Calamus penna (Cuvier y Valenciennes, 1830) 163. Calamus leucosteus Jordan y Gilbert, 1883 164. Calamus nodosusRandall y Caldwell, 1966 165. Calamus bajonado(Bloch y Schneider, 1801) LII Familia Sciaenidae 102. Género CynoscionGill, 1854 166. Cynoscion arenariusGinsburg, 1929 167. Cynoscion nothus(Holbrook, 1855) 103. GéneroBairdiella Gill, 1861 168.Bairdiella chrysoura Lacépède, 1803) 169. Bairdiella ronchus (Cuvier y Valenciennes, 1830) 104. GéneroMenticirrhusGill, 1861 170.Menticirrhus americanus(Linnaeus, 1758) 171. Menticirrhus saxatilis (Bloch y Schneider, 1801) 105. Género Stellifer Oken, 1817 172.Stellifer lanceolatusHolbrook, 1855 173.Stellifer colonensisMeek e Hildebrand, 1925 106. GéneroEquetus Rafinesque, 1815 174.Equetus lanceolatus (Linnaeus, 1758) 107. Género Pareques Gill, 1876 175. Pareques acuminatus Bloch y Schneider, 1801 176. Pareques umbrosus(Jordan y Eigemann, 1886) 177. Parequessp 108. Género MicropogoniasBonaparte, 1851 178. Micropogonias undulatus(linnaeus, 1766 109. GéneroUmbrina Cuvier, 1817 179.Umbrima coroides Cuvier y Valenciennes, 1830 110. Género Larimus Cuvier y Valenciennes, 1830 180. Larimus fasciatus Holbrook, 1855 111. GéneroOdontoscionGill, 1863 181.Odontoscion dentex(Cuvier, 1830) 112. GéneroCorvula Jordan y Eigemann, 1889 182.Corvula sanctae-luciae Jordan, 1890 113. Género Sciaena (Poey) 183.Sciaena sp LIII. Familia Mullidae 114. GéneroUpeneusCuvier, 1829 184.Upeneus parvus Poey, 1853 115. GéneroMulloidichthys 185.Mulloidichthys martinicus (Cuvier y Valenciennes, 1829) 116. Género MullusLinnaeus, 1758 186. Mullus auratusJordan y Gilbert, 1882 117. GéneroPseudopeneus Bleeker, 1862 187.Pseudopeneus maculatus (Bloch, 1793) LIV. Familia Ephippidae 118. GéneroChaetodipterus Lacépède, 1802 188. Chaetodipterus faber(Brussonet, 1782) LV. Familia Chaetodontidae 119. Género Chaetodon Linnaeus, 1758 189. Chaetodon sp 190.Chaetodon striatus Linnaeus, 1758 191.Chaetodon acellatus Bloch y Naturgesch, 1787 192. Chaetodon sedentarius Poey, 1860 193. Chaetodon aya Jordan, 1886 LVI. Familia Pomacanthidae 120. GéneroPomacanthus Lacépède, 1803 194. Pomacanthus arcuatus (Linnaeus, 1758) 121. GéneroHolacanthusLacépède, 1803 195. Holacanthus isabelita LVII Familia Pomacentridae 122. Género ChromisCuvier, 1814 196. Chromis scotti Emery, 1968 197. Chromis enchrysurus Jordan y Gilbert, 1882 Suborden Mugilidae LVIII. Familia Mugilidae 123. GéneroMugilLinnaeus, 1758 198. Mugil curemaValenciennes, 1836 Suborden Sphyraenoidei LIX. Familia Sphyraenidae 124. GéneroSphyraena Bloch y Schneider, 1801 199.Sphyraena guachancho Cuvier y Valenciennes, 1882 Suborden Polynemoidei LX. Familia Polynemidae 125. GéneroPolydactylus Lacépède, 1803 200. Polydactilus octonemus Girard, 1858 Suborden Labroidei LXI. Familia Labridae 126. GéneroLachnolaimusValenciennes, 1839 201.Lachnolaimus maximus (Walbaum 1792) 127. GéneroDecodon Gunther, 1862 202.Decodon puellaris (Poey, 1860) 128. Género Hemipieronotus Lacépède, 1802 203. Hemipteronotus novaculaLinnaeus, 1758 129. GéneroBodianus Bloch, 1790 204.Bodianus sp 130. GéneroHalichoeres Ruppell, 1835 205.Halichoeres caudalis Poey, 1860 206.Halichoeres garnoti (Valenciennes, 1839) LXII. Familia Scaridae 131. GéneroNicholsina Fowler, 1915 207.Nicholsina usta (Valenciennes, 1839) Suborden Trachinoidei LXIII. Familia Opistognathidae 132. GéneroLonchopisthus Gill, 1862 208.Lonchopisthus micrognathus (Poey, 1860) 209. Lonchopisthus lindneri Gingsburg, 1942 LXIV. Familia Percophididae 133. GéneroBembrops Steindachner, 1876 210.Bembrops anatirrostris Gingsburg, 1955 LXV. Familia Uranoscopidae 134. GéneroKathetostoma (Gunter, 1860) 211.Kathetostoma albigutta Bean, 1892 Suborden Blennioidei LXVI. Familia Callionymidae 135. GéneroCallionymus Linnaeus, 1758 212.Callionymus himantophorusGoode y Bean, 1895 Suborden Gobioidei LXVII. Familia Gobiidae 136. GéneroBolmannia(Jordan, 1889) 213.Bollmannia boqueronensis Evermann y Marsh, 1892 Suborden Acanthuroidei LXVIII. Familia Acanthuridae 137. GéneroAcanthurus y Forskal, 1775 214.Acanthurus bahianus Castelnau, 1885 Suborden Scombroidei LXIX. Familia Gempylidae 138. Género EpinnulaPoey, 1845 215. Epinnula orientalis(Gilchrist y Von Bonde, 1924) LXX. Familia Trichiuridae 139. GéneroTrichiurus Linnaeus, 1758 216.Trichiurus lepturus (Linnaeus, 1758) LXXI. Familia Scombridae 140. GéneroScomberomorus Lacépède, 1802 217. Scomberomorus maculalus(Mitchill, 1815) 141. GéneroScomberLinnaeus, 1758 218.Scomber japonicus(Gmelin, 1788) LXXII. Familia Ariommidae 142. GéneroAriomma Jordan y Schneider, 1904 219.Arlomma bondi Fowler, 1930 Suborden Stromatoidei LXXIII. Familia Stromateidae 143. GéneroPeprilus Cuvier, 1800 220.Peprilus paru (Linnaeus, 1758) 221.Peprilus triacanthus (Peck, 1800) Orden Pleuronectiformes. Suborden Pleuronectoidei LXXIV. Familia Bothidae 144. GéneroSyaciumRanzani, l840 222.Syacium gunteriGinsburg, 1933 223.Syacium micrurumGinsburg, 1933 224.Syacium papillo sum(Linnaeus, 1758) 145. GéneroAncylopsetta Gill, 1864 225.Ancylopsetta guadrocellata Gill, 1864 226. Ancylopsetta dilecta (Goode y Bean, 1883) 146. Género CyclopsettaGill, 1889 227. Cyclopsetta fimbriata(Goode y Bean, 1883) 228. Cyclopsetta chittendeniBean, 1894 147. GéneroTrichopsetta Gill, 1889 229.Trichopsetta ventralis (Goode y Bean, 1815) 148. Género GastropsettaBean, 1894 230. Gastropsetta frontalisBean, 1894 149. GéneroEngyophrysJordan y Bollman, 1890 231.Engyophrys senta Ginsburg, 1933 150. GéneroCitharichthys Bleeker, 1862 232.Citharichthys spilopterus Gunther, 1862 233. Citharichthys macrops Dresel, 1885 234. Citharichthys cornutus Gunther, 1862 151. Género Etropus Jordan y Gilbert, 1882 235. Etropus crossotusJordan y Gilbert, 1882 236. Etropus rimosus Goode y Bean, 1885 152. GéneroBothusRafinesque, 1810 237.Bothus ocellatus(Agassiz, 1831) 238.Bothus robinsiJutare, 1962 239.Bothus lunatus(Linnaeus, 1758) 153. GéneroMonolene Goode, 1880 240.Monolene sessilicauda Goode, 1880 LXXV. Familia Pleuronectidae 154. GéneroPoecilopsetta Gunter, 1888 241.Poecilopsetta beani (Goode, 1881) Suborden Soleoidei LXXVI. Familia Cynoglossidae 155. GéneroSymphurus Rafinesque, 1810 242.Symphurus plagiusa Linnaeus, 1766 243.Symphurus diomedianus (Goode y Bean, 1865) 244. Symphurus civitatusGingsburg, 1951 245. Symphurus parvusGingsburg, 1951 LXXVII. Familia Soleidae 156. GéneroGymnachirus Kaup, 1858 246.Gymnachyrus nudus Kaup, 1858 247.Gymnachyrus melas 157. GéneroAchirus Lacépède, 1803 248. Achirus lineatus (Linnaeus, 1758) 158. Género TrinectesRafinesque, 1832 249. Trinectes maculatus (Bloch y Schneider, 1801) Orden Tetraodontiformes. Suborden Balistoidei LXXVIII. Familia Monacanthidae 159. GéneroStephanolepis Gill, 1861 250.Stephanolepis hispidus(Linnaeus, 1766) 251. Stephanolepis setifer (Bennett, 1830) 160. GéneroAluterus Cuvier, 1817 Cloquet, 1816 252.Aluterus schoepfi (Linnaeus, 1766) 253.Aluterus monoceros Linnaeus, 1758 254.Aluterus heudeloti Hallard, 1855 255.Aluterus scripta (Osbeck, 1765) 161. Género MonacanthusCuvier, 1817 256. Monacanthus ciliatus(Mitchill, 1818) 257. Monacanthussp LXXIX. Familia Balistidae 162. GéneroBalistes Linnaeus, 1758 258.Balistes capriscus Gmelin, 1788 LXXX. Familia Ostraciidae 163. GéneroAcanthostracion Blecker, 1865 259.Acanthostracion quadricornis (Linnaeus, 1758) 164. Género LactophrysSwaison, 1758 260. Lactophrys trigonus(Linnaeus, 1758) Suborden Tetraodontoidei LXXXI. Familia Tetraodontidae 165. GéneroSphoeroides lacépède, 1798 261. Sphoeroides greeleyi (Gilbert, 1900) 262. Sphoeroides nephelus (Goode y Bean, 1758) 263. Sphoeroides dorsalisLongley, 1934 264. Sphoeroides spengleri(Bloch, 1782) 265. Sphoeroides pachygaster (Muller y Troschel, 1848) 166. Género Lagocephalus Swaison, 1839 266. Lagocephalus laevigatus (Linnaeus, 1766) LXXXII. Familia Diodontidae 167. GéneroChilomycterus Bibron, 1846 267.Chilomycterus schoepfi (Walbaum, 1792) 168. Género Diodon Linnaeus, 1758 268. Diodon hystrix Linnaeus, 1758 269.Diodon halocanthus Linnaeus, 1758
|

