|
MORFOLOGÍA, SISTEMÁTICA Y ZOOGEOGRAFÍA DE LAS MEDUSAS (CNIDARIA: HYDROZOA Y SCYPHOZOA) DEL PACIFICO TROPICAL ORIENTAL MORPHOLOGY, SYSTEMATICS AND ZOOGEOGRAPHY OF MEDUSAE (CNIDARIA: HYDROZOA AND SCYPHOZOA) FROM THE EASTERN TROPICAL PACIFIC
LOURDES SEGURA-PUERTAS
Universidad Nacional Autónoma de
México. Facultad de Ciencias Laboratorio de
Invertebrados.
Se
estudia la distribución y la abundancia de 61 especies de Hidromedusas
correspondientes a 5 órdenes, 22 familias y 40 géneros, y de 3
especies de Escifomedusas pertenecientes a 2 órdenes, 2 familias y 2
géneros, en la región epipelágica del Pacífico
Tropical Oriental. Las colecciones de plancton fueron obtenidas durante el
Proyecto EASTROPAC (Eastern Tropical Pacific) desde febrero de 1967 hasta marzo
de 1968.
Se exponen breves descripciones e ilustraciones
para cada una de las especies identificadas durante el presente
trabajo.
La distribución de las especies se analiza
en relación con las principales masas de agua de la zona
epipelágica características de la región del
Pacífico trópico-ecuatorial oriental, distinguiéndose
así dos categorías principales, medusas
trópico-ecuatoriales y medusas subtropicales. Una tercera
categoría se asigna para las especies que son comunes a ambas
localidades, y una cuarta para aquellas medusas procedentes de otras regiones
oceánicas.
En la primera categoría, medusas
trópico-ecuatoriales, se incluyen las siguiente
especies,Aequorea macrodactyla, Cunina frugifera, Cunina globosa,
Cunina octonariana, Cunina peregrina, Cunina tenella, Eucheilota comata,
Eucheilola menoni, Euphysilla pyramidata, Euphysora bigelowi, Gotoea similis,
Leuckartiara zacae, Lizzia alvarinoae, Lizzia ferrarii, Lizzia gracilis,
Nausithoë albatrossi, Octophialucium bigelowi, Phialidium simplex,
Phialidium uchidai, Podocoryne apicata, Podocoryne minima, Podocoryne simplex,
Proboscidactyla ornata, Rhopalonema funerarium, Sarsia coccomeira, Stomotoca
pterophylla, Tetrarchis erythrogaster y Toxorchis
polynema.
En cuanto a las medusas subtropicales se
distinguen, Aeginura beebei, Aequorea coerulescens, Amphogona
apsteini, Bougainvillia fulva, Cunina duplicata, Dipleurosoma pacificum,
Ectopleura dumortieri, Ectopleura sacculifera, Euphysora furcata, Haliscera
bigelowi, kanaka pelagica, Pachycordile sp, Pandea sp y Podocoryne
carnea.
Por lo que se refiere a las medusas que son
comunes en las regiones tropicales y subtropicales se
encuentran,Aegina citrea, Aglaura hemistoma, Amphogona apicata,
Cytaeis tetrastyla, Geryonia probosciadalis, Liriope tetraphylla,
Nausithoë punctata, Pegantha clara, Pegantha martagon, Pegantha
tríloba, Pelagia noctiluca, Phialopsis diegensis, Rhopalonema velatum,
Sminthea eurygaster, Solmaris rhodoloma, Solmudella bitentaculata, Zanclea
costata y Zanclea orientalis.
Por último,
entre las medusas procedentes de otras regiones oceánicas
aparecen,Bythotiara drygalskii, Halitholus Intermedius, Halitholus
pauper y Pochella polynema. Entre las especies de Hidromedusas
identificadas, 16 especies, Amphogona apicata, Dipleurosoma pacificum,
Eucheilota menoni, Euphysora bigelowi, Euphysora furcata, Euphysora pyramidata,
Gotoea similis, Kanaka pelagica, Lizzia gracilis, Phialidium simplex,
Phialidium uchidai, Podocoryne apicata, Podocoryne carnea, Podocoryne minima,
Podocoryne simplex y Zanclea orientalis, conocidas previamente para
otras regiones oceánicas se observan por primera vez en las aguas del
Pacífico Tropical Oriental, así como 3 especies que hasta la
fecha habían sido consideradas típicas de otras
latitudes(Halitholus intermedius, Halitholus pauper y Pochella
polynema.)
La mayoría de las especies
muestran una distribución errátil tanto en el tiempo como en el
espacio a lo largo de los 5 periodos bimestrales estudiados, siendo
únicamente algunas especies,Aglaura hemistoma, Amphogona
apicata, Liriope tetraphylla, Rhopalonema velatum y Solmundella
bitentaculata las que presentan una aparición continua y
abundante a lo largo de este periodo. Se discuten las variaciones en la
distribución bimestral de las especies, en relación con el
régimen climático y dinámico oceánico. Dichas
fluctuaciones cuantitativas aparecen representadas en los mapas
correspondientes para cada una de las especies
identificadas.
El análisis que se efectuó para
detectar organismos asociados a las medusas, reveló la presencia de
numerosos anfípodos símbiontes, incluyendo una sola
especie,Thamneus platyrrhynchus en la
EscifomedusaPelagia noctiluca. Así mismo, se
observó la presencia de larvas de Narcomedusas adheridas a las regiones
subumbrelares de 2 especies de Hidromedusas, Rhopalonema velatum y
Aglaura
hemistoma.
The distribution and abundance of 61 species of Hydromedusae corresponding to 5
orders, 22 families, and 40 genera, and 2 species of Scypliomedusae belonging
to 2 orders, 2 families and 2 genera are studied in the Eastern Tropical
Pacific epipelagic region. The samples were taken during the EACTROPAC (Eastern
Tropical Pacific) Project, from february 1967 until mardi
1968.
Brief descriptions and illustrations are given for each
species.
The distribution is related to the main water masses
of the epipelagic zone of the Eastern tropico-equatorial Pacific ocean. Two
main categories of species are found: tropico-equatorial medusae, and
subtropical medusae. A third category is assigned to species common to both
areas, and a fourth for medusae from other oceanic regions. The
tropico-equatorial medusae include:Aequorea macrodactyla, Cunina
frugifera, Cunina globosa, Cunina octonaria, Cunina peregrina, Cunina tenella,
Eucheilota comata, Eucheilota menoni, Euphysilla pyramidata, Euphysora
bigelowi, Gotoea similis, Leuckartiara zacae, Lizzia alvarinoae, Lizzia
ferrarii, Lizzia gracilis, Nausithoë albatrossi, Octophialucium
bigelowi, Phialidium simplex, phialidium uchidai, Podocoryne apicata,
Podocoryne minima, Podocoryne simplex, Proboscidactyla ornata, Rhopalonema
funerarium, Sarsia coccometra, Stomotoca pterophylla, Tetrorchis erythrogaster
and Toxorchis polynema.
The subtropical medusae
found are: Aeginura beebei, Aequorea coerulescens, Amphogona apsteini,
Bougainvillia fulva, Cunina duplicata, Dipleurosoma pacificum, Ectopleura
dumortieri, Ectopleura sacculifera, Euphysora furcata, Haliscera bigelowi,
Kanaka pelagica, Pachycordile sp, Pandea sp and Podocoryne
carnea.
Species common to both areas are: Aegina
citrea, Aglaura hemistoma, Amphogona apicata,Cytaeis tetrastyla,
Geryonia proboscidalis, Liriope tetraphylla, Nausithoë punctata.,
Pegantha clara, Pegantha martagon, Pegantha triloba, Pelagia noctiluca,
Phialopsis diegensis, Rhopalonema velatum, Sminthea eurygaster, Solmaris
rhodoloma, Solmundella bitentaculata, Zanclea costata, and Zanclea
orientalis.
Species from other oceanic
regions:Bythotiara drygalskii, Halitholus intermedius, Halitholus
pauper and Pochella polynema.
Sixteen species
previously known as typical of other oceanic regions were observed for the
first time in the Eastern Tropical Pacific: Amphogona apicata,
Dipleurosoma pacificum, Eucheilota menoni, Euphysora bigelowi, Euphysora
furcata, Euphysilla pyramidata, Gotoea similis, Kanaka pelagica, Lizzia
gracilis, Phialidium simplex, Phialidium uchidai, Podocoryne apicata,
Podocoryne carnea, Podocoryne minima, Podocoryne simplex and Zanclea
orientalis. Similary, Halitholus intermedius, Halitholus Pauper and Pochella
polynema, species typical of high latitudes.
During
the 5 bimonthly periods studied here, most of the species show random,
distribution in time and space. However,Aglaura hemistoma, Amphogona
apicata, Liriope tetraphylla, Rhopalonema velatum and Solmudella
bitentaculata appeared continuosly and abundantly in the collections.
Variation in the bimonthly distribution of the species are discussed in
relation to the ocean and atmosphere regimes. Distribution maps are also
included.
Several Amphipoda,Thamneus
platyrrhynchus specimens were observed in symbiotic association with
the Scyphomedusae pelagia noctiluca. Also, larvae of
Narcomedusae were detected attached to the subumbrelar regions of Rhopalonema
velatum and Aglaura
hemistoma(Hidromedusae).
Las medusas en conjunto han recibido bastante atención por parte de los zoólogos, aunque pocos planctólogos se han ocupado de este grupo de suma importancia, desde varios puntos de vista, en el campo de la ecología marina. Las medusas desempeñan un papel importante en la economía del mar por sus hábitos depredadores y como organismos competidores en alimento con los peces y otros animales de importancia comercial (Russell, 1970). Sus mecanismos de desplazamiento son débiles, y así pueden proporcionar una gran ayuda como organismos indicadores de masas de agua y corrientes. Por último se consideran importantes desde el punto de vista biomédico debido a que algunas especies son extremadamente tóxicas y constituyen un verdadero peligro para los nadadores (Russell, 1965; Halstead, 1966-68; Phillips y Burke, 1970). Además las toxinas y compuestos obtenidos de las medusas, están empleándose en la elaboración de medicamentos (Barnes y Horridge, 1965; Tabrah et al, 1972). El presente estudio se basa en el análisis de las colecciones de plancton obtenidas en las series de Cruceros Oceanográficos efectuados durante el Proyecto EASTROPAC (Eastern Tropical Pacific) en el periodo febrero 1967-marzo 1968. Las muestras fueron obtenidas durante la noche en la mayoría de las estaciones, y a diversas profundidades en la región del epiplancton (0-200m). El propósito fundamental de este trabajo es determinar la composición y abundancia relativa de las medusas que habitan la zona epipelágica del Pacífico Tropical Oriental y establecer las afinidades zoogeográficas de esta composición faunística. Otros objetivos que se abarcan además, comprenden la distribución de las especies en las diversas estaciones del año, la determinación de las especies indicadoras y sus relaciones ecológicas y oceanográficas, así como elucidar el significado ecológico de los organismos asociados con las medusas. Los trabajos publicados sobre las medusas en el Pacífico Tropical Oriental son escasos y esporádicos (Agassiz y Mayer, 1902; Bigelow, 1909, 1940; Kramp, 1956, 1968; Alvariño, 1970, 1972, 1976). La mayor parte de ellos proporcionan listas de especies, descripciones y notas sobre la distribución y sistemática de este grupo tan complejo. Otros trabajos corresponden a material recolectado en determinadas regiones de escasa amplitud o bien se basan en los estudios aislados de algunas especies en particular. Uno de los primeros trabajos efectuados en el área de este estudio fue el de Agassiz y Mayer (1902) quienes determinaron 20 especies de Hidromedusas obtenidas durante la Expedición "Albatross" (1899-1900) entre San Francisco, Calif, y las Islas Marquesas en el Pacífico Tropical. Bigelow (1909) publicó uno de los trabajos más extensos sobre la distribución geográfica de las medusas en el Pacífico Tropical Oriental, proporcionando excelentes descripciones e ilustraciones de 72 especies, las cuales incluyen 2 géneros y 17 especies nuevas. En otra publicación Bigelow (1940) determina 20 especies de medusas al analizar el material recolectado durante la expedición "Eastern Pacific Zaca" realizada durante 1937-1938 a lo largo de las costas del Pacífico centro americano, desde Costa Rica hasta Panamá. Kramp (1956) basándose en el material recolectado en el Pacífico Tropical Oriental por el Dr. Cyril Crossland en 1923-1925, proporciona una lista de 9 especies de medusas, aportando algunas consideraciones acerca de su distribución. Smith (1925) estudia las medusas de agua dulce que habitan la zona del Canal de Panamá. Alvariño (1970) discute las especies de medusas del cinturón trópico-ecuatorial oceánico. En otros trabajos, Alvariño (1972, 1976, 1977) estudia las medusas del Pacífico mexicano, centro americano y ecuatoriano. Otros trabajos de importancia efectuados a través del Océano Pacífico incluyen a Bigelow (1913) y Kramp (1928, 1962, 1965 y 1968) de los cuales el último puede ser considerado como básico y fundamental, al tratarse de un estudio extenso de las hidromedusas que habitan los océanos Indico y Pacífico. Dicho trabajo incluye diagnosis, ilustraciones, algunas claves para la identificación, discutiéndose además aspectos zoogeográficos y comparando la fauna del Océano Pacífico con la del Atlántico. En regiones geográficas adyacentes al área de estudio, Bigelow (1914) publica algunas notas sobre la medusa del Género Stomolophus de San Diego, California. Kishinouye (1899) y Fewkes (1889) estudian algunas medusas de California, describiendo el primero de ellos una especie nueva. Torrey (1909) analiza y determina 11 especies de Leptomedusas para la región de San Diego, California. Hyman (1947) describe 2 especies nuevas de hidromedusas con hábitos semisedentarios en la zona litoral de las costas de California. Kramp (1962) discute las afinidades específicas de algunas especies dePhialidiumrecolectadas en las costas del Pacífico norteamericano. Alvariño (1967, 1969 y 1980) define la distribución batimétrica de las medusas de San Diego, California, estudia y determina las medusas del Mar de Cortés, e identifica las medusas presentes en la Corriente de California durante los años de 1954 y 1958. Por otro lado, al sur de la zona de estudio, Mann y Zapfe (1950) describen una especie nueva para Chile. Kramp (1952, 1966 y 1968) estudia y determina las medusas que habitan la zona costera de Chile, así como las que se encuentran en el Sistema de Corrientes de Perú. Fagetti (1973) identifica las especies meso y batipelágicas de las aguas chilenas e incrementa el conocimiento de otras especies epipelágicas en dicha zona. En México hasta la fecha, se han efectuado pocos trabajos referentes al estudio de las medusas, entre éstos podemos citar los de Chávez (1966) y Signoret (1969), ambos limitados a las lagunas costeras del Golfo de México. En particular no se ha desarrollado algún trabajo en la región del Pacífico Tropical Oriental. ÁREA DE ESTUDIOEl Pacífico Tropical Oriental es una región que se extiende entre el Trópico de Cáncer (23º27'N) y el Trópico de Capricornio (23° 27'S) y desde las costas de México Centro América y América del Sur hasta los 1300 longitud Oeste. En el norte esta región está limitada por la zona sur de la Corriente de California y porciones de la Corriente Ecuatorial Septentrional y al sur por la rama nórdida de la Corriente de Perú y ramales de la Corriente Ecuatorial Meridional. Esta área tiene una estructura poco común en cuanto a la temperatura, el oxígeno y la salinidad. La razón de estas estructuras particulares no ha sido aún definida perfectamente, pero tiene que estar en relación con la localización de la zona, su posición relativa con respecto al resto del Océano Pacífico y al Continente Americano, la disposición de las islas adyacentes y el sistema de corrientes y contracorrientes. Estos factores en conjunto se entrelazan con una circulación global oceánica y atmosférica para producir una masa de agua con una temperatura relativamente alta en las capas superficiales, salinidades bajas y una capa de contenido mínimo de oxígeno que abarca algunos estratos de varios metros por debajo de la termoclina, la cual se localiza en el estrato de los 100 metros próximos a la superficie oceánica. A partir de 1950 se ha incrementado y canalizado el interés y la atención en esta zona del Pacífico Tropical Oriental, debido a que es una región de fertilidad elevada en donde se encuentran pesquerías de gran importancia y además en esta región se han observado problemas específicos de gran interés desde el punto de vista oceanográfico, que hay que estudiar con detalle y amplitud para poder discutir y conocer mejor el ámbito oceánico y las relaciones complejas que se producen entre los factores bióticos y abióticos. La mayoría de las expediciones realizadas en esta región han sido efectuadas y patrocinadas por la Institución Scripps de Oceanografía, EUA. Las operaciones de "California Cooperative Oceanic Fisheries Investigations", que se iniciaron en el año de 1949 y continúan hasta el presente, se extienden a lo largo del estado de California hasta el límite de la Península de Baja California, proporcionando así mensualmente datos y observaciones de incalculable valor durante todo este amplio periodo. A partir de 1952 una serie de Cruceros y Expediciones han cubierto la zona de la Corriente de Perú y la región trópico ecuatorial oriental del Pacífico. La expedición "Shellback" en 1952 fue la primera en cubrir completamente la región del Pacífico Tropical Oriental y además, Capricorn (1952), Scofield (1953), Eastropic (1955), Productivity Scope (1956), Dowind (en parte) en 1957-1958, Bondy (1958), Scot (en parte) en 1958, Costa Rica Dome (1959), Step (1960), Thetis (en parte) 1960, Bonacca (1963), Esmeralda (1963), Red Rooster (1963), Papagayo (1965), Swansong (1955), Acento (1965-66), Eastropac (1967-68), Piquero IV y V (1969). TOPOGRAFÍAEl fondo oceánico en esta región forma parte de la cuenca más grande localizada en el Océano Pacífico. Las profundidades en general son del orden de los 3500 y 4500m. La plataforma continental es angosta y el talud continental es inclinado. La plataforma continental alcanza los 50 km de amplitud solamente a lo largo de las costas de México y América Central, entre el Golfo de Tehuantepec y Nicaragua, en el Golfo de Panamá, y a lo largo de las costas del Perú, entre 7ºS y 11ºS (Fisher y Raitt, 1962). La fosa de Acapulco excede los 6200 m de profundidad, cerca de los 14ºN 94ºW y lejos de las costas de Perú, la fosa Perú-Chilena, excede los 8000 m de profundidad a los 21ºS (Fisher y Raitt, 1962). Las Islas Galápagos se encuentran conectadas con Centro América mediante la cordillera Cocos, y con Ecuador por medio de otra cordillera que se extiende hacia el este. CIRCULACIÓN SUPERFICIALLa circulación de las aguas en los estratos de superficie en el Pacífico Tropical Oriental, cambia considerablemente en respuesta a las variaciones en los sistemas de vientos dominantes en esta zona. La circulación se encuentra dominada por las regiones este y ecuatorial de los remolinos anticiclónicos en el norte y en el sur del Océano Pacífico. En el norte éstos proceden de la Corriente de California y la Corriente Septentrional, y en el sur, de la Corriente de Perú y de la Corriente Ecuatorial Meridional. Entre estos dos remolinos, se desarrolla la Contracorriente Ecuatorial, cuando la zona de convergencia intertropical se encuentra suficientemente lejos al norte del Ecuador (Wyrtki, 1966). Debido a la configuración del océano, estos dos remolinos no penetran en una zona del Pacífico Tropical Oriental, entre Cabo Corrientes y Ecuador, por lo que esta región tiene una circulación variable y compleja. TEMPERATURA Y SALINIDAD EN LOS ESTRATOS SUPERFICIALES
TemperaturaWyrtki (1965) trabajando con todos los datos disponibles sobre la distribución de la temperatura superficial en esta región, ha destacado claramente algunos hechos de interés. Ha confirmado el flujo de agua cálida situado lejos de las costas de Perú. Estipula que el agua cálida localizada lejos de las costas de Centro América, no es tan homogénea como se había considerado previamente y observa claramente los efectos de surgencia en el Golfo de Tehuantepec y en el Golfo de Panamá durante determinados meses del año. Los resultados de un análisis minucioso de las temperaturas en los estratos superficiales en el Océano Pacífico, revelan que en el Pacífico Tropical Oriental, el cambio continuo de la fase de la progresión anual de temperatura se realiza desde el hemisferio sur hacia el hemisferio norte (Wyrtki, 1965). SalinidadLas cartas y mapas elaborados por Schott (1935) y Bennett (1966), muestran algunos rasgos característicos de los cambios estacionales de la salinidad en los estratos superficiales. La variación estacional de la salinidad superficial es relativamente débil en la zona sur del Océano Pacífico, así como en la Corriente de California. En el Pacífico Oriental dichos cambios estacionales son mucho más grandes, especialmente en los alrededores del Golfo de Panamá. Desde las costas de Centro América se extiende una zona hacia el oeste, cerca de los 10ºN, con salinidad por debajo de 34%. Esta zona varía ligeramente en latitud con respecto a las estaciones anuales, desplazándose hacia el sur durante los meses de abril-junio y hacia el norte durante la segunda mitad del año. Las aguas del Golfo de California con elevada salinidad, se encuentran conectadas durante todo el año con las aguas subtropicales del Pacífico Norte también con alta salinidad, por medio de aguas con salinidades que varían entre 34.0 y 34.5%. Estas aguas separan las aguas de la Corriente de California de las aguas tropicales superficiales, ambas con salinidades bajas. FRENTES OCEÁNICOSUno de los frentes más pronunciados en lalitudes bajas es el frente ecuatorial, el cual se extiende desde las costas de Ecuador hacia el noroeste, corta el Ecuador hacia el este de las Islas Galápagos y se continúa entre 1º y 3ºN hacia el oeste (Fig. 1) . Este frente aparece muy marcado cerca de la costa y se va debilitando progresivamente a medida que avanza hacia el oeste, donde se destruye debido a la mezcla de aguas. Al parecer este frente no es continuo a lo largo de su trayectoria, sino que está constituido por algunos segmentos individuales (Wyrtki, 1966). Este frente separa las aguas tropicales con elevada temperatura y baja salinidad, de las aguas más frías con alta salinindad procedentes de la Corriente de Perú. En el extremo sur de la Península de Baja California se distinguen otros frentes, entre las aguas de la Corriente de California y las del Golfo de California y entre el Golfo de California y el avance costero de la Contracorriente Ecuatorial. En el primero de ellos, la diferencia en densidad es pequeña debido a la mezcla de las aguas frías con baja salinidad de la Corriente de California y las aguas cálidas con elevada salinidad del Golfo de California. Dicho frente aparece perfectamente marcado cerca de Cabo San Lucas desvaneciéndose progresivamente hacia el suroeste, debido probablemente, a que el Golfo de California aporta solamente pequeñas cantidades de agua. MASAS DE AGUA EN LA ZONA EPIPELÁGICAEn los estratos del mar más próximos a la superficie se encuentran básicamente involucrados tres tipos diferentes de aguas: a) agua superficiel tropical con elevada temperatura y baja salinidad, b) agua superficial subtropical de elevada salinidad, generalmente aguas cálidas aunque con temperaturas variables y c) aguas frías de salinidad baja y originadas en las altas latitudes de los hemisferios boreal y austral respectivamente (Fig. l). Los límites entre estas masas de agua obviamente se encuentran sujetos a fluctuaciones con las estaciones del año, y en la mayoría de los casos se trata de zonas limítrofes más que frentes (Wyrtki, 1966). La masa de agua superficial tropical se localiza en las regiones donde las temperaturas en las aguas epipelágicas son altas y sus variaciones con la estación del año son de escasa amplitud y donde la salinidad es baja debido a las intensas precipitaciones pluviales. En el Pacífico Tropical Oriental estas aguas se localizan en una región donde las aguas de superficie alcanzan una temperatura de más de 25ºC, y con salinidades generalmente inferiores a 34%. El límite sur de estas aguas se extiende desde el Ecuador hacia el norte de las Islas Galapagos y continúa al oeste, donde coincide aproximadamente con el límite sur de la Contracorriente Ecuatorial. El límite norte de esta masa de agua puede identificarse aproximadamente al nivel de la isoterma de 25ºC, cerca de los 15º latitud Norte, límite que fluctúa a través de todo el año en unos 5º de latitud. 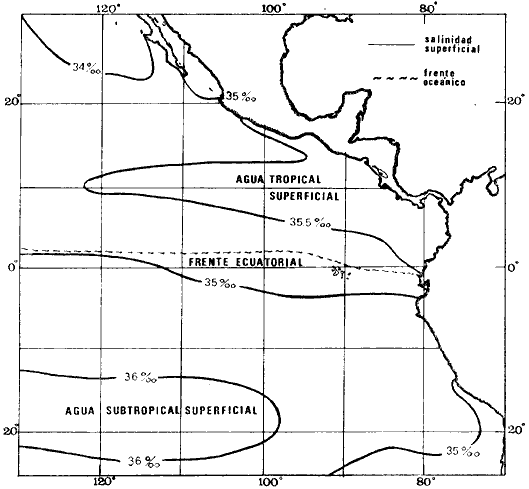 Fig. 1. Distribución de las principales masas de agua superficiales en el Pacífico Tropical Oriental, así como la localización del frente oceánico ecuatorial (Wyrtki,1996). La masa de agua subtropical de superficie en el hemisferio sur del Océano Pacífico, se localiza en las regiones donde la evaporación es mucho más intensa que las precipitaciones pluviales. Estas aguas se caracterizan por una elevada salinidad, sin embargo la temperatura varía dentro de una fluctuación amplia que va de 15º a 28ºC. Las aguas con las salinidades más elevadas se localizan entre los 12º y 25º latitud sur y entre 100º y 150º longitud oeste, donde las salinidades alcanzan más de las 36%. Los límites norte y este de esta masa de agua no se encuentran determinados con precisión. El límite norte no coincide con el límite sur de la masa de agua superficial tropical, debido a que entre estas dos masas de agua existe otra cuyas propiedades son intermedias entre ambas, y se denomina masa superficial ecuatorial. Estas aguas no son el producto de una mezcla entre las dos masas de agua adyacentes, ya que sus propiedades se encuentran determinadas por la advección estacional de aguas más frías que proceden de la Corriente de Perú y las surgencias en la región ecuatorial. El agua de la Corriente de California es de temperatura moderada y de salinidad baja. Esta Corriente fluye hacia el sur y se desvía hacia el oeste a la altura de las costas de Baja California para continuar el circuito con la Corriente Septentrional, ya que las aguas procedentes de la Corriente de California han perdido allí ya totalmente su identidad. Así, la temperatura y la salinidad de las aguas de la Corriente de California, se incrementan a lo largo de su trayecto frente al continente norteamericano, hasta que se convierten en las aguas superficiales subtropicales del Océano Pacífico Septentrional. No existen límites entre las aguas subtropicales y tropicales, sin embargo se observan transiciones graduales en sus propiedades. CIRCULACIÓN
Corriente ecuatorial subsuperficialEl descubrimiento de esta corriente por Cromwell en 1952, modificó completamente el concepto que se tenía de la circulación ecuatorial, y muchos de los fenómenos inexplicables hasta ese momento, pueden ahora comprenderse perfectamente. Se trata de una corriente que se desplaza a profundidades por debajo de la superficie, simétrica con respecto al Ecuador y su flujo alcanza unos 300 km de extensión, y estratos de 200 m de altura. Por encima de esta corriente existe una capa de unos 20-50 m de altura la cual se mueve hacia el oeste. La Corriente Subsuperficial Ecuatorial afecta considerablemente la distribución de las masas de agua en el Pacífico Tropical Oriental. Contracorriente ecuatorialLa existencia de esta corriente se conoce desde hace mucho tiempo. Esta corriente fluye hacia el este a través de todo el Océano Pacífico, y se extiende entre las corrientes ecuatoriales septentrional y meridional. La velocidad, la amplitud, y el transporte de dicha corriente, varían considerablemente con respecto a las estaciones del año, y aún durante periodos más cortos, observándose en ocasiones que de un día para otro, se producen variaciones drásticas (Knauss, 1961). Lejos de las costas de América Central, la contracorriente se bifurca y una de sus ramas, la más intensa, se desvía generalmente hacia el norte, alrededor del Domo de Costa Rica, formando asi la Corriente Costera de Costa Rica, la cual aporta su flujo a la Corriente Ecuatorial Septentrional. Corriente ecuatorial septentrionalLa Corriente Ecuatorial Septentrional es una continuación del flujo procedente de la Corriente de California, al que se integran aguas de la Contracorriente Ecuatorial y aguas ascendentes del Pacífico Tropical Oriental. La contribución de estas corrientes varía con las estaciones del año. La mayor parte del flujo de la Corriente Ecuatorial Septentrional se encuentra concentrada en los estratos de 300 m a 0 m. Corriente ecuatorial meridionalEsta corriente se desarrolla como resultado de la actividad de los vientos alisios en el hemisferio sur del Océano Pacífico. Los límites de esta corriente están en el norte determinados por la Contracorriente Ecuatorial, aproximadamente a los 4º latitud Norte, al sur se extiende en las proximidades de los 10º latitud Sur y se continúa hacia el oeste y suroeste con velocidades menores y de valores irregulares. En el ecuador la Corriente Ecuatorial Meridional alcanza solamente estratos de 20-50 m de grosor, incrementándose en este valor considerablemente hacia la zona sur, en donde alcanza hasta cerca de los 200 m de profundidad. Esta corriente está alimentada por las aguas que vienen directa o indirectamente de la Corriente Subsuperficial Ecuatorial. Corriente del PerúLa Corriente del Perú, o mejor dicho el sistema de la Corriente del Perú, está formado por algunas ramas más o menos independientes que accionan entre sí de manera compleja. Dicho sistema está integrado por una corriente costera y una corriente oceánica. Entre estas dos corrientes existe una contracorriente que fluye hacia el sur primordialmente como una corriente subsuperficial. La corriente costera se extiende aproximadamente hasta los 15º latitud sur, donde la mayor parte de su flujo gira alejándose gradualmente de la costa. La contracorriente transporta agua subsuperficial ecuatorial de elevada salinidad y contenido bajo en oxígeno, y así aporta la mayor parte del agua involucrada en los procesos de surgencia que se producen a lo largo de estas costas, al norte de los 15º latitud sur. Al sur de esta latitud, la surgencia está alimentada por las aguas de las capas inferiores de la corriente costera, las cuales ostentan notaciones de salinidad relativamente bajas. A lo largo de la costa la surgencia alcanza lechos poco profundos, y los movimientos ascendentes se encuentran restringidos dentro de los estratos de 100 m a los 0 m. Lejos de la costa los movimientos ascendentes alcanzan, sin embargo, niveles de mayor profundidad. La corriente oceánica interacciones muy poco con los procesos complejos que se producen cerca de la costa. Esta corriente fluye hacia el norte, alcanzando velocidades apreciables, y se extiende a unos 700 m de profundidad. MATERIAL Y MÉTODOSLas colecciones de plancton analizadas durante el presente trabajo fueron obtenidas durante el ProyectoEASTROPAC (Eastern Tropical Pacific) desde febrero 1967 hasta marzo 1968. Este proyecto ha sido uno de los más amplios efectuados, realizándose una serie de Cruceros Oceanográficos patrocinados y financiados en colaboración por el Departamento del Interior de los Estados Unidos, el Servicio de Costas de los Estados Unidos, así como la Oficina de Investigaciones Oceanográficas de la Marina, actuando de coordinador el Bureau of Commercial Fisheries (ahora National Marine Fisheries Service, La Jolla, California). La expediciónEASTROPAC se dividió en 7 periodos de 2 meses cada uno. En los periodos bimestrales de febrero-marzo, agosto-septiembre 1967 y febrero-marzo 1968, se llevaron a cabo varios cruceros. Estos cruceros cubrieron un área comprendida entre 20º latitud norte y 20º latitud sur (15ºS en agosto-septiembre 1967) y desde la zona costera del Continente Americano hasta los 119º longitud oeste (126º W en febrero-marzo 1967). Durante los periodos bimestrales de abril-mayo, junio-julio, octubre-noviembre 1967 y de diciembre 1967-enero 1968 los cruceros fueron independientes. Cada uno de estos cruceros cubrió un área entre 200 latitud norte y 3º latitud sur y entre 98 y 119º longitud oeste. En el presente trabajo se analiza el material recolectado durante cinco periodos bimestrales (Tabla l). La localización de las estaciones de muestreo ocupadas por los doce cruceros a lo largo de los cinco periodos bimestrales, aparecen en las figuras 2, 3, 4, 5, y 6. Los datos oceanográficos físicos, químicos y biológicos obtenidos durante esta expedición, han sido publicados en una serie de Atlas deEASTROPAC (Love, 1970, 1971, 1972, 1973, 1974, 1975, 1977). Las listas de las estaciones la posición de las mismas, la fecha, la hora, el tipo de redes empleado, la profundidad de las recolectas, así como el volumen de agua filtrada, son datos que fueron suministrados por el Centro de Preclasificación Oceanográfica de la Smithsonian. Las muestras de plancton fueron obtenidas en arrastres oblicuos con redes cónicas de 0.5 m de diámetro en la boca y construidas de malla con una apertura de 333 micras. Los arrastres se efectuaron a diversas profundidades en la región del epiplancton, desde aproximadamente unos 216 m de profundidad hasta la superficie. El material planctónico así obtenido fue separado en dos partes, el 50% de cada una de las colectas se encuentra depositado en la Institución Smithsonian, EUA, y el 50% restante se localiza en las diversas Instituciones que participaron en el mencionado proyecto. 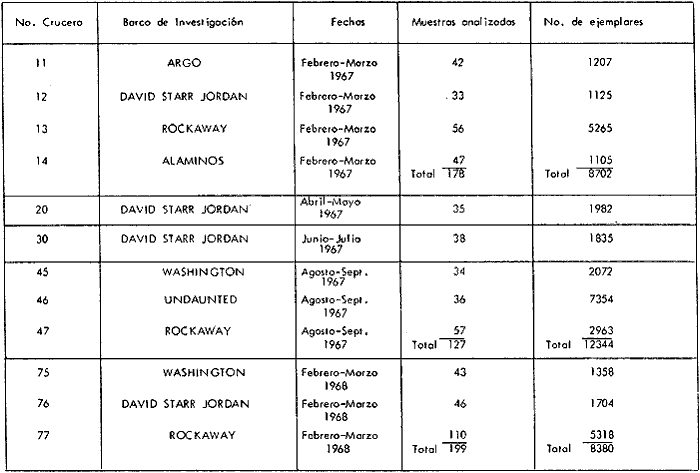 TABLA 1. TOTAL DE MUESTRAS ANALIZADAS DURANTE LOS CINCO PERIODOS BIEMESTRALES El material analizado durante el presente trabajo procede de la colección depositada en la Institución Smithsonian (Smithsonian Oceanographic Sorting Center) que comprende en la mayoría de los casos, las muestras obtenidas durante arrastres nocturnos. Las medusas fueron separadas previamente del resto de los organismos planctónicos en el Centro de Preclasificación Oceanográfica de la misma institución. En la mayoría de los casos la separación de las medusas se efectuó a partir de porciones alícuotas de magnitud variable, aunque en otros casos, se logró analizar la totalidad de la muestra disponible, que resultaba ser, según se explica anteriormente, el 50% del total. El análisis del material se ha realizado con un microscopio estereoscópico Nikon (8-40X). La identificación de las diferentes especies ha sido basada principalmente en el trabajo de Kramp (1968). Otros trabajos básicos de gran valor para la identificación de las medusas incluyen a Kramp (1919, 1926, 1957 a 1961, 1965); Mayer (1910); Bigelow (1909, 1913, 1940), y Russell (1953, 1970). Una vez determinado el número de individuos para cada una de las especies presentes en las fiderentes alícuotas, se ralizaron los cálculos matemáticos necesarios con objeto de estimar el número de organismos presentes en 1000 m3 de agua filtrada, considerando el volumen de agua para cada uno de los arrastre. Los mapas de distribución para cada una de las especies, en los diferentes periodos bimestrales, presentan la cantidad de ejemplares en 1000 m3 de agua filtrada. Los organismos que se encontraban en condiciones óptimas de conservación, fueron seleccionados para dibujarlos mientras se observaban directamente en el microscopio. Las ilustraciones correspondientes han sido preparadas por la autora. Todos los ejemplares fueron medidos y los resultados se expresan en milímetros. Las medusas han sido examinadas además en su totalidad para detectar la presencia de organismos asociados (comensales y parásitos).
Figura 2 Figura 3 Figura 4 Figura 5 Figura 6 MORFOLOGÍA GENERAL DE LAS MEDUSAS
HIDROMEDUSASUna medusa típica es un animal solitario, libre nadador y con una perfecta simetría tetrámera (Hyman, 1940). Su cuerpo consiste de una campana gelatinosa o umbrela. La superficie externa convexa de la umbrela es la superficie exumbrelar y la superficie interna cóncava es lasuperficie subumbrelar. La cavidad que se encuentra delimitada por la superficie subumbrelar es la cavidad subumbrelar. La cavidad subumbrelar se comunica al exterior por medio de una apertura la cual se encuentra parcialmente cerrada por una banda horizontal, el velo, situado inmediatamente por dentro del margen umbrelar, el cual es el borde marginal de la umbrela (Fig. 7). 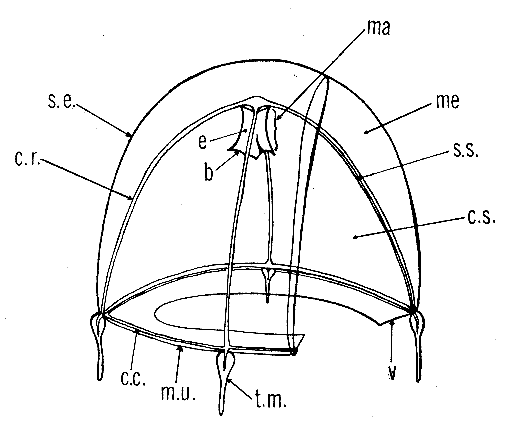 Fig. 7 Esquema de una medusa con un corte longitudinal en un cuadrante. s.e. superficie exumbrelar; me mesoglea; b boca; t.m. tentáculo marginal; c.r. conducto radial; c.c. conducto circular; e estómago; ma manubrio; c.s. cavidad subumbrelar; s.s. superficie subumbrelar; m.u. margen umbrelar; v velo (Russell, 1953). La umbrela tiene típicamente la forma de campana, sin embargo existe una variación considerable de formas, las cuales difieren de una especie a otra. Existen formas esféricas, por ejemploBougainvillia ramosa, así como abovedadas,Aglantha, o bien aplanadas en diferentes grados para producir formas hemisféricas como Phialella, de platillo comoAequorea., o aún más planas hasta alcanzar la forma semejante a un disco comoObelia. La umbrela varía también en el grado de rigidez, el cual depende de la cantidad de mesoglea no celular que contiene. En algunas especies, la mesoglea es extremadamente delgada como se observa enObelia, por lo que la medusa es de naturaleza sumamente frágil. El grosor de la mesoglea puede ser regular como enPhialidium, o bien considerablemente gruesa como enBougainvillia. El grosor de la mesoglea también varía en diferentes regiones de la umbrela. En ciertas especies, la mesoglea es muy gruesa en el épice de la umbrela dando origen a un cono puntiagudo o redondeado, de tamaño variable que se denominaproyección o proceso apical. El margen umbrelar en la mayoría de las Hidromedusas es completo, sin embargo en las Narcomedusas es lobulado, las fisuras que separan dichos lóbulos poseen células ectodérmicas dispuestas en hileras orientadas hacia la base de los tentáculos marginales, y se conocen con el nombre deperonia. En las medusas adultas el tamaño de la umbrela varía de 1-2 mm hasta unos 20 cm. El tamaño de las medusas está relacionado en gran parte con la forma de la umbrela. En las medusas pequeñas la umbrela tiene generalmente forma de campana. Al incrementarse el tamaño, la umbrela va adoptando progresivamente una forma más aplanada hasta alcanzar la forma de platillo. Como regla general, las Antomedusas poseen formas campanuliformes y las Leptomedusas formas más aplanadas. Las medusas poseen células urticantes onematocistos esparcidos por la superficie exumbrelar, especialmente en la zona del margen umbrelar. Los nematocistos difieren considerablemente en estructura, sin embargo todos se encuentran rodeados por una cápsula conteniendo un fluido refringente. En el interior de la cápsula se localiza un filamento enrollado en espiral el cual se desenrolla y dispara en el momento de la descarga. Las diferencias en la forma y estructura de este filamento se han utilizado para agrupar a los nematocistos en diferentes categorías (Hyman, 1940). En algunas especies los nematocistos se encuentran organizados en una armadura perfectamente definida, la cual puede tener la forma de hileras radiales que van desde el margen umbrelar hasta el ápice de la umbrela, como se observa en Ectopleura.En otros casos los nematocistos están organizados en bandas anchas rodeando la región de la umbrela, como sucede en las fases juveniles deAequorea. En algunas especies los nematocistos se encuentran confinados a áreas definidas, como enZanclea. Envelo formauna banda horizontal que rodea la apertura circular de la cavidad subumbrelar, dejando una apertura central circular denominadaapertura velar. El tamaño de esta apertura varía en relación con la talla de la medusa y constituye un elemento importante en la propulsión. El velo en algunas especies está perfectamente desarrollado y cuelga a manera de cortina, o cierra parcialmente la cavidad subumbrelar, sin embargo en otras especies es rudimentario como en el caso de Obelia. En el margen umbrelar se localizan lostentáculos marginales, cuya función principal es la captura de alimentos. Estos presentan una gran variedad de formas, sin embargo en algunas especies, pueden estar ausentes o reducidos, a manera de protuberancias como en Pennaria, Los tentáculos marginales están inervados con células sensoriales y se encuentran provistos de gran cantidad de nematocistos, cuya disposición se utiliza como un buen carácter diagnóstico (Russell, 1953). Los tentáculos pueden ser huecos, conteniendo una extensión del conducto circular, o bien sólidos, con un corazón central de células endodérmicas. Los tentáculos marginales poseen una dilatación en su base, el bulbo tentacular, el cual puede llevar ocelos y otras estructuras sensoriales. En algunas especies los bulbos tentaculares crecen hacia arriba abarcando una pequeña porción de la umbrela envolviendo parcialmente al margen umbrelar formando así elaguijón exumbrelar, como se observa en Leuckartiara. Los bulbos marginales pueden poseer un solo tentáculo o bien varios, como enBougainvillia. El número de tentáculos marginales es generalmente 4, sin embargo esta cantidad varía con las especies, o aún en la misma especie durante las diferentes fases del desarrollo. Existen medusas que poseen un solo tentáculo como Steentrupia, otras que poseen dos comoStomotoca, o bien cuatro, ocho, doce, dieciseis o un número indefinido. Cuando el número de tentáculos es indefinido, a menudo se incrementa con la edad. Cuando el número de tentáculos es cuatro o menos, son siempre radiales, cada uno se origina en la terminación de un conducto radial. Cuando el número es mayor que cuatro, a menudo uno, dos, tres o más tentáculos están simétrica y regularmente esparcidos entre los tentáculos radiales, como se observa enLeuckartiara.A menudo los tentáculos radiales son mucho más grandes y largos que los interradiales y adradiales, y en muchos casos estos últimos son pequeños y rudimentarios, aparentemente funcionan como órganos sensoriales o zonas de formación de nematocistos (Russell, 1953). Los tentáculos en la mayoría de las especies son sencillos, sin embargo en algunos casos se bifurcan y algunas de sus ramas pueden terminar en órganos adhesivos como en Cladonema. La mayoría de las medusas poseen tentáculos marginales de un solo tipo, difiriendo en tamaño con la edad, sin embargo existen algunas especies que poseen tentáculos marginales de dos tipos, comoLiriope. Algunas especies poseen entre los tentáculos marginales otras estructuras conocidas con el nombre decirros. Estos organoides son mucho más pequeños que los tentáculos y no poseen bulbos básales. Son sólidos, con un centro formado por una hilera de células endodérmicas. Se reconocen dos tipos de cirros, loscirros helicoidales, que como su nombre lo indica, se encuentran enrollados en espiral terminando en una protuberancia de nematocistos de una forma que se aproxima a esa espiral, y loscirros flexibles en donde los nematocistos se encuentran dispuestos en anillos a lo largo de toda su longitud. Los cirros pueden estar situados en los lados adyacentes a los bulbos básales de los tentáculos marginales, cirros laterales, o bien se pueden encontrar esparcidos a lo largo del margen umbrelar, entre los tentáculos marginales, cirros marginales. En el margen umbrelar se localizan también los órganos sensoriales. En las Hidromedusas los principales órganos sensoriales son los ocelos y los estatocistos, los cuales presentan diferentes grados de organización. Los ocelos son órganos especializados para la percepción luminosa, y son muy comunes en las Antomedusas, en donde se encuentran mejor desarrollados (Russell, 1959). Los ocelos son como unas manchas de color café, negras o rojizas. En la mayoría de los casos los ocelos consisten en una masa de células ectodérmicas pigmentadas, asociadas con células nerviosas. En un estado de diferenciación más avanzado, los ocelos pueden presentar lentes, y las células pigmentadas son de origen ectodérmico, o bien endodérmico. Los ocelos se localizan generalmente en los bulbos basales de los tentáculos marginales. Pueden estar situados en el lado externo del bulbo, ladoabaxial como se observa enSarsia, o bien en el lado interno, ladoadaxial, como en el caso deBougainvillia. Los estatocistos se consideran como órganos de equilibrio. Dichos órganos están ausentes en las Antomedusas, sin embargo aparecen en el resto de las Hidromedusas. Estos órganos son de dos tipos dependiendo de su origen, ectodérmicos o endodérmicos. Los estatocitos ectodérmicos se presentan en las Leptomedusas, se desarrollan en el velo, en la zona donde éste se une con el margen umbrelar. Como el velo está constituido por células ectodérmicas, los estatocistos por consiguiente tienen el mismo origen. Los estatocistos ectodérmicos son pequeñas cavidades localizadas en el velo, las cuales pueden permanecer abiertas, o bien cerrarse por completo y se les denomina, en el primer caso,vesículas marginales abiertas, y en el segundovesículas marginales cerradas. Las vesículas contienen en su interior pequeñas concreciones esféricas o poligonales, compuestas de material orgánico y carbonato de calcio. En cada una de las vesículas pueden existir de una hasta muchas concreciones. Los estatocistos endodérmicos se presentan en las Limnomedusas, las Traquimedusas y las Narcomedusas. Son estructuras sensoriales en forma de clava y crecen hacia fuera del margen umbrelar, cada uno de ellos está formado por un eje de células endodérmicas originadas en el conducto circular y cubiertas exteriormente por células ectodérmicas, además en su extremo distal poseen una o más células endodérmicas grandes, conteniendo una concreción sólida. En este segundo tipo de nemacitocistos también se distingue la forma abierta y la cerrada. Las Narcomedusas siempre poseen clavas sensoriales abiertas, sin embargo las Limnomedusas y las Taquimedusas pueden presentar la forma abierta, así como la cerrada. En algunas especies de Narcomedusas existen hileras de células ectodérmicas con sedas, las cuales se originan desde las clavas sensoriales y se dirigen hacia el ápice sobre la superficie exumbrelar. A estas estructuras se les conoce con el nombre deotoporpa. Otras estructuras marginales consideradas como órganos sensoriales son loscordilios.Éstos se presentan en la familiaLaoidiceidae. Son estructuras en forma de clava con una porción distal gruesa y un pedúnculo angosto, constituidas por una capa interna de células endodérmicas grandes y cubiertas externamente por ectodermo. Los cordilios contienen nematocistos, excepto enPtychogena antartica y P.crocea(Russell, 1953). En el centro de la superficie subumbrelar cuelga elmanubrio con elestómago,el cual es un saco sencillo que termina distalmente en laboca. El estómago puede ser cilíndrico o fusiforme y muy grande en proporción con el tamaño de la umbrela, especialmente en las Antomedusas. El estómago se encuentra unido a la superficie subumbrelar por medio de subase. En algunas especies el estómago está sostenido sobre una extensión gelatinosa que se proyecta desde el centro de la cavidad subumbrelar, a la que se denominapedúnculo. El pedúnculo varía en forma y dimensiones entre las diferentes especies. El conjunto de estructuras que penden de la cavidad subumbrelar, semejando al badajo de una campana, se conoce con el nombre de manubrio. Así, en algunas especies el manubrio está constituido únicamente por el estómago, y en otras por el estómago y el pedúnculo. El estómago se comunica al exterior por medio de la boca. Elmargen bucal puede ser sencillo y circular como el deSarsia, o bien puede formarlabios bucales los cuales en algunas especies son sencillos y radiales como en Phialidium, y en otras pueden estar lobulados con variados grados de complejidad, como se observa enLeuckartiara. La boca en la mayoría de las especies se encuentra armada con nematocistos cuya distribución varía con las diferentes especies (Hyman, 1940). Algunas especies poseen tentáculos orales los cuales se originan a corta distancia y por encima del margen bucal. Cada uno de estos tentáculos termina en una pequeña protuberancia de nematocistos. Los tentáculos orales pueden ser sencillos como enLizzia, o ramificados como enBougainvillia. El número y disposición de los tentáculos orales varía con las especies. La boca, así como las estructuras bucales son de gran importancia en la sistemática del grupo (Russell, 1953). Losconductos radiales son tubos que parten desde las esquinas radiales de la base del estómago y desembocan en unconducto circular que rodea el margen de la umbrela. Los conductos radiales son por lo general rectos y angostos, sin embargo existen variaciones en las diferentes especies. Los conductos radiales se comunican con el estómago por medio de un orificio circular o en forma de embudo. Los conductos radiales, el conducto circular, el estómago y el manubrio constituyen el sistema gastrovascular de las medusas. El número de conductos radiales varía de cuatro a dieciseis, sin embargo algunas especies poseen más, sobrepasando los cien comoAequorea. En la mayoría de los casos los conductos radiales son sencillos, aunque pueden ramificarse en algunas de las diferentes especies. El lugar en que se verifica la ramificación varía con las especies, pudiendo localizarse en la base del estómago como enHalopsis,o bien a cierta distancia del estómago como enProboscidactyla. En el caso de aquellas especies en que el número de conductos radiales se incrementa con la edad, por lo general los conductos recién formados se desarrollan a partir de la base del estómago,centrifugalmentehacia el conducto circular. Sin embargo existen algunas especies en que los conductos de reciente formación se originan del conducto circular y crecencentripetalmentehacia el estómago. En algunas especies estos conductos nunca llegan al estómago, permaneciendo como conductos ciegos a los que se les conoce con el nombre de conductos centripetales. En las Narcomedusas no existen conductos radiales, éstos se encuentran substituidos por bolsas que crecen sobre la superficie subumbrelar a partir del estómago que es grande y circular. El conducto circular en la mayoría de las especies es hueco y angosto, sin embargo en ocasiones es sólido, y está formado por un centro de células endodérmicas, como sucede enProboscidactyla. El conducto circular en el caso de las Narcomedusas puede o no estar presente. En estos organismos el margen umbrelar es lobulado, por lo que el conducto circular, cuando existe, se continúa hacia arriba en la umbrela a ambos lados de las fisuras, orientado en dirección vertical. A estas porciones de conductos verticales se les denomina conductos peroniales. La forma medusoide es el individuo sexual de los Hidrozoarios. Las gonadas son de gran valor taxonómico. Así, la posición de las mismas por ejemplo, constituye uno de los principales caracteres para distinguir a las Antomedusas y Leptomedusas. Las gonadas consisten en pliegues epidérmicos en los que maduran las células sexuales. Las gonadas se localizan en las paredes del estómago, o en los conductos radiales. Cuando se localizan en el estómago, pueden ser cilíndricas y rodear por completo al estómago, como enSarsia, o bien pueden tener una posición interradial o adradial como enBougainvillia. Las gonadas que se localizan en los conductos radiales son ovales, alargadas, o en forma de hoja, por lo general se encuentran separadas completamente del estómago. Sin embargo en algunas especies, las porciones terminales se continúan con el estómago, como sucede en Loadicea. En muy raras ocasiones las gonadas se localizan tanto en las paredes del estómago, como en los conductos radiales (Podocoryne hartlaubi). Cuando el tejido gonadal se desarrolla en las paredes laterales de los conductos radiales, las gonadas se encuentran divididas longitudinalmente por medio de un surco medio, como enTiaropsis. En ciertas especies el tejido gonadal se desarrolla de una forma continua cubriendo por completo el conducto radial, como se observa en Phialidium hemisphaericum. Existen especies en las que el tejido gonadal se desarrolla extraordinariamente y cubre un área considerable de los conductos radiales por lo que las gonadas en este caso penden de la cavidad subumbrelar, por ejemplo Aglantha, y Amphogona. Las Hidromedusas son por regla general dioicas, una excepción es el géneroEleutheriay otros; en éste los óvulos y los espermatozoides se desarrollan juntos en las paredes de una bolsa epidérmica incubadora localizada por debajo del estómago. El proceso de reproducción asexual es un fenómeno muy común entre las medusas, especialmente en las Antomedusas, en donde las yemasmedusoides se desarrollan en las paredes del estómago como en Cytaeis, o bien en la base de los tentáculos marginales, como enHybocodon. Las yemas medusoides se desarrollan también en el margen de la umbrela, en los conductos radiales y en otros lugares, aparecido siempre en un orden de secuencia. Todas las Hidromedusas constituyen parte del meroplancton, excepto las especies de los órdenes Traquimedusa y Narcomedusa que son haloplanctónicas (Kramp, 1968). ESCIFOMEDUSASLa umbrela tiene la típica forma de platillo, o bien hemisférica, a excepción del Orden Coronatae, en que varía desde la forma de disco como enAtolla, hasta cónica como enPeryphylla. La forma de la umbrela se puede comparar con las de dos platillos invertidos, de los cuales el inferior, el platillo subumbrelar es plano. Ambos platillos se encuentran fusionados de sus bordes y encierran entre sí un espacio que equivale a la cavidad gastrovascular. En el centro del platillo inferior se localiza una apertura que comunica al exterior. En las Escifomedusas la mesoglea es celular, gruesa y de consistencia sólida (Russell, 1970). El margen umbrelar se encuentra dividido por una serie de fisuras dando lugar a los lóbulos marginales. Si los lóbulos se encuentran situados cerca de un órgano sensorial marginal, se denominan lóbulos ropalares y si se localizan cerca de un tentáculo marginal reciben el nombre de lóbulos tentaculares. En el género Rhizostoma, que carece de tentáculos marginales, los lóbulos que se localizan entre los pares de lóbulos ropalares se conocen con el nombre delóbulos velares. En las medusas del Orden Coronatae, la zona marginal de la umbrela se encuentra separada del disco central por un surco, que se denomina surco coronal.En la zona marginal de la umbrela se localizan una serie de surcos radiales, los cuales dividen el margen en un número de áreas gruesas denominadas pedalia. Los pedalia pueden ser ropalares o tentaculares, dependiendo que su localización sea respectivamente en la base de un órgano sensorial o en un tentáculo marginal. La superficie exumbrelar puede ser lisa o estar ornamentada conprotuberancias de nematocistos, las cuales pueden ser en escaso número y grandes, como sucede enPelagia, o numerosas como enRhizostoma.Dichas protuberancias también se localizan en el manubrio. La superficie subumbrelar se caracteriza por la presencia de una musculatura ectodérmica constituida por músculos radiales y circulares (Russel, 1970). A lo largo del margen umbrelar se localizan los tentáculos marginales, sin embargo en algunos órdenes, éstos pueden localizarse en la superficie subumbrelar, o en la superficie exumbrelar, como sucede enAurelia. Los tentáculos marginales pueden ser huecos o sólidos, y son muy flexibles debido a la presencia de la musculatura ectodérmica. El sistema gastrovascular consisten de un estómago central en el que se localizan losfilamentos gástricos, y una zona marginal periférica que se denomina seno gastrovascular o seno coronal. En el Orden Coronatae el estómago central se encuentra separado del seno gastrovascular por medio de cuatro áreas interradiales de fusión en forma de media luna, denominadasseptos gástricos, los cuales alternan con cuatro áreas que permiten el libre acceso entre el estómago y el seno gastrovascular. A estos cuatro pasajes se les conoce con el nombre deostiolos gástricos. El seno gastrovascular se encuentra dividido por septos radiales a lo largo de su trayectoria originando así un número de áreas obolsas. Según que estas bolsas se localicen en el radio de un órgano sensorial, o bien de un tentáculo marginal, se les denomina respectivamente, bolsas ropalares o tentaculares. En los órdenes Semaestomeae y Rhizostomeae no existen septos gástricos, y el estómago se comunica con el seno, gastrovascular a lo largo de su periferia. Sin embargo en algunas especies, dichos septos se encuentran reemplazados por numerosas áreas de fusión cuya disposición puede dar origen a unsistema de conductos radiales, que puede ser simple o ramificado como enAurelia. El estómago central se comunica al exterior por medio de la boca, la cual se localiza en el centro de un manubrio. El manubrio puede tener cuatro labios radiales, o estar constituido por un pilar de diferente tamaño de consistencia sólida, el tubo oral, el cual se encuentra dividido en su extremo distal, dando origen a cuatro estructuras alargadas, losbrazos orales. Los márgenes de estos brazos son delgados y lobulados, y forman los labios bucales que rodean un surco axial, que corre a lo largo de la superficie interna de los brazos orales revestidos con endodermo. Los filamentos gástricos localizados en el estómago central, se encuentran dispuestos en cuatro grupos interradiales, losfaceli. Los filamentos gástricos están constituidos por un centro de mesoglea sólido y cubiertos por un epitelio de células ectodérmicas, entre las que se encuentran células glandulares, nematocistos y células musculares. De esta manera dichas estructuras sirven para paralizar a las presas después de que entran en el estómago, siendo además el sitio donde se efectúa la digestión. Los filamentos gástricos pueden ser muy largos, extendiéndose hasta el seno gastrovascular. En las medusas del Orden Coronatae, lasgonadas en número de ocho, aparecen situadas adradialmente. Se originan a manera de proliferaciones endodérmicas del seno coronal, y se localizan en la periferia del estómago central. Las gonadas varían de forma en las diferentes especies del Orden. En las medusas de los Ordenes Semaeostomeae y Rhizostomeae, las gonadas son únicamente cuatro, situadas interradicalmente dentro de la cavidad del estómago central. Las gonadas se desarrollan en forma de engrosamientos del endodermo subumbrelar del estómago, en la periferia de los filamentos gástricos. En el interior de estos engrosamientos se desarrollan cavidades, las cuales constituyen el seno genital, que se encuentra atravesado por trabéculas, uniendo así el epitelio genital con el epitelio del endodermo subumbrelar. Las Escifomedusas son unisexuales, a excepción de Chrysaora que es hermafrodita. En esta especie los gametos masculinos se desarrollan dentro de pequeñas vesículas a partir del epitelio endodérmico, y carecen de localización definida (Russell, 1970). Los órganos sensoriales marginales son estructuras compuestas, las cuales desempeñan diferentes funciones. La forma más diferenciada de órgano es el ropalio que está formado de un cuerpo terminal sólido cuyo endodermo se encuentra lleno de cristales, los estaticistos. El ropalio se proyecta del margen umbrelar y se encuentra conectado con el sistema gastrovascular por medio delconducto ropalar. El ropalio se localiza en unnicho sensorial protector, formado por una extensión del margen umbrelar y las zonas laterales de los lóbulos ropalares adyacentes, los cuales forman el piso y las paredes del nicho. En el interior de ese nicho, en la base del ropalio, se localizan dos depresiones laterales inervadas profusamente por tejido nervios, denominadas cavidades sensoriales subumbrelares. En la superficie exumbrelar, por encima del ropalio también existe una depresión, la cavidad sensorial exumbrelar. En las superficies exumbrelar y subumbrelar se localizan también dos manchas de pigmento endodérmico, losocelos. Dada la compleja estructura de estos órganos sensoriales los cuales incluyen diferentes organoides sensorios, cada uno de éstos interviene en una función diferente. Los estatocistos son sensibles a la gravedad, los ocelos lo son a la luz, y las cavidades sensoriales exumbrelar y subumbrelar, aunque su función no es aún conocida, pueden ser sensibles a las substancias químicas (Russell, 1970). En síntesis, las Escifomedusas difieren esencialmente de las Hidromedusas en carecer develo, la presencia de filamentos gástricos en el estómago, y en el origen endodérmico de las gonadas. Por otro lado el sistema gastrovascular de los órdenes Semaeostomeae y Rhizostomeac se semeja al de las Hidromedusas, ya que posee conductos radiales y algunas veces circulares. Considerando la presencia de los lóbulos marginales, las Escifomedusas recuerdan a las Narcomedusas. La división septal de la cavidad gastrovascular, y la presencia de filamentos gastricos sugieren una afinidad con los Antozoarios. RESULTADOS
SISTEMÁTICAEn este capítulo se exponen breves descripciones para cada una de las especies de Hidromedusas y Escifomedusas identificadas durante el presente estudio, siguiendo la secuencia sistemática del Trabajo de Kramp (1968). Las descripciones, así como las láminas presentadas, se basan en el análisis detallado de los miles de organismos observados durante el desarrollo de esta investigación. Se identificaron un total de 61 especies de Hidromedusas pertenecientes a 5 órdenes, 22 familias y 40 géneros, y de 3 especies de Escifomedusas correspondientes a 2 órdenes, 2 familias y 2 géneros (Tabla 2).
Tabla 2 Clase HYDROMEDUSAEOrden Anthomedusae Familia Corynidae Género Sarsia, Lesson, 1843 Sarsia coccometra Bigelow, 1909 (Lám. 1, Fig. 1) Sarsia coccometraBigelow, 1909; Meyer, 1910; Foester, 1923; Kramp, 1961; Alvariño, 1967. Descripción.La umbrela posee una proyección apical pequeña y cónica. La umbrela tiene un diámetro que varía de 1.0 a 3.0 mm, y una altura de 2.0 a 6.0 mm; la mesoglea es muy delgada. El estómago es grande, tan largo como la cavidad umbrelar, sin pedúnculo. La boca es sencilla, rodeada por un labio circular. El estómago posee una extensión apical ancha y triangular por encima del nivel del origen de los conductos radiales, conformándose en un contorno que se extiende hacia la proyección apical de la umbrela. Las gonadas ocupan casi toda la longitud del estómago, dejando descubierta únicamente una región basal corta. Los 4 conductos radiales son sencillos y el conducto circular angosto. Los 4 tentáculos marginales, en posición radial, llevan bulbos básales grandes, cada uno con un ocelo en su lado aboral. Los tentáculos cerca de su base, se encuentran desnudos, pero a lo largo de toda su longitud, poseen anillos prominentes de nematocistos, y en el extremo de cada uno de los tentáculos se localiza un hinchamiento cubierto de nematocistos. Distribución.Se ha observado frente a San Diego, California, y en las zonas costeras del Pacífico, frente a la América Central. En la zona de estudio tiene una aparición esporádica, observándose únicamente en tres localidades alejadas de la costa frente a Colombia y Ecuador (Figs. 91, 92 y 93). Familia TubulariidaeGéneroEctopleura L. Agassiz, 1862Ectopleura dumortieri(Van Beneden, 1844) (Lám. 1, Fig. 2) Tubularia dumortierii Van Beneden,1844, 1866. Ectoleura dumortieri L. Agassiz, 1862; Hinks, 1868; Bohm, 1878; Haeckel, 1879; Harthlaub, 1894, 1917; Browne, 1905a; Mayer, 1910; Vanhöffen, 1911, 1920; Neppi y Stiasny, 1913; Foerster, 1923; Stechow, 1923; Kramp, 1930, 1933, 1937, 1959a; Russeli, 1938, 1953; Sousa, Silva y Santos-Pinto, 1949; Nair, 1951; Vannucci, 1957; Chow y Huang, 1958; Fagetti, 1973. Ectopleura ochracea L. Agassiz, 1862; A. Agassiz, 1965; Haeckel, 1879; Fewkes, 1882b; A. Agassiz y Woodworth, 1896; Nutting, 1901; Hargitt, 1905; Bigelow, 1909, 1914; Fish, 1926. Ectopleura octogona Thiel, 1938; Kramp, 1955a. Ectopleura prolifera Hargitt, 1908. Descripción: Umbrela en forma de pera. El diámetro de la umbrela varía de 0.5 a 1.0 mm, y la altura de 0.5 a 1.5 mm; la mesoglea es bastante gruesa, especialmente en el polo aboral. El velo es angosto. La exumbrela posee 4 pares de líneas longitudinales de nematocistos, extendiéndose desde la base de los bulbos tentaculares hasta el ápice de la umbrela, donde todos convergen en un punto. El estómago es fusiforme y se extiende hasta el nivel de la apertura velar. No posee pedúnculo. La boca es sencilla, en forma de tubo, y se encuentra armada de nematocistos. Las gonadas se encuentran rodeando completamente el estómago dejando libre únicamente la boca. Los 4 conductos radiales y el conducto circular son angostos. Los 4 tentáculos marginales radiales son cortos y con bulbos grandes. La superficie externa de los tentáculos es gruesa y cubierta de nematocistos, sus extremos distales se encuentran enrollados a manera de hélices. Distribución.Aparece en las zonas costeras del Pacífico mexicano; Chefoo en China; costas de Vietnam e India. Esta medusa es muy común durante el verano en las Bahías de Narragansett y Buzzard, y en las costas sur de Nueva Inglaterra, y al este de New Haven, Connecticut. También se ha observado en Beaufort, Carolina del Norte, y en Carolina del Sur en la Bahía de Winyah; en el Canal de la Mancha, y fuera de las costas del mar del Norte en Inglaterra, Escocia, Holanda y Alemania. En la zona de estudio aparece únicamente en algunas localidades frente a las costas de Colombia, Ecuador y Perú (Figs. 111 y 112). Ectopleura sacculifera Kramp. 1957(Lám. 1, Fig. 3) Ectopleura sacculifera Kramp, 1957a. Descripción. Umbrela de forma cónica. El diámetro de la umbrela varía de 0.5 a 0.2 mm, y la altura de 1.0 a 2.0 mm; la mesoglea es bastante gruesa. El velo es angosto. La exumbrela posee 8 hileras de nematocistos, partiendo en pares desde los 4 bulbos tentaculares marginales, pronto se separan y continúan, a la misma distancia hasta el ápice que termina en punta roma. Las hileras de nematocistos corren a lo largo de los ejes de las 8 aristas adradiales prominentes, separadas perfectamente por los surcos perradiales e interradiales. El estómago es tan largo como la cavidad umbrelar, con una base cuadrangular ancha unida a la subumbrela. No posee pedúnculo gástrico. El tubo bucal es angosto. La boca termina en una apertura circular sencilla, con un borde ligeramente grueso. El estómago es de sección transversal circular, y se encuentra rodeado completamente por las gonadas, las cuales están constituidas por 4 sacos largos interradiales que cuelgan desde la porción media del estómago, extendiéndose hasta el nivel de la boca. En algunos de los ejemplares observados se distinguieron yemas medusoides localizadas en las zonas interradiales del estómago, en la región adyacente a la parte basal. Los 4 conductos radiales, y el conducto circular son angostos. Lleva 2 tentáculos moniliformes opuestos con bulbos básales grandes y 2 bulbos rudimentarios marginales. Distribución. Se localiza en la región costera de Ecuador, en el Pacífico Tropical Oriental. Durante el presente estudio aparece al suroeste de las Islas Galápagos, así como en algunas localidades frente a México, Costa Rica, Nicaragua, Colombia y Ecuador (Figs. 113, 114, 115, 116 y 117). Género Euphysora Maas, 1905 Euphysora bigelowi Maas, 1905(Lám. 1, Fig. 4) Eyphysora bigelowi Maas, 19,05, Vanhöffen, 1912a, 1912b; Browne, 1916; Kramp, 1928, 1948b, 1952, 1953, 1958b; Nair, 1951; Chiu, 1954b; Chow y Huang, 1958; Ganapati y Nagabhushanam, 1958. Euphysa bigelowiUchida, 1927, 1938a; 1947a; Yamazi, 1958. Steentrupia bigelowi Mayer, 1910; Bal y Pradhan, 1952. Descripción.Umbrela con una proyección apical en forma de cono. El diámetro de la umbrela varía de 0.5 a 0. 1 mm, y la altura de 1.0 a 1.5 mm; la mesoglea es delgada excepto en la proyección apical. El velo es angosto. La exumbrela está cubierta de gránulos finos con nematocistos, especialmente en la porción términal. El estómago tiene forma de huso y no se extiende más allá de la apertura velar. Las gonadas se localizan alrededor del estómago, excepto en las porciones proximal y distal. Los 4 conductos radiales son anchos y el conducto circular angosto. Posee 4 tentáculos marginales, sin embargo solo uno de ellos se encuentra bien desarrollado, los otros 3 son rudimentarios, y el tentáculo principal lleva en su parte interna, una hilera de protuberancias con nematocistos. El tentáculo opuesto al principal es el más pequeño de todos, y los otros 2 son iguales y de una longitud intermedia. Carece de ocelos. Distribución. Se ha observado en la región Indo-Malaya, costas de la India, región costera oriental de África; sur del Japón y Chefoo en China; noroeste de Australia y Chile. Ahora ha sido también observada en el Pacífico Tropical Oriental en dos localidades, frente a la región costera de Costa Rica y Colombia (Figs. 45 y 46). Euphysora furcata Kramp, 1948(Lám. 2, Fig. 1) Euphysora furcata Kramp, 1948b, 1955a, 1957a, 1959a; Fagetti, 1973. Descripción.La umbrela tiene el ápice puntiagudo y las paredes delgadas. El diámetro de la umbrela varía de 2.0 a 3.0 mm, y la altura de 4.0 a 5.0 mm. El estómago tiene forma de barril, con una cámara apical ancha y cónica. Las gonadas se localizan rodeando completamente al estómago. Posee 4 conductos radiales con células endodérmicas vacuoladas y de gran tamaño. Tiene 4 tentáculos, el tentáculo principal es largo, se bifurca dos veces en su porción terminal y se encuentra ornamentado con protuberancias de nematocistos en sus cuatro extremos distales, terminando cada ramita en una esfera de nematocistos. Opuesto a este tentáculo se localizan otros más pequeños y filiforme. Posee además 2 tentáculos pequeños y cónicos. Distribución. Es una especie de régimen oceánico. Se encuentra distribuida ampliamente en el Océano Atlántico, entre 40ºN y 40ºS; en el Océano Indico, y al oeste del Océano Pacífico, al norte de Japón y este de Tahití; y recientemente también observada en Chile. Ahora se ha encontrado en el Pacífico Tropical Oriental únicamente en dos localidades alejadas de las costas frente a Perú (Fig. 118). Género Euphysilla Kramp, 1955 Euphysilla pyramidata Kramp, 1955(Lám. 2, Fig. 2) Euphysilla pyramidata Kramp, 1955a, 1959a. Descripción. La umbrela es de forma cilíndrico-conoidea, tan alta como ancha. El diámetro y la altura de la umbrela varían de 0.5 a 1.0 mm; la mesoglea es ligeramente gruesa. El velo es angosto. El estómago tiene forma piramidal con la base ancha y cuadrada unida a la subumbrela. La boca es ancha y cuadrada, con un borde delgado y ligeramente doblado hacia arriba. La longitud del estómago llega a ocupar casi la totalidad de la cavidad subumbrelar. Las gonadas cubren las partes del estómago a manera de 4 placas interradiales planas o ligeramente cóncavas. Los ejemplares analizados durante el presente estudio, no poseían gonadas, sin embargo se observaron numerosas yemas medusoides en diferente estado de desarrollo, adheridas a las paredes del estómago. Tiene 4 conductos radiales y un conducto circular muy estrecho. Los 4 tentáculos marginales radiales son cortos y robustos, y cada uno está ornamentado con 5-7 prominencias transversales que llevan nematocistos sobre su lado adaxial y una protuberancia esférica terminal. Los bulbos tentaculares son anchos y van armados en la parte adaxial, de un cojinete de nematocistos. Carece de ocelos. Distribución. Se localiza en la zona oeste de Madagascar y Golfo de Guinea en las costas occidentales de África. Ahora ha sido recolectada en el Pacífico Tropical Oriental en diversas localidades aisladas entre sí, frente a la región costera de México, Colombia, al noroeste y suroeste de las Islas Galápagos, así como frente a Perú (Figs. 40, 41, 42, 43 y 44). Género Gotoea Uchida, 1927 Gotoea similis Kramp, 1959(Lám. 2, Fig. 3) GotoeasimilisKramp, 1959a. Descripción. Umbrela de forma oval con la zona apical aplanada y los lados más o menos perpendiculares, como en un cilindro. La umbrela tiene un diámetro de 1.5 mm, y una altura de 2.0 mm; la mesoglea es delgada. Los nematocistos aparecen dispersos sobre la exumbrela. El estómago posee una base ancha y es ligeramente más largo que la cavidad subumbrelar. La boca presenta 4 labios apenas insinuados, anchos y sumamente pequeños, y el margen oral lleva nematocistos. Las gonadas penden desde la parte superior del estómago a manera de 4 sacos grandes interradiales y de diferente tamaño. Los 4 conductos radiales y el conducto circular son angostos. Al borde de la umbrela hay 4 bulbos tentaculares marginales grandes, uno de los cuales posee un tentáculo marginal largo y delgado que termina en una protuberancia esférica cubierta de nematocistos. Los bulbos marginales son cojinetes grandes, elongados y cubiertos con nematocistos, se extienden hacia arriba sobre la exumbrela más allá del margen umbrelar y difieren en tamaño; el más pequeño es el que posee el tentáculo, el bulbo opuesto a éste, mide más del doble y los 2 restantes son de tamaño intermedio y semejantes. Carece de ocelos. Descripción. Es una especie común en el Océano Índico y rara en el Océano Atlántico. Se ha observado en Bali; Madagascar y en el Canal de Mozambique. En el Océano Atlántico cerca de Santa Helena. Ahora ha sido recolectada en el Pacífico Tropical Oriental en una sola localidad frente a Costa Rica (Fig. 47). Grupo INCERTAE SEDIS Género Pachycordyle Weismann, 1883 Pachycordyle sp(Lám. 2, Fig. 4) El nombre genéricoPachycordylese utiliza para designar a un número de Antomedusas pequeñas y degeneradas, sin tentáculos, sin conductos radiales o conducto circular y sin apertura bucal. Sin embargo presentan un manubrio bien desarrollado el cual se encuentra rodeado por las gonadas. Existen 5 especies dePachycohdyle descritas hasta ahora(P.weismanii, P. degeneratus, P. globulosa, P. lineata, y P. conica). El ejemplar que apareció en una de las colecciones de plancton analizadas durante el presente estudio, posee los caracteres diagnósticos del género aunque difiere le las 5 especies descritas previamente. Sin embargo debido a que solo se ha obtenido un ejemplar, se mantiene por el momento comoPachycordylesp. Descripción.Umbrela campanuliforme. La umbrela tiene un diámetro de 1.0 mm, y una altura de 2.0 mm; la mesoglea es delgada. La umbrela posee un proceso apical redondeado dentro del cual se proyecta un conducto apical angosto. La apertura velar es amplia y el velo estrecho. La umbrela posee 6 líneas meridionales iguales en grosor, que corren desde el margen umbrelar hasta la base del proceso apical. El manubrio es más o menos cilíndrico, tan largo como la longitud de la cavidad subumbrelar y se encuentra unido a un pedúnculo filiforme. No se observan gonadas. Distribución. Se encontró en una sola localidad frente a las costas de Perú (Fig. 121). Familia Zancleidae Género Zanclea, Gegenbaur, 1856 Zanclea costata Gegenbaur, 1856(Lám. 3, Fig. 1) Zanclea costata Gegenbaur, 1856; Haecke1, 1879; Mayer, 1910; Vanhöffen, 1913; Grobben, 1915; Neppi, 1915; Hartlaub, 1917; Russell y Rees, 1936; Russell, 1938; Vannucci, 1957; Chow y Huang, 1958; Kramp, 1958a, 1959a, 1959c, 1968; Alvariño, 1964, 1967. Zanclea gemmosa McCrady, 1957; Hartlaub, 1907; Bigelow, 1909, 1914; Mayer, 1910; Foerster, 1923; Russell y Ress, 1936; Russell, 1938, 1953; Uchida, 1947a. Gemmaria gemmosa McCrady, 1857; A. Agassiz, 1865; Haecke1, 1879; Fewkes, 1881; Weill, 1934b. Coryne implexa Allman, 1964; Hartlaub, 1907; Mayer, 1910; Vanhöffen, 1911; Neppi, 191; Neppi y Stiasny, 1913; Hartlaub, 1917; Pell, 1918, 1938; Kramp, 1930; Runnstrom, 1932; Russell y Rees, 1936; Ranson, 1937; Babnik, 1948; Russell, 1953. Gemmaria cladophora A. Agassiz, 1865; Haecke1, 1879; Fish, 1926. Gemmaria implexa Allman, 1871, 1872; Hargitt, 1904; Browne, 1905a. Gemmaria implexa var. neapolitana Bruckner, 1914. Zanclea cladophora Hartlaub, 1907, 1917; Mayer, 1910; Bigelow, 1914; Russell, 1953. Guntherella implexa Weill, 1934b. Descripción. Umbrela en forma de campana, tan alta como ancha. La altura de la umbrela varía de 1.5 a 6.0 mm; la mesoglea tiene un grosor regular. El velo es ancho. La exumbrela posee nematocistos confinados en pequeñas áreas de forma oval, localizadas inmediatamente por encima de los bulbos marginales, o bien a manera de líneas meridionales las cuales se extienden a diferente distancia hacia el ápice de la umbrela. La boca es sencilla, circular y con nematocistos en el margen. Los 4 conductos radiales y el conducto circular son de anchura regular. Las gonadas están en posición interradial y cubren la mayor parte de la longitud del estómago, dejando libre la boca. Lleva 2 tentáculos radiales opuestos a 2 bulbos marginales también en posición radial, o bien 4 tentáculos marginales radiales. Los bulbos básales son cónicos, elongados y ornamentados con cápsulas pedunculadas o cnidóforos a lo largo de su superficie abaxial, cada cnidóforo es de forma oval y contiene de 2 a 5 nematocistos. Distribución. Es una especie ampliamente distribuida en las aguas costeras cálidas y templadas de los océanos. En el Pacífico Tropical Oriental, su aparición es esporádica. Durante el presente estudio se recolectó únicamente en 4 localidades frente a la región costera de México, Nicaragua y Costa Rica (Figs. 189 y 190). Zanclea orientalis Browne, 1916(Lám. 3, Fig. 2) Zanclea orientalis Browne, 1916; Russeli, 1953; Kramp, 1959c, 1968. Descripción.Umbrela en forma de campana, ligeramente más alta que ancha y con el ápice redondeado. El diámetro de la umbrela varía de 0.5 a 1.5 mm y la altura de 1.0 a 1.5 mm; la mesoglea es delgada. El velo es angosto. El estómago es cilíndrico y alcanza aproximadamente la mitad de la longitud de la cavidad subumbrelar. La boca es circular. Las gonadas se localizan sobre el estómago formando protuberancias interradiales. En algunos de los ejemplares analizados durante el presente estudio, se observaron yemas medusoides sobre las paredes del estómago. Tiene 4 conductos radiales y un conducto circular estrechos. Lleva 2 tentáculos radiales opuestos y armados con nematocistos globulares pedunculados, así como 2 bulbos tentaculares rudimentarios. Posee 4 parches radiales de nematocistos por encima del margen de la umbrela. Distribución.Es una especie que aparecía únicamente en el Océano Indico, al norte de Chagos. Ahora ha sido recolectada en el Pacífico Tropical Oriental en algunas localidades frente a Nicaragua, Colombia así como al oeste de las Islas Galápagos (Figs. 191, 192 y 193). Familia Cytaeididae Género Cytaeis Eschscholtz, 1829 Cytaeis tetrastyla Eschscholtz, 1829(Lám. 3, Fig. 3) Cytaeis tetrastyla Eschoscholtz, 1829; Browne, 1905b; Mayer, 1910; Vanhöffen, 1911, 1912a, 1912b; Hart1aub, 1917; Bigelow, 1918; Kramp, 1928; Menon, 1932; Ranson, 1932a; Pell, 1938; Thiel, 1938; Uchida, 1938a; Nair, 1951; Kramp, 1953, 1955a, 1955b, 1957a, 1959a, 1968; Vannucci, 1957; Fagetti, 1973; Alvariño, 1976. CyteistetrastylaPell, 1918. Cytaeis atlantica(Steentrup, 1837); Mayer, 1915; ThieI, 1938; Berril, 1950; Vannucci, 1951b; Alvariño, 1972. Cytaeis herdmaniBrowne, 1905b, 1916. Cytaeis japonica Uchida, 1927; Komai, 1931; Yamazi, 1958. Cytaeis macrogasterHaeckel, 1879. Cytaeis nigritinaHaecke1, 1879. Cytaeis vulgaris Agassiz y Mayer, 1899; Bigelow, 1909; Maas, 1909; Mayer, 1910; Hardaub, 1911; Menon, 1931; Uchida, 1947a. Descripción.Umbrela en forma de cono truncado, piriforme o de aspecto globoso. El diámetro de la umbrela varía de 0.5 mm a 4.5 mm, y la altura de 0.5 a 4.0 mm; la mesoglea es delgada. El velo es ancho. El estómago es largo, normalmente se extiende cerca de la apertura velar. El estómago posee a menudo yemas medusoides localizadas sobre la mitad superior del mismo, las cuales se encuentran en diversas fases de desarrollo. La boca es sencilla con apertura circular, y está rodeada por un anillo con 8-12 tentáculos orales cortos y delgados, terminando cada uno de ellos en una protuberancia pequeña cubierta de nematocistos. Los 4 conductos radiales y el conducto circular son estrechos. Lleva 4 tentáculos marginales robustos, dispuestos radialmente tan largos como el diámetro de la umbrela. Algunos de los ejemplares analizados durante el presente estudio, presentaban 5 tentáculos marginales. El quinto tentáculo se localiza en uno de los interradios, el bulbo tentacular es ligeramente más pequeño que los restantes y posee un conducto radial ciego, que seinicia de la base del tentáculo y se dirige hacia el ápice llegando aproximadamente a la mitad de la altura de la umbrela. Los bulbos tentaculares básales son grandes, piriformes y poseen una masa de pigmento endodérmico de color obscuro. Distribución. Es una especie parcialmente oceánica que se encuentra distribuida ampliamente en las regiones cálidas del Océano Atlántico (40ºN-30ºS); en el Mediterráneo. En el Océano Indico era solamente conocida en las regiones tropicales, pero los resultados de la Expedición "Dana" mostraron que seguía las corrientes a lo largo de las costas Africanas hasta penetrar al Canal de Mozambique. En el Océano Pacífico se distribuye principalmente dentro de la banda tropical, penetrando hacia el Norte, hasta la zona Sur del Japón. Los resultados obtenidos durante el presente estudio revelan que en el Pacífico Tropical Oriental, su distribución comprende una zona amplia que se extiende desde los 19ºN hasta los 17.5ºS, y desde la región costera hasta los 126ºW (Figs. 137, 138, 139, 140 y 141. Familia Hydractiniidae Género Podocoryne M. Sars, 1846 Podocoryne apicata Kramp, 1959(Lám. 3, Fig. 4) Podocoryne apicataKramp, 1959c, 1968. Descripción. Umbrela en forma de domo, globular o ligeramente cónica, un poco más alta que ancha, y con una proyección apical gelatinosa. La altura de la umbrela varía de 0.5 a 2.0 mm; la mesoglea es gruesa, especialmente en la región apical. El velo es angosto. La exumbrela posee numerosos grupos de nematocistos pequeños, especialmente alrededor del ápice. El estómago tiene forma de barril y se encuentra colocado sobre un pedúnculo gelatinoso conspicuo de tamafio variable. El estómago y el pedúnculo se extienden hasta la mitad de la cavidad subumbrelar. La boca es angosta, con 4 brazos bucales pequeños y sencillos terminando cada uno de ellos en una protuberancia pequeña cubierta de nematocistos. Los 4 conductos radiales y el conducto circular son estrechos. Lleva 4 tentáculos marginales largos los cuales poseen una cobertura densa de nematocistos, que ocupan más allá de su parte media distal. Los bulbos tentaculares básales son grandes y se encuentran provistos de una área circular grande, en su lado abaxial, con una pigmentación naranja-rojiza. Distribución. Es una especie que solo había sido observada en la región Indo-Malaya, Estrecho de Malacca, Golfo de Siam, Vietnam. Ahora ha sido recolectada en el Pacífico Tropical Oriental en algunas localidades frente a las costas de México, Nicaragua, Perú, y al noroeste y suroeste de las Islas Galápagos (Figs. 71, 72, 73, 74 y 75). Podocoryne carnea M. Sars, 1846(Lám. 4, Fig. 1) Podocoryne carnea M. Sars, 1846; Krohn, 1853; Allman, 1859, 1872; Hincks( 1868; Grobben, 1875; Browne, 1896; Mayer, 1910; Hartlaub, 1911; Bigelow, 1914; Dick, 1919; Marshall, 1925; Fish, 1926; Kramp, 1927, 1937, 1939, 1959a, 1968; Runnstrom 1932; Thiel, 1932a, 1932b; Hovasse, 1935: Russell, 1938, 1953; Stanstschew, 1940; Berril, 1950; Deevey, 1952b; Rees, 1953; Southward, 1954; Maghraby y Perkins, 1956; Naunov, 1956; Vannucci, 1956b; Valkanov, 1957. Podocoryne carneavar.chilensis Kramp, 1952. Sarsia nodosa Bush, 1851. Ectopleura nodosa L. Agassiz, 1862. Turritopsis nutricola A. Agassiz, 1862, 1865; Fewkes, 1881; Hargitt, 1905. Syndictyon nodosum Haecke1, 1879. Dysmorphosa carnea Haecke1, 1879. Cytaeis exigua, Haecke1, 1879; Nenni y Stiasny, 1913; Pell, 1918, 1938; Barbik, 1948. Calycidion formosumFewkes, 1882b. Podocoryne conchicolaHargitt, 1904. Hydractinia carneavar.mediterranea Neppi, 1919. Hydractinia carnea Sverdrup, 1921. Descripción. Umbrela en forma de campana, ligeramente más alta que ancha, sin proceso apical. La altura de la umbrela es de 1.0 mm, cuando ha alcanzado Su desarrollo completo; la mesoglea es delgada. El velo es ancho. Los nematocistos aparecen dispersos por la superficie de la exumbrela. El estómago es cilíndrico, su longitud no va más allá de la zona media de la cavidad subumbrelar y carece de pedúnculo. La boca cuando se encuentra extendida presenta un contorno cuadrado, pero por regla general es angosta. En cada una de las esquinas de la boca existe una prominencia de nematocistos, pero sin formar tentáculos orales verdaderos. Las gonadas se localizan en las zonas interradiales del estómago. Carece de yemas medusoides. Los 4 conductos radiales y el conducto circular son estrechos. Lleva 8 tentáculos marginales, 4 de ellos en posición radial y 4 interradiales, los primeros se encuentran bien desarrollados, y los interradiales son más pequeños. El ejemplar que apareció durante el presente estudio, poseía únicamente 6 tentáculos marginales, 4 radiales y 2 interradiales más pequeños que los primeros. Carece de ocelos. Distribución. Se ha recolectado en las zonas costeras europeas, desde el Mediterráneo, hasta Cabo Norte; en Islandia; en las costas orientales de Norteamérica. En África del Sur; en las costas de Chile, y ahora aparece en al región del Pacífico Tropical Oriental en una sola localidad frente a la región sur de Perú (Fig. 124). Podocoryne mínima (Trinci, 1903)(Lám. 4, Fig. 2) Cytaeissp Browne, 1898. Cytaeis minima Trinci, 1903. Dysmorphosa minuta Mayer, 1900. Podocoryne minuta Mayer, 1910. Podocoryne minima Hartlaub, 1911; Kramp, 1928, 1949c, 1968; Russell, 1940b, 1953; Vannuci, 1957; Chow y Huang, 1958. Descrición. La umbrela tiene forma de campana redondeada, ligeramente más alta que ancha, y por lo general con un engrosamiento apical pequeño. La umbrela mide alrededor de 1.0 mm de altura; la mesoglea tiene un grosor regular. El velo es ancho. El estómago es cilíndrico o en forma de botella, y pende de un pedúnculo pequeño. La boca termina en 4 labios radiales elongados, los cuales forman 4 brazos orales sencillos terminando cada uno de ellos en una protuberancia pequeña cubierta de nematocistos. Las gonadas se localizan en las zonas interradiales del estómago. El estómago posee también yemas medusoides en sus paredes. Los 4 conductos radiales y el conducto circular son estrechos. Lleva 4 tentáculos radiales sólidos. Los bulbos tentaculares básales son grandes y redondeados. Carece de ocelos. Distribución. Se localiza en Chefoo, China; en el Mediterráneo; en el Canal de la Mancha; en Brasil, y ahora aparece en el Pacífico Tropical Oriental en 2 localidades frente a Nicaragua (Figs. 76 y 77). Podocoryne simplex Kramp, 1928(Lám. 4, Fig. 3) Podocoryne simplex Kramp, 1928, 1968; Uchida, 19301 1938a, 1938b, 1947a; Russell, 1953; Yamazi, 1958. Descripción. Umbrela en forma de globo. El diámetro y la altura de la umbrela varían de 0.5 a 1.0 mm; la mesoglea es delgada, a excepción del ápice, en donde es ligeramente más gruesa. El velo es ancho. El estómago tiene forma de barril, y se encuentra situado sobre un pedúnculo corto y gelatinoso. El tubo bucal es prismático, las 4 esquinas de la boca se proyectan en 4 brazos tubulares no ramificados, cortos y terminando cada uno de ellos en una protuberancia pequeña cubierta de nematocistos. El manubrio es tan largo casi como la cavidad subumbrelar. Las gonadas se localizan en las paredes interradiales del estómago. La región gonadal del estómago también lleva de 1 a 4 yemas medusoides situadas en las paredes interradiales del mismo. Los 4 conductos radiales y el conducto circular son estrechos. Lleva 4 tentáculos marginales radiales cuya longitud es aproximadamente igual a la altura de la umbrela. Los ejemplares de pequeño tamaño, solo poseen 2 tentáculos opuestos, y los de mayor tamaño, 4, 2 de ellos más grandes que los otros 2. Los bulbos tentaculares básales son anchos. Carece de ocelos. Distribución. Se localiza en Japón; en las Islas Palao, al Este de las Filipinas y ahora ha sido recolectada en el Pacífico Tropical Oriental, apareciendo en algunas localidades, fuera del Golfo de Tehuantepec, frente a Nicaragua, Costa Rica, y al Noroeste y Suroeste de las Islas Galápagos (Figs. 78, 79, 80, 81 y 82). Familia Bougainvillidae Género Lizzia Forbes, 1846 Lizzia alvarinoae, Segura, 1980 (Lám. 4, Fig. 4)Lizzia alvarinoae Segura, 1980. Descripción. Umbrela en forma de domo, ligeramente más alta que ancha, con una proyección apical pequeña. La umbrela tiene un diámetro que varía de 1.0 a 2.0 mm, y una altura de 1.5 a 2.5 mm; la mesoglea tiene un grosor regular, especialmente en la zona apical. El estómago es grande, en forma de barril y se encuentra unido a un pedúnculo prominente de base ancha. El estómago posee yemas medusoides pedunculadas, de forma ovoidea, las cuales se desarrollan en las zonas interradiales. La boca es sencilla, con apertura circular, sin labios prominentes y se encuentra rodeada por 4-20 tentáculos orales no ramificados, los cuales se originan a corta distancia por encima del margen bucal y cada uno de ellos termina en una pequeña protuberancia cubierta de nematocistos. El conjunto de estómago y estructuras bucales se extiende más allá de la zona media de la cavidad subumbrelar. Los 4 conductos radiales y el conducto circular son estrechos. Los 4 tentáculos marginales están en posición radial, llevan bulbos básales grandes, piriformes y con la zona central ligeramente pigmentada. Distribución. Aparece en el Pacífico Tropical Oriental en algunas localidades aisladas entre sí, fuera del Golfo de Tehuantepec, frente a Perú, y al Suroeste de las Islas Galápagos (Figs. 50, 51 y 52). Lizzia ferrarii Segura, 1980(Lárn. 5, Fig. 1) Lizzia ferrariiSegura, 1980. Descripción. Umbrela en forma de domo, algunas veces más ancha que alta, con una proyección apical pequeña. El diámetro de la umbrela varía de 1.0 a 3.0 mm, y la altura de 1.0 a 2.5 mm; la mesoglea es bastante gruesa, especialmente en la región apical. El velo es ancho. El estómago es más o menos cilíndrico y se encuentra unido a un pedúnculo pequeño y cónico. El estómago posee en toda su extensión yemas medusoides piriformes, las cuales se encuentran en diversas fases de desarrollo. Algunas de estas yemas poseen 4 tentáculos marginales pequeños y de igual tamaño. La boca es sencilla con apertura circular, y está rodeada por una hilera de 12-24 tentáculos orales, los cuales se originan a corta distancia por encima del margen bucal, terminando cada uno de ellos en una pequeña protuberancia cubierta de nematocistos. El conjunto integrado por el estómago y las estructuras bucales, se extiende más allá de la zona media de la cavidad subumbrelar. Los 4 conductos radiales y el conducto circular son estrechos. Lleva 8 tentáculos marginales, 4 de ellos en situación radial y 4 ínterradiales. Los tentáculos son largos, m.iden 1/3 más que la altura de la umbrela, y todos son del mismo tamaño. Los bulbos tentaculares básales son grandes, piriformes y se encuentran provistos de una masa densa de pigmento endodérmico de color rojizo, que en los bulbos radiales se extiende ascendiendo un poco por los conductos radiales. Distribución. Se recolectó en el Pacífico Tropical Oriental en diversas localidades alejadas entre sí, frente a las costas mexicanas, El Salvador, Nicaragua, Costa Rica, y al Noroeste y Suroeste de las Islas Galápagos (Figs. 53, 54 y 55). Lizzia gracilis (Mayer, 1900)(Lám. 5, Fig. 2) Cytaeis gracilisMayer, 1900. Podocoryne gracilis Mayer, 1910. Lizzia gracilis Hartlaub, 1911; Vanhöffen, 1919; Kramp, 1928, 1959a, 1968. Descripción. Umbrela de forma achatada, piriforme, con una leve proyección apical; un poco más ancha que alta. El diámetro aproximado de la umbrela es de 2.0 mm; la mesoglea es de grosor regular. El velo es ancho. El estómago es pequeño, y se localiza sobre un pedúnculo corto, ancho y sólido. La boca es sencilla con apertura circular y está rodeada por una hilera de 8 tentáculos orales no ramificados, terminando cada uno de ellos en una protuberancia pequeña cubierta de nematocistos. El estómago posee yemas medusoides localizadas en las 4 zonas interradiales. Cuando las medusas se liberan solo poseen 4 tentáculos marginales de igual tamaño. Los 4 tentáculos interradiales se desarrollan hasta que la medusa alcanza la mitad de su tamaño, y después de que ha adquirido los 8 tentáculos orales. Los 4 conductos radiales y el conducto circular son angostos. Lleva 8 tentáculos marginales rígidos y recurvados hacia arriba del margen umbrelar, los 4 tentáculos radiales son 2/3 tan largos que la altura de la umbrela, los 4 tentáculos interradiales alcanzan solo la mitad de esta longitud. Los bulbos tentaculares básales son grandes, huecos y con su endodermo densamente pigmentado. Distribución. Es una especie nerítica. Se ha observado en Tortugas, Florida (donde fue descrita originalmente); en el Mar de Sonda; en la región Indo-Malaya; en las Islas-Fiji, y ahora ha sido recolectada en el Pacífico Tropical Oriental apareciendo en diversas localidades aisladas entre sí, a lo largo de las costas mexicanas, frente a Nicaragua, Costa Rica, Perú, y al noroeste y suroeste de las Islas Galápagos (Figs. 56, 57, 58, 59 y 60). Género Bougainvillia Lesson, 1836 Bougainvillia fulva Agassiz y Mayer, 1899(Lám. 5, Fig. 3) Bougainvillia fulva Agassiz y Mayer, 1899; Mayer, 1910; Vanhöffen, 1911; Browne, 1916; Bigelow, 1919; Foerster, 1923; Uchida, 1927, 1938a; Kramp, 1928, 1953, 1957a, 1958b, 1968; Stiasny, 1928; Menon, 1932; Nair, 1951; Chiu, 1954b; Vannucci, 1957; Ganapati y Nagabhushanam, 1958; Alvariño, 1964; Fagetti, 1973. Descripción. Umbrela piriforme. El diámetro y la altura de la umbrela varían de 1.0 a 3.0 mm; la mesoglea es de grosor regular. El estómago es pequeño, cruciforme, y tiende a convertirse en forma de cubo cuando las gonadas están completamente desarrolladas. El estómago puede poseer yemas medusoides dispuestas en 8 hileras de racimos meridionales. La boca es sencilla, y se encuentra rodeada por 4 tentáculos orales los cuales se ramifican dicotómicamente desde 2 hasta 8 veces, el tronco basal de los tentáculos orales es corto. Los conductos radiales y el conducto circular son estrechos. Lleva 4 racimos o grupos de tentáculos marginales, en situación radial, cada uno de los cuales posee de 3 a 20 tentáculos cortos. Los bulbos tentaculares básales son pequeños, de forma rectangular en los ejemplares de menor tamaño, y de forma triangular en los ejemplares más grandes. Los ocelos son pequeños y elongados, localizados en la base de los tentáculos marginales. Distribución. De acuerdo con Kramp, esta especie es común en las aguas costeras de las zonas tropicales del Océano Pacífico e Indico, incluyendo la región oriental del Pacífico. Es particularmente común en el Archipiélago Malayo, y se extiende al Oeste de Madrás y en las costas orientales de África. Es una especie bien definida con su centro de dispersión en la región Malaya. En el Pacífico Tropical Oriental apareció con cierta frecuencia en diversas localidades alejadas entre sí, al sur de las Islas Revillagigedo, frente a Nicaragua, Costa Rica, Perú, y en las regiones norte y suroeste de las Islas Galápagos (Figs. 102, 103, 104, 105 y 106). Familia Pandeidae Género Stomotoca L. Agassiz, 1862 Stomotoca pterophylla Haeckel, 1879(Lám. 5, Fig. 4) Stomotoca pterophylla Haeckel, 1879; Mayer, 1910; Bigelow, 1917, 1918, 1926, 1940; Ranson, 1936; Uchida, 1940; Kramp, 1955a, 1955b, 1959a, 1968; Alvariño, 1976. Stomotoca atraVanhöffen,, 1912b. Stomotoca divisa Maas, 1897; Hartlaub, 1913; Foerster, 1923; Boone, 1933. Descripción. Umbrela cónica, y por lo general con una proyección apical puntiaguda. La umbrela mide 4.0 mm de diámetro y 2.0 mm de altura; la mesoglea es gruesa en la zona apical, y delgada en la zona marginal. El velo es angosto. El estómago es grande y se encuentra unido a un pedúnculo cónico y ancho. El manubrio se, extiende más allá del margen umbrelar. Las gonadas se localizan en las paredes del estómago dispuestas en 8 hileras adradiales. La boca posee 4 labios profusamente ondulados. Los 4 conductos radiales son anchos y lisos, a manera de listones, y el conducto circular es estrecho. Lleva 2 tentáculos marginales opuestos y muy largos, además de 60-80 protuberancias marginales rudimentarias. Carece de ocelos. Distribución. Se ha recolectado en las costas de Panamá, Colombia y Perú; en Japón; Se extiende además desde Florida hasta las costas de Maine; en las Bahamas; en el Mar de los Sargazos; en el Golfo de Guinea y en las costas occidentales de África. Durante el presente estudio aparecía en una sola localidad frente a las costas de Ecuador (Fig. 94). Género Halitholus Hartlaub, 1913 Halitholus intermedius (Browne, 1902)(Lám. 6, Fig. 1) Tiara intermedia Browne, 1902; Mayer, 1910; Hartlaub, 1913. Halitholus intermediusBrowne y Kramp, 1939; Kramp, 1957a, 1959a, 1968; Fagetti, 1973. Descripción. Umbrela en forma de campana, ligeramente más alta que ancha y con una proyección apical prominente de forma cónica. El diámetro de la umbrela varía de 2.0 a 5.0 mm, y la altura de 3.0 a 8.0 mm; la mesoglea es gruesa. El estómago es ancho y se extiende hasta cerca de la mitad de la longitud de la cavidad subumbrelar. El estómago posee las gonadas en las regiones interradiales, a manera de pliegues horizontales. La boca es grande, con 4 labios ligeramente lobulados. Los 4 conductos radiales son anchos y lisos, aunque pueden estar ligeramente ondulados en ejemplares contraídos, el conducto circular es estrecho. Lleva 8 tentáculos marginales, 4 radiales y 4 interradiales, 8 bulbos adradiales sin tentáculos, y un número variable de bulbos pequeños. Los bulbos tentaculares son grandes y ligeramente comprimidos lateralmente. Los ocelos se localizan en el lado abaxial de los bulbos básales tentaculares, así como en los bulbos adradiales. Distribución. Es una especie subantártica. Se ha observado en las Islas Malvinas; al Sur de África y en Chile. Ahora ha sido recolectada en el Pacífico Tropical Oriental en algunas localidades alejadas entre sí, frente a Nicaragua, Colombia, Perú y al noroeste y suroeste de las Islas Galápagos (Figs. 195, 196, 197 y 198). Halitholus pauper Hartlaub, 1913(Lám. 6, Fig. 2) Halitholus pauper Hartlaub, 1913; Kramp, 1914, 1926, 1939, 1942, 1943, 1959a, 1968; Foerster, 1923; Thiel, 1932a, 1932b; Uchida, 1930, 1940; Dunbar, 1942; Naumov, 1956. Descripción. Umbrela cilíndrica o en forma de barril, con una proyección apical como lengüeta redondeada. El diámetro de la umbrela va de 3.0 a 4.0 mm, y la altura de 2.0 a 4.0 mm; la mesoglea es gruesa. El estómago es grande, y se extiende hasta la mitad de la longitud de la cavidad subumbrelar. El estómago posee las gonadas a manera de pliegues las cuales semejan la forma de una herradura. La boca es grande y con labios lobulados. Los 4 conductos radiales son anchos y el conducto circular es estrecho. Lleva 8 tentáculos marginales, 4 radiales largos, y 4 interradiales pequeños, distinguiéndose además algunos bulbos rudimentarios pequeños. Los bulbos tentaculares basales son grandes. Los ocelos se localizan en la base de los tentáculos marginales. Distribución. Es una especie predominantemente ártica. Se ha observado en Japón; al suroeste de Kamchatka; en la Isla de Vancouver; en Islandia; en Groenlandia y en Canadá. Ahora ha sido recolectada en el Pacífico Tropical Oriental únicamente en dos localidades, frente a México y Colombia (Fig. 199). Género Leuckartiara Hartlaub, 1913 Leuckartirara zacaeBigelow, 1940 (Lám. 6, Fig. 3) Leuckartiara zacae Bigelow. 1940: Fagetti, 1973; Alvariño, 1976. Descripción.Umbrela en forma de domo. El diámetro de la umbrela varía de 1.0 a 5.0 mm, y la altura de 1.5 a 7.0 mm; la mesogles es de grosor regular La exumbrela posee costillas logitudinales que parten de laas bases de los tentáculos merginales, y contienen cada una de ellas un conducto angosto, existiendo un total de 9 costillas, cada una conectada con un tentáculo. el estómago es grande, se xtiende hasta 2/3 de la longitud de la cividad subumbrelar. La boca posee un margen profusamente lobulado. Las gonadas se localizan sobre las paredes del estomago en una estructura complicada formando numerosos plieges. Los 4 conductos radiales y elñ conducto circular son anchos. lleva 4 tentáculos radiales grandes, y en cada uno de los cuadranes de 2 a 3 tentáculos bien dessarrollandos y de diferente tamaño, además de 1 a 3 bulbos rudimentarios entre cada 2 tentáculos, todos ello con ocelos. Distribución. se ha observado en el Golfo de Panamá; Chile; sumatra, y en el Canal de Mozambique. durante el presente estudio aparecia en algunas localidades frente a las costas mexicanas, al oeste de las Islas Galápagos y frente a Perú (figs. 48 y 49). Género Pandea Lesson, 1843 Pandea sp.(Lám. 6, Fig. 4) Descripción. de formas juveniles. Umbrela en forma de domo, sin engrosamiento apical. El diámetro de la umbrela varía de 1.0 a 2.0 mm, y la altura de 1.0 a 3.0 mm; la mesoglea es gruesa. La exumbrela posee hileras longitudinales de nematocistos, las cuales son tan numerosas como los tentáculos marginales, y se extienden desde el margen de la umbrela hasta el centro de la zona apical de la umbrela. El velo es estrecho. El estómago es grande y ancho, y en algunos ejemplares, ocupa completamente la cavidad subumbrelar. La boca posee labios lobulados. Las gonadas al iniciar el desarrollo presentan su posición marcada por pequeñas fosas aisladas sobre la pared del estómago. Los 4 conductos radiales son anchos y el conducto circular es estrecho. Lleva numerosos tentáculos marginales, hasta 24, número máximo que se ha observado. Los bulbos tentaculares basales son cónicos y comprimidos lateralmente. No hay certeza sobre la presencia de los ocelos. Estos ejemplares son muy semejantes a los descritos por Ranson (1936) y Russell (1953) como formas juveniles dePandea conica, difiriendo únicamente en el número de tentáculos marginales, ya que éstos sólo poseen 4 tentáculos radiales y 6 bulbos tentaculares rudimentarios. También existe una gran afinidad con los estados juveniles descritos por Browne (1916) como Pandea sp, difiriendo de éstos también en el número de tentáculos marginales, presentando únicamente 7 tentáculos marginales y unos cuantos bulbos tentaculares adradiales. Por lo que se puede concluir por el momento, que estos ejemplares son formas juveniles de Pandea cónica, o bien que pertenecen a otra especie estrechamente relacionada con ésta. Distribución. Durante el presente estudio aparecía en algunas localidades al noroeste de las Islas Galápagos, así como frente a las costas de Ecuador y Perú (Figs. 122 y 123). Familia Calycopsidae Género Bythotiara Günter, 1903 Bythotiara drygalskii Vanhöffen, 1912(Lám. 7, Fig. 1) Bythotiara drygalskiiVanhöffen, 1912a; Hartlaub, 1913; Alvariño, 1976. Descripción. Umbrela hemisférica, ligeramente más alta que ancha, con ápice redondeado. La altura de la umbrela es de 2.0 mm; la mesoglea es gruesa. El velo es estrecho. El estómago es grande y sin pedúnculo. La boca posee 4 labios pequeños. Las gonadas son 8, y están localizadas en posición adradial sobre el estómago, y presentan surcos transversales. Los 4 conductos radiales, y el conducto circular son angostos. Lleva 4 tentáculos marginales en posición radial, terminando cada uno de ellos en una protuberancia esférica cubierta de nematocistos. Carece de ocelos. Distribución. Se ha recolectado en el Antártico; frente a las costas de Colombia, y ahora durante el presente estudio aparece en la zona sur frente a Perú (Fig. 191). Género Kanaka Uchida, 1947 Kanaka pelagica Uchida, 1947(Lám. 7, Fig. 2) Kanaka pelagiaUchida, 1947a; Kramp, 1968. Heterotiara minor Kramp, 1953. Descripción. Umbrela en forma de domo, con la región del extremo superior formada por mesoglea gruesa. El diámetro de la umbrela es de 3.0 mm, y la altura de 4.0 mm; mesoglea de grosor regular. El velo es ancho. El estómago es pequeño, y posee yemas medusoides localizadas en las zonas interradiales. Los 4 conductos radiales, y el conducto circular son estrechos. Los conductos radiales muestran una curvatura al nivel de la porción media de su longitud, y no existen conductos centripetales. Lleva 8 tentáculos marginales largos y huecos, que terminan en una protuberancia globosa cubierta con nematocistos. Distribución. Se ha observado en el Pacífico Central. Ahora ha sido recolectada en las cercanías de las Islas Galápagos y frente a la zona sur de Perú (Fig. 20). Orden LeptomedusaeFamilia Dipleurosomatidae Género Dipleurosoma Boek, 1866 Dípleurosoma pacificum Agassiz y Mayer, 1902 (Lám. 7, Fig. 3) Dipleurosoma pacificum Agassiz y Mayer, 1902; Mayer, 1910; Kramp, 1968. Descripción. La umbrela es achatada. El diámetro de la umbrela varía de 5.0 a 7.0 mm; la mesoglea es de grosor regular. El velo es estrecho. El estómago está extendido en la dirección de los dos grupos de conductos radiales opuestos. La boca está rodeada por 6 labios pequeños y lobulados. Los 6 conductos radiales son angostos, y se originan en grupos de 3 desde los lados del estómago, 2 de dichos conductos se bifurcan y así se constituyen 8 conductos radiales. El ejemplar analizado durante el presente estudio, presentaba 10 conductos radiales, uno de los cuales se bifurcaba en la zona próxima al estómago. Las gonadas son lineales, con la superficie ligeramente papilada, y ocupan la región media de los 8 conductos radiales. Lleva alrededor de 100 tentáculos pequeños. Los bulbos tentaculares basales son cónicos. Los ocelos se localizan en la base de la mayoría de los tentáculos. Los órganos sensoriales, o cordili, son en forma de bastones delgados, y se encuentran distribuidos a intervalos irregulares entre los tentáculos. Distribución. Se ha observado al Norte de Tahití; al Sur del Océano Pacífico, y ahora, durante el presente estudio, ha sido recolectada al noroeste de las Islas Galápagos (Fig. 110). Familia Laodiceidae Género Toxorchis Haecke1, 1879 Toxorchis polynema Kramp, 1959(Lám. 7, Fig. 4) Toxorchis polynemaKramp, 1959a, 1959c, 1968; Alvariño, 1977. Descripción. La umbrela es plana y delgada. El diámetro de la umbrela varía de 6.0 a 7.0 mm; la mesoglea es delgada. El velo es muy estrecho. El estómago es ancho y chato. La boca posee labios anchos y lobulados. Los 4 grupos de conductos radiales son angostos, y se bifurcan en el interior de la base cruciforme del estómago dando origen a 16 conductos radiales (4 x 4), los cuales parten del estómago y se dirigen al conducto circular, que también es estrecho. Las gonadas se extienden a lo largo de las 3/4 a 2/3 partes proximales de los conductos radiales, son generalmente de aspecto sinuoso, y se encuentran divididas por una línea media, a lo largo de su eje ventral. Los tentáculos marginales varían en número, observándose de 2 a 5 entre los conductos radiales. Los bulbos tentaculares básales son anchos y en forma de pera. Los cordili tienen forma de bastón, se encuentran situados sobre una protuberancia marginal diminuta, y no poseen nematocistos. Distribución. Se ha observado en Madagascar; desde las Islas Maldivia hasta Ceylán; en el Archipiélago Malayo; en Nueva Zelanda; en las Islas Sociedad y en Samoa; en Angola, y al Oeste de África. Ahora aparece en el Pacífico Tropical Oriental en una sola localidad al noroeste de las Islas Galápagos (Fig. 96). Familia Campanulariidae Género Phialidium Leuckart, 1856 Phialidium simplex Browne, 1902(Lám. 8, Fig. 1) Phialidium simplexBrowne, 1902; Mayer, 1910; Thiel, 1938; Browne y Kramp, 1939; Kramp, 1948a, 1953, 1957a, 1959a, 1968; Vannucci, 1951b; Fagetti, 1973. Descripción. Umbrela en forma de vidrio de reloj. El diámetro de la umbrela varía de 2.5 a 7.0 mm; la mesoglea es de grosor regular. El estómago es corto. La boca posee 4 labios grandes de contornos lobulados. Los 4 conductos radiales son estrechos. Las gonadas se localizan a lo largo de la parte distal de los conductos radiales. En algunos ejemplares se han observado 3 a 6 conductos radiales. Lleva de 60 a 85 tentáculos marginales, además de bastantes bulbos jóvenes. Los bulbos tentaculares básales son globulares. Los estatocistos se localizan entre los tentáculos marginales, cada uno con una concreción. Distribución. Se ha observado en las zonas tropicales de la región oeste del Indopacífico; en las costas de Chile; en África del Sur; en Brasil; en las Islas Campbell, en la región subantártica del Océano Pacífico; al noroeste de Australia y en las Islas Malvinas. Durante el presente estudio aparecía en algunas localidades en las costas mexicanas, al noroeste y suroeste de las Islas Galápagos y frente a Perú (Figs. 64, 65, 66 y 67). Phialidium uchidai Kramp, 1961(Lám. 8, Fig. 2) Phialidium simplex Uchida, 1947a. Phialidium uchidai Kramp, 1961, 1968. Descripción. Umbrela en forma de cúpula de escasa altura. El diámetro de la umbrela varía de 3.0 a 10.0 mm; la mesoglea es delgada. El estómago es pequeño, cuadrangular. Los 4 conductos radiales, y el conducto circular son estrechos. Las gonadas se localizan sobre los 4 conductos radiales, en las cercanías del conducto circular, y son de forma oval o alargada. Lleva de 16 a 28 tentáculos marginales pequeños. Los bulbos tentaculares básales son menos prominentes que en el resto de las especies del género. Posee de 24 a 42 estatocistos dispuestos irregularmente. Distribución. Se ha observado en las Islas Palao, en el Océano Pacífico. Ahora ha sido recolectada en el Pacífico Tropical Oriental, en algunas localidades frente a Nicaragua y Perú (Figs. 68, 69 y 70). Familia Lovenellidae Género Eucheilota. McCrady, 1857 Eucheilota comata (Bigelow, 1909)(Lám. 8, Fig. 3) Phialucium comataBigelow, 1909; Mayer, 1910; Foerster, 1923. Phialopsis comataVanhöffen, 1911. Eucheilota comataKramp, 1959a, 1959c, 1968. Descripción. Umbrela más ancha que alta. El diámetro de la umbrela varía de 6.0 a 12.0 mm; la mesoglea es gruesa. El estómago es corto y en forma de matraz. La boca posee 4 labios lobulados. En los ejemplares de mayor tamaño, se distingue un pedúnculo pequeño. Los 4 conductos radiales y el conducto circular son estrechos. Las gonadas aparecen como pequeñas protuberancias globulares en la región media de los conductos radiales, y con el crecimiento de la medusa se alargan avanzando hacia el conducto circular localizándose finalmente en la mitad distal de los conductos radiales. Lleva 17 tentáculos marginales y 23 bulbos rudimentarios. Los tentáculos marginales son pequeños, y se encuentran flanqueados por 1 a 3 pares de cirros laterales. Los cirros también se localizan a los lados de los bulbos rudimentarios más grandes, sin embargo los bulbos pequeños carecen de ellos. Los bulbos tentaculares básales son prominentes. Los estatocistos varían de 7 a 14, son grandes y se encuentran distribuidos irregularmente. Distribución: Se le ha observado en las costas de México, y en el Océano Pacífico; en Chile y al oeste de la India. Durante el presente estudio aparecía en diversas localidades en las costas de México, frente a Panamá, Colombia, Ecuador, Perú, y al noroeste de las Islas Galápagos (Figs. 34, 35, 36 y 37). Eucheilota menoni Kramp, 1959(Lám. 8, Fíg. 4) Eucheilotasp Menon, 1932. Eucheilota menoni Kramp, 1959c, 1968. Descripción. La umbrela es hemisférica. El diámetro de la umbrela varía de 2.0 a 3.0 mm; la mesoglea es gruesa. El velo es estrecho. El estómago mide la mitad de la longitud de la cavidad subumbrelar, las zonas laterales del estómago poseen gránulos finos de pigmento negro. La boca se encuentra rodeada por 4 labios sencillos. Los 4 conductos radiales y el conducto circular son estrechos. Las gonadas son gruesas y globulares, localizándose entre la porción media y distal de los conductos radiales. Lleva 4 tentáculos radiales grandes, cada uno con un área de pigmento negro, y con 2 o 3 pares de cirros laterales; 4 bulbos, intreradiales grandes y esféricos, también con pigmentación negra, sin cirros laterales; 16 bulbos pequeños sin pigmentación, y 8 vesículas marginales. Los bulbos tentaculares básales son prominentes. Distribución. Se ha observado en Madrás, India; en el Mar de Java; en las Islas Nicobar; en el Estrecho de Málaca y en las Filipinas. Ahora aparece en el Pacífico Tropical Oriental en diversas localidades frente a las costas de Méxíco, Colombia y Ecuador (Figs. 38 y 39). Familia Phialuciidae Género Octophialucium Kramp, 1955 Octophialucium bigelowi, Kramp, 1955(Lám. 9, Fig. 1) Octocanna polynema Bigelow, 1909; Mayer, 1910. Octophialucium bigelowiKramp, 1955a, 1968. Descripción.La umbrela es casi plana. El diámetro de la umbrela varía de 2.0 a 3.0 mm, y la altura es de 1.0 mm; la mesoglea es muy gruesa. El velo es estrecho. El estómago es pequeño. La boca posee 8 labios que terminan en punta. Los 8 conductos radiales son estrechos. Las gonadas se localizan a lo largo, y ocupando la mayor parte de los conductos radiales. Lleva 8 tentáculos marginales grandes, en posición radial, y entre éstos de 1 a 3 bulbos triangulares. Los tentáculos marginales y los bulbos triangulares poseen papilas excretoras sobre el lado oral de sus bases. Posee de 3 a 5 estatocistos dispuestos entre los tentáculos radiales. Distribución. Esta especie ha sido observada en la Bahía de Acapulco, en el Pacífico mexicano; en el Golfo de Panamá. Durante el presenté estudio se recolectó al noroeste y suroeste de las Islas Galápagos (Figs. 62 y 63). Familia Eirenidae Género Phialopsis Torrey, 1909 Phialopsis diegensis Torrey, 1909(Lám. 9, Fig. 2) Phialopsis diegensis Torrey, 1909; Mayer, 1910; Vanhöffen, 1911; Foerster, 1923; Russell, 1940b, 1953; Kramp, 1948b, 1957a, 1959a, 1968; Alvariño, 1969; Fagetti, 1973. rene viridula Maas, 1893; Vanhöffen, 1912b. Eirene diegensisRanson, 1934c. Descripción. Umbrela en forma de campana achatada. El diámetro de la umbrela varía de 3.0 a 21.0 mm; la mesoglea es delgada, engrosada sólo en la región tope del domo. El velo es estrecho. El estómago es muy pequeño, y se encuentra unido a un pedúnculo cónico corto. La boca posee 4 labios radiales muy pequeños y con bordes lobulados. Los 4 conductos radiales son rectos, y el conducto circular es estrecho. Las gonadas son como líneas finas y se localizan sobre los conductos radiales, limitadas al disco de la subumbrela, y se extienden desde la base del pedúnculo del estómago, hasta las cercanías del conducto circular, además carecen del surco medio. Lleva de 16 hasta 28 o más tentáculos marginales huecos; de 3 a 9 bulbos marginales rudimentarios colocados entre los tentáculos marginales, y no existen cirros laterales. Los bulbos tentaculares básales son cónicos y alargados. Posee de 2 a 5 vesículas marginales cerradas situadas entre los tentáculos marginales, cada una con 2 a 6 concreciones. Distribución. Esta especie ha sido recolectada en el Océano Atlántico desde los 35ºS hasta los 60ºN; en San Diego, California; al suroeste de las Islas Galápagos y en la región occidental del Océano Indico, por lo que parece ser una especie con una amplia distribución oceánica. Durante el presente estudio se recolectó en diversas localidades aisladas entre sí frente a las costas de México, Colombia, Ecuador, Perú, y al suroeste de las Islas Galápagos (Figs. 172 y 173). Familia Aequoreidae Género Aequorea Péron y Lesueur, 1809 Aequorea coerulescens (Brandt, 1838)(Lám. 9, Fig. 3) Zygodacty1a coerulescens Brandt, 1838a. Aequorea coerulescens Bigelow, 1909; Mayer, 1910; Foerster, 1923; Uchida, 1927, 1938b, 1947b, 1958; Boone, 1938; Ranson, 1949; Kramp, 1957a, 1959a, 1968; Chow y Huang, 1958; Yamazi, 1958; Alvariño, 1976; Fagetti, 1973. Descripción. Umbrela en forma de casquete casi plano. El diámetro de la umbrela varía de 8.0 a 27.0 mm; la mesoglea es de grosor regular. El velo es estrecho. El estómago en los ejemplares de mayor tamaño ocupa casi la mitad del diámetro de la umbrela. La boca posee 31 labios o prominencias orales pequeñas. Tiene aproximadamente 100 conductos radiales de diferente grosor, unos son anchos, y la mayor parte de ellos muy angostos, sin existir una disposición definida en cuanto al tamaño. Las gonadas se localizan a lo largo de la mayor parte de los conductos radiales, en los anchos, pero no todos los conductos radiales llevan gonadas, ya que los angostos son estériles. Posee numerosos tentáculos marginales, localizándose de 3 a 6 tentáculos entre cada 2 conductos radiales. Los tentáculos son de diferente tamaño, sin existir patrón definido entre ellos, lo que indica que deben representar posiblemente diferentes fases de crecimiento. Además existe un número considerable de bulbos rudimentarios localizados entre los tentáculos marginales. Los bulbos tentaculares básales son largos y comprimidos lateralmente, con papilas excretoras prominentes dispuestas en la base del lado interno. Los estatocistos son muy numerosos y se localizan entre los tentáculos marginales. Distribución. Esta especie ha sido observada en las aguas costeras y zonas templadas de las regiones orientales y occidentales del Océano Pacífico; en el Océano Indico y al sur del Océano Atlántico. Durante el presente estudio se recolectó en diversas localidades al noroeste de las Islas Galápagos, frente a Costa Rica y Perú (Figs. 99 y 100). Aequorea macrodactyla. (Brandt, 1835)(Lám. 9, Fig. 4) Mesonema macrodactyla Brandt, 1835. Aequorea macrodactylum Bigelow, 1909. Aequorea maldiviensis Mayer, 1910. Mesonema coelum pensile Vanhöffen, 1911. Aequorea macrodactyla Browne, 1916; Menon, 1932; Thíel, 1938; Uchida, 1938a, 1947a, 1977b; Kramp, 1953, 1957a, 1957b, 1958a, 1958b; Alvariño, 1964, 1977; Fagetti, 1973. Descripción. Umbrela en forma de casquete plano, con un disco central grueso y lenticular. El diámetro de la umbrela varía de 3.0 a 19.0 mm; la mesoglea es delgada en el margen y gruesa en el disco central. El velo es estrecho. El estómago ocupa casi la mitad del diámetro de la umbrela. Posee de 60 a 100 conductos radiales. Las gonadas se localizan a lo largo de la mayor parte de los conductos radiales. Lleva de 16 a 30 tentáculos marginales, además de 5 a 8 bulbos tentaculares rudimentarios entre cada par de tentáculos. Los bulbos tentaculares básales son anchos, de forma triangular y poseen una quilla abaxial, además de una papila excretora prominente. Los estatocistos varían en número, localizándose de 7 a 15 entre cada par de tentáculos marginales. Distribución. Esta especie ha sido observada en el Pacífico Tropical Oriental; en las aguas costeras de la región Indo-Malaya; en la zona occidental del Océano Indico, desde las Islas Maldivias hasta Madagascar, y en la costa oriental de África; más allá del sureste de África. En el Océano Atlántico su aparición es aislada, en las costas occidentales de África, en la zona sur de las costas orientales de América del Sur; en el Mar Caribe y en las costas suroeste de las Islas Británicas. Durante el presente estudio se recolectó en diversas localidades al noroeste y suroeste de las Islas Galápagos, así como en el extremo sur frente a las costas de Perú (Figs. 8, 9 y 10). Orden Limnomedusae Familia Proboscidactylidae Género Proboscidactyla Brandt, 1835 Proboscidactyla ornata (McCrady, 1857)(Lám. 10, Fig. 1) Willsia ornata McCrady, 1857. Dyscannota dysdipieura Haeckel, 1879. Willeatta ornata Haeckel, 1879. Willia gemnifera Fewkes, 1882b. Proboscidactyla varians Browne, 1905a. Proboscidactyla tropica Browne, 1905a, 1916. Proboscidactyla flavicirralavar. stolonifera Maas, 1905; Mayer, 1910; Ranson, 1937. Proboscidactyla ornata Neppi, 1912: Neppi y Stiasny, 1913; Thiel, 1938; Vannucci, 1951b, 1957; Kramp, 1952, 1953, 1955,a, 1957a, 1959a, 1968; Chiu, 1954a; Yamazi, 1958; Alvariño, 1969. Proboscidactyla ornatavar.gemnifera Vanhöffen, 1912; Bigelow, 1914. Proboscidactyla ornatavar.stolonifera Bigelow, 1919; Foerster, 1923; Berrill, 1950. Porboscidactyla conica Menon, 1932. Proboscidactyla tipica Komai y Yamazi, 1945; Komai, 1951. Proboscidactyla varians Nair, 1951. Probosadactyla mutabilis Ganapati y Nagabhushanam, 1958. Descripción.La umbrela es un poco más alta que un hemisferio. El diámetro de la umbrela varía de 2.0 a 5.0 mm; la mesoglea es gruesa y rígida. El velo es estrecho. El estómago tiene forma de matraz, y se extiende hasta el nivel de la apertura velar. La boca posee 4 labios dispuestos radialmente, recurvados y con bordes lobulados. Las gonadas se desarrollan sobre las zonas interradiales del estómago. El estómago posee yemas medusoides que se originan en las esquinas radiales del mismo, o se desarrollan a nivel de las ramificaciones de los conductos radiales. Las yemas pueden aparecer en diferentes fases de desarrollo. Posee 4 conductos radiales principales los cuales se originan a partir de las 4 esquinas radiales del estómago, cada uno de estos conductos se bifurca dando origen a 2 ramas (conductos primario y secundario), una de éstas, la más larga y la primeramente formada (conducto primario) da origen a otra rama (conducto terciario), posteriormente el conducto secundario da origen nuevamente a otra rama (conducto cuaternario), por lo que se constituyen 16 conductos radiales, cada uno de los cuales termina en la cavidad de un bulbo tentacular basal. No existe conducto circular, y un cordón sólido formado por células endodérmicas conecta todos los bulbos tentaculares entre sí. Posee además 16 conductos centripetales delgados que alternan en posición con los radios tentaculares. Sobre cada uno de estos conductos aparecen en la exumbrela uno o varios grupos de nematocistos. Lleva 16 tentáculos marginales, cada uno de los cuales se localiza en la parte terminal de las ramas de los conductos radiales (4 en cada cuadrante). Los bulbos tentaculares básales son grandes y huecos, y su endodermo está densamente pigmentado. Distribución. Tiene una distribución circunglobal en las aguas cálidas y costeras. Durante el presente estudio aparece en diversas localidades, frente a las costas de México, Nicaragua, Costa Rica, Ecuador, y al noroeste y suroeste de las Islas Galápagos (Figs. 83, 84, 85 y 86). Género Pochella Hartlaub, 1917 Pochella polynema Hartlaub, 1917(Lám. 10, Fig. 2) Pochella polynemaHartlaub, 1917; Russell, 1938, 1953; Kramp, 1947, 1959a, 1968. Descrición. Umbrela en forma de campana o hemisférica. El diámetro de la umbrela varía de 2.0 a 4.0 mm; la mesoglea tiene un grosor regular. El velo es ancho. El estómago es grande, cuadrangular, y se extiende hasta 2/3 de la cavidad subumbrelar. La boca posee 4 labios ligeramente ondulados. Las gonadas son 4 y se localizan sobre el estómago, aparecen en forma de cojinetes cubriendo cada una de ellas la zona interradial de la pared del estómago. Los 4 conductos radiales son lisos y anchos, a menudo con ramificaciones laterales delgadas. El conducto circular no está bien definido. Lleva de 30 hasta 40 tentáculos marginales sólidos. Los bulbos tentaculares básales son grandes y redondeados. Carece de ocelos. Distribución. Su distribución es esporádica. Sólo se ha observado en Vancouver, en las costas del Pacífico norteamericano y en el noroeste de Europa. Ahora aparece en el Pacífico Tropical Oriental en diversas localidades aisladas entre sí, frente a Nicaragua, Perú, y al suroeste de las Islas Galápagos (Figs. 200 y 201). Orden Trachymedusae Familia Halicreatidae Género Haliscera Vanhöffen, 1902 Haliscera bigelowi Kramp, 1947(Lám. 10, Fig. 3) Homeonema albaBigelow, 1909; Alvariño, 1967. Halicreas albaMayer, 1910; Peterson, 1957. Haliscera bigelowi Kramp, 1947, 1948b, 1957a, 1959a, 1968; Russell, 1953. Descripción. Umbrela más o menos hemisférica, con la zona apical en forma de domo, en donde la mesoglea se engruesa notablemente. El diámetro de la umbrela mide 5.0 mm, y la altura 3.0 mm; la mesoglea es delgada, a excepción de la zona apical. El velo es ancho. El estómago es ancho y plano. La boca es sencilla con apertura circular. Los 8 conductos radiales y el conducto circular son anchos. Las gonadas son de forma oval y se localizan a lo largo de la mitad de los conductos radiales, más cerca del estómago que del conducto circular. Posee aproximadamente 96 tentáculos marginales sólidos, alternando largos con pequeños. Los estatocistos son 3, y se localizan en cada uno de los octantes. Distribución. Es una especie batipelágica. Se localiza en la región del Pacífico Tropical Oriental y noroeste de Nueva Zelanda. En el Océano Atlántico se distribuye desde el oeste de África hasta Islandia. Durante el presente estudio aparece en una sola localidad al suroeste de las Islas Galápagos (Fig. 119). Familia Rhopalonematidae Género Rhopalonema Gegenbaur, 1856 Rhopalonema velatum Gegenbaur, 1856(Lám. 10, Fig. 4) Rhopalonema velatum Gegenbaur, 1856; Haecke1, 1879; Maas, 1893, 1905; Vanhöffen, 1902, 1911, 1912a, 1912b; Bigelow, 1909, 1913, 1914, 1915, 1917, 1918, 1919, 1922, 1926; Mayer, 1910, 1915; Neppi y Stiasny, 1911, 1913; Neppi, 1912, 1920; Browne, 1916; Foerster, 1923; Kramp, 1924, 1947, 1948a, 1948b, 1953, 1955a, 1956, 1957a, 1958a, 1958b, 1959a, 1968; Ranson, 1925a, 1925b, 1936, 1949; Uchida, 1928, 1947; Broch, 929; Dawidoff, 1936; Thiel, 1936b, Pell, 1938; Babnik, 1948; Fraser y Saville, 1949b; Moore, 1949; Fraser, 1950, 1952a, 1954a, 1954b, 1955, 1956; Rossi, 1958; Vannucci, 1951b, 1957; Russell, 1953; Chiu, 1954b; Bernard, 1955a; Blackburn, 1955; Huré, 1955; Alvariño, 1957a, 1957b, 1963, 1964, 1968, 1969, 1972, 1976, 1977; Ganapati y Nagabhushanam, 1958; Yamazi, 1958; Fagetti, 1973. Sminthea globosa Gegenbaur, 1856. Sminthea tympanum Gegenbaur, 1856. Calyptra umbiculata Leukart, 1856. Trachynema octonarium Haeckel, 1879. Marmanema tympanum Haeckel, 1879. Marmanema clavigerum Haeckel, 1879. Marmanema umbiculatum Haecke1, 1879. Rhopalonema coerulem Haeckel, 1879; Browne, 1906; Mayer, 1910. Rhopalonema PolydactylumHaeckel, 1879. Marmanema velatoidesMaas, 1893. Rhopalonema striatum Maas, 1893; Mayer, 1910. Rhopalonema typicumAgassiz y Mayer, 1902. Rhopalonema clavigerumMayer, 1910. Descripción. Umbrela en forma hemisférica, a menudo con una proyección apical semejando un pequeño domo. El diámetro de la umbrela varía de 1.0 a 12.0 mm, y la altura de 0.5 a 9.0 mm; la mesoglea es delgada. El velo es muy ancho. El estómago es angosto y elongado, con base octagonal y contráctil, extendiéndose algunas veces hasta las cercanías del margen uníbrelar. La boca posee 4 labios pequeños. Los 8 conductos radiales (4 radiales y 4 interradiales), y el conducto circular son estrechos. Posee 8 gonadas alargadas u ovales que se extienden a lo largo del tercio medio de los conductos radiales. Las gonadas empiezan su desarrollo cuando la medusa ha alcanzado un tamaño aproximado de 4.0 mm de diámetro. Tiene 32 tentáculos marginales, 8 en las bases de los conductos radiales y 24 pequeños, distribuidos alrededor del margen a iguales distancias entre los conductos radiales. Todos los tentáculos son sumamente quebradizos y comúnmente se rompen durante las faenas de arrastre. Los estatocistos se localizan junto a cada uno de los tentáculos marginales. Distribución. Es una especie oceánica, preferentemente epipelágica. Se encuentra distribuida ampliamente en las regiones cálidas y templadas de los grandes océanos, así como en el Mediterráneo. Durante el presente estudio aparece distribuida prácticamente por toda la región, extendiéndose desde los 20ºN hasta los 20ºS, y desde la zona costera hasta los 120ºW (Figs. 174, 175, 176, 177 y 178). Rhopalonema funerarium Vanhöffen, 1902 (Lám. 11, fig. 1)Non Dianaea funeraria Quoy y Gaimard, 1827. Rhopalonema funerariumVanhöffen, 1902, 1920; Bigelow, 1917, 1919; Kramp, 1947, 1948b, 1957a, 1957b, 1959a, 1968; Bigelow, 1926; Broch, 1929; Ranson, 1936; Russell, 1953; Vannucci, 1957; Fagetti, 1973; Alvariño, 1976. Rhopalonema coeruleum Maas, 1906; Mayer, 1910. Descripción. Umbrela más o menos cónica, sin proyección apical. El diámetro de la umbrela varía de 7.0 a 19.0 mm, y la altura de 4.0 a 12.0 mm; la mesoglea tiene un grosor regular. El velo es ancho. El estómago es pequeño. La boca posee 4 labios pequeños. Los 8 conductos radiales y el conducto circular son estrechos. Posee 9 gonadas en forma de huso, elongadas, las cuales se extienden a lo largo de los extremos distales de los conductos radiales. Lleva 8 tentáculos marginales radiales, 8 tentáculos interradiales, y 16 tentáculos muy pequeños en posición adradial, éstos últimos semejan cirros, y cada uno termina en una protuberancia globular. Los estatocistos aparecen en número de 32, y se localizan en la mitad de los espacios entre tentáculos y "cirros". Distribución. Es una especie de régimen batipelágico. Se ha observado en el Pacífico Tropical Oriental; al este de Nueva Zelanda; en el Archipiélago Malayo y en el Océano Índico. En el Océano Atlántico se encuentra distribuida ampliamente, principalmente en las zonas orientales. Durante el presente estudio aparece en diversas localidades oceánicas al noroeste y suroeste de las Islas Galápagos, así como en algunas estaciones alejadas de la costa frente a Ecuador y Perú (Figs. 87, 88, 89 y 90). Género Sminthea Gegenbaur, 1856 Sminthea eurygaster Gegenbaur, 1856 (Lám. 11, Fig. 2)Sminthea eurygaster Gegenbaur, 1856; Mayer, 1910; Grobben, 1915; Neppi, 1915; Browne, 1916; Pell, 1918, 1938; Broch, 1929; Thiel. 1935b, 1936b; Ranson, 1936; Vannucci, 1951b; Blackburn, 1955; Kramp, 1957a, 1958b, 1959a, 1968; Fagetti, 1973. Trachynema eurygaster Haeckel, 1879. Descripción. La umbrela es de forma cónica, de poca altura y lleva una pequeña proyección apical gelatinosa. El diámetro de la umbrela varía de 1.0 a 6.0 mm, y la altura de 0.5 a 3.0 mm; la mesoglea es delgada, a excepción de la zona de la proyección apical. El velo es muy ancho, alcanza aproximadamente la magnitud de la mitad de la altura de la umbrela. El estómago es pequeño. La boca posee 4 labios muy pequeños. Los 8 conductos radiales y el conducto circular son estrechos. Posee 8 gonadas pequeñas, globulares o en forma de huso, las cuales se disponen sobre los 8 conductos radiales muy próximas al conducto circular. Lleva 8 tentáculos marginales en posición radial. Los estatocistos son 8, y se encuentran localizados en las zonas interradiales. Distribución. Es una especie que habita las aguas profundas y mesopelágicas. Se ha observado en el Golfo de Panamá; al este de Australia; cerca de Ceylán; en las Islas Chagos y al norte de Madagascar. En el Océano Atlántico se encuentra distribuida desde los 45ºS hasta el Golfo de Vizcaya. Durante el presente trabajo aparece en diversas áreas esparcidas por la zona de estudio, al norte y sur de las Islas Galápagos, en la región costera de México, Costa Rica, Panamá, Ecuador y en el extremo norte de Perú (Figs. 179, 180, 181 y 182). Género Amphogona Browne, 1905 Amphogona. apsteini (Vanhöffen, 1902)(Lám. 11, Fig. 3) Pantachogon apsteiniVanhöffen, 1902. Amphogona apsteini Browne, 1905a, 1916; Mayer, 1910; Foerster, 1923; Uchida, 1928, 1947a; Kramp, 1953, 1955a, 1956, 1957a, 1959a, 1968. Descripción. La umbrela es de forma ligeramente cónica hasta hemisférica. El diámetro de la umbrela varía de 2.5 a 3.0 mm; la mesoglea es delgada, pero rígida. El velo es ancho. El estómago es pequeño y tiene forma de barril. La boca posee 4 labios sencillos y pequeños que terminan en punta. Los 8 conductos radiales y el conducto circular son estrechos. Las gonadas son más o menos esféricas, y se encuentran sobre los conductos radiales, ocupando solamente una pequeña área cerca del conducto circular. En los organismos adultos todas las gonadas son del mismo tamaño, sin embargo en los organismos pequeños, existen gonadas grandes y pequeñas, alternando unas con otras. En algunos casos, un mismo individuo puede presentar gonadas masculinas y femeninas (4 y 4). Tiene de 40 a 64 tentáculos marginales, frecuentemente 8 en cada octante, aunque ese número puede variar. El número de estatocistos fluctúa de 16 a 24, y se localizan esparcidos entre los tentáculos. Distribución.Se ha observado en las zonas tropicales orientales y occidentales del Océano Pacífico; en el Archipiélago Malayo; en el Océano Indico, desde Sumatra hasta Madagascar; en el Golfo de Guinea y en las costas de África. Durante el presente estudio aparece en dos localidades en los extremos norte y sur frente a las costas de Perú (Fig. 101). Amphogona apicata Kramp, 1957(Lám. 11, Fig. 4) Amphogona apicata Kramp, 1957a, 1959a, 1968. Descripción. La umbrela tiene forma de domo, tan alta como ancha, o más alta que ancha, y con una proyección apical cónica. El diámetro de la umbrela varía de 1.0 a 7.0 mm, y la altura de 1.0 a 8.0 mm; la mesoglea es delgada, a excepción de la región apical que se engruesa. El velo es ancho. El estómago es tubular, y cuando se encuentra contraído, puede adoptar la forma de urna. El estómago se encuentra unido a un pedúnculo gelatinoso, pequeño, de una longitud equivalente a 1/6 de la altura de la cavidad subumbrelar. La boca posee 4 labios sencillos y pequeños. Los 8 conductos radiales y el conducto circular son estrechos. Las gonadas tienen forma de saco, y penden de los conductos radiales, están situadas en la zona próxima a la porción media de esos conductos, pero más cerca del ápice que del margen de la umbrela. Las gonadas por lo general son de diferente tamaño, sin embargo no se encuentran alternando grandes y pequeñas. Lleva unos 64 tentáculos marginales pequeños. No se han observado estatocistos. Distribución. Es una especie batipelágica, que se ha observado en Nueva Zelanda; en el Canal de Mozambique; al Oeste de África y al Suroeste del Océano Atlántico. Ahora aparece en el Pacífico Tropical Oriental, observándose con cierta frecuencia en la mayor parte de la región investigada, frente a las costas de México, Costa Rica, Colombia, Ecuador, Perú, así como en las regiones oceánicas de toda la región, extendiéndose hasta los 1260 longitud Oeste (Figs. 132, 133, 134, 135 y 136). Género Tetrorchis Bigelow, 1909 Tetrorchis erythrogaster Bigelow, 1909(Lám. 12, Fig. 1) Tetrorchis erythrogaster Bigelow, 1909; Mayer, 1910; Thiel, 1936b; Kramp, 1957a, 1959a, 1968; Alvariño, 1976. Descripción. Umbrela piriforme. El diámetro de la umbrela mide 0.5 mm y la altura 1.0 mm; la mesoglea es muy gruesa en la región apical, y se adelgaza hacia el margen. El velo es ancho. El estómago es tubular, y se extiende un poco más allá de la apertura velar. La boca posee 4 labios conspicuos. Los 8 conductos radiales y el conducto circular son anchos. Las gonadas se desarrollan en 4 de los 8 conductos radiales, cerca de su porción media, tienen forma de salchicha, y se encuentran unidas a los conductos radiales por medio de un tallo fino. Lleva 4 tentáculos marginales grandes, opuestos a los 4 conductos radiales fértiles, además de 16 a 24 tentáculos pequeños Los tentáculos marginales grandes son robustos y están provistos de raíces endodérmicas prominentes. No se han observado estatocistos. Distribución. Esta especie habita las aguas profundas de la región mesopelágica. Se ha observado en el Pacífico Tropical Oriental; al este de Nueva Zelanda y en el Océano Atlántico. Durante el presente estudio aparece en una sola localidad costera frente a Colombia (Fig. 95). Género Aglaura, Péron y Lesueur, 1809 Aglaura hemistoma Péron y Lesueur, 1809(Lám. 12, Fig. 2) Aglaura hemistoma Péron y Lesueur, 1809; Haecke1, 1879; Neppi, 1912; Vanhöffen, 1912b; Bigelow, 1913, 1914, 1915, 1917, 1918, 1922, 1926; Neppi y Stiasny, 1913; Mayer, 1915; Pell, 1918. 1938; Foerster, 1923; Ranson, 1925b, 1932b, 1936, 1949; Uchida, 1928, 1940, 1947a, 1947b; Broch, 1929; Candeias, 1930, 1932; Lele y Gae, 1935; Russell, 1935; Thiel, 1935b; Babnik, 1948; Moore, 1949; Berrill, 1950; Nair, 1951; Vannucci, 1951b; 1957; Bal y Pradhan, 1952; Kramp, 1953, 1955a, 1956, 1957a, 1958a. 1959a, 1968; Chiu 1954b; BIackburn, 1955; Huré, 1955; Ganapati y Nagabhushanam, 1958; Yamazi, 1958; Alvariño, 1963, 1968, 1969, 1972, 1976, 1977; Fagetti, 1973. Aglaura hemistoma var. nausica Haeckel, 1879. Aglaura hemistoma var. prismatica Maas, 1897. Aglaura hemistomavar. laterna Maas, 1893. Aglaura hemistoma var. octagona Bigelow, 1904. Aglantha globuligeraHaeckel, 1879. Aglaura elongataVanhöffen, 192la, 1912b. Descripción. La umbrela tiene forma de campana, con el ápice plano. El diámetro de la umbrela varía de 0.5 a 4.0 mm, y la altura de 0.5 a 5.0 mm; la mesoglea es delgada, pero rígida. El velo es ancho. El estómago es pequeño y se encuentra unido a un pedúnculo cónico genetalmente de longitud igual al radio de la umbrela. La boca posee 4 labios sencillos y pequeños. Las gonadas son 81 en forma de salchicha, y se encuentran localizadas sobre el pedúnculo, en el punto de unión de los 8 conductos radiales con el estómago. Los 8 conductos radiales son rectos y anchos, el conducto circular también es ancho. Aparecen de 48 a 85 tentáculos marginales sólidos y quebradizos, los cuales por lo regular se encuentran rotos, sin embargo cuando permanecen completos, llegan a medir una longitud equivalente a 3/4 el diámetro de la umbrela y sus extremos distales poseen forma de bastón. Los estatocistos, en número de 8, se encuentran colocados entre los 8 conductos radiales. Distribución. Es una especie que habita ampliamente las aguas cálidas y templadas de todos los océanos, incluyendo el Mediterráneo. Su amplitud de distribución fluctúa de los 40ºN a los 40ºS. Durante el presente estudio aparece esparcida por una zona amplia que se extiende desde los 20ºN hasta los 20ºS y desde la región costera hasta los 126ºW (Figs. 127, 128, 129, 130 y 131). Familia Geryoniidae Género Geryonia Péron y Lesueur, 1809 Geryonia porboscidalis (Forskal, 1775)(Lám. 12. Fig. 3) Medusa proboscidalis Forskal, 1775. Geryonia hexaphylla Péron y Lesueur, 1809. } Geryonia proboscidalisEschscholtz, 1829; Mayer, 1910 Vanhöffen, 1912b; Bigelow, 1913, 1915, 1918, 1919: 1938; Neppi y Stiasni, 1913; Browne, 1916; Neppi, 1919, 1920; Foerster, 1923; Kramp, 1924, 1948b, 1953, 1955a, 1957a, 1959a, 1968; Ranson, 1925b, 1936; Uchida, 1928, 1938a, 1947b; Broch, 1929; Dawydoff, 1936; Thiel, 1936b; Moore, 1949; Berril, 1950; Vannucci, 1951b, 1957; Chiu, 1954b; B1ackburn, 1955; Yamazi, 1958; Alvarifio, 1963; Fagetti, 1973. Carmarina hastata Schmidt, 1920; Alvarado, 1923a; Slonimski, 1926; Weifi, 1926, 1935; Chiu, 1954b. Descripción. La umbrela es más o menos hemisférica. El diámetro de la umbrela varía de 1.0 a 34.0 mm; la mesoglea es de grosor regular. El velo es ancho. El estómago es pequeño, y se encuentra unido a un pedúnculo largo y cónico, a menudo tan largo como el diámetro de la umbrela. En el pedúnculo se distinguen 6 bandas anchas de músculos longitudinales. La boca posee 6 labios sencillos. Los 6 conductos radiales y el conducto circular son anchos, y posee además 7 o más conductos centripetales (ciegos) localizados en cada uno de los espacios entre los 6 conductos radiales. Las gonadas, en número de 6, tienen forma de corazón alargado, y se localizan sobre los 6 conductos radiales, extendiéndose desde las cercanías de la base del pedúnculo hasta el conducto circular. Lleva 6 tentáculos marginales radiales largos, huecos y contráctiles, y 6 tentáculos interradiales pequeños y sólidos. Los primeros se encuentran localizados en los radios de los 6 conductos radiales, son sumamente contráctiles, y están provistos con anillos de nematocistos, los tentáculos interradiales se proyectan a una corta distancia por encima del margen umbrelar, y van provistos a lo largo del lado aboral de protuberancias pequeñas cubiertas con nematocistos. Los estatocistos, en número de 12, se localizan por encima del velo, cerca de la base de los 12 tentáculos. Distribución.Esta especie se encuentra distribuida en las zonas tropicales y subtropicales de todos los océanos, incluyendo el Mediterráneo, principalmente en los estratos superiores de agua. Esta medusa es más abundante, y de mayor tamaño en el Mediterráneo, que en otras partes del mundo. Durante el presente estudio aparece ocupando pequeñas áreas en las regiones costeras y oceánicas frente a las costas mexicanas, frente a Costa Rica, el noroeste de las Islas Galápagos, y frente a las costas de Perú (Figs. 142, 143, 144, 145 y 146). Género Liriope Lesson, 1843 Liriope tetraphylla (Chamisso y Eysenhardt, 1821)(Lám. 12, Fig. 4) Geryonia tetraphylla Chamisso y Eyenhardt, 1821. Dianaea exigua Quoy y Gaimard, 1827. Geryonia bicolorEschscholtz, 1829. Geryonia rosacea Eschscholtz, 1829; Gegenbaur, 1856. Geryonia exiguaEschtcholtz, 1829; Gegenbaur, 1856. Liriope cerasiformisLesson, 1843; Candeias, 1932. Geryonia appendiculataForbes, 1848. Liriope tetraphyllaGegenbaur, 1856; Vanhöffen, 1902, 1912a, 1912b; Mayer, 1910; Bigelow, 1909, 1913, 1914, 1917, 1918, 1919, 1922. 1938, 1940; Brown, 1916; Udiida, 1927, 1928, 1938.t, 1938b, 1947a, 1947b; Broch, 1929; Menon, 1931, 1932, 1945; Russell, 1933, 1939; Lele y Gae, 1935; Thiel, 1935b; Dawydoff, 1936; Ranson, 1936; Thiel, 1936b; Ling, 1937; CarvaIho, 1951; Babinik, 1948; Moore, 1949; Nair, 1951; Vannucci, 195la, 1951b, 1957; Bal y Pradhan, 1952; B1ackburn, 1955; George, 1953; Kramp, 1953, 1955a, 1955b ( 1956, 1957a, 1958a, 1958b, 1959a, 1959b, 1968; Russell, 1953; Chiu, 1954a, 1954b; Barnard, 1955b; Alvarifio, 1957a, 1957b, 1958, 1963, 1964, 1967, 1968, 1969, 1972, 1976, 1977; Ganapati y Nagabhushanan, 1958; Uchida, 1958; Yamazi, 1958; Fagetti, 1973. Liriope bicolorGegenbaur, 1856. Liriope rosaceaGegenbaur, 1856; Maas, 1897; Hartlaub, 1909b; Mayer, 1910, 1915; Foerster, 1923; Ranson, 1925a. Liriope appendiculata Gegenbaur, 1856. Liriope exigua Gegenbaur, 1856; Mayer, 1910; Ranson, 1925a, 1925b, 1936, 1949; Broch, 1929; Cowles, 1930; Russell, 1935, 1938, 1939; Kramp, 1948b.
Liriope mucronataGegenbaur, 1856; Mayer, 1910; Kramp, 1924; Ranson, 1925a, 1925b.Liriope scutigera McCrady, 1857; Fewkes, 1881; Brooks, 1886; Mayer, 1910; Bigelow, 1914, 1915, 1917, 1922, 1926; Ranson, 1925a, 1925b, 1926, 1949; Eish, 1926; Broch, 1929; Cowles, 1930; Bigelow y Sears, 1939. Liriope catharinensis Muller, 1859; Maas, 1893; Mayer, 1910; Broch, 1929.Xanthea tetraphylla L. Agassiz, 1862. Glossocodon catharinensisHaeckel, 1864. Liriope eurybia Haeckel, 1864; Maas, 1893; Mayer, 1910; Neppi, 1912; Neppi y Stiasny, 1913; Pell, 1918, 1938; Kramp, 1924, 1947, 1948b; Ranson, 1925b; Weill, 1926; Rossi, 1958; Huré, 1955.Liriope liguriana Haeckel, 1864, 1865. Glossocodon eurybia Haeckel, 1865. Glossocodon mucronaton 0. y H. Hertwig, 1878. Liriantha tetraphyllaHaeckel, 1879. Liriantha appendiculataHaeckel, 1879. Liriantha scutigeraHaeckel, 1879. Liriantha catharínensisHaeckel, 1879. Liriantha mucronataHaeckel, 1879. Liriope cerasus Haeckel, 1879. Liriope cruciferaHaeckel, 1879. Liriope conirostrisHaeckel, 1879; Mayer, 1910; Broch, 1929. Glossoconus canariensisHaeckel, 1879. Glossocodon agaricusHaeckel, 1879. Glossocodon lutkeniiHaeckel, 1879. Glossocodon tenuirostrisFewkes, 1882a. Glossonia haecke1iiGoette, 1886. Liriope distanogona Maas, 1893; Mayer, 1910. Liriope compactaMaas, 1893. Liriope minima Maas, 1893; Mayer, 1910; Ranson, 1925a.Liriope hyperbolica Maas, 1893; Mayer, 1910. Liriope hialinaAgassiz y Mayer, 1899. Liriope agaricusVanhöffen, 1902; Mayer, 1910. Liriope canariensisVanhöffen, 1902; Mayer, 1910. Liriope lutkernii Vanhöffen, 1902; Mayer, 1910. Liriope indicaBigelow, 1904; Mayer, 1910; Foerster, 1923. Liriope hemisphericusBigelow, 1904. Liriope haeckeliiHartlaub, 1909b; Mayer, 1910. Liriope spBrowne, 1916; Deevey, 1952b; Chiu y Cutress, 1954. Descripción. La umbrela es hemisférica. El diámetro de la umbrela varía de 0.5 a 14.0 mm; la mesoglea es gruesa en los ejemplares grandes. El velo es ancho. El estómago es pequeño, y se encuentra unido a un pedúnculo largo y de tamaño variable. En el pedúnculo se distinguen 4 bandas de músculos longitudinales. La boca posee 4 labios pequeños. Los 4 conductos radiales y el conducto circular son anchos, además posee de 1 a 3 (o más) conductos centripetales ciegos, los cuales se localizan en cada uno de los cuadrantes. Las gonadas se localizan sobre los 4 conductos radiales y observan una gran variedad de formas y tamaños, desde oval, hastacircular y en forma de corazón. Lleva 4 tentáculos radiales largos, huecos, con anillos de nematocistos en toda su longitud, y 4 tentáculos interradiales pequeños, sólidos con protuberancias cubiertas con nematocistos en posición adaxial. Los estatocistos son en número de 8, y se localizan cerca de la base de los tentáculos. Distribución.Esta especie se encuentra habitando generalmente las regiones templadas y tropicales de todos los océanos, incluyendo el Mediterráneo. En el Océano Pacífico se extiende desde los 40ºN hasta los 40ºS; en el Océano Indico aparece al norte de los 40ºS; en el Océano Atlántico tiene una distribución similar a la del Pacífico, sin embargo en la zona oriental penetra hacia el norte, más allá del Canal de la Mancha. Durante el presente estudio muestra una distribución amplia extendiéndose desde los 20ºN hasta los 20ºS, y desde la región costera hasta los 126ºW (Figs. 147, 148, 149, 150 y 151). Orden Narcomedusae Famiila Aeginidae Género Aegina Eschscholtz, 1829Aegina citrea Eschscholtz, 1829 (Lám. 13, Fig. 1) Aegina citrea Eschscholtz, 1829; Haeckel, 1879; Maas, 1905; Mayer, 1910; Brown, 1916; Bigelow, 1919, 1938, 1940; Ranson, 1925b, 1936; Kramp, 1947, 1948b, 1955a, 1957a, 1958b, 1959a, 1968; Russell, 1953; Chiu, 1954b; B1ackburn, 1955; Petersen, 1957; Van nucci, 1957; Alvarifio, 1964, 1967, 1968, 1972, 1975, 1977; Fagetti, 1973. Aegina roseaEschscoltz, 1829; Haeckel, 1879; Maas, 1909; Vanhöffen, 1912b; Bigelow, 1914, 1919, 1938; Foerster, 1923, Uchida, 1928, 1947b; Broch, 1929; Thiel, 1932a, 1932b, 1935b, 1936b; Vannucci, 1951b; Yashnov, 1952; Naumov, 1956; Yamazi, 1958. Cunarcha aeginoidesHaeckel, 1879, 1881. Aegina rhodinaHaeckel, 1879; Mayer, 1904, 1910; Kramp, 1924; Broch, 1929. Aegina canariensis Haeckel, 1879; Mayer, 1910. Aegina eschscholtzii,Haeckel, 1879; Mayer, 1910. Solmundus tetralinusHaeckel, 1879. Aegina lacteaVanhöffen, 1908a; Bigelow, 1913. Aefina brunneaVanhöffen, 1908a; Mayer, 1910; Bigelow, 1913. Aegina alternansBigelow, 1909; Mayer, 1910; Bigelow, 1913.Aegina pentanemaKishinouye, 1910; Mayer, 1910; Uchida, 1928.Aegina aeginoidesMayer, 1910.Aegina sp Uchida, 1947a; Moore, 1949. Descripción. La umbrela es hemisférica. El diámetro de la umbrela varía de 2.0 a 8.0 mm; la mesoglea es gruesa en el ápice, y muy delgada en el margen de la umbrela. El velo es ancho, con músculos circulares fuertes. El estómago es grande, lenticular de cuya periferia se proyectan 8 bolsas rectangulares, 2 entre cada par de tentáculos. Las bolsas poseen ángulos redondeados, y son tan largas como el radio de la parte central del estómago. Las 8 bolsas están separadas entre sí por medio de 8 fisuras largas y angostas. La boca es sencilla y circular. Las gonadas se desarrollan en el ectodermo de la pared subumbrelar del estómago, alrededor de las porciones periféricas de las bolsas gástricas. Posee sistema de conductos periféricos. Lleva típicamente 4 tentáculos marginales sólidos, los cuales se proyectan de una zona hacia la mitad de la distancia entre el ápice y el margen umbrelar. En la base de cada uno de los tentáculos, se origina una banda peronial, la cual se extiende hasta el margen de la umbrela, dividiéndola así en 4 lóbulos. Entre los ejemplares analizados durante el presente estudio, apareció uno que poseía 5 tentáculos marginales, así como 5 lóbulos. Los estatocistos, en número de 8, se encuentran distribuidos 2 en cada uno de los cuadrantes, sin embargo este número puede variar. Distribución. Esta especie se encuentra ampliamente extendida por las zonas cálidas y templadas de los océanos. En el Océano Pacífico avanza hacia el Norte, hasta las Islas Aleutianas, y hacia el sur frente a Chile y Sur de Australia. En el Océano Atlántico se extiende desde las Islas de Georgia del Sur hasta Islandia. Durante el presente estudio aparece en diversas localidades aisladas entre sí, frente a las costas de Colombia, Ecuador y Perú (Figs. 125 y 126). Género Aeginura Haeckel, 1879 Aeginura beebei Bigelow, 1940(Lám. 13, Fig. 2) Aeginura beebei Bigelow, 1940; Kramp, 1968; Alvariflo, 1976. Descripción.La umbrela es en forma discoidal. El diámetro de la umbrela varía de 8.0 a 18.0 mm; la mesoglea es gruesa en la mitad superior de la umbrela, y delgada en los bordes. El velo es ancho. El estómago es circular y plano, con 22 bolsas gástricas que presentan un contorno de forma romboide, los márgenes interradiales de las bolsas son lobulados. La boca es sencilla y circular. Las gonadas se localizan sobre las paredes de las bolsas gástricas, a nivel de los interradios. Carece de sistema de conductos periféricos. Posee 11 antímeros. Lleva 11 tentáculos marginales primarios, y de 1 a 3 tentáculos secundarios sobre el margen de cada uno de los antímeros. Los tentáculos secundarios difieren estructuralmente de los primarios, los primeros carecen de raíces endodérmicas y sus bases son más turgentes que en los otros. Los estatocistos varían de 1 a 6 en cada uno de los antímeros. Distribución. Es una especie de aguas de superficie. Se ha observado en las aguas costeras de Panamá y Colombia en el Océano Pacífico. Durante el presente estudio aparece en dos localidades alejadas entre sí, frente a las costas de Perú (Figs. 97 y 98). Género Solmundella Haeckel, 1879 Solmundella bitentaculata (Quoy y Gaimard, 1833)(Lám. 13, Fig. 3) Charybdea bitentaculata Quoy y Gaimard, 1833. Aeginopsis mediterráneaMüller, 1851. Solmundella mediterranea Haeckel, 1879; Browne, 1910; Zalenskii, 1911; Mayer, 1915; Browne, 1916; Thiel, 1931, 1936b; Rossi, 1958. Aeginella bitentaculata Haeckel, 1879. Aeginella dissonema Haeckel, 1879. Solmundella mulleri Haeckel, 1879. Solmundella bitentaculata var. mediterranea Mayer, 1910; Neppi, 1912; Neppi y Stiasny, 1913; Babnik, 1948; Berril, 1950. Solmundella bitentaculataMayer, 1910; Vanhöffen, 1911, 1012a, 1912b; Bigelow, 1913, 1919; Mayer, 1914; Browne, 1916; Foerster, 1923; Stiasny, 1928b; Uchida, 1928, 1938a, 1947a; Broch, 1929; Menon, 1931, 1932, 1945; Thiel, 1932a, 1932b, 1935b, 1936b; Lele y Gae, 1935; Dawydoff, 1936; Ling, 1937; Nair, 1951; Vannucci, 1951b, 1957; Bal y Pradhan, 1952; Kramp, 1952, 1953, 1955a, 1956a. 1957a, 1958a, 1958b, 1959a, 1959b, 1968; George, 1953; Chiu 1954a, 1954b; Alvariño, 1957b, 1958, 1968, 1969, 1972, 1976, 1977; B1ackburn, 1955; Naumov, 1956; Ganapati y Nagabhushanam, 1958; Yamazi, 1958; Fagetti, 1973. Descripción. La umbrela es hemisférica. El diámetro de la umbrela varía de 0.5 a 6.0 mm; la mesoglea es gruesa, especialmente en la región apical. El velo es ancho, con músculos circulares y potentes. El estómago es ancho y lenticular, con 8 bolsas gástricas, 2 entre cada par sucesivo de bandas peroniales. Las bolsas gástricas son por lo general de forma rectangular, con los ángulos redondeados. Las gonadas se desarrollan en la pared ectodermal de la subumbrela, por debajo de las bolsas gástricas, y en medusas de gran tamaño, adquieren la forma de un anillo que se localiza cerca de la periferia del estómago central. Lleva 2 tentáculos opuestos y muy largos, los cuales se proyectan desde la umbrela, cerca del ápice. Posee además 2 surcos peroniales profundos que se extienden a lo largo de la exumbrela, desde el margen velar hasta la base de cada uno de los tentáculos. Los estatocistos son en número de 32, 8 en cada cuadrante, aunque por lo general solo aparecen de 8 a 16. Distribución. Es una especie muy común en los océanos con un habitat amplio. En el Océano Pacífico se extiende hacia el Norte hasta Japón y el Sur de California. En el Océano Atlántico se localiza con poca frecuencia, más o menos hasta los 40ºN. Es una especie muy común en el Mediterréneo. También habita la zona circunpolar de las aguas subantárticas. Durante el presente estudio, las poblaciones de esta especie ocupaban un área amplia, extendiéndose desde los 20ºN hasta los 20ºS, y desde la región costera hasta los 126ºW (Figs. 184, 185, 186, 187 y 188). Familia Solmarisidae Género Pegantha Haecke1, 1879 Pegantha clara R. P. Bigelow, 1909(Lám. 13, Fig. 4) Pegantha clara R. P. Bigelow, 1909; Vanhöffen, 1912b; Bigelow, 1914, 1918, 1938, 1940; Kramp, 1947, 1948b, 1957a, 1959a, 1968; Berril, 1950; Alvariño, 1957b, 1978. Pegantha smaragdina H. B. Bigelow, 1909; Mayer, 1910; Hanitzch, 1911; Vanhöffen, 1912b; Bigelow, 1940; Kramp, 1957a. Polycalpa forskaleiVanhöffen, 1908a. Polyxenia spVanhöffen, 1912a. Descripción. La umbrela es hemisférica, de escasa altura y con la superficie aboral lisa. El diámetro de la umbrela varía de 1.5 a 23.0 mm; la mesoglea es gruesa. El velo es estrecho. El estómago es plano, de contorno circular, en los ejemplares pequeños. La boca está rodeada por un labio sencillo y circular. Posee lóbulos marginales cuyo número varía de 9 a 19, que incrementan en número con la edad del organismo. Los lóbulos son cuadrados y en ocasiones más largos que anchos, por lo general en forma de lengüeta. Cada uno de los lóbulos posee de 3 a 5 estatocístos, algunas veces más, así como otoporpa lineales y largos, tan largos como la longitud de los lóbulos marginales. El sistema de conductos periféricos es ancho. Las gonadas se desarrollan a manera de bolsas lisas o ligeramente lobuladas, en los radios de los lóbulos marginales. Lleva de 9 a 18 tentáculos marginales, los cuales se encuentran localizados entre los lóbulos marginales. Los tentáculos al igual que los lóbulos, también aumentan en número con la edad. Un hecho característico de esta especie es que posee una alternancia de generaciones de medusas. La segunda generación se desarrolla en el organismo progenitor, en la substancia gelatinosa de la exumbrela, cerca del margen de la cavidad gástrica. Distribución. Se encuentra habitando ampliamente los 3 grandes océanos, entre los 40ºN a 50ºN y los 40ºS, principalmente en la zona epipelágica. Durante el presente estudio aparece en diversas áreas alejadas entre sí frente a El Salvador, Costa Rica, Golfo de Panamá, Colombia, Ecuador y Perú, así como al noroeste y suroeste de las Islas Galápagos (Figs. 156, 157, 158, 159 y 160). Pegentha martagon Haeckel, 1879 (Lám. 14, Fig. 1) Pegantha martagon Haeckel, 1879; Mayer, 1910; Bigelow, 1918, 1940; Kramp, 1955a, 1955b, 1957a, 1959a, 1968; Fagetti, 1973. Pagantha simplex Bigelow, 1904. Descripción. La umbrela es hemisférica. El diámetro de la umbrela varía de 2.0 a 9.0 mm; la mesoglea es gruesa. El velo es estrecho. La exumbrela es lisa por encima de la inserción de los tentáculos marginales, sin embargo a nivel de los lóbulos marginales, se localizan unas aristas poco prominentes en la línea media de cada lóbulo. El estómago es plano. La boca está rodeada por un labio sencillo y elástico. El número de lóbulos y tentáculos marginales es variable, como sucede comúnmente en el Género. El número más grande es de 15 en ejemplares de 9.0 mm de diámetro, y el más pequeño de 7 en ejemplares de 2.0 a 3.0 mm de diámetro. Los lóbulos son tan largos como anchos, las incisiones entre ellos son profundas, y los peronia cortos. Los tentáculos son tan largos como el diámetro de la umbrela. Las gonadas son simples o lobuladas irregularmente, y se localizan en la zona basal de los lóbulos marginales. El sistema de conductos periféricos se encuentra bien desarrollado, con la porción transversal de los conductos angosta y las porciones laterales proximales anchas, disminuyendo distalmente. Los estatocistos incrementan su número con el crecimiento del individuo, y aún varía en los lóbulos de un mismo organismo, distinguiéndose de 5 a 8 y 9 en cada uno de los lóbulos. Cada estatocisto está conectado con un otoporpa conteniendo nematocistos. Los otoporpa son angos, tos, y tan largos como el doble de la porción trasnversal de los conductos periféricos. Distribución.En una forma de régimen principalmente epipelágico. Se encuentran distribuida ampliamente en los 3 grandes océanos, aproximadamente desde los 40ºN hasta las cercanías del continente Antártico. Durante el presente estudio aparece en diversas localidades costeras y oceánicas frente a México, Nicaragua, Ecuador, Perú, y al noroeste y suroeste de las Islas Galápagos (Figs. 161, 162 y 163). Pegantha triloba Haeckel, 1879(Lám. 14, Fig. 2) Pegantha trilobaHaeckel, 1879; Bigelow, 1909;1928; Mayer, 1910; Vanhöffen, 1912a, 1959a, 1968; Ranson, 1949; Alvariño, 1972, 1976. Descripción. La umbrela es hemisférica o ligeramente aplanada. El diámetro de la umbrela varía de 3.0 a 20.0 mm; la mesoglea es extremadamente rígida. La exumbrela posee una ornamentación característica y bien marcada desde la base de cada uno de los tentáculos se proyecta un surco profundo, el cual se extiende hasta las cercanías del ápice de la umbrela y estos surcos se encuentran flanqueados por aristas que se extienden hacia abajo, hasta alcanzar el margen de los lóbulos marginales; en la linea media de los lóbolos, y tambien extendiendose hacia el ápice, se localiza una segunda serie de aristas, y finalmente posee aristas menos prominentes confinadas a los lóbulos, a lo largo de las lineas de los otoporpa. Los lóbolos marginales son ovales, punteagudos y más largos que anchos, las incisiones entre ellos son porfundas. los otoporpa varían en longitud, los laterales que son los más largos alcanzan el nivel de la base de los tentáculos. Posee de 8 a 16 lóbulos, y de 8 a 16 tentáculos los tentáculos son tal largos como el diámetro de la umbrela, rígidos y recuvados, en los organismos vivos hacia la cavidad umbrelar. El sistema de conductos periféricos se encuentran bien desarrollados. Las gonadas se localizan en el margen del estómago, y se proyectan hacia las cavidades de los lóbulos marginales. Las gonadas, en los ejemplares de mayor tamaño, son trilobadas, cada una consiste en un lóbulo central y dos laterales. El lóbulo central se encuentra rodeado y sostenido por una prominencia gelatinosa, mientras que los lóbulos laterales, que son las porciones sexuales principales de las gonadas, son planos, en forma de hoja y están subdivididos. Loss estatocistos se lozalizan en cada un de los lóbulos marginales, y el número varía de 12 a 20, en los ejemplares de mayor tamaño, y de cuatro a cinco en los más pequeños. Distribución. Es una especie que se encuentra habitando ampliamente los tres grandes océanos, extendiéndose desde los 30ºN hasta los 30ºS. Su distribución vertical también abarca varios estratos. Durante el pressente estudio aparecen diversas localidades alegadas entre si, en el Golfo de Tehuntepec, frente a Ecuador, Perú así como el noroeste y suroeste de las Islas Galápagos (Figs. 164, 165, y 166). Género Solmaris Haeckel, 1879 Solmaris rhodoloma (Brandt, 1838)(Lám. 14, Fig. 3) Aequorea rhodoloma Brandt, 1838a. Solmaris rhodoloma Maas, 1909; Mayer, 1910; Uchida, 1928; Kramp, 1953, 1956, 1959a; B1ackburn, 1955. Solmaris coronaMayer, 1910; Yamazi, 1958. Descripción. Umbrela en forma de disco. El diámetro de la umbrela mide 5.0 mm; la mesoglea es muy delgada. El velo es ancho. El estómago es plano. Las gonadas se encuentran organizadas en forma anular. Posee 30 lóbulos marginales de tamaño variable, cada uno de ellos con 1 a 2 estatocistos. Tiene 30 tentáculos marginales, la mayoría incompletos. Carece de sistema de conductos periféricos y otoporpa. Distribución: Es una forma epipelágica. Se localiza en aguas costeras, cálidas y templadas de las regiones occidental, central y oriental del Océano Pacífico. Durante el presente estudio aparece en una sola localidad oceánica, al suroeste de las Islas Galápagos (Fig. 183). Familia Cuninidae Género Cunina Eschscholtz, 1829 Cunina duplicata Maas, 1893 (Lám. 14, Fig. 4) Cunina duplicata Maas, 1893; Bigelow, 1909, 1918; Mayer, 1910; Thiel, 1936b; Blackburn, 1955; Kramp, 1955a, 1957a, 1959a, 1968; Fagetti, 1973. descripción. La umbrela es aplanada. El diámetro de la umbrela varía de 15.0 a 23.0 mm; la mesoglea es de grosor regular. El velo es ancho. Posee unas 20 bolsas gástricas, las cuales incrementan en número con la edad. Las bolsas gástricas tienen forma de lengüeta, o bien son rectangulares, legeranmente más largas que anchas, con los lados paralelos y separados por espacios amplios, son de diferentes dimensiones, alternando grandes y pequeñas Las gonadas forman una banda sinuosa continua siguiendo los ejes de las bolsas gástricas. Los lóbulos marginales son rectangulares, cada uno de ellos con 2 o 3 estatocistos. Los otoporpa son muy pequeños. Posee sistema de conductos periféricos, cuyaas porciones transversales son estrechaas, y las laterales anchas, sin embargo los ejemplares analizados durante el presente estudio presentaban el sistema de conductos periféricos de tipo uniformemente estrecho. Distribución. Es una forma epipelágica. Se encuentra distribuida amopliamente en los Oceános Índico y Atlántico; en localidades dispersas al Este de Australia y en las costas de Perú. Durante el presente estudio aparece en un área paqueña lejos de las costas de Perú, así como al suroeste de las Islas Galápagos (Figs. 107, 108 y 109). Cunina frugifera Kramp, 1948(Lám. 15, Fig. 1)Cunina frugifera Kramp, 1948b, 1953, 1955a, 1957a, 1959b, 1968; Alvariño, 1976. Descripción.La umbrela es en forma de domo o cúpula. El diámetro de la umbrela varía de 3.0 a 9.0 mm; la mesoglea apical es muy gruesa. El velo es estrecho. Se observan de 6 a 12 bolsas gástricas separadas entre sí por espacios triangulares anchos. Se distinguen yemas medusoides desarrollándose sobre la subumbrela, a los lados de las bolsas gástricas. Los lóbulos marginales son más o menos cuadrados, tan largos como anchos, cada uno con 4 estatocistos. Los otoporpa son lineales. El sistema de conductos periféricos es ancho y plano. Lleva de 6 a 12 tentáculos marginales, los cuales carecen de cojincillos ectodermales en sus bases. Distribución: Es una forma epipelágíca. Se encuentra habitando ampliamente las zonas cálidas de los grandes océanos. Durante el presente estudio aparece únicamente en algunas localidades frente a México, Perú, y al noroeste y suroeste de las Islas Galápagos (Figs. 11, 12 y 13). Cunina globosa Eschscholtz, 1829(Lám. 15, Fig. 2) Cunina globosa Eschscholtz, 1829; Bigelow, 1909; Mayer, 1910; Foerster, 1923; Thiel, 1936b; Naumov, 1956; Kramp, 1957a, 1959a, 1968; Petersen, 1957; Alvariño, 1969, 1976. Descripción. La umbrela es de forma cónica o casi globular. El diámetro de la umbrela varía de 2.0 a 19.0 mm; la mesoglea es gruesa. El velo es estrecho. El estómago es plano, y está unido a un pedúnculo gelatinoso y ancho. Posee de 10 a 14 bolsas gástricas anchas, cuadrangulares, separadas entre sí mediante regiones septales muy angostas. Las gonadas forman espesamientos que cubren la mitad, o tres cuartas partes de las bolsas gástricas. Los lóbulos marginales son cortos y anchos, cada uno contiene 3 nematocistos, los cuales están situados en elevaciones ectodérmicas prominentes. Los otoporpa son cortos y de forma oval. El sistema de conductos periféricos se encuentra bien desarrollado. Los tentáculos marginales se originan a corta distancia por encima del margen umbrelar, su longitud alcanza el tercio del diámetro de la umbrela, y se encuentran con frecuencia recurvados hacia la cavidad subumbrelar, careciendo sus bases de los cojinetes ectodermales. Distribución. Es una forma epipelágica. Aparece frecuentemente en localidades aisladas en los Océanos Pacífico y Atlántico. Durante el presente estudio su distribución se restringe a diversos núcleos pequeños frente a las costas de Colombia, Ecuador, Perú, así como al noroeste y suroeste de las Islas Galápagos (Figs. 14, 15, 16, 17 y 18). Cunina octonaria McCrady, 1857(Lám. 15, fig. 3) Cunina octonaria McCrady, 1857; Kramp, 1953, 1955a, 1957a, 1958b, 1959a, 1959b, 1968; B1ackburn, 1955; Vanucci, 1957; Alvariño, 1968, 1972. Cunoctantha octonariaHaeckel, 1878; Mayer, 1910; Bigelow, 1915; Foerster, 1923; Menon, 1932; Thiel, 1935b, 1936b; Kramp, 1948b; Berril, 1950; Nair, 1951; Vannucci, 1951b. Cunoctantha parasiticaMetschnikoff, 1881. Cunina parasiticaHanitzsch, 1911, 1912. Cunina sp Browne, 1916. Descripción. La umbrela es más plana que un hemisferio. El diámetro de la umbrela varía de 1.0 a 7.0 mm; la mesoglea es de grosor regular. El velo es estrecho. El estómago es cónico y central. La boca posee 4 labios radiales. El estómago posee 8 bolsas gástricas radiales, anchas, cuadradas y muy juntas unas de otras. Las gonadas se desarrollan en el ectodermo de la sumumbrela, inmediatamente por debajo de las 8 bolsas gástricas. Posee 8 lóbulos marginales anchos, cada uno lleva generalmente 3 estatocistos. Los atoporpa son pequeños. Carece de sistema de conductos periféricos. Tiene 8 tentáculos marginales, tan largos como el radio de la umbrela, y se proyectan desde los lados de la umbrela, hacia la mitad del espacio entre el margen y el ápice. Los tentáculos son quebradizos, y poseen cojinetes gruesos de células ectodérmicas, las cuales posiblemente sirvan para sostener a los tentáculos que se originan inmediatamente por encima. Distribución. Es una especie epipelágica que habita zonas amplias en las aguas cálidas de los océanos. Durante el presente estudio aparece en pequeñas áreas frente a las costas mexicanas, centroamericanas y peruanas (Figs. 19, 20, 21, 22 y 23). Cunina peregrina Bigelow, 1909 (Lám. 15, fig. 4) Cunina peregrina Bigelow, 1909; foerster, 1923; Uchida. 1928; Thiel, 1936b; Kramp, 1948b, 1955a, 1956, 1957a, 1959b, 1968; Berrill, 1950; Alvariño, 1967; Fagetti, 1973. Descripción.La umbrela es hemisférica. El diámetro de la umbrela varía de 2.0 a 11.0 mm; la mesoglea es gruesa. El velo es estrecho. El estómago es aplanado. La boca es circular, y se encuentra rodeada por un solo labio. El estómago posee de 8 a 14 (12 comúnmente) bolsas gástricas de forma cuadrangular. Las gonadas se desarrollan sobre la pared gástrica subumbrelar, a lo largo de las bolsas gástricas. Esta especie desarrolla procesos de gemación interna. Dicho proceso tiene lugar dentro de la cavidad gástrica, y está restringido a la superficie oral de las bolsaas gástricas. Los lóbulos marginales son cortos y anchos, cada uno de ellos con 3 a 6 estatocitos. Los otoporpa son lineales y angostos, varían considerablemente en longitud, pero nunca se extienden más allá de la región media de los lóbulos marginales. Carece de sistema de conductos periféricos. Lleva de 8 a 12 tentáculos marginales, los cuales son tan largos como el radio de la umbrela, éstos poseen cojinetes ectodermales en sus bases. Distribución.Setrata de una forma epipelágica que habia ampliamente las aguas cálidas de los grandes aceános. Durante el presente estudio su distribución abarca una zona amplia que se extiende desde los 20ºN hasta los 18ºs, y desde la región costera hasta los 126ºW (fig. 24, 25, 26, 27 y 28). Cunina tenella (Bigelow, 1909)(Lám. 16, Fig. 1) Cunoctantha tenella Bigelow, 1909; Mayer, 1910; Naunov. 1956. Cunina tenella Kramp, 1957a, 1968. Descripción. La umbrela es hemisférica. El diámetro de la umbrela varía de 2.0 a 8.0 mm; la mesoglea es gruesa, especialmente en la región apical. El velo es estrecho. El estómago es lenticular y profundo. La boca posee un labio circular. El estómago lleva 8 bolsas gástricas, de forma más o menos triangular. Las gonadas se desarrollan a lo largo de las bolsas gástricas. Los 8 lóbulos marginales son muy cortos, de contornos redondeados amplios, cada uno con 1 a 3 estatocistos. Los otoporpa son pequeños y lineales. El sistema de conductos periféricos se encuentra bien desarrollado. Lleva 8 tentáculos marginales largos, los cuales poseen en sus bases, cojinetes ectodermales en forma de riñón. Distribución.Es una especie epipelágica. Se ha observado en las costas del Pacífico mexicano, y en el Mar de Ojotsk. Durante el presente estudio aparece en diversas áreas alejadas entre sí, frente al Golfo de Tehuantepec, al oeste de las Islas Galápagos, ocupando en esta última localidad un área que se extiende aproximadamente desde los 15ºN hasta los 15ºS (Figs. 29, 30, 31, 32 y 33) Clase SCPHOMEDUSAE Orden Coronatae Familia Nausithoidae Género Nausithoë Kolliker, 1853 Nausithoë punctata Kolliker, 1853(Lám. 16, Fig. 2) Nausithoë punctataKolliker, 1853, Haecke1, 1880; Mayer, 1910, 1915; Bigelow, 1913, 1917, 1918, 1928, 1938; Vanhöffen, 1912a; Browne, 1916, Kramp, 1924, 1955a, 1955b, 195%, 1968; Thiel, 1928; Candeias, 1930; Menon, 1930; Stíasny, 1931, 1934, 1937, 1940; Weill, 1934b; Komai, 1935, 1936a, 1936b; Zirpolo, 1939; Ranson, 1934a, 1934b; Berrill, 1949; Fraser y Saville, 1949b; Moore, 1949; Fraser, 1950, 1954a, 1955; Nair, 1951; George, 1953; Chiu, 1954b; Hedgpeth, 1954; Uchida, 1954; Horridge, 1956b; Yamazi, 1958; Alvarifio, 1968, 1972, 1975, 1977; Fagetti, 1973. Nusithoë Punctatavar. Pacifica Stiasny, 1919b, 1935. Nausithoë sp Uchida, 1947a; Searle, 1957. Nausithoë Fraser, 1952a. Descripción. La umbrela es de forma discoidal, como un hemisferio achatado. El diámetro de la umbrela varía de 0.5 a 6.0 mm; la mesoglea es gruesa. Carece de velo. El disco central de la exumbrela es grueso, forma como un casquete lenticular con la superficie finamente punteada de gránulos, y se encuentra separado de la zona de pedalia periférica, mediante un surco anular. La zona de pedalia está compuesta de 16 engrosamientos radiales, 8 en los radios de los tentáculos, y 8 en los radios de los órganos sensoriales, alternando en posición con los 16 lóbulos marginales. Los lóbulos marginales son largos, flexibles, y en forma de espátula. Lleva 8 tentáculos marginales en posición adradial, los cuales se originan en fisuras profundas entre los lóbulos marginales. Las bases tentaculares miden aproximadamente 3/4 del diámetro de la umbrela. Posee 8 órganos sensoriales marginales, 4 radiales y 4 interradiales, los cuales se localizan entre los lóbulos marginales, en el fondo de 8 figuras. Los órganos sensoriales poseen una masa distal endodérmica, y un ojo ectodérmico y proximal, porvisto de una lente, una retina y fibras nerviosas. El estómago es central, y está conectado con un seno amplio, anular en el disco, mediante 4 ostia radiales y anchas que alternan con 4 septos interradiales cortos. El seno circular ancho, está inte rrumpido cerca del margen umbrelar por 16 septos en los radios de las líneas medias axiales de los lóbulos marginales, estos septos son incompletos, dejando un conducto circular marginal. Así las 16 bolsas gástricas periféricas, se localizan en los radios de los órganos sensoriales y tentáculos, y se encuentran unidas por el conducto circular marginal en la línea axial de cada uno de los lóbulos marginales. Posee además 4 grupos de filamentos gástricos sencillos, no ramificados localizados sobre los septos interradiales del estómago central, proyectándose centrípetamente hacia el estómago. Cada uno de los grupos posee 7 filamentos gástricos. La bosa es sencilla, cruciforme y con 4 labios. Las gonadas son en número de 8, grandes y globulares, y se localizan en los 8 radios tentaculares, sobre el piso de la subumbrela en la zona del seno circular interno. Distribución. Es una especie común en las aguas cálidas y templadas de todos los océanos. Durante el presente estudio aparece en diversas localidades alejadas entre sí, lejos de las costas de México, en la región costera de Panamá y Ecuador, al sur de las Islas Galápagos, así como frente a las costas de Perú (Figs. 152, 153, 154 y 155). Nausithoë albatrossi (Maas, 1897)(Lám. 16, Fig. 3) Nauphanta albatrossi Maas, 1897. Nausithoë albatrossi Mayer, 1910; Kramp, 1952. Descripción. La umbrela es de forma discoidal. El diámetro de la umbrela mide 20.0 mm; la mesoglea es gruesa. Carece de velo. El disco central de la umbrela es liso. El margen de la umbrela se encuentra dividido en lóbulos marginales angostos y elongados, con los lados paralelos y los extremos redondeados. Lleva 6 tentáculos marginales, los cuales se originan entre los lóbulos marginales. Posee 6 órganos sensoriales marginales que alternan en posición con los tentáculos marginales. El estómago es pequeño. Posee además filamentos gástricos, los cuales están organizados en hileras y situados en los interradios, cada una de las hileras está constituida por 4 grupos de 5 filamentos cada uno. Los filamentos gástricos de cada uno de los grupos, se originan muy juntos entre sí, quedando espacios de considerable amplitud entre cada uno, de los grupos. Las gonadas son en número de 8, grandes y de forma oval, y se localizan sobre el piso de la subumbrela. Distribución: Se ha observado en el Golfo de Panamá y en Chile. Durante el presente estudio aparece en un núcleo pequeño en la región plenamente oceánica al oeste de los 110OW (Fig. 6l). Orden Semaeostomeae Familia Pelagiidae Género Pelagia Péron y Lesueur, 1809 Pelagia noctiluca (Forskal, 1775)(Lám. 16, Fig. 4) Medusa pelagica Linné, 1758. Medusa noctilucaForskal, 1775. Medusa Perla Slabber, 1781; Modeer, 1791. Pelagia cyanellaPéron y Lesueur, 1809; Eschscholtz, 1829; Forbes, 1848; L. Agassiz, 1860; Haecke1, 1880; Mayer, 1910; Bigelow, 1914, 1926; Hartman y Emery, 1956; Vannucci, 1957.Pelagia panopyraPéron y Lesueur, 1809; Eschscholtz, 1829; Brandt, 1838a; Haeckel, 1880; Vanhöffen, 1888; Kishinouye, 1910; Mayer, 1910, 1915, 1917; Bigelow, 1913; Browne, 1916; Stiasny, 1929, 1931; Dakin y Colefax, 1933; Uchida, 1934b, 1935, 1938b, 1947b, 1955, 1958; Yamazi, 1958. Pelagia noctiluca Péron y Lesueur, 1809; Eschscholtz, 1829; Wagner, 1885; Hertwing, 1878; Haecke1, 1879; Metsdinikoff, 1886; Vanhöffen, 1888; Mayer, 1910; Schaxel, 1910a, 1910b; Heymans y Moore, 1923; Kramp, 1924, 1947, 1948a, 1948b, 1955a, 1956, 1959b; Ranson, 1925a, 1925b, 1926; Weill, 1926; Bigelow, 1928, 1940; Menon, 1930; Stiasny, 1931, 1934, 1935, 1937, 1940; Nobre, 1931; Rao, 1931; Boone, 1938 Russell, 1938; Legendre, 1940; Ries y Ries, 1941; Komai, 1942; Ranson, 1945, 1949; Berrill, 1949; Moore, 1949; Franc, 1951; Nair, 1951; Lubet, 1954; Fraser, 1955, 1956; Rossi, 1958; Thiel, 1958; Horridge, 1959; Fagetti, 1973; Alvariño, 1977. Aurelia phosphorica Péron y Lesueur, 1809. Dianaea cyanella Lamark, 1816. Rhizostoma perla Eschscholtz, 1829. Pelagia flaveola Eschscholtz, 1829. Pelagia discoidea Eschscholtz, 1829. Pelagia labiche Eschscholtz, 1829. Pelagia denticulata Brandt, 1838b; Haeckel, 1879. Pelagia phosphora Haeckel, 1879; Vanhöffen, 1888, 1902; Mayer, 1910. Pelagia perla Haeckel, 1879; Delap, 1907; Mayer, 1910; Le Danois, 1913; Broch, 1914; Weill, 1934b; Fraser, 1948, 1950, 154b. Pelagia papillata Haeckel, 1879. Pelagia placenta Haeckel, 1879; Vanhöffen, 1888. Pelagia neglectaVanhöffen, 1888. Pelagia crasaVanhöffen, 1888. Pelagia minutaVanhöffen, 1888. Pelagia noctiluca var. neglecta Mayer, 1910. Pelagia panopyra var. placenta Mayer, 1910. Pelagia purpuroviolaceaStiasny, 1914. Pelagia rosacea Stiasny, 1914. Pelagia curacaoensis Stiasny, 1922. Descripción. La umbrela es hemisférica, en los organismos jóvenes bastante aplanada. El diámetro de la umbrela varía de 2.0 a 35.0 mm; mesoglea es gruesa. Carece de velo. La exumbrela se encuentra cubierta con protuberancias de nematocistos variables en forma, tamaño y distribución. El margen umbrelar está dividido en 16 lóbulos marginales de forma rectangular, con esquinas redondeadas. Lleva 8 tentáculos marginales huecos en posición adradial, tan largos como el doble o triple del diámetro de la umbrela. Posee 8 órganos sensoriales, 4 radiales y 4 interradiales, éstos consisten de estatocistos y bulbos sensoriales, pero sin ocelos, y protegidos por una extensión exumbrelar del margen de la umbrela y de los lados de los lóbulos marginales. El estómago es central y contiene 400 o más filamentos gástricos dispuestos en 4 grupos interradiales. A partir del estómago se origina un tubo oral constituido por mesoglea muy densa. El tubo oral es continuo y se divide distalmente en 4 brazos alargados con bordes sumamente sinuosos. La longitud del manubrio es aproximadamente 1.5 veces el diámetro de la umbrela. El tubo oral mide de 1/3 a 1/4 de la longitud total del manubrio. El manubrio se encuentra cubierto superficialmente con verrugas de nematocistos. Las 4 gonadas son elongadas, muy plegadas y en posición interradial. Distribución. Es una especie oceánica que se encuentra distribuida ampliamente en las aguas cálidas y templadas de los océanos. En el presente estudio aparece en diversas localidades alejadas entre sí, frente a las costas mexicanas, en los alrededores de las Islas Galápagos, frente a Nicaragua, Costa Rica y en la zona costera al Norte de Perú (Figs. 167, 168, 169, 170 y 17l). DISTRIBUCIÓN EN EL PACÍFICO TROPICAL ORIENTALSe identificaron un total de 61 especies de Hidromedusas y 3 especies de Escifomedusas en la región del Pacífico Tropical Oriental. Entre las primeras, se encuentran algunas especies que constituyen las primeras observaciones para la región. Además, especies que habían sido determinadas previamente para esta zona, no aparecieron en las colecciones de plancton aquí analizadas (Tabla 3). Esto se debe seguramente a un fenómeno peculiar que se observa en la mayoría de las especies de medusas, su presencia en los océanos no es constante, debido a que la aparición de las fases adultas, se encuentra restringida únicamente a ciertas épocas del año, y a la particularidad de muchas especies de presentar una distribución errátil (Alvariño, 1975). La distribución de las especies se analiza en relación con las principales masas de agua de superficie características de la zona de estudio. a) Aguas trópico-ecuatoriales superficiales, con una elevada temperatura y una baja salinidad, cuyas propiedades en la región ecuatorial, se encuentran determinadas por la advección estacional de las aguas más frías procedentes de la Corriente de Perú, y de la surgencia ecuatorial y b) agua subtropical superfical, caracterizada por una elevada salinidad y una temperatura generalmente cálida, aunque con temperaturas variables. Una tercera categoría se asigna para aquellas especies que son comunes o ambas localidades, cálidas y templadas, y una cuarta para aquellas medusas de otras regiones oceánicas. MEDUSAS TRÓPICO-ECUATORIALESAequorea macrodactyla (Brandt). Es una especie que fue observada previamente en el Pacífico Tropical Americano (Bigelow, 1909), en el Golfo de Panamá (Kramp, 1959a), y en las costa de Ecuador (Alvariño, 1977). Aparece ahora en la región investigada únicamente durante 3 periodos bimestrales. Durante el periodo de Febrero-Marzo 1967, se observa en dos núcleos de escasa concentración localizados al noroeste y suroeste de las Islas Galápagos (Fig. 8).  TABLA 3. ESPECIES DE MEDUSAS OBSERVADAS PREVIAMENTE EN LA REGIÓN ESTUDIADA 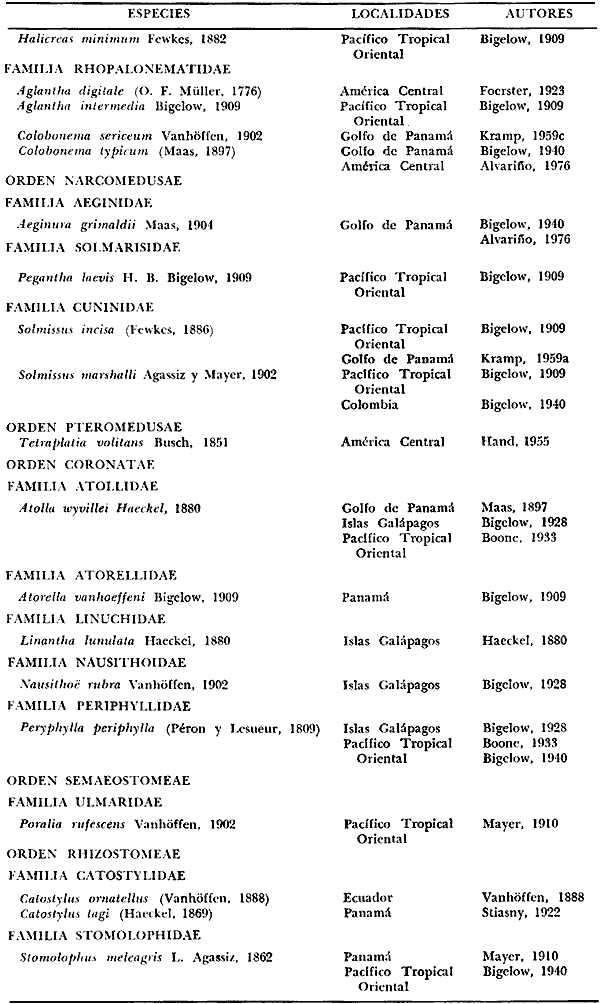 TABLA 3. (Continuación) En el periodo de Abril-Mayo 1967 las poblaciones de A. macrodactyla disminuyen ligeramente, apareciendo un solo núcleo de escasa concentración, en la zona plenamente oceánica, al suroeste de las Islas Galápagos (Fig. 9). Durante el último periodo Febrero-Marzo 1968, se detecta un incremento en la concentración y extensión de las poblaciones, las cuales avanzan hacia el continente en la zona sur de Perú (Fig. 10). A. macrodactylaha sido también observada con anterioridad en esta región por algunos autores (Kramp, 1957, 1968 y Fagetti, 1973). Cunina frugifera Kramp. Es una especie epipelágica que se encuentra distribuida ampliamente por las zonas cálidas de los océanos. Se observa ahora únicamente durante 3 periodos bimestrales. Durante el periodo Febrero-Marzo 1967 su aparición se restringe a 4 núcleos de escasa concentración y alejados entre sí, tres de ellos en la región plenamente oceánica, frente a México, y al noroeste y suroeste de las Islas Galápagos, y el cuarto frente a las costas de Perú (Fig. 11). En el periodo de Agosto-Septiembre 1967 hubo un descenso en la concentración de las poblaciones, apareciendo dos núcleos ocupando las mismas localidades que en el periodo anterior (Fig. 12). Durante el último periodo, Febrero-Marzo 1968 se produce un ligero incremento en la concentración de las poblaciones, apareciendo ahora tres núcleos, dos de ellos al noroeste y suroeste de las Islas Galápagos, y el tercero cerca del continente, frente a las costas de México (Fig. 13). Esta especie ha sido citada previamente para las costas colombianas (Alvariño, 1976). Cuniga globosaEschscholtz. Es una especie epipelágica que se ha determinado en algunas zonas aisladas del Océano Pacífico, así como en el Atlántico. Bigelow (1909) observó esta especie en las costas del Pacífico mexicano y Alvariño (1969) en el Mar de Cortés. En la zona de estudio aparece esparcida por algunas regiones a lo largo de los 5 periodos bimestrales. Durante el periodo Febrero-Marzo 1967 aparecen cuatro núcleos de escasa concentración alejados entre sí. Uno de ellos se localiza en la región plenamente oceánica, al noroeste de las Islas Galápagos (aproximadamente a los 110ºW), y los tres restantes ocupan pequeñas áreas en las cercanías del continente, uno frente a las costas de Colombia, otro aparece en una banda que se extiende desde la zona sur de las Islas Galápagos hasta la región costera frente a Ecuador, y el último frente a la zona de Perú (Fig. 14). En el periodo Abril-Mayo 1967 las poblaciones deC. globosa disminuyen apareciendo únicamente dos núcleos, aunque uno de ellos con una concentración ligeramente más elevada. Dichos núcleos se localizan en la región plenamente oceánica al noroeste de las Islas Galápagos (Fig. 15). Durante el periodo de junio-julio 1967, las poblaciones se incrementan nuevamente de manera similar al primer periodo, ocupando dos áreas al noroeste y suroeste de las Islas Galápagos (Fig. 16). En el siguiente periodo, Agosto-Septiembre 1967 las poblaciones de C. globosadecrecen nuevamente, apareciendo únicamente dos núcleos alejados entre sí, uno de ellos en la región plenamente oceánica al suroeste de las Islas Galápagos, y el otro en las cercanías del continente, frente a las costas de Perú (Fig. 17). Durante el periodo Febrero-Marzo 1968 las poblaciones incrementan en concentración y extensión apareciendo una franja transversal pequeña frente a las costas de Colombia, un núcleo aislado frente a las costas de Ecuador y una franja costera grande, que se extiende desde la región norte hasta la zona meridional de Perú (Fig. 18). Cunina octonaria McCrady. Es una medusa epipelágica que se encuentra abundante y ampliamente distribuida por las regiones cálidas de todos los océanos. Se observa con cierta frecuencia a lo largo de los 5 periodos bimestrales. Durante el primer periodo, Febrero-Marzo 1967 las poblaciones de C. octonariaaparecen en diversos núcleos de escasa concentración y alejados entre sí, lejos de la zona litoral, a excepción de uno de ellos que se localiza frente a las costas de Panamá (Fig. 19). En los periodos de Abril-Mayo y Junio-Julio 1967 se observa un descenso en la concentración de las poblaciones apareciendo un solo núcleo lejos de las costas mexicanas (Figs. 20 y 2l). Durante el cuarto periodo, Agosto-Septiembre 1967 las poblaciones aumentan considerablemente en concentración y extensión, observándose un núcleo de concentración elevada frente a las costas de Ecuador y extendiéndose estas poblaciones por toda la región costera hasta la zona norte de Costa Rica. Alejada de esta área se distingue otra más extensa, localizada al oeste de las Islas Galápagos, la que se extiende hacia el sur frente a las costas de Perú. Al norte las poblaciones de C. octonariaocupaban un área amplia que se extendía desde las costas mexicanas hacia el oeste, llegando aproximadamente a los 120ºW. Sin embargo hay que distinguir la ausencia total de la especie entre las dos primeras áreas, así como en el centro de esta última, debido posiblemente a la incursión de aguas frías en estas zonas (Fig. 22). En el último periodo, Febrero-Marzo 1968 las poblaciones disminuyen, incrementándose así el área despoblada frente al continente, excepto por dos núcleos pequeños en las regiones costeras de Panamá y Ecuador (Fig. 23). Foerster (1923) había observado previamente esta especie en la zona costera del Pacífico mexicano, y Alvariño (1972) en el Golfo de Panamá. Cunina peregrina Bigelow. Es una especie epipelágica que habita comúnmente las aguas cálidas de los grandes océanos. Se observa con cierta frecuencia durante los cinco periodos bimestrales. Durante el periodo de Febrero-Marzo 1967, aparecía distribuida en diversos núcleos de escasa concentración y alejados entre sí, la mayoría de ellos localizados en las cercanías del continente, frente a las costas de México, Costa Rica, Colombia, Ecuador, y Perú (Fig. 24). En el periodo de Abril-Mayo 1967 las poblaciones se concentraban en una sola área, no demasiado extensa, en la región plenamente oceánica al oeste de las Islas Galápagos (Fig. 25). Durante el periodo junio-julio 1967, las poblaciones deC. peregrina disminuyen apareciendo una franja transversal pequeña en la región plenamente oceánica, al noreoste de las Islas Galápagos (Fig. 26). En el siguiente periodo, Agosto-Septiembre 1967 las poblaciones aumentan consecuentemente en concentración y extensión, ocupando tres áreas grandes y alejadas entre sí, en las regiones costeras de México, Costa Rica y Ecuador, así como en la región plenamente oceánica, al oeste de los 90ºW observándose al mismo tiempo la ausencia de la especie en las zonas centrales de estas áreas (Fig. 27). Durante el último periodo, Febrero-Marzo 1968 la concentración de las poblaciones se mantiene más o menos constante con respecto al periodo anterior, distinguiéndose dos áreas principales, al oeste de las Islas Galápagos y frente a las costas de Colombia, Ecuador, y el extremo norte de Perú, dejando una franja despoblada entre estas dos áreas, debido tal vez a la incursión de las aguas frías en esta región (Fig. 28). Bigelow (1909) y Kramp (1956) han observado esta especie en esta zona del Pacífico Tropical Oriental. Alvariño (1967) la cita para la región de San Diego, California y Kramp (1966) la ha recolectado frente a la costa chilena (33º08'S), localidad que constituye el límite máximo de su expansión meridional en esta región. Cunina tenella,(Bigelow). Es una especie epipelágica común en la Bahía de Acapulco (Bigelow, 1909). Aparecía a lo largo de los cinco periodos bimestrales. Durante el periodo Febrero-Marzo 1967, las poblaciones de C. tenella ocupaban diversas áreas de escasa concentración y alejadas entre sí, dos de estas áreas eran grandes en extensión, una de ellas se localizaba frente al Golfo de Tehuantepec, y la otra ocupaba una región amplia al oeste de las las Galapagos, extendiéndose aproximadamente desde los 5ºN hasta los 15ºS (Fig. 29). En el periodo Abril-Mayo 1967, se observa un descenso ligero en la concentración de las poblaciones, persistiendo un núcleo pequeño en las cercanías del Golfo de Tehuantepec (Fig. 30). Durante los meses de junio-julio 1967 las poblaciones aumentaban ligeramente en extensión, distinguiéndose dos áreas de tamaño regular en la región plenamente oceánica al oeste de las Islas Galápagos (Fig. 31). En el siguiente periodo, Agosto-Septiembre 1967 las poblaciones se mantenían más o menos constantes en concentración, sin embargo su distribución se restringía nuevamente a diversos núcleos pequeños y alejados entre sí en algunas regiones costeras, así como en la zona plenamente oceánica, al oeste de las Islas Galápagos (Fig. 32). Durante el último periodo, Febrero-Marzo 1968 las poblaciones de C. tenella aumentaban considerablemente ocupando una franja estrecha lejos de la región costera, al oeste de las Islas Galápagos, que se extendía aproximadamente desde los 150N hasta los 15°S (Fig. 33). Eucheilota comata (Bigelow). Especie que aparecía en diversas localidades a lo largo de cuatro periodos bimestrales. Durante el periodo Febrero-Marzo 1967, las poblaciones deE. comata ocupaban 3 núcleos pequeños de escasa concentración y alejados entre sí, uno de ellos se extendía desde una región localizada frente a las costas de Ecuador hasta el sur de las Islas Galápagos, otro núcleo le localizaba en la región plenamente oceánica frente a Perú, y el tercero en pleno ecéano situado aproximadamente a los 5ºN 20ºW (Fig. 34). En el periodo Abril-Mayo 1967, se registra un descenso ligero en las poblaciones, apareciendo dos núcleos pequeños de escasa concentración, ocupando localidades similares a las del tercer núcleo del periodo anterior (Fig. 35). Durante el periodo de Agosto-Septiembre 1967 se observa un incremento leve en la concentración de las poblaciones, persistiendo tres núcleos pequeños localizados en regiones diferentes, uno en la región costera frente a Colima, y los dos restantes en las cercanías de las costas de Ecuador (Fig. 36). En el último periodo, Febrero-Marzo 1968 las poblaciones deE. comataextienden su distribución, ocupando un área grande al oeste de las Islas Galápagos, así como una franja costera pequeña, frente a la zona costera de Panamá y Colombia (Fig. 37). Dos autores, Bigelow (1909), y Kramp (1959c), han observado también esta especie en las costas del Pacífico mexicano. Eucheilota menoni Kramp. Esta es la primera observación de esta especie para el Pacífico Tropical Oriental, apareciendo durante el periodo de FebreroMarzo 1967 en un solo núcleo pequeño de escasa concentración, alejado de las costas sur de México (Fig. 38). Durante el periodo de Agosto-Septiembre 1967, se observa un incremento en la concentración de las poblaciones, distinguiéndose tres núcleos pequeños localizados en las regiones costeras de México, Colombia y Ecuador (Fig. 39). Esta especie ha sido observada con anterioridad en Madras, India (Menon, 1932), y en las Islas Nicobar, el Estrecho de Málaca, las Filipinas, así como en el Mar de Java (Kramp, 1959c). Euphysilla pyramidataKramp. Especie determinada previamente para el Golfo de Guinea (Kramp, 1955a), siendo ésta la primera vez que se observa en el Pacífico Tropical Oriental. Aparece con cierta frecuencia durante los cinco periodos bimestrales. Durante el primer periodo, FebreroMarzo 1967, se observa en diversos núcleos pequeños de escasa concentración y alejados entre sí, localizados en la región costera de México, en una zona alejada de la costa frente a Ecuador, al noroeste y suroeste de las Islas Galápagos, así como en la región plenamente oceánica, al oeste de los 110ºW (Fig. 40). En los meses de Abril-Mayo 1967, las poblaciones de E. pyramidata decrecen en extensión, apareciendo únicamente dos núcleos pequeños de escasa concentración, uno en las cercanías del Golfo de Tehuantepec, y el otro un poco más al oeste de este núcleo (Fig. 41). Durante el periodo de junio-julio 1967, se detecta un incremento ligero en la concentración de las poblaciones apareciendo un núcleo grande en las cercanías del Golfo de Tehuantepec, y otro más pequeños, en la región plenamente oceánica, al oeste de los 110ºW (Fig. 42). En el periodo de Agosto-Septiembre 1967, las poblaciones continúan aumentando, ocupando un área más amplia la que se extiende desde la región costera de jalisco, hasta una zona alejada de la costa frente al extremo norte de Costa Rica, también se observan dos núcleos pequeños frente a Costa Rica, y al oeste de los 110ºW (Fig. 43). En el último periodo, Febrero-Marzo 1968, las poblaciones se mantienen en concentraciones similares al periodo anterior, ocupando localidades diferentes. Se distinguen dos franjas no muy extensas al noroeste y suroeste de las Islas Galápagos, así como dos núcleos pequeños, uno frente a las costas de Nicaragua, y el otro en la región plenamente oceánica, al oeste de los 110ºW (Fig. 44). Euphysora bigelowi Maas. Es una especie poco común, observándose únicamente durante dos periodos bimestrales. Durante el periodo de FebreroMarzo 1967 aparece un núcleo pequeño de escasa concentración en una región alejada de las costas frente a Colombia (Fig. 45). En el periodo de Agosto-Septiembre 1967, se observa nuevamente un núcleo pequeño de escasa concentración hacia el norte, en la región costera de Costa Rica (Fig. 46). Esta especie ha sido citada con anterioridad para las costas sur de Chile (Kramp, 1952). Gotoea similisKramp. Es una especie común en el Océano Indico, y rara en el Océano Atlántico (Kramp, 1968). Aparece ahora por primera vez en el Océano Pacífico, observándose durante el periodo de Agosto-Septiembre 1967, en un núcleo pequeño de escasa concentración lejos de la costa, frente a Costa Rica (Fig. 47). Es una de las pocas especies que habitan las aguas del Océano Indico, y que extienden su distribución al Pacífico Tropical Oriental. Leukartiara zacae Bigelow. Es una especie desconocida en el Océano Atlántico y típica del Pacífico Tropical Americano. Aparece únicamente durante dos periodos bimestrales. Durante el primer periodo, Febrero-Marzo 1967, las poblaciones de L. zacaeocupaban diversos núcleos de escasa concentración y esparcidos por la zona de estudio, en la región costera de México, en las cercanías de las Islas Galápagos, en la región plenamente oceánica al sur de Perú, y al oeste de los 1100 longitud Oeste (Fig. 48). En el periodo Febrero-Marzo 1968, las poblaciones decrecen apareciendo únicamente dos núcleos pequeños de escasa concentración en la región oceánica al oeste de los 110ºW (Fig. 49). Esta especie también ha sido observada en el Golfo de Panamá (Bigelow, 1940); en las costas de Chile (Kramp, 1966); en el Pacífico colombiano; en la Península de Nicoya (zona límite entre El Salvador y Guatemala) y en el Golfo de Tehuantepec (Alvariño, 1976). Su distribución hacia el Norte se extiende hasta California (Alvariño, 198-). Lizzia alvarinoae Segura. Esta especie se observa únicamente durante tres periodos bimestrales. En el periodo Febrero-Marzo 1967, aparece un núcleo pequeño de escasa concentración alejado de la costa frente a la zona meridional de Perú (Fig. 50). Durante el periodo de Abril-Mayo 1967, las poblaciones se mantienen constantes, apareciendo un núcleo pequeño en latitudes más altas, fuera del Golfo de Tehuantpeec (Fig. 51). En el último periodo, Febrero-Marzo 1968 se observa un incremento en las poblaciones de L. alvarinoae apareciendo diversos núcleos pequeños y alejados entre sí, frente a Perú, y al suroeste de las Islas Galápagos (Fig. 52). Lizzia ferrarii Segura. La aparición de esta especie, al igual que la anterior, presentaba discontinuidad a lo largo de los cinco periodos bimestrales, apareciendo durante cada periodo en regiones diferentes, lo cual señala su característica distribucional errátil. En el periodo Febrero-Marzo 1967, las poblaciones deL. ferrari ocupaban tres núcleos pequeños de escasa concentración, en una zona alejada de la costa frente a El Salvador, Ecuador y Perú (Fig. 53). Durante el periodo de Agosto-Septiembre 1967, se observa un ligero incremento en la concentración de las poblaciones, apareciendo diversos núcleos pequeños y alejados entre sí, en la zona costera de México, un núcleo alejado de la costa que se extiende desde los 13ºN hasta los 5ºS, frente a las costas de Ecuador, y al noroeste de las Islas Galápagos (Fig. 54). En el periodo de Febrero-Marzo 1968, las poblaciones aumentaban en concentración y extensión, distinguiéndose un núcleo de concentración elevada al suroeste de las Islas Galápagos, extendiéndose estas poblaciones al este, así como al oeste hasta llegar a las cercanías del continente (Fig. 55). Lizzia gracilis (Mayer). Especie que ha sido citada previamente para Tortugas, Florida, (Vanhöffen, 1913 y Mayer, 1910); para el Mar de Sonda, Indonesia (Kramp, 1928), y para las Islas Fiji, el Estrecho de Málaca; la Bahía de Candos y el Mar de Java (Kramp, 1965). La presencia de esta especie en la zona de estudio constituye la primera observación que se tiene para el Pacífico Tropical Oriental. Su aparición es continua, aunque poco frecuente, a lo largo de los cinco periodos bimestrales. Durante el periodo de Febrero-Marzo 1967 aparece en diversos núcleos pequeños de escasa concentración, frente a las costas mexicanas y frente a Perú (Fig. 56). En el periodo de Abril-Mayo 1967, las poblaciones de L. gracilis, decrecen ligeramente apareciendo únicamente dos núcleos pequeños, uno de ellos persiste en su localización frente a las costas mexicanas, y el otro aparece al oeste de los 100ºW (Fig. 57). Durante el periodo de junio-julio 1967, se observa un incremento en las poblaciones, distinguiéndose dos núcleos de extensión regular, en el Golfo de Tehuantepec, y en la región plenamente oceánica, al oeste de los 110ºW (Fig. 58). En el periodo de Agosto-Septiembre 1967 las poblaciones se mantienen en concentraciones similares con respecto al periodo anterior, observándose una franja costera que se extiende desde la zona meridional de México hasta Guatemala, dejando una zona despoblada cerca del Golfo de Tehuantepec (Fig. 59). Durante el último periodo, Febrero-Marzo 1967 las poblaciones de L. gracilis disminuyen nuevamente, apareciendo dos núcleos pequeños de escasa concentración al noroeste Y suroeste de las Islas Galápagos (Fig. 60). Nausithoë albatrossi (Maas). Aparece únicamente durante el periodo de Junio-Julio, 1967 ocupando un núcleo pequeño de escasa concentración, en la región plenamente oceánica al oeste de los 110ºW (Fig. 61). Esta especie había sido observada únicamente por Maas (1897) en el Golfo de Panamá, sin embargo Kramp (1952), la determinó en Chile, y la confirma como una especie válida. La presencia de esta especie en el área de estudio, extiende su distribución longitudinal hacia el oeste (118º34'W). Octophialucium bigelowiKramp. Especie citada con anterioridad para la Bahía de Acapulco (Bigelow, 1909), y para el Golfo de Panamá (Kramp, 1965). Se observa únicamente durante dos periodos bimestrales. En el periodo de Febrero-Marzo 1967, aparece en un núcleo pequeño de escasa concentración, en la región plenamente oceánica, al oeste de los 110ºW (Fig. 62). Durante el periodo de Agosto-Septiembre 1967, las poblaciones se mantienen constantes con respecto al periodo anterior, distinguiéndose un núcleo pequeño en la misma latitud, solo que en la zona norte, aproximadamente a los 11ºN (Fig. 63). De esta manera O. bigelowi extiende su distribución hacia la zona oeste de la región investigada. Phialidium simplex Browne. Es una especie con una amplia distribución en las regiones tropicales del Océano Indico. La única observación sobre su presencia en el Pacífico Tropical Oriental corresponde a las costas chilenas (Kramp, 1966 y Fagetti, 1973). Ahora aparece en otras localidades en la zona durante cuatro periodos bimestrales. En el periodo de Abril Mayo 1967, las poblaciones de P. simplex ocupaban un solo núcleo pequeño de escasa con centración al oeste de las Islas Galápagos, aproximadamente a los 0º (Fig. 64). En el siguiente periodo Junio-julio 1967 las poblaciones incrementan ligeramente en concentración, apareciendo ahora dos núcleos pequeños con una localización similar a la del periodo anterior (Fig 65). Durante el periodo de Agosto-Septiembre 1967, las poblaciones aumentaban en extensión, apareciendo diversos núcleos pequefios de escasa concentración y alejados entre sí, en la zona costera de la región meridional de México, así como al noroeste y suroeste de las Islas Galápagos (Fig. 66). En el último periodo, Febrero-Marzo 1968, las poblaciones se mantenían constantes con respecto al periodo anterior, detectándose algunos núcleos pequeños al suroeste de las Islas Galápagos y frente a Perú (Fig. 67). Así, P. simplex amplía su distribución hacia latitudes más altas. Phialidium uchidaiKramp. Esta especie solo ha sido observada en el Océano Pacífico en las Islas Palao, al este de las Filipinas. La aparición de esta especie en el área de estudio, constituye el primer registro de su presencia en el Pacífico Tropical Oriental. Se ha observado únicamente durante tres periodos bimestrales. En el periodode FebreroMarzo 1967, aparecía en un núcleo pequefio de escasa concentración en la zona costera al sur de Perú (Fig. 68). Durante el periodo de Agosto-Septiembre 1967 las poblaciones de P. uchidai se mantienen en concentraciones similares con respecto al periodo anterior, observándose un núcleo pequeño alejado de la costa meridional de Perú (Fig. 69). En el último periodo, Fabrero-Marzo 1968, las poblaciones se mantenían en la misma concentración, apareciendo un núcleo pequeño en latitudes más altas, frente a Nicaragua, al oeste de los 100ºW (Fig. 70). Como se puede apreciar, es una especie cuya aparición en el plancton es esporádica, y al mismo tiempo en escaso número. Podocoryne apicata Kramp. Especie que solo ha sido observada en la región Indo-Malaya, pero ahora por primera vez se ha determinado su presencia en el Pacífico Tropical Oriental. Su aparición es en escaso número, pero constante a lo largo de los cinco periodos bimestrales. En el periodo de Febrero-Marzo 1967, se observa en algunos núcleos pequeños de escasa concentración, en la zona costera sur de México, en la región plenamente oceánica al oeste de los 110ºW, así como en una región alejada de la costa frente a la zona sur de Perú (Fig. 7 l). Durante el periodo de Abril-Mayo 1967, las poblaciones disminuían considerablemente en número, apareciendo un solo núcleo pequéño en la región plenamente oceánica, frente a Nicaragua, al oeste de los 110ºW (Fig. 72). En el siguiente periodo, junio-julio 1967 las poblaciones se mantenían similares en concentración, así como en localización con respecto al periodo anterior (Fig. 73). Durante el periodo de Agosto-Septiembre 1967, se observa un incremento en las poblaciones, apareciendo tres núcleos pequeños al suroeste del Golfo de Tehuantepec, al noreste de las Islas Galápagos, y al sur frente a las costas de Perú (Fig. 74). En el último periodo, Febrero-Marzo 1968 las poblaciones continuaban aumentando, distinguiéndose diversos núcleos esparcidos por la zona, al noroeste y suroeste de las Islas Galápagos, así como en la región costera del extremo norte de Perú (Fig. 75). Podocoryne minima (Trinci). Es una especie que ahora se determina por primera vez para el Pacífico Tropical Oriental. Aparece únicamente durante dos periodos bimestrales. En el periodo de Abril-Mayo 1967, las poblaciones de P. minima ocupaban un núcleo pequeño de escasa concentración alejado de la costa, frente al extremo norte de Nicaragua (Fig. 76). Durante el periodo de Agosto-Septiembre 1967 las poblaciones se mantenían constantes en concentración, distinguiéndose nuevamente un número pequeño en la región plenamente oceánica, al oeste de los 110ºW (Fig. 77). Esta especie ha sido citada con anterioridad para el Mediterráneo (Trinci, 1903); el Canal de la Mancha (Russell, 1940b, 1953); Brasil (Vannucci, 1957) y Chefoo, China (Chow y Huang, 1958). Podocoryne simplex Kramp. Es otra de las especies que aparece por primera vez en el Pacífico Tropical Oriental, observándose en algunas localidades durante los cinco periodos bimestrales. En el periodo de Febrero-Marzo 1967, aparece en tres núcleos pequeños de escasa concentración, fuera del Golfo de Tehuantepec, frente a las costas de Colombia, y al suroeste de las Islas Galápagos (Fig. 78). Durante el periodo de Abril-Mayo 1967, las poblaciones de P. simplex decrecen ligeramente, observándose un solo núcleo pequeño al noroeste de las Islas Galápagos (Fig. 79). En el siguiente periodo, junio-julio 1967, las poblaciones se mantienen constantes con respecto al periodo anterior, distinguiéndose ahora el núcleo en la región plenamente oceánica, al oeste de los 110ºW (Fig. 80). Durante el periodo de Agosto-Septiembre, las poblaciones aumentaban ligeramente, apareciendo dos núcleos pequeños en las costas de Colima, y al noroeste de las Islas Galápagos (Fig. 8l). En el último periodo, Febrero-Marzo 1968 se distinguen, al igual que en el primer periodo, tres núcleos pequeños de escasa concentración en la región sur, al suroeste de las Islas Galápagos, y frente a Perú (Fig. 82). P. simplex ha sido observada previamente en algunas localidades de Japón (Uchida, 1930, 1938a, 1938b y Yamazi, 1958), y en las Islas Palao, al este de las Filipinas (Uchida, 1947a). Proboscidactyla ornata. Es una especie estrictamente nerítica, y tiene una distribución circunglobal en las aguas cálidas y costeras. Su presencia es escasa durante cuatro periodos bimestrales. En el periodo de Abril-Mayo 1967, aparece en dos núcleos pequeños de escasa concentración, lejos del Golfo de Tehuantepec, y al noroeste de las Islas Galápagos (Fig. 83). Durante el siguiente periodo, junio-julio 1967, las poblaciones de P. ornata decrecen, apareciendo un solo núcleo pequeño al noroeste de las Islas Galápagos (Fig. 84). En el periodo de Agosto-Septiembre 1967, se observa un incremento ligero en las poblaciones, apareciendo dos núcleos pequeños, en la región costera de jalisco, y frente a las costas de Ecuador (Fig. 85). Durante el último periodo, Febrero-Marzo 1968 las poblaciones se mantienen constantes, observándose dos núcleos pequeños, lejos de las costas de Costa Rica, yen la región plenamente oceánica, al suroeste de las Islas Galápagos (Fig. 86). Esta especie ha sido observada previamente en la región, únicamente en dos localidades, en la Bahía de Acapulco (Bigelow, 1909), y en las costas de Chile (Kramp, 1952). Alvariño (1969) la ha observado al norte, en el Mar de Cortés. Rhopalonema funerariumVanhöffen. Es una especie de régimen predominantemente batipelágico, con una distribución circunglobal en las aguas cálidas de los océanos. Se observa con cierta frecuencia a lo largo de cuatro periodos bimestrales. Durante el periodo de FebreroMarzo 1967, aparece en 4 núcleos de escasa concentración, dos grandes y dos pequeños, en la región plenamente oceánica al noroeste y suroeste de las Islas Galápagos (Fig. 87). En el periodo de Abril-Mayo 1967, las poblaciones deRh. funerarium disminuían considerablemente observándose 4 núcleos pequeños que ocupaban localidades similares a las del periodo anterior (Fig. 88). Durante el periodo de Agosto-Septiembre 1967, las poblaciones disminuían apareciendo únicamente un núcleo pequeño de escasa concentración frente a las costas de Perú (Fig. 89). En el último periodo, Febrero-Marzo 1968 las poblaciones aumentaban considerablemente apareciendo diversos núcleos pequeños de escasa concentración y alejados entre sí, frente a las costas de Ecuador, Perú, así como al noroeste y suroeste de las Islas Galápagos (Fig. 90). Esta especie ha sido citada para el Pacífico Tropical Americano (Mayer, 1910), y para Colombia (Al variño, 1976). Recientemente fue recolectada en el Pacífico Sur Oriental, en el sector de la Corriente de Perú, frente a Chile (Fagetti, 1973). Sarsia coccometra Bigelow. Es una especie de escasa abundancia, y de aparición esporádica, apareciendo únicamente durante tres periodos bimestrales. En el primer periodo, Febrero-Marzo 1967 aparecen dos núcleos pequeños de escasa concentración, lejos de las costas de Colombia, y frente a las costas de Ecuador (Fig. 91). Durante el periodo de Agosto-Septiembre 1967 las poblaciones de S. coccometradisminuyen, y el núcleo que se encontraba lejos de las costas colombianas, avanza hacia la costa, extendiéndose en toda la región costera de Colombia (Figura 92). En el último periodo, Febrero-Marzo 1968 las poblaciones se mantienen en concentraciones similares, apareciendo un núcleo pequeño frente a las costas de Ecuador (Fig. 93). Esta especie fue originalmente descrita para las costas de América Central (Bigelow, 1909), y desde entonces no se había vuelto a observar en esta región del Pacífico. Stomotoca pterophyllaHaeckel. Aparecía únicamente durante un periodo bimestral, Febrero-Marzo 1968, en un núcleo pequeño de escasa concentración alejado de la costa, frente a Ecuador (Fig. 94). Esta especie ha sido determinada con anterioridad para las zonas de Panamá (Mayer, 1910); Callao, Perú (Vanhöffen, 1912b), y Colombia (Alvariño, 1976). Tetrorchis erythrogaster. Al igual que la especie anterior, se observa únicamente durante un periodo bimestral, Febrero-Marzo 1967, en un núcleo pequeño de escasa concentración, en la zona costera de Colombia (Fig. 95), donde había sido observada previamente por Alvariño (1976). Esta especie fue originalmente descrita por Bigelow (1909) para el Pacífico Tropical Oriental. Toxorchis polynema Kramp. Especie que también aparecía durante un periodo bimestral, Abril-Mayo 1967, en un núcleo pequeño de escasa concentración, en la región plenamente oceánica, al noroeste de las Islas Galápagos (Fig. 96). Esta especie ha sido citada con anterioridad para la región del Pacífico Ecuatoriano (Alvariño, 1977). MEDUSAS SUB-TROPICALESAeginura beebei Bigelow. Aparece únicamente durante dos periodos bimestrales. En el periodo de Febrero-Marzo 1967, se observa en un núcleo pequeño de escasa concentración, lejos de las costas de Perú (Fig. 97). Durante el periodo de Agosto-Septiembre 1967, las poblaciones deA. beebei se mantienen constantes avanzando hacia la región plenamente oceánica, al suroeste de las Islas Galápagos (Fig. 98). Esta especie se considera típica del Pacífico Tropical Oriental. Se ha encontrado distribuida ampliamente en las aguas colombianas (Alvariño, 1976). Bigelow (1940) la considera como una especie nerítica que habita las aguas ecuatoriales panameñas. Aequorea coerulescens(Brandt). Es una especie que habita las aguas costeras en las zonas templadas de las regiones orientales y occidentales del Océano Pacífico. Su aparición es esporádica, observándose únicamente durante dos periodos bimestrales. En el periodo de juniojulio 1967, aparecía en un núcleo pequeño de escasa concentración al noroeste de las Islas Galápagos (Fig. 99). Durante el siguiente periodo, Agosto-Septiembre 1967 las poblaciones de A. coerulescens aumentaban en extensión, observándose tres núcleos pequeños de escasa concentración, en la zona costera de Costa Rica, en las cercanías de las Islas Galápagos, y frente a las costas de Perú (Fig. 100). Esta especie ha sido observada también en esta zona (Bigelow, 1909), Kramp (1957a, 1966, 1968) y Fagetti (1973) quienes la señalan para las costas de Perú y Chile, y Alvariño (1976) para Colombia. Amphogona apsteini(Vanhöffen). Especie epipelágica común de la región occidental del Pacífico Tropical. En el Pacífico Tropical Oriental aparecía únicamente durante un periodo bimestral, Febrero-Marzo 1968 ocupando dos áreas pequeñas de escasa concentración en las regiones norte y sur, frente a las costas de Perú (Fig. 101). Esta especie ha sido observada también en la Bahía de Acapulco (Bigelow, 1909); en las costas del Pacífico mexicano (Mayer, 1910), y al norte de las Islas Galápagos (Kramp, 1956). Bougainvillia. fulva (Agassiz Mayer). Es una especie estenotérmica de aguas templadas. Se encuentra distribuida generalmente desde África hasta Tahití, incluyendo el sureste de Australia y Nueva Zelanda, existiendo únicamente tres determinaciones sobre su presencia en el Pacífico Oriental, así en la Bahía de Acapulco (Mayer, 1910); en las costas mexicanas (Foerster, 1923), y en el Golfo de Arauco y la Bahía de Valparaíso, Chile (Fagetti, 1973). Durante el presente estudio aparecía con cierta frecuencia durante los cinco periodos bimestrales. En el primer periodo Febrero-Marzo 1967, se observaba en 4 núcleos pequeños de escasa concentración y alejados entre sí, lejos de las costas de Nicaragua, al suroeste de las Islas Galápagos, y en la zona costera del extremo norte de Perú (Fig. 102). Durante el siguiente periodo, Abril-Mayo 1967 las poblaciones deB. fulva decrecen, persistiendo únicamente el núcleo al suroeste de las Islas Galápagos (Fig. 103). En el periodo junio-julio 1967, las poblaciones se mantenían constantes en cuanto a concentración, observándose dos núcleos pequeños lejos de las costas de México y Costa Rica (Fig. 104). Durante el periodo de Agosto-Septiembre 1967 las poblaciones se incrementan nuevamente, de una forma similar al primer periodo, apareciendo diversos núcleos pequeños y alejados entre sí, frente al Golfo de Tehuantepec y Costa Rica, así como en la región plenamente oceánica, al noroeste y suroeste de las Islas Galápagos (Fig. 105). En el último periodo, Febrero-Marzo 1968 las poblaciones deB. fulva continuaban aumentando, ocupando dos franjas angostas y paralelas entre sí, una de ellas se extendía desde la región plenamente oceánica hasta las inmediaciones surorientales de las Islas Galápagos (104º W), aproximadamente al sur de este punto, se extendía la segunda franja hasta alcanzar el continente, a la altura de la región costera de Ecuador (Fig. 106).B. Fulva se considera una especie perfectamente definida, con su centro de dispersión en la región Malaya. Cunina duplicataMaas. Es una especie epipelágica. Aparecía con poca frecuencia a lo largo de tres periodos bimestrales. En el periodo de Febrero-Marzo 1967 se observaba en un núcleo pequeño de escasa concentración lejos de las costas de Perú (Fig. 107). Durante el siguiente periodo, Abril-Mayo 1967 las poblaciones deC. duplicata se mantenían constantes y el núcleo avanzaba hacia la región plenamente oceánica, al suroeste de las Islas Galápagos (Fig. 108). En el último periodo, Febrero-Marzo 1968 las poblaciones aumentaban ligeramente, apareciendo un área de contorno irregular frente a las costas de Perú (Fig. 109). Esta especie ha sido también observada en algunas localidades oceánícas de la costa septentrional de Chile (Kramp, 1968). Su hallazgo en una localidad a los 34º17'S, extiende más aún su distribución latitudinal en la zona investigada (Fagetti, 1973). Dipleurosoma pacificum Agassiz y Mayer. Esta especie ha sido observada en una sola localidad al Norte de Tahití, zona sur del Océano Pacífico (Agassiz y Mayer, 1902). Aparecía ahora en un núcleo pequeño de escasa concentración, en la región plenamente oceánica, al noroeste de las Islas Galápagos durante el periodo de Agosto-Septiembre 1967 (Fig. 110). Se trata así de la primera cita que se tiene de esta especie para el Pacífico Tropical Oriental. Ectopleura dumortieri (Van Beneden). Se observa con frecuencia en las regiones cálidas de la zona occidental del Océano Atlántico. En la zona de estudio aparecía únicamente durante dos periodos bimestrales. En el periodo de Agosto-Septiembre 1967, las poblaciones deE. dumortieriocupaban una franja costera que se extendía desde las costas meridionales de Colombia hasta la zona norte de Ecuador, así como diversas áreas pequefias de escasa concentración y alejadas entre sí, en la región plenamente oceánica, al oeste de los 110ºW, en las cercanías orientales de las Islas Galápagos, y frente a las costas de Perú (Fig. 111). Durante el periodo de Febrero-Marzo 1968, las poblaciones disminuían notablemente apareciendo un solo núcleo pequeño en la zona costera del extremo norte de Perú (Fig. 112). Esta especie ha sido citada con anterioridad en la región norte del Pacífico Oriental, en las costas mexicanas (Foerster, 1923 y Kramp, 1965), y Fagetti (1973) la ha observado en el sector sur, en la Bahía de Valparaíso, Chile. Ectopleura sacculifera Kramp. Es una especie que aparece en pocas localidades durante los cinco periodos bimestrales. En el primer periodo Febrero-Marzo 1967, las poblaciones de E. sacculifera ocupaban un área de tamaño regular y de escasa concentración, en las cercanías occidentales de las Islas Galápagos (Fig. 113). En el periodo de Abril-Mayo 1967 las poblaciones disminuían, apareciendo un núcleo pequeño de escasa concentración en la región plenamente oceánica, al suroeste de las Islas Galápagos (Fig. 114). Durante el periodo de Juniojulio 1967 se detecta un ligero incremento en las poblaciones, distinguiéndose dos núcleos pequeños, lejos de las costas de México (Fig. 115). En el periodo de Agosto-Septiembre 1967 las poblaciones deE. sacculiferacontinuaban incrementando en extensión, observándose ahora tres núcleos, al noroeste y suroeste de las Islas Galápagos, así como en la región costera del extremo norte de Perú (Fig. 116). Durante el último periodo, Febrero-Marzo 1968 las poblaciones aumentaban progresivamente en concentración y extensión, ocupando una franja larga y estrecha que se extendía desde la región plenamente oceánica (120ºW), hasta las cercanías de las Islas Galápagos, obseru vandose también otros núcleos pequeños en las costas de Nicaragua, y lejos de las costas de Colombia y Ecuador (Fig. 117). Esta especie había sido observada previamente en la región oriental del Pacífico, no lejos de las costas de Ecuador (Kramp, 1957a). Euphysora furcata Kramp. Especie parcialmente oceánica. Aparecía únicamente durante un periodo bimestral, Agosto-Septiembre 1967 en dos núcleos pequeños de escasa concentración, lejos de las costas de Perú (Fig. 118). También ha sido citada con anterioridad para las costas chilenas (Kramp, 1966 y Fagetti, 1973). Haliscera bigelowi Kramp. Es una especie oceánica, batipelágica y común en el Pacífico Tropical Oriental (Bigelow, 1909). Se observa también durante un solo periodo bimestral, Agosto-Septiembre 1967 en un núcleo pequeño de escasa concentración, al suroeste de las Islas Galápagos (Fig. 119). Al parecer su distribución es más o menos extensa en el Océano Pacífico (Kramp, 1965), sin embargo en esta ocasión su aparición fue errátil. Kanaha pelagica Uchida. Aparecía únicamente durnate un periodo bimestral, Febrero-Marzo 1967, ocupando dos áreas pequeñas de escasa concentración, al noroeste de las Islas Galápagos y frente a Perú (Fig. 120). Esta especie ha sido determinada previamente para el Pacífico Central (Uchida, 1947a). El hallazgo de su presencia en la zona de estudio, extiende así su distribución hacia la región oriental del Océano Pacífico. Pachycordye sp. Se observa únicamente durante un periodo bimestral, Febrero-Marzo 1968 en un núcleo pequeño de escasa concentración, en el extremo sur, frente a las costas de Perú (Fig. 121). Pandeasp. Esta medusa aparecía únicamente durante dos periodos bimestrales. En el primer periodo, Febrero-Marzo 1967 ocupaba tres áreas pequeñas de escasa concentración, al noroeste de las Islas Galápagos, así como frente a las costas de Perú (Fig. 122). Durante el último periodo, Febrero-Marzo 1968 las poblaciones de Pandea se mantenían más o menos constantes en concentración apareciendo dos núcleos frente a las costas de Ecuador y Perú (Fig. 123). Podocoryne carnea M. Sars. Es una especie con cierta diversificación en cuanto a su forma, por lo que algunos autores han distinguido diversas variedades. Kramp (1952) determina una nueva variedad, P. carnea var.chilensis para las costas de Chile, sin embargo años más tarde, en 1968 menciona en uno de sus trabajos, que debido a razones geográficas, considera haber cometido un error en cuanto a su identificación. La observación de esta especie en el área de estudio, durante el periodo de Febrero-Marzo 1968 en un núcleo pequeño de escasa concentración, lejos de las costas sur de Perú (Fig. 124), apoya su determinación para esta zona del Océano Pacífico. MEDUSAS COMUNES EN LAS REGIONES TROPICALES Y SUBTROPICALESAegina citreaEschscholtz. Es una especie mesobatipelágica que se encuentra distribuida ampliamente en las zonas cálidas y templadas de los océanos. Tiene una población indígena en la zona templada, al norte del Océano Pacífico, y se localiza a ambos costados de las regiones templadas. Es una especie euribática que tiene su límite de distribución hacia el norte perfectamente definido. Aparecía únicamente durante dos periodos bimestrales. En el periodo de Febrero-Marzo 1967, las poblaciones de A. citreaocupaban un área pequeña de escasa concentración lejos de las costas meridionales de Perú (Fig. 125). Durante el periodo de Febrero-Marzo 1968 las poblaciones aumentaban ligeramente en concentración, apareciendo dos áreas frente a las costas de Ecuador y Perú (Fig. 126). Esta especie ha sido observada precisamente en esta zona, frente a las costas de Perú y Ecuador (Bigelow, 1909). Años más tarde, en 1940, el mismo autor la señala para las costas de Costa Rica y Colombia. Kramp (1959a, 1966) la cita para el Golfo de Panamá, y para las costas chilenas, donde también ha sido observada por Fagetti (1973). A. citrea también ha sido recolectada en las aguas de California (Alvariño, 1967, 198-). La presencia de esta especie en los estratos superficiales del océano indica la posibilidad de fenómenos de surgencia en dicha zona. Aglaura hemistoma Péron y Lesueur. Es una de las especies más abundantes y comunes que aparecieron en la mayoría de las estaciones de muestreo, y a lo largo de los cinco periodos bimestrales que comprendió este estudio. La población deA. hemistoma presentaba en el periodo de Febrero-Marzo 1967, dos núcleos de concentración elevada, al suroeste y sur de las Islas Galápagos, extendiéndose estas poblaciones respectivamente hacia América Central y las Islas Galápagos, y desde estas zonas hacia el oeste. Se ha observado que durante este periodo, la especie estaba ausente en una franja costera (excepto por un núcleo que se extendía desde el sur de Ecuador hasta el norte de Perú), y al oeste de los 100ºW, y en la zona de la Corriente Ecuatorial Septentrional. La ausencia frente al continente y en la zona plenamente oceánica, al oeste de los 100ºW, indica posiblemente la progresión de las aguas frías (ya que se trata de una especie típica de ambientes cálidos) procedentes de la Corriente de Perú, y las surgencias que se producen en estas zonas (Fig. 127). Durante el periodo de Abril-Mayo 1967, la abundancia ha disminuido, persistiendo las zonas despobladas en la región de la Corriente Nórdica Ecuatorial, y frente a la América Central (Fig. 128). En el periodo junio-julio 1967, las poblaciones aumentaban progresivamente en concentración y extensión, disminuyendo el espacio despoblado (Fig. 129), y en el periodo de Agosto-Septiembre, continuaban aumentando las poblaciones de A. hemistoma, presentando un núcleo de elevada concentración al oeste de las Islas Galápagos y extendiéndose estas poblaciones progresivamente hacia el continente. Sin embargo durante este periodo se nota su ausencia en una zona amplia que abarca desde el Golfo de Tehuantepec y América Central (Guatemala, Nicaragua, El Salvador, Honduras, Costa Rica), extendiéndose hacia el sur frente a Ecuador y Perú. Esta zona despoblada de A. hemistomase extendía entre las poblaciones oceánicas que avanzaban hacia la región de las Galápagos y las poblaciones del Golfo de Panamá que avanzaban frente a Colombia y Ecuador, y otras poblaciones que aparecían frente a las costas meridionales de Perú (Fig. 130). En el periodo de Febrero-Marzo 1968, el núcleo de elevada concentración al oeste de las Islas Galápagos, avanzó un poco hacia el este, persistiendo en líneas generales la distribución que presentaba durante el periodo anterior, pero las poblaciones avanzaron hacia el continente, reduciéndose así los núcleos despoblados en esta región, aún cuando vuelve a observarse una cierta repetición de la distribución que prevalecía durante el mismo periodo para 1967, con unas zonas de ausencia de la especie frente a Ecuador y Perú, así como al oeste de los 100ºW (Fig. 131). Esta especie también ha sido observada en esta zona por otros autores. Entre Panamá y las Islas Galápagos (Vanhöffen, 1913); desde las costas colombianas hasta las Islas Marquesas (Kramp, 1956); frente a las costas chilenas (Kramp, 1966 y Fagetti, 1973). Esta especie es también muy abundante en el Mar de Cortés (Alvariño, 1969). Amphogona apicata Kramp. Es una especie batipelágica que hasta la fecha había sido observada únicamente al sur del Océano Pacífico, en Nueva Zelanda, y en el Océano Atlántico (Kramp, 1965). Aparece ahora en el Pacífico Tropical Oriental con cierta frecuencia y a lo largo de los cinco periodos bimestrales. Durante el periodo de Febrero-Marzo 1967, las poblaciones de A. apicataocupaban numeorsas localidades dispersas por las zonas tropical, ecuatorial y subtropical, distinguiéndose un núcleo de concentración elevada frente a las costas de Costa Rica (Fig. 132). En el siguiente periodo, Abril-Mayo 1967 las poblaciones disminuyen considerablemente, apareciendo únicamente dos núcleos pequeños al noroeste de las Islas Galápagos (Fig. 133). Durante el periodo de junio-julio 1967, las poblaciones aumentaban ligeramente observándose una franja estrecha en la región plenamente oceánica, al oeste de las Islas Galápagos, así como un núcleo pequeño localizado en latitudes más altas, lejos de las costas mexicanas (Fig. 134). En el periodo de Agosto-Septiembre 1967, las poblaciones de A. apícataaumentaban progresivamente en concentración y extensión, presentando un núcleo de elevada concentración al oeste de las Islas Galápagos, extendiéndose estas poblaciones hacia el continente hasta alcanzar las Costas de América del Sur (Ecuador y Perú). Al norte de esta franja, las poblaciones ocupaban otras áreas más o menos extensas que se extendían hasta llegar a las costas mexicanas (Fig. 135). Durante el periodo de Febrero-Marzo 1968, el núcleo de elevada concentración localizado al oeste de las Islas Galápagos, avanzó hacia el sureste, manteniéndose la distribución de una manera similar con respecto al periodo anterior (Fig. 136). Cytaeis tetrastylaEschscholtz. Es una especie parcialmente oceánica debido a la capacidad de propagación asexual que posee, y tiene una distribucíón amplia en las aguas tropicales y subtropicales de los océanos. Aparecía con cierta frecuencia durante los cinco periodos bimestrales. En el periodo Febrero-Marzo 1967, las poblaciones deC. tetrastylaocupaban dos áreas más o menos extensas y de escasa concentración, al este y oeste de las Islas Galápagos (Fig. 137). Durante el periodo de Abril-Mayo 1967, se observa un decrecimiento en la abundancia de las poblaciones, persistiendo una franja estrecha en la región plenamente oceánica, frente a las costas mexicanas (Fig. 138), sin embargo en el siguiente periodo, junio-julio 1967, las poblaciones de C. tetrastyla aumentaban ligeramente ocupando la misma localidad que en el periodo anterior, solo que en menor extensión, además de un núcleo pequeño localizado en el Golfo de Tehuantepec (Fig. 139). Durante el periodo de Agosto-Septiembre 1967, las poblaciones continuaban aumentando apareciendo diversos núcleos esparcidos en las regiones costeras de México, Costa Rica y Ecuador, así como en algunas localidades en la región plenamente oceánica, al noroeste y suroeste de las Islas Galápagos y frente a Perú (Fíg.140). En el último periodo, Febrero-Marzo 1968 las poblaciones aumentaban progresivamente en concentración y extensión, ocupando dos franjas grandes y horizontales, al norte y sur de las Islas Galápagos, las que se extendían desde la región plenamente oceánica, hasta llegar frente a las costas de Ecuador y Perú (85ºW), distinguiéndose una amplia zona despoblada entre ambas, en la región de la Corriente Ecuatorial Meridional (Fig. 141). Esta especie ha sido citada para el Pacífico Tropical Oriental por Bigelow (1909), Mayer (1910), y Agassiz y Mayer (1899); Vanhöffen (1912b) la determina para Panamá, las Islas Galápagos y Callao, en la costa occidental de América del Sur, y Alvariño (1976) para la región de Colombia. También ha sido recolectada frente a las costas de Chile (Fagetti, 1973). Geryonia proboscidalis(Forskal). Habita las capas de agua superficiales, y se encuentra distribuida generalmente en las zonas tropicales y subtropicales de todos los océanos (Kramp, 1968). Aparecía a lo largo de los cinco periodos bimestrales. En el periodo de Febrero-Marzo 1967, las poblaciones deG. proboscidalis ocupaban dos áreas pequeñas y de escasa concentración, en la región plenamente oceánica frente a las costas de México y Perú (Fig. 142). Durante el siguiente periodo, Abril-Mayo 1967 las poblaciones disminuían considerablemente, persistiendo un núcleo pequeño frente a las costas de México (Fig. 143). En el periodo de junio-julio 1967 las poblaciones aumentaban nuevamente, ocupando una franja que se extendía desde la región plenamente oceánica hasta llegar a la región costera de México, además de un núcleo pequeño localizado al noroeste de las Islas Galápagos (Fig. 144). En el siguiente periodo, Agosto-Septiembre 1967 las poblaciones deG. proboscidalis disminuían ligeramente, persistiendo un núcleo pequeño de escasa concentración en la región plenamente oceánica, frente a las costas de México, y los dos restantes se localizaban frente a las costas de Perú (Fig. 145). Durante el último periodo, Febrero-Marzo 1968 las poblaciones se mantenían más o menos constantes con respecto al periodo anterior, observándose algunos núcleos pequeños frente a Nicaragua, así como al noroeste y suroeste de las Islas Galápagos (Fig. 146). La primera observación que se tiene de esta especie para las costas del Pacífico americano, corresponde a la señalada por Fagetti (1973) frente a la costa septentrional chilena. Liriope tetraphylla (Chamisso y Eysenhardt). Es otra de las especies más frecuentes y que aparece en elevada concentración de individuos. Aparecía en la mayoría de las estaciones muestreadas, y a lo largo de los cinco periodos bimestrales de este programa. En el periodo de Febrero Marzo 1967, las poblaciones de L. tetraphyllapresentaban 4 núcleos de elevada concentración, al noroeste y sur de las Islas Galapagos, extendiéndose dichas poblaciones progresivamente hacia el continente y hacia el oeste. Durante este periodo la especie se encontraba ausente en una franja costera (que se extendía desde el sur de Ecuador hasta las costas meridionales de Perú), en la zona de la Corriente Ecuatorial Septentrional y en un área extensa al oeste de los 100ºW, interrumpida únicamente por dos franjas estrechas que se extendían desde las costas de Ecuador y sur de Perú, hasta ese punto (Fig. 147). La ausencia de esta especie en la región costera, así como en la zona plenamente oceánica, al oeste de los 100ºW, se debe posiblemente al aporte de las aguas frías procedentes de la Corriente de Perú y las surgencias características de estas zonas. En el siguiente periodo. Abril-Mayo 1967 las poblaciones aumentaban consecutivamente en concentración y extensión, disminuyendo así los espacios despoblados (Fig. 148). Durante el periodo de junio-julio 1967, las poblaciones se mantenían relativamente constantes, persistiendo el área despoblada, ahora un poco más al oeste de los 100ºW (Fig. 149). En el periodo de Agosto-Septiembre 1967, se observa un incremento en la concentración de las poblaciones, presentando diversos núcleos de elevada concentración en las regiones costeras de México, Ecuador y Perú, y progresando estas poblaciones hacia la región plenamente oceánica (120ºW). Se observa también una zona despoblada pequeña que se extendía desde la región costera del extremo sur de Nicaragua hasta las cercanías orientales de las Islas Galapagos, así como al oeste de estas Islas, en la región de la Corriente Ecuatorial Meridional (Fig. 150). En el periodo de Febrero-Marzo 1968, algunos de los núcleos de elevada concentración avanzaron hacia la región plenamente oceánica, persistiendo únicamente el de la zona costera de Ecuador. La distribución de L. tetraphylla se mantiene constante en general con respecto al periodo anterior, persistiendo las zonas despobladas en las regiones de las Corrientes Septentrional Meridional y la del Perú (Fig. 151). Esta especie también es muy abundante en el Mar de Cortés (Alvariño, 1969), así como en las costas de Chile (Kramp, 1966, y Fagetti, 1973). Nausithoë punctata Kolliker. Es bastante común en las aguas cálidas y templadas. Aparecía con poca frecuencia a lo largo de cuatro periodos bimestrales. En el periodo de Febrero-Marzo 1967, las poblaciones de N. punctata ocupaban tres áreas pequeñas y de escasa concentración, en la región costera de Panamá, y Ecuador, así como al sur de las Islas Galápagos (Fig. 152). Durante el periodo de Abril-Mayo 1967, las poblaciones decrecen, apareciendo un solo núcleo pequeño, en la región plenamente oceánica lejos de las costas mexicanas (Fig. 153). En el periodo de Agosto-Septiembre 1967, las poblaciones aumentaban nuevamente, observándose un núcleo de elevada concentración en la zona costera de Ecuador, y extendiéndose estas poblaciones hacia el norte, en una franja costera, hasta el extremo norte de Costa Rica. Alejados de esta franja, aparecían también dos núcleos pequeños en las regiones costeras de México y Perú (Fig. 154). Durante el último periodo, Febrero-Marzo 1968 las poblaciones de N. punctata continuaban aumentando, apareciendo diversos núcleos pequeños y esparcidos por la región de estudio, lejos de las costas mexicanas, frente al Golfo de Panamá, al noroeste y suroeste de das Islas Galápagos, así como frente a las costas de Perú (Fig. 155). Esta especie ha sido citada con anterioridad para las Islas Galápagos (Bigelow, 1928); desde Costa Rica hasta el Golfo de Tehuantepec: (Alvariño, 1972) y para las costas de Chile (Kramp, 1966 y Fagetti, 1973. Pegantha clara R. P. Bigelow. Esta especie fue descrita por Bigelow (1909) como P. smaragdina en el Pacífico Tropical Oriental (Colombia, Ecuador, y Perú). Vanhöffen (1912b) la observó frente a Chile y en el Pacífico Central, sin embargo la identificó erróneamente como Polycolpa forskalei. Bigelow (1940) la obtuvo en recolectas correspondientes a las costas colombianas. Kramp (1965) la encontró al suroeste de las Islas Galápagos, así como en la región oceánica frente a California, y Alvariño (1969, 1976, 1977) la observó en las aguas del Mar de Cortés y en la región del Pacífico Central. Por lo que se puede observar esta especie se encuentra ampliamente distribuida en el Océano Pacífico, dentro de las mismas latitudes que habita en el Océano Atlántico (40ºN-40ºS). Durante el presente estudio aparecía con cierta frecuencia a lo largo de los cinco periodos bimestrales. Durante el periodo de FebreroMarzo 1967, las poblaciones deP. clara ocupaban diversos núcleos pequeños de escasa concentración y esparcidos por la región, en el Golfo de Panamá, al sureste y suroeste de las Islas Galápagos, frente a las costas de Perú, y en la región plenamente oceánica al oeste de los 120ºW (Fig. 156). En el siguiente periodo, Abril-Mayo 1967 las poblaciones disminuían considerablemente apareciendo solamente un núcleo de tamaño regular frente al Golfo de Tehuantepec: (Fig. 157). Durante el periodo de Junio-Julio 1967, las poblaciones se mantenían más o menos constantes, avanzando un poco hacia el oeste (Fig. 158). En el periodo de Agosto-Septiembre, las poblaciones aumentan nuevamente apareciendo dos franjas pequeñas y estrechas al noroeste de las Islas Galápagos, y frente a las regiones costeras de Colombia y Ecuador, además de dos núcleos pequeños en la región plenamente oceánica, frente a Perú (Fig. 159). En el último periodo, Febrero-Marzo 1968 las poblaciones continuaban aumentando progresivamente en concentración y extensión, observándose tres franjas angostas y alejadas entre sí, una de ellas, muy larga, se extendía desde la región plenamente oceánica (al oeste de los 110º) hasta las cercanías del continente, frente a Colombia. Se distinguían además diversos núcleos pequeños esparcidos por diversas localidades de la región de estudio (Fig. 160). Pegantha martagon Haeckel. Es una especie que habita las capas superficiales de los tres grandes océanos. Aparecía únicamente durante tres periodos bimestrales. En el periodo de Febrero-Marzo 1967, las poblaciones de P. martagon se encontraban dispersas en diversos núcleos pequeños de escasa concentración, lejos de las costas de Nicaragua y Costa Rica, al norte y noroeste de las Islas Galápagos, así como en la región plenamente oceánica, al oeste de los 120ºW (Fig. 161). Durante el periodo de Agosto-Septiembre 1967 las poblaciones aumentan ligeramente, ocupando un área de tamaño regular al noroeste de las Islas Galápagos, observándose además diversos núcleos pequeños frente a las costas de México, Ecuador y Perú (Fig. 162). En el último periodo, Febrero-Marzo 1968 las poblaciones disminuían nuevamente persistiendo tres núcleos pequeños al noroeste y suroeste de las Islas Galpagos, así como frente a las costas de Perú (Fig. 163). Esta especie ha sido recolectada en numerosas localidades en el Pacífico Tropical Oriental. En el Golfo de Panamá (Bigelow, 1940, Kramp, 1959a, 1965); en el Pacífico Tropical (Mayer 1910); en el Pacífico Sur (Kramp, 1957a), y frente a las costas de Chile (Kramp, 1966 y Fagetti, 1973). Esta especie ha sido observada también en aguas antárticas y subantárticas en el Pacífico (Kramp, 1957a), sin embargo su distribución al norte, no se extiende más allá de los 40º latitud Norte. Pegantha triloba Haeckel. Especie distribuida ampliamente en las regiones cálidas y templadas de los grandes océanos. Aparecía, al igual que P. martagon,durante los mismos tres periodos bimestres. En el periodo de Febrero-Marzo, 1967, las poblaciones de P. triloba ocupaban cuatro áreas pequeñas y de escasa concentración, cerca del Golfo de Tehuantepec, y al norte y sur de las Islas Galápagos (Fig. 164), Durante el periodo de Agosto-Septiembre 1967, las poblaciones se mantenían constantes y avanzaban hacia la región plenamente oceánica, al noroeste y suroeste de las Islas Galápagos (Fig. 165). En el último periodo, Febrero-Marzo 1968 las poblaciones de P. triloba aumentaban considerablemente, habitando las cercanías de las Islas Galápagos (Fig. 166). Esta especie ha sido citada para el Pacífico Tropical Oriental por Bigelow (1909). Vanhöffen (1912b) la observa frente a Perú y en las Islas Galápagos. Kramp (1965) la recolecta fuera del Golfo de Panamá, y Alvariño (1972, 1976) la cita para la región de Costa Rica. Pelagia noctiluco.Forskal. Especie oceánica que se encuentra ampliamente distribuida en los mares cálidos y templados. Aunque su aparición se detectó sólo en algunas localidades a lo largo de los cinco periodos bimestrales, fue la especie que presentó, en ciertas localidades, la máxima concentración de organismos (más de 10,000 individuos por 1000 M3 de agua filtrada). En el periodo Febrero-Marzo 1967, aparecía un núcleo de elevada concentración al sur de las Islas Galápagos, extendiéndose estas poblaciones a una corta distancia de este punto. Las poblaciones de P. noctiluca ocupaban también un área de tamaño regular en las costas mexicanas (Fig. 167). En el periodo de Abril-Mayo 1967, el núcleo de elevada concentrcaión al sur de las Islas Galápagos, avanzaba hacia el noroeste de dichas Islas, extendiéndose estas poblaciones a una corta distancia de esta región (Fig. 168). Durante el periodo de junio-julio 1967, las poblaciones disminuían, persistiendo un núcleo pequeño de escasa concentración al noroeste de las Islas Galápagos, y uno más, en la región costera de México (Fig. 169). En el siguiente periodo, Agosto-Septiembre 1967 las poblaciones de P. noctilucaaumentaban nuevamente, observándose dos núcleos de elevada concentración frente a Nicaragua y Costa Rica, extendiéndose estas poblaciones hacia la América Central y zona sur de México (Golfo de Tehuantepec), y desde estas regiones hacia el Oeste. Se distingue al mismo tiempo, que la especie estaba ausente en un área que abarca desde el extremo sur del Golfo de Tehuantepec, hasta el extremo norte de Nicaragua (Fig. 170). En el último periodo, Febrero-Marzo 1968 las poblaciones disminuían, apareciendo un núcleo pequeño de escasa concentración en la región costera del extremo norte de Perú (Fig. 171). Esta especie había sido citada previamente desde las Islas Galápagos hasta Panamá (Bigelow, 1928); para las regiones de Costa Rica y Colombia (Bigelow, 1940); para Ecuador (Alvarifio, 1977); para el Perú (Ranson, 1945 y Kramp, 1968), así como para las costas de Chile (Kramp, 1966 y Fagetti, 1973). Phialopsis diegensis Torrey. Especie parcialmente oceánica. Fue descrita originalmente en material recolectado en San Diego, California (Torrey, 1909), posteriormente se citó para el Pacífico Tropical Oriental (Vanhöffen, 1912a como Eirene viridula) y para el suoreste de las Islas Galápagos (Bigelow, 1909). Su distribución se extiende al Pacífico Oriental Meridional, frente a las costas chilenas (Fagetti, 1973), por lo que parece ser, se trata de una especie con una amplia distribución oceánica. Durante el presente estudio aparecía únicamente durante dos periodos bimestrales. En el periodo de Agosto-Septiembre 1967, las poblaciones de Ph. diegensis ocupan dos áreas pequeñas y de escasa concentración, en la región plenamente oceánica frente a las costas meridionales de México, y frente a Perú (Fig. 172). Durante el periodo de Febrero-Marzo 1968, las poblaciones aumentaban considerablemente observándose un núcleo de elevada concentración frente a las costas de Colombia, extendiéndose estas poblaciones hacia el continente (ocupando la mayor parte de la región costera colombiana) y hacia el suroeste respectivamente. Al sur de esta zona, frente a Ecuador y Perú, las poblaciones de Ph. diegensis, ocupaban un área más grande, de contornos irregulares que se extendía hasta el suroeste de las Islas Galápagos (Fig. 173). Rhopalonema velatum Gegenbaur. Es una especie oceánica, preferentemente epipelágica, y común en las regiones cálidas y templadas de los Océanos Pacífico, Indico y Atlántico. Durante los cinco periodos bimestrales aparecía en concentraciones elevadas, extendiéndose prácticamente por toda el área de estudio. En el periodo de Febrero-Marzo 1967, las poblaciones deRh. velatumpresentaban un núcleo de elevada concentración, en la región oceánica frente al Golfo de Tehuantepec, extendiéndose estas poblaciones hacia el continente (México, América Central y América del Sur), y hacia el oeste, en la región plenamente oceánica. Durante este periodo la especie estaba ausente en una franja costera en la región de Perú, en un área que se extendía desde la zona costera de Colombia y Ecuador hasta el oeste de los 85ºW, en el Golfo de Tehuantepec, así como en diversas áreas plenamente oceánicas, una de ellas muy amplia, al oeste de los 95ºW. La ausencia de esta especie en las zonas costeras, y en la región plenamente oceánica, al oeste de los 95ºW, se debe probablemente a la incursión de las aguas frías procedentes de la Corriente de Perú y de las surgencias que se presentan en estas zonas (Fig. 174). En el siguiente periodo, Abril-Mayo 1967 se mantenía un núcleo de elevada concentración en la región plenamente oceánica, al oeste de los 110ºW, extendiéndose estas poblaciones hacia el continente, hasta llegar a las costas meridionales de México, persistiendo las áreas despobladas en las cercanías del Golfo de Tehuantepec, y al oeste de los 95ºW (Fig. 175). Durante el periodo de junio-julio 1967, las poblaciones de Rh. velatum se mantenían más o menos constantes, reduciéndose en gran parte las áreas despobladas al oeste de los 95ºW, y ampliándose considerablemente la cercana al Golfo de Tehuantepec, a excepción de un núcleo pequeño y aislado frente al Golfo (Fig. 176). En el periodo de Agosto-Septiembre, las poblaciones se incrementaban con respecto al primer periodo, desapareciendo áreas despobladas en las zonas costeras, a excepción del Golfo de Tehuantepec, y persistiendo, aunque en menor magnitud, las de la región plenamente oceánica, al oeste de los 95ºW (Fig. 177). Durante el último periodo, Febrero-Marzo 1968 el núcleo de elevada concentración, que durante el periodo anterior se encontraba al sur de las Islas Galápagos, avanza hacia el continente hasta llegar a la región costera de Ecuador, persistiendo al mismo tiempo las áreas despobladas en las zonas costeras de Perú, el Golfo de Tehuantepec, y al oeste de los 95ºW (Fig. 178). Esta especie ha sido citada con anterioridad para la región por Foerster (1923) en un área que se extiende desde Baja California hasta Guatemala; para Colombia (Kramp, 1956); para toda la región oceánica de la América Central hasta el Golfo de Tehuantepec y Manzanillo (Alvariño, 1976). Esta especie ha sido observada también con frecuencia hacia el norte, en el Mar de Cortés y en California (Alvariño, 1968, 198) y hacia el sur, frente a las costas de Chile (Kramp, 1966 y Fagetti, 1973). Sminthea eurygaster Gegenbaur. Es una especie que hasta la fecha no se había observado hacia el norte más allá del Golfo de Panamá, donde fue citada por Kramp (1965). Aparecía ahora con cierta frecuencia a lo largo de cuatro periodos bimestrales. En el periodo de FebreroMarzo 1967, las poblaciones de S. eurygaster ocupaban diversas áreas de escasa concentración al norte y sur de las Islas Galápagos, así como en la región plenamente oceánica al oeste de los 110 ºW (Fig. 179). Durante el periodo de Abril-Mayo 1967, las poblaciones disminuían considerablemente apareciendo únicamente tres núcleos pequeños de escasa concentración, lejos de las costas mexicanas (Fig. 180). En el periodo de Agosto-Septiembre 1967, las poblaciones de S. eurygasteraumentaban nuevamente, ocupando un área bastante amplia que se extendía desde la región plenamente oceánica al oeste de los 110ºW, hasta el litoral de Costa Rica, Panamá, Ecuador, y el extremo norte de Perú. Se observaba al mismo tiempo que la especie estaba ausente en una franja costera ancha que abarcaba las costas meridionales de México, Guatemala, El Salvador, Honduras y Nicaragua, extendiéndose hacia la región oceánica, hasta el norte de las Islas Galápagos (Fig. 18l). Durante el último periodo, Febrero-Marzo 1968 las poblaciones se mantenían más o menos constantes, aunque con una distribución diferente, observándose tina franja horizontal que se extendía desde la región litoral de Costa Rica hasta la zona plenamente oceánica, aproximadamente a los 120ºW, así como un área de tamaño regular frente a las costas de Perú, y diversos núcleos pequeños esparcidos por la zona de estudio (Fig. 182). Su límite de distribución latitudinal hacia el Sur se encuentra determinado a los 42º25'S (Fagetti, 1973). Solmaris rhodoloma (Brandt). Especie común en la región occidental del Pacífico Tropical. Ahora aparecía en el periodo de Febrero-Marzo 1968, en un núcleo pequeño de escasa concentración en la región plenamente oceánica, al suroeste de las Islas Galápagos (Fig. 183). En el Pacífico Tropical Oriental ha sido observada previamente en una sola localidad, las costas de Chile, de donde fue originalmente descrita (Brandt, 1838a). Solmundella bitentaculata (Quoy y Gaimard). Especie muy común en el Pacífico Tropical Oriental (Kramp, 1965) y ha sido observada en Chile, Perú, Panamá y las Islas Galápagos (Vanhöffen, 1912b); en la Bahía de Acapulco y en el Golfo de Panamá (Kramp, 1965); frente a Buenaventura, Colombia, cerca de la Península de Nicoya y en la región de Manzanillo (Alvarifio, 1976). Asimismo es muy abundante en las aguas cálidas de Baja California (Alvariño, 198) y en las costas de Chile (Fagetti, 1973). Es una especie que aparece con suma frecuencia y sus poblaciones alcanzaron concentraciones elevadas a lo largo de los cinco periodos bimestrales del Programa EASTROPAC. En el periodo de Febrero-Marzo 1967, las poblaciones de S. bitentaculatapresentaban diversos núcleos de elevada concentración en las regiones costeras de México, Nicaragua, Colombia, Ecuador y Perú, extendiéndose estas poblaciones hacia el resto del continente, así como al oeste en la región plenamente oceánica, aproximadamente a los 125ºW. Durante este periodo se distinguía también una zona amplia despoblada, al oeste de los 100ºW (Fig. 184). Durante el siguiente periodo, Abril-Mayo 1967 las poblaciones disminuían en concentración, mas no en extensión, persistiendo las zonas despobladas al oeste de los 100ºW (Fig. 185). En el periodo de junio-julio 1967, las poblaciones de S. bitentaculata aumentaban ligeramente en concentración y extensión, reduciéndose así las áreas despobladas (Fig. 186). Durante el periodo de Agosto-Septiembre 1967, la distribución de las poblaciones sigue los lineamientos generales que se observaban en el primer periodo, apareciendo ahora una zona despoblada al norte de las Islas Galápagos, en la región de la Corriente Ecuatorial Septentrional (Fig. 187). En el último periodo, Febrero-Marzo 1968 las poblaciones aumentaban en concentración y disminuían en extensión, extendiéndose así las zonas inhabitadas por la especie. El área despoblada que se localizaba al norte de las Islas Galápagos, se extendía hacia el continente, hasta la zona nerítica de Costa Rica (Fig. 188). Zanclea costata Gegenbaur. Es una especie que se encuentra ampliamente distribuida por las aguas costeras de los mares cálidos y templados, aunque aparentemente es poco frecuente en el Pacífico Tropical Oriental. Aparecía únicamente durante dos periodos bimestrales. En el periodo de Febrero-Marzo 1967, se observaba en dos núcleos pequeños de escasa concentración, frente al Golfo de Tehuantepec (Fig. 189). En el periodo de Agosto-Septiembre 1967, aparecía solo un núcleo pequeño en la zona litoral de Costa Rica (Fig. 190). Esta especie ha sido observada con anterioridad únicamente en las costas del Pacífico mexicano (Foerster, 1923), y en las aguas de San Diego, California (Alvariño, 1967). Zanclea orientalis Browne. Es una especie conocida únicamente para el Océano Índico. Aparecía ahora en algunas localidades del Pacífico Tropical Oriental durante tres periodos bimestrales, extendiendo así su distribución al Océano Pacífico, posiblemente con el flujo de la Contracorriente Ecuatorial. Durante el periodo de Febrero-Marzo 1967, las poblaciones de Z. orientalis ocupaban un área pequeña de escasa concentración, en la región plenamente oceánica, al oeste de los 110ºW (Fig. 19l). En el periodo de Agosto-Septiembre 1967, las poblaciones aumentaban ligeramente, persistiendo el núcleo al oeste de los 110ºW, y dos más, al oeste de las Islas Galápagos, y en la región costera de Colombia (Fig. 192). Durante el último periodo, Febrero-Marzo 1968 las poblaciones de Z. orientalisdisminuyen nuevamente, persistiendo únicamente el núcleo al oeste de los 110ºW (Fig. 193). MEDUSAS DE OTRAS REGIONES OCEÁNICASBythotiara drygalskiiVanhöffen. Es una especie que por muchísimo tiempo fue considerada como exclusiva de la región Antártica. Recientemente ha sido observada en la región oceánica, frente a las costas de Colombia (Alvariño, 1976). Ahora aparecía en la región plenamente oceánica, frente al extremo sur de Perú (20º01'S-115º52'W), en un núcleo pequeño de escasa concentración durante el periodo de Febrero-Marzo 1968 (Fig. 194). Halitholus intermedius (Browne). Es una especie que había sido descrita con anterioridad solamente para las Islas Malvinas (Browne, 1902), y para África del Sur (Kramp, 1957a). Su distribución se extendió al Océano Pacífico cuando fue observada por primera vez en la Bahía de Valparaíso, Chile (Fagetti, 1973). Ahora aparecía en latitudes más altas, observándose a lo largo de cuatro periodos bimestrales. En el periodo de Febrero-Marzo 1967, las poblaciones de H. intermediuspresentaban dos núcleos pequeños de escasa concentración, frente al Golfo de Tehuantepec, y al suroeste de las Islas Galápagos (Fig. 195). Durante el siguiente periodo, Abril-Mayo 1967 el núcleo que se encontraba frente al Golfo de Tehuantepec, avanzó un poco hacia el sur (Fig. 196). En el periodo de Agosto-Septiembre 1967, las poblaciones deH. intermedius aumentaban ligeramente apareciendo tres núcleos pequeños de escasa concentración, frente a Guatemala, Colombia, y en la región costera de Ecuador (Fig. 197). Durante el último periodo, Febrero-Marzo 1968 las poblaciones disminuyen nuevamente, observándose dos núcleos pequeños al este y noroeste de las Islas Galápagos (Fig. 198). Es una especie subantártica, cuya incursión en estas latitudes es debida a la Corriente de Perú (Fagetti, 1973). Halitholus pauper. Hartlaub. Especie considerada de régimen predominantemente ártico. En el Océano Pacífico se ha observado al norte de Japón (Uchida, 1940), y en Vancouver, en las costas norteamericanas (Foerster, 1923). Aparecía ahora durante el periodo de Febrero-Marzo 1967, en dos núcleos pequeños de escasa concentración, frente a las costas de México, y en la región plenamente oceánica al noroeste de, las Islas Galápagos (Fig. 199). Su presencia en esta región indica la incursión e influencia de aguas procedente del Pacífico Norte integradas al sistema de corrientes característico de la zona investigada. Pochella polynemaHartlaub. Es una especie de distribución esporádica, tanto en tiempo como en espacio. Sólo ha sido observada en el Mar del Norte (Hartlaub, 1917); en Vancouver, en las costas del Pacífico norteamericano (Foerster, 1923), y en el noroeste de Europa (Russell, 1953). Ahora ha sido recolectada por primera vez en el Pacífico Tropical Oriental únicamente durante dos periodos bimestrales. En el periodo de Agosto-Septiembre 1967, las poblaciones deP. polynemaocupaban un área pequeña frente a las costas meridionales de Ecuador, extendiéndose estas poblaciones hacia el continente hasta el extremo norte de Perú (Fig. 200). Durante el periodo de Febrero-Marzo 1968, las poblaciones se mantenían más o menos constantes en concentración, apareciendo dos núcleos pequeños lejos de las costas de México, y al suroeste de las Islas Galápagos (Fig. 20l). Su presencia en esta región podría explicarse como en el caso deH. pauper. REPRODUCCIÓNLos Celenterados constituyen un material excelente para estudiar el proceso morfogenético, debido a que existe una amplia complejidad estructural entre las diferentes formas del Phylum, y estos organismos no son, en muchos casos, difíciles para ser estudiados en el laboratorio. Las Hidromedusas son consideradas, dentro de un plan general, como organismos que alternan entre una fase hidroide sésil que se reproduce asexualmente para formar medusas, y una fase medusoide libre nadadora que se reproduce sexualmente para formar larvas, las cuales se fijan al substrato y se desarrollan en hidroides (Berrill, 1950). En este ciclo de vida general, existen variaciones entre las diferentes especies del grupo. Russell (1953) establece 3 categorías para las Hidromedusas. 1. medusas con un hidroide sésil, o libre nadador. 2. medusas con un desarrollo directo. 3. medusas con una fase parasítica durantesu ciclo de vida. En el primer caso, los óvulos pueden ser fecundados ya sea en la medusa misma o bien en el medio ambiente que la rodea, dando origen a una larva plánula la cual posteriormente se desarrolla para formar el hidroide. La mayoría de los huevos se encuentran envueltos por cubiertas que pueden variar en origen y complejidad morfológica. Los huevos de la Hidromedusa son por lo general desnudos, en ocasiones se encuentran rodeados por una capa gelatinosa delgada. Sin embargo los huevos de la AntomedusaBougainvillia multitentaculata,poseen una cubierta continua de nematocistos (Szollosi, 1969). Durante el proceso de la gastrulación, los nematocistos se incorporan gradualmente al ectodermo, transformándose así en una parte integral de la plánula. La presencia de etsa armadura de nematocistos en los huevos, constituye posiblemente un mecanismo de adaptación, ventajoso en su lucha contra los depredadores. Cuando la fecundación es interna, el grado de desarrollo alcanzado por el producto de la reproducción, cuando es liberado del progenitor, varía entre las diferentes especies. Así por ejemplo en Turritopsis nutricula y Nemopsis dofleini, entre otras, los huevos se desarrollan hasta alcanzar el estado de plánula. EnHybocodon prolifer y Margelopsis haeckeli, el desarrollo continúa hasta formarse una larva actínula, la cual se encuentra adherida a la pared gonadal del estómago del progenitor (Berrill, 1950). La plánula es una larva ciliada alargada la cual posee, en la mayoría de los casos, una capa de ectodermo, una de endodermo y una cavidad gastrovascular. Esta larva contiene todos los elementos celulares básicos de los Celenterados, células epíteliales, musculares, nerviosas y sensoriales, glandulares, urticantes, y digestivas (Campbell, 1973). Existe un número muy reducido de plánulas que no alcanzan la fase libre nadadora, tal es el caso deHaliclystus (Thiel, 1966). La actínula es una larva ciliada en forma de pera y con 8 tentáculos, la cual lleva por algún tiempo una vida pelágica, antes de su fijación al substrato. Cuando la fecundación es externa, el desarrollo del huevo conduce a la formación de la plánula. La plánula después de llevar una vida libre nadadora por algunas horas o días, desciende al fondo y se fija al substrato adecuado, ya sea por el polo anterior como en Phialidium, o bien a lo largo de su superficie como en Turritopsis. En el primer tipo de fijación, las estructuras bucales del pólipo primario se desarrollan en el extremo libre. La boca se forma donde el ectodermo se vuelve extremadamente delgado hasta que finalmente se rasga, y los tentáculos resultan de evaginaciones que se forman alrededor del hipostoma. Los tentáculos aparecen simultáneamente, o bien en orden indefinido y variable, dependiendo de la especie de que se trate. Posteriormente se desarrollan las demás estructuras típicas para cada especie como son los gonóforos, los tentáculos proximales, las yemas, y los estolones. En el segundo caso, cuando la plánula se fija al substrato a lo largo de su superficie, el pólipo primario se desarrolla a partir de una yema que se origina en la superficie libre de la plánula. Las plánulas de numerosas especies exhiben una discriminación notable en cuanto a la selección de lugares adecuados para su fijación. Así por ejemplo la plánula de Proboscidactyla flavicirrata,se fija únicamente en los tubos de los gusanos Sabélidos, eludiendo los tubos vacíos, así como otras superficies (Rees, 1979). Una vez que el pólipo primario se ha desarrollado completamente, se inicia el crecimiento de la colonia mediante el proceso de gemación. El crecimiento y gemación de las colonias está rigido por patrones específicos que dependen de la especie. De una manera general los hidroides sésiles se encuentran entre las Antomedusas, Leptomedusas y Limnomedusas, y en estas últimas, los hidroides son pequeños y a menudo sin tentáculos. La colonia al alcanzar su desarrollo completo, inicia la producción de medusas de una manera asexual, por gemación. Roosen-Runge (1970) al estudiar el ciclo de vida dePhialidium gregarium en el laboratorio, observó que las colonias de hidroides crecen y producen medusas en respuesta directa al suplemento alimenticio. Al aumentar la cantidad de alimento, se produce un incremento en la formación de hidroides, seguido por la liberación de medusas que se produce en el transcurso de dos semanas. En los hidroides Atecata o Gymnoblastea las yemas medusoides son desnudas, y se desarrollan en las estolones(Perigonimus), en los tallos de los hidrantes(Clava, Bougainvillia), en los hidrantes mismos(Pennaria, Tubularia), o en algunos casos, a partir de hidrantes modificados conocidos como gonozoides o blastostilos(Eudrendium, Hydractinia). En los hidroides Tecata o Calyptoblastea las medusas, en la mayoría de los casos, se desarrollan en los blastostilos, los cuales están protegidos por una cubierta especializada, la gonoteca. La medusa al ser liberada del hidroide progenitor inicia una vida independiente, que puede durar algunas horas mientras alcanza la madurez sexual, como es el caso dePodocoryne carnea, o bien es mucho más amplio como sucede en la mayoría de las medusas cuyo promedio de vida es de unos dos meses (Rees, 1957). Existen pocos casos de especies con un periodo de vida planctónico largo como Aequorea, y Tima bairdi, las cuales pueden vivir hasta 6 meses o más (Russell, 1953) en esa fase pelágica. Las medusas en el momento de su liberación son muy pequeñas, miden 1.0 mm o menos de altura. Cuando la medusa adulta posee de 1 a 4 tentáculos marginales, las medusas recién liberadas son solo unas miniaturas de esa forma adulta. Sin embargo las medusas adultas que poseen numerosos tentáculos, difieren bastante de las medusas juveniles, las cuales atraviesan por una serie de fases de desarrollo, hasta convertirse en formas adultas. Este proceso ha contribuido en gran medida a la problemática de la sistemática del grupo, ya que las diversas fases de una misma especie, han sido descritas como especies diferentes. Cuando la medusa alcanza la madurez sexual, se lleva a cabo la fertilización, con la consiguiente formación de la plánula, que se fija al substrato, crece y se desarrolla, originando la fase hidroide que produce la fase medusa completándose así el ciclo de vida. Roosen-Runge (1962) al estudiar el ciclo de vida de una Hidromedusa pequeña Phialidium gregarium,observó que una hembra es capaz de producir un promedio de 50 huevos por día durante 60 días, o bien 3000 huevos durante su vida. Cada huevo al desarrollarse en organismo adulto, es capaz de producir un mínimo de 300 medusas en una estación del año. Así la productividad potencial de cada pareja fértil es de alrededor de un millón o más de medusas, las cuales serán reducidas en número al estar expuestas a los diversos factores bióticos y abióticos del medio ambiente. Aunque es muy raro, existen medusas con un hidroide pelágico libre-nadador,, por ejemplo,Margelopsis haeckeli, la cual carece completamente de una fase fija durante su ciclo de vida. Por otro lado es frecuente observar en las colecciones de plancton, hidroides de hábitos sésiles y que fueron desprendidos de su substrato, ya sea por fenómenos climatológicos, o bien por acciones mecánicas como son el oleaje, las corrientes, y los arrastres de fondo (Russell, 1953). En el caso de las medusas con un desarrollo directo, la plánula se transforma directamente en la forma medusoide, sin pasar en su ciclo vital, por un estado hidroide sésil. Este tipo de desarrollo es característico de las Traquimedusas y las Narcomedusas cuyos hábitos plenamente oceánicos y pelágicos son perfectamente conocidos. Entre las Geryonidae (Traquimedusas) solo se conoce el desarrollo embrionario deGeryonia y Liriope que son sumamente similares, difiriendo únicamente en la producción de 6 tentáculos primarios paraGeryonia y 4 paraLiriope (Berrill, 1950). En ambos casos se constituye una plánula, la cual se transforma directamente en una medusa libre nadadora. El ciclo de vida completo de algunos representantes de las Narcomedusas como Solmaris ySolmudellaha sido perfectamente estudiado. Los huevos de las especies en estos dos géneros se desarrollan directamente en una forma medusoide, sin pasar por un estado sésil de ningún tipo. Independientemente de que la división del huevo o zigoto sea igual o desigual, se forma una plánula la cual precede a la forma medusoide (Berrill, 1950). Las medusas que poseen una fase parasítica durante su ciclo de vida, están representadas entre las Narcomedusas, las cuales poseen obviamente ciclos de vida más complejos. Entre ellas se encuentranPegantha y Cunina,cuyos huevos están modificados en relación a su facultad parasitaria. Los huevos en cada uno de los casos se desarrollan asociados con una célula nodriza cuya función exclusiva es proporcionar alimento durante las primeras fases del desarrollo embrionario. EnPegantha clara la fase parasítica se desarrolla en la substancia gelatinosa de la exumbrela del organismo progenitor. El desarrollo se inicia a partir de una estructura formada por 2 células, una encerrada por la otra. La célula interna es la futura larva, y la célula externa es la nodriza. La larva crece, adquiere tentáculos y puede desarrollarse directamente en una medusa con una existencia independiente, o bien, puede producir yemas las cuales posteriormente adquieren la forma medusoide (Bigelow, 1909). No se sabe si estas medusas se transforman en adultos semejantes al progenitor, o son solamente una fase intermedia en el ciclo de vida de la especie (Russell, 1953). En otra especie, Cunina octonaria, la plánula resultante del proceso sexual, se fija por su boca al margen umbrelar de otra medusa,Turritopsis nutricola, crece, adquiere 4 tentáculos y emigra por la cavidad subumbrelar hasta llegar a la boca del huésped, donde se fija y se transforma en una actínula parásita, la cual mediante el proceso de gemación produce yemas, que se transforman en medusas libres nadadoras (Berrill, 1950). Por lo que se refiere a las Escifomedusas, se pueden distinguir 2 modalidades en cuanto a su ciclo de vida. Las medusas que poseen una fase sésil (escifistoma) durante su ciclo de vida, y aquellas en donde el huevo fecundado se transforma directamente en una forma medusoide libre nadadora, como es el caso dePelagia noctiluca. El desarrollo embrionario de las Escifomedusas muestra un patrón más regular que el de las Hidromedusas, pero a la vez introduce complicaciones morfogenéticas adicionales. Los sexos están separados en la mayoría de las especies, a excepción de Chrysaora que es hermafrodita. La fecundación puede ser externa o interna. En este último caso, el zigoto se desarrolla en el ovario, en bolsas especiales en la pared del estómago, o bien en los pliegues de los brazos orales. La segmentación del huevo es total y puede ser igual o desigual. El desarrollo continúa y se forma una blástula, que posteriormente da lugar a una gástrula. El proceso mediante el cual se constituye la gástrula ha provocado mucho desacuerdo entre los autores, a menudo estudiando incluso la misma especie. La gastrulación conduce a la formación de una plánula libre nadadora, la cual en la mayoría de las Escifomedusas, se fija al substrato y se convierte en una larva polipoide tentaculada, la escifistoma, o bien se desarrolla directamente en una forma medusoide joven, la éfira (Hyman, 1940). La forma de la escifistoma varía entre las diferentes especies. Esta larva está constituida por un disco de fijación con el que se adhiere al substrato, y el cuerpo que está dividido en 2 regiones, el tallo y el cáliz. En la parte distal del cáliz se localiza el disco oral cuyo margen se encuentra bordeado por una hilera de tentáculos filiformes (Chapman, 1966). La escifistoma es capaz de generar más larvas, por diferentes mecanismos; gemación, estrobilación, o mediante la formación de estructuras de resistencia, como son los podocistos (Russell, 1970). Las yemas se originan en diferentes sitios de la escifistoma. En algunas formas se producen cerca de la unión del cáliz con el tallo (Cotylorhiza, Cassiopea). Las yemas se desprenden y nadan activamente mediante la acción de cilios, hasta que se fijan nuevamente al substrato. En otros géneros comoAurelia. y Chrysaora, las yemas se forman inicialmente como procesos laterales de la pared del cuerpo, en el tallo, cerca de la base, y crecen a manera de estolones a una distancia considerable del porgenitor, y al fijarse pueden dar origen a una nueva escifistoma o bien a una o dos a lo largo de su trayecto, antes de fijarse, rompiéndose posteriormente la conexión con el progenitor (Berrill, 1949). La estrobilación de la escifistoma conduce a la formación de éfiras. En muchos casos se produce una sola éfira, y en muchos otros se producen 2, 3 o más, a manera de series. Las éfiras una vez que han completado su desarrollo funcional, quedan libres llevando una existencia libre nadadora y transformándose posteriormente en la medusa adulta. Numerosos investigadores se han dedicado al estudio de los factores que estimulan la estrobilación en la escifistoma. Han observado así, que el alimento, la temperatura, y la intensidad luminosa son factores que influyen frecuentemente en la estrobilación. Sin embargo las interrelaciones entre éstos y otros factores ambientales, no se han comprendido perfectamente hasta el momento, siendo necesario realizar numerosos estudios "in situ" para tratar de dilucidar el fenómeno en todo su conjunto de mecanismos. El podocisto (o quiste pedal) es un estado encapsulado que se presenta en el ciclo de vida de algunas medusas de los órdenes Semaeostomeae y Rhizostomeae. Se trata de una estructura cuticular plano-convexa de color café, conteniendo en su interior una masa de tejido blanquecino (Chapman, 1968). Se puede considerar como una estructura de resistencia que se desarrolla cuando las condiciones ambientales son desfavorables. El podocisto, es capaz de vivir durante largos períodos (más de tres años), lo que se puede deducir por las reservas que contiene, ricas en hidratos de carbono, lípidos y proteínas. El podocisto, al desarrollarse origina pólipos pequeños, o bien un organismo semejante a la plánula. Se han observado podocistos en las escifistomas de Aurelia, aurita, Chrysoara hysoscella, Cyanea capillata, Dadylometra quinquecirrha, y Rhizostoma pulmo. La mayoría de los trabajos que se han publicado acerca de la biología de la escifistoma, son el resultado de investigaciones realizadas en el laboratorio, donde es muy difícil reproducir satisfactoriamente las condiciones de vida naturales. Los métodos de reproducción de la escifistoma antes mencionados, se han observado en el laboratorio, bajo condiciones ambientales controladas o conocidas, lo cual ha originado cierta especulación en cuanto a los factores ambientales que puedan influir en el proceso reproductivo. BIOLUMINISCENCIALa bioluminiscencia es un fenómeno difundido ampliamente entre los organismos marinos, el cual se ha observado desde tiempos clásicos, y así muchos naturalistas han intentado descubrir su origen, causas y función; sin embargo, sólo durante los últimos 25 años se han intensificado los estudios en este campo, empleando las técnicas e instrumentación adecuadas, demostrando así que la bioluminiscencia es un proceso que ocurre en organismos que habitan todos los estratos batimétricos oceánicos, y se encuentra tan difundido en los organismos marinos, que su ausencia es más notable que su presencia (Tett y Kelly, 1973). La bioluminiscencia a pesar de ser un fenómeno de los más comunes, es a al vez uno de los procesos menos comprendidos en la fisiología y comportamiento de los animales marinos. Gran parte de lo que actualmente se conoce de este fenómeno deriva de las observaciones visuales que se han ido acumulando a través de los años resultando la mayoría de las veces especulativas, al tratar de explicar la función en sí, y más aún, al interpretar las tendencias evolutivas del mencionado proceso. La mayoría de los resultados obtenidos mediante diversos estudios se han deducido de la morfología de especies particulares, o bien, de observaciones visuales de individuos removidos de su hábítat normal, y sujetos a diversas condiciones experimentales, a menudo utilizando ejemplares en malas condiciones o aún moribundos. Todo ello se debe en gran parte a que los estudios se encuentran restringidos a los organismos que se pueden cultivar con cierta facilidad en el laboratorio, o bien, para aquellos que puedan ser recolectados en cantidades considerables. Aunado a esto, la discusión entre diversos autores respecto al trabajo de campo, los resultados se complican, debido al uso de diferentes sistemas de unidades, utilizados para medir la intensidad de la luminiscencia (Tett y Kelly, 1973). Sin embargo se ha obtenido alguna información respecto al carácter espectral de la luz, así como a las diversas intensidades de luz que los organismos son capaces de emitir. En algunas especies, al utilizar estímulos leves, se han podido establecer las características temporales de las emisiones luminiscentes (Nicol, 1958). Recientemente también se han realizado investigaciones en algunas especies, sobre la naturaleza química de la luminiscencia (Shimomura etal, 1962). La luminiscencia espontánea es rara, sin embargo en muchos organismos la excitación mecánica local, produce ondas luminosas que se propagan más allá del lugar estimulado, reflejando claramente las propiedades de un sistema conductor neural o epitelial. La bioluminiscencia es un fenómeno muy frecuente en las comunidades planctónicas marinas, y son muchas las especies de medusas que poseen sistemas emisores de luz, por lo que es probable que la luminiscencia desempeña un papel importante en la supervivencia, defensa, alimentación, etc. Entre las Hidromedusas se conocen 22 géneros que incluyen especies bioluminiscentes. Estos son,Lizzia, Rathkea, Stomotoca, Leuckartiara y Euphysa(Antomedusas); Loadicea, Melicertissa, Halistaura, Obelia, Phialidium, Octophialucium, Eutonina, Tima, Aequorea, Halopsis y Matrocomella(Leptomedusas); Liriope, Geryonia, Crossota y Colobonema(Traquimedusas); y Solmissus y Aeginura(Narcomedusas). La bioluminiscencia en general se encuentra más difundida entre las Antomedusas y Leptomedusas (con una generación polipoide bien desarrollada), que entre las Traquimedusas y Narcomedusas (con una generación hidroide reducida o aún ausente). Esto se encuentra relacionado con el hecho de que las formas que habitan la zona costera (Antomedusas y Leptomedusas) pueden ser observadas y recolectadas con mayor frecuencia que aquellas que son capaces de llevar una vida independiente en aguas plenamente oceánicas (Taquimedusas y Narcomedusas), por lo que obviamente el número de observaciones de bioluminiscencia en organismos costeros es desproporcionalmente más alto (Boden y Kampa, 1964). La luz que emiten las medusas se produce a nivel del margen de la umbrela, o bien en toda su superficie, y puede ser de color azul o verde (Herring, 1978). Las especies que emiten luz verde poseen una proteína fluorescente en los fotocitos. Tal es el caso deAequorea y Halistaura cuyo proceso bioluminiscente es intracelular y en él se encuentran involucradas dos proteínas, que proporcionan la energía necesaria para el proceso de emisión de luz. Shimomura y sus colaboradores (1962) aislaron de la HidromedusaAequorea una substancia a la que denominaron ecuorina. Esta substancia tiene las propiedades generales de una proteína cuyo peso molecular oscila alrededor de los 30 000. Demostraron que el único requisito para la reacción luminiscente "in vitro", es la ecuorina, iones de calcio o sales de estroncio y agua, y este proceso se efectúa independientemente de la presencia de oxígeno. Aunque la reacción "in vitro" produce luz azul, se ha observado que el organismo vivo produce luz verde. Estos autores detectaron también la presencia de una proteína fluorescente de color verde, en algunas de las fracciones analizadas durante el proceso de purificación. Un año más tarde estos mismos autores, extrajeron una proteína bioluminiscente de otra Hidromedusa,Halistaura, a la que le dieron el nombre de halistaurina (Shimomura et al., 1963). Aunque el sistema en este organismo es muy similar al de Aequorea, el proceso de extracción del componente proteínico esencial, es ligeramente diferente, y la purificación resulta un tanto más difícil. Shimomura y Johnson en 1966 propusieron el término"fotoproteínas" para designar a estas substancias, basándose en el tipo no enzimático de sistema bioluminiscente, donde la luz visible es producida por un organismo vivo, y la luz total es proporcionada a la proteína específica, la cual no se regenera, sino que se consume durante el proceso. Recientemente en un trabajo realizado sobre la naturaleza química de la luminiscencia enAequorea, Morin y colaboradores (1971), observaron que este organismo es sensible al calcio, al magnesio y al estroncio. El calcio es el único ion que provoca fácilmente la luminiscencia, el estroncio muestra debilidad en su actividad, mientras que el magnesio la inhibe. La bioluminiscencia provocada por estimulación mecánica ha sido observada por Nicol (1958) en 4 especies de Hidromedusas batipelágicas, Crossota alba, Aeginura grimaldii, Octophialucium funeraria y Colobonema sericeum. En todos los casos la respuesta al estímulo se manifestó con un destello azulado, y en las diferentes especies la duración variaba ntre 1 y 4 segundos. Es interesante señalar además que la bioluminiscencia no había sido observada con anterioridad en las cuatro especies aquí citadas. Entre las Escifomedusas existen 4 géneros con especies bioluminiscentes, Atolla y Periphylla(Coronatae), así como Pelagia y Poralia(Semaeostomeae). Atolla wyvillei, Atolla parva y Periphylla periphylla producen un destello azulado cuando se las estimula mecánicamente. Este destello perdura alrededor de 2 segundos (Nicol, 1958). El proceso bioluminiscente enPelagia se efectúa en ausencia de oxígeno. La luz se produce en células epiteliales modificadas de la umbrela, las cuales se encuentran asociadas con células mucosas. Cuando el organismo es sometido a estimulaciones intensas, libera una secreción mucosa luminiscente sobre la umbrela (Boden y Kampa, 1964). En el género Poralia también se ha observado una secreción similar a la descrita para Pelagia(Herring, sin publicar). Es posible que la secreción luminosa liberada por estos organismos, la utilicen para distraer la atención de sus depredadores y poder evadirlos. También se ha observado quePelagia. posee una ritmicidad diurna en la luminiscencia, esto es, la estimulación táctil durante el día, no produce ningún efecto. Sin embargo se han obtenido resultados contradictorios relacionados con la existencia de un ritmo circadiano. Realmente hasta la fecha se conoce poco acerca de la bioquímica de la luminiscencia en las Escifomedusas. La bíoluminiscencia es un problema que se ha investigado en algunos aspectos desde un punto de vista puramente fundamental, y sólo en raras ocasiones, con alguna aplicación práctica directa. Por ejemplo, la dependencia que tienen del oxígeno molecular la mayoría de los sistemas bioluminiscentes para mantener el proceso de emisión de luz, puede proporcionar las bases para detectar la presencia de oxígeno. La sensibilidad de los sistemas bioluminiscentes al oxígeno molecular varía ampliamente entre los diferentes organismos. Se considera que las bacterias luminosas se encuentran entre los organismos más sensibles, y también entre los más convenientes, para ser utilizados como detectores de oxígeno (Johnson y Shimomura, 1972). Cualquier sistema luminiscente, aún el tipo más sencillo, en el que no intervienen componentes específicos diversos, a excepción de la luciferina como substrato, pueden ser empleados potencialmente como una prueba para detectar el componente específico (Cormier, et al.,1974). Por último, aunque el mecanismo dista de ser perfectamente claro, el único micrométodo rápido para detectar calcio en los sistemas biológicos, está basado en la especificidad para el calcio de la ecuorina bioluminiscente. La posibilidad de esta aplicación fue propuesta por Shimomura y colaboradores (1963) quienes hicieron hincapié en algunas de las ventajas proporcionadas en términos de especificidad, sensibilidad y velocidad de reacción. El calcio desempefia un papel importante en algunos procesos biológicos, como son, la excitación y contracción muscular, así como la transmisión neuromuscular (Cormier et al., 1974). Ashley y Ridway (1968) utilizaron por vez primera la ecuorina para detectar calcio en un sistema biológico, al observar el proceso de contracción en las fibras musculares de Balanus nubilus,las cuales fueron inyectadas con la proteína bioluminiscente sensible al calcio, la ecuorina. A partir de esta fecha se ha incrementado el empleo de la ecuorina bioluminiscente como una prueba para detectar la concentración de calcio durante estos procesos en diversos organismos. La aplicación práctica de la bioluminiscencia es potencialmente amplia e importante, y constituye paradójicamente uno de los fenómenos más comunes e inexplicables en el ambiente marino. ORGANISMOS ASOCIADOS A LAS MEDUSASDesde mediados del siglo XIX se han venido realizando algunas observaciones sobre las características que presentan las asociaciones entre ciertas especies de invertebrados y vértebrados. Sin embargo, hasta el momento, el esfuerzo encauzado para revisar y analizar ese fenómeno con el detalle que se precisa, no ha alcanzado el nivel necesario para obtener resultados efectivos. A continuación se describen las diferentes formas de asociación entre algunos organismos y las medusas que aparecen descritas en la literatura, así como las observadas durante el presenté estudio. Las medusas como huéspedes de larvas de tremátodos Lebour (1916a) señala la presencia en algunas especies de medusas, de una fase larvaria no enquistada (cercaria) del tremátodo Pharyngora bacillaris. La forma adulta de este tremátodo es un parásito común deScomber scombrus (macarela, caballa). Las medusas que aparecían infectadas con esta cercaria fueron,Obelia sp, Cosmetira pilosella, Turris pileata y Phialidium hemisphaericum. El parásito se encuentra por lo general adherido al manubrio, o bien a las paredes del estómago, aunque algunas veces aparece también en la pared subumbrelar. De acuerdo con Lebour (1916a) esta asociación es sin duda un caso de parasitismo, ya que la mayoría de las medusas obtenidas en los diversos arrastres, se encontraban infectadas por el tremátodo, y con la excepción de un ctenóforo(Pleurobrachia pileus), ninguno del resto de los organismos presentes en las colecciones contenían el parásito. Stunkard (1967) observó "in situ", larvas no enquistadas del tremátodoOpechona, o un género muy similar, en 3 especies de medusas, Bougainvillia carolinensis, Gonionemus vertens y Chrysoara quinquecirrha, las cuales contenían muchos de estos parásitos. Stunkard, más tarde (1969) realizó algunos experimentos en acuarios, para analizar el ciclo de vida del parásito. Los datos obtenidos durante estos estudios ayudaron a dilucidar algunos problemas. Así, el primer huésped intermediario del parásito es ungasterópodo la especieAnacharis avara en donde se desarrollan las cercarias. Estas posteriormente penetran, aunque no se enquistan, en algunas especies de medusas comoGonionemus vertens y Chrysoara quinquecirrha, así como en el ctenóforoMnemiopsis leidy, donde se transforman en metacercarias. El estado adulto de estas formas se desarrolla en algunos peces teleósteos incluyendo a Stenotomus chrysops y Centropristis striatus,los cuales adquieren el parásito al ingerir medusas infectadas. El análisis de este ciclo de vida también proporcionó un esclarecimiento en la posición sistemática del tremátodo, el cual fue a asignado a un género nuevo Neopechona, y descrito otra vez como una nueva combinación, N. pyriforme (Linton, 1900). Las medusas como huéspedes de crustáceos Barham y Pickwell (1969) observaron "in situ" la asociación entre el isótopo gigante Anuropus branchiatus, y la enorme escifomedusa Deepstarai enigmatica Russell, 1967. Las fotografías obtenidas en esta ocasión, antes y después de la captura, muestran claramente al isópodo adherido a la superficie subumbrelar de la medusa. Estos autores afirman que la medusa no mostraba movimientos natatorios normales, al contrario, la medusa aparecía fláccida, flotando pasivamente. Russell (1967) al examinar esa medusa observó que carecía de estómago, de una porción de la umbrela, del revestimiento epitelial y de algunas porciones del músculo coronal, por lo cual sugirió que el ejemplar se encontraba moribundo en el momento de la captura. Bartham, y PickweIl (1969) indican que el anurópido se alimenta de los tejidos de la medusa hasta el punto de incapacitar sus movimientos naturales, y así crea un vehículo flotante y protector". Es interesante destacar que estos autores no encontraron nematocistos en el contenido estomacal del isópodo asociado, de tal manera que el significado ecológico de su relación es puramente conjetural, ya que no existen criterios establecidos para determinar exactamente cuáles son los movimientos natatorios normales enDeepstaria, y además, como mencionan Phillips et al. (1969), las medusas pueden actuar como huéspedes de una amplia variedad de crustáceos y otros metazoarios, sin perder la capacidad en sus movimientos. Desde hace varios años se han venido realizando una serie de observaciones esporádicas sobre las relaciones entre algunas especies de anfípodos y diversas escifomedusas. Dahl (1959) al examinar histológicamente el tubo digestivo de 25 ejemplares de Hyperia galba, obtenindos de la escifomedusa Cyanea capillata, observó un gran número de cápsulas de nematocistos, algunos de los cuales identificó como los del tipo y tamaño característico deC. capillata.Basándose en esta evidencia Dahl asume queH. galbaes un ectoparásito verdadero de la escifomedusa con quien se encuentra en esta asociación biológica. Las observaciones de Bowman, Meyer y Hicks (1963) sobre este tipo de asociaciones, sugieren que los tejidosdel huésped no constituyen ni el único alimento, ni siquiera son la fuente principal de su nutrición. Es posible que la medusa actúe como una plataforma móvil desde la cual el anfípodo realiza pequeñas excursiones para recolectar partículas alimenticias, incluyendo algunas que proceden de las capturas realizadas por la medusa. En efecto, las superficies molares y mandibulares deHyperiaestán adaptadas para triturar material mucho más consistente y fibroso que el proporcionado por el tejido gelatinoso de la medusa (Bowman y Greener, 1973). Harbison, Biggs y Madin (1977) al estudiar las asociaciones de los anfípodos con el zooplancton gelatinoso, encontraron que algunos miembros de las familias Hyperiidae, Brachyscelidae y Lycacidae aparecían asociados con diferentes especies de medusas, entre las que se encontraban, Aequorea sp, Eirene pyramidalis, Pelagia noctiluca, Liriope tetraphylla y Leuckartiara sp. Estos autores observaron también la ocurrencia de dos o más especies de anfípodos en algunas medusas, tal es el caso de Brachyscelus rapacoides, Brachyscelus sp, Lestrigonus schizogeneios y Lestrigonussp, cohabitando en la medusaAequorea sp. Al parecerLestrigonusmuestra cierta preferencia por consumir el alimento capturado por la medusa, en tanto que,Brachyscelusconsume los tejidos del huésped. De acuerdo con estos autores, los hábitos alimenticios de los anfípodos son bastante flexibles, y se encuentran condicionados por circunstancias relacionadas con la nutrición del huésped. Numerosos anfípodos se alimentan de las partículas capturadas por el huésped, o bien de los tejidos de éste, dependiendo de su disponibilidad, por lo que es posible que el comportamiento alimenticio de los anfípodos sea esencialmente oportunista, como sucede con algunos peces asociados a las escifomedusas. Durante el presente estudio, 6 de los 7 413 ejemplares de Pelagia noctiluca observados, contenían numerosos anfípodos simbiontes en sus tejidos. Los anfípodos aparecían embebidos en el tejido subumbrelar, a nivel de los filamentos gástricos, en los festones marginales, así como en los brazos orales. El Dr. Alan Hart del Departamento de Oceanografía Biológica de la Universidad de Texas A & M, EUA, efectuó la identificación de estos anfípodos asociados, determinando una sola especie, Thamneus platyrrhynchus Stebbing, 1888 y diversas formas juveniles enquistadas, las cuales podrían corresponder a la misma especie. Harbison et al. (1977) han observadoT. platyrrhynchus asociado con P. noctiluca, así como Lestrigonus crucipes(Familia Hyperiidae), sin encontrar hasta ese momento las dos especies de anfípodos cohabitando en una misma medusa. Otros crustáceos que han sido observados en asociación con las medusas, son las larvas filosomas de algunas especies de langostas. Shojima (1963) recolectó larvas grandes de la especieIbacus ciliatus adheridas a las escifomedusasAurelia aurita y Dactylometra pacifica.La mayoría de las larvas se encontraban en la última fase de filosoma. Thomas (1963) observó también este tipo de asociación entre larvas filosofas de Ibacus sp, y la escifomedusa Pelagia panopyra. Cada medusa contenía una larva de Ibacus adherida firmemente a la superficie exumbrelar. De acuerdo con este autor, la asociación podría proporcionar cierta ventaja para la filosoma, ya que obtendría protección, trasporte y posiblemente también alimento. Sin embargo, en cuanto a este último factor, no fue posible demostrar que las filosomas estuviesen alimentándose de los tejidos de la medusa. Las larvas de picnogónidos también se encuentran asociadas con las medusas, como lo demuestra Lebour (1916b), quien observó numerosas medusas conteniendo larvas de picnogónidos en el manubrio, y en la unión del manubrio con el estómago. Las medusas involucradas en este tipo de asociación fueronObelia sp,Cosmetira pilosella, Turris pileata, Stomotoca dinema y Phialidium hemisphaericum. Las formas larvarias fueron identificadas como fases larvales de Anaphia petiolata, un picnogónido que habita comúnmente diferentes colonias de hidrozoarios durante sus primeras fases de desarrollo. Durante esta etapa, un gran número de larvas, en vez de introducirse a un pólipo, se introducen en una medusa, posiblemente adhiriéndose a ésta antes de ser liberada de la colonia, o quizá penetrando a una gonoteca, antes de la liberación de la medusa. Este hecho proporciona una gran ventaja al organismo simbionte, incrementando así su área de dispersión, ya que se trata de organismos con movimientos natatorios débiles y por lo tanto con áreas de distribución restringidas. Por último, se ha observado con cierta frecuencia una interesante asociación entre el cangrejo-araña,Libinia. dubia y algunas especies de escifomedusas. Este crustáceo bentónico aparece adherido al manubrio de las escifomedusas, Aurelia aurita, Stomolophus meleagris, ChrYsaora quinquecirrha y Chiropsalmus quadrumanus, y se alimenta de los tejidos del huésped. Teniendo en cuenta los hábitos de estos dos organismos en asociación, uno planctónico y el otro bentónico, Corrington (1927) analiza el problema proponiendo dos alternativas: la medusa adquiere el simbionte al descender al substrato del fondo, aun cuando sea ocasionalmente, o bien, el cangrejo en alguna de sus fases larvales, busca protección dentro de la umbrela de la medusa y permanece adherido a ella durante un largo período de su ciclo de vida. Gutsell (1928) se muestra de acuerdo con la hipótesis de que el cangrejo penetra en la cavidad umbrelar de la medusa durante la última fase de su período larval (posiblemente la megalopa). Phillips, Burke y Keener (1969) al observar el comportamiento de estos organismos en su medio ambiente natural, así como en acuarios deducen que el cangrejo entra en una asociación transitoria con la medusa cuando ésta se encuentra cerca del fondo, o en ese substrato. El hecho de haber observado y recolectado numerosos cangrejos (con tamaños similares a aquellos que habitan en las medusas) asociados con hidroídes y ectoproctos, apoya la naturaleza transitoria de esta asociación. Como afirma Phillips (1972), la asociación del cangrejoaraña con la medusa, no es un tipo de simbiosis permanente. Se puede considerar más bien que el cangrejo es, en este caso, un depredador. Las medusas y su relación con los peces La asociación entre algunos peces y ciertas especies de escifomedusas se ha venido observando desde finales del siglo pasado. Lawles (1877) cita el acompañamiento invariable entre Aurelia aurita y un pez no identificado. Posteriormente Romanes (1877) contribuye a este respecto, identificando el pez involucrado en este tipo de asociación como Merlangus carbonarius. En ese mismo año, Gill (1877) observa el fenómeno en otras especies, Pronotus similis aparece asociado en un número considerable con Dactylometra quinquecirrha, Zygodactlylo groenlandica y Cyanea artica. De acuerdo con algunos autores, la asociación de los peces con las medusas, proporciona a los primeros, protección y oportunidad de atrapar pequeños organismos planctónicos paralizados o capturados por los tentáculos de las medusas. Así lo demuestra el trabajo de Dahl (1961) quien confirma este punto de vista, al observar el comportamiento de las formas juveniles de Gadus merlangus las cuales buscan la compañía deCyanea capillata debido principalmente a la protección que proporciona la medusa. Durante el curso de su investigación observó que el contacto con los tentáculos de la escifomedusa, no parece ser muy peligroso para los juveniles deG. merlangus. Al analizar histológicamente la piel de estos juveniles, encontró solamente algunos nematocistos aislados adheridos a la piel, por lo que supone que la superficie corporal de estos organismos, no estimula la descarga de los nematocistos de la medusa. Y lo considera como una posible adaptación a la asociación con la escifomedusa. Mansueti (1963) ofrece una revisión detallada sobre la naturaleza de la asociación entre los peces y las escifomedusas, y discute la relación simbiótica de algunos de ellos en la Bahía de Chesapeake. Así, analiza la relación existente entrePeprilus alepidotus, Poronotus triacanthus y la esciformedusa Chrysaora quinquecirrha, y concluye que el grado de asociación entre estas especies, varía desde el contacto puramente accidental, pasando por el comensalismo, hasta llegar al parasitismo. Así por ejemplo, un número considerable de formas juveniles deP. alepidotus y P. triacanthus llevan una existencia aparentemente comensal y ectoparásita con la escifomedusaC. quinquecirrha en la Bahía de Chesapeake durante los meses de julio a octubre. P. alepidotus es el pez más abundante en este tipo de asociación, y es atraído por las medusas donde encuentra protección y alimento. Así, se inicia una asociación comensal al consumír organismos planctónicos que se encuentran sobre o en las cercanías del huésped. Esta asociación se convierte gradualmente en parasítica al atacar y consumir algunos órganos del huésped como son, los tentáculos y el manubrio. Finalmente, en el otoño, el pez se convierte en un organismo depredador de la medusa. Se ha observado al mismo tiempo que peces del mismo tamaño, llevan una existencia independiente en los mismos meses que los peces simbióticos, lo cual sugiere que en la mayoría de los casos, este tipo de asociación es fortuita. Mansueti (1963) concluye que la mayoría de las asociaciones entre peces y medusas, son fenómenos ecológicos temporales, resultantes de una serie de factores extrínsecos en los cuales, las medusas son esencialmente huéspedes pasivos, y los peces oportunistas activos. Los peces asociados con las medusas, gozan de una ventaja sobre aquellos no simbióticos de la misma especie, la cual repercute en un suplemento alimenticio continuo, abrigo, protección e inmunidad gradual, y al mismo tiempo obtienen un incremento en el área de dispersión de la especie, reduciendo así la competencia intraespecífica. Un ejemplo de comportamiento similar ha sido observado por Phillips, Burke y Keener (1969) en otras especies. Al estudiar las interrelaciones tróficas de las medusas con otros organismos en las aguas del Golfo de México, encontraron que las formas juveniles de P. alepidotus y Chloroscombrus chrysunus se encontraban asociadas a las escifomedusas C. quinquecirrha y Stomolophus meleagris, en un tipo de asociación puramente comensal. La medusa proporciona protección y es, en mayor o menor grado, una fuente de alimento para los comensales, sin llegar éstos en ninguno de los casos a alimenarse de los tejidos de la medusa. Al mismo tiempo, la medusa lleva consigo, en los peces, alimento disponible. Aparentemente el factor principal en este tipo de asociación comensal, es la habilidad de los peces asociados para evitar el contacto con los tejidos de la medusa mientras permanecen en sus cercanías. Estos autores también observaron la asociación entrePoronotus burti y la escifomedusaCyanea capillata, en la quePoronotus es un verdadero depredador de la escifomedusa, siendo inmune a sus nematocistos. Los peces analizados durante este estudio, a excepción dePoronotus, no eran inmunes a las toxinas de las escifomedusas. Se conoce muy poco acerca de los aspectos inmunológicos involucrados en este tipo de asociación. Aparentemente una misma especie de pez, puede o no, ser inmune a las toxinas del huésped, dependiendo esto de la localización geográfica, y de los factores abióticos (temperatura, salinidad), así como del estado fisiológico de la medusa (Phillips, 1972). Las medusas como huéspedes de larvas de otras especies de medusas Durante el presente estudio se encontraron larvas de Narcomedusas adheridas a las regiones subumbrelares deRhopalonema velatum y Aglaura hemistoma.Kramp (1957, 1959) considera a estas larvas de Narcomedusas como organismos comensales y discute su presencia en Bougainvillia platygaster, Rh. velatum, Rh. funerarium y Pantachogon haeckeli, las cuales identifica tentativamente como fases larvales de Pegantha triloba, Cunina peregrina, Cunina. sp y Pegantha sprespectivamente. En el presente estudio, 20 de los 2 497 ejemplares de Rh. velatum analizados, presentaban agrupamientos de larvas de Narcomedusas adheridos a la región subumbrelar, cerca de la base del estómago. Cada uno de los ejemplares poseía un conjunto de larvas en diferentes estados de desarrollo. Estas larvas son aparentemente idénticas a las descritas por Kramp (1957, 1959), como larvas de Cunina peregrina. Sin embargo en este caso, a diferencia de lo observado por Kramp, "huéspedes más o menos degenerados, destituidos de gonadas y por lo general sin manubrio", la medusa huésped se encontraba, en la mayoría de los casos, en perfectas condiciones, sin presentar ningún signo degenerativo. Phillips (1972) al estudiar los Cnidarios del Golfo de México, observa algunos ejemplares de Rh. velatum con larvas asociadas, y en perfectas condiciones, lo que le hace suponer que se trata de una especie de Narcomedusa distinta a la observada por Kramp. Desde un punto de vista muy particular, se trata de la misma especie descrita por Kramp en 1957, solo que debido a factores accidentales, coincidió que este autor siempre las observó en ejemplares que habían perdido las gonadas y el estómago por alguna otra causa, muy ajena al comensalismo de estas Narcomedusas, Por lo que se refiere a Aglaura hemistoma, 13 de los 11723 ejemplares analizados, aparecieron con grupos de larvas de Narcomedusas adheridas a la región subumbrelar, en las cercanías de la base del pedúnculo. Estas larvas son muy semejantes a aquellas deC. peregrina que se encontraron asociadas a Rh. valatum, por lo que es posible que C. peregrinacarezca de una elevada especificidad con respecto a la elección del huésped. Hasta la fecha no se conocen con certeza, los efectos queproduce el parasitismo en la dinámica de las poblaciones de medusas. Este campo proporciona por ejemplo, un excelente potencial en la investigación de los métodos de control biológico en especies extremadamente tóxicas, que habitan las aguas costeras donde causan, con frecuencia, garves problemas a los nadadores. ConclusionesDISCUSIÓN Y CONCLUSIONESCon el objeto de establecer una discusión desde un punto de vista preferentemente zoogeográfico, las especies de Hidromedusas y Escifomedusas recolectadas durante el presente estudio, se agrupan en dos categorías ecológicas principales: especies neríticas, y especies oceánicas, esta última comprende a su vez dos grupos, epipelágico y batipelágico, en relación con el hábitat batimétrico normal que ocupan. ESPECIES NERÍTICASEsta categoría incluye a las medusas que derivan de hidroides sésiles adheridos al fondo (o a objetos que se encuentran en el fondo) de la plataforma continental y a lo largo de la región costera. De las 37 especies de medusas neríticas que se observaron durante el presente estudio, únicanmente 5 son endémicas, Sarsia coccometra, Ectopleura sacculifera, Lizzia alvarinoae, Lizzia ferrarii y Octophialucium bigelowi. Es interesante señalar que de estas 37 especies de medusas neríticas, solamente 6 son originarias de las aguas frías de los hemisferios norte y sur respectivamente.Halitholus pauperes una especie predominantemente ártica, con una distribución considerable en el Océano Atlántico, comprendiendo las costas orientales y occidentales de Groenlandia, el Estrecho de Hudson, y el noroeste de Islandia. En el Océano Pacífico solo se había recolectado en el Mar de Ojotsk, al norte de Japón, y en las costas norteamericanas de Vancouver (Kramp, 1968). Sin embargo durante el presente estudio, aparece esporádicamente en las aguas del Pacífico Tropical Oriental. Es notable que una especie indígena de las aguas árticas y boreales, extienda su distribución a las aguas tropicales, ya que existen barreras hidrológicas, como son las surgencias, en el límite entre las aguas boreales y tropicales. Sin embargo es muy probable que las medusas, con sus hábitos pelágicos, sean capaces de sobrepasar estos límites, bajo ciertas condiciones. Así, durante un flujo extremado de las aguas nórdicas, poblaciones de esta especie han logrado avanzar hacia la región tropical, manteniéndose allí y recibiendo intermitentemente nuevos aportes. Pochella polynema y Podocoryne simplex son especies predominantemente boreales, con apariciones esporádicas en las aguas del Pacífico central y norteamericano, y ahora también se han encontrado en algunas localidades en la región del Pacífico Tropical Oriental. Phialidium simplex y Halitholus intermedius son especies originarias de las aguas subantárticas. La presencia de estas especies en el Pacífico Tropical Oriental, se debe posiblemente a que son arrastradas por las aguas de la Corriente de Perú, que fluyen hacia el norte y giran hacia el oeste, a la altura del ecuador para integrarse a la Corriente Ecuatorial Meridional. Bythotiara drygalskii es una especie antártica, que puede penetrar a la región del Pacífico Tropical Oriental, al igual que las dos especies anteriores, bajo la influencia de la Corriente de Perú. Las regiones árticas y subantárticas tienen sus faunas propias y hasta el presente, un número muy escaso de medusas neríticas de estas regiones, han aparecido en otras zonas del Océano Pacífico. En efecto, entre la región boreal y oriental y el Pacífico Tropical Oriental, existe un límite faunístico definido, como resultado de la trayectoria de la Corriente de California, la cual gira hacia el oeste a la altura de Baja California, y forma parte de la Corriente Ecuatorial Septentrional, impidiendo así, un avance de las especies boreales hacia el sur y viceversa. Por otro lado, el sistema de Corrientes de Perú, conduciendo aguas frías del hemisferio sur hacia la zona ecuatorial, constituye otro límite, aunque menos definido, entre las especies tropicales y las subantárticas. No obstante remolinos procedentes de los sistemas principales de esas corrientes, desplazan porciones de poblaciones hacia localidades alejadas de esos circuitos. La mayoría de las 37 especies de medusas neríticas recolectadas en la región del Pacífico Tropical Oriental, se encuentran distribuidas ampliamente por las aguas del Océano Pacífico, sin embargo 3 de ellas, tienen una distribución errátil en dichas aguas, Kanaka pelagica, Eucheilota comata y Podocoryne minima. Esta última muestra el mismo comportamiento en el Océano Atlántico. Teniendo en cuenta el número considerablemente elevado de medusas neríticas (187 especies según Kramp, 1968) que habitan la región del Indo-Pacífico Occidental, son muy pocas las especies que se han observado durante estos estudios en las aguas del Pacífico Tropical Oriental.Podocoryne carnea y Lizzia gracilis son especies comunes en la región Indo-Malaya,Zanclea costata, Eucheilota menoni, Gotoea similis yToxorchis polynema, son especies frecuentes en las aguas del Océano Indico, las dos primeras no se han observado en el Océano Atlántico, y las dos últimas tienen una distribución errátil en dichas aguas. Por el contrario,Podocoryne carnea es una especie habitual en las aguas del Océano Atlántico y en el Mediterráneo, rara en la región del Pacífico Tropical Oriental, y no se ha observado en el Océano Indico (Kramp, 1959a). Considerando esta diferencia tan enorme en cuanto a la composición faunística de Hidromedusas neríticas de ambas regiones, es lógico suponer que esa área extensa de mar abierto que separa a estas dos regiones, constituye una barrera natural que impide el avance de las especies hacia el Este. Como es sabido, existen especies que habitan la región del Pacífico Tropical Oriental y también se encuentran en las aguas del Océano Atlántico. La mayoría son especies con una amplia distribución en ambos océanos,Ectopleura dumortieri, Phialopsis diegensis, Zanclea costata(muy común también en el Mediterráneo),Euphysora. furcata y Cytaeis tetrastyla(especies parcialmente oceánicas),Stomotoca pterophylla y la Escifomedusa Nausithoë punctata.La presencia de estas especies en las aguas cálidas y templadas de ambos océanos, pudo derivarse de una conexión directa al través del actual Istmo de Panamá, en un período geológico anterior (Kramp, 1959a; 1968). Por otro lado, existen especies que son habitantes comunes en las aguas del Pacífico Tropical Oriental, y sin embargo en el Océano Atlántico, aparecen restringidas a ciertas localidades.Aequorea macrodactyla es una especie habitual en el Pacífico Tropical Oriental, así como en el Océano Indico, pero en el Océano Atlántico su aparición es aislada, costas occidentales de África, zona sur de las costas orientales de América, Mar del Caribe, y costas suroeste de las Islas Británicas. Esta especie tiene una vida pelágica prolongada por lo que es capaz de avanzar y desplazarse a grandes distancias con las corrientes. Proboscidactyla ornata tiene una distribución circunglobal en las aguas cálidas y costeras, sin embargo en el Océano Atlántico, su presencia es esporádica. Aequorea coerulescens es una especie común en las aguas de los Océanos Indico y Pacífico y rara en el Océano Atlántico. Las siguientes especies, Bougainvillia fulva, Leuckartiara zacae, Phialidium uchidai, Dipleurosorna. pacificum, Euphysora bigelow, y la EscifomedusaNausithoë albatrossi, aparecen con cierta frecuencia en las aguas del Pacífico Tropical Oriental, sin embargo no se han observado en el Océano Atlántico. Asimismo, en las aguas del Pacífico Tropical Oriental aparecen medusas neríticas procedentes de regiones oceánicas muy distantes. Tal es el caso deEuphysilla pyramidata, especie conocida únicamente de la región occidental de Madagascar y del Golfo de Guinea, en las costas occidentales de África (Kramp, 1968). Su presencia en la zona de estudio es difícil de explicar, sin embargo existe la posibilidad de que haya sido arrastrada hasta las aguas tropicales del Mar Caribe, por el flujo de la Corriente Ecuatorial Meridional que avanza en estas regiones. Su paso hacia la región del Pacífico Tropical Oriental pudo efectuarse, al igual que otras especies, mediante una conexión directa a través del Istmo de Panamá. Otra vía de comunicación podría señalarse avanzando desde Madagascar con la Deriva del Oeste a través de la región meridional del Océano Pacífico, y adentrándose en la Corriente de Australia y la compleja región Indonesia-Malasia-Melanesia, integrarse en la Contracorriente Ecuatorial, estableciendo sus poblaciones en el Pacífico Tropical Oriental, recibiendo pulsaciones intermitentes con nuevos aportes mediante esta ruta. Indiscutiblemente existen diferencias características en la composición faunística de las diversas regiones geográficas, sin embargo es indudable el hecho de que existe un intercambio de especies entre dichas regiones. Las especies al avanzar en nuevos ambientes y encontrar las condiciones hidrológicas y bióticas adecuadas, se establecen y extienden así sus poblaciones, en el caso contrario, sus incursiones son momentáneas y fracasan en su avance por nuevas regiones oceánicas. ESPECIES OCEÁNICASLas especies oceánicas se pueden definir como aquellos organismos que habitan las masas de agua de los océanos, sin depender directamente de la región costera. Las corrientes marinas constituyen un factor importante en la distribución de estos organismos. La mayoría de las medusas oceánicas son holopelágicas (Traquimedusas y Narcomedusas), esto es, que durante todo su ciclo de vida forman parte del plancton. Sin embargo, algunas especies de Antomedusas y Leptomedusas, aunque derivan de hidroides sésiles adheridos al fondo de la plataforma costera, se desplazan y habitan en la zona plenamente oceánica, lejos de las costas, por lo cual se definen como especies parcialmente oceánicas (Kramp, 1968). Estas especies, al igual que las especies oceánicas, se encuentran influidas por las mismas condiciones hidrológicas. En esta categoría quedan incluidas 3 especies, Cytaeis tetrastyla., Euphysora furcata. y Phialopsis diegensis las cuales han sido consideradas entre las especies neríticas. ZONA EPIPELÁGICALa gran mayoría de las especies de Hidromedusas epipelágicas recolectadas en las aguas del Pacífico Tropical Oriental, son indígenas de las aguas cálidas, y tienen una distribución amplia en las regiones cálidas y templadas del Océano Pacífico, difiriendo algunas de ellas en sus límites de distribución hacia ambos hemisferios. Con excepción de algunas especies, las restantes se encuentran de la misma manera, distribuidas ampliamente por las aguas cálidas y templadas de los Océanos Indico y Atlántico. Entre las escifomedusas, Pelagia noctiluca es una forma oceánica y su amplitud de distribución es muy grande, habitando las aguas cálidas y templadas de todos los océanos (Russell, 1970). De las 20 especies oceánicas que se observaron en las colecciones estudiadas, únicamente 2 tienen una población indígena en las aguas templadas del Pacífico Norte, Aegina citrea y Rhopalonema velatum, abundantes y de frecuencia constante en las zonas templadas de los Océanos Pacífico, Indico y Atlántico, y son euribáticas. La presencia de las siguientes especies, Pegantha clara, Pegantha martagon, Cunina frugifera y Cunina globosa, en las aguas templadas del Pacífico Norte, es más o menos esporádica.Liriope tetraphylla y Solmundella bitentaculata. son especies abundantes y de frecuencia constante en el Pacífico Norte. así como en otras regiones oceánicas, y son particularmente abundantes en el Pacífico Tropical Oriental. S. bitentaculata y P. martagon son asimismo abundantes en el hemisferio sur, penetrando en las aguas antárticas (Kramp, 1968). Solamente 1 especie de Narcomedusa, Cunina tenella, se extiende hasta las aguas árticas del Océano Pacífico, y no se ha observado en el Océano Atlántico ni en el Mediterráneo. Algunas de las especies que aparecieron en la zona de estudio, necesitan una consideración especial debido a que sus áreas de distribución se encuentran más o menos restringidas. Aeginura beebei solo aparecía esparcida en algunas localidades de la región estudiada, principalmente ocurría en Panamá, suroeste de las Islas Galápagos y frente a Perú. Solmaris rhodoloma yAmphogona apsteini, son especies comunes en las aguas tropicales en el Océano Pacífico Occidental, la segunda de ellas ha sido observada con frecuencia también en el Océano Indico, y sin embargo aparecen. únicamente en algunas localidades del Pacífico Tropical Oriental. De estas 3 especies, A. apsteini, es la única que ha sido observada, y solo en una ocasión, en las aguas del Océano Atlántico (Golfo de Guinea). ZONA BATIPELÁGICAEn las aguas del Pacífico Tropical Oriental aparecieron 4 especies que se consideran predominantemente batipelágicas,Rhopalonema funerarium, Haliscera bigelowi, Tetrorchis erythrogaster y Amphogona apicata. Dichas especies fueron recolectadas en los estratos superficiales del océano, lo que indica la posibilidad de que su presencia en los estratos epipelágicos, se debe a la acción de los fenómenos de surgencias en esa zona.Rh. funerarium se encuentra distribuida ampliamente en los Océanos Pacífico, Indico y Atlántico (Kramp, 1959).A. apicala es una especie con una amplia distribución en el Océano Atlántico, y rara en el Océano Índico. En el Océano Pacífico solo había sido recolectada en Nueva Zelanda, y ahora aparecía distribuida ampliamente por las aguas del Pacífico Tropical Oriental, H. bigelowi y T. erythrogaster, aparecen con cierta frecuencia en las aguas del Océano Atlántico, son especies comunes en el Pacífico Tropical Oriental, y no se han observado en el Océano Indico, lo cual puede atribuirse, como en otros casos, a un fenómeno muy peculiar en las medusas, el que se refiere a su aparición errátil en los ámbitos marinos. Son relativamente pocas las especies de medusas con poblaciones extensas y abundantes. Los resultados del presente estudio lo confirma una vez más, ya que de las 64 especies de medusas que se identificaron en las aguas del Pacífico Tropical Oriental, únicamente 19 presentan una distribución continua a lo largo de los cinco periodos bimestrales que comprendió este trabajo. La mayoría de estas especies muestra además, un incremento considerable en sus poblaciones durante los periodos bimestrales Febrero-Marzo 1967 o Febrero-Marzo 1968. El presente trabajo contribuye, en gran medida, a la integración del conocimiento de la fauna de medusas pelágicas que habitan las aguas del Pacífico Tropical Oriental, ampliándose así, la lista faunística de estos organismos al incluir 2 especies nuevas, así como 19 especies que se registran por vez primera en esta región del Océano Pacífico.
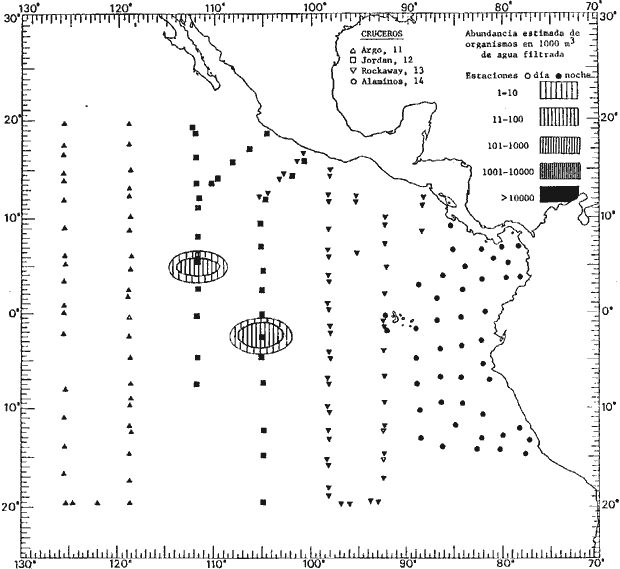 Fig. 8. Distribución general de Aequorea macrodactyla (Brandt, 1835), en el Pacífico Tropical Oriental durante el primer periodo bimestral (Febrero-Marzo 1967). 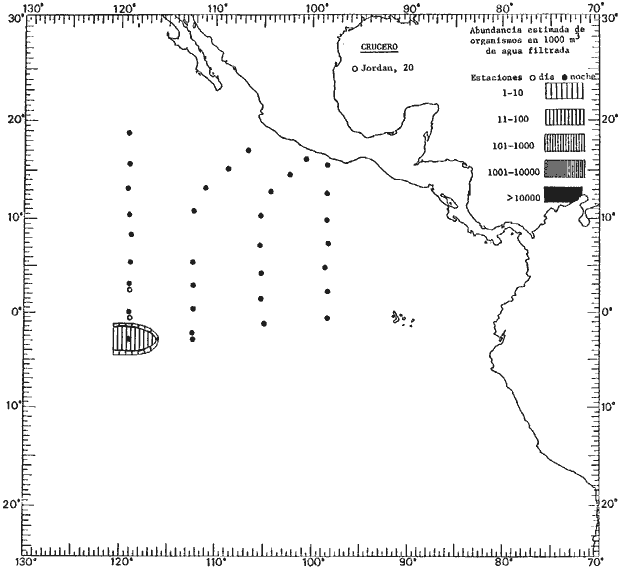 Fig. 9. Distribución general de Aequorea macrodactyla (Brandt, 1835), en el Pacífico Tropical Oriental durante el segundo Periodo bimestral (Abril-Mayo 1967). 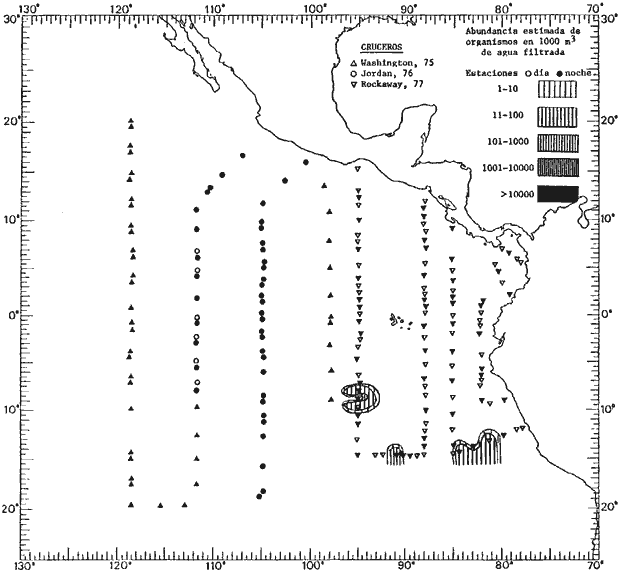 Fig. 10. Distribución general de Aequorea macrodactyla (Brandt, 1835), en el Pacífico Tropical Oriental durante el último periodo bimestral (Febrero-marzo 1968). 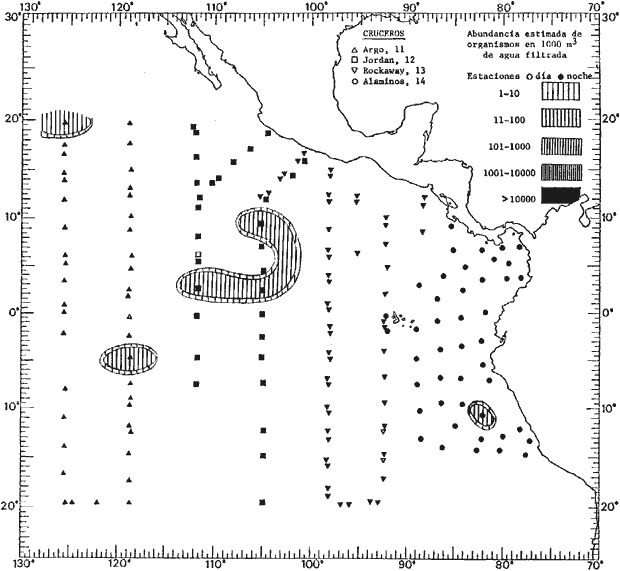 Fig. 11. Distribución general de Cunina frugifera Kramp, 1918, en el Pacífico Tropical Oriental durante el primer periodo bimestral (Febrero-Marzo 1967). 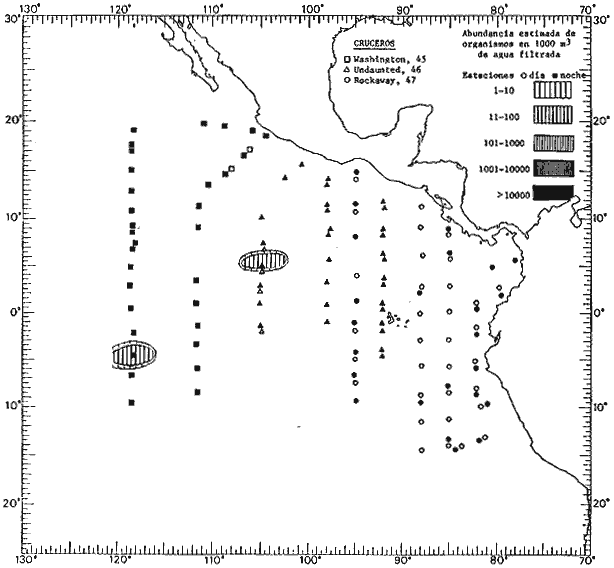 Fig. 12. Distribución general de Cunina frugifera Kramp, 1948, en el Pacífico Tropical Oriental durante el cuarto periodo bimestral (Agosto-Septiembre 1967). 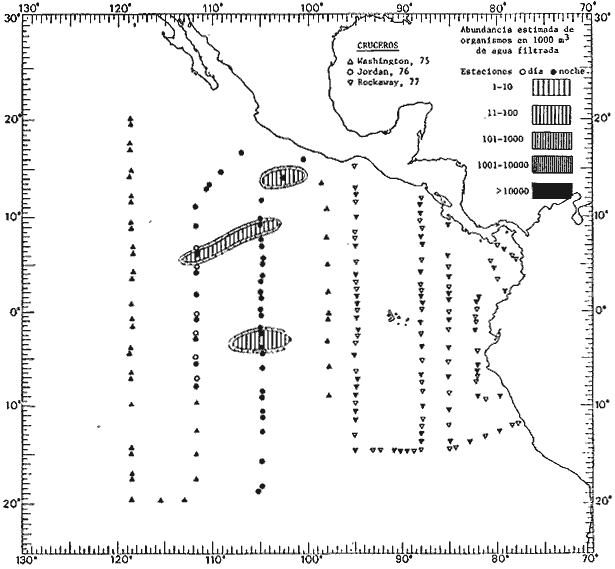 Fig. 13. Distribución general de Cunina frugifera Kramp, 1948, en el Pacífico Tropical Oriental durante el último periodo bimestral (Febrero-Marzo 1968). 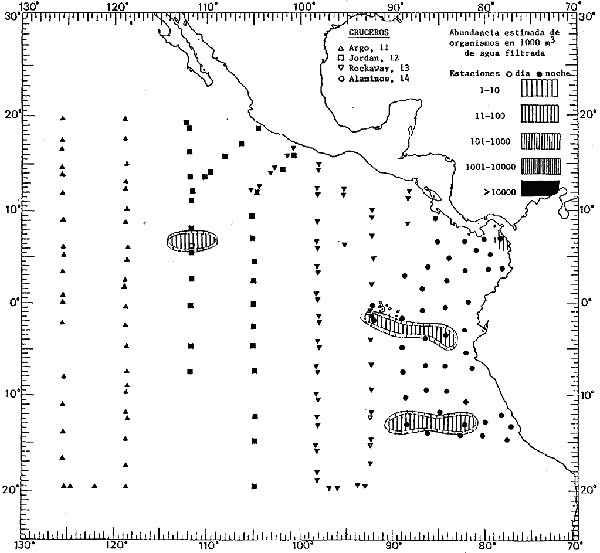 Fig. 14. Distribución general de Cunina globosa Eschscholtz, 1829, en el Pacífico Tropical Oriental durante el primer periodo bimestral (Febrero-Marzo 1967). 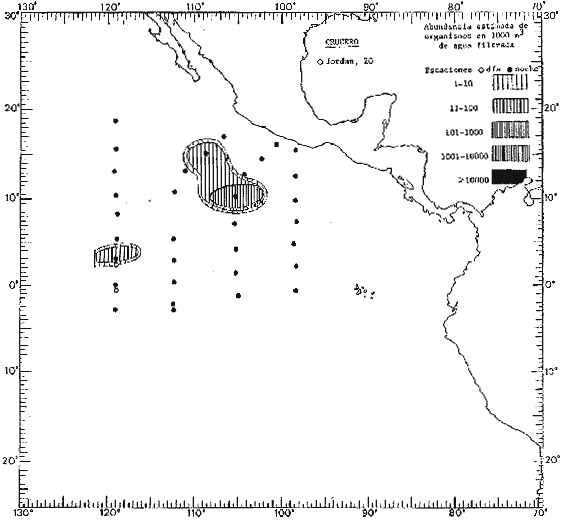 Fig. 15. Distribución general de Cunina globosa Eschscholtz, 1828, en el Pacifíco Tropical Oriental durante el segundo periodo bimestral (Abril-Mayo 1967). 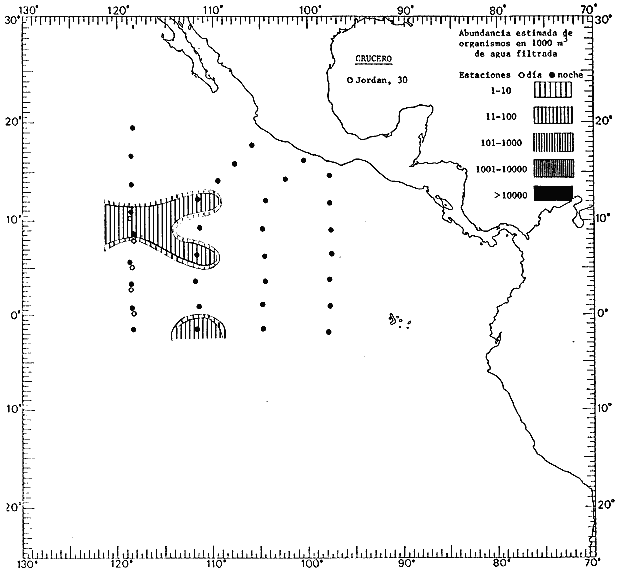 Fig. 16. Distribución general de Cunina globosa Eschscholtz, 1829, en el Pacífico Tropical Oriental durante el tercer periodo bimestral (junio-julio 1967). 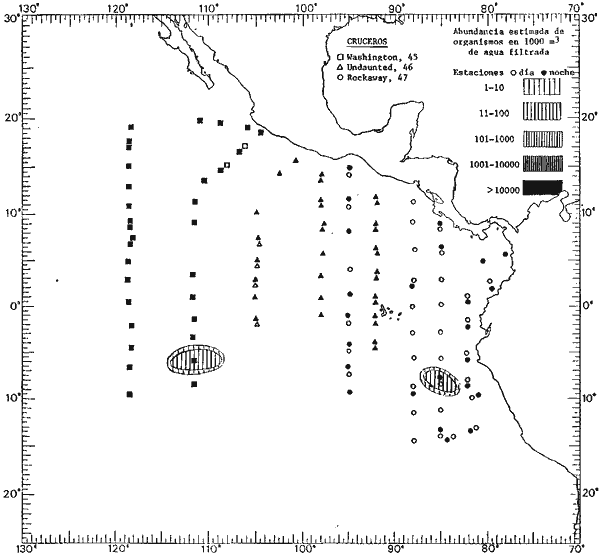 Fig. 17. Distribución general de Cunina globosa Eschscholtz, 1829, en el Pacífico Tropical Oriental durante el cuarto periodo bimestral (Agosto-Septiembre 1967).  Fig. 18. Distribución general de Cunina globosa Eschscholtz, 1828, en el Pacífico Tropical Oriental durante el quinto periodo bimestral (Febrero-Marzo 1968). 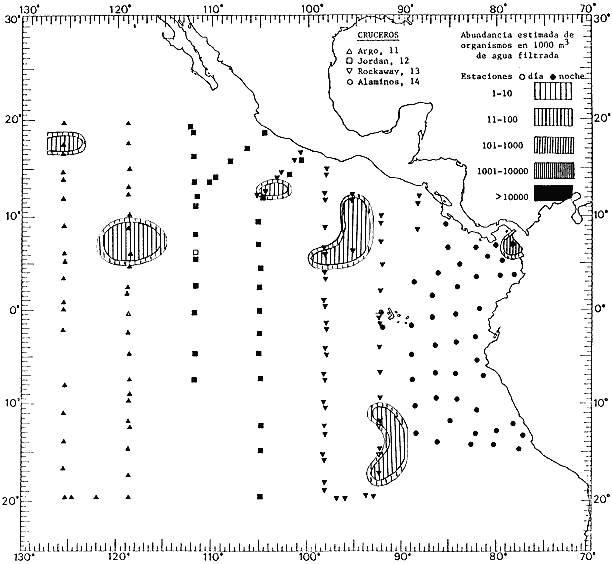 Fig. 19. Distribución general de Cunina octonaria McCrady, 1857, en el Pacífico Tropical Oriental durante el primer periodo bimestral (Febrero-Marzo 1967). 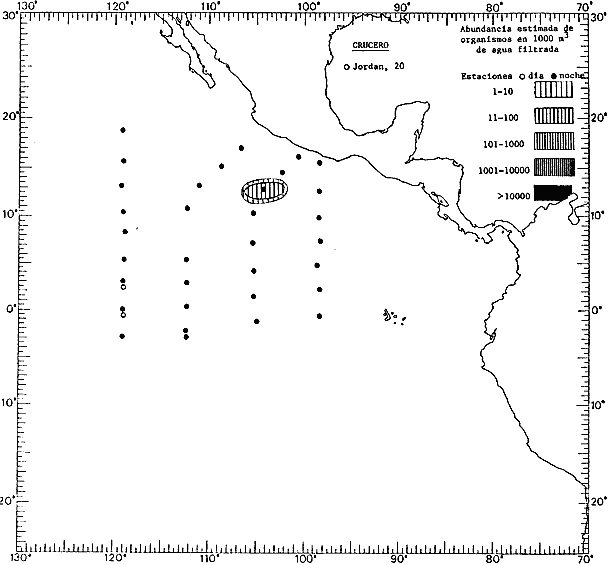 Fig. 20. Distribución general de Cunina octonaria McCrady, 1857, en le Pacífico Tropical Oriental durante el segundo periodo bimestral (Abril-Mayo 1967). 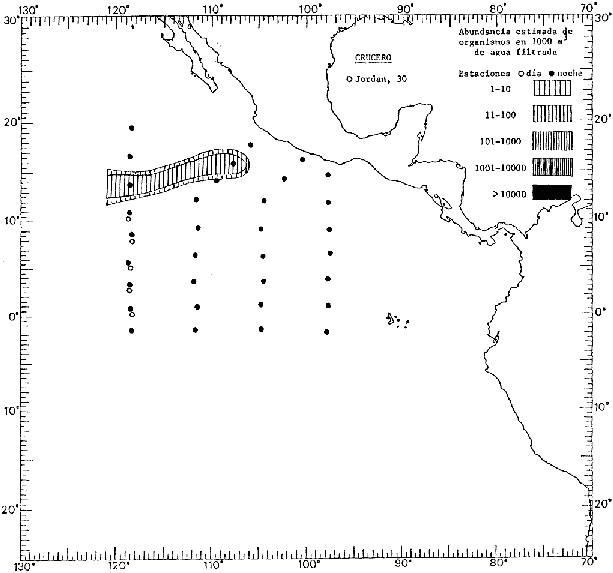 Fig. 21. Distribución general de Cunina octonaria McCrady, 1857, en el Pacífico Tropical Oriental durante el periodo bimestral (Junio-julio 1967). 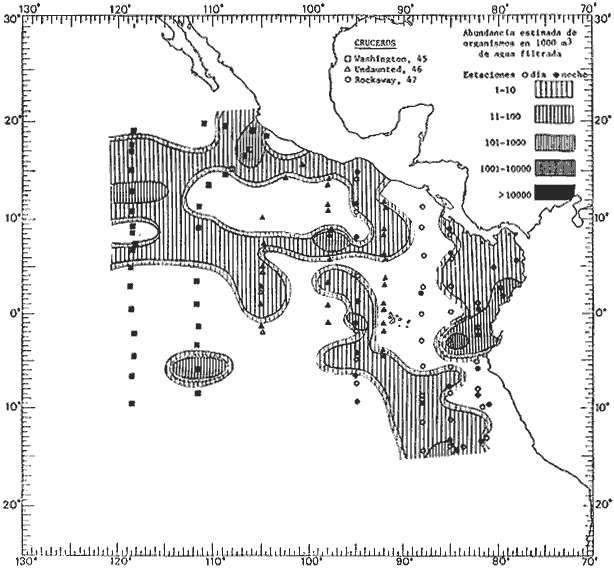 Fig. 22. Distribución general de Cunina octonaria McCrady, 1857, en el Pacífico Tropical Oriental durante el cuarto periodo bimestral (Agosto-Septiembre 1967). 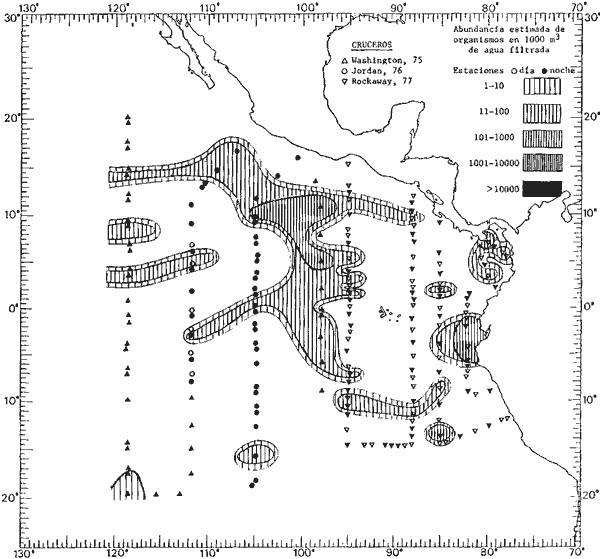 Fig. 23. Distribución general de Cunina octonaria McCrady, 1857, en el Pacífico Tropical Oriental durante el quinto periodo bimestral (Febrero-Marzo 1968). 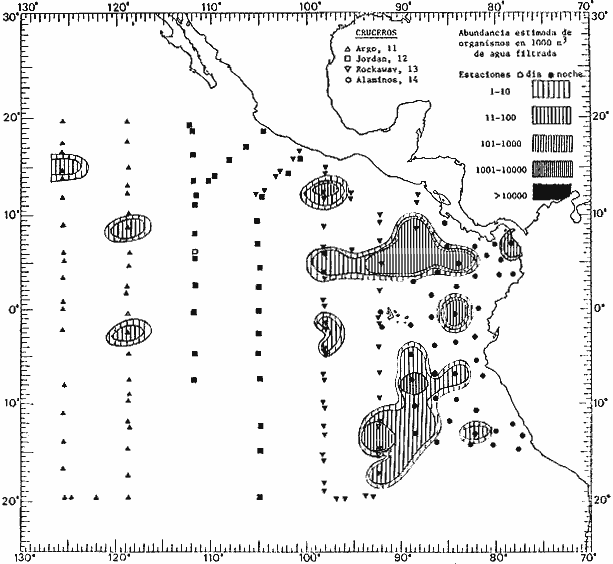 Fig. 24. Distribución general de Cunina Peregrina Bigelow, 1909, en el Pacífico Tropical Oriental durante el primer periodo bimestral (Febrero-Marzo 1967). 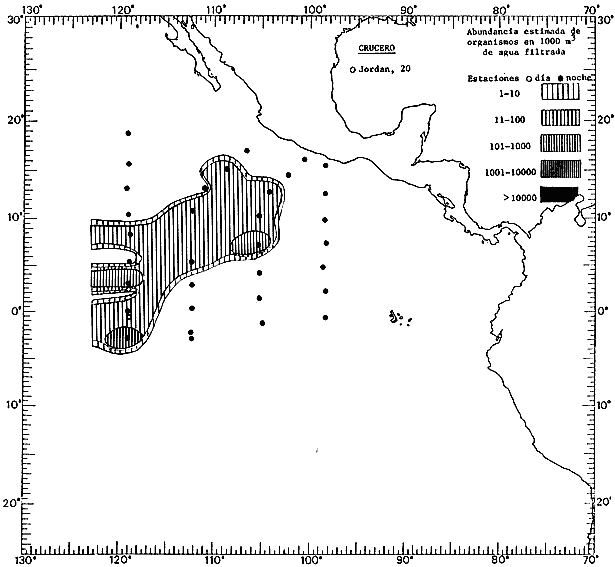 Fig. 25. Distribución general de Cunina peregrina Bigelow, 1909, en el Pacífico Tropical Oriental durante el segundo periodo bimestral (Abril-Mayo 1967). 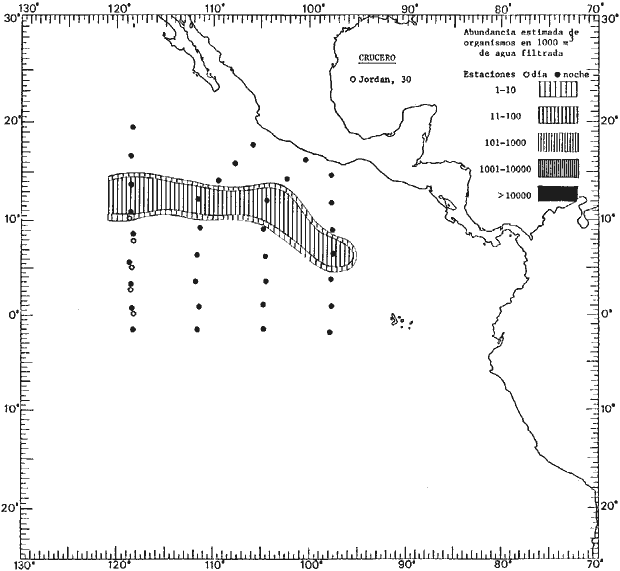 Fig. 26. Distribución general de Cunina peregrina Bigelow, 1909, en el Pacífico Tropical Oriental durante el tercer periodo bimestral (junio-julio 1967). 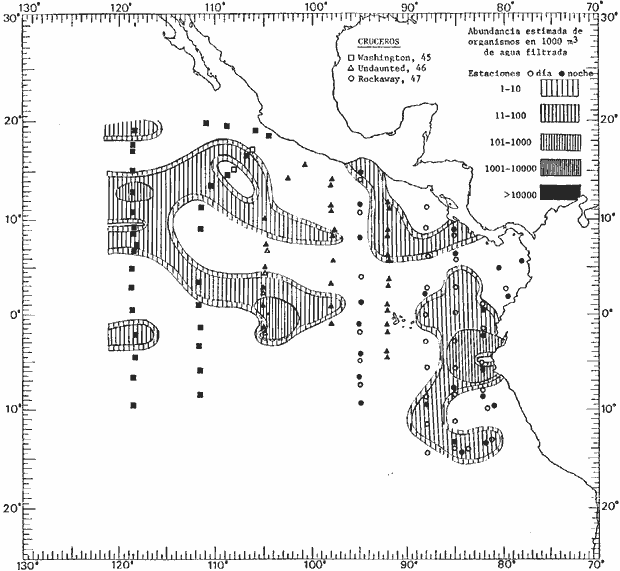 Fig. 27. Distribución general de Cunina peregrina Bigelow, 1909, en el Pacífico Tropical Oriental durante el cuarto periodo bimestral (Agosto -Septiembre 1967). 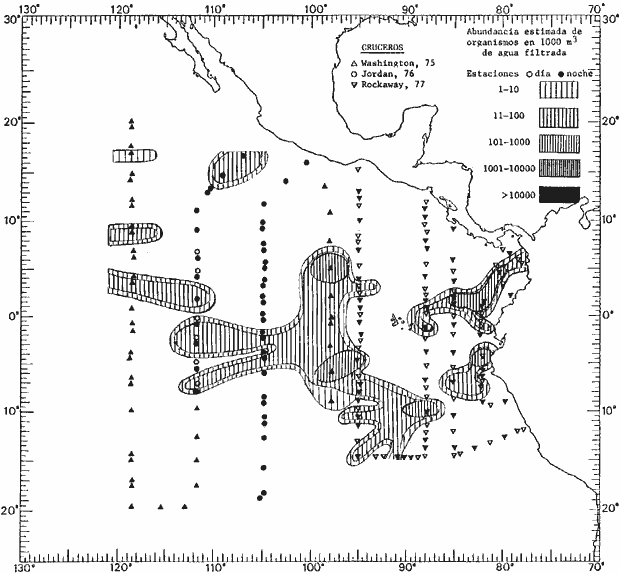 Fig. 28. Distribución general de Cunina peregrina Bigelow, 1909, en el Pacífico Tropical Oriental durante el quinto periodo bimestral (Febrero-Marzo 1968). 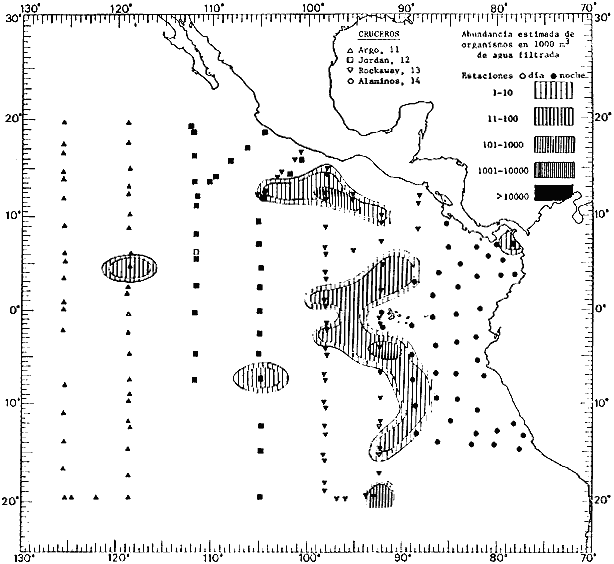 Fig. 29. Distribución general de Cunina tenella (Bigelow, 1909), en el Pacífico Tropical Oriental durante el primer periodo bimestral (Febrero-Marzo 1967). 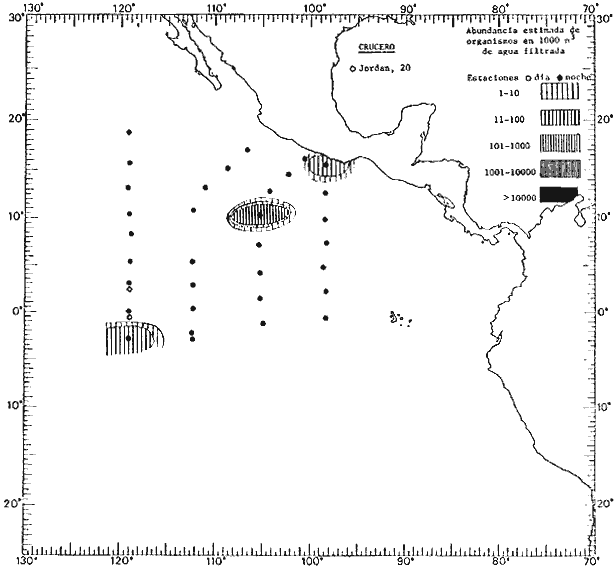 Fig. 30. Distribución general de Cunina tenella, (Bigelow, 1909), en el Pacífico Tropical Oriental durante el segundo periodo bimestral (Abril-Mayo, 1967). 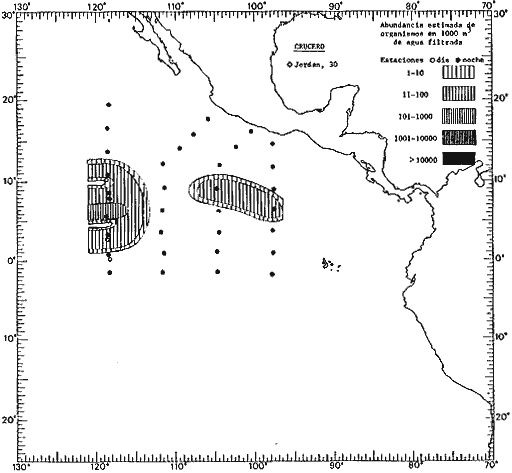 Fig. 31. Distribución general de Cunina tenella (Bigelow, 1909), en el Pacífico Tropical Oriental durante el tercer periodo bimestral (junio-julio 1967). 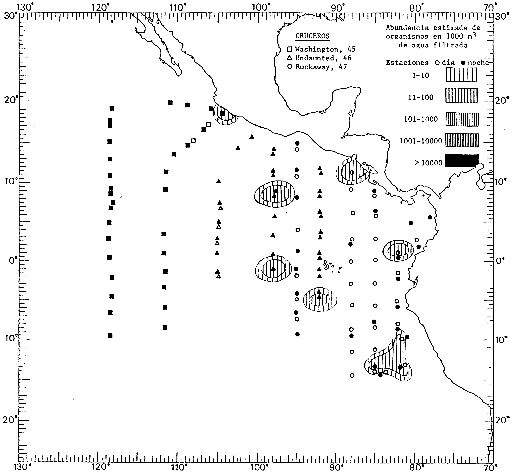 Fig. 32. Distribución general de Cunina tenella (Bigelow, 1909), en el Pacífico Tropical Oriental durante el cuarto periodo bimestral (Agosto-Septiembre 1967). 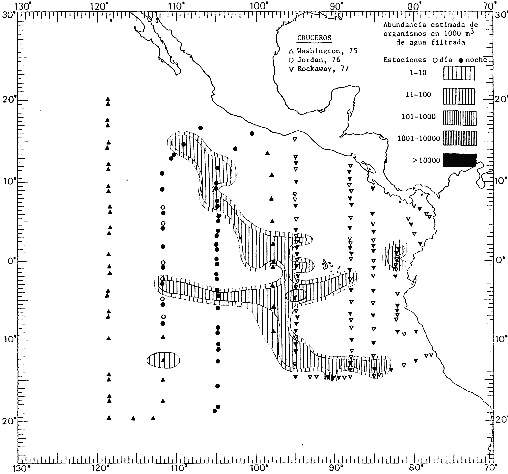 Fig. 33. Distribución general de Cunina tenella (Bigelow, 1909), en el Pacífico Tropical Oriental durante el quinto periodo bimestral (Febrero-Marzo 1968). 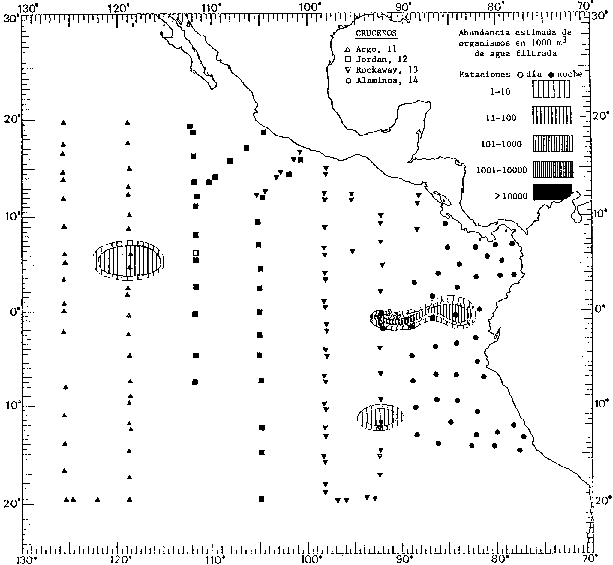 Fig. 34. Distribución general de Eucheilota comata (Bigelow, 1909), en el Pacífico Tropical Oriental durante el primer periodo bimestral (Febrero-Marzo 1967). 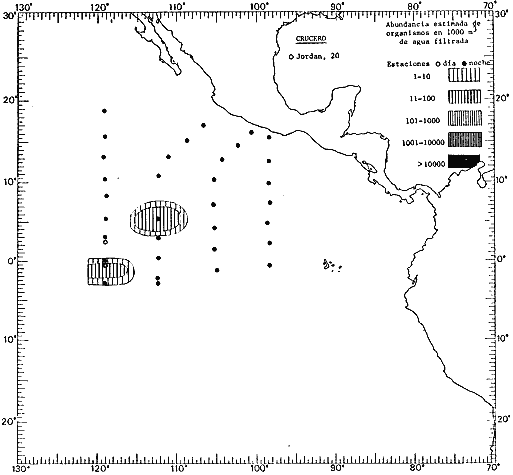 Fig. 35. Distribución general de Eucheilota comata (Bigelow, 1909), en el Pacífico Tropical Oriental durante el segundo periodo bimestral (Abril-Mayo 1967). 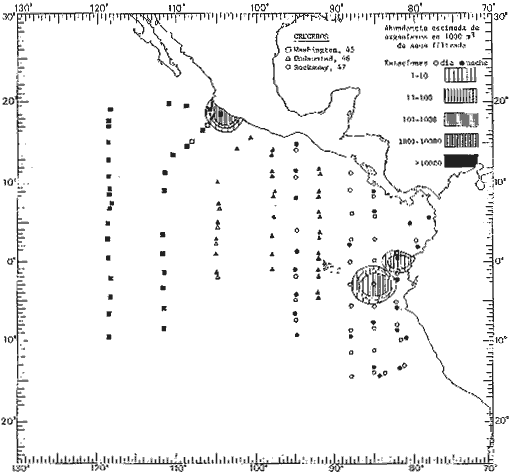 Fig. 36. Distribución general de Eucheilota comata (Bigelow, 1909), en el Pacífico Tropical Oriental durante el cuarto periodo bimestral (Agosto-Septiembre 1967).  Fig. 37. Distribución general de Eucheilota comata (Bigelow, 1909), en el Pacífico Tropical Oriental durante el quinto periodo bimestral (Febrero-Marzo 1968).  Fig. 38. Distribución general de Eucheilota menoni Kramp, 1959, en el Pacífico Tropical Oriental durante el primer periodo bimestral (Febrero-Marzo 1967). 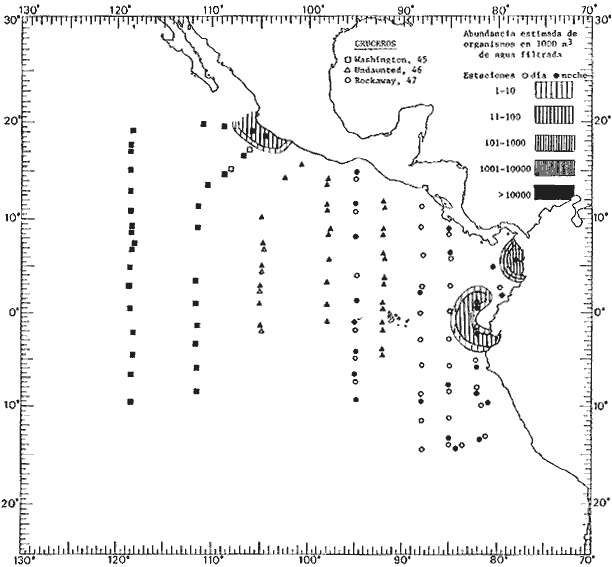 Fig. 39. Distribución general de Eucheilota menoni Kramp, 1959, en el Pacífico Tropical Oriental durante el cuarto periodo bimestral (Agosto-Septiembre 1967). 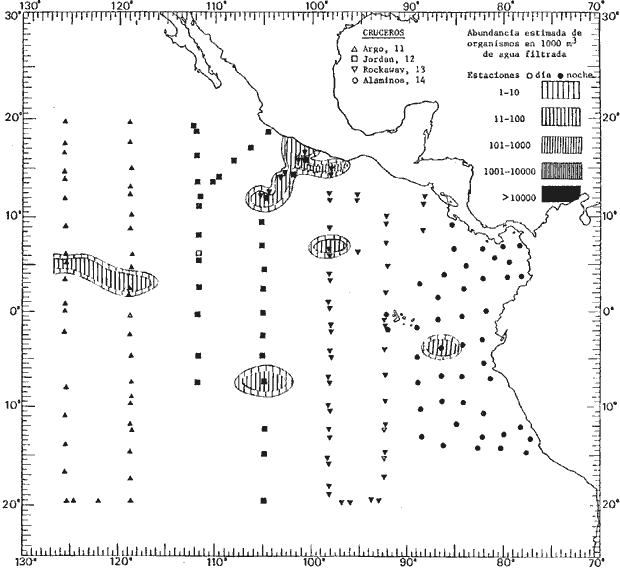 Fig. 40. Distribución general de Euphysilla pyramidata Kramp, 1955, en el Pacífico Tropical Oriental durante el primer periodo bimestral (Febrero-Marzo 1967). 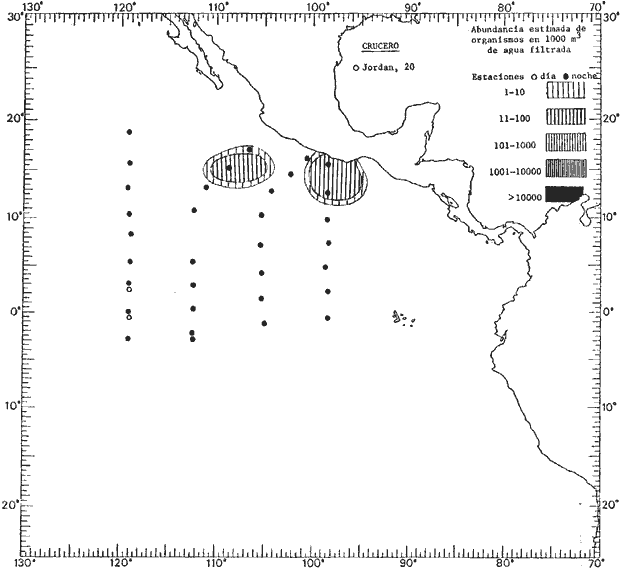 Fig. 41. Distribución general de Euphysilla pyramidata Krap, 1955, en el Pacífico Tropical Oriental durante el segundo periodo bimestral (Abril-Mayo 1967). 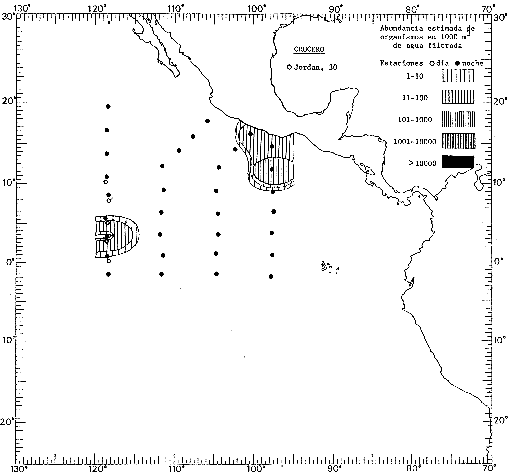 Fig. 42. Distribución general de Euphysilla pyramidata Kramp, 1955, en el Pacífico Tropical Oriental durante el tercer periodo bimestral (junio-julio 1967). 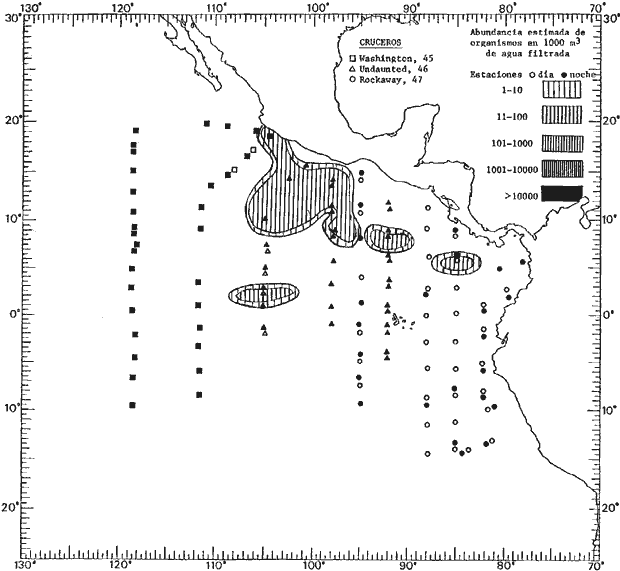 Fig. 43. Distribución general de Euphysilla pyramidata Kramp, 1955, en el Pacífico Tropical Oriental durante el cuarto periodo bimestral (Agosto-Septiembre 1967). 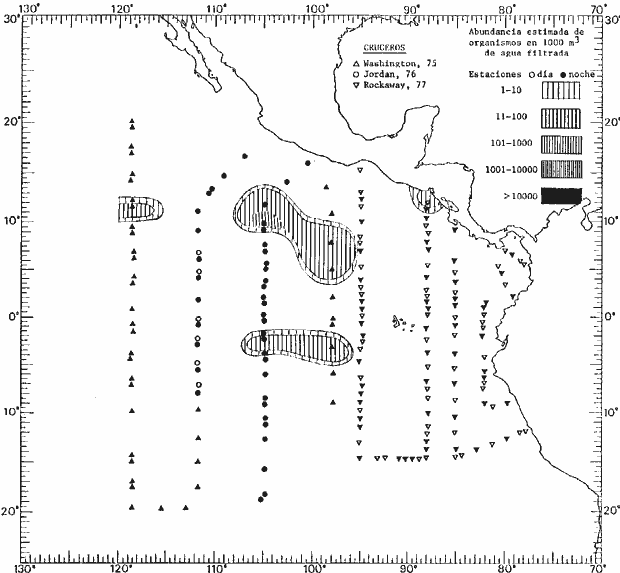 Fig. 44. Distribución general de Euphysilla pyramidata Kramp, 1955, en el Pacífico Tropical Oriental durante el quinto periodo bimestral (Febrero-Marzo 1968). 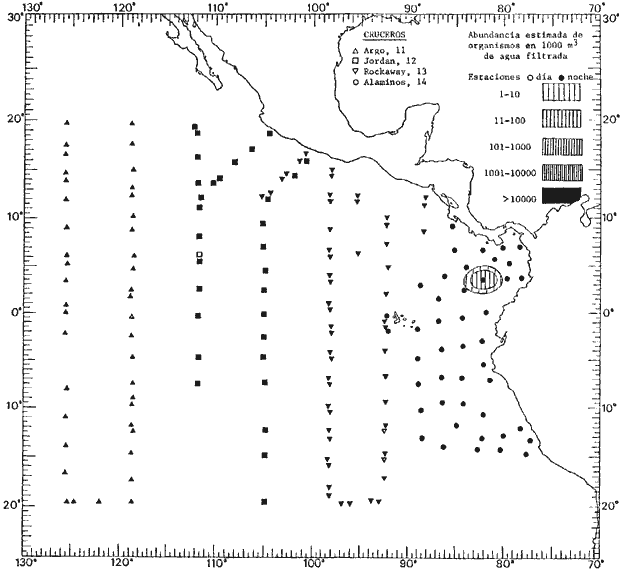 Fig. 45. Distribución general de Euphysora bigelowi Maas, 1905, en el Pacífico Tropical Oriental durante el primer periodo bimestral (Febrero-Marzo 1967). 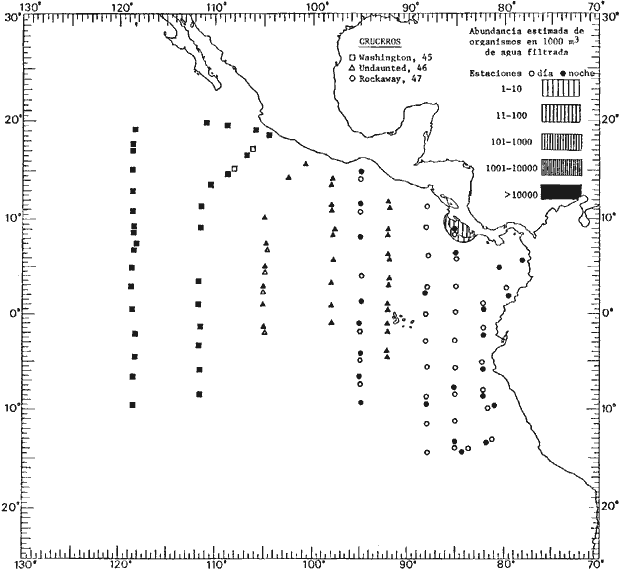 Fig. 46. Distribución general de Euphysora bigelowi Maas, 1995, en el Pacifíco Tropical Oriental durante el cuarto periodo bimestral (Agosto-septiembre 1967). 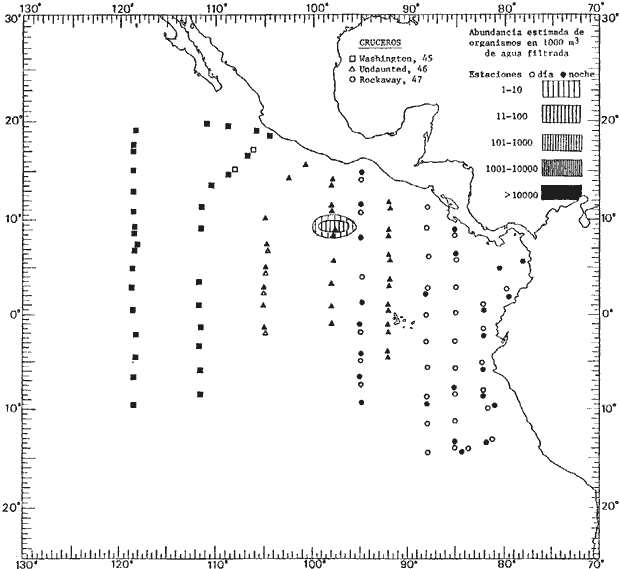 Fig. 47. Distribución general de Gotoea similis Kramp, 1959, en el Pacífico Tropical Oriental durante el cuarto periodo bimestral (Agosto -Septiembre 1967). 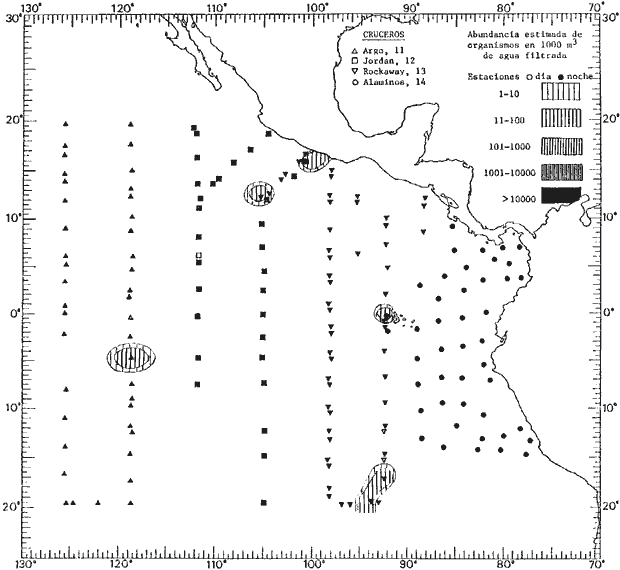 Fig. 48. Distribución general de Leuckartiara zacae Bigelow, 1940, en el Pacífico Torpical Oriental durante el primer periodo bimestral (Febrero-Marzo 1967). 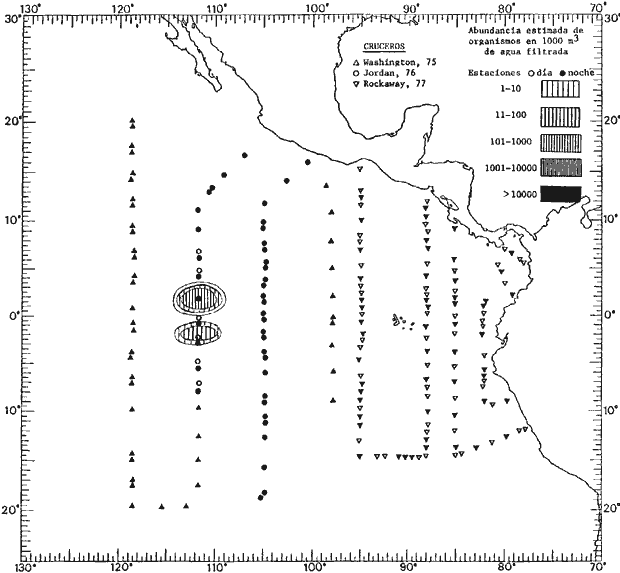 Fig. 49. Distribución general de Leuckartiara zacae Bigelow, 1940, en el Pacífico Tropical Oriental durante el quinto periodo bimestral (Febrero-Marzo 1968). 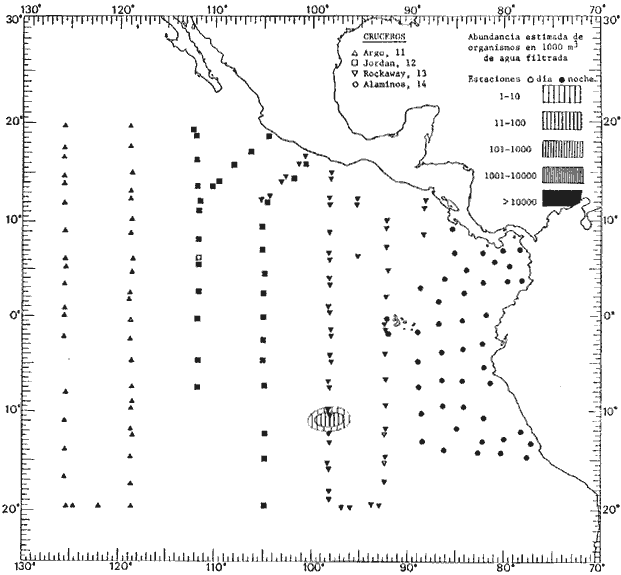 Fig. 50. Distribución general de Lizzia alvarinoae Segura, 1980, en el Pacífico Tropical Oriental durante el primer periodo bimestral (Febrero-Marzo 1967). 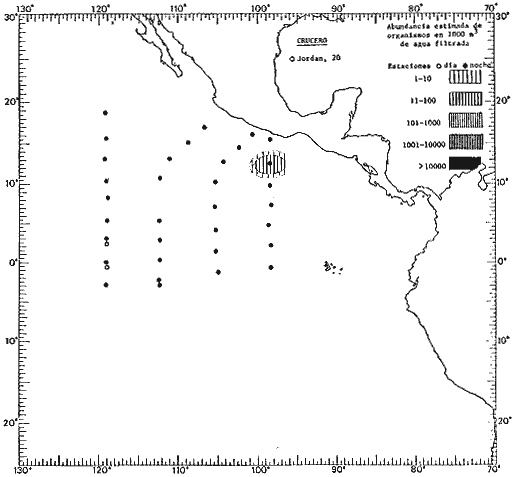 Fig. 51. Distribución general de Lizzia alvarinoae Segura, 1980, en el Pacífico Tropical Oriental durante el segundo periodo bimestral (Abril-Mayo 1967). 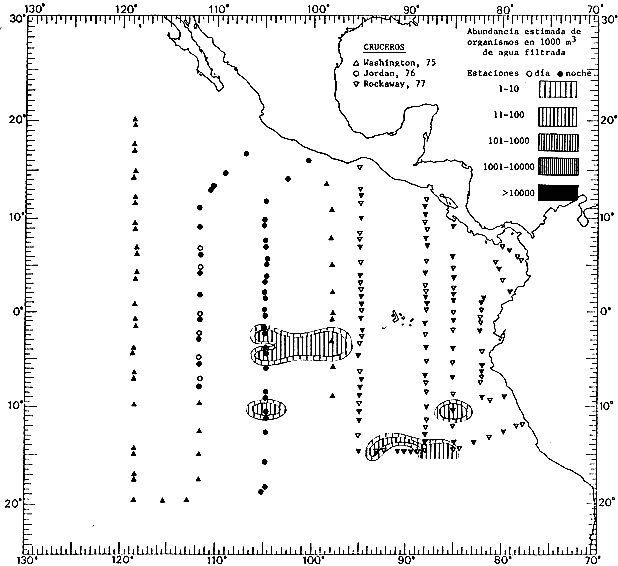 Fig. 52. Distribución general de Lizzia alvarinoae Segura, 1980, en el Pacífico Tropical Oriental durante el quinto periodo bimestral (Febrero-Marzo 1968). 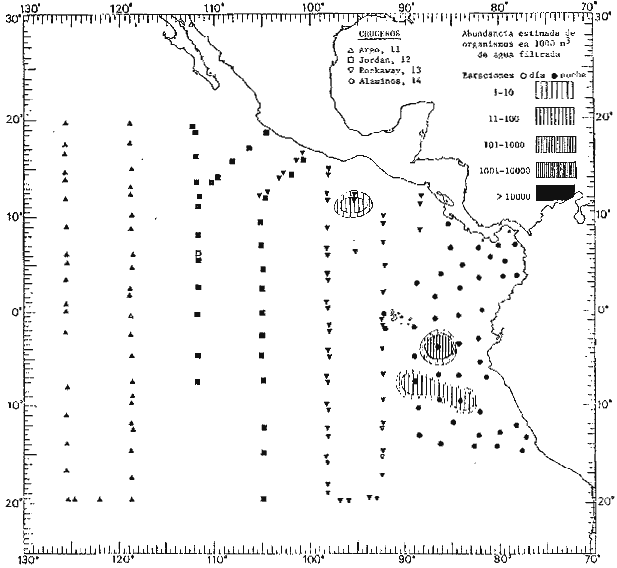 Fig. 53. Distribución general de Lizzia ferrarii Segura, 1980, en el Pacífico Tropical Oriental durante el primer periodo bimestral (Febrero-Marzo 1967). 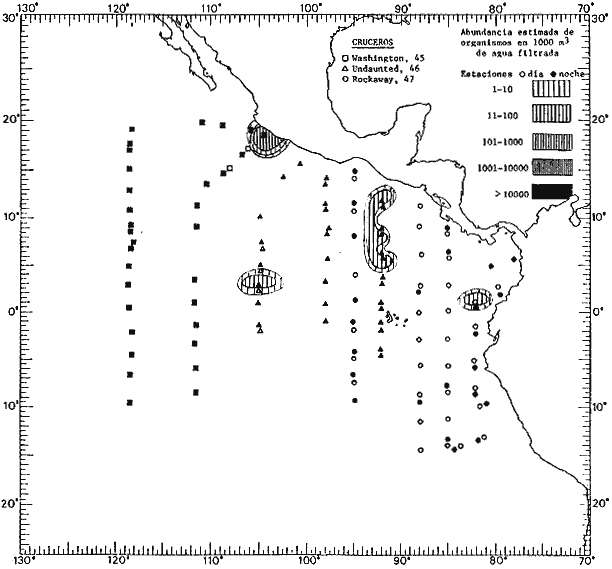 Fig. 54. Distribución general de Lizzia ferrarii Segura, 1980, en el Pacífico Tropical Oriental durante el cuarto periodo bimestral (Agosto-Septiembre 1967). 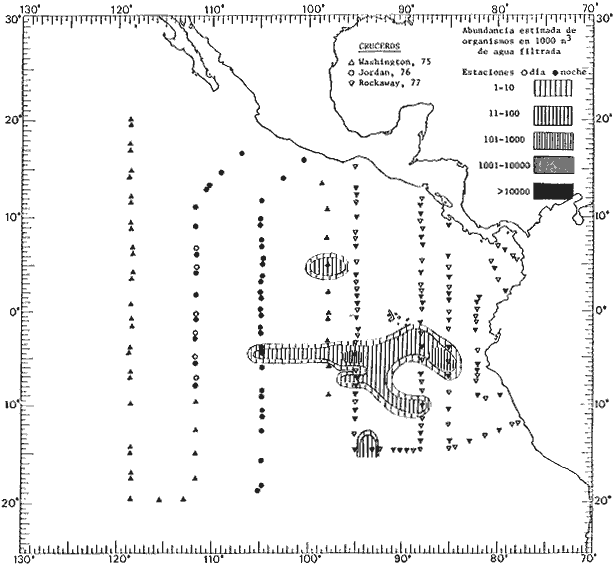 Fig. 55. Distribución general de Lizzia ferrarii Segura, 1980, en el Pacífico Tropical Oriental durante el quinto periodo bimestral (Febrero-Marzo 1968). 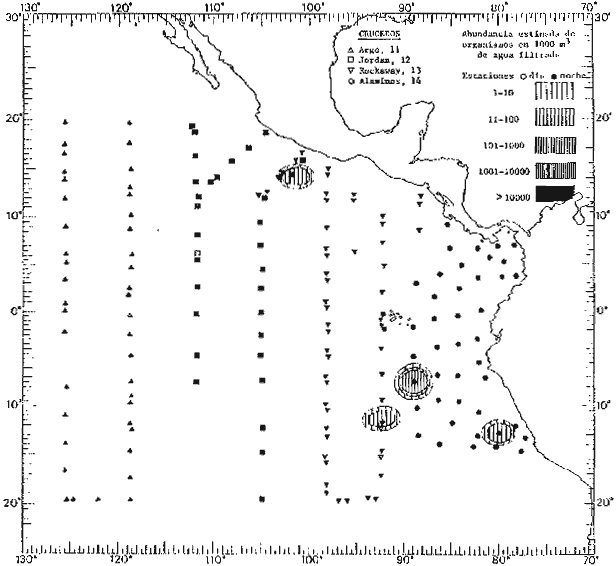 Fig. 56. Distribución general de Lizzia gracilis (Mayer, 1910), en el Pacífico Tropical Oriental durante el primer periodo bimestral (Febrero-Marzo 1967). 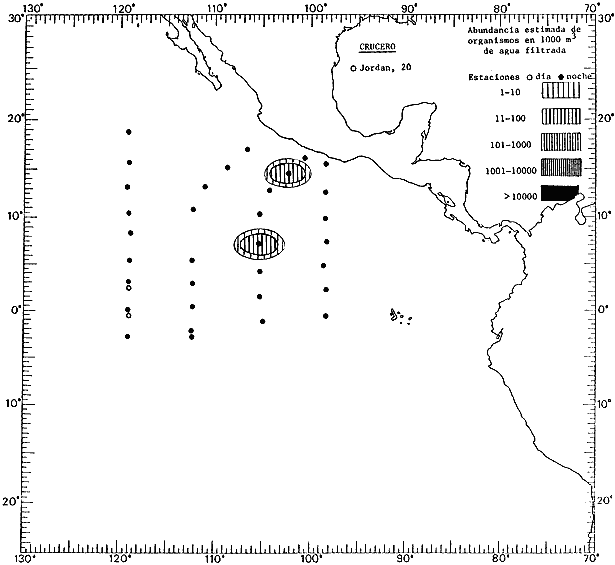 Fig. 57. Distribución general de Lizzia gracilis (Mayer, 1910), en el Pacífico Tropical Oriental durante el segundo periodo bimestral (Abril-Mayo 1967). 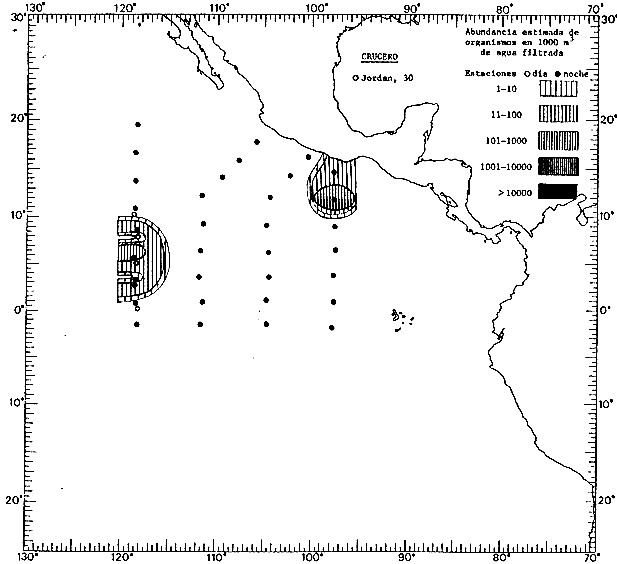 Fig. 58. Distribución general de Lizzia gracilis (Mayer, 1910), en el Pacífico Tropical Oriental durante el tercer periodo bimestral (junio-julio 1967). 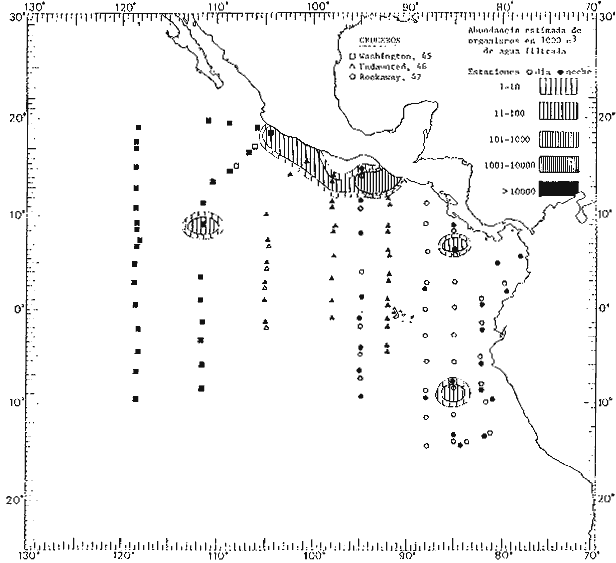 Fig. 59. Distribución general de Lizzia gracilis (Mayer, 1910), en el Pacífico Tropical Oriental durante el cuarto periodo bimestral (Agosto -Septiembre 1967). 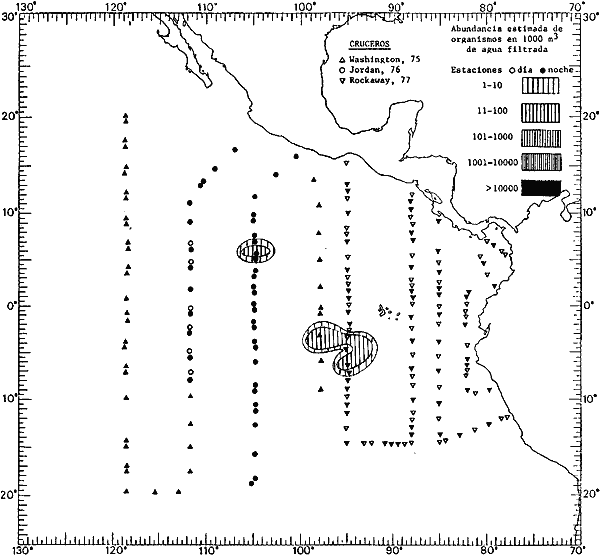 Fig. 60. Distribución general de Lizzia gracilis (Mayer, 1910), en el Pacífico Tropical Oriental durante el quinto periodo bimestral (Febrero-Marzo 1968). 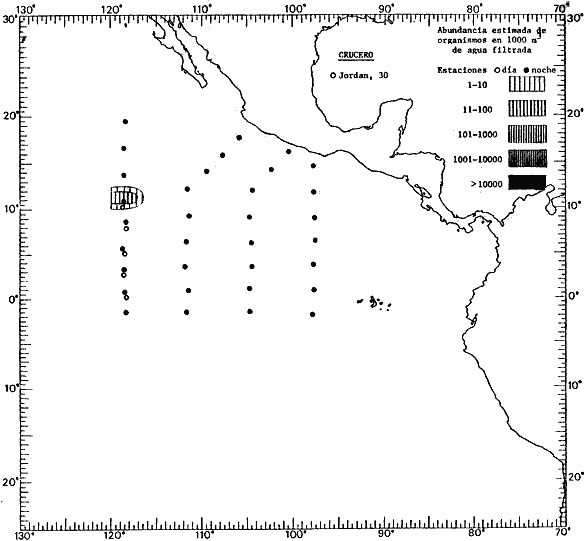 Fig. 61. Distribución general de Nausithoë albatrossi (Maas, 1897), en el Pacífico Tropical Oriental durante el tercer periodo bimestral (Junio-julio 1967). 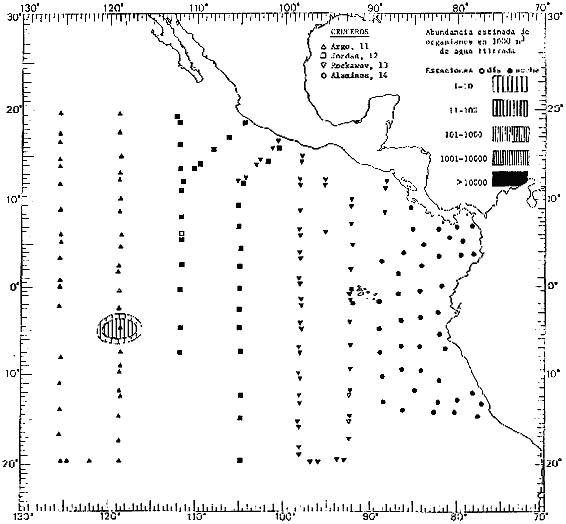 Fig. 62. Distribución general de Octophialucium bigelowi Kramp, 1955, en el Pacífico Tropical Oriental durante el primer periodo bimestral (Febrero-Marzo 1967). 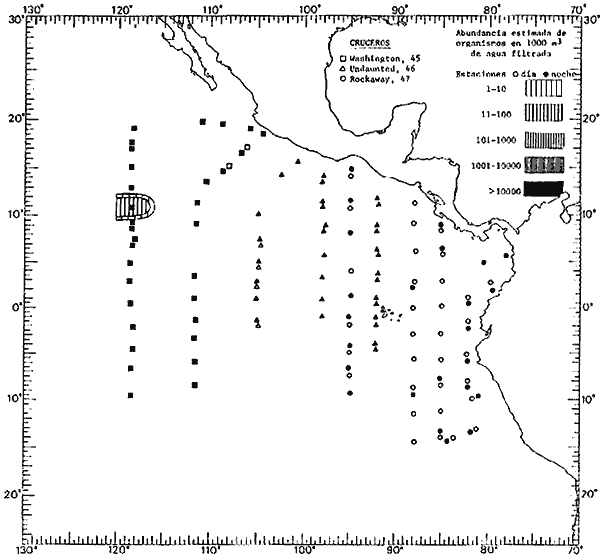 Fig. 63. Distribución general de Octophialucium bigelow Kramp, 1955, en el Pacífico Tropical Oriental durante el cuarto periodo bimestral (Agosto-Septiembre 1967). 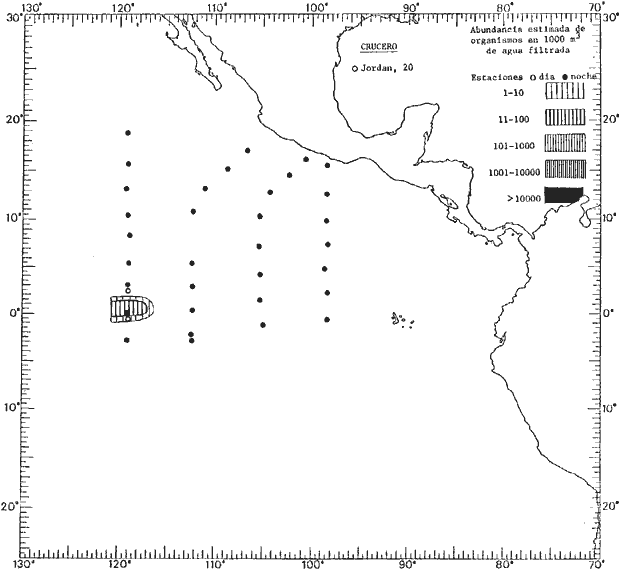 Fig. 64. Distribución general de Phialidium simplex Browne, 1902, en el Pacífico Tropical Oriental durante el segundo periodo bimestral (Abril-Mayo 1967 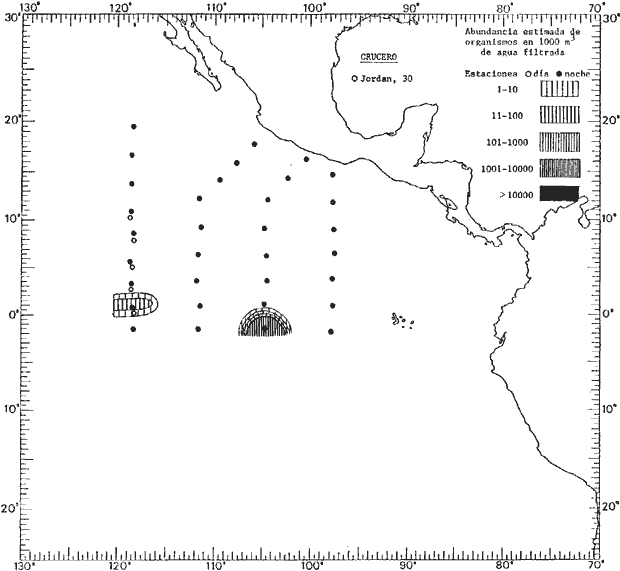 Fig. 65. Distribución general de Phialidium simplex Browne, 1902, en el Pacífico Tropical Oriental durante el tercer periodo bimestral (Junio-julio 1967).  Fig. 66. Distribución general de Phialidium simplex Browne, 1902, en el Pacífico Tropical Oriental durante el cuarto periodo bimestral (Agosto-Septiembre 1967).  Fig. 67. Distribución general de Phialidium simplex Browne, 1902, en el Pacífico Tropical Oriental durante el quinto periodo bimestral (Febrero-Marzo 1968).  Fig. 68. Distribución general de Phialidium uchidai Kramp, 1961, en el Pacífico Tropical Oriental durante el primer periodo bimestral (Febrero-Marzo 1967).  Fig. 69. Distribución general de Phialidium uchidai Kramp, 1961, en el Pacífico Tropical Oriental durante el cuarto periodo bimestral (Agosto-Septiembre 1967). 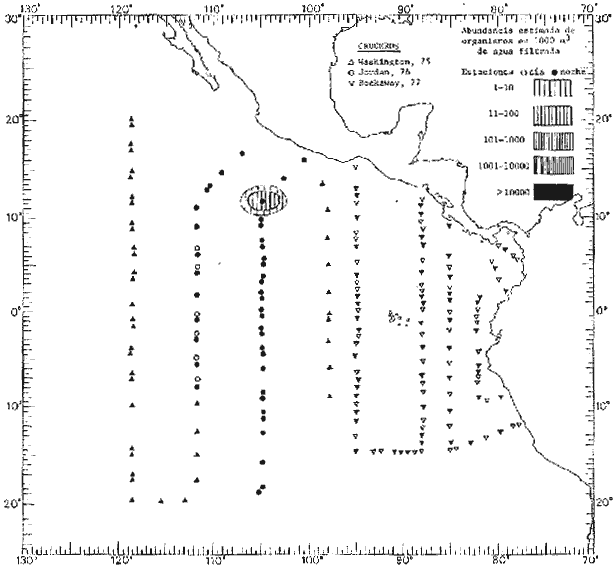 Fig. 70. Distribución general de Phialidium uchidai Kramp, 1961, en el Pacífico Tropical Oriental durante el quinto periodo bimestral (Febrero-Marzo 1968). 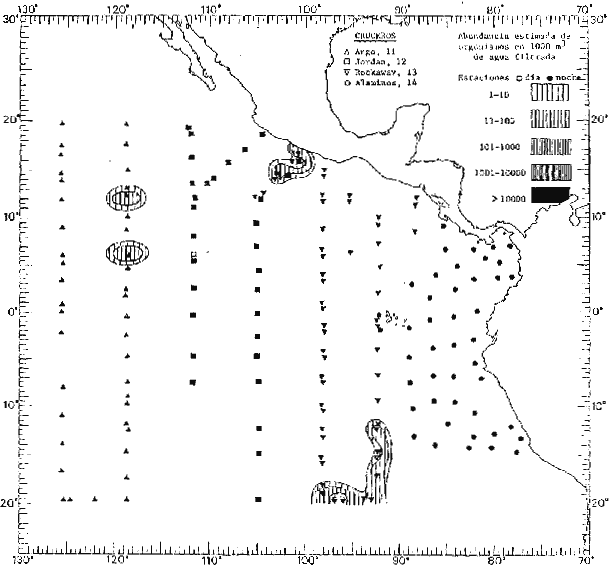 Fig. 71. Distribución general de Podocoryne apicata Kramp, 1959, en el Pacífico Tropical Oriental durante el primer periodo bimestral (Febrero-Marzo 1967). 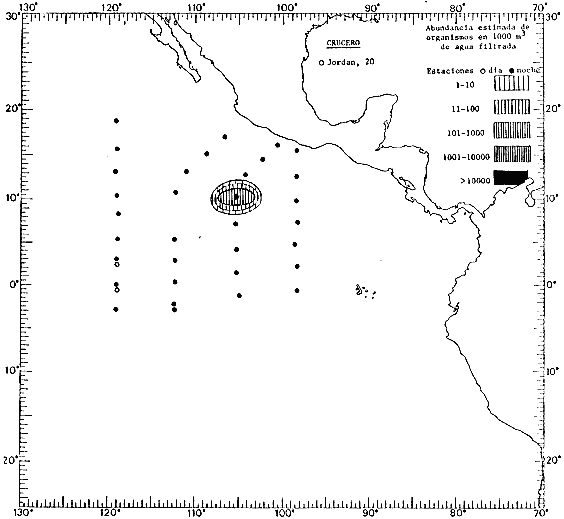 Fig. 72. Distribución general de Podocoryne apicata Kramp, 1959, en el Pacífico Tropical Oriental durante el segundo periodo bimestral (Abril-Mayo 1967). 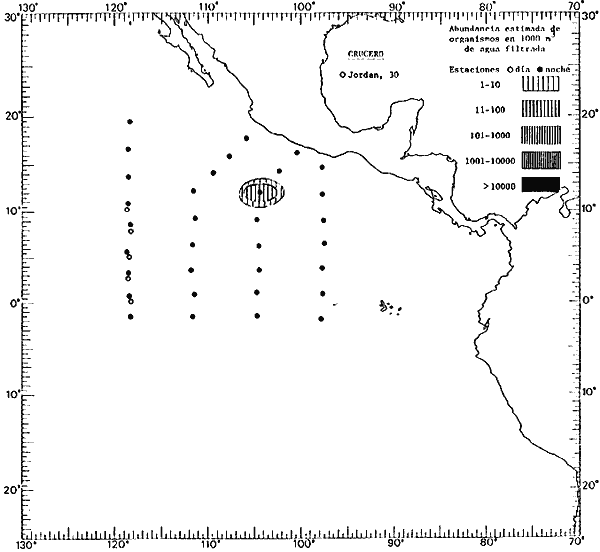 Fig. 73. Distribución general de Podocoryne apicata Kramp, 1959, en el Pacífico Tropical Oriental durante el tercer Periodo bimestral (junio-julio 1967). 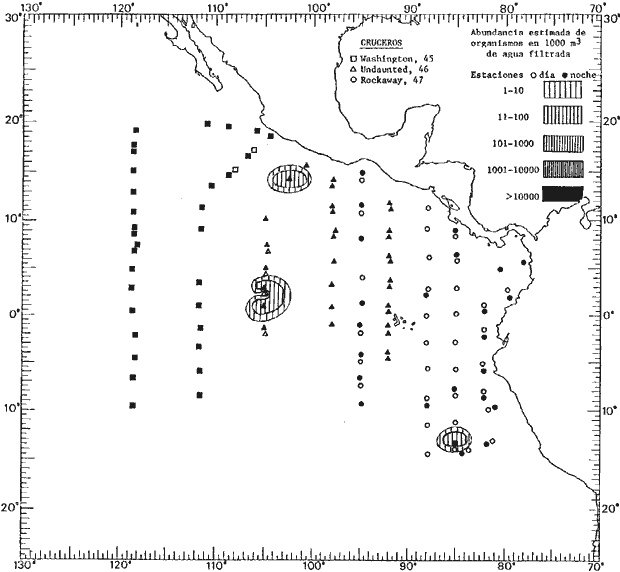 Fig. 74. Distribución general de Podocoryne apicata Kramp, 1959, en el Pacífico Tropical Oriental durante el cuarto periodo bimestral (Agosto-Septiembre 1967). 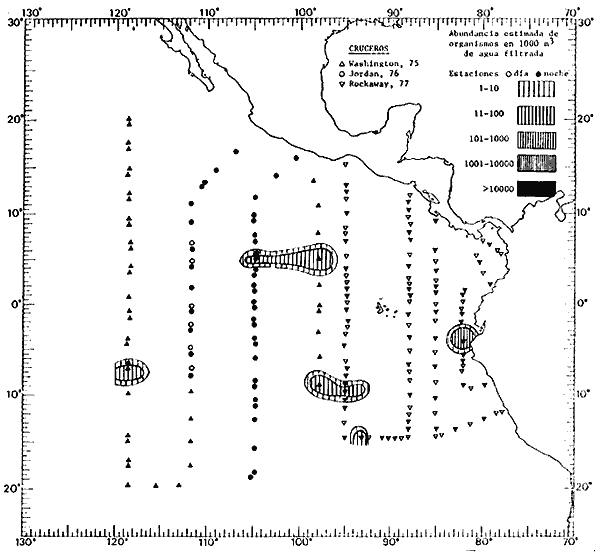 Fig. 75. Distribución general de Podocoryne apicata Kramp, 1959, en el Pacífico Tropical Oriental durante el quinto periodo bimestral (Febrero-Marzo 1968). 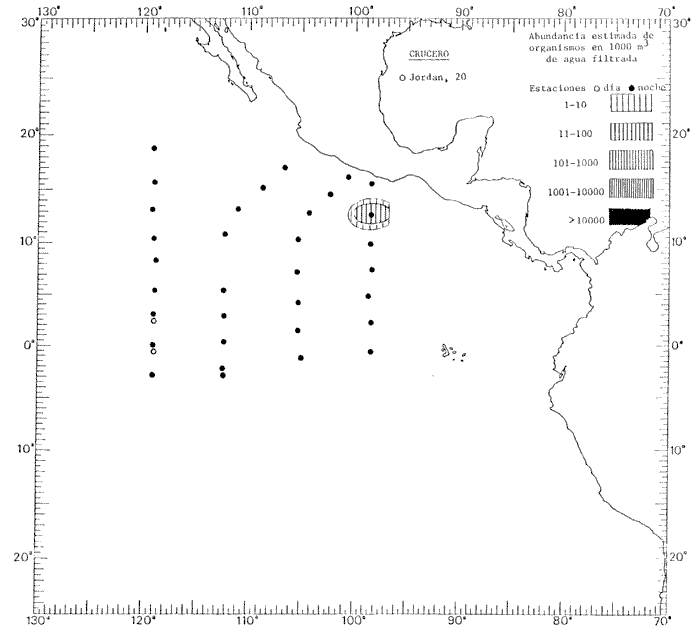 Fig. 76. Distribuciín general de Podocoryne minina (Trinci, 1903), en el Pacífico Tropical Oriental durante el segundo periodo bimestral (Abril-Mayo 1967). 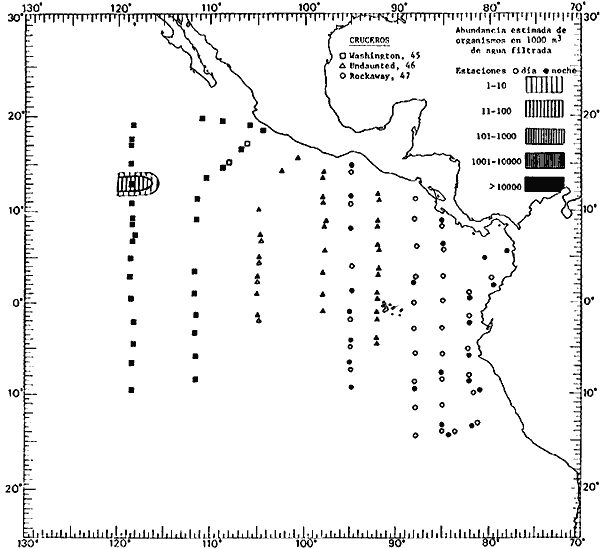 Fig. 77. Distribución general de Podocoryne minima (Trinci, 1903), en el Pacífico Tropical Oriental durante el cuarto periodo bimestral (Agosto-Septiembre 1967). 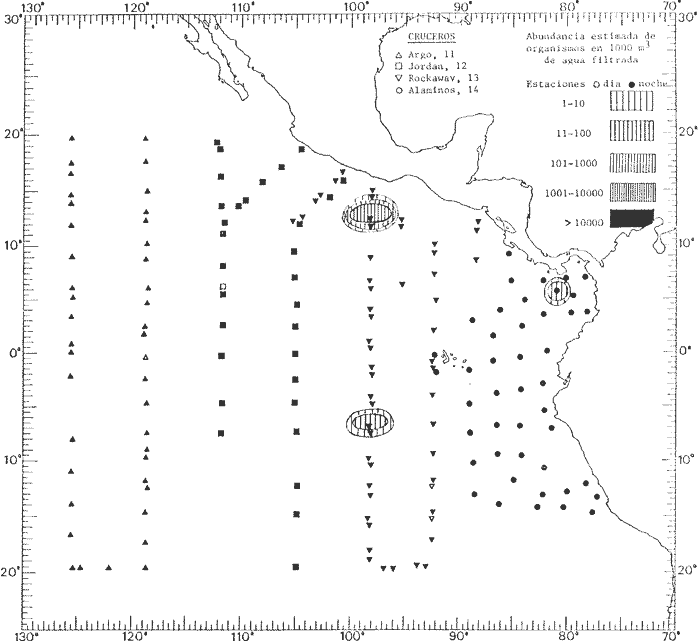 Fig. 78. Distribución general de Podocoryne simplex Kramp, 1928, en el Pacífico Tropical Oriental durante el primer periodo bimestral (Febrero-Marzo 1967). 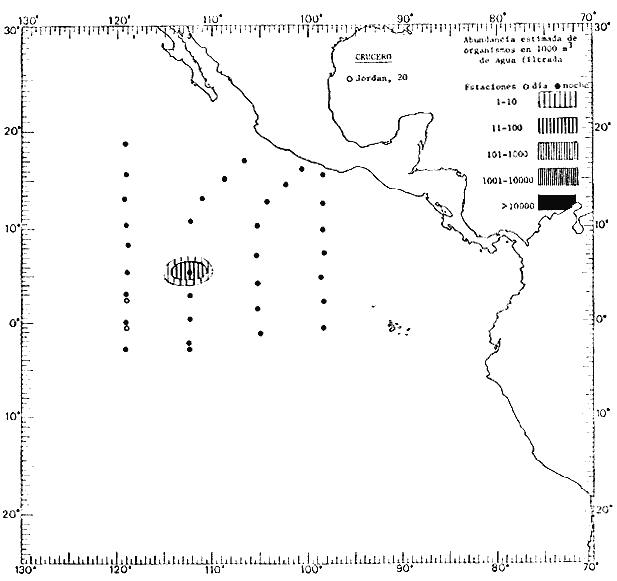 Fig. 79. Distribución general de Podocoryne simplex Kramp, 1928, en el Pacífico Tropical Oriental durante el segundo periodo bimestral (Abril-Mayo 1967). 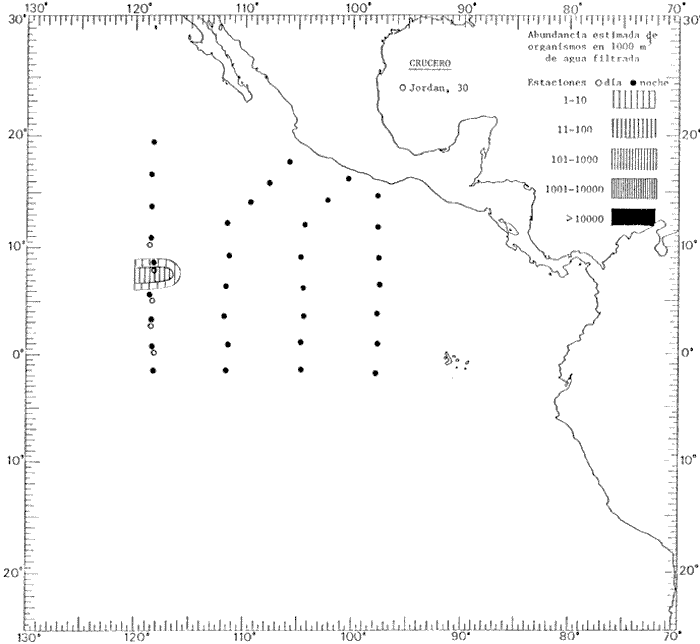 Fig. 80. Distribución general de Podocoryne simplex Kramp, 1928 en el Pacífico Tropical Oriental durante el tercer periodo bimestral (junio-julio 1967). 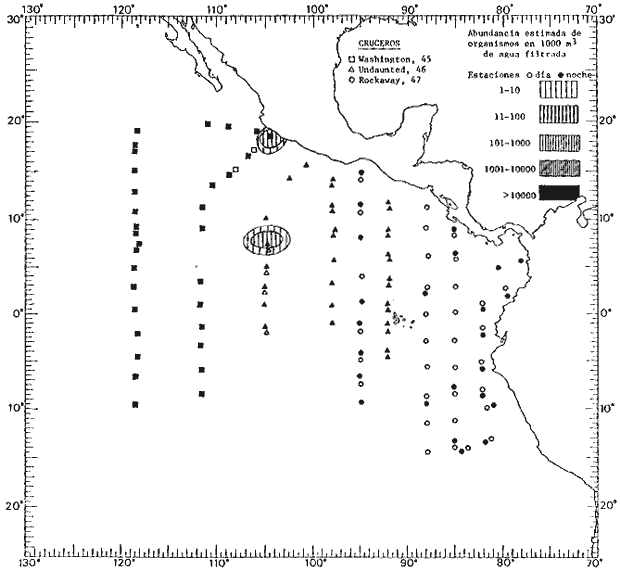 Fig. 81. Distribución general de Podocoryne simplex Kramp, 1928, en el Pacífico Tropical Oriental durante el cuarto periodo bimestral (Agosto-Septiembre 1967). 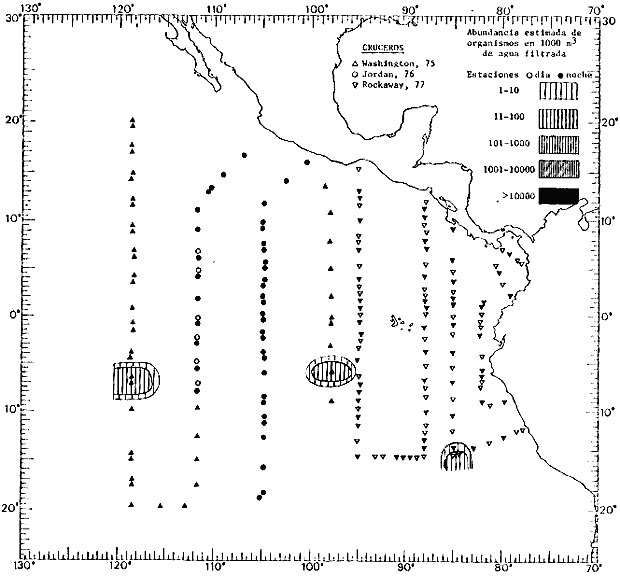 Fig. 82. Distribución general de Podocoryne simplex Kramp, 1928, en el Pacífico Tropical Oriental durante el quinto periodo bimestral (Febrero-Marzo 1968). 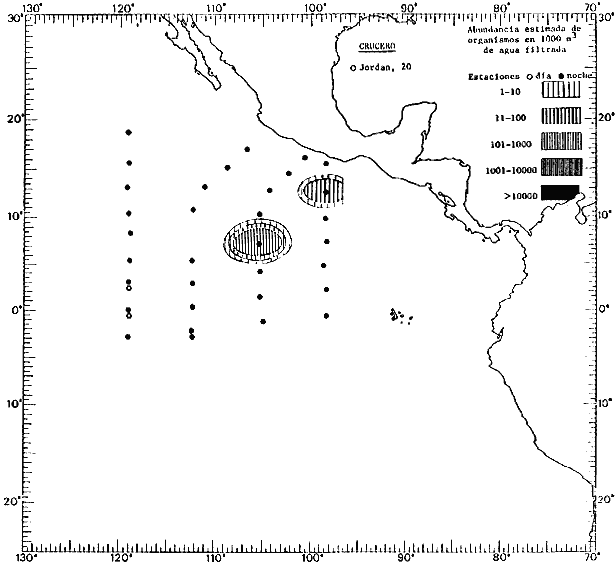 Fig. 83. Distribución general de Proboscidactyla ornata (McCrady, 1857), en el Pacffico Tropical Oriental durante el segundo periodo bimestral (Abril-Mayo 1967). 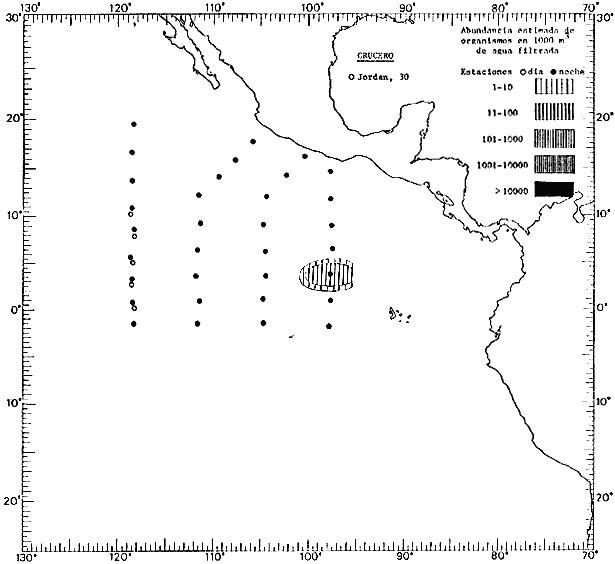 Fig. 84. Distribución general de Proboscidactyla ornata (McCrady, 1857), en el Pacífico Tropical Oriental durante el tercer periodo bimestral (junio-julio 1967). 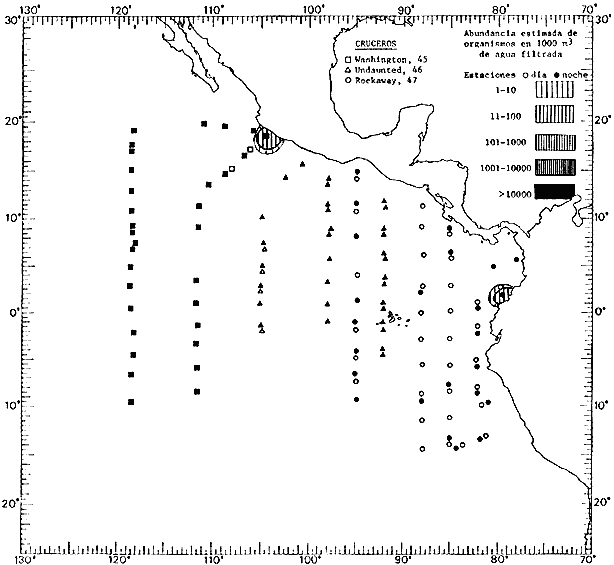 Fig. 85 Distribución general de Proboscidactyla ornata (Mc crady, 1857), en el Pacífico Tropical Oriental durante el cuarto periodo bimestral (Abril-Mayo 1967). 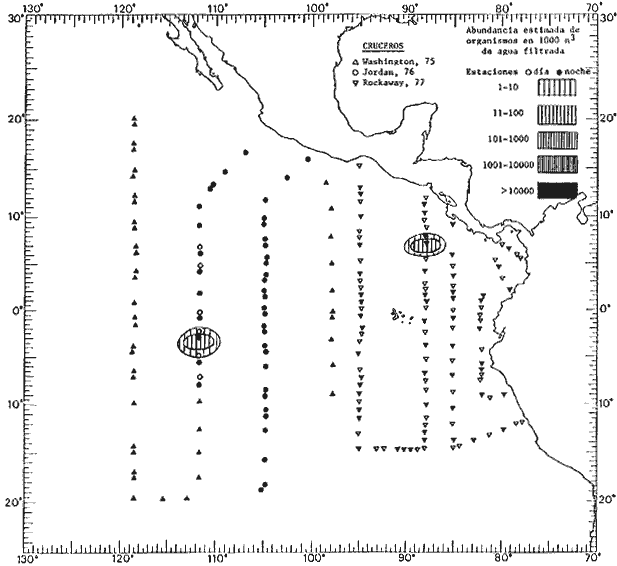 Fig. 86. Distribución general de Proboscidactyla ornata (McCrady, 1857), en el Pacífico Tropical Oriental durante el quinto periodo bimestral (Febrero-Marzo 1968). 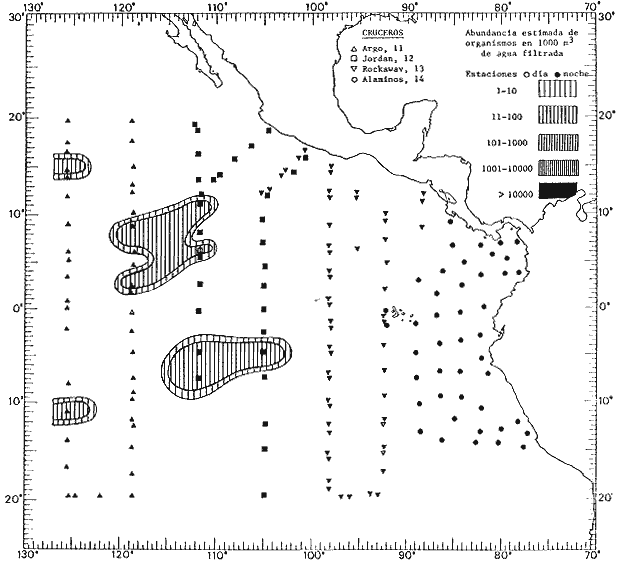 Fig. 87. Distribución general de Rhopalonema funerarium Vanhöffen, 1902, en el Pacífico Tropical Oriental durante el primer periodo bimestral (Febrero-Marzo 1967). 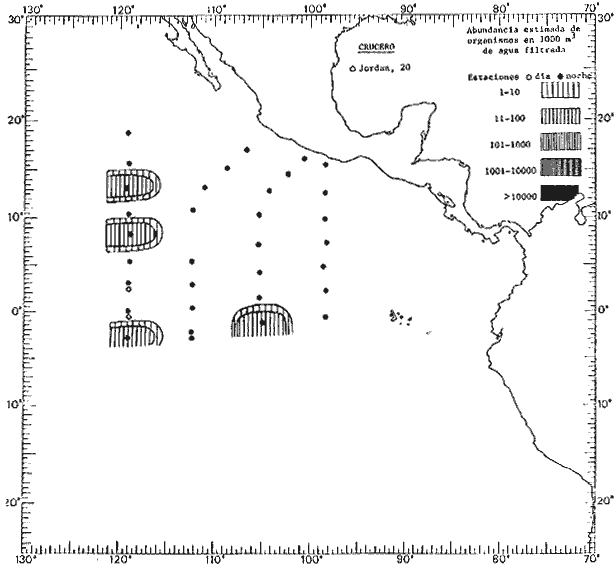 Fig. 88. Distribución general de Rhopalonema funerarium Vanhöffen, 1902, en el Pacífico Tropical Oriental durante el segundo periodo bimestral (Abril-Mayo 1967). 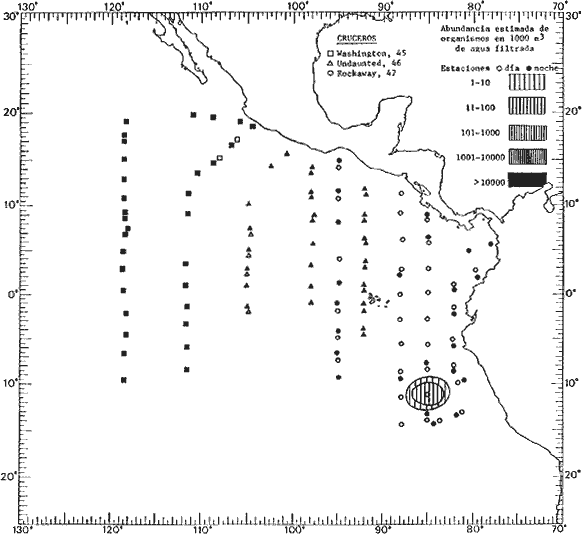 Fig. 89. Distribución general de Rhopalonema funerarium Vanhöffen, 1902, en el Pacífico Tropical Oriental durante el cuarto periodo bimestral (Agosto-Septiembre 1967). 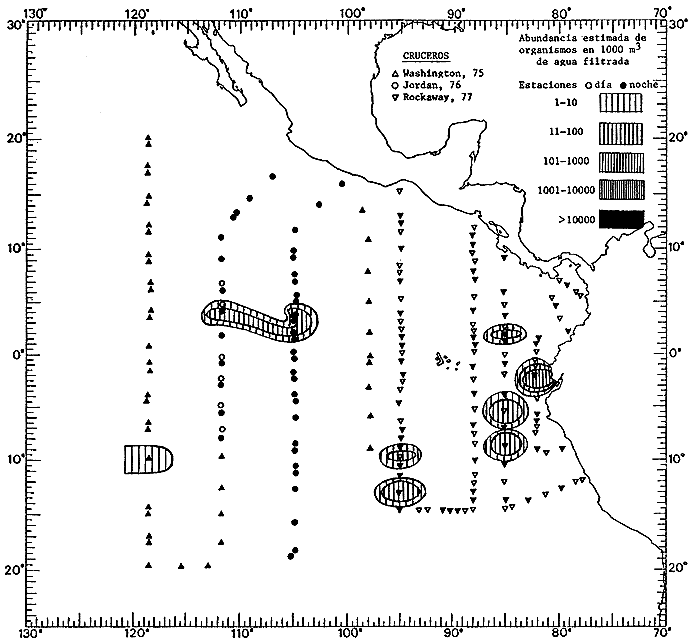 Fig. 90. Distribución general de Rhopalonema funerarium Vanhöffen, 1902, en el Pacífico Tropical Oriental durante el quinto periodo bimestral (Febrero-Marzo 1968). 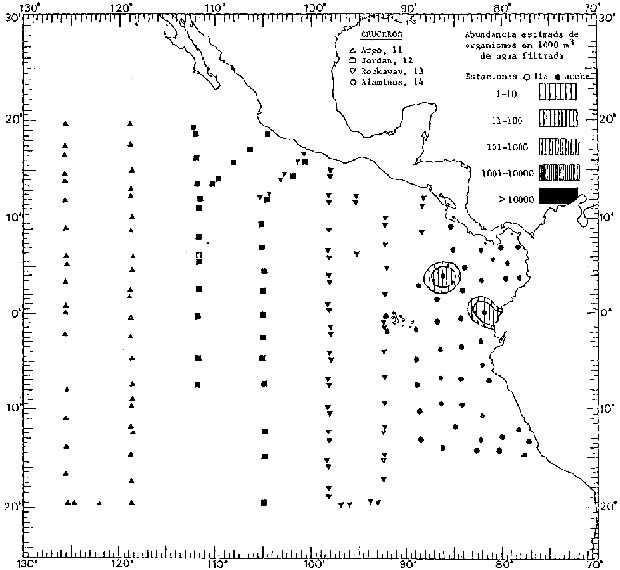 Fig. 91. Distribución general de Sarsia coccometra Bigelow, 1939, en el Pacífico Tropical Oriental durante el primer periodo bimestral (Febrero-Marzo 1967). 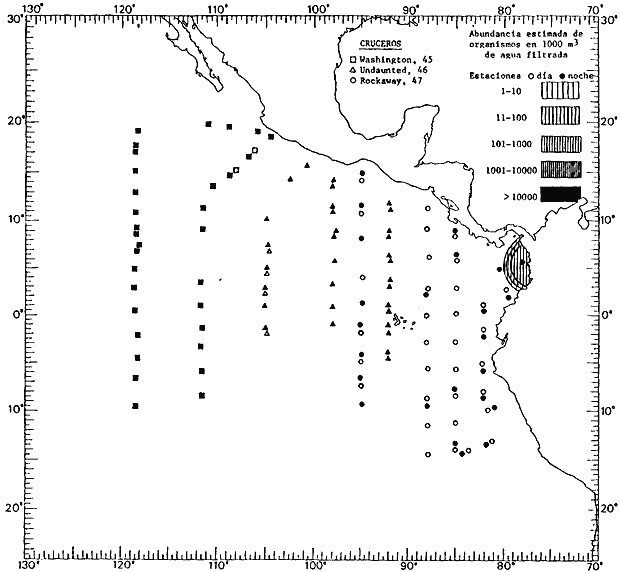 Fig. 92. Distribución general de Sarsia coccometra Bigelow, 1909, en el Pacífico Tropical Oriental durante el cuarto periodo bimestral (Agosto-Septiembre 1967).  Fig. 93. Distribución general de Sarsia coccometra Bigelow, 1909, en el Pacífico Tropical Oriental durante el quinto periodo bimestral (Febrero-Marzo 1968). 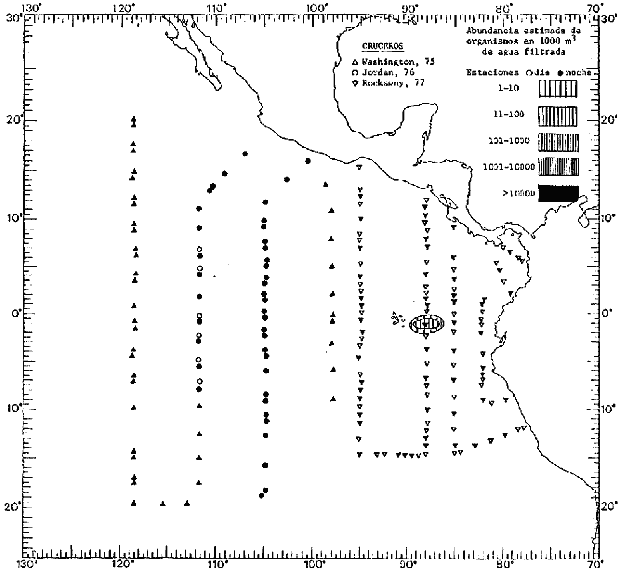 Fig. 94. Distribución general de Stomotoca Pterophylla Haeckel, 1879, en el Pacífico Tropical Oriental durante el quinto periodo bimestral (Febrero-Marzo 1968). 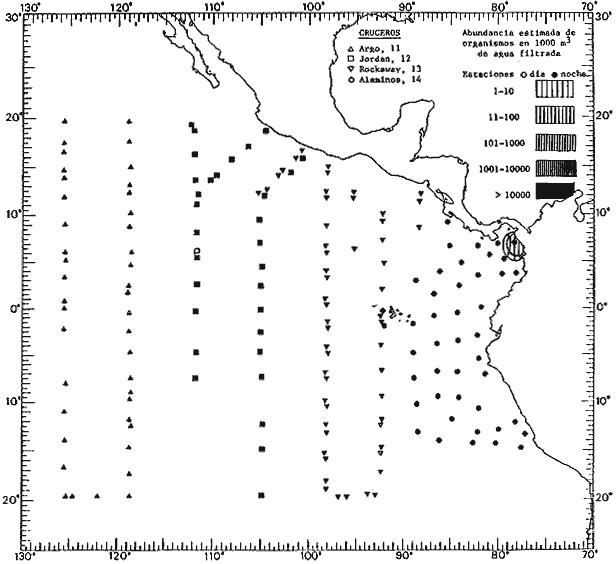 Fig. 95. Distribución general de Tetrorchis erytrogaster Bigelow, 1909, en el Pacífico Tropical Oriental durante el primer periodo bimestral (Febrero-Marzo 1967). 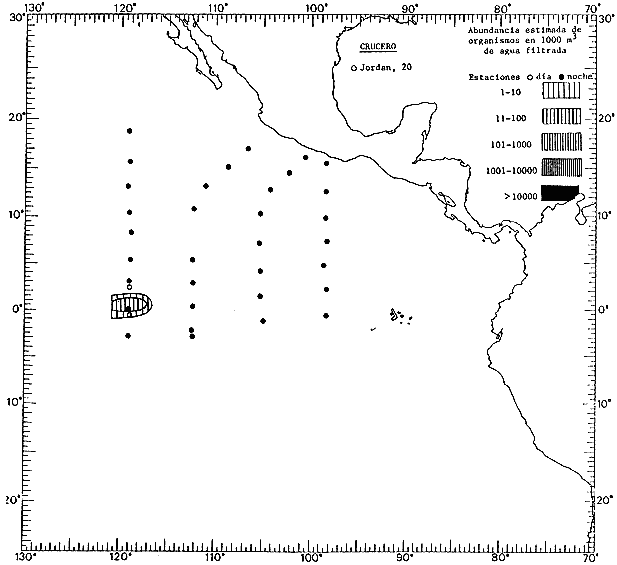 Fig. 96. Distribución general de Toxorchis polynema Kramp, 1959, en el Pacífico Tropical Oriental durante el segundo periodo bimestral (Abril-Mayo 1967). 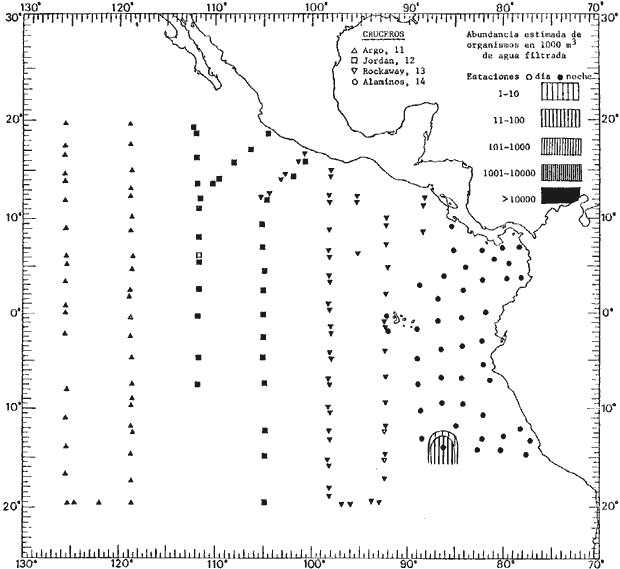 Fig. 97. Distribución general de Aeginura beebei Bigelow, 1910, en el Pacífico Tropical Oriental durante el primer periodo bimestral (Febrero-Marzo 1967). 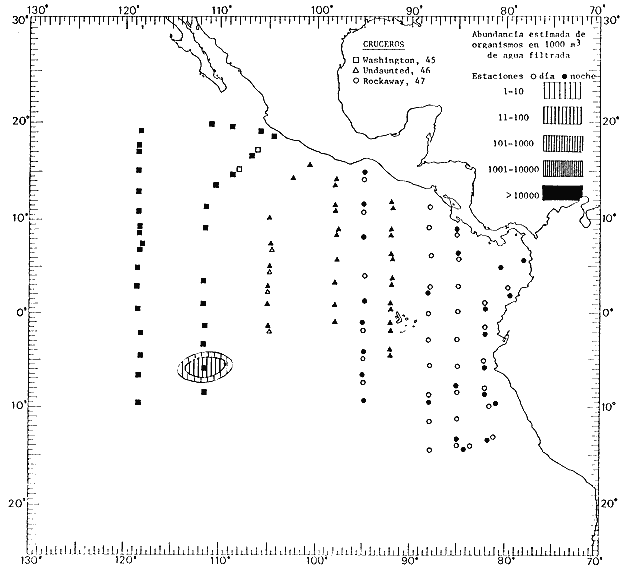 Fig. 98. Distribución general de Aeginura beebei Bigelow, 1910, en el Pacífico Tropical Oriental durante el cuarto periodo bimestral (Agosto-Septiembre 1976). 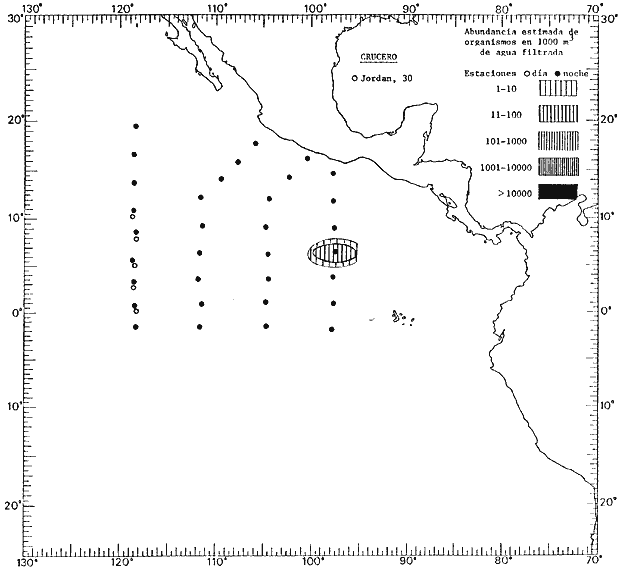 Fig. 99. Distribución general de Aequorea coerulescens (Brandt, 1938, en el Pacífico Tropical Oriental durante el tercer periodo bimestral (junio-julio 1967). 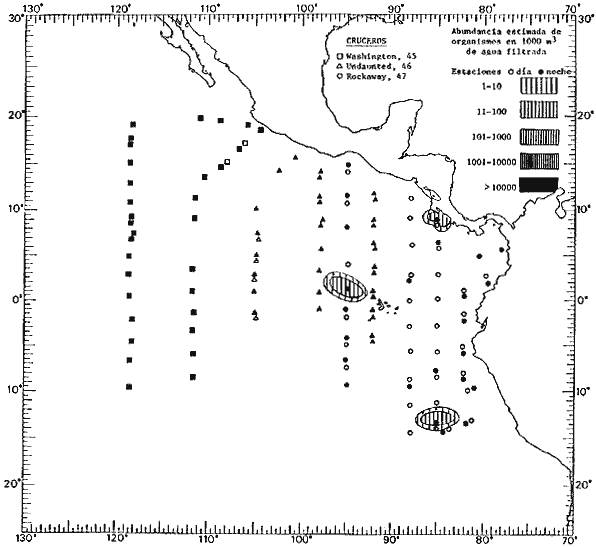 Fig. 100. Distribución general de Aequorea coerulescens (Brandt; 1938), en el Pacífico Tropical Oriental durante el tercer periodo bimestral (Agosto-Septiembre 1967). 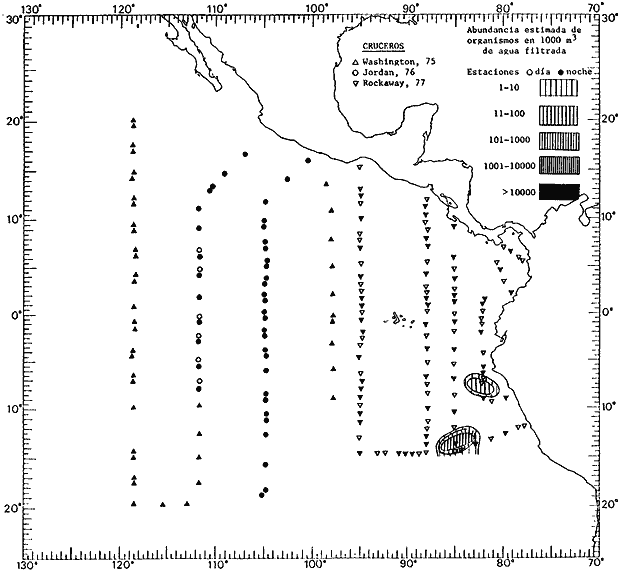 Fig. 101. Distribución general de Amprogona apsteini (Vanhöffen, 1902), en el Pacífico Tropical Oriental durante el quinto periodo bimestral (Febrero-Marzo 1968). 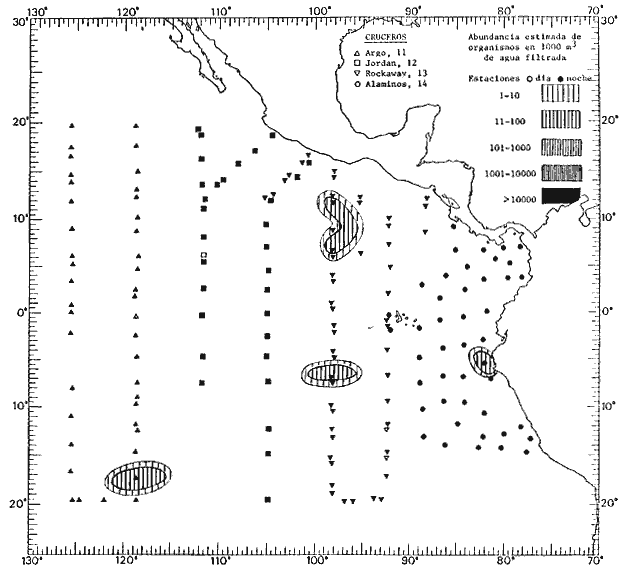 Fig. 102. Distribución general de Bougainvillia fulva Agassiz y Mayer, 1899, en el Pacífico Tropical Oriental durante el primer periodo bimestral (Febrero-Marzo 1967). 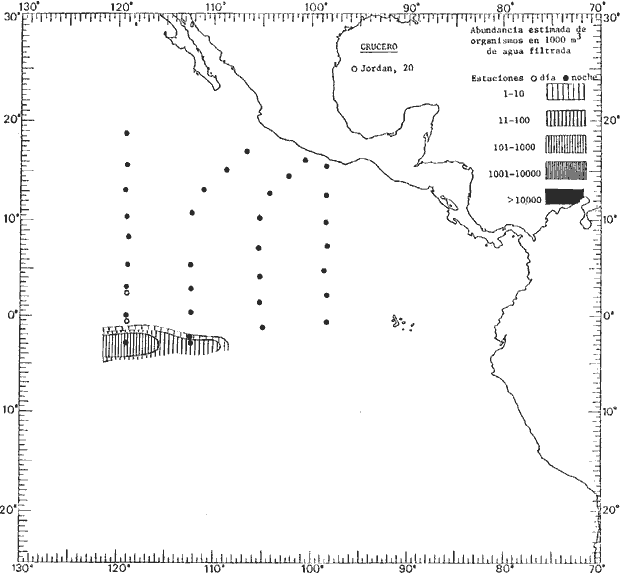 Fig. 103. Distribución general de Bougainvillia fulva Agassiz y Mayer, 1899, en el Pacífico Tropical Oriental durante el segundo periodo bimestral (Abril-Mayo 1967). 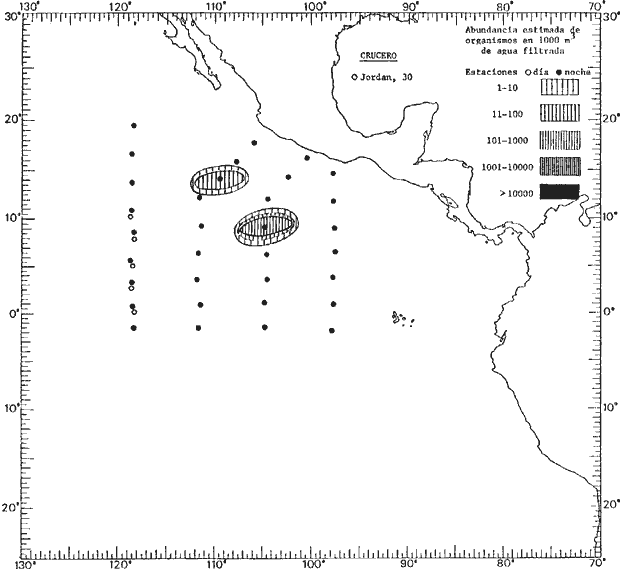 Fig. 104. Distribución general de Bougainvillia fulva Agassiz y Mayer, 1899, en el Pacífico Tropical Oriental durante el tercer periodo bimestral (junio-julio 1967). 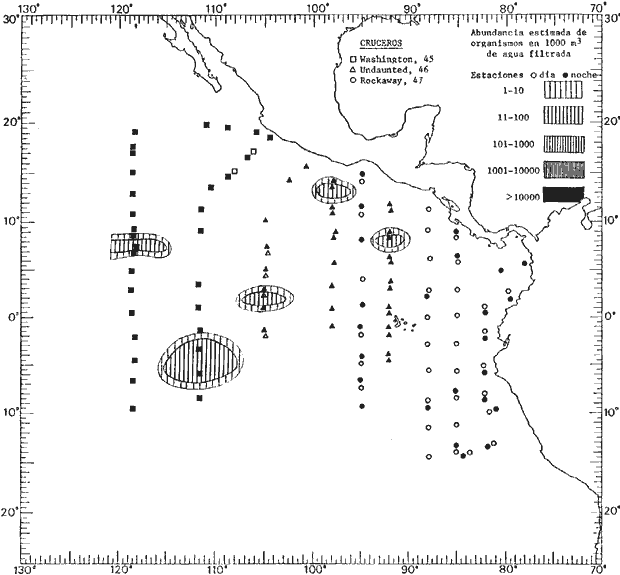 Fig. 105. Distribución general de Bougainvillia fulva Agassiz y Mayer, 1899, en el Pacífico Tropical Oriental durante el cuarto periodo bimestral (Agosto -Septiembre 1967). 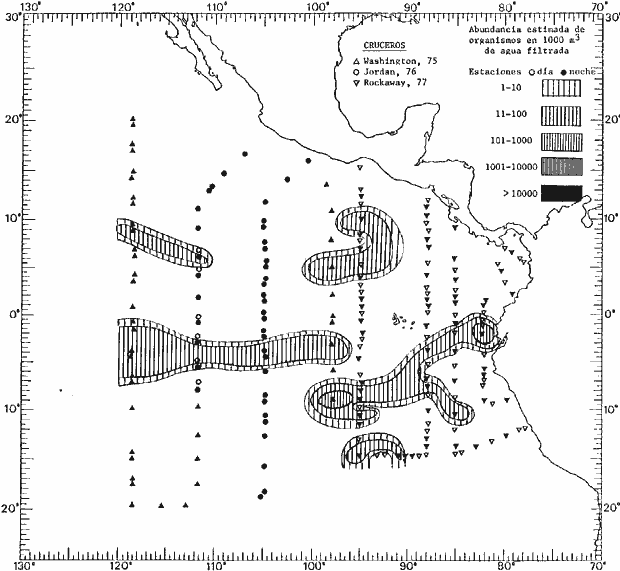 Fig. 106. Distribución general de Bougainvillia fulga Agassiz y Mayer, 1899, en el Pacífico Tropical Oriental durante el quinto periodo bimestral (Febrero-Marzo 1968). 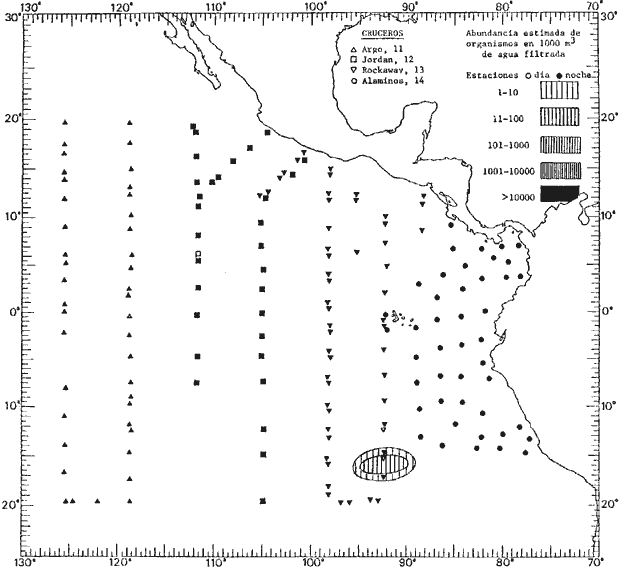 Fig. 107. Distribución general de Cunina duplicata Maas, 1893, en el Pacífico Tropical Oriental durante el primer período bimestral (Febrero-Marzo 1967). 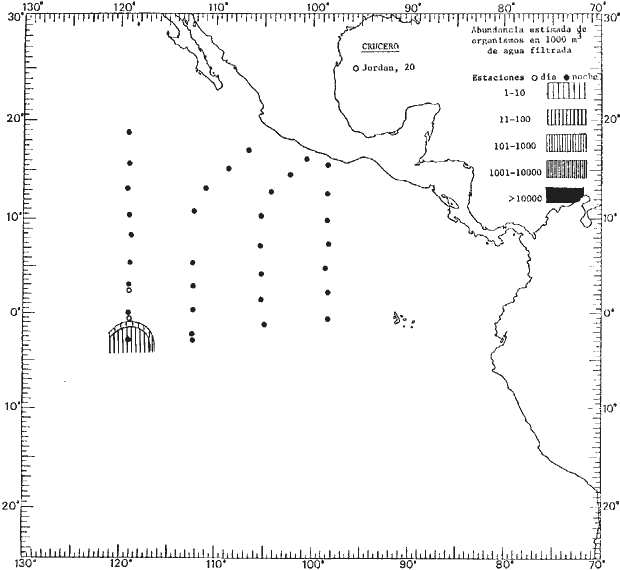 Fig. 108. Distribución general de Cunina duplicata Maas, 1893, en el Pacífico Tropical Oriental durante el segundo periodo bimestral (Abril-Mayo 1967). 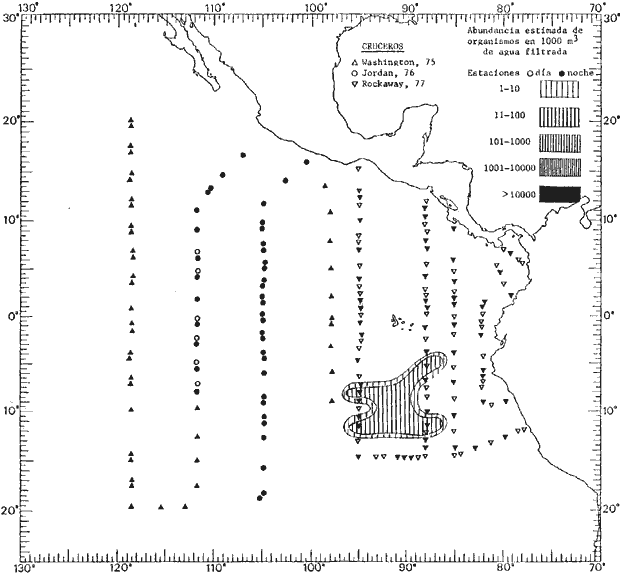 Fig. 109. Distribución general de Cunina duplicata Maas, 1893, en el Pacífico Tropical Oriental durante el quinto periodo bimestral (Febrero-Marzo 1968). 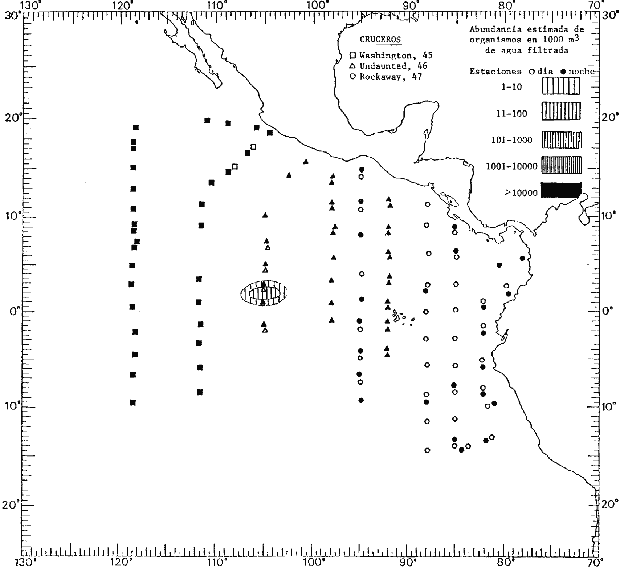 Fig. 110. Distribución general de Dipleurosoma Pacificum Agassiz y Mayer, 1902, en el Pacífico Tropical Oriental durante el cuarto periodo bimestral Agosto -Septiembre 1967). 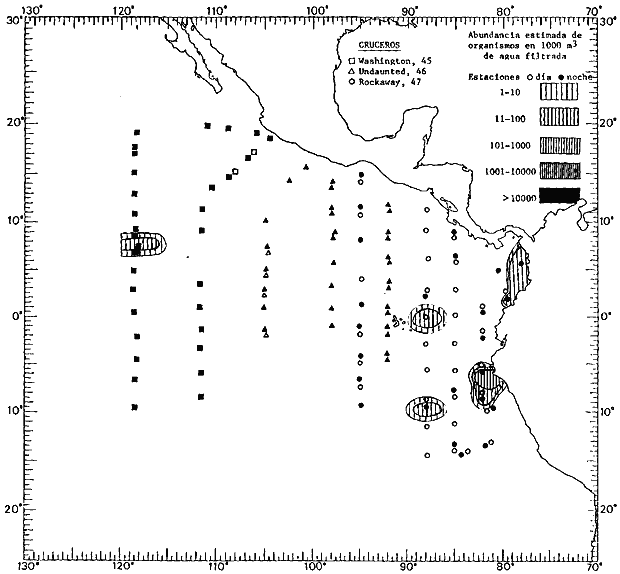 Fig. 111. Distribución general de Ectopleura dumortieri (Van Beneden, 1844). en el Pacífico Tropical Oriental durante el cuarto periodo bimestral (Agosto -Septiembre 1967). 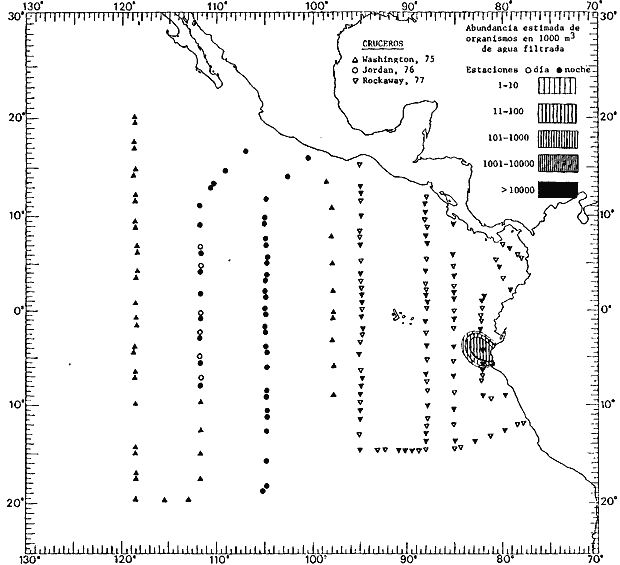 Fig. 112. Distribución general de Ectopleura dumortieri (Van Beneden, 1844), en el Pacífico Tropical Oriental durante el quinto periodo bimestral (Febrero-Marzo 1968). 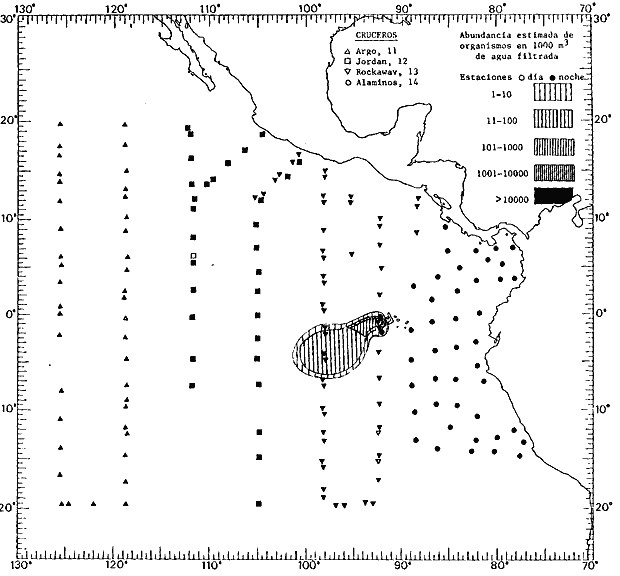 Fig. 113. Distribución general de Ectopleura sacculifera Kramp, 1957, en el Pacífico Tropical Oriental durante el primer periodo bimestral (Febrero-Marzo 1967). 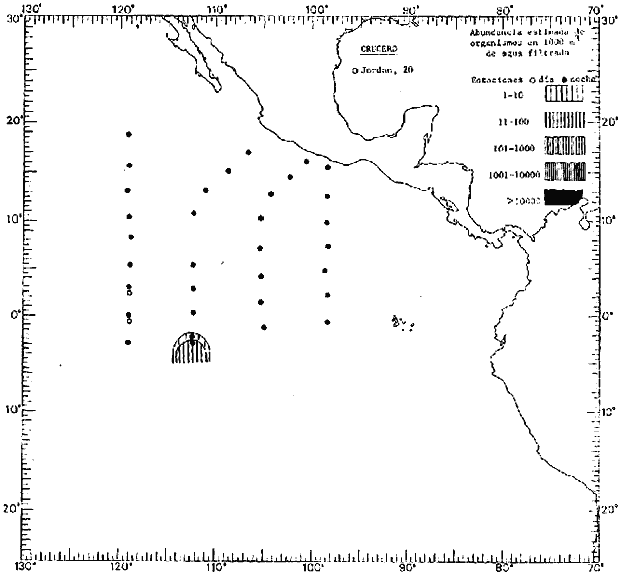 Fig. 114. Distribución general de Ectopleura sacculifera Kramp, 1957, en el Pacífico Tropical Oriental durante el segundo periodo bimestral (Abril-Mayo 1967). 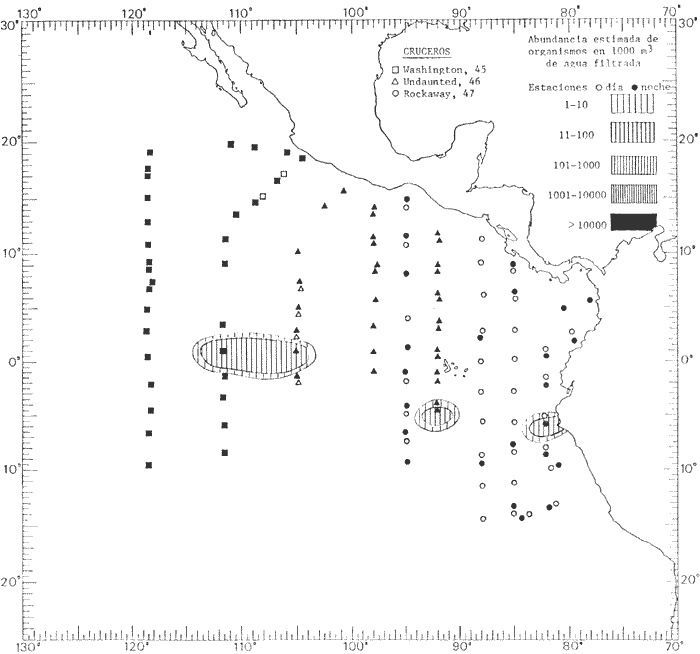 Fig. 116. Distribución general de Ectopleura sacculifera Kramp, 1957, en el Pacífico Tropical Orienta] durante el cuarto periodo bimestral (Agosto - Septiembre 1967). 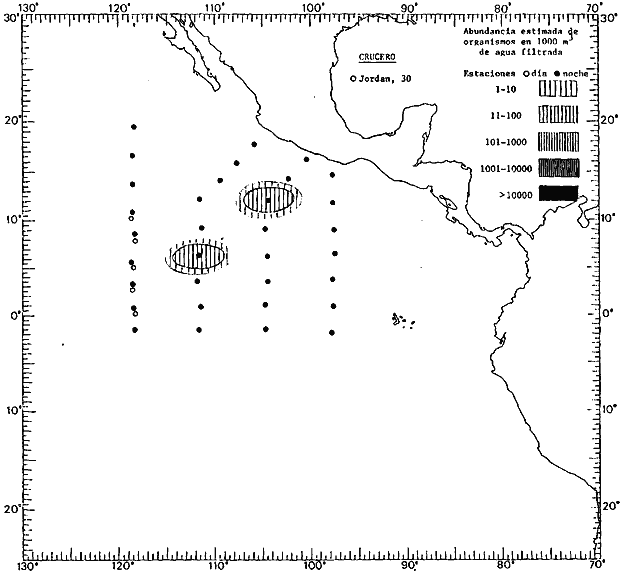 Fig. 115. Distribución general de Ectopleura sacculifera Kramp, 1957, en el Pacífico Tropical Oriental durante el tercer periodo bimestral (junio-julio 1967). 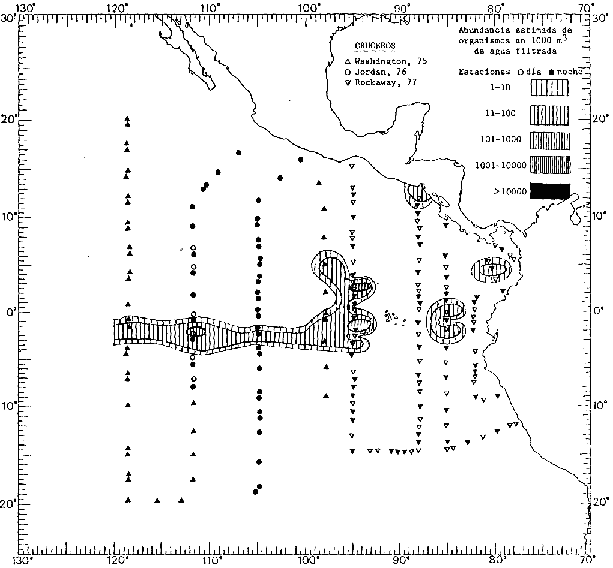 Fig. 117. Distribución general de Ectopleura sacculifera Kramp, 1957, en el Pacífico Tropical Oriental durante el quinto periodo bimestral (Febrero-Marzo 1968). 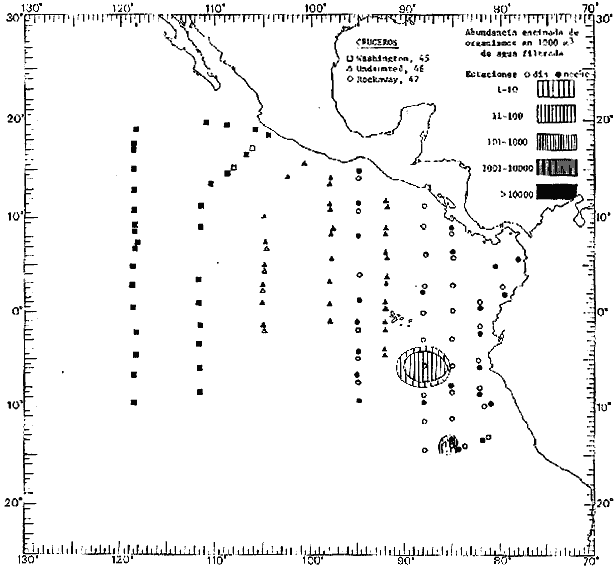 Fig. 118. Distribución general de Euphysora furcata Kramp, 1948, en el Pacífico Tropical Oriental durante el cuarto periodo bimestral (Agosto-Septiembre 1967).  Fig. 119. Distribución general de Haliscera bigelowi Kramp, 1947, en el Pacífico Tropical Oriental durante el cuarto periodo bimestral (Agosto-Septiembre 1967). 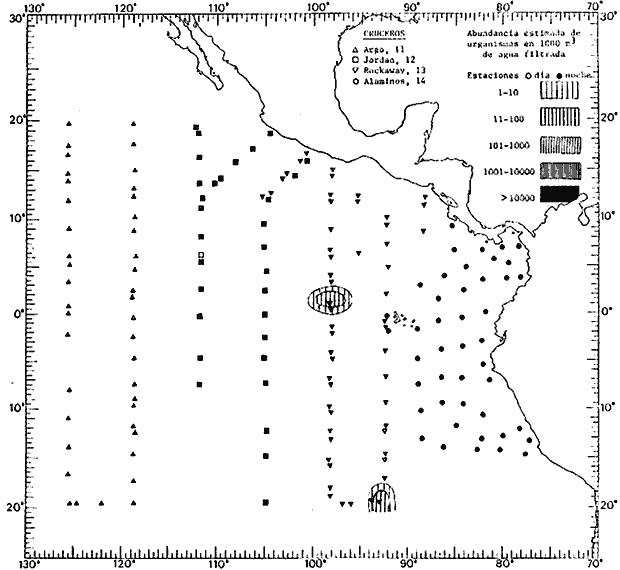 Fig. 120. Distribución general de Kanaka pelagica Uchida, 1947, en el Pacífico Tropical Oriental durante el primer periodo bimestral (Febrero-Marzo 1967).  Fig. 121. Distribución general de Pachycordyle sp en el pacífico Tropical Oriental durante el quinto periodo bimestral (Febrero-Marzo 1968). 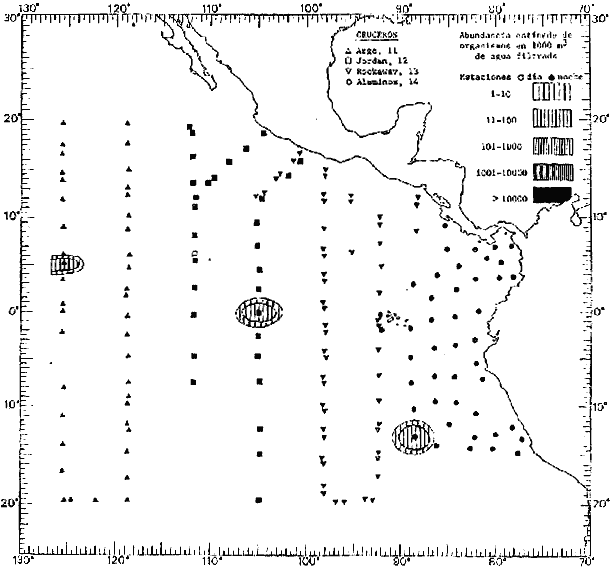 Fig. 122. Distribución general de Pandea sp en el Pacífico Tropical Oriental durante el primer periodo bimestral (Febrero-Marzo 1967). 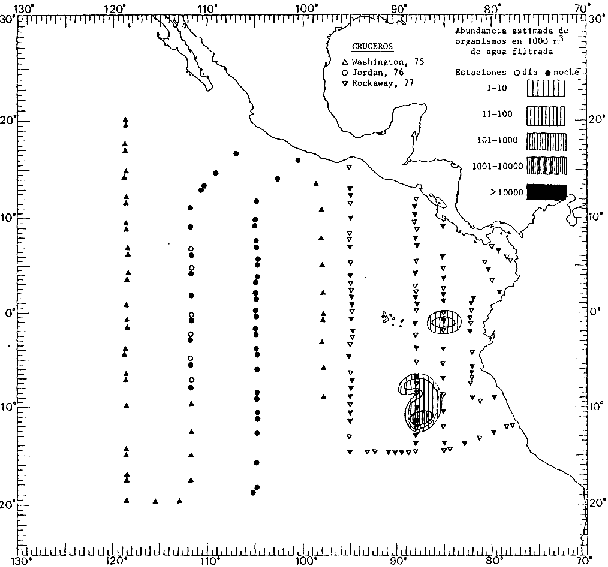 Fig. 123. Distribución general de Pandea sp en el Pacífico Tropical Oriental durante el quinto periodo bimestral (Febrero-Marzo 1968). 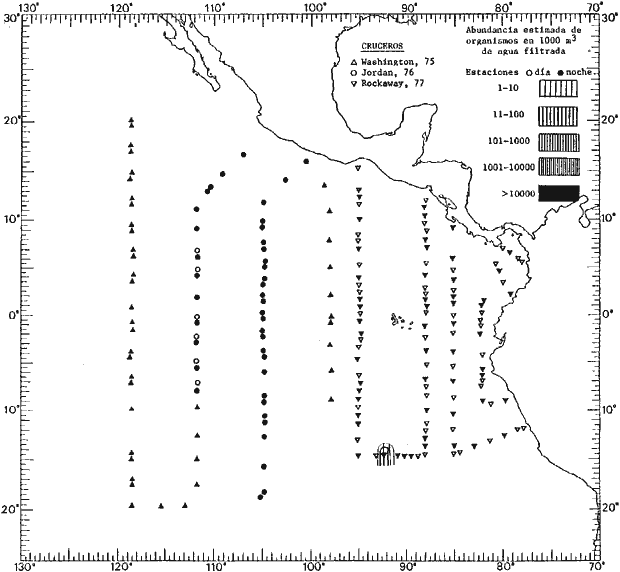 Fig. 124. Distribución general de Podocoryne carnea M. Sars, 1846, en el Pacífico Tropical Oriental durante el quinto periodo bimestral (Febrero-Marzo 1968). 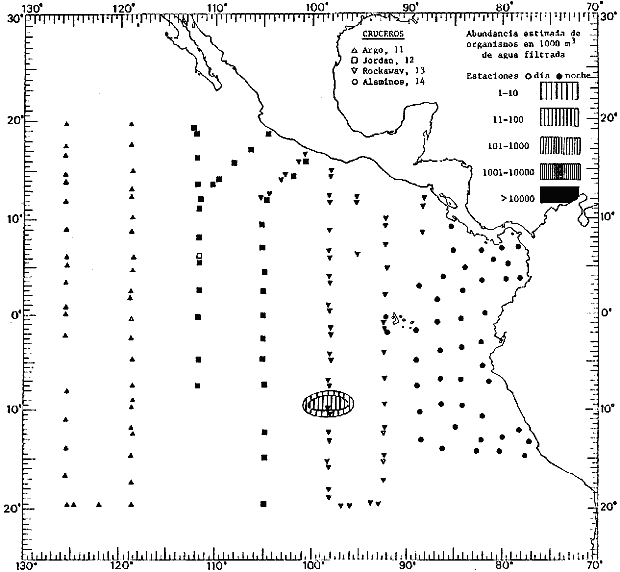 Fig. 125. Distribución general de Aegina citrea Eschscholtz, 1829, en el Pacífico Tropical Oriental durante el primer periodo bimestral (Febrero-Marzo 1967).  Fig. 126. Distribución general de Aegina citrea Eschscholtz, 1829, en el Pacífico Tropical Oriental durante el quinto periodo bimestral (Febrero-Marzo 1968). 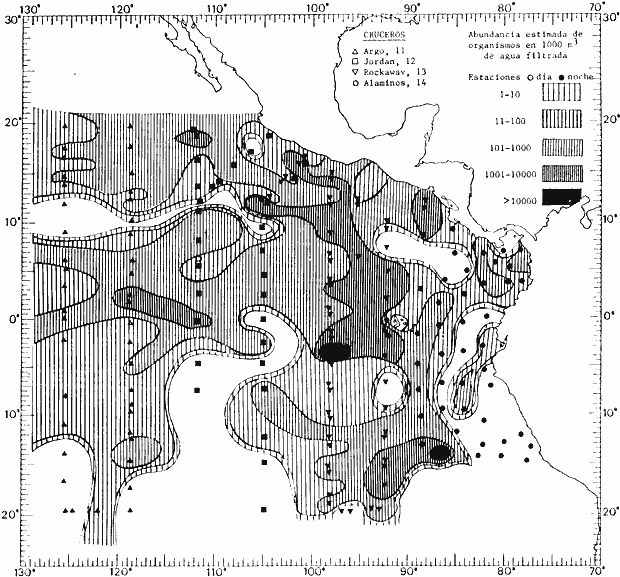 Fig. 127. Distribución general de Aglaura hemistoma Péron y Lesueur, 1809. en el Pacífico Tropical Oriental durante el primer periodo bimestral (Febrero-Marzo 1967).  Fig. 128. Distribución general de Aglaura hemistoma Péron y Lesueur, 1809, en el Pacífico Tropical Oriental durante el segundo periodo bimestral (Abril-Mayo 1967). 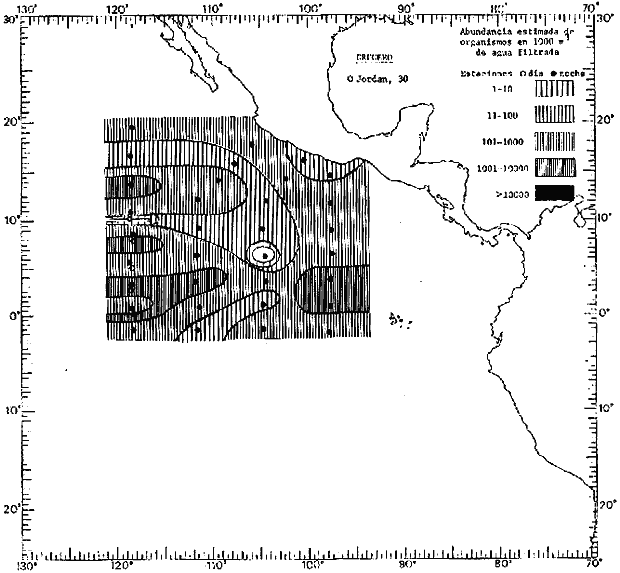 Fig. 129. Distribución general de Aglaura hemistoma Péron y Lesueur, 1809. en el Pacífico Tropical Oriental durante el tercer periodo bimestral (Junio-julio 1967).  Fig. 130. Distribución general de Aglaura hemistoma Péron y Lesueur, 1809, en el Pacífico Tropical Oriental durante el cuarto periodo bimestral (Agosto-Septiembre 1967). 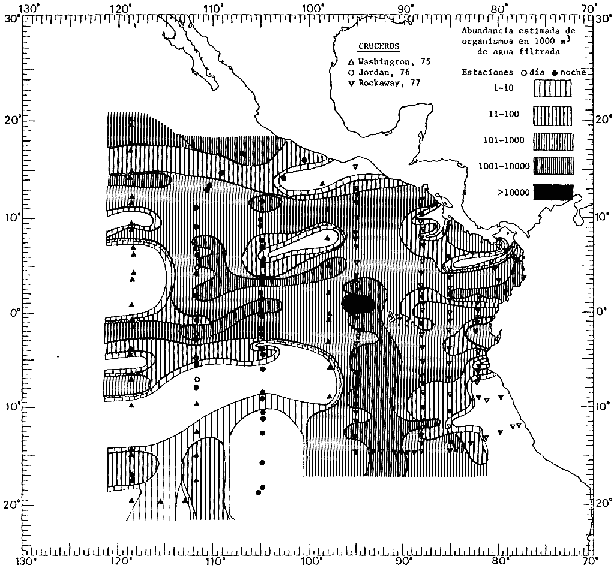 Fig. 131. Distribución general de Aglaura hemistoma Péron y Lesueur, 1809, en el Pacífico Tropical Oriental durante el quinto pcriodo bimestral (Febrero-Marzo 1968). 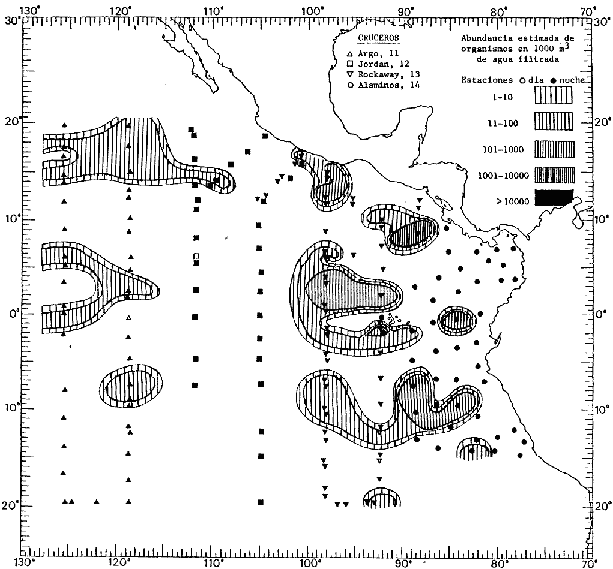 Fig. 132. Distribución general de Amphogona apicata Kramp, 1957, en el Pacífico Tropical Oriental durante el primer periodo bimestral (FebreroMarzo 1967). 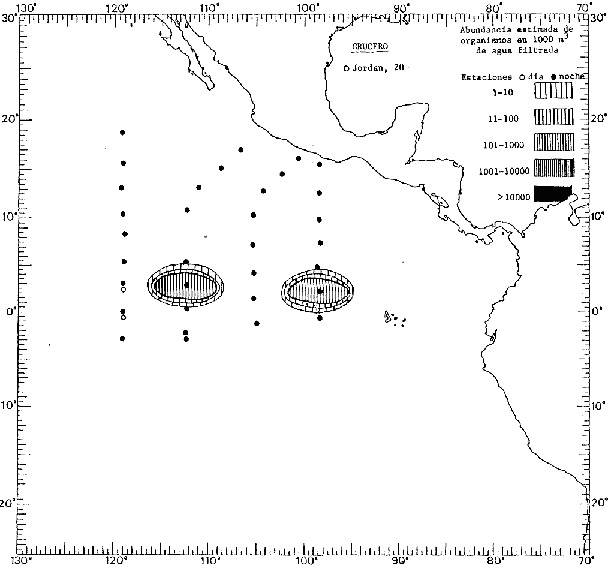 Fig. 133. Distribución general de Amphogona apicata Kramp, 1957, en el Pacífico Tropical Oriental durante el segundo periodo bimestral (Abril-Mayo 1967). 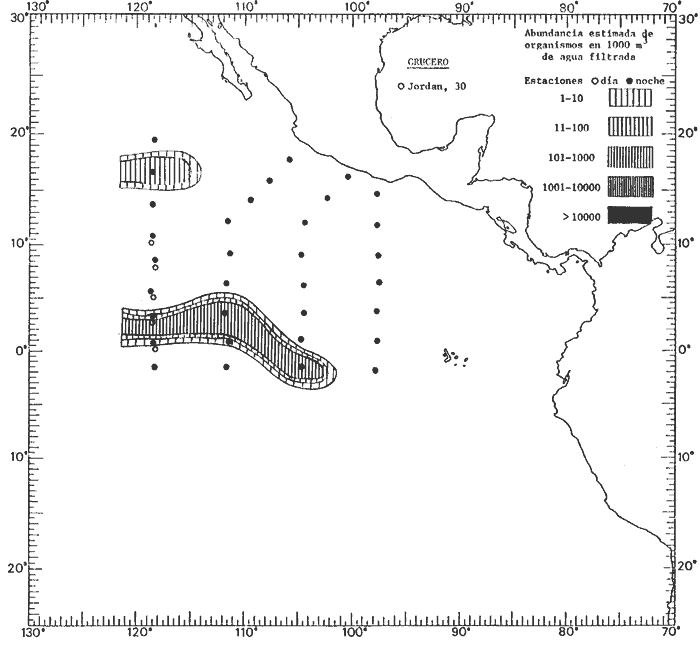 Fig. 134. Distribución general de Amphogona apicata Kramp,- 1957, en el Pacífico Tropical Oricntal durante el tercer periodo bimestral (junio-julio 1967).  Fig. 135. Distribución general de Amphogona apicata Kramp, 1957. en el Pacífico Tropical Oriental durante el cuarto periodo bimestral (Agosto-Septiembre 1967). 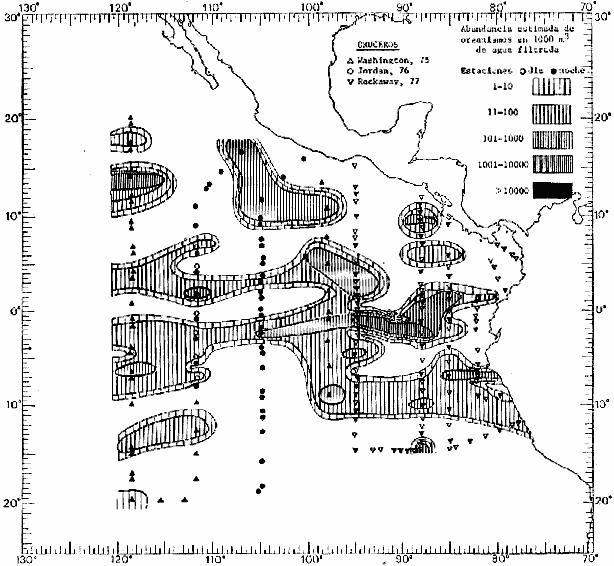 Fig. 136. Distribución general de Amphogona apicata Kramp, 1957, en el Pacífico Tropical Oriental durante el quinto periodo bimestral (Febrero-Marzo 1968). 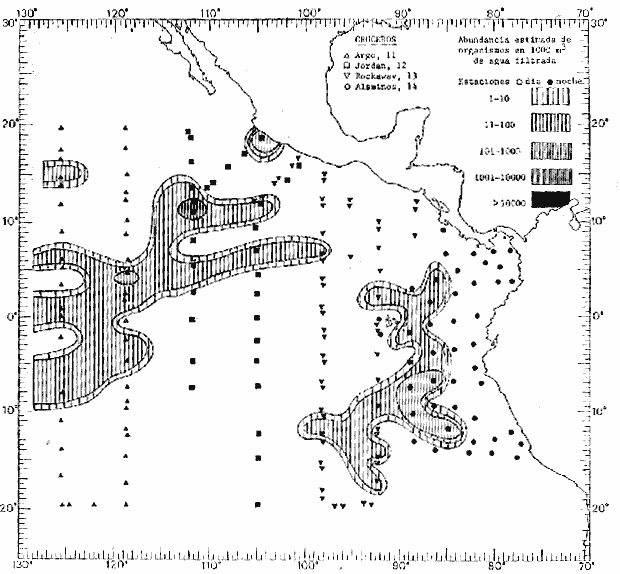 Fig. 137. Distribución general de Cytaeis tetrastyla Eschscholtz, 1829, en el Pacífico Tropical Oriental durante el primer periodo bimestral (Febrero-Marzo 1967).  Fig. 138. Distribución general de Cytaeis tetrastyla Eschscholtz, 1829, en el Pacífico Tropical Oriental durante el segundo periodo bimestral (Abril-Mayo 1967). 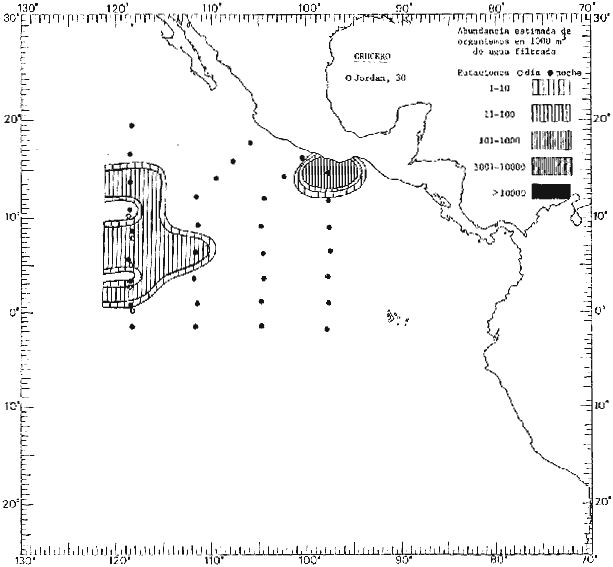 Fig. 139. Distribución general de Cytaeis tetrastyla Eschscholtz. 1829, en el Pacífico Tropical Oriental durante el tercer periodo bimestral (junio-julio 1967).  Fig. 140. Distribución general de Cytaeis tetrastyla Eschscholt, 1829, en el Pacífico Tropical Oriental durante el cuarto periodo bimestral (Agosto-Septiembre 1967). 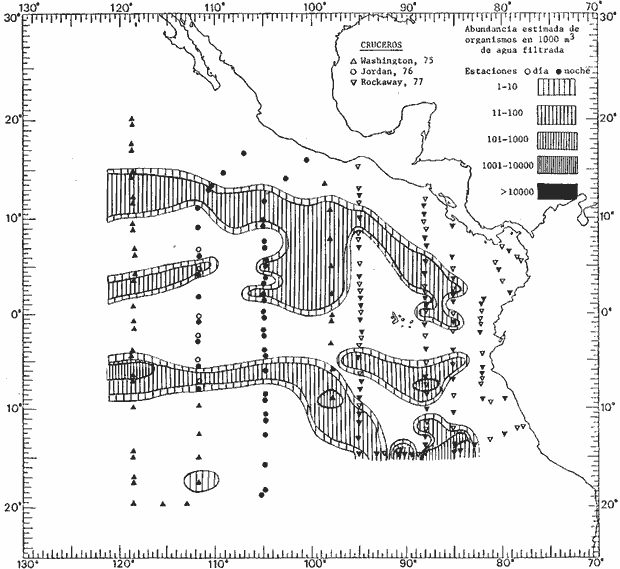 Fig. 141. Distribución general de Cytaeis tetrastyla Eschscholt, 1829, en el Pacífico Tropical Oriental durante el quinto periodo bimestral (Febrero-Marzo 1968). 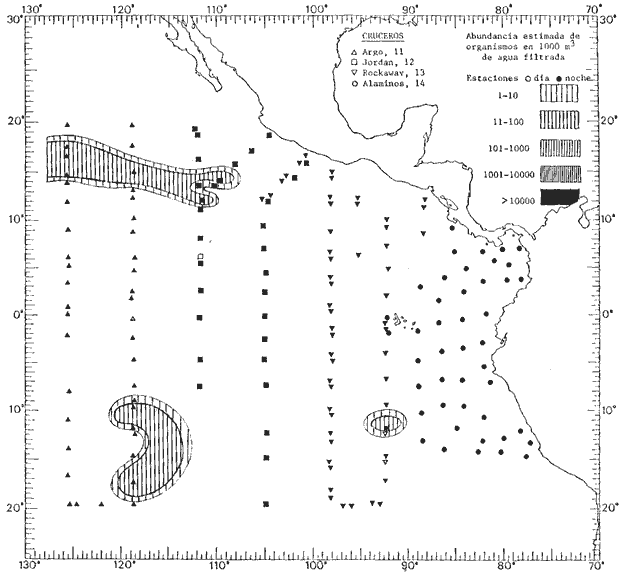 Fig. 142. Distribución general de Geryonia proboscidalis (Forkal, 1775), en el Pacífico Tropical Oriental durante el primer periodo bimestral (Febrero-Marzo 1967). 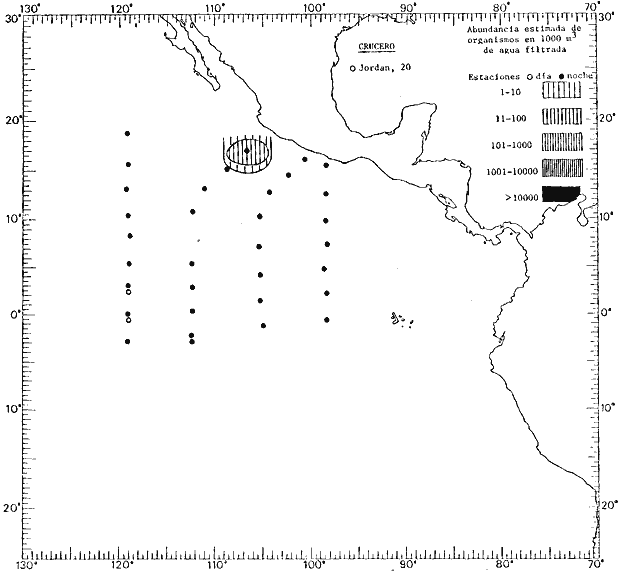 Fig. 143. Distribución general de Geryonia proboscidalis (Forskal, 1775), en el Pacífico Tropical Oriental durante el segundo periodo bimestral (Abril-Mayo 1967). 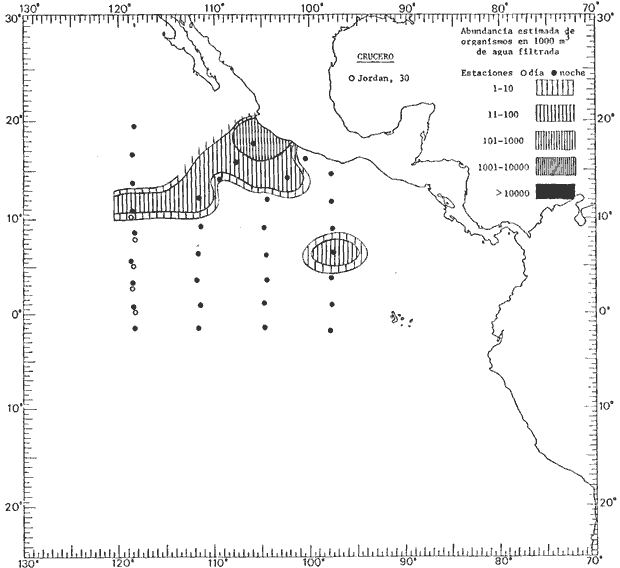 Fig. 144. Distribución general de Geryonia proboscidalis (Forskal, 1775), en el Pacífico Tropical Oriental durante el tercer periodo bimestral (junio-julio 1967). 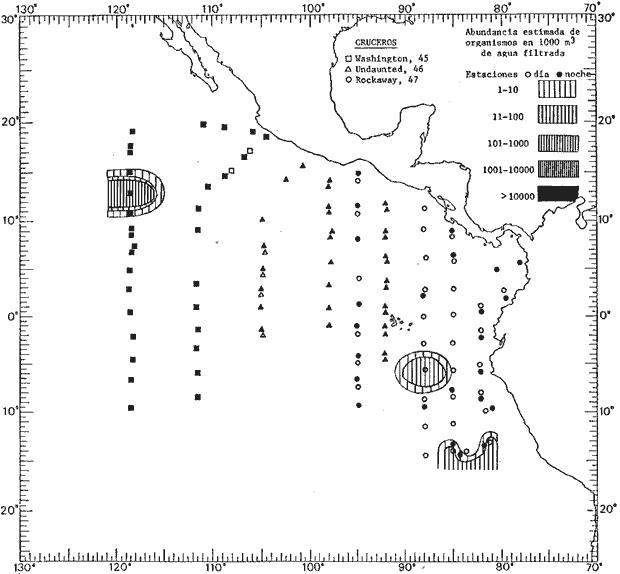 Fig. 145. Distribución general de Geryonia proboscidalis (Forskal, 1775), en el Pacífico Tropical Oriental durante el cuarto periodo bimestral (Agosto -Septiembre 1967). 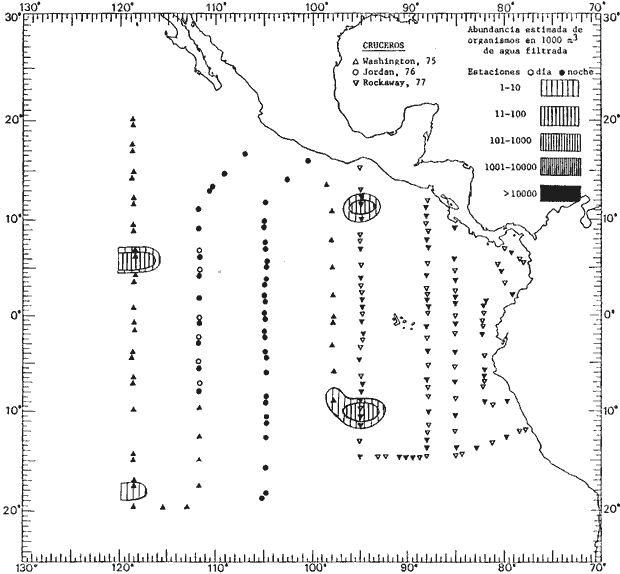 Fig. 146. Distribución general de Geryonia Proboscidalis (Forskal, 1775), en el Pacífico Tropical Oriental durante el quinto periodo bimestral (Febrero-Marzo 1968). 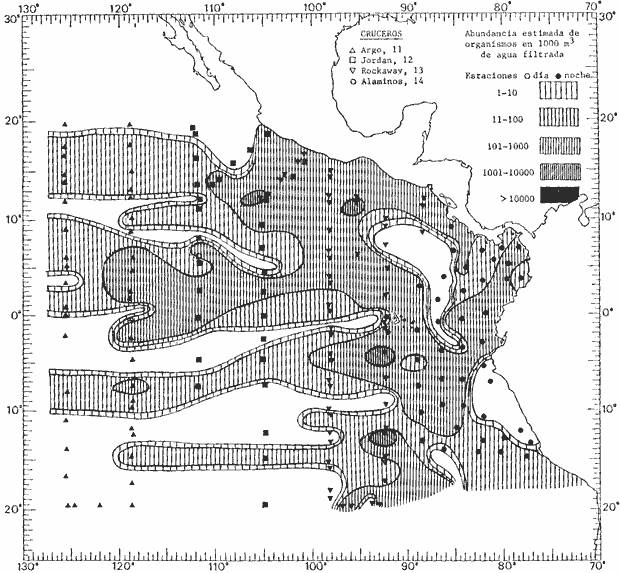 Fig. 147. Distribución general Liriope letraphylla (Chamisso y Eysenhardt, 1821), en el Pacífico Tropical Oriental durante el primer periodo bimestral (Febrero-Marzo 1967). 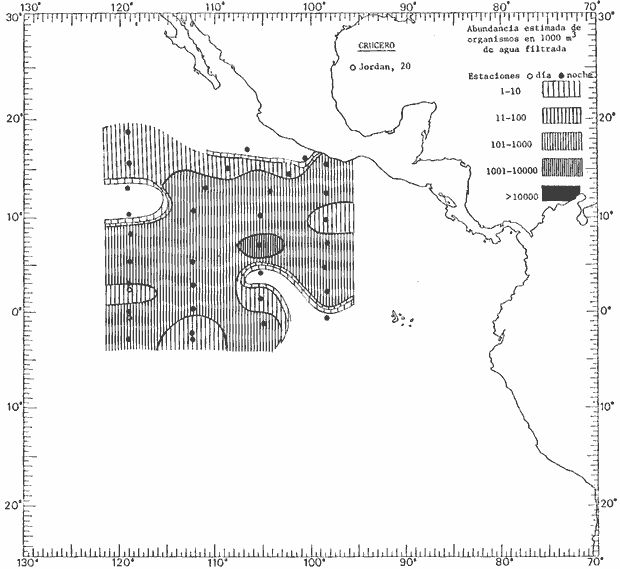 Fig. 148. Distribución general de Liriope tetraphylla (Chamisso y Eysenhardt, 1821), en el Pacífico Tropical Oriental durante el segundo periodo bimestral (Abril-Mayo 1967). 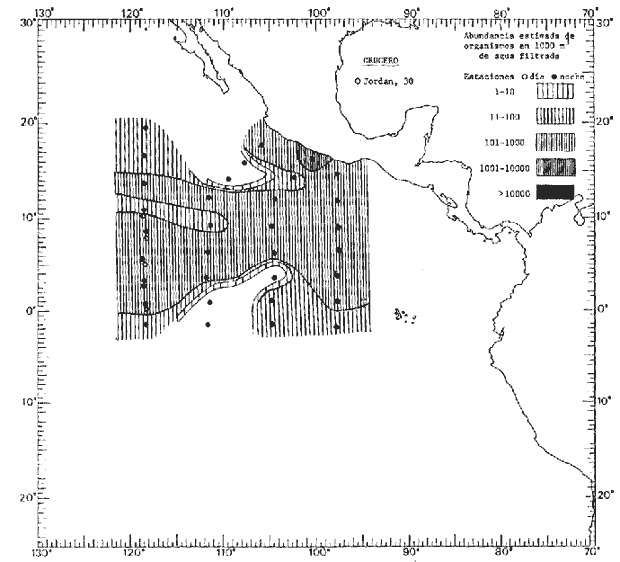 Fig. 149. Distribución general de Liriope tetraphylla (Chamisso y Eysenhardt, 1821), en el Pacífico Tropical Oriental durante el tercer periodo bimestral (junio-julio 1967). 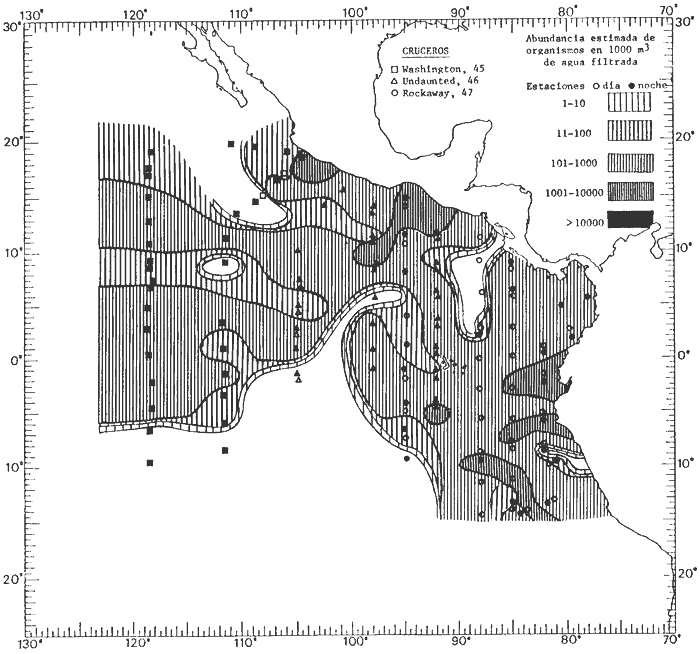 Fig. 150. Distribución general de Liriope tetraphylla (Chamisso y Eysenhardt, 1821), en el Pacífico Tropical Oriental durante el cuarto periodo bimestral (Agosto-Septiembre 1967).  Fig. 151. Distribución general de Liriope tetraphylla (Chamisso y Eysenhardt, 1821), en el Pacífico Tropical Oriental durante el quinto periodo bimestral (Febrero-Marzo 1968). 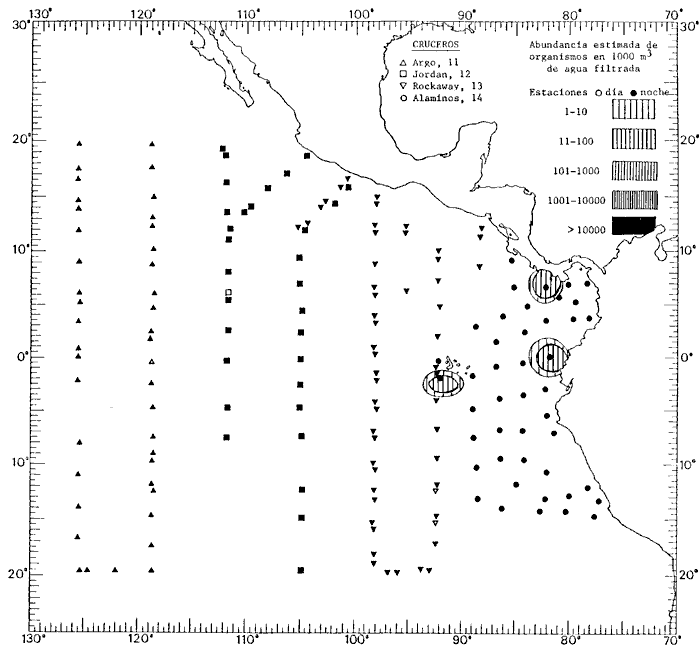 Fig. 152. Distribución general de Nausithoë punctata Kolliker, 1893, en el Pacífico Tropical Oriental durante el primer periodo bimestral (Febrero-Marzo 1967). 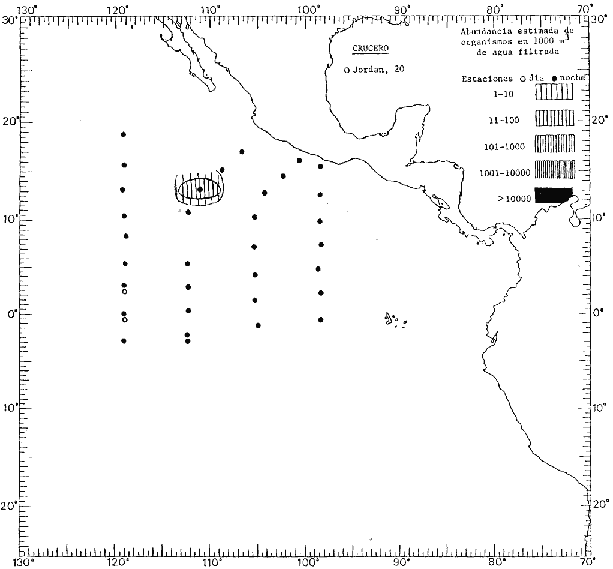 Fig. 153. Distribución general de Nausithoë punctata Kolliker, 1893, en el Pacífico Tropical Oriental durante el segundo periodo bimestral (Abril-Mayo 1967). 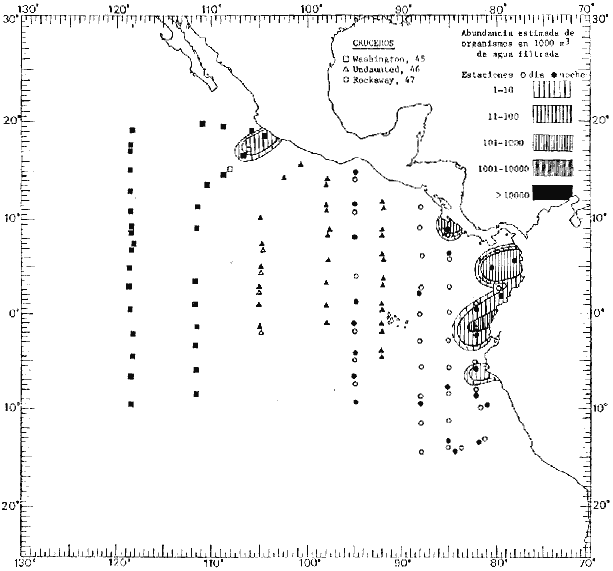 Fig. 154. Distribución general de Nausithoë Punctata Kolliker, 1893, en el Pacífico Tropical Oriental durante el cuarto periodo bimestral (Agosto-Septiembre 1967). 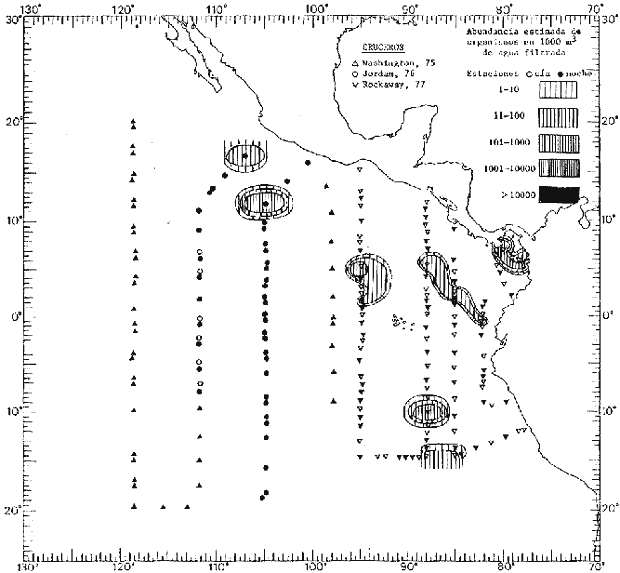 Fig. 155. Distribución general de Nausithoë Punctata Kolliker, 1893, en el Pacífico Tropical Oriental durante el quinto periodo bimestral (Febrero-Marzo 1968). 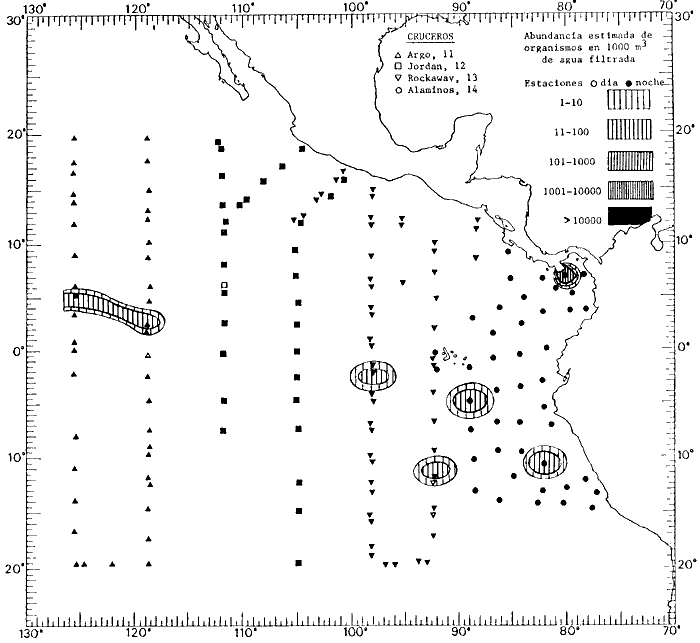 Fig. 156. Distribución general de Pegantha clara R. P. Bigelow, 1909, en el Pacífico Tropical Oriental durante el primer periodo bimestral (Febrero-Marzo 1967). 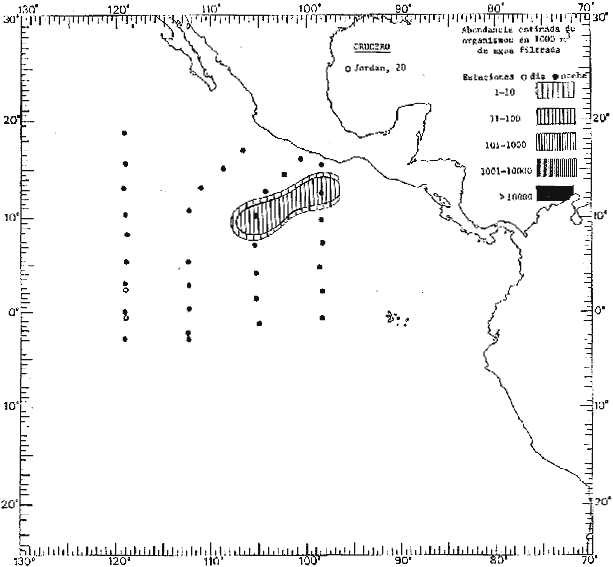 Fig. 157. Distribución general de Pegantha clara R. P. Bigelow, 1909, en el Pacífico Tropical Oriental durante el segundo periodo bimestral (Abril-Mayo 1967). 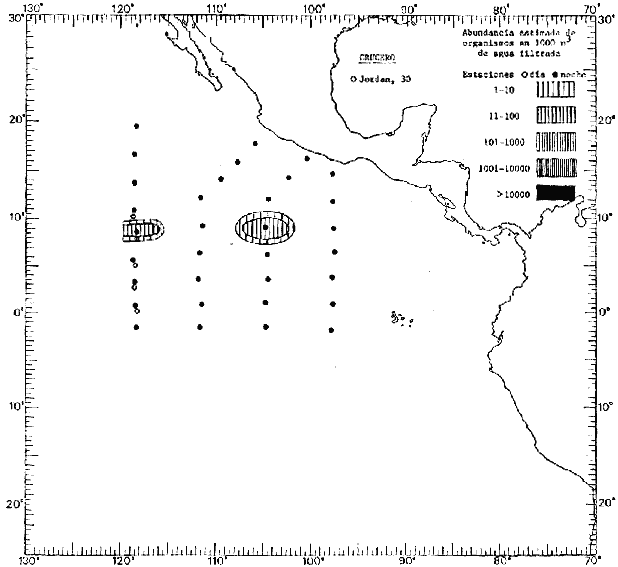 Fig. 158. Distribución general de Pegantha clara R. P. Bigelow, 1909, en el Pacífico Tropical Oriental durante el tercer periodo bimestral (junio-julio 1967). 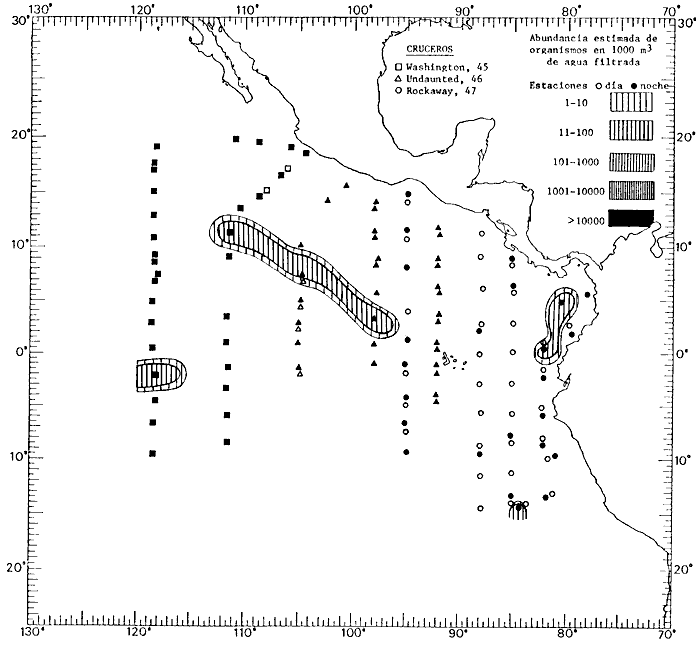 Fig. 159. Distribución general de Pegantha clara R. P. Bigelow, 1909, en el Pacífico Tropical Oriental durante el cuarto periodo bimestral (Agosto-Septiembre 1967). 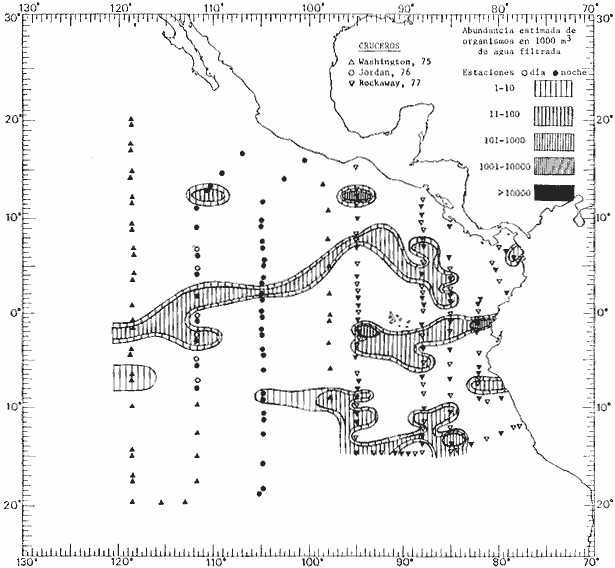 Fig. 160. Distribución general de Pegantha clara R. P. Bigelow, 1909, en el Pacífico Tropical Oriental durante el quinto periodo bimestral (Febrero-Marzo 1968). 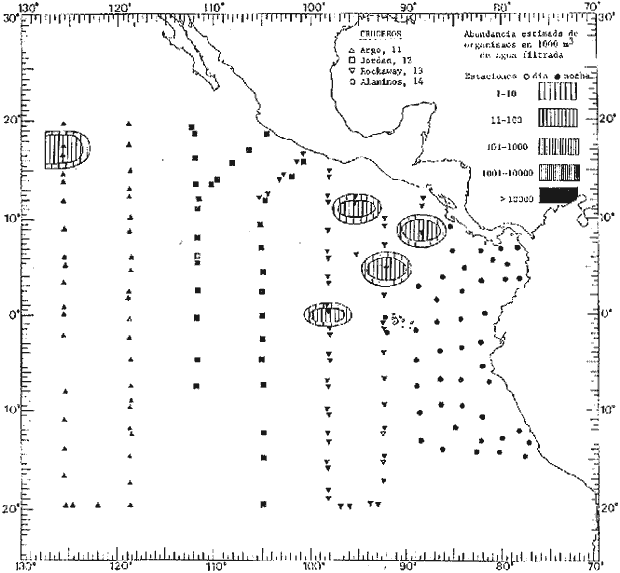 Fig. 161. Distribución general de Pegantha martagon Haeckel, 1879, en el Pacífico Tropical Oriental durante el primer periodo bimestral (Febrero-Marzo 1967). 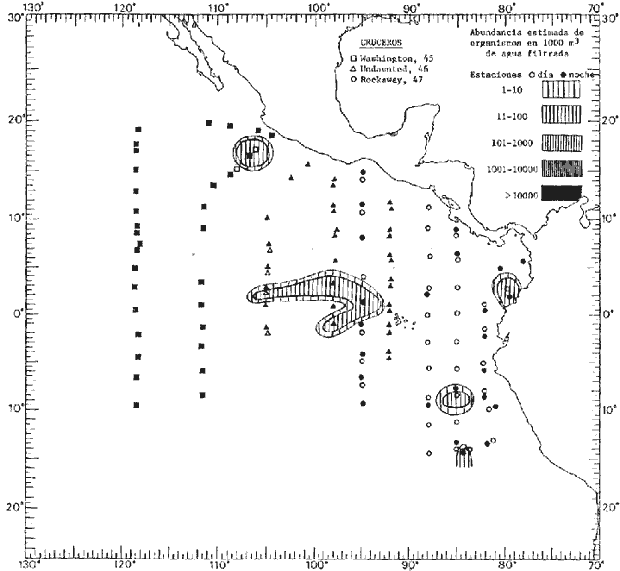 Fig. 162. Distribución general de Pegantha martagon Haeckel, 1879, en el Pacífico Tropical Oriental durante el cuarto periodo bimestral (Agosto-Septiembre 1967). 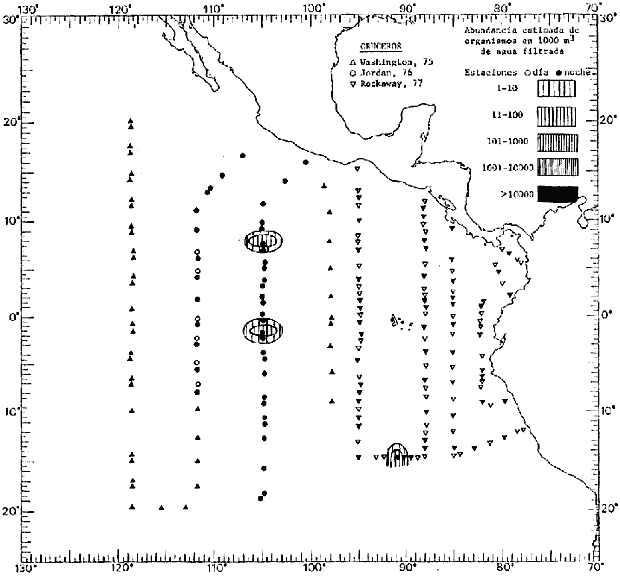 Fig. 163. Distribución general de Pegantha martagon Haeckel, 1879, en el Pacífico Tropical Oriental durante el quinto periodo bimestral (Febrero-Marzo 1968). 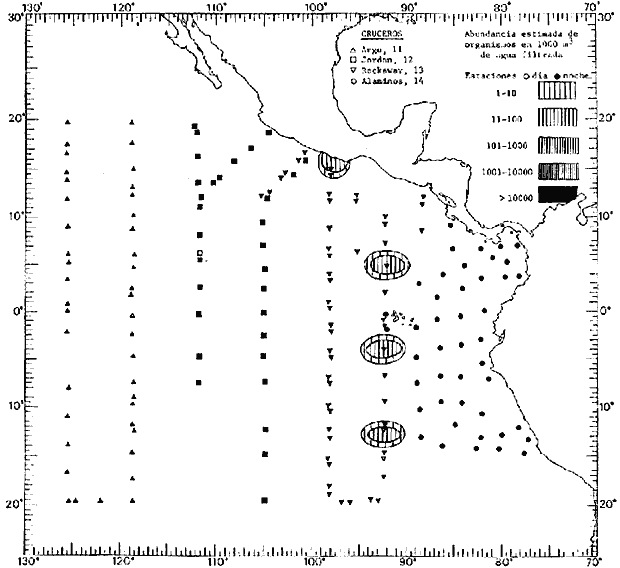 Fig. 164. Distribución general de Pegantha triloba Haeckel, 1879, en el Pacífico Tropical Oriental durante el primer periodo bimestral (Febrero-Marzo 1967). 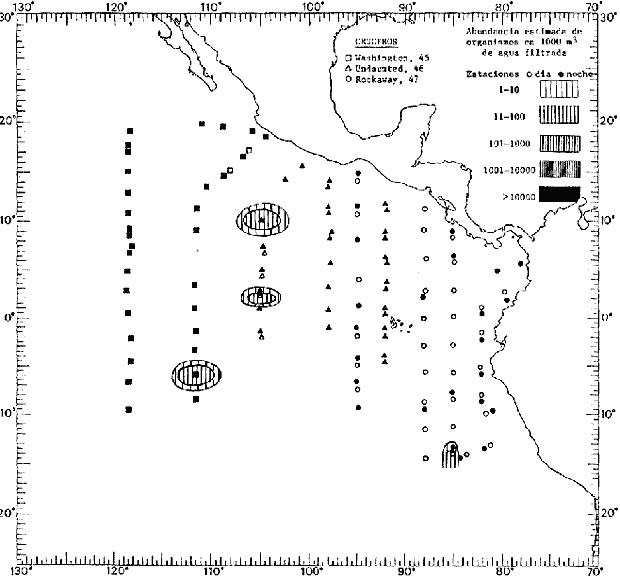 Fig. 165. Distribución general de Pegantha triloba Haeckel, 1879, en el Pacífico Tropical Oriental durante el cuarto periodo bimestral (Agosto-Septiembre 1967). 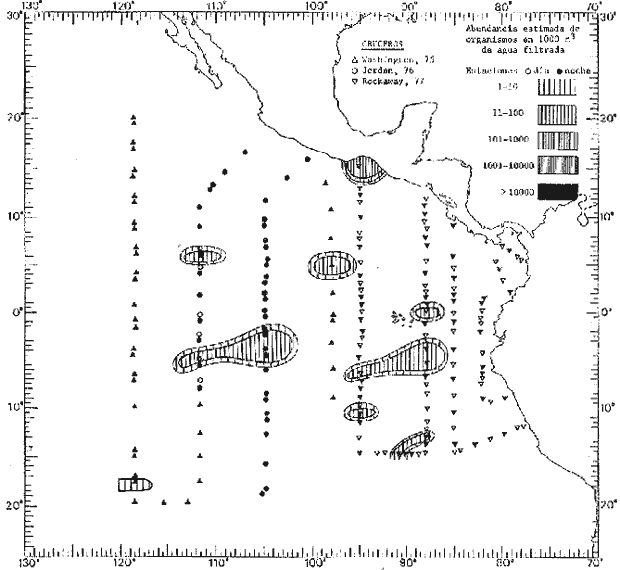 Fig. 166. Distribución general de Pegantha triloba Haeckel, 1879, en el Pacífico Tropical Oriental durante el quinto periodo bimestral (Febrero-Marzo 1968). 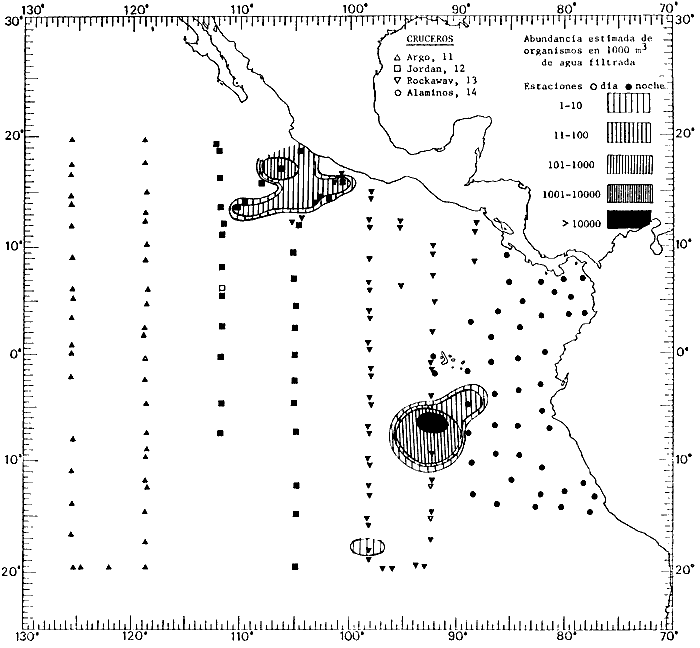 Fig. 167. Distribución general de Pelagia noctiluca Forskal, 1779. en el Pacífico Tropical Oriental durante el primer periodo bimestral (Febrero -Marzo 1967). 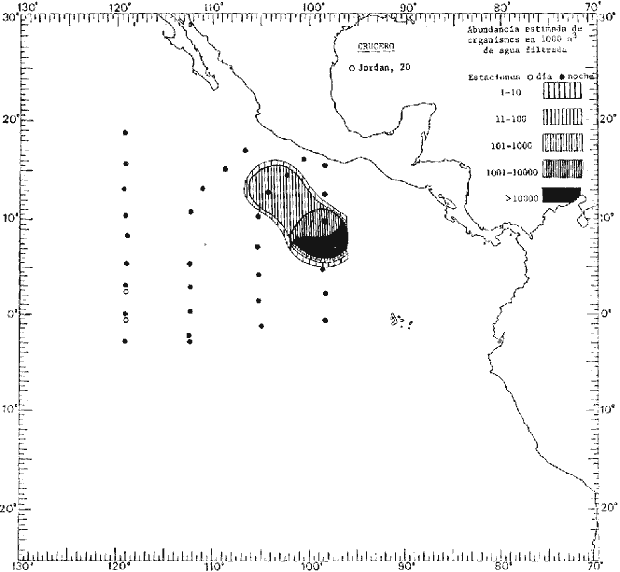 Fig. 168. Distribución general de Pelagia noctiluca Forskal, 1779, en el Pacífico Tropical Oriental durante el segundo periodo bimestral (Abril-Mayo 1967). 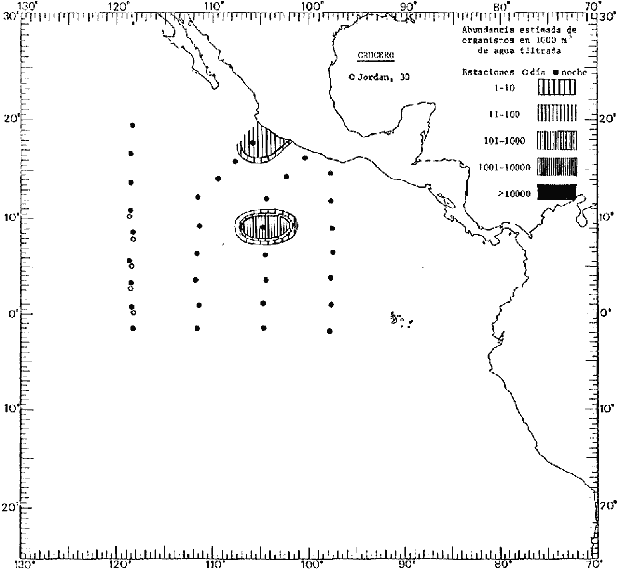 Fig. 169. Distribución general de Pelagia noctiluca Forskal, 1779, en el Pacífico Tropical Oriental durante el tercer periodo birnestral (junio-julio 1967). 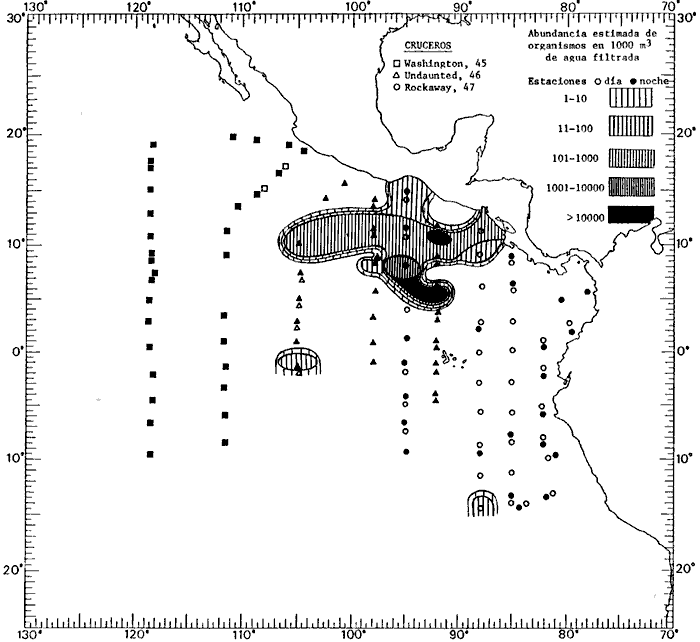 Fig. 170. Distribución general de Pelagia noctiluca Forskal, 1779, en el Pacífico Tropical Oriental durante el cuarto periodo bimestral (Agosto-Septiembre 1967). 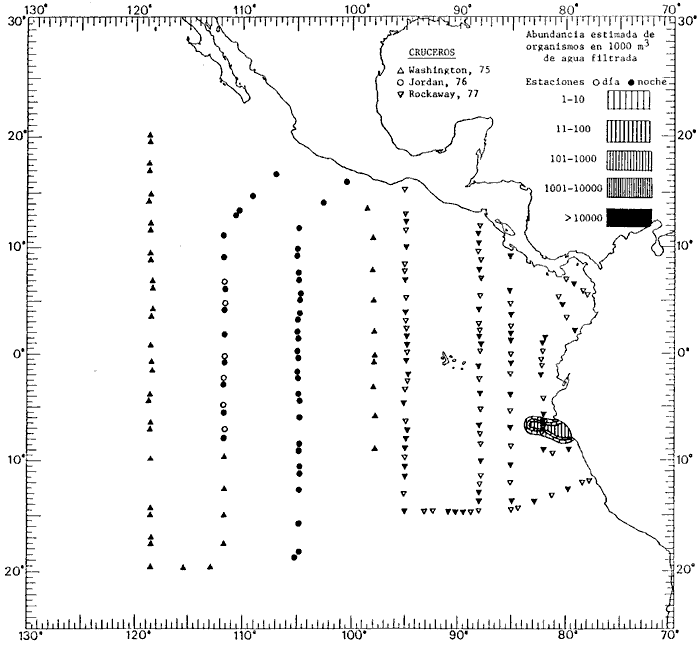 Fig. 171. Distribución general de Pelagia noctiluca Forskal. 1779, en el Pacífico Tropical Oriental durante el quinto periodo bimestral (Febrero-Marzo 1968). 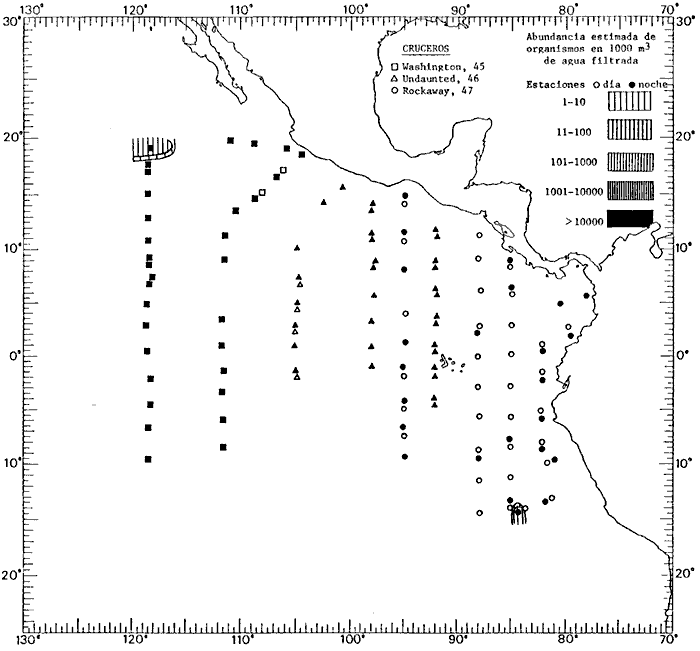 Fig. 172. Distribución general de Phialopsis diegensis Torrey, 1909, en el Pacífico Tropical Oriental durante el cuarto periodo bimestral (Agosto-Septiembre 1967). 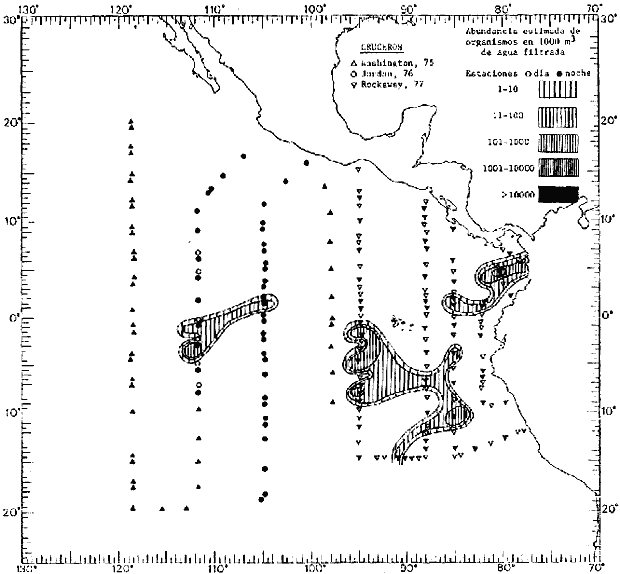 Fig. 173. Distribución general de Phialopsis diegensis Torrey, 1909, en el Pacífico Tropical Oriental durante el quinto periodo bimestral (Febrero-Marzo 1968). 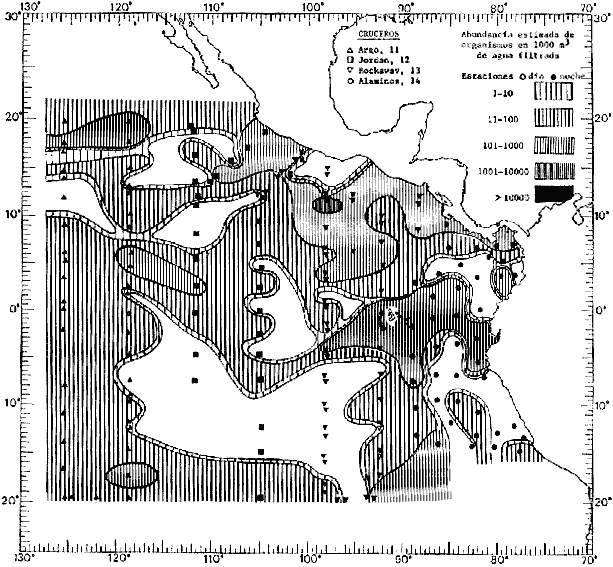 Fig. 174. Distribución general de Rhopalonema velatum Gegenbaur, 1856, en el Pacífico Tropical Oriental durante el primer periodo bimestral (Febrero-Marzo 1967). 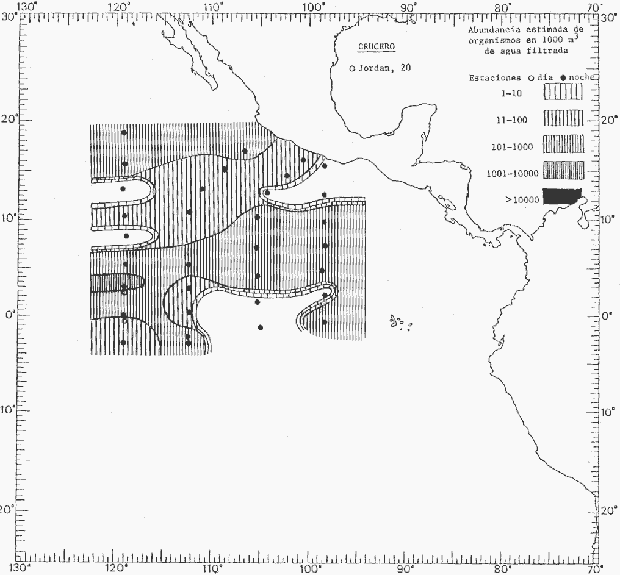 Fig. 175. Distribución general de Rhopalonema velatum Gegenbaur, 1856, en el Pacífico Tropical Oriental durante el segundo periodo bimestral (Abril-Mayo 1967).  Fig. 176. Distribución general de Rhopalonema velatum Gegenbaur, 1856, en el Pacífico Tropical Oriental durante el tercer periodo bimestral (junio-julio 1967). 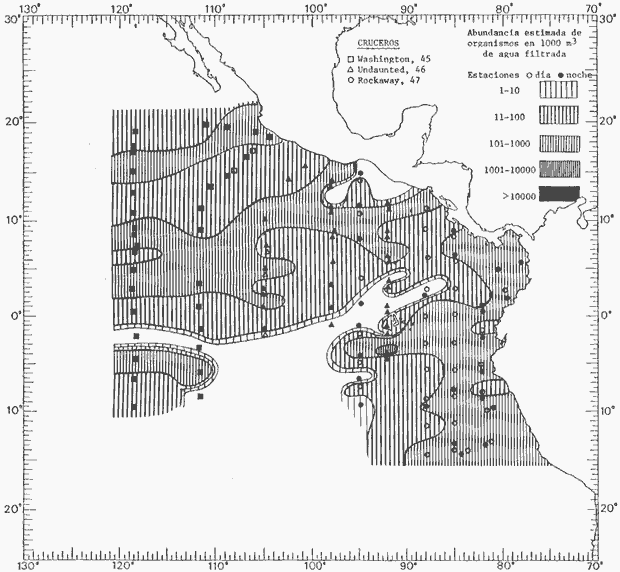 Fig. 177. Distribución general de Rhopalonema velatum Gegenbaur, 1856, en el Pacífico Tropical Oriental durante el cuarto periodo bimestral (Agosto-Septiembre 1967). 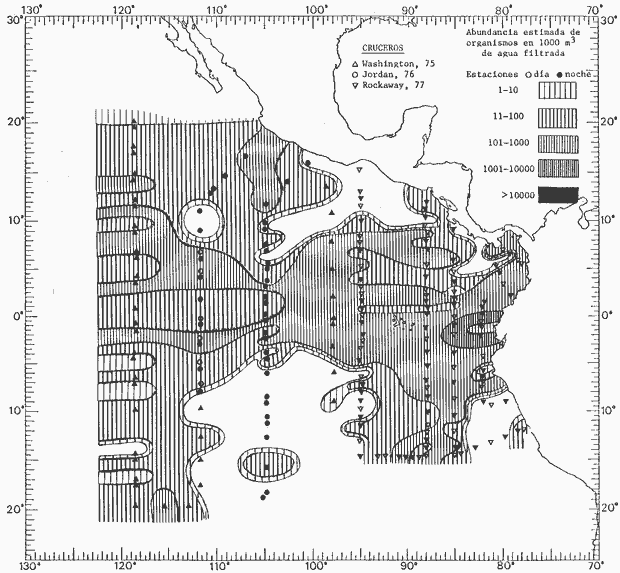 Fig. 178. Distribución general de Rhopalonema velatum Gegenbaur, 1856, en el Pacífico Tropical Oriental durante el quinto periodo bimestral (Febrero-Marzo 1968). 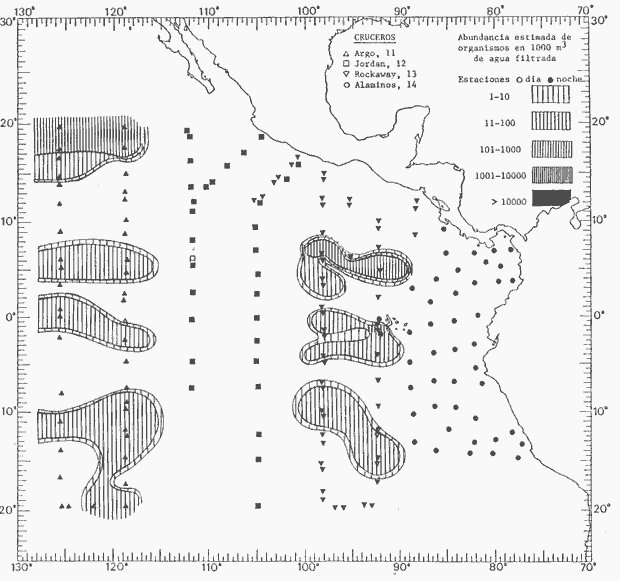 Fig. 179 Distribución general de Sminthea eutygaster Gegenbaur, 1856 en el pacífico tropical oriental durante el primer periodo bimestral (Febrero-Marzo 1967) 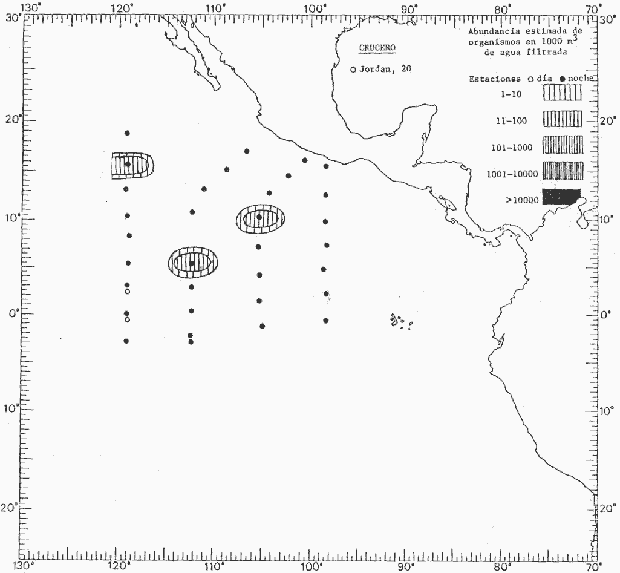 Fig. 180. Distribución general de Sminthea eurygaster Gegenbaur, 1856, en el Pacífico Tropical Oriental durante el segundo periodo bimestral (Abril-Mayo 1967). 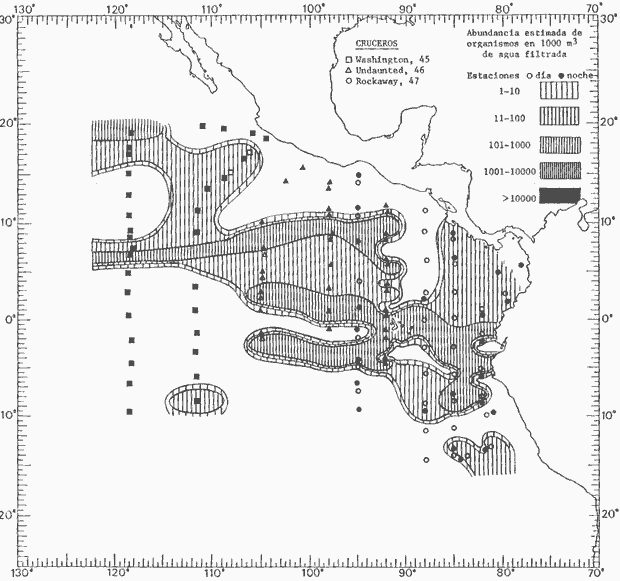 Fig. 181. Distribución general de Sminthea eurygaster Gegenbaur, 1856, en el Pacífico Tropical Oriental durante el cuarto periodo bimestral (Agosto-Septiembre 1967). 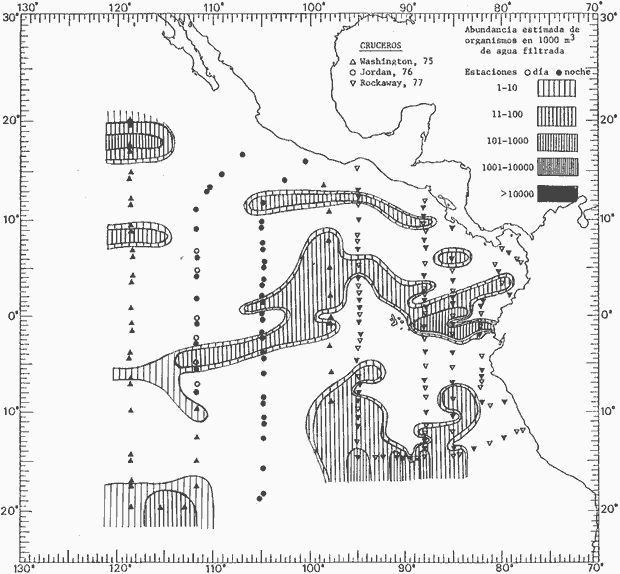 Fig. 182. Distribución general de Sminthea eurygaster Gegenbaur, 1856, en el Pacífico Tropical Oriental durante el quinto periodo bimestral (Febrero-Marzo 1968).  Fig. 183. Distribución general de Solmaris rhodoloma (Brandt, 1838), en el Pacífico Tropical Oriental durante el quinto periodo bimestral (Febrero-Marzo 1968). 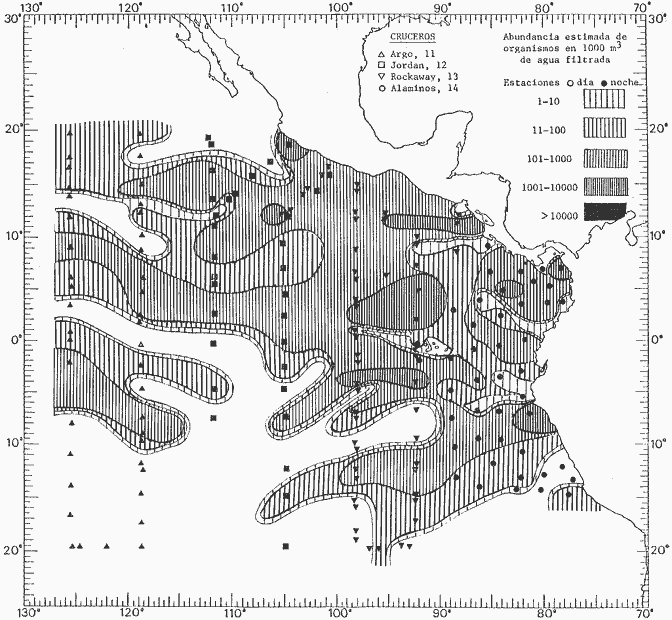 Fig. 184. Distribución general de Solmundella bitentaculata (Quoy y Gaimard, 1833), en el Pacífico Tropical Oriental durante el primer periodo bimestral (Febrero-Marzo 1967). 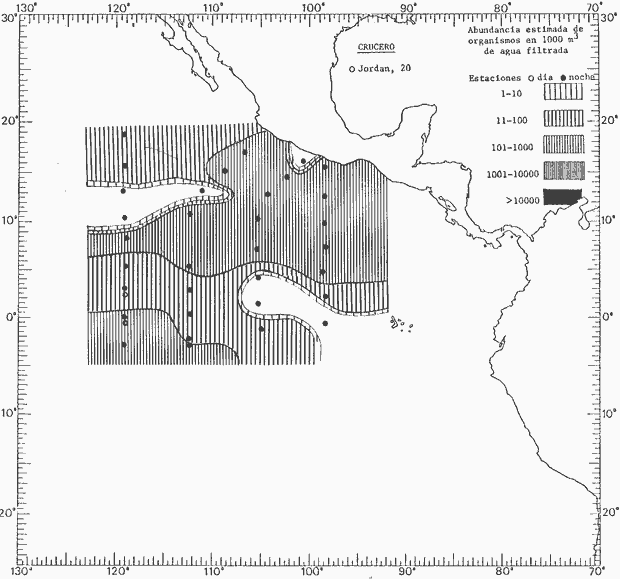 Fig. 185. Distribución general de Solmundella bitentaculata (Quoy y Gaimard, 1833), en el Pacífico Tropical Oriental durante el segundo periodo bimestral (Abril-Mayo 1967).  Fig. 186. Distribución general de Solmundella bitentaculata (Quoy y Gaimard, 1833), en el Pacífico Tropical Oriental durante el tercer periodo bimestral (junio-julio 1967).  Fig. 187. Distribución general de Solmundella bitentaculata (Quoy y Gaimard, 1833), en el Pacífico Tropical Oriental durante el cuarto periodo bimestral (Agosto-Septiembre 1967).  Fig. 188. Distribución general de Solmundella bitentaculata (Quoy y Gaimard, 1833), en el Pacífico Tropical Oriental durante el quinto periodo bimestral (Febrero-Marzo 1968). 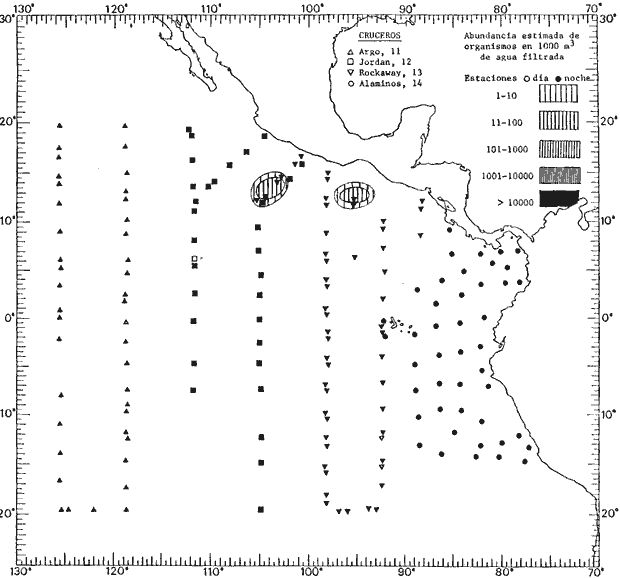 Fig. 189. Distribución general de Zanclea costata Gegenbaur, 1856, en el Pacífico, Tropical Oriental durante el primer periodo bimestral (Febrero-Marzo 1967).  Fig. 190. Distribución general de Zanclea costata Gegenbaur, 1856, en el Pacífico Tropical Oriental durante el cuarto periodo bimestral (Agosto-Septiembre 1967). 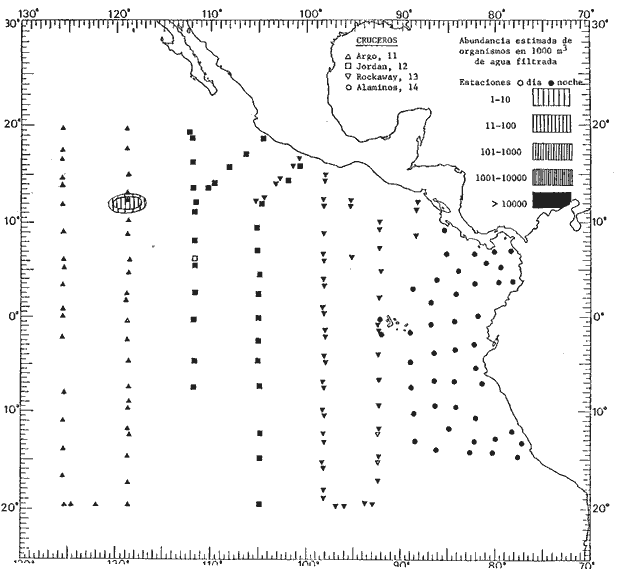 Fig. 191. Distribución general de Zanclea orientalis Browne, 1916, en el Pacífico Tropical Oriental durante el primer periodo bimestral (Febrero-Marzo 1967). 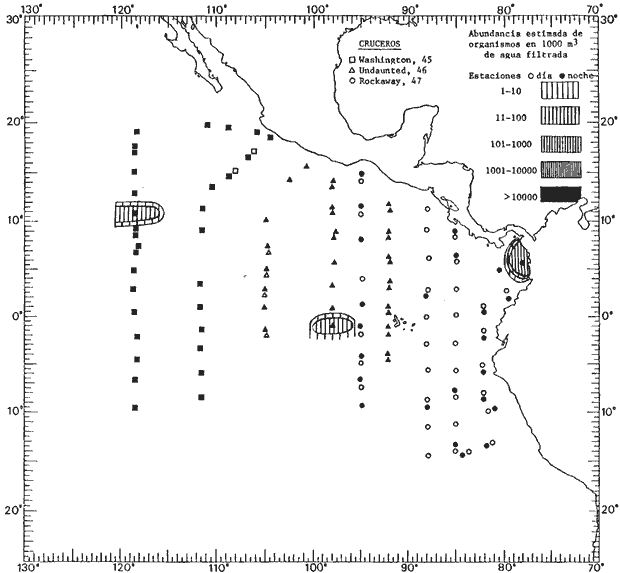 Fig. 192. Distribución general de Zanclea orientalis Browne, 1916, en el Pacífico Tropical Oriental durante el cuarto periodo bimestral (Agosto-Septiembre 1967). 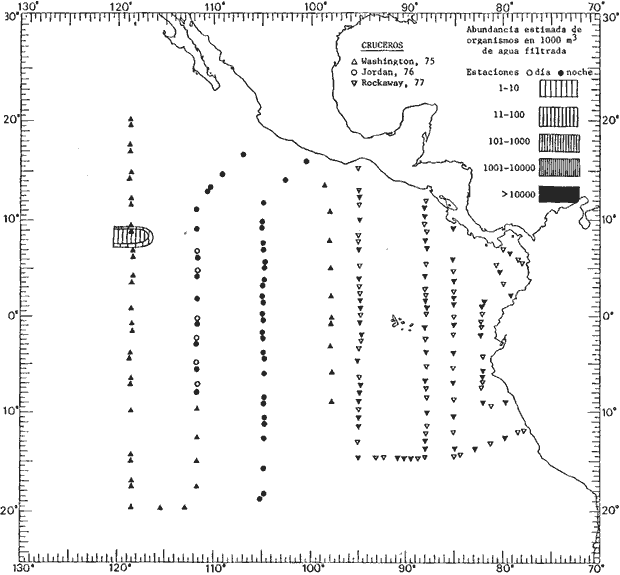 Fig. 193. Distribución general de Zanclea orientalis Browne, 1916, en el Pacífico Tropical Oriental durante el quinto periodo bimestral (Febrero-Marzo 1968).  Fig. 193. Distribución general de Zanclea orientalis Browne, 1916, en el Pacífico Tropical Oriental durante el quinto periodo bimestral (Febrero-Marzo 1968). 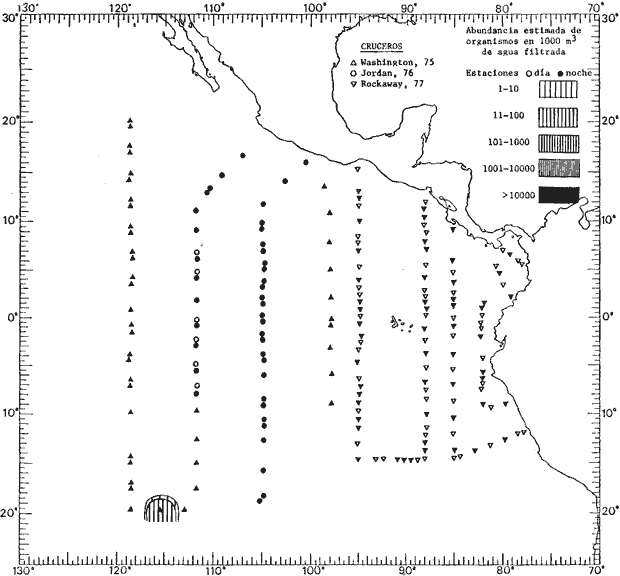 Fig. 194. Distribución general de Bythotiara drygalskii Vanhöffen, 1912, en el Pacífico Tropical Oriental durante el quinto periodo bimestral (Febrero-Marzo 1968). 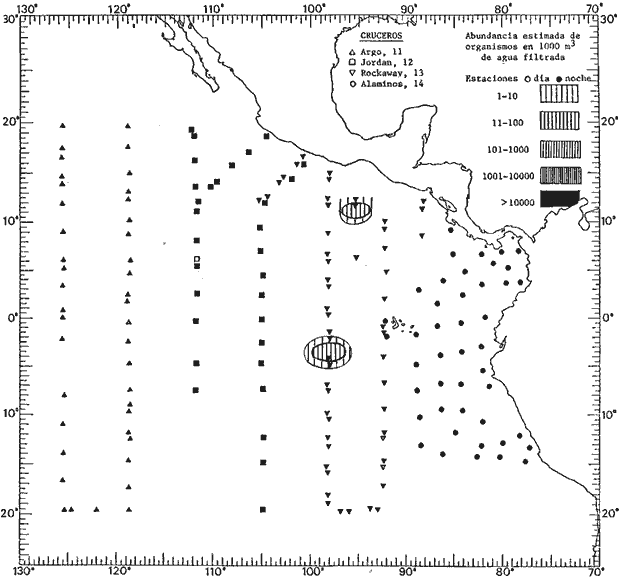 Fig. 195. Distribución general de Halitholus intermedius (Browne, 1902), en el Pacífico Tropical Oriental durante el primer periodo bimestral (Febrero-Marzo 1967). 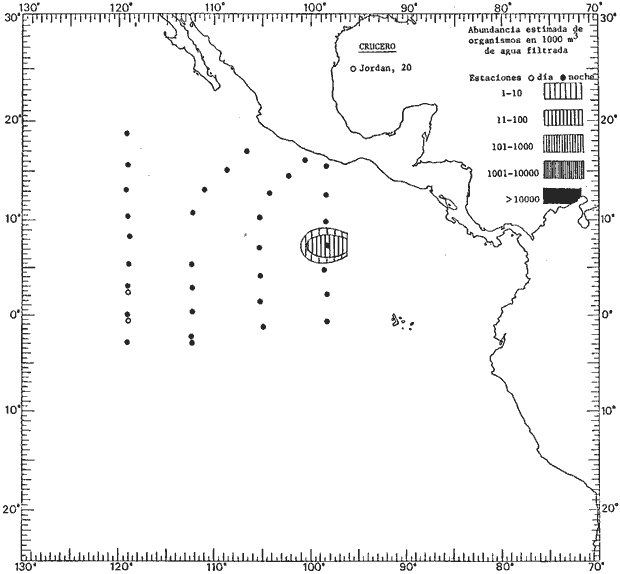 Fig. 196. Distribución general de Halitolus intermedius (Browne, 1902), en el Pacífico Tropical Oriental durante el segundo periodo bimestral (Abril-Mayo 1967).  Fig. 197. Distribución general de Halitholus intermedius (Browne, 1902), en el Pacífico Tropical Oriental durante el cuarto periodo bimestral (Agosto-Septiembre 1967). 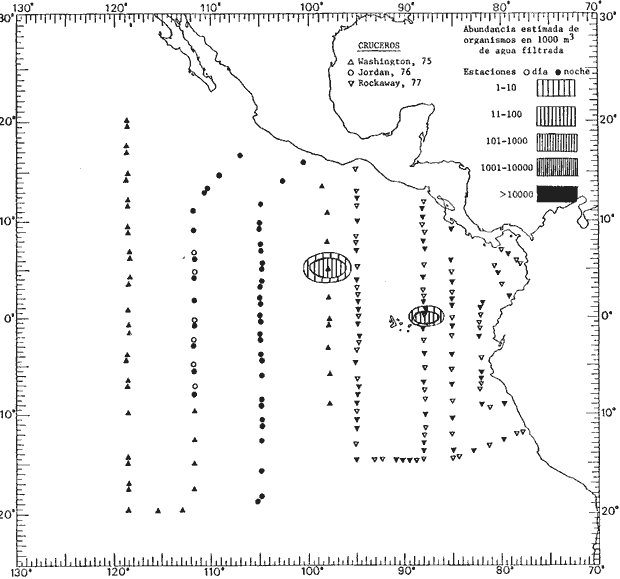 Fig. 198. Distribución general de Halitholus intermedius (Browne, 1902), en el Pacífico Tropical Oriental durante el quinto periodo bimestral (Febrero-Marzo 1968). 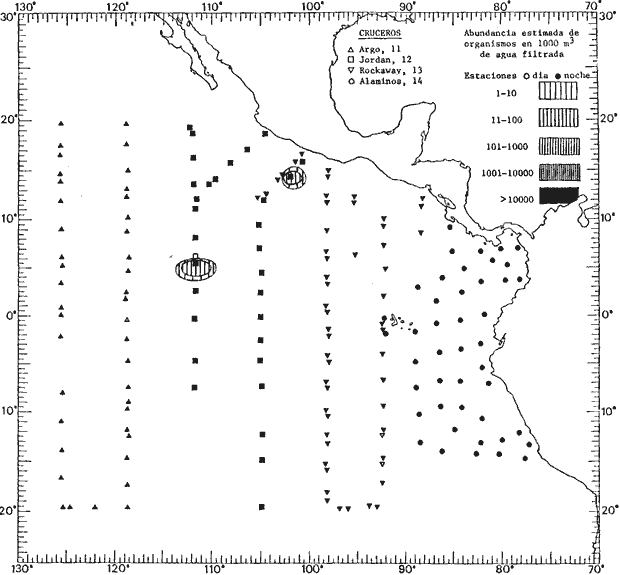 Fig. 199. Distribución general de Halitholus pauper Hartlaub, 1913, en el Pacífico Tropical Oriental durante el primer periodo bimestral (Febrero-Marzo 1967). 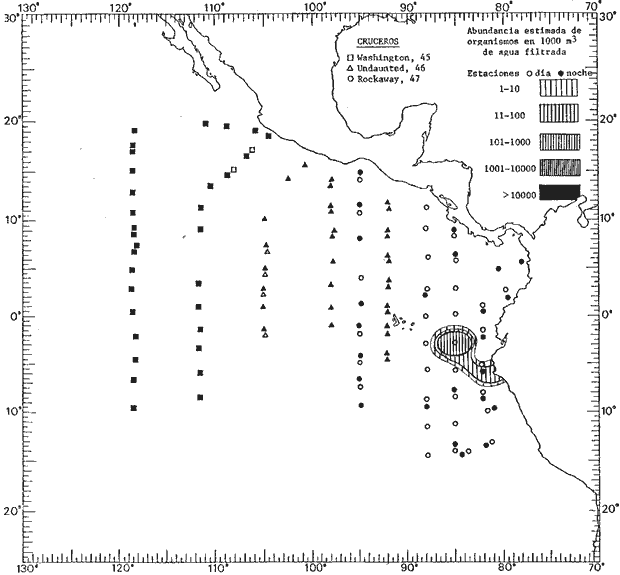 Fig. 200. Distribución general de Pochella polynema Hartlaub, 1917, en el Pacífico Tropical Oriental durante el cuarto periodo bimestral (Agosto-Sepitembre 1967). 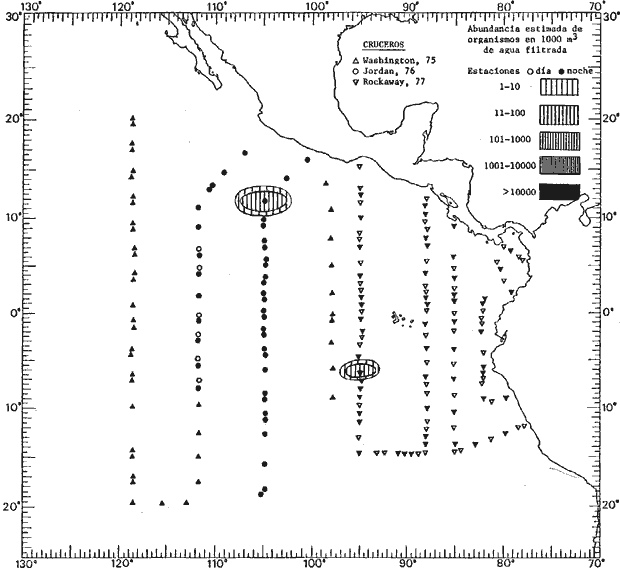 Fig. 201. Distribución general de Pochella polynema Hartlaub, 1917, en el Pacífico Tropical Oriental durante el quinto periodo bimestral (Febrero-Marzo 1968). AgradecimientosLa autora expresa sus agradecimientos a las siguientes personas e Instituciones que de una u otra forma contribuyeron al desarrollo de esta investigación la cual fue presentada como Tesis Doctoral. La Universidad Nacional Autónoma de México, brindó el apoyo y las facilidades oportunas para la realización de este trabajo. El doctor Frank Ferrari, director del Smithsonian Oceanographic Sorting Center Smithsonian Institution, proporcionó las colecciones de plancton obtenidas durante el ProyectoEASTROPAC. El señor Daniel Gettings del Southwest Fisheries Center (NOAA, NMFS), suministró el apoyo necesario durante el proceso de compilación bibliográfica. Los doctores Douglas Biggs y John Wormuth, facilitaron el equipo y las instalaciones necesarias para el desarrollo de este trabajo. Muy especialmente a la doctora Ángeles Alvarifio por su valiosa y acertada asesoría académica. Al M. en C. Juan Cifuentes Lemus, doctor Agustín Ayala-Castañares, doctor Eucario López Ochoterena,. doctora Ana Hoffmann Mendizábal, doctor Luis Rafael Segura Vernis y doctor Virgilio Arenas Fuentes, por la revisión del manuscrito y sus atinadas sugerencias. LITERATURAAGASSIZ, A.,Mem. Mus. Comp. Zool. Ham. North American Acalephae. Illustrated catalogue of the Museum of Comparative Zoology at Harvard College II.1865.1-234.(2)1 AGASSIZ, A. Y W. WOODWORRTH,Eucope. Bull. Mus. Comp. Zool. Ham.Studies from Newport Narie Laboratory. XV. Some variation in the genus.1896.121-150.(2):1 AGASSIZ, A. y W. WOODWORTHStudies from the Fiji Islands. Bull. Mus. Comp. Zool. Harv.,1896.157-189.(9):32 AGASSIZ, A. y W. WOODWORTH Mem. Mus. Comp. Zool. Harv.Reports on the scientific results of the Expedition to the Tropical pacific in charge of Alexander Agassiz by the U.S. Fish Commission Steamer Albatross, from August 1899, to March 1900. 1902. III Medusae.1902.139-176.(3):26 AGASSIZ, L. Contributions of the Natural History of the United States of America1860.1-131.3: AGASSIZ, L.Contributions to the Natural History of The United States of America1862.1-380.4: ALLMAN, G. J. Ann. Mag. Nat. Hist. Notes on the Hydroid Zoophytes.1859.48-144.4: ALLMAN, G. J. Ann. Mag. Nat. Hist.On the construction and limitation of genera among the Hydroida.1864.345-380.13: ALLMAN, G. J. A Monograph of the Gymnoblastic or Tubularian Hydroids. Ray Society1871-2.1-450 pp. ALVARADO, S. Bol. Soc. Esp. Hist. Nat.Sobre la estructura de la substancia fundamental de la mesoglea de las hidromedusas.1923a.167-173.23: ALVARIÑO, A. Bol. Inst. Esp. Ocean.Estudio del zooplancton del Mediterraneo Occidental. Campaña del "Xauen" en el verano del 1954.1957a.1-26.81: ALVARIÑO, A. Bol. Inst. Esp. Ocean.Zooplancton del Atlántico Ibérico campaña del "Xauen" en el verano del 1954.1957b.1-51.82: ALVARIÑO, A. Etude du zooplancton de la Méditerranée occidentale. Rapp. et Proc. Verb. Réun. Comm. Intern. Explor. Scient. Mer Méditerranée.1958.169-178.14: ALVARIÑO, A.Preliminary report on the Chaetognatha, Siphonophorae and Medusae the Gulf of Siam and the South China Sea. Southwest Asia Research Program. Univ. California Scripps Inst. Oceanogr.1963.104-108.63-6: ALVARIÑO, A.Preliminary results of Schipps Institution of Oceanography Investigations in the Indian Ocean 1960-1963. Report on Chaetognaths, Siphonophorae and Medusae. International Indian Ocean Expedition, SIO. Reference Number 64-191964.103-108. ALVARIÑO, A. Pacific Science Bathymetric distribution of Chaetognatha, Siphonophorae, Medusae and Ctenophorae off San Diego, California.1967.474-485.(4):21 ALVARIÑO, A. An. Inst. Biol. Univ. Nac. Autón. Méx. Ser. Cienc. del Mar y Limnol. Los Quetognatos, Sifonóforos y Medusas enla region del Atlántico Ecuatorial bajo la influencia del Amazonas.1968.41-76(1): ALVARIÑO, A. An. Inst. Biol. Univ. Nac. Autón. Mexico, Ser. Cienc. del Mar y Limnol.Zoogeografía del Mar de Cortés: Quetognatos, Sifonóforos y Medusas.1969.11-54.(1): ALVARIÑO, A. Zooplancton del Caribe, Golfo de México v regiones adyacentes del Pacífico. IV Congreso Nacional de Oceanografía Mexico1972.223-247. ALVARIÑO, A.Indicadores planctónicos: Distribución batimétrica de algunas medusas. Resúmenes II Simposio Latino-Americano de Oceanografía Biológica, Venezuela1975.7-8. ALVARIÑO, A. El zooplancton de la región de la América Central en el Pacífico. III Simposio Latino-Americano sobre Oceanografía Biologica. El Salvador.1976.1-47. ALVARIÑO, A. El plancton del Pacífico Ecuatoriano. IV Simposio-Latino-Americano sobre Oceanografía Biológica, Guayaquil, Ecuador.1977. ALVARIÑO, A. The Medusae of the California Current Region. CalCOFI monthly cruises of 1954 and 1958. California Cooperative Oceanic Fisheries Investigations. Atlas (en prensa).198- ASHLEY, C. C. y E. B. RIDGWAY.NatureSimoultaneous recording of membrane potential, calcium transient and tension in single muscle fibres.1968.1168-1169.219: BABNIK, P. Acta Adriat.Hydromedusae from the middle and South Adriatic 1939 and 1940.1948.1-68.(9):3 BAL, D. V. y L. B. PRADHAN, J. Univ. Res.Records of zooplankton in Bombay waters during 1944-47.1952.525-559.(5):16 BARHAM, E. G. y G. V. PICKWELL, Deep-Sea Res.The giant isopod Anuropus: a Scyphozoan symbiont.1969.525-559.(5):16 BARNES, W. P. P. y G. A. HORRIDGE, J. Exp. Biol. A neuropharmacological active substance from jellyfish ganglia.1965.257-267.42: BENNETT, E. B.,Inter-Amer. Trop. Tuna Comm., Bull.Monthly charts of surface salinity in the Eastern Tropical Pacific Ocean.1966.3-33.(1):11 BERNARD, F. Bull. Inst. Oceanogr. Monaco,Densité du plancton vu au large de Toulon depuis la Bathyscaphe F.N.R.S. III.1955a.1-16.1963: BERNARD, F. Bull. Inst. Océanogr.Etude préliminaire quantitative de la répartition saisoniere du Zooplancton de la baie d'Alger.Monaco.1955b.1-28.1065: BERRILL, N. J. Biol. Bull. Form and growth in the development of a Scyphomedusa.1949.283-292.(3):96 BERRILL, N. J. Quart. Rev. Biol.Development and medusa-bud formation in the Hydromedusae.1950.292-316.(3):25 BIGELOW, H. B. Bull. Mus. Comp. Zool. Harv. Medusae from the Maldive Islands.1904.245-269.(9):39 BIGELOW, H. B. Mem. Mus. Comp. Zool. Harv.Reports on the scientific results of the Expedition to the Eastern Tropical Pacific of "Albatross", from October, 1904 to March 1905.19091-245.37: BIGELOW, H. B. Proc. U.S. Nat. Mus. Medusae and Shiphonophorae collected by the U.S. Fisheries Steamer "Albatross" in the NorthWestern Pacific, 1906.1913.1-419.44: BIGELOW, H. B.Zoology Note on the medusan genus Stomolophus from San Diego.1914.239-241.(10):13 BIGELOW, H. B. Bull. Mus. Comp. Zool. Harv.Exploration of the coast water between Nova Scotia and Chesapeake Bay, july and August, 1913, by the U.S. Fislieries schooner Grampus". Oceanopgraphy and plankton. Medusae, Siphonopliores and Ctenophores.1915.149-359.(2):59 BIGELOW, H. B. Bull. Mus. Comp. Zool. Harv.Explorations of the coast water between Cape Cod and Halifax in 1914 and 1915, by the U.S. Fisheries schooner "Grampus". Oceanography and plankton.1917.163-357.(2):61 BIGELOW, H. B. Bull. Mus. Comp. Zool. Harv.Some Medusae and Siphonophorae from the Western Atlantic.1918.365-442.(8):62 BIGELOW, H. B. Bull. U.S. Nat. Mus.Hydromedusae, siphonophores and ctenophores of the "Albatross" Philippine Expedition. Contribution to the biology of the Philippine Archipelago and adjacent regions.1919.279-362.1: BIGELOW, H. B. Bull. Mus. Comp. Zool. Harv.Exploration of the coastal watter of f the North-eastern United States in 1916 by the U.S. Fisheries schooner "Grampus".1922.85-188.(4):65 BIGELOW, H. B. Bull. U.S. Bur. Fish. Plankton of the offshore waters of the Gulf of Maine.1962.341-380.(2):40 BIGELOW, H. B. Zoologica, N.Y.Scyphomedusae from the Arcturus oceanographic Expedition.1928.495-524.(10):8 BIGELOW, H. B. Zoologica, N.Y.Plankton of the Bermuda Oceanographic Expedition. VIII. Medusae taken during the years 1929 and 1930.1938.99-189.(5):23 BIGELOW, H. B. Zoologica, N. Y.Medusae of the Templeton Crocker and Eastern Pacific ZACA Expeditions, 1936-1937.1940.281-321.(19):25 BIGELOW, H. B. y SEARS, M. Mem. Mus. Comp. Zool. Harv.Studies of the waters of the continental shelf, cape cod to Chesapeake Bay. III. A volumetric study of the Zooplankton.1939.181-378.(4):54 BIGELOW, R. P. Biol. Bull. Woods Hole A new Narcomedusa froni the North Atlantic.1909.80-82.16: BLACKBURN, M. Austr. J. marfreshw. Res.Trachymedusae anf Narcomedusae of South-East Australian waters.1955.410-428.(3):6 BODEN, B. P. y E. M. KAMPA, Ocean. Mar. Biol. Ann. Rev.Planktonic bioluminiscence.1964.341-371.2: BOECK, A. Vidensk. Medd. naturh. Foren. Kbh. Om to tilysneladende bilateralsymmetriske Hydromeduser: Dipleurosoma typica og Stuvitzii.1866.131-140.10 y 22: BÖHM, R. Jena. Z. Naturw.Helgolander Leptomedusen.1878.68-203.(5):12 BOONE, L. Bull. Vanderbill Ocean. (Mar.) Mus.Scientific results of the cruises of the yachts "Eagle" and "Ara", 1921-1928. Coelenterata. Echinodermata and Mollusca.1933.1-217.4: BOONE, L. Bull. Vanderbilt Ocean. (Mar.) Mus.The marine Algae, Coelenterata of the world cruises of the yachts "Ara-, 1928-1929 and "Alva", 1931-1932, "Alva" Mediterranean cruise, 19311. and "Alva" South American cruise, 1935. W. K. Vanderbilt, commanding.1938.27-76.7: BOWMAN, T. E., C. D. MEYERS Y S. D. HICKS, Chesapeake Science Notes on associations between Hyperiid Amphipods and Medusae in Cheasapeake and Narragansett Bays and the Niantic river.1963.141-146.(3):4 BOWMAN, T. E. y H. E. GREENER, Smithsonian Contributions to Zoology The families and genera of Hyperiidae (Crustacea: Amphipoda).1973.1-64.146: BRANDT, J. E. Rec. Act. Acad. Imp. Sci. Si. Pétersb. Prodromus descriptionis animalium ab Mertensio in orbis terrarum circumnavigatione observatorurn, fasc. I.1835.1835-75. BRANDT, J. E. Mém. Acad. Sci. St. Pétersb. Sci. Nat.Ausführliche Beschreibung der von C. 11. Mertens auf seiner Weltumsegelung beobachteten Schirmquallen. Ser 61838a.237-411.2: BRANDT, J. E. Bull. Acad. Ssa. St. Pétersb.Remarques sur quelques modifications dans Parrangement de l'ordre des Acalephes Discopliores ou Ombrelliferes.1938b.185-191.(24):1 BROCH, H. Rep. Sars N. Atl. Deep. Sea Exped.Scyphomedusae from the Michael Sars" North Atlantic Deep Sea Expedition 1910.1914.1-24.(1):3 BROCH, H. Nord. Plankt., Hoja Craspedote Meduse. Teil II. Trachylinen (Trachymedusen und Narcomedusen).1929.481-539.21: BROOKS, W. K. Mem. Boston Soc. Nat. Hist.The life history of the Hydromedusae.1886.359-430.(12):3 BROWNE, E. T. Proc. Zool. Soc. Lond.On British hydroids and medusae.1896.159-500.1896: BROWNE, E. T. J. Mar. Biol. Assoc. U.K.On keeping medusae alive in a aquarium.1898.176-180.(2):5 BROWNE, E. T. Ann. Mar. Nat. Hist.A preliminary report on Hydromedusae from the Falkland Islands.1902.272-284.(7):9 BROWNE, E. T. Fauna and geography of the Maldive and Laccadive Archipelagoes.Hydromedusae, with a revision of the Williadae and Petasidae.1905a.242-219.(3):2 BROWNE, E. T. Rep. Pearl. Fish. Manaar.Report on the medusae collected by Professor Herdman at Ceylon, 1902.1905b.131-166.27: BROWNE, E. T. Trans. Linn. Soc. Lond. (Zool.)Biscayan se of H.M.S. Research, 1900. Part IX. The Medusae.1906.163-187.(2):10 BROWNE, E. T. Nat. Antarct. Exped., 1901-1901. Nat. Hist.,Coelenterata V. Medusae.1910.1-62.5: BROWNE, E. T. Trans. Linn. Soc. LondonMedusae from the Indian Ocean.1916.160-210.(2):17 BROWNE, E. T. y P. L. KRAMP, Discovery ReportsHydromedusae from the Falkland islands.1939.265-322.18: BRÜCKNER, E. Z. wiss. Zool.Beitrag zur Kenntnis von Perigoniniris cidaritis Weismann und Gemmaria Implexavar. neapolitana Hargitt.1914.445-505.Bd. III: BUSCH, W. Beobachtungen über Anatomic und Entwickelung einiger wirbellosen ScethiereBerlin.1851.1-43. CAMPBELL, R. D. Pacific Science. Host specificity. setting, and metamorphosis of the two tentaeled Hydroid Probos cidactyla flavicirrata.1968.336-339.(3):22 CAMPBELL, R. D. "Reproduction in marine in vertebrates"Cnidaria. (Giese and Pearse Eds.)1973.133-199.Vol. I CANDELAS, A. Bull. Soc. portug. Sci. Nat.Estudos de plancton tia Baia de Sesimbra.1930.11-72.(3):2 CANDELAS, A. Mem. Mus Zool. niv. CoimbramContribuicao para o conhecimento dos Coelenterados planctonicos das costas portuguesas. Ser. I1932.1-11.57: CARVALHO, J. de P. Rev. Ind. anim. Sao Paulo.Ocorrencia do genero Liriope, no plancton marinho de Santos e Sao Vicento.1941.105-11.4: CHAMISSO, A. y EYSENHARDT. C. G. Nova Acta Phys. Med. Acad. Caesar. Leopold. Carol. Cur. De animalibus quibusdam e elasse vermium Linneana, in circumnavigatione terrae. (1815-18). Fasc. 2.1821.345-374(2):5 CHAPMAN, D. M. Zool. Soc., LondonEvolution of the Scyphistoma. Symposia1966.51-75.16: CHAPMAN, D. M. J. Mar. Biol. Ass. U.K.Structure, histochemistry and formation of the podocyst and cutiele of Aurelia aurita.1968.187-208.(1):48 CHÁVEZ, E. A. Estudio ecológico parcial de un sistema esturiano en la costa oriental de México. Tesis Profesional Esc. Nal. Cienc. Biol. IPN.México1966.65 pp. CHIU, S. T. Acta Zool. Sinica Studies on the zooplnkton of Amoy Harbour. I. Hydromedusae.1954a.41-48.6: CHIU, S. T. Acta Zool. Sinica.Studies on the medusa fauna of South-Easter China Coast, with notes on their geographical distribution.1954b.49-57.(1):6 CHOW, T. H. y HUANG, M. C, Acta Zool. Sinica. A study on Hydromedusae of Chefoo.1958.173-191.10: CHU, G. W. T. C. y C. E. CUTRESS, Proc. Hawaii. acad. Sci.Human dermatitis caused by marine organisms in Hawaii.1954.929: CORMIER, M., J. K. HORI y J. M. ANDERSON, Biochim. Biophys. Acta Bioluminiscence in Coelenterates.1974.137-161.346: CORRINGTON, J. D. Biol. Bull.Comensal association of a spider crab and a medusa.1927.346-350.(5):53 COWLES, R. P. Bull. U.S. Bur. Fish.A biological study of the offshore waters of Chesapeake Bay.1930.277-381.46: CROWELL, S. Proc. Indiana Acad. Sci.The polyp stage of Craspedacusta.1951.309.60: DAHL, E. Nature The Amphipod, Hyperia ralba, an ec toparasite of the jelly-fisb. Cyanea capillata.London1959.1749.(4377):183 DAHL, E. SarsiaThe association between young whiting, Gadus merlangus and the jellyfish Cyanea capillata.1961.47-55.3: DAKIN, W. J. y A. COLEFAX, Proc. Linn. Soc. N.S.W.The marine plankton of the coastal waters of New South Wales. I. The chief planktonic forms and their seasonal distribution.1933.186-222.58: DAWYDOFF, C. Bull. soc. Zool. Fr.Observations sur la faune pálagique des caux indochines de lit mer de Chine meridionale.1936.461-484.61: DEEVEY, G. B. Bull Bingham. Ocean. Coll.A survey of the zooplankton in Block Island Sound, 1943-6.1952a.65-119.(3):13 DEEVEY, G. B. Bull. Bingam. Ocean. Coll. Quantity and composition of the zooplancton of Block Island Sound, 1949.1952b.120-164.(3):13 DELAP, M. J. Fisheries, IIreland, Sci. Invest.Notes on the rearing, in an aquariuni, of Aurelia aurita L. and Pelagia perla (Slabber).1907.22-26.7: DICK, J. Glasga. Nat. Elyde Anthomedusae.1919.91.8: DUNBAR, M. J. Canad. J. Res. Marine macroplankton from the Canadian Eastern Arctic. II. Medusae, Siphonophora, Ctenophora, Pteropoda and Chaetognatha.1942.71-77.(3):20 ESCHSCHOLTZ, F. System der Acalephen. Eine ausfurliche Beschreibung aller medusenargigen Stralilthiere,Berlin.1829.1-190, FAGETTI, E. Rev. Biol. mar. Medusas de aguas Chilenas.Valparaiso1973.31-75.(1):15 FEWKES, J. W. Bull. Mus. Comp. Zool. Harv.Studies of the jelly-fishes of Narragansett Bay.1881.141-182.(8):8 FEWKES, J. W. Bull Mus. Comp. Zool. Harv. Notes on Acalephes from with a description of new genera and species.1882a.251-289.(7):9 FEWKES, J. W. Bull. Mus. Comp. Zool. Harv.On the Acalephae of the cast coast of New England.1882b.291-310.(8):9 FEWKES, J. W. Amer. Nat. On a few California Medusac.1889.591-602.(271):23 FISH, C. J. Bull. U.S. Bur. Fish.Seasonal distribution of the plankton of the Woods Hole region.1926.91-179.41: FISHER, R. L. y RAIT, R. W, Deep-Sea Res.Topography and structure of PeruChile Trench.1962.423-443.(5):9 FOERSTER, R. S. Contr. Cand. Biol. The Hydromedusae of the west coast of North America, with special reference to those of the Vancouver Island region.1923.219-277.(12):1 FORBES, E. Ann. Mag. Nat. Hist. 0n the pulmograde medusae of the British seas. Ser. I1846.284-287.18: FORBES, E. A monograph of the British naked-eye Medusae. Ray Society,London1848.1-104. FORSKAL, P. Description animalium avium, amphibiorum, piscium, insectorum; quae in itinere oriental observavit Petrus Forskal, Hauniae.1775.164 pp. FRANC, A. Bull. Lab. Marit. Dinard Le Zooplancton de la région de DinardSaint-Malo.1951.25-40.34: FRASER, J. H. Ann. Biol. Copenhague Plankton in Scotish waters.1948.43.3: FRASER, J. H. Ann. Biol. CopenhaguePlankton investigations from Scotish Research Vesseis.1950.91-99.6: FRASER, J. H. Ann. Biol. CopenhagueInvestigations from Scotish Research Vessels.1952a.32-35.8: FRASER, J. H. Ann. Biol. Copenhague Scottish plankton investigations, 1951.1952b.104-105.8: FRASER, J. H. Ann. Biol. CopenhagueInvestigations from Scotish Research Vessels in 1953.1954a.31.10: FRASER, J. H. Ann. Biol. CopenhagueZooplankton collections made by Scottish Research Vessels during 1953.1954b.99-101.10: FRASER, J. H. Mar. Res. Scot. The plankton of the waters approaching the British Isles in 1953.1955.1-7.1: FRASER, J. H. Ann. Biol. Copenhague, Scottish plankton investigations.1956.26-27.11: FRASER, J. H. y A. SAVILLE, Ann. Biol. CopenhagueMalcroplankton in the Faeroe Channel, 1948.1949a.29-30.5: FRASER, J. H. y A. SAVILLE, Ann. Biol. CopenhaguePlankton distribution in Scottish and adjacent waters in 1948.1949b.61-64.5: GANAPATI, P. N. y R. NAGABHUSHANAM, Mem. Ocean. Andhra. Univ. Ser. 62,Seasonal distribution of the Hydromedusae off the Visakhapatnam coast.1958.91-99.2: GEGENBAUR, C. ... z. wiss. Zool.Versuch eines Systemes der Medusen, mit Beschreibung neuer oder weníng gekannter Formen; zugleich ein Beitrag1856.202-273.Bd. 8: GEORGE, P. C. J. Zool. Soc. The marine plankton of the coastal waters of Calicut with observations on the bydrobiological conditions.India1953.76-107.(1):5 GILL, T. N. Nature On the kinds of fish which are found associated with Medusae.London1877.362.(409):16 GOETTE, A. S. B. preuss. Akad. Wiss. Verzeichniss der Medusen welche von Dr. Sander auf S.M.S. "Prinz Adalbert" gesammelt wurden.1886831-837.7: GROBBEN, K. Sitzber. Akad. Wiss. Wien, Math. Nat. Kl., Arbeiten aus dem zoologish-vergleichendanatomischen Institute der Universtät Wien. 11. Über Podocoryne carnea Sars.1875.455-486.72: GROBBEN, K. Anz. Akad. Weiss. WienAdriatic Medusae collected by S. M. S. "Najade".1915.2-5.52: GUNTHER, R. T. Ann. Mag. Nat. Hist.Report on the Coelenterata from the intermediate waters of the North Atlantic, obtained by Mr. George Murray during the cruise of the "Oceana" in 1898. Ser. 71903.420-430.11: GUTSELL, J. S. Ecology The spider crab. Libinía dubia, and the jellyfish, Stomolophus meleagris, found associated at Beaufort, North Carolina.1928.358-259.(3):9 HLECKEL, E. Jena Z. Naturw. Beschreibung neuer Craspedoten Medusen aus dem Golfe von Nizza.1864.325-342.1: HLECKEL, E. Monatsber. Königl. Akad. Wiss.Über eine neue form des Generationswechsels be¡ den Medusen und über die Verwandschaft der Geryoniden und Aeginiden.Berlin1865.85-94. HLECKEL, E. Das System der Medusen. Esrter Theil einer Monographie der Medusen.Jena.1879.360 pp. HLECKEL, E. System der Acraspeden. Zweite Hälfte des System der Medusen.Jena.1880.361-672. HLECKEL, E. Rep. Sci. Res. Challenger (Zoology),Report on the deep-sea medusae dredged by H.M.S. Challenger during the years 1873-1876.1881.1-154.4: HALSTEAD, G. Poisonous and venomous marine animals of the world. Govern. Printing office,Washington, D. C.1966-1968.pages 1994, 1-1070 y 1-1006. 3 Vols. HAND, C. Pacific Science. A study of the structure, affinities, and distribution of Tetraplatia volitans Busch (Coelenterata: Hydrozoa: Ptermedusae).1955.332-348.(3):9 HANITZSCH, P. Mitt. Zool. Stat. Neapel.Der Entwicklungskreislauf von Cunina parasitica Metschn.1911.204-250.20: HANITZSCH, P. Verh. dtsch. Zool. Ges. Bemerkungen zur Entwicklung der Narcomedusen.1912.281-309.22: HARBISON, G. R., D. C. BIGGS y L. P. MADIN, Deep-Sea Res. The associatíons of Amphipoda Hyperiidae with gelatinous zooplankton. II. Association with Cnidaria, Ctenopliora and Radiolaria.1977.465-488.24: HARGITT, C. W. Biol. Bull. Variation among Hydromedusae.1901.221-255(5):2 HARGITT, C. W. Mitt. Zool. Stat. Neapel.Notes on some Hydromedusae from the Bay of Naples.1904.553-585.16: HARGITT, C. W. J. Exp. Zool.Variations among Scyphomedusae.1905.547-584.(4):2 HARGITT, C. W. Biol. Bull. Woods HoleNotes on a few Coelenterates of Woods Hole.1908.95-120.(2):14 HARGITT, C. W. y G. T. HARGITT, J. Morph.Studies in the development of Scyphomedusae.1910.217-262.(2):21 HARTLAUB, C. Wiss. Meeresuntersuch. (N.F.)Die Coelenteraten Helgolands.1894.161-206.1: HARTLAUB, C. Nord. Plankt.Craspedote Medusen, Teil. I. Lief. I. Codoniden und Eladenemiden.1907.1-135.6: HARTLAUB, C. Zool. Anz. Über Thaumantias pilosella Forbes und die neue Lafoëiden-Gattung Cosmetira.1909a.82-89.34: HARTLAUB, C. Zool. Jb., Abt. Syst., Über einige von Ch. Gravier in Djibouti gesammelte Medusen.1909b.447-476.27: HARTLAUB, C.Médises. Crois. Océanog. Belgíca Mer du Gronland (1905),Bruxelles.1909b.463-482. HARTLAUB, C. Nord. Plankt., Hoja Craspedote Medusen. Parte I. Hoja 2: Margelidae.1911.137-235.15: HARTLAUB, C. Nord. Plankt., Hoja Craspedote Medusen. Teil. I. Lief. 3: Tiaridae:1913.237-363.17: HARTMAN, O. y K. O. EMERY, Limnol. Ocean.Bathypelagic Coelenterates.1956.304-312.(4):1 HEDGPETH, J. W. Fish. Bull. U.S.Sciphozoa. Gulf of Mexico, its origin, waters and marine life.1954.277-278.55: HERRING, P. J. "Bioluminiscence in action"Bioluminiscence of invertebrates other than Insects. (P. Herring Ed.)Academic Press, New York.1978.199-240. HERTWIG, O. y R. HERTWIG, Das Nervensystem und die Sinnesorgane der MedusenLeipzig.1878.1-189 HEYMANS, C. y A. R. MOORE, C.R. Soc. Biol.Action des ions sur la luminiscence et les pulsations de Pelagia noctiluca.Paris1923.430-432.89 HINCKS, T. A history of the British Hydroid, Zoophytes.John van Voorst.London1868.328 pp.Vols. I y II. HORRIDGE, G. A. Quart. J. Micro. Sci.The nervous system of the ephyra larva of Aurelia aurita.1956a.59-74.97 HORRIDGE, G. A. J. Exp. Biol. The nerves and museles of medusae. V. Double innervation in Scyphozoa.1956b.366-383.33: HORRIDGE, G. A. J. Exp. Biol. The nerves and museles of medusae, VI. The rhythm.1959.72-91.31: HOVASSE, R. Bull. Biol. Fr., Belg.Deux peridiniens parasites convergents.1935.59-85.69: HURÉ, J. Acta Adriat.Distribution annuelle verticale du zooplancton sur une station de l'Adriatique méridionale.1955.24-29.(7):7 HYMAN, L. H. The Invertebrates. Protozoa through Ctenophora. Mc Graw-Hill Book, Co. New York1940.365-538.Vol. I. HYMAN, L. H. Trans Amer. Micros. Soc. Two new Hydromedusae from the Califronia coast.1947.262-268.(3)66 JOHNSON, F. y O. SHIMOMURA, Enzimatic and nonenziniatic bioluminiscence. In "Photophysiology" (A. Giese Ed.),Academic Press.New York.1972.275-334.7: KELLY, M. G. y P. PETT,Bioluminiscence in the ocean In "Bioluminiscence in action" (P. Herring ed.), Academic Press. New York.1978.399-417. KNAUSS, J. A. J. Geophys. Res. The structure of the Pacific Equatorial Countercurrent.1961.143-155.(1):66 KISHINOUYE, K. Zool. Anz. A new medusae from the California coast.1899.44-45.Bd. 22: KISHINOUYE, K. J. Coll. Sci. Tokyo Some medusae of Japanese waters.1910.1-35.(9):27 KÖLLIKER, A. Z. Wiss. Zool. Gegenbaur, Kolliker y Müller, 1953; Berich. über einige im Herbst 1852 in Messina angestellte vergleieliende-anatomische Undersuchungen.1853.299-370.(3-4):4 KOMAI, T. Annol. Zool. Jap. On the hydroid stage of Cytaeis japonica Uchida.1931.255-258.(7):13 KOMAI, T. Mem. Coll. Sci. Kyoto (B)On Stephanoscyphus and Neusithoë.1935.289-339.10: KOMAI, T. Mem. Coll. Sci. Kyoto (B)On another form of Stephanoscyphrus, found in the waters of Japan.1936a.175-183.11: KOMAI, T. Zool. Mag. Tokyo On the peculiar scyphopolyp Stephano cyphus.1936b.535-544.48: KOMAI, T. Annot. Zool. Jap., The nervous system in some coelenterate types. 2. Ephyra and Scyphula.1942.25-29.(2):21 KOMAI, T. Amer. Nat.Phyllotaxis-like arrangement of organs and zooids in some medusae.1951.75-76.85: KOMAI, T. e I. YAMAZI, Annot. Zool. Jap.The asexual reproduction of the Hydromedusa Gastroblasta chengshanensis.1944.105-108.(5):22 KOMAI, T. e I. YAMAZI, Annot. Zool. Jap. Order found in the arrangement of organs KRAMP, P. L., 1913. Medusae collected by the "Tjalfe" and zooids in some medusae.1945.1-7.(1):23 KOMAI, T. e I. YAMAZI, Vidensk. Meed. dansk. Naturh. Foren Kbh. Expedition (In Greenland waters).257-286.65: KOMAI, T. e I. YAMAZI,Meduser of Siplionophorer. aCtalogue of the Medusae and Siphonophora of Greenland.1914.381-456.23: KOMAI, T. e I. YAMAZI, Danish Ingolf Expedition,Medusae. Part I Leptomedusae.1919.1-111.(8):5 KOMAI, T. e I. YAMAZI,Rep. Danish Ocean. Exped. Medit.Medusae.1924.1-67.2: KOMAI, T. e I. YAMAZI, Danish Ingolf Expedition.Medusae. Part. II. Onthomedusae.1926.1-102.(10):5 KOMAI, T. e I. YAMAZI, K. danske vidensk. Selsk.The Hydromedusae of the Danish waters.1927.1-291.1: KOMAI, T. e I. YAMAZI, Vidensk. Medd. dansk Naturh. Foren. Copen. Papers from Dr. Mortensen's Pacific expedition 191416. Hydromedusae anda Anthomedusae.1928.27-62.85: KOMAI, T. e I. YAMAZI, Mém. Mus. Hist. Nat. Belg.Hydromedusae collected in the South-Western part of the North Sea and in the Eastern Part of the Channel in 19031914.1930.1-55.45: KOMAI, T. e I. YAMAZI, Nord. Plankt., HojaCraspedote Medusen, Teil 3. Leptomedusen.1933.541-602.22: KOMAI, T. e I. YAMAZI, Nat. Verd. "Blaa Vandmoend" i Kattegat i Somme ren 1936.1937.163-173.21: KOMAI, T. e I. YAMAZI, The Zoology of Iceland,Medusae, Shiphonophora and Ctertophora.1939.1-37.(5):5 KOMAI, T. e I. YAMAZI,Medusae. The "Godthaab" Expedition 1928 Medd. Gronland,1942.1-168.(1):81 KOMAI, T. e I. YAMAZI,The Zoology of East Greenlad. Medusae, Siphonophora and Ctenophora. Medd. Gronland,1943.1-20.(12):121 KOMAI, T. e I. YAMAZI, Danish Ingolf Expedition,Medusae. Part III. Trachylina and Scyphozoa, with, zoogeographical remarks on all the medusae of the Northern Atlantic.1947.1-66.(14):5 KOMAI, T. e I. YAMAZI, Further Zool. Res. Swed. Antarct. Exp.Medusae collected by the Swedish Antarctic Expedition 1901-3.1948a.1-16.(1):4 KOMAI, T. e I. YAMAZI, Rep. Sars. N. Atl. DeepSea Exped.Trachymedusae and Narcomedusae from the "Michael Sars" North Atlantic Deep-Sea Expedition 1910 with additions on Anthomedusae, Leptomedusae and Scyphomedusae.1948b.1-23.(9):5 KOMAI, T. e I. YAMAZI, Acta Univ. Lund., N. F. Aud. 2.Reports on the Lund University Chile Expedition 1948-49. 2. Medusae collected by the Lund University Chile Expedition 1948-49.1952.1-19.47, 7; KOMAI, T. e I. YAMAZI, Sco. Rep. Gr. Barrier Reef Exped.Hydromedusae.1953.259-322.(4):6 KOMAI, T. e I. YAMAZI, Atlantide ReportThe Medusae of the tropical west coast of Africa.1955a.240-324.1: KOMAI, T. e I. YAMAZI, Deep.-Sea Res.A revision of Ernest Haeckel's determinations of a collection of medusae beloging to the Zoological Museum of Copenhagen.1955b.149-168.(4):3 KOMAI, T. e I. YAMAZI,Vidensk. Medd. dansk Naturh. Foren. Copen. Medusae collected in the Eastern Tropical Pacific by Cyril Crossland in 1924-1925.1956.1-6.118: KOMAI, T. e I. YAMAZI,Hydromedusae from the Discovery lections. Discovery Reports,1957a.1-12829: KOMAI, T. e I. YAMAZI, Antarct. Res.. B. Medusae. B.A.N.Z.1957b.151-164.(8):6 KOMAI, T. e I. YAMAZI, Vidensk. Medd. dansk naturh. Foren. Kbh. Some Mediterranean Hydromedusae collected by A.K. Totton in 1954 and 1956.1958a.115-128.119: KOMAI, T. e I. YAMAZI, Rec. Indian Mus.Hydromedusae in the Indian Museum.1958b.339-376.53: KOMAI, T. e I. YAMAZI,Dana Rep. The Hydromedusae of the Atlantic Ocean and adjacent waters.1959a.3-283.46: KOMAI, T. e I. YAMAZI, Mém. Inst. Sci. Nat. Belg.Medusae, mainly from the west coast of Africa.1959b.1-33.(6):3 KOMAI, T. e I. YAMAZI, Vidensk. Medd. dansk Naturh. Foren. Copen. Some new and little-known Indo-Pacific Medusae.1959c.223-259.121: KOMAI, T. e I. YAMAZI, J. Mar. Biol. Ass. U.K.Synopsis of the Medusae of the world.1961.1-469.40: KOMAI, T. e I. YAMAZI, Pacific ScienceNotes on some Eastern Pacific species of Phialidium (Leptomedusae).1962.25-29.(1):16 KOMAI, T. e I. YAMAZI, Dana Rep. The Hydromedusae of the Pacific and Indian Oceans. Sec. I.1965.1-162.63: KOMAI, T. e I. YAMAZI, Vidensk. Medd. dansk Naturh. Foren. Copen. A collection of Medusae from the coast of Chile.1966.1-38.129: KOMAI, T. e I. YAMAZI, Dana Rep. The Hydromedusae of the Pacific and Indian Ocean. Sections II and III.1968.1-200.(72):13 KROHN, A. Arch. Naturgesch. Über die Natur des Kuppelförmigen Anhages am Leibe von Phyllirrhoë bucephalum.1853.278-281.Bd. 19: LAMARCK, J. Historie naturelle des animaux sans vertebres.Paris.1816.1815-1822.2: LAWLES, E. Nature On a fish-sheltering medusa.London1877.227.(403):16 LEBOUR, M. V. J. Mar. Biol. Ass. U. K.Medusae as hosts for larval Trematodes.1916a.57-59.(1):11 LEBOUR, M. V. J. Mar. Biol. Ass. U.K., Notes on the life history of Anaphia petiolata1916b.51-56.(1):11 LE DAONIS, E. Bull. Soc. Zool. Fr.Coelentérés du plankton recueillis pendant la croisiere d'été 1913 par le yacht "Pourqoi-Pas?" sous le commandemente du D. Jean Charcot.Paris.1913.282-31538: LEGENDRE, R. Ann. Inst. Océan. La faune pálagique de l'Atlantique au large de Gascogne, recueillie dans des estomacs de Germons. III. Invertébrés.Paris1940.140-148.(4):20 LELE, S. H. y P. B. GAE, J. Univ. Bombay Some common Hydromedusae of the Bombay harbour.1935.90-101.(5):3 LELE, S. H. y P. B. GAE, Histoire Naturelle des Zoophytes. Acalephes.Paris.1843.596 pp. LEUCKART, R. Arch. Naturgesch., Jahrg.Beiträge zur Kenntniss der Medusenfauna von Nizza.1856.1-40.Bd. 1: LING, S. W. Peking Nat. Hist. Bull.Studies on Chinese Hydrozoa. I. On some Hydromedusae from the Chekiang coast.1937.351-365.(4):2 LINKO, A. Trav. Soc. Nat. St. Pétersb.Observations sur les méduses de la Mer Blanche.1900.137-156.29: LINNÉ, C., Systema Naturae, Edit. 10, reformata. and 2 Holmiae.1758.Vols. 1 LOVE. C. M. (editor), US. Dep. Comm. Natl. Mar. Fish. Serv. Circular 330.EASTROPAC Atlas Vols. 1, 2, 3, 4, 5, 6, 7, 8, 9. 10 y 11. Washington, D.C.1970-1977. LUBET, P. Bull. Soc. Sci. Arcachon, N.S.Variations saissonieres du zooplancton du bassin d'Arcachon.1954.204-216.6: MANN, G. Y ZOPFF., H. Invest. Zool. Chil., Fasc.Stauroelaria hodgsoni, nueva niedusa para Chile.1950.7-8.2: MAAS, 0. Ergebn. Atlant. Plankton Exped., Die Craspedoten Medusen der Planckton-Expedition.1893.1-1072: MAAS, 0. Mem. Mus. Com. Zool. Harv.Die Medusen. Reports on an exploration off the west coast of Mexico. Central and South America, and off the Galápagos Islands by the U.S. Steamer "Albatross" during 1891.1897.9-92.(1):23 MAAS, 0. Siboga-Expedite, X. Leiden, Die Craspedoten Medusen der Siboga-Expedition.1905.1-84.6: MAAS, 0. Abh. Bayer. Akad. Wiss., MathPhysik Cl.,Japanische Medusen.1909.1-52.1: MAGHRABY, A. M. y E. J. PERKINS, Ann. Mag. Nat. Hist., Ser. 12Additions to the marine fauna of Whistable.1956.481-486.9: MANSUETI, R. Copeia Symbiotic behaviour between small fishes and jelly-fishes with new data on that between the stromatoid, Peprilus alepidotus and scyphomedusa, Chrysaora quinquecirrha.1963.40-80.1: MARSHALL, S. M., Proc. roy Soc. Edinb.A survery of Elyde Plankton.1925.117-141.45: MAYER, A. G. Bull. Mus. Comp. Zool. Harv. Some medusae from the Tortugas, Florida.1900.13-82.(2):37 MAYER, A. G. Mem. Nat. Sci. Brooklyn1-33(1):1 MAYER, A. G. Medusae of the world Vols. I, II y III,Carnegie FoundationWashington, D.C.1910.735 pp. MAYER, A. G. Effects of temperature on tropical marine animals. Pap. Tortugas Lab.1914.1-24.183: MAYER, A. G. Pap. Tortugas Lab.Medusae of the Philippines and of Torres Straits. Being a report on the Scypromeduse collected by the U.S. Fisheries Bureau steamer "Albatross" in the Philippines Island and Malay Archipelago, 1907-1910, and upon the medusae collected by the expedition of the Carnegie Institution of Washington to Torres Straits, Australia, in 1913.1915.157-202.8: MAYER, A. G. Bull. U.S. Nat. Mus.Report upon the Scyphomedusae collected by the U.S. Bureau of Fisheries steamer "Albatross" in the Philippine Islands and Malay Archipelago.1917.171-233.100: McCRADY, J. Proc. Elliot Soc. Nat. Hist.Gymnophthalmata of Charleston Harbour.1857.103-221.1: MENON, K. S. Rec. Indian Mus. A preliminary account of the INIadras Plankton.1931.489-516.33: MENON, M. A. S. Proc. Indian Acad. Sci.Observations on the seasonal distribution of the plankton of the Trivandrum cotts.1945.31-62.(2):22b MENON, M. G. K. Bull. Madras Goul. Mus.The Scyphomedusae of Madras and the neighbouring coast.1930.1-28.(1):3 MENON, M. G. K. Bull. Madras Govt. Mus., N.S.. Nat. Hist. Sect., The Hydromedusae of Madras.1932.1-32.(2):3 METSCHNIKOFF, E. Z. Wiss. Zool.Vergleichend-embryologische Studien.1881.433-444.Bd. 36: METSCHNIKOFF, E. Arb. Zool. Inst. Univ. WienMedusoloische Mittheilungen.1886.237-266.6: MODEER, A., Nova Acta Phys. Med. Acad. Leopold Carol. Nat. Gur. Tentamen systematis medusarum stabiliendi.1791.19-34.8: MOORE., H. B.. Bull. Bingham Ocean. Coll.The zooplankton of die upper waters of the Bermudad area of the North Atlantic.1949.1-97.(2):12 MORIN, J. G. y J. W. HASTINGS, J. Cell. Physiol.Biochemistry of the bioluminiscence of colonial Hydroids and other Coelenterates.1971.305-311.(3):77 MÜLLER, J. Arch. Anal. Physiol, Lpz.,Übereine eigntümliche Medusae des Mittelmeeres und inhren Jugendzustrand.1859.272-277. MURBACH, L. y C. SHEARER, Proc. Zool. Soc.On Medusae from the coast of British Columbia and Alaska.London1903.164-192.(1):2 NAIR, K. K. Bull. Re.y. Inst. Univ. Travancore, Ser. C. Nat. Sci., Medusae of the trivandrum Coast. Part 1. Systematics.1951.47-75.(1):2 NAUMOV, D. V., Trud. Problem. Temat. Sovesh.Medusae in the far eastern waters of the Soviet Union.1956.34-41.6: NEPPI, V. akad. Wiss. Univ. Wien., Math. Nat.Adriatische Hydromedusen. S.B.1912.709-734.121: NEPPI, V. Anz. Wiss. Wien.Vorläufige Mitteilung úher die walirend der Terminfahrten auf S.M. Shiff "Najade" gesammleten, Adriatischen Medusen.1915.2-5.52: NEPPI, V. Boll. Soc. Nat. NapoliNotizia riguardante alcume idromeduse ano1919. NEPPI, V. Boll. Soc. Nat. NapoliAggiunta alla nota sopra alcune idromeduse anomale del golfo di Napoli.1920.89-91.32: NEPPI, V. y G. STIASNY, Zool. Anz.Die hydromedusen des Golfes von Triest.1911.395-399.38: NEPPI, V. y G. STIASNY,Arb. Zool. Inst. univ. WienDie hydroemdusen des Golfes con Triest.1913.23-92.20: NICOL, J. A. J. Alar. Biol. Ass. U.K.Observations on luminiscence in pelagic animals.1958.705-752.(3):37 NOBRE, A. Contribucoes para o estudo dos Coelenterados de PortgualPorto.1931.1-82 NUTTING, C. C. Bull. U.S. Fish. Comiss. WashingtonThe hydroids of the Woods Hole region.1901.325-386.19: PELL, M. Allatorv, Kozlem, BudapestHydromedusae of Hungarian Adriatic: ("Najade") Expedition 1913-1914.1918.22-32.17: PELL, M. Mah. Term. KözlemThe Hydromedusae of the Adriatic, collected by the "Najade".1938.919-930.(2):57 PÉRON, F. y C. A. LESUEUR, Ann. Mus. Hist. Nat.Histoire générale et particuliere de tous les animaux que composent la famille des Méduses.1809.312-366.14: PETERSEN, K. W., Videsk. Medd. dansk naturh. Foren. Kbh.On some medusae from the North Atlantic (Papers from the "Dana" Oceanographical coll. No. 48).1957.25-45.119: PHILLIPS, P. J., W. D. BURKE y E. J. KEENER, Trans. Amer. Fish. Soc.Observation on the tropic significance of jellyfishes in Mississippi Sound with quantitive data on the associative behavior of small fishes with meduses.1969.703-712.98: PHILLIPS, P. J., W. D. BURKE y E. J. KEENER, Trans. Amer. Fish. Soc.Observation on the tropic significance of jellyfishes in Mississippi Sound with quantitive data on the associative behavior of small fishes with meduses.1969.703-712.98: PHILLIPS, P. J. y W. D. BURKE, Bull. Mar. Sci. The ocurrence of sea waps (Cubomedusae) in Mississippi Sound and the Northern Gulf of Mexico.1970.853-859.20: PHILLIPS, P. J. The pelagic Cnidaria of the Gulf of Mexico.Tesis Doctoral.Universidad de Texas A & M1972.211 pp. QUOY, J. R. C. y J. P. GAIMARD, Ann. Sci. Nat. Paris,Observations zoologiques faites a bord de l'Astrolabe en mai 1826 dans le détroit de Gibraltar.1827.1-129.10: QUOY, J. R. C. y J. P. GAIMARD, ZoologieVoyage de 18 Astrolabe pendant 1826-29 sous le commandement de M. J. Dumont d'Urville.1833.1-390.4: RANSON, G. Bull. Mus. Hist. Nat. ParisMéduses du plankton recuielli par "La tanche" pendant sa premiere croisiere de 1923.1925a.88-92.31: RANSON, G. Bull. Mus. Hist. Nat. ParisQuelques observations sur le plankton et liste des Méduses recuillis par "La Tanche" pendant sa croisiere de 1924.1925b.379-382.31: RANSON, G. RANSON, G. Sur quelques Méduses des cotes de la Manche.1926.296-302.32: RANSON, G. Bull. Mus. Hist. Nat., Paris, Sér. 2,Revision de la collection des méduses du Muséum National d'Histoire Naturelle.1932a.988-1000.4: RANSON, G. Bull. inst Ocean. MonacoSur les méduses de la collection du Prince de Monaco. Une espece nouvelle. Aglantha krampi.1932b.1-19.593: RANSON, G. Bull. Mus. Hist. Nat., Paris, Sér. 2Revision de la collection des méduses du Muséum National d'Histoire Naturelle IV.1934a.68-77.6: RANSON, G. Bull. Mus. Hist. Nat., Paris, Sér. 2Revision de la collection des méduses du Muséum National d'Histoire Naturelle V.1934b.177-183.6: RANSON, G. Rés. cap. sci. MonacoMéduses provenant des campagnes du Prince Albert 1. de Monaco.1936.1-245.Fasc. 92: RANSON, G. Bull. Soc. Zool. Fr.Cnidactines et cnidothylacies eliez les An thoméduses.1937.318-329.62: RANSON, G. Bull. Soc. Zool. Fr., Ser. 2Les Scyphoméduses de la collection du Museum National d'Histoire Naturelle Paris. II. Catalogue raisoneé; origine des récoltés.1945.312-320.17: RANSON, G. Mém. Inst. Sci. Nat. belg., Sér. 2Resultats scientifiques des croisieres du navire école belge "Mercator" IV. 2. Méduses.1949.121-158.(33): RAO, H. S. Rec. Indian Mus. Notes on Scypohomedusae in the Indian Museum.1931.25-62.33: REES, W. J. Univ. Bergen Arb. Naturv. R.Records of hydroids and medusae taken at Herdla, Berge, in 1937.1953.1-8.16: REES, W. J. Bull. Brit. Mus. (Nal. Hist.) Zool.Evolutionary trends in the elassification of capitate hydroids and medusae.1957.453-534.4: REES, J. T. Can. J. Zool. Growth stages of the medusa of Proboscidactyla -flavicirrata Brandt, 1835 (Hydrozoa; Limnomedusae).1979.551-557.(3):57 RIES, J. V. y M. V. RIES, UmschauLichttod und Leuchten.1941.69-72.45: ROMANES, G. L. Nature The fish-sheltering medusa.London1877.248.(404):16 ROOSEN-RUNGE, E. C. Pacific ScienceOn the biology of sexual reproduction of Hydromedusae Genus Phialidium Leuckart.1962.15-24.(1):16 ROOSEN-RUNGE, E. C. Biol. Bull.Life cyele of the Hydromedusa Phialidium gregarium (A Agassiz, 1862) in the laboratory.1970.203-221.(1):139 ROSSI, L. Boll. Inst. Mus. Zool. Univ. TorinoCelenterati del Golfo di Rapallo (Riviera Ligure).1949.193-235.2: ROSSI, L. Doriana Contributo allo studio della fauna di porfondita vivente presso la Riviera Ligure di Levante.1958.1-13.(92):2 RUNNSTRÖM. S., Bergens Mus. Arbok, Eine Übersich über dar Zooplank ton des Terdla- und Hjeltefjordes.1932.1-67.7: RUSSELL, F. E. Adv. Mar. Biol.Marine toxins and venomous and poisonous marine animals.1965.255-384.3: RUSSELL, F. S. Mar. Biol. Ass. U.K.The seasonal distribution of macroplankton as shown by catches in the 2-metre Stramin ring-trawl in off-shore waters off Plymouth.1933.73-82.19: RUSSELL, F. S. Rapp. Cons. Explor. Mer.A review of some aspects of zooplankton research.1935.3-30.95: RUSSELL, F. S. J. Mar. Biol. Ass. U.K. The Plymouth offshore medusa fauna.1938.411-439.(2):22 RUSSELL, F. S. Sch. Sci. Rev.Jelly-fish. Scyphomedusae.1939.268-279.78: RUSSELL, F. S. Mar. Biol. Ass. U.K. On the nematocists of Hydromedusae.1940a.515-523.24: RUSSELL, F. S. On the hydrod of Eutima gracilis (For bes and Goosir). Ibid.,1940b.479-480.28: RUSSELL, F. S. The Medusae of the British Isles: Anthomedusae Leptomedusae, Limnomedusae, Trachymedusae and Narcomedusae.Cambridge University Press.1953.530 pp. RUSSELL, F. S. The Medusae of the British Isles. Pelagic Scyphozoa with a supplement to the first vol. on Hydromedusae.Cambridge University Press.1970.281 pp. RUSSELL, F. S. y W. J. REES, Mar. Biol. Ass. U.K. On rearing hydroid Zanelea implexa (Alder) and its medusa Zanelea gemmosa (McCrady), with a review of the genus Zanelea. 1.1936.107-130.(2):21 SARS, M., Fauna litoralis Norvagiae, Hefte1846.94.1: SCHAXEL, J. Zool. Anz. Die Oegenese von Pelagia noctiluca Pér. et Les. mit besonderer Berücksichúgung der Chromidien und Nueleolen.1910a.407-414.35: SCHAXEL, J. Fetschr. R. Herlwig, Die Eibildung der Meduse Pelagia noctica Pér. et Les. Untersuchungen über die morphologischen Bez¡ehungen der Kernubstanzen untereinander und zum Cytoplasma.1910b.167-212.1: SCHMIDT, W. J. Arch. Mikr. Anat.Mehrfaserige ("polypine") subephyteliale MuskeIzellen be¡ Hydromedusen (carmarina)1920.456-472.(1):93 SCHOTT, G. Geographie des Indischen und Stillen Ozeans. C. BoysenHamburg.1935.413 pp. SEARLE, A. E. Malay. Nat. J.. An introduction to Malayan jelly-fish.1957.67-76(3)11 SEARS, M. Fish. Bull. U.S.Hydromedusae of the Gulf of Mexico.1954.273-274.89: SEGURA, L. Proceedings of the Biological Society of Washington Two new species of Lizzia (Hydrozoa: Anthomedusae) from the Eastern Tropical Pacific.1980.515-522.(3):93 SHIMOMURA, O., F. H. JHONSON and Y. SAIGA, J. Cell. Comp. Physiol. Extraction, purification and properties of aequorin, a biolumniscent protein from the luminous Hydromedusan, Aequorea.1962.223-240.(3):59 SHIMOMURA, O., F. H. JHONSON and Y. SAIGA, J. Cell. Comp. Physiol. Extraction and properties of halistaurin, a bioluminiscent protein from the Hydromedusan Halistaura.1963.9-15.(1):62 SHIMOMURA, O. y F. H. JOHNSON, "Bioluminiscence in Progress"Partial purification and properties of the Chaetopterus luminiscence system. (Johnson and Haneda Eds.) Princeton, New York.1966.495-521. SHOJIMA, Y. Bull. Jap. Soc. Sci. Fish. Scyllarid phyllosomas habitat of accompanying jellyfish.1963.349-353.(4):29 SIGNORET, P. A. Contribución al conocimiento de las medusas de las lagunas de Tamialma y Alvarado, Veracruz. Tesis Profesional. Facultad de Ciencias, UNAM, México.1969.52 pp. SLABBER, M.Physikalische Belustigungen, oder mikroskopische Wahrenhmungen von 43 und aus ländischen Wasser und Landthierchen Nürenberg.1781. SLONIMSKY, P., C.R. Soc. Biol. Un nouveau procédé pour la mise en evidence du systeme gastro-vasculaire chezles méduses.Paris1926.926-928.95: SMITH, F. Science, N.S. Fresh-water medusae in the Panama Canal zone.1925.588-589.61: SOUSA E SILVA, E. y J. SANTOS-PINTO, Bol. Soc. portug. Cienc. Nat., Ser. 2, 0 Plancton da Bahía de S. Martinho do Porto.1949.203-241.2: SOUTHWARD, A. J. Rep. mar. biol. Sta. Port. Erin Some notes on Manx medusae.1954.17-22.66: STANTSCHEW, V. Arb. biol. Meeresst. Varna, Das Vorkommeu von Podocoryne carnea Sars in Golf von Varna und sein Verhalten ausserhalb des Wassers.1940.11-18.9: STECHOW, E. Zool. Jb., Abt. Syst.Zur Kenntnis der Hydroidenfauna des Mittelmeeres, Amerikas und anderer Gebiete, II.1923.29-270.47: STEENTRUP, J. Acta et Catalogus Musei Hafmensis. Hauniae (sin publicar).1837. STIASNY, G. Zool. Anz. Zwei neue Pelagien aus der Adria.1914.529-533.44: STIASNY, G. Zoöl. Mede. Die Scyphomedusen-SammIung des Naturhistorischen Reichsmuseums in Leiden. I. Die Carybdein (Cubomedusen).Leiden1919a.33-58.5: STIASNY, G. Zoöl. Mede. Die Scyphomedusen-SammIung des Naturhistorischen Reichsmuseums in leiden II. Stauromedusen, Coronatae, Semaestomae.Leiden1919b.66-98.5: STIASNY, G. Zöol. Mede.Ergebnisse der Nachuntersuchung einiger Rhizostomeen-Typen Haeckel's und Chun's aus dem zoologischen Musseum in Hamburg.Leiden1922.41-60.7: STIASNY, G. Vidensk. Medd. dansk Naturh. Foren. Copen..,Papers from Dr. Th. Mortensen's Pacific Expedition 1914-16. Scyphomedusae.1924.485-499.77: STIASNY, G. Zool. Med. Mitteilungen über Scyphomedusen. II. 1. Über einige Entwicklungsstadien von Rhizostoma octopus Linn. 2. Das Gefässystem der Mundarme von Rhizostoma octopus. 3. Über die Anhänge an den Mundarme von Rhizostoma octopus.1928a.177-198.11: STIASNY, G. Zool. Med. Hydromedusen aus der Java-See.1928b.206-226.11: STIASNY, G. Tijdschr. ned. dierk. Ver.Demonstration of Chirodropus gorilla, Eudendrium rameum, Eutonina (Campanulina) indicans (Romanes) syn. E. socialis Hartlaub and Zygocama buitendijki n. sp.1929.127.4: STIASNY, G. Zöol. Meded. Die Rhizostomeen-Sammlung des British Museum (Natural History) in London.1931.137-178.14: STIASNY, G. Discovery ReportsScyphomedusae1934.329-396.8: STIASNY, G. Verh. Akad. Wet. Amst.,Die Scyphomedusen der Snefflusexpedition.1935.1-44.34: STIASNY, G. Sci. Rep. Murray Exped.Scyphomedusae.1937.203-242.(7):4 STIASNY, G. Dana Rep. Die Scyphomedusen.1940.1-28.18: STUNKARD, H. W., Biol. Bull. The life-cyele and developmental stages of a digenetic trematode whose unencysted metacercarial stages accur in medusae.1967.488.(2):133 STUNKARD, H. W. Biol. Bull. The morphology and life-history on Neopechona pyriforme (Linton, 1900) n. gen., n. comb. (Trematoda: Lepocreadiidae).1969.96-113.(1):136 SVERDRUP, A. Skr. Viddenskselsk., Christ. I. mat. naturu. klasse, Planktonundersökelser fra Kristiania florden. Hydromedusen.1921.1-50.1: SZOLLOSI, D. Science Unique envelope of a jelly - fish ovum: the armed egg.1969.586-587.(3867):163 TABRATH, F. F., KASHIWAGI y T. R. NORTON, Int. J. Elin. Pharmacol. Ther. Toxicol.Antitumor activity in mice of four Coelenterate extracts.1972.420-422.(4):5 TETT, P. B., y M G. KELLY, Oceanogr. Mar. Biol. Ann. Rev.Marine bioluminiscence.1973.89-173.11: THIEL, H. Zool. Soc. London, The evolution of Scyproboa a review. Symposia1966.77-117.16: THIEL, M. E. Mitt. Zool. Mus. Hamb. Die Scyphomedusen des Zoologischen Staats Institut und Zoologischen Museums in Hamburg. I. Cubomedusen, Stauromedusen und Coronatae.1928.1-34.43: THIEL, M. E. Int. Rev. Hydrobiol. Die Hydromedusen der Weddellsee. Baiträge zur Planktonbevölkerung der Weddellsee nach, der Ergebnissen der Deutschen Antarkischen Expeditíon 1911-1912, VI.1931.305-306.25: THIEL, M. E. Fauna Arct., JenaÜbersicht über die Hydromedusen der Arktis.1932a.119-158.6: THIEL, M. E. Arch. Naturgesch. Die Hydromedusenfauna des Nördlichen Eismeeres in tiergeographischen Betrachtung.1932b.435-514.1: THIEL, M. E. Ergbn. Zool.Über die Wirking des Nesselgiftes der Quallen auf den Menschen.1935a.1-35.8: THIEL, M. E. Wiss. Ergebn. dtsch. atlant. Exped. "Meteor".Die Besiedlung des Südatiantischen Ozeana mit Hydromedusen.1935b.32-100.12: THIEL, M. E. Zool. Anz. Zur Kenntnis der Hydromedusenfauna des Schwarzen Meeres.1935c.161-174.3: THIEL, M. E. Bronns KlassenScyphomedusae.1936a.1-480.2: THIEL, M. E. Zool. Jb., Abt. Syts.Systematische Studien zu den Trachylinae, der Meteor-expedition.1936b.1-92.69: THIEL, M. E. Zool. Anzeiger. Die Leptolinae der "Meteor" Expedition in systematischer Betrachtung. I. Anthomedusen. II. Leptomedusen.1938.289-303.121: THIEL, M. E. Abh. naturu. Ver. Hamburg. N.F.Beiträge zur Kenntnis der Wachstums und Fortpflanzungsverhälnisse von Aurelia aurita L.1958.13-263: THIEL, H. Symp. Zool. Soc. LondonThe evolution of the Scyphozoa.1966.77-117.16: THOMAS, L. Nature Phyllosoma larvae associated with medusae.1963.208.198: TRINCI, G., Mitt. zool. Sta. NeapelDi una nuova specie di Cytaeis gemmante, del Golfo di Napoli.1903.1-34.16: TORREY, H. B. Univ. Calif. Publ. (zool.), The Leptomedusae of the San D¡ego region.1909.11-31.(2):6 UCHIDA, T. Jap. Jour Zool. Some Hydromedusae from northern japan.1925.77-100.1: UCHIDA, T. Jour. Fac. Sci. Imp. Univ. Tokyo Zool.Studies on japanese Hydromedusae. 1. Anthomedusae.1927.145-241.(3):1 UCHIDA, T. Jap. J. Zool. Studies on japanese Hydromedusae. 2. Trachymedusae and Narcomedusae.1928.73-79.2: UCHIDA, T. Zool. Anz.Beiträge zur Kenntnis der japanischen Hydromedusen.1930.329-335Bd. 88: UCHIDA, T. Bot. and Zool., Tokyo, Fresh-water medusae of the world.1934a.1148-1159.8: UCHIDA, T. Proc. Imp. Acad. JapanMetamorphosis of a Scyphomedusa (Pelagia panopyra)1934b.428-430.10: UCHIDA, T. Trans. Sapporo nal. Hist. Soc.Remarks on the Scyphomedusan family Pelagidae.1935.42-45.14: UCHIDA, T. Bull. biogeogr. Soc. JapanMedusae in the vicinity of the Amakusa Marine Biological Station.1938a.143-149.8: UCHIDA, T. Sci. Rep. Tohoku Univ.Report of the Biological Survey of Mutsu Bay. 32. Medusae from Mutsu Bay.1938b.37-46.13: UCHIDA, T. J. Fac. Sci. Hokkaido Univ. Ser. 6, Zool.The fauna of Akkeshi Bay. XI. Medusae.1940.277-297.7: UCHIDA, T. Jour. Fac. Sci. Imp. Univ. Ser. 6, Zool.,Some medusen from the Central Pacific.1947a.297-319.(3):9 UCHIDA, T. Jour. Fac. Sci. Imp. Univ. Ser. 6, Zool.Medusae in the vicinity of Shimoda.1947b.331-343.9: UCHIDA, T. Jour. Fac. Sci. Imp. Univ. Ser. 6, Zool.Distribution of Scyphomedusae in japanese and its adjacent waters.1954.209-219.12: UCHIDA, T. Bull. biogr. Soc. PapanScyphomedusae from the Loochoo Islands and Formosa.1955.14-16.16-19: UCHIDA, T. J. Fac. Sci. Niigata Univ., Ser. 2, Biol. Geol. and Mineral. Hydroids and Medusae from the vicinity of the Sado Marine Biological Station.1958.163-165.2: VAN BENEDEN, P. J.Mém. Acad. R. Belg.Recherches sur l'Embriogénie des Tubulaires, et l'Histoire Naturelle des différents Genres de cette Famille qui habitent la Côte d'Ostende.1844.172.17: VAN BENEDEN, P. J. Mém. Acad. R. Belg.Recherches sur la Faune Littorale de Belgique.1866.3-207.34: VALKANOV, A. Arb. Biol. Meeresst. Varna, Katalog unserer Schamarzmeerfauna.1957.1-61.19: VANHÖFFEN, E. Bibliotheca ZoologicaUntersuchungen über semäostome und rhizostorne Medusen.Stuttgart1888.1-52.(3):1 VANHÖFFEN, E. Wiss. Engebn. "Valdivia",Die Acraspeden Medusen der deutschen Tiefsee Expedition 1898-1899. -I. Trachymedusen.1902.1-52.3: VANHÖFFEN, E. Wiss. Ergebn. "Valdivia"Die Narcomedusen.1908a.41-74.19: VANHÖFFEN, E. Dtsch. Südpol. Exped. Die Lucernariden und Scyphomedusen der Deutschen Südpolar-Expedition 1901-1903.1908b.25-49.10: VANHÖFFEN, E.Wiss. Ergebn. "Valdivia"Die Anthomedusen und Leptomedusen der Deutschen Tiefsee Expedition 1898-1899.1911.191-233.(5):19 VANHÖFFEN, E. Dtsch. Südpol. Exped. Die Craspedoten Medusen der Deutschen SüdpolarExpedition 1901-1903.1912a.351-395.13 (Zool. V): VANHÖFFEN, E.Zoologica Die craspedoten Medusen des "Vettor Pisan".Stuttgart1912b.1-34.67: VANHÖFFEN, E. Zool. Jb., Suppl.Über westindische Medusen.1913.413-432.11: VANHÖFFEN, E. Beitr. Meeresfauna Westafr. Coelenterata pelagica.1920.16-17(1):3 VANNUCCI, M. Bol. Inst. Paul. Oceanogr. Hydrozoa e Scyphozoa existentes No Instituto Paulista de Oceanografía.1951a.69-100.2: VANNUCCI, M. Bol. Inst. Paul. Oceanogr. Distribucao dos Hidrozoa hecidos nas costas do Brasil.1951b.105-124.2: VANNUCCI, M. Proc. zool. Soc. Lond.Biological notes and description o[ a new species of Dipurena (Hydrozoa, Corynidac).1956a.479-487.127: VANNUCCI, M. Glasg. Nat. Notes on the Hydromedusae of the Elyde Sea arca with new distribution records.1956b.243-247.17: VANNUCCI, M. Ann. Acad. Bras. Sci.Distribução de Scyprozoa Brasil.1957.593-598.29: WAGNER, N., Die Wirbellosen des Wissens MeeresLeipzig1885.1-21.1: WEIL, R. Bull. Sic. zool. Fr.Existence, chez certains Coelentérés, d'un cnidome spécifique, caractéristique de I'état larvaire. Interprétation des monocnidomes.1926.254-260.51: WEIL, R. Trav. Stat. zool. Wimmereux,Contribution a I'étude des cnidaires et de leurs nématocystes. I. Recherches sur les néinatocystes (morphologie, physiologie, developpement).1934a.1-347.10: WEIL, R. Trav. Stat. zool. WimmereuxContribution à I'étude des enidaires et de leurs nématocystes. II. Valeur taxonomique du cnidome.1934b.351-701.11: WEIL, R. Bull. Soc. zool. Fr.Halammohydra Remane, genre d'Hydrozoaires aberrant. Son cnidome etsa position taxonomique: Affinités avec les Siphonophores Chondrophorides et avec protohydra leuckarti Greef.1935.73-87.60: WEISMANN, A., Die Entstehung der Sexualzellen be¡ den Hydomedusen. Zugleich als Beitrag zur Kenntnis des Baues und der Lebensercheinungen dieser Gruppe. Jena.1883.1-295. WOOSTFR, W. S. y T. CROMWELL, Bull. Scripps Inst. Oceanogr.An oceanographic description of the Eastern Tropical Pacific.1958.169-282.(3):7 WYRTKI, K. Inter. amer. Trop. tuna Comm. Bull.Surface currents of the Eastern Tropical Pacific Ocean.1965.271-294.(5):9 WYRTKI, K. Oceanograf. Mar. Biol. Ann. Rec.Oceanography of the Eastern Equatorial Pacific Ocean.1966.33-68.4: YAMAZI, I. Publ. Seto. mar. biol. Lab.Preliminary check-list of plankton organisms found in Tanabe. Bay and its environs.1958.111-163.(1):7 YASHNOV, V. A. Invest. Far-East. Seas U. S.S.R.Coelenterates from the Pacific Ocean around Kamchatka.Moscow1952.95-98.3: ZALENSKIJ, V. Mén. Acad. Sci. St. Pétersb. Sér. 8Solmundella und Actinula.1911.1-70.30: ZIRPOLO, G. Boll. Soc. Nat. NapoliAzione dell'acqua prsante sugli organismi. II. Ricerche sulla Discomedusa. Nausithoë punctata.1939.123-128.49: Láminas
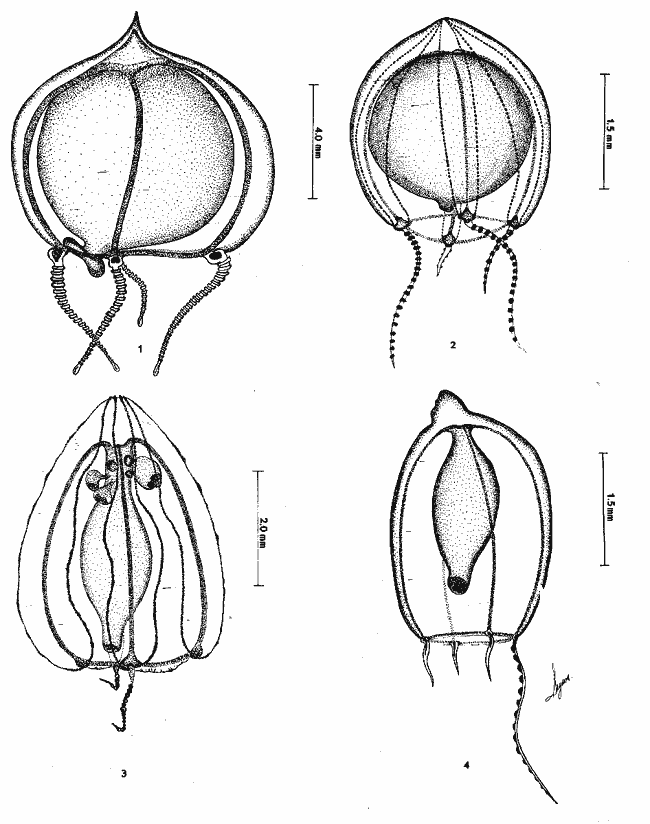 Lám. 1. Fig. 1: Sarsia coccometra Bigelow, 1900. Fig. 2: Ectopleura dumortieri (Van Beneden, 1844). Fig. 3:Ectopleura sacculifera Kramp, 1957. Fig. 4: Euphysora bigelowi Maas, 1905. 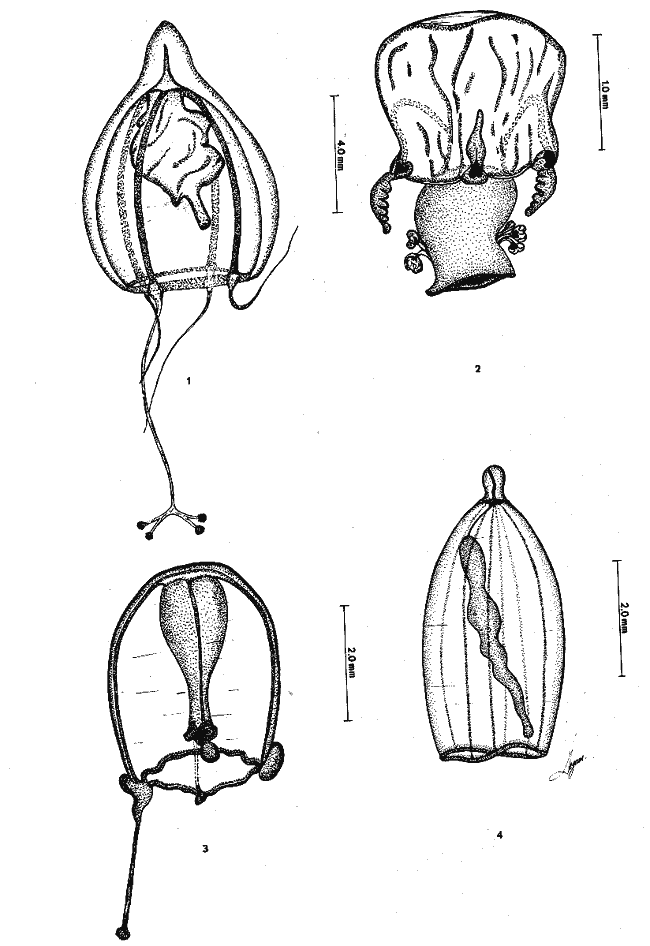 Lám. 2. Fig. 1: Euphysora furcata Kramp, 1948. Fig. 2: Euphysilla pyramidata Kramp, 1955. Fig. 3: Gotoea similis Kramp, 1959. Fig. 4: Pachycordile sp. 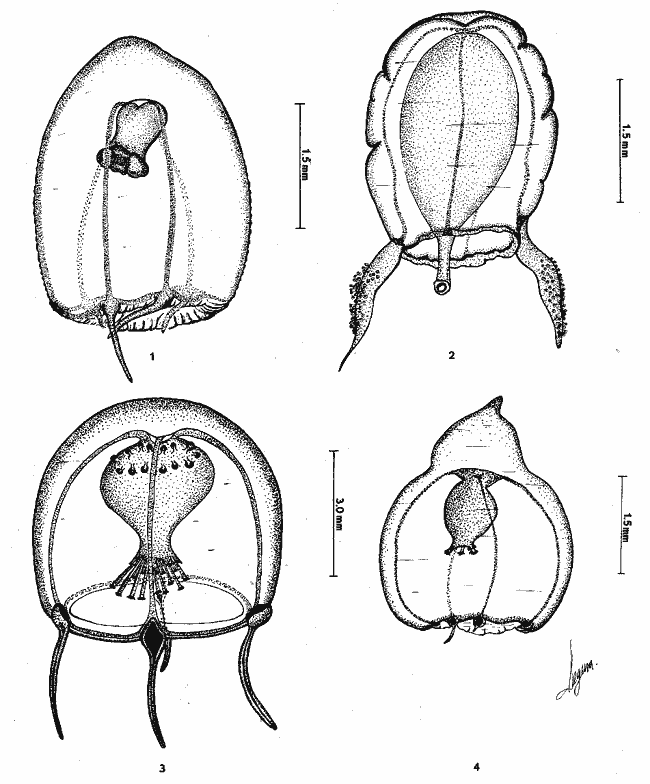 Lám. 3. Fig. 1: Zanclea costata Gegenbaur, 1856. Fig. 2: Zanclea orientalis Browne, 1916. Fig. 3: Cytaeis tetrastyla Eschscholtz, 1828. Fig. 4: Podocoryne apicata Kramp, 1959. 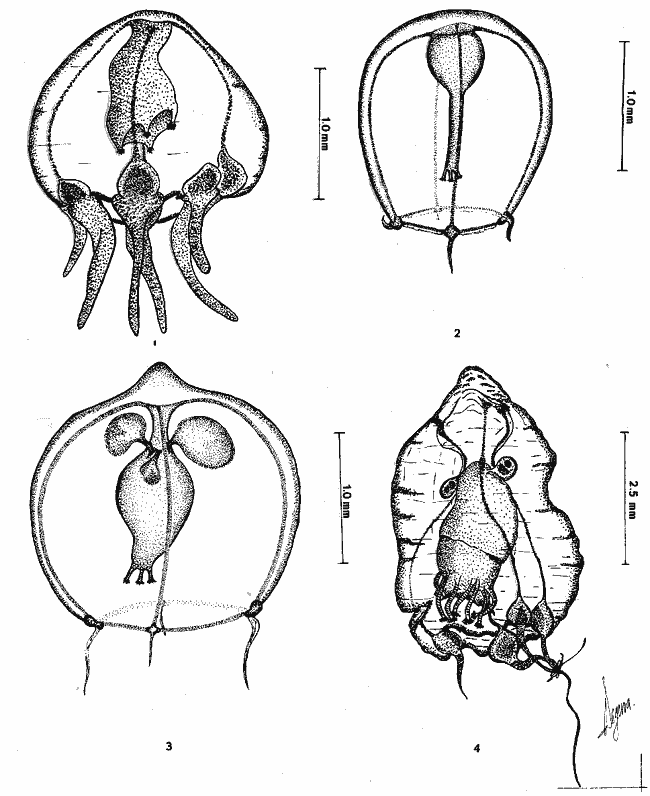 Lám. 4. Fig. 1: Podocoryne carnea M.Sars, 1846. Fig. 2: Podocoryne simplex Kramp, 1928. Fig. 3: Podocoryne minima (Trinci, 1903). Fig. 4: Lizzia alvarinoae Segura, 1980. 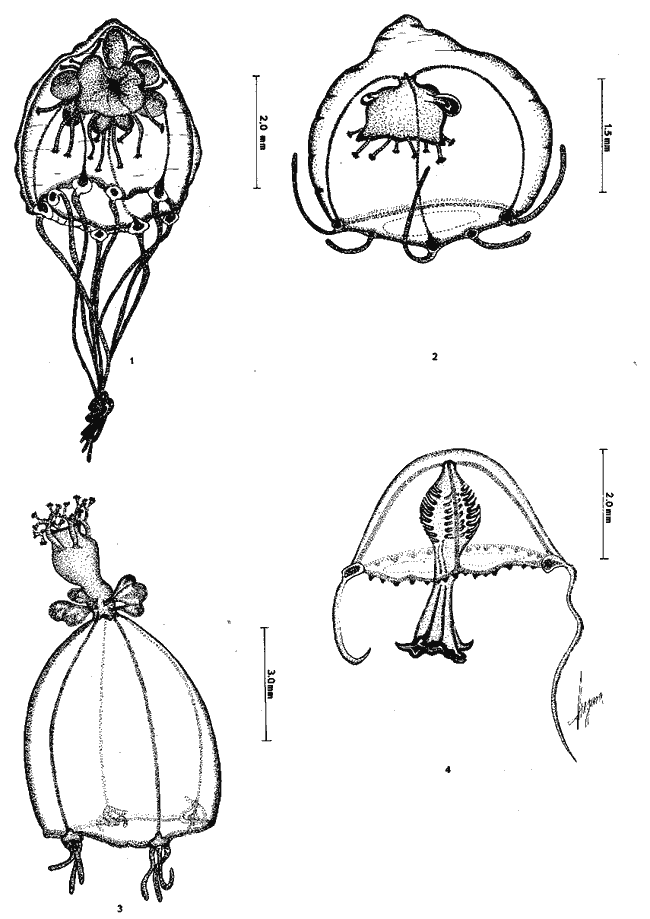 Lám.5.Fig. 1: Lizzia ferrarii Segura, 1980. Fig. 2: Lizzia gracilis (Mayer, 1899) Fig. 3: Bougainvillia fulva Agassiz y Mayer, 1899. Fig. 4: Stomotoca pterophylla Hacckel, 1879. 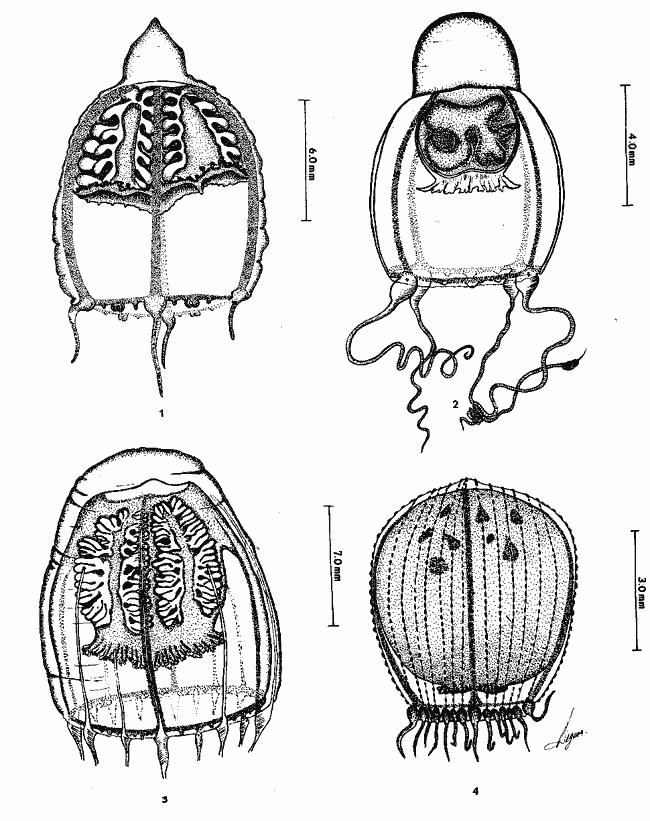 Lám. 6. Fig. 1: Halitholus intermedius Browne, 1902. Fig. 2: Halitholus pauper Hartlaub, 1913. Fig. 3: Leuckartiera zacae Bigelow, 1940. Fig. 4: Pandea sp. 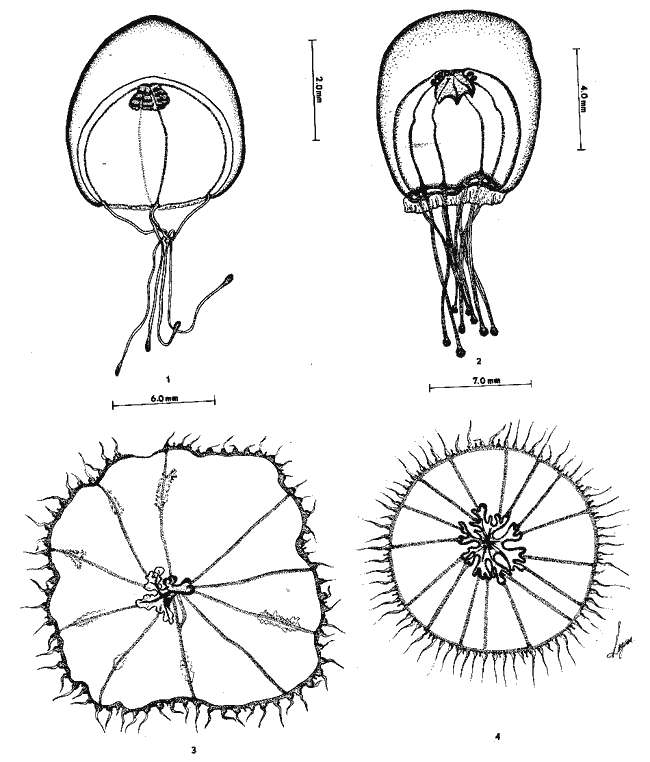 Lám. 7. Fig. 1: Bythotiara drygalskii Vanhöffen, 1912. Fig. 2: Kanaka pelagica Uchida. 1947, Fig. 3: Dipleurosoma pacificum Agassiz y Mayer, 1902. Fig. 4: Toxorchis polynema Kramp, 1959. 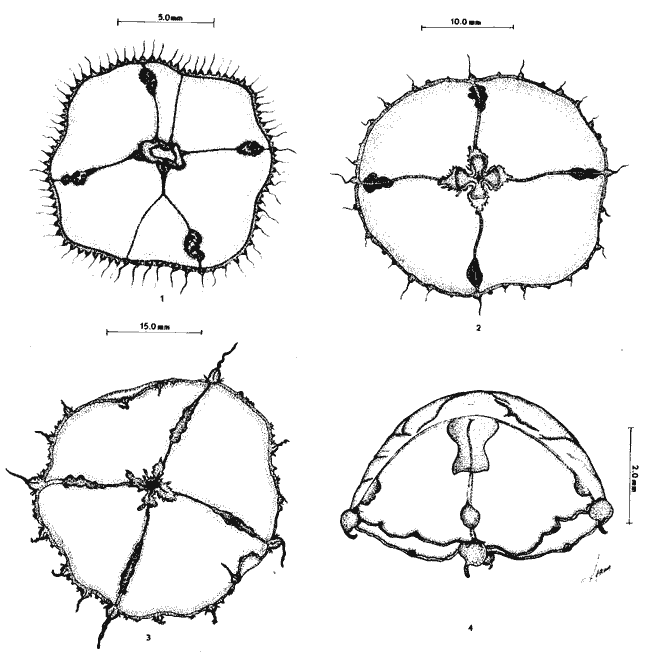 Lám. 8. Fig. 1. Phialidium simplex Browne, 1902. Fig. 2: Phialidium uchidai Kramp, 1961. Fig. 3: Eucheilota comota (Bigelow, 1909). Fig. 4: Eucheilota menoni Kramp, 1959. 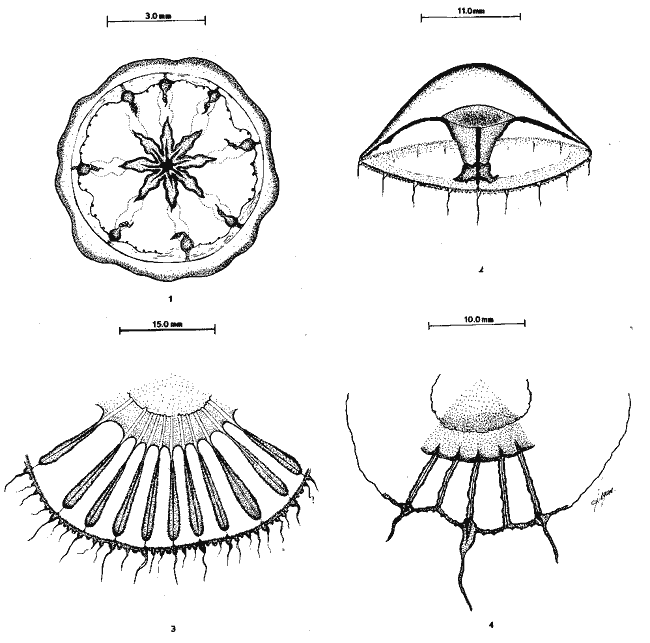 Lám. 9. Fig. 1. Octophialucium bigelowi Kramp, 1955. Fig. 2:Phialopsis diegensis Torrey, 1909. Fig. 3: Aequorea coerulescens (Brandt, 1838). Fig. 4: Aequorea macrodactyla (Brandt, 1835). 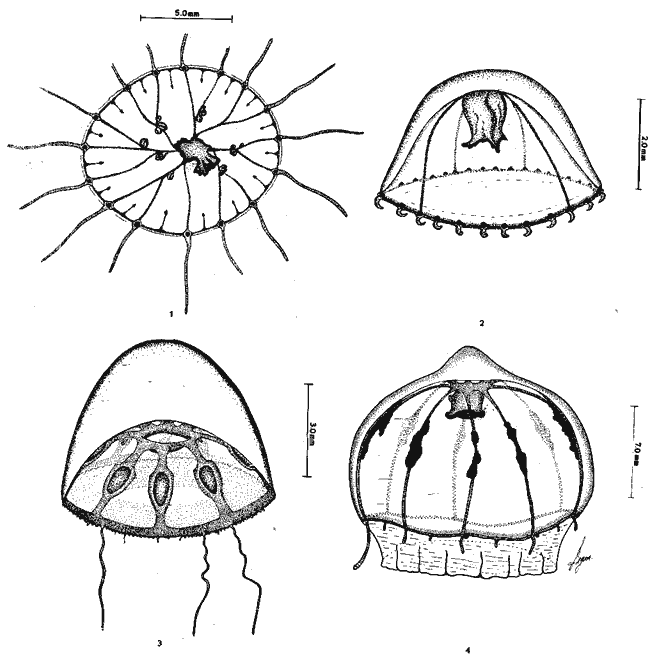 Lám. 10. Fig. 1. Proboscidactyla ornata (McCrady. 1857. Fig. 2: Pochella polynema Hartlaub, 1917. Fig. 3: Haliscera bigelowi Kramp, 1947. Fig. 4: Rhopalonema velatum Gegenbaur, 1856. 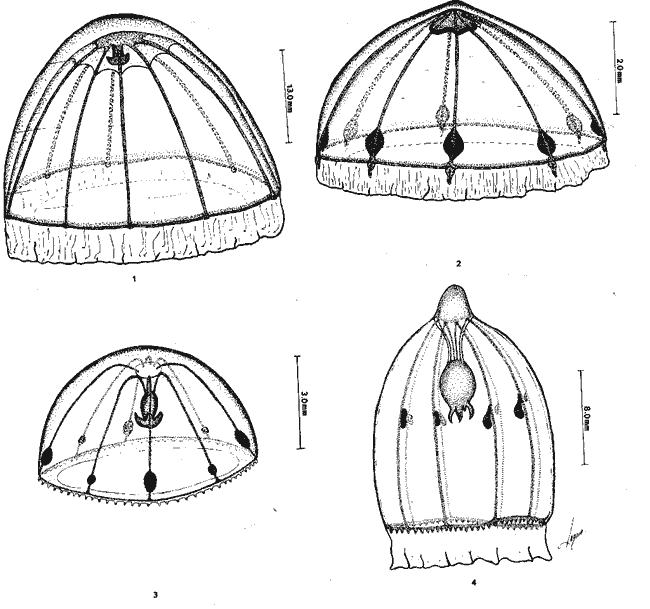 Lám. 11. Fig. 1: Rhopalonema funerarum Vanhöffen, 1902. Fig. 2: Sminthea eurygaster Gegenbaur, 1856. Fig. 3: Amphogona apsteini (Vanhöffen, 1902). Fig. 4: Amphogona apicata Kramp, 1957. 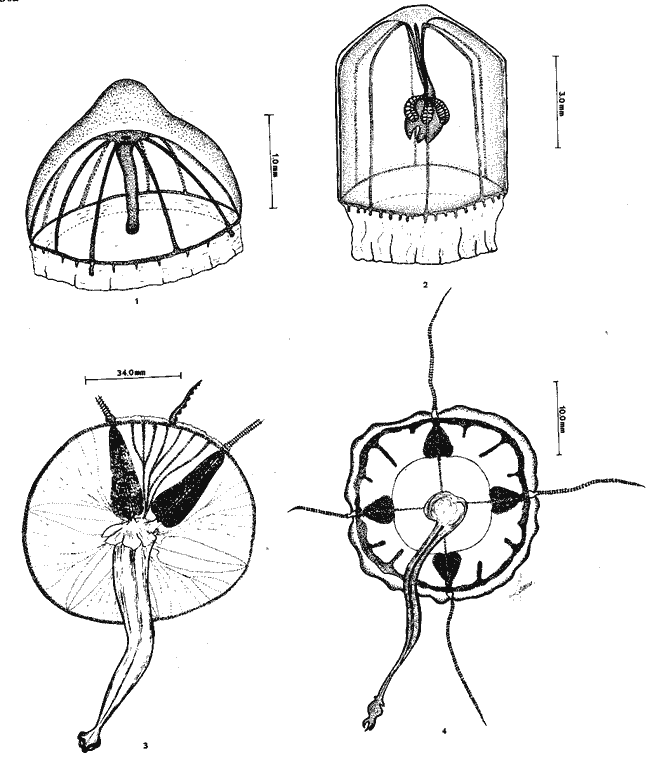 Lám. 12. Fig. 1: Tethorchis erythrogaster Bigelow, 1909. Fig 2: Aglaura hemistoma Péron y Lesueur, 1809. Fig. 3: Geryonia porboscidalis (Forskal. 1775). Fig. 4: Liriope tetraphylla (Chamisso y Eysenhardt, 1821). 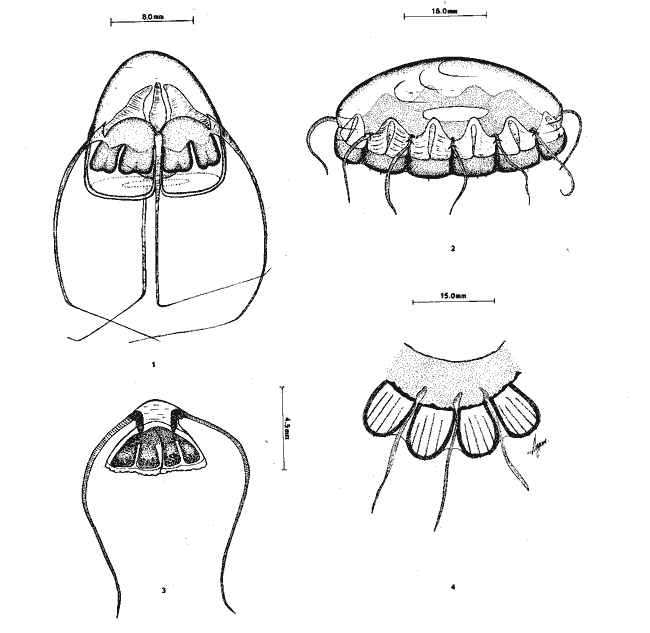 Lám. 13. Fig. 1: Aegina citrea Eschscholtz, 1829. Fig. 2: Aeginura beebei Bigelow. 1940. Fig. 3: Solmundella bitentaculata (Quoy y Gaimard, 1833). Fig- 4: Pegantha clara R. P. Bigelow 1909. 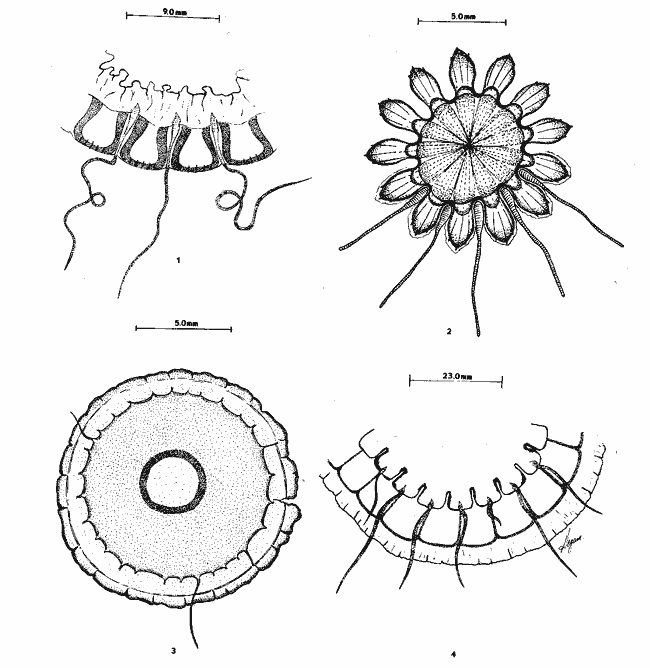 Lám. 14. Fig. 1: Pegantha martagon Haeckel, 1879. Fig. 2. Pegantha triloba Haeckel, 1879. Fig. 3: Solmaris rhodoloma (Brandt, 1838). Fig. 4: Cunina duplicata Maas. 1893. 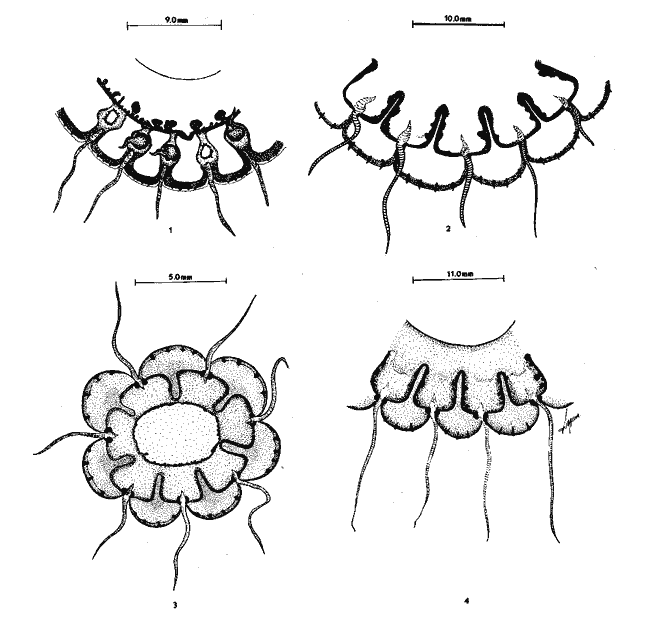 Lam. 15. Fig. 1: Cunina frugifera Kramp. 1948. Fig 2: Cunina globosa Eschscholtz., 1829. Fig. 3: Cunina octonaria McCrady, 1857. Fig. 4: Cunina peregrina Bigelow, 1909. 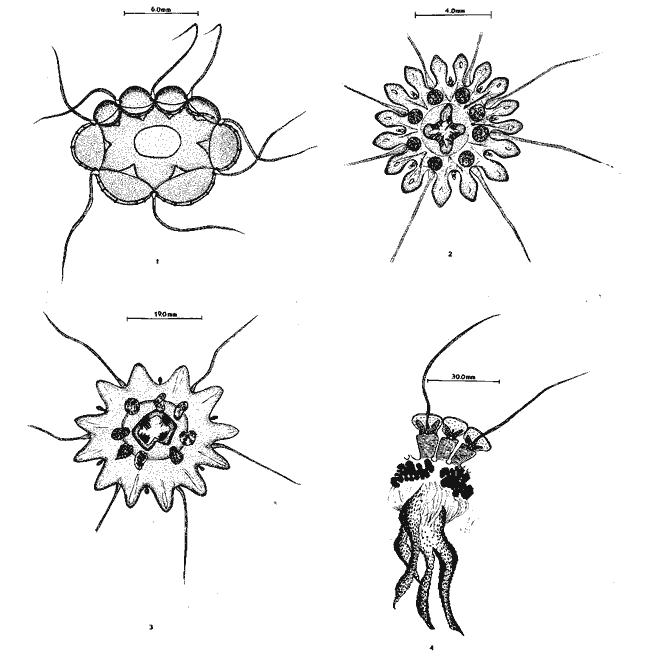 Lám. 16. Fig. 1: Cunina tenella (Bigelow, 1909). Fig. 2: Nausithoë punctata Kolliker, 1893. Fig. 3: Nausithoë albatrossi (Maas, 1897). Fig. 4: Pelagia noctiluca Forskal, 1779.
|

