|
TAXONOMÍA, ECOLOGIA Y ESTRUCTURA DE LAS COMUNIDADES DE PECES EN LAGUNAS COSTERAS CON BOCAS EFÍMERAS DEL PACÍFICO DE MÉXICOTrabajo presentado en la "39th. Annual Meeting American Society of Limnology and Oceanography", Savannah, Georgia, 19 al 21 de julio de 1976. Recibido el 7 de octubre de 1977 y aceptado para su publicación el 2 de diciembre de 1977.
ALEJANDRO YÁÑEZ-ARANCIBIA
Universidad Nacional Autónoma de México, Centro de
Ciencias del Mar y Limnología. Laboratorio de Ictiología y
Ecología Estuarina. Contribución 85 del Centro de Ciencias del
Mar y Limnología, UNAM.
1. Las lagunas costeras de
Guerrero presentan un ciclo de fisiología ambiental con tres periodos
ecológicos anuales: Periodo 1 (normal, salinidades
entre 15 y 34‰), agosto a noviembre, las lagunas se encuentran en
contacto con el mar a través de una boca en la barrera arenosa
existiendo un intercambio biológico, físico y químico.
Periodo 2 (hipersalino, salinidades mayores de 35‰
noviembre a mayo, las lagunas se encuentran aisladas del mar y la
evaporación excede a los aportes de aguas dulces; mínimo volumen
de agua en las lagunas, Periodo 3 (hipo salino, salinidades
menores de 15‰ mayo a agosto, las lagunas se encuentran aisladas del mar
y los aportes de aguas dulces exceden a la tasa de evaporación;
máximo volumen de agua en las lagunas.
2. La
vegetación de las lagunas se compone de los siguientes elementos: a)
palmar, b) lignetum pernnifolio de manglar, c) semiacuática, y d)
acuática. Los principales productores primarios son los manglares y
fitoplancton.
3. Según estudios de otros autores la
biomasa fitoplanctónica es alta comparada con otros ecosistemas
lagunares de México.
4. Los grupos del zooplancton
más comunes han sido copépodos, quetognatos, larvas de
gastrópodos, larvas de bivalvos, larvas de cirripedios, larvas de
poliquetos, larvas de decápodos, y algunas larvas y huevecillos de
peces. Estudios de otros autores discuten la diversidad específica y
abundancia del zooplancton en las lagunas de Guerrero.
5. La
macrofauna bentónica tiene representantes de Porifera, Cnidaria,
Annelida, Mollusca (bivalos y gastrópodos) en fondos blandos y duros,
Arthropoda (Scalpellidae, Balanidae, Penaeidae, Palaemonidae, Callianasidae,
Diogenidae, Coenobitidae, Portunidae, Xanthidae, Pinnotheridae, Grapsidae,
Gecarcinidae, Ocypodidae, Isopoda y Tanaidacea) distribuidos en: a) facie de
playa, b) facie de manglar, c) facie bentónico pelágico, y d)
facie bentónico de fondos arenosos y fangosos. En general el bentos
está pobremente representado y no caracteriza a las lagunas en
particular.
6. Examinados 15 905 especímenes de peces
fueron determinados: 2 clases, 2 divisiones, 6 superórdenes, 13
órdenes, 22 subórdenes, 37 familias, 67 géneros y 105
especies. Las familias mejor representadas en diversidad han sido Carangidae
(11 especies), Sciaenidae (8), Gobidae (8), Gerridae (7), Urolophidae (6),
Engraulidae (5), Poecilidae (5), y Pomadasyidae (4).
7.
Zoogeográficamente el sistema lagunar estudiado (37 familias, 67
géneros y 105 especies) presenta una afinidad de "cero" especies con
Canadá, 15% con California, 31%, con el Golfo de California, 45% con
Huizache-Caimanero Sinaloa, 48%, con Agua Brava Nayarit, 60% con el litoral de
Guerrero, 67% con el complejo tropical de Panamá-Colombia-Ecuador, 60%,
con el litoral de Perú, 47, con el litoral del norte de Chile, 16% con
las islas Galápagos, 15% con la costa del Sur del Golfo de México
y el Caribe, 5% con la ictiofauna continental de Sudamérica, 2% de
especies introducidas y el 10% son endémicas del Pacífico de
México.
Estos antecedentes refuerzan la
hipótesis que la ictiofauna costera del Pacífico Oriental ha
seguido ciertos patrones de radiación limitados más bien por el
avance en el grado de evolución y adaptación a las masas de aguas
frío-temperadas, que por una capacidad de desplazamiento de los
peces.
8. La diversidad varía en el espacio y en el
tiempo y muy pocas especies se encuentran presentes todo el año y a
través de todo el sistema lagunar, estas especies fueron 9 (8.5%) y en
número de individuos 10 152 (64%) de las colectas totales, i.
e., Galeichthys caerulescens (3 396), Mugil curema
(2 825), Diapterus peruvianus (1831), Lile
stolifera (478), Dormitator latifrons (425)
Mugil cephalus (402), Cichlasoma
trimaculatum (384), Gerres cinereus (267)
y Gobionellus microdon (145).
9. La
dinámica ecológica del ambiente se refleja en la
composición cuali y cuantitativa de las comunidades
ictiofaunísticas, las cuales, en todo el sistema lagunar, están
constituidas por un 14%, de peces dulceacuícolas, 6% de peces marinos
propiamente estuarinos, 28% de peces marinos que utilizan el estuario como
áreas de crianza, 31% de peces marinos que utilizan el estuario como
adultos y para alimentarse, y 21% de peces marinos visitantes ocasionales de
periodicidad acíclica. Esta proporción varía en las
diferentes lagunas en su composición y abundancia relativa de especies
de acuerdo a: a) las condiciones hidrológicas del sistema
ecológico, consecuencia de b) la época del año y el
período ecológico de las lagunas, c) la localidad dentro del
estuario y sus gradientes de salinidades, y d) la disponibilidad del
alimento.
10. Examinados cuantitativamente 2 372
estómagos de los peces de importancia comercial (i. e., Elops
affinis, Galeichthys caerulescens, Centropomus robalito, C. nigrescens, Caranx
hippos, Lutjanus argentiventris, L. novemfasciatus, Gerres cinereus, Eugerres
lineatus, Diapterus peruvianus, Mugil curema, Cichlasoma trimaculatum y
Dormitator latifrons) y determinada cualitativamente la
alimentación del resto de la fauna ictiológica, se concluye que
dentro de la trama trófica de los ecosistemas lagunares existen
3 categorías ictiotróficas.
11. Las 3 categorías ictiotróficas
corresponden a: I. Consumidores Primarios donde se incluye a
los peces a) Planctófagos -fito y/o zooplanctófagos-, b)
Detritívoros, y c) Omnívoros que se alimentan de pequeños
organismos animales, detritus y vegetales. 2. Consumidores
Secundarios donde se incluye a los peces predominantemente
carnívoros que eventualmente pueden incorporar en su dieta algunos
vegetales y detritus pero sin mucha significación cuantitativa. 3.
Consumidores de Tercer Orden donde se incluye a los peces
exclusivamente carnívoros donde los vegetales y el detritus son un
alimento accidental.
12. El espectro trófico de los
peces puede sufrir modificaciones, dentro de un patrón general, debido
a: a) la disponibilidad del alimento, b) la edad del pez, c) la época
del año y el periodo ecológico en que se encuentra la laguna, y
d) el área particular dentro de la laguna.
13. Por
afinidad ecológica las lagunas pueden ser reunidas en dos
tipos. Grupo A en las cuales el ciclo de fisiología
ambiental afecta a toda la laguna, profundidades medias de 1 m, temperaturas de
29 a 35° C, salinidades de 2 a 125‰ alta biomasa
fitoplanctónica, variable cantidad de detritus, pocos manglares,
variable biomasa macrobentónica, estructura trófica y comunidades
nectónicas complejas en diversidad durante el periodo
1 simplificándose durante los
periodos 2 y 3;
sólo un 15% de peces presentes durante todo el año demuestra lo
inestable del ambiente. Grupo B en las cuales el ciclo
afecta sólo una parte limitada de las lagunas, profundidades medias de 2
m, temperaturas de 29 a 33°C, salinidades de 0 a 4‰, muy alta
biomasa fitoplanctónica, grandes cantidades de detritus, numerosos
manglares, casi ausencia de biomasa macrobentónica, estructura
trófica y comunidades nectónicas de complejidad relativa durante
el periodo 1 en la zona de influencia. marina y simples en el resto de la
laguna durante ese periodo, así como también en toda la
superficie lagunar durante los periodos 2 y
3; un 55% de peces presentes durante todo el año demuestra lo
estable del ambiente.
14. Los manglares son los productores
primarios más importantes en ambos grupos de lagunas, agregando
además al fitoplancton en las lagunas del Grupo B. A
partir de ellos existen al menos cuatro vías del flujo energético
hacia los heterótrofos: 1. Hojas de manglar y fitoplancton que proveen
sustancias orgánicas disueltas --> microorganismos -->
consumidores. 2. Sustancias orgánicas disueltas --> absorción
por sedimentos y por detritus particulado ya existente --> consumidores. 3.
Hojas y restos de hojas --> consumidores, 4. Hojas y restos de hojas -->
bacterias y hongos --> consumidores. Esta última es la más
importante.
15. La diversidad ictiofaunística, la
productividad pesquera de las lagunas, y la complejidad de la trama
trófica, están en relación directa con la influencia
marina que reciben las lagunas durante el periodo 1. En las
lagunas del Grupo A, durante el Periodo
1. La diversidad puede llegar a 70 especies, la densidad es de 12
ejem./19.5 m² y el "standing crop" de 66.7 g/m²; durante el
periodo 2 la diversidad es de 18 especies, la densidad es de
8 ejem./m² y el "standing crop" de 44.3 g/m²; durante el
periodo 3 la diversidad es de 22 especies, la densidad es de 7
ejem./19.5 m² y el "standing crop" de 38.8 g/m². En las lagunas
del Grupo B, durante el periodo 1, la
diversidad puede llegar a 26 especies, la densidad es de 14 ejem./19.5
m² y el "standing crop" de 43.1 g/m²; durante el periodo
2 la diversidad es de 19 especies la densidad es de 7 ejem./19.5
m² y el "standing crop" de 21.5 g/m²; durante el periodo
3 la diversidad es de 26 especies, la densidad es de 8 ejem./19.5
m² y el "standing crop" de 24.6 g/m². Las condiciones de
salinidad determinan un reemplazo de especies dentro de los diferentes niveles
tróficos, tanto intra como inter lagunar.
16. La
diversidad ictiofaunística, en términos de número de
especies (riqueza o variabilidad) y de índice (H'), está regulada
principalmente por los siguientes factores: 1. variedad de nichos, 2.
tamaño o sobreposición de los nichos, 3. estabilidad del
medioambiente, 4. rigurosidad del medioambiente, 5. sucesión, 6.
productividad, 7. acumulación de biomasa, 8. competencia, 9. espacio,
10. tamaño de los organismos, y 11. longitud de las cadenas
alimenticias. Estos factores tienen un efecto particular en el medioambiente
lagunar estuarino y se discuten en detalle.
17. El corolario
ecológico es que, en los estuarios y lagunas costeras, los peces
transforman energía desde fuentes primarias, conducen energía
activamente a través de la trama trófica, intercambian
energía con ecosistemas vecinos a través de importación y
exportación de ella, representan una forma de almacenamiento de
energía dentro del ecosistema y, finalmente, constituyen un agente de
regulación energética.
1. The coastal
lagoons of the State of Guerrero, México, present an environmental
physiology cycle with three ecological annual periods: Period
1 (normal, salinities from 15 to 34 ppt) from August to November, the
lagoons are in contact with the sea through an open pass in the barrier
permitting biological, physical and chemical exchange. Period
2 (hypersaline, salinities higher than 35 ppt) from November to May,
the lagoons are isolated from the sea and evaporation exceeds freshwater input,
there is a minimum volume of water inside the lagoons. Period
3 (hyposaline, salinities lower than 15 ppt) from May to August, the
lagoons are isolated from the sea and freshwater input exceeds the rate of
evaporation, there is a maximum volume of water inside the lagoons.
2. The vegetation of the lagoons is made up of the following elements.
a) Palmar (palm trees), b) Lignetum peremnifolio from mangrove, c) Semi-aquatic
and d) Aquatic. The main primary producers are the mangroves and
phytoplankton.
3. According to some authors, the
phytoplankton biomass is high compared to other lagoon ecosystems of
México.
4. The most common zooplanktonic groups are
Copepods, Chaetognata, larvae of Gasteropoda, larvae of Bivalvia, larvae of
Cirripedia, larvae of Polychaeta, larvae of Decapoda and some fish eggs and
larvae. Studies of some authors discuss species diversity and abundance of the
zooplankton in coastal lagoons of Guerrero.
5. The benthic
macrofauna includes: Porifera, Cnidaria, Annelida, Mollusca (Bivalvia and
Gasteropoda) in soft and hard bottoms, Arthropoda (Scalpellidae, Balanidae,
Penaeidae, Palaemonidae, Callianasidae, Diogenidae, Coenobitidae, Portunidae,
Xanthidae, Pinnotheridae, Grapsidae, Gecarcinidae, Ocypodidae, Isopoda and
Tanaidacea) distribuited on: a) the beach association, b) the mangrove
association, c) the benthic-pelagic association and d) the benthic association
with sand and mudy bottoms. In general the benthos is poorly represented and
does not characterize the lagoons.
6. 15 905 fish specimens
were examined and 2 Classes, 2 Divisions, 6 Superorders, 13 Orders, 22
Suborders, 37 Families, 67 Genera and 105 Species determined. The best
represented families with regard to species diversity were Carangidae (11),
Sciaenidae (8), Gobiidae (8), Gerridae (7), Urolophidae (6), Engraulidae (5),
Poecillidae (5) and Pomadasyidae (4).
7. Zoogeographically
the studied ecosystem (37 families, 67 genera, and 105 species) has affinities
of "zero" % with Canada, 15% with California, 31% with Gulf of California, 45%
with Huizache-Caimanero Sinaloa, 48% with Agua Brava Nayarit, 60% with littoral
of Guerrero, 67% with the tropical complex of Panama-Colombia-Ecuador, 60% with
littoral of Peru, 4% with littoral of north of Chile, 16% with the Galapagos
island, 15% with south coast of Gulf of Mexico and Caribbean, 5% with the
continental ichthyofauna of South America, 2% are introduced species, and 10%
are endemic species of the Pacific coast of Mexico.
These
results support the hypothesis that the coastal ichthyofauna of the Eastern
Pacific, has fallowed certain radiation patterns limited by the degree of
evolution and adaptations to cold-temperate water masses, and not by the moving
capacity of fishes.
8. Species diversity varies with space
and time and very few species are found during the entire year and throughout
the entire lagoon system, the most important are 9 species (8.5%) and represent
10 152 specimens (64%), i. e., Galeichthys caerulescens (3
396), Mugil curema (2 825), Diapterus
peruvianus (1831), Lile stolifera (478),
Dormitator latifrons (425), Mugil
cephalus (402), Cichlasoma trimaculatum (384),
Gerres cinereus (267) and Gobionellus
microdon (145).
9. The ecological dynamics of the
environment are reflected in the qualitative and quantitative composition of
the ichthyofaunistic communities in the entire lagoon system. They are made up
of 14% of fresh water fishes, 6% of estuarine fishes, 28% of marine fishes that
utilize the estuary as a natural breeding area, 31% of marine fishes that when
adults utilize the estuary as a feeding ground, and 21% of occasional visiting
marine fishes with non-cyclic periodicity. This proportion varies in
composition and relative abundance of species in the lagoons according to: a)
the hydrological conditions of the ecological system, a consequence of b) the
season of the year and the ecological moment of the lagoon, c) the area in the
estuary and its salinity gradient and d) the avalability of food.
10. The stomachs of 2 372 fishes of commercial importance were
examined, i. e., Elops affinis, Galeichthys caerulescens, Centropomus
robalito, C. nigrescens, Caranx hippos, Lutianus argentiventris, L.
novemfasciatus, Gerres cinereus, Eugerres lineatus, Diapterus peruvianus, Mugil
curema, Cichlasoma trimaculatum and Dormitator latifrons.
The food of the rest of the ichthyofauna was qualitatively
determined, indicating that in the food web of the lagoon ecosystem there are
3 ichthyotrophic categories.
11. The
3 ichthyotrophic categories belong to: 1) Primary
Consumers, where the following fishes are included, a) plankton
feeders phyto and/or zooplankton feeders, b) detritus feeders c) omnivorous,
that feed on small animals, detritus and plants, 2) Secondary
Consumers including the predominantly carnivorous fishes which can
incorporate in their diet some plants and detritus but with little quantitative
significance. 3) Tertiary Consumers including the
exclusively carnivorous fishes where plants and detritus are accidental
food.
12. The trophic spectrum of fishes can be modified,
inside a general pattern, due to: a) the availability of food, b) the age of
the fish, c) the time of the year and the ecological moment of the lagoons, and
d) the particular area inside the lagoon.
13. Based on
ecological affinities the lagoons can be arranged in two groups. Group
A where the cycle of environmental physiology affects the entire
lagoon: mean depth of 1 m temperatures from 29 to 35° C, salinities from
2 to 125 ppt, high phytoplanktonic biomass, variable amount of detritus, few
mangroves, variable macrobenthic biomass, and complex nektonic communities in
diversity during period 1 becoming less complex during
periods 2 and 3; only 15% of fishes
present during the entire year indicate the in stability of the system.
Group B where the cycle affects only a limited part of the
lagoons: mean depths of 2 m, temperatures from 29 to 33º C, salinities
from 0 to 4 ppt, very high phytoplankton biomass, large quantities of detritus,
numerous mangroves, macrobenthic biomass almost absent, trophic structure and
nektonic communities of relative complexity during period 1
in the zone of marine influence and simple in the rest of the lagoon during
this period as well as in the entire lagoon surface during periods
2 and 3; 55% of the fishes present during the
entire year indicate the stability of the environment.
14.
Mangroves are the most important primary producers in both groups of lagoons,
in addition to the phytoplankton in the lagoons of the Group
B. From the mangroves and phytoplankton there are at least four
energy flow pathways to heterotrophus: 1) Mangroves leaves and phytoplankton
that provide dissolved organic substances --> microorganisms -->
consumers. 2) Dissolved organic substances --> absortion by sediments and
particulate detritus already existing --> consumers. 3) Leaves and remains
of leaves --> consumers. 4) Leaves and remains of leaves --> bacteria and
fungi --> consumers. The latter one is the most important in tropical
estuaries (W. E. Odum, 1971).
15. The ichthyofaunistic
diversity, the fisheries production of the lagoons, and the complexity of the
food web, are directly related to the marine influence of the lagoons during
period 1. In Group A lagoons, during period 1
the diversity can be 70 species, the density 12 smps
spms =
specimens.
16. The ichthyofaunistic diversity, in terms of
number of species (variability) and the index (H') are regulated principally by
the following possible factors. 1) variety of niches, 2) size of niche or niche
overlapping, 3) stability of environment, 4) stress of environment, 5)
succession, 6) productivity, 7) biomass accumulation, 8) competition, 9) space,
10) body size and 11) length of food chains. These factors have a particular
effect in the lagoon-estuarine environment.
17. The
ecological corollary is that in the lagoon-estuarine environment fishes
transform energy from primary sources, actively pass energy throughout the food
web, exchange energy with neighboring ecosystems through importantion and
exportation of it. They represent a form of energy storage inside the
ecosystem, and finally, they constitute an agent of energy
regulation.
En septiembre de 1973 se iniciaron muestreos sistemáticos sobre los peces de la lagunas costeras de Guerrero como parte de un estudio integral de los recursos biológicos de la zona costera de los Estados de Michoacán y Guerrero, en un convenio de colaboración entre la Comisión del Río Balsas de la Secretaría de Recursos Hidráulicos, y el Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Entre los planteamientos iniciales del mencionado estudio, se enfatizó que de los recursos naturales costeros renovables, la pesca ocupa un lugar preferencial y pese a que en Guerrero se explotan algunas especies importantes, el conocimiento de la fauna ictiológica en general y particularmente de su biología y ecología, es muy limitado en relación a los puntos que Yáñez-Arancibia (1975 a) señala como básicos para la prospección, evaluación, administración y explotación racional de los recursos ícticos lagunares y/o estuarinos (Fig. 1).  La colaboración de los pescadores artesanales del litoral de Guerrero fue fundamental para el desarrollo de estos estudios. Los trabajos importantes que tienen relación con la fauna de peces de la costa del Pacífico de México no son escasos, sin embargo, por la disparidad de objetivos, no es mucha la relación existente entre ellos. Algunos hacen referencia parcial a la costa del Pacífico mexicano, los menos estudian colecciones importantes de peces, y otros analizan más o menos exhaustivamente áreas en particular. Todos ellos representando antecedentes básicos para el conocimiento de la ictiofauna del Pacífico mexicano (Jordan et al., 1895; Jordan y Evermann, 1896-1900; Jordan et al., 1930; Meek, 1904; Meek y Hildebrand, 1923, 1925 y 1928; Hiyama et al., 1940; Beebe y TeeVan, 1941; Hildebrand, 1946; Ramírez-Granados, 1952; Berdegué, 1954 y 1956, Mann, 1954; De Buen, 1959 y 1960; Koepcke, 1962; Ramírez Hernández y Sevilla, 1963; Ramírez-Hernández et al., 1964; Ramírez-Hernández, 1965 y 1968; Ramírez Hernández y Arvizú, 1965; Ramírez-Hernández y Páez, 1965, Ramírez-Hernández et al., 1965; Álvarez y Cortés, 1962; Díaz, 1965; Kato et al., 1967; Chirichigno, 1968, 1969 y 1974; Carranza, 1969a, 1969b y 1970; Álvarez, 1970; Bailey et al., 1970; Carranza y Amezcua-Linares, 1971a y 1971b; Amezcua-Linares, 1972 y 1977; González-Villaseñor, 1972; Miller y Lea, 1972; Dahl, 1972; Hart, 1973; Castro, 1965, 1967 y 1974; Castro et al., 1970 y 1974; Miller, 1976; S.I.C., 1976; Holguín-Quiñones, 1976; Yáñez-Arancibia, 1974, 1975a, 1975b, 1976a, 1976b, 1977a, 1977b; Yáñez-Arancibia y Leyton Vargas, 1977; Yáñez-Arancibia et al., 1976; Yáñez-Arancibia y Nugent, 1975, 1976 y 1977). Sin embargo, un análisis de esta literatura permite precisar que sólo algunos trabajos se refieren estrictamente al área de estudio en particular, de los cuales los únicos que enfatizan en aspectos biológicos y ecológicos corresponden a los estudios del autor de este trabajo. Plantear una discusión ecológica detallada para la fauna ictiológica de las lagunas costeras de Guerrero, hace necesario disponer de un buen conocimiento biológico y abiótico del área, que permita integrar ecológicamente a las comunidades de peces dentro del sistema lagunar estuarino en cuestión. En ese aspecto existe mucha información de diversos trabajos, la mayoría de los cuales han sido parte de informes científicos elaborados por el Centro de Ciencias del Mar y Limnología, para la Comisión del Río Balsas, que representan una información valiosa para lograr los objetivos del estudio ictio-ecológico aquí propuesto. Desde el punto de vista geológico y geomorfológico (Lankford, 1974 y 1975; Lankford et al., 1975, Warme y Sánchez, Carranza-Edwards et al., 1975). Desde el punto de vista hidrográfico (Arpi et al., 1974; Castellanos, 1975) Desde el punto de vista biológico y ecológico (Stuardo et al., 1974; Stuardo y Martínez-Guerrero, 1975; Stuardo y Villarroel, 1976; Luján, 1975; Villarroel, 1975 y 1976; Weinborn, 1974; Licea-Durán et al., 1975 y 1976; Guzmán Arroyo, 1975; Martínez-Guerrero, 1975 y 1978; Estévez, 1976; Román 1976; además de la literatura específica sobre peces citada anteriormente). Aparte de la literatura analizada, existen muy pocos trabajos específicos sobre fauna ictiológica lagunar en otras costas de México como el Golfo de México y el Caribe, los cuales, sin embargo, serán considerados importantes en este estudio por corresponder a los únicos antecedentes de comparación del ecotono en cuestión (i.e., Hildebrand, 1958 y 1969; Zarur, 1961 y 1962; Darnell, 1962; Toral, 1971, Chávez, 1972; Toral y Reséndez, 1973, Reséndez, 1970, 1973 y 1975; E. Jordan et al., 1978). Es un hecho reconocido desde mucho tiempo y en diferentes países que los sistemas lagunares y/o estuarinos representan en su mayoría un potencial de recursos pesqueros de considerable magnitud. Vannucci (1969) sintetiza la mayor información posible sobre esta consideración. Los peces de esos ecosistemas desarrollan uno de los papeles más importantes en el balance energético de esos sistemas biológicos, y en la progresión natural del ambiente (Yáñez-Arancibia y Nugent, 1977). Esto determina que la ictiología lagunar sea uno de los aspectos más importantes y tal vez uno de los de mayor proyección dentro de los estudios ecológicos y biológico-pesqueros que pretenden evaluar y proponer una correcta administración de los recursos bióticos de un área que presenta características ambientales, en gran medida, predominántemente estuarinas. Estos ambientes son ecosistemas críticos para algunos organismos pero al mismo tiempo ideales para otros. En términos generales son cuerpos de aguas someras de volúmenes variables dependiendo de los periodos de secas y de lluvias, con temperaturas elevadas, salinidades muy variables, fondos predominantemente fangosos, y características de topografía y superficies muy irregulares. La dinámica de fenómenos climáticos, meteorológicos y oceanográficos determina rangos desde el agua dulce hasta ambientes hipersalinos, dependiendo además de las tasas de precipitación, evaporación, escurrimiento y mareas. Todas estas variables han dificultado mucho una definición precisa de estos ecotonos. No obstante, todos los investigadores que han abordado con mayor o menor éxito este tema, ya sea desde el punto de vista biológico, o geológico, o hidrográfico, o energético, coinciden en considerar a las lagunas costeras como un ambiente ecológico de cambio, complejo, donde parece poco apropiado hacer predicciones o pronósticos biológicos a largo plazo. Más. aún, la diversidad de componentes faunísticos, particularmente peces, dificulta enormente efectuar un estudio desde el punto de vista ecológico (Günter, 1956; Hedgpeth, 1957; McHugh, 1967; Yáñez-Arancibia, 1975a). La complejidad ambiental de estos ecosistemas hacen de su ecología un multidisciplinario tópico que no es fácil de entender en términos ordinarios. Los ejemplos en los cuales se apoyan algunos de los principios generales de interacciones entre la fauna, la flora y el medioambiente, son a menudo difíciles de describir cuantitativamente y con frecuencia son sólo locales en su aplicación. De manera que el problema ictiológico en las lagunas costeras debe ser abordado a nivel de ecosistema como problema integral más que como problema particular (Yáñez-Arancibia, 1975a) Al respecto existen importantes trabajos como antecedentes, los cuales indirectamente enfatizan ese aspecto y es necesariamente fundamental mencionarlos: Hiatt (1947b) Reid (1955a y 1955b), Günther (1938 y 1956), Günter (1967 y 1969), Hedgpeth (1957), Hildebrand (1958 y 1969), Thompson (1957), Springer y Woodburn (1960), Darnell (1958 y 1961), Teal (1962), Tabb et al. (1962), J. H. Day (1967), McHugh (1966, 1967 y 1975), Dahlberg y Odum (1970), Qasim (1970), Parker y Blanton (1970), Thomas et al. (1971); Odum (1971), Odum y Heald (1972 y 1975), Odum et al. (1973), J. W. Day et al. (1973a y 1973b); Carr y Adams (1973), Hodgkin (1973), Lenaton (1973), McErlean et al. (1973), Nixon y Oviatt (1973), Turner y Johnson (1973), Wagner (1973), Wiley et al. (1973), Heald et al. (1974), Hester y Copeland (1975). Stuardo, et al. (1974), De Sylva (1962, 1975 y 1976), Brook (1975); Saila (1975) ; Allen y Horn (1976), Subrahmanyam y Drake (1975), Subrahmanyam et al. (1976), Snedaker y Brook (1976); entre otros, además de los estudios particulares del autor de este trabajo. Se sabe que México posee 1.5 millones de hectáreas de ambientes estuarinos, y según Cárdenas (1969) y Yáñez-Arancibia (1975 a y 1976 b) 12, 555 km² de superficie de lagunas costeras, real y/o potencialmente productivas, muchas de ellas en estados precarios de explotación, otras irracionalmente explotadas, pero todas en un estado latente de contaminación futura por los impactos del hombre en el ambiente natural. Según Lankford (1977) las costas de México se encuentran marginadas por 125 lagunas costeras, lo que le da al país una característica litoral muy particular y excepcional. OBJETIVOSConsiderando todos los antecedentes presentados y entendiéndose que la explotación y/o cultivos de organismos marinos, así como también que la comprensión de la dinámica de un ambiente natural, implica un conocimiento taxonómico y ecológico acabado de las especies a explotarse y de su biología, se propone este estudio ictio ecológico como un esfuerzo que se identifica con: a) la necesidad de resolver problemas biológicos de los peces de ambientes lagunares dentro de una de las líneas de investigación del Laboratorio de Ictiología y Ecología Estuarina del Centro de Ciencias del Mar y Limnología de la UNAM; b) con los intereses de prospección y evaluación de recursos renovables para su óptimo aprovechamiento en un país como México con 10 000 km. de litoral, 500 000 km² de plataforma continental y 200 millas de mar patrimonial, y c) con las perspectivas particulares de desarrollo socioeconómico de la zona costera del Estado de Guerrero. En ese contexto el estudio pretende: 1) determinar las características de la dinámica ambiental de las lagunas, y la fauna y flora típicas de ellas, 2) precisar el status taxonómico de la fauna ictiológica del área, 3) discutir la diversidad, la composición y la abundancia de las especies, de las poblaciones y de las comunidades, 4) interpretar la tendencia del flujo energético del ecosistema sobre la base de las relaciones tróficas de los organismos, 5) entregar algunos aspectos de la dinámica de las poblaciones de los peces de importancia comercial, 6) caracterizar ictioecológicamente a las diferentes lagunas y determinar la estructura de sus comunidades, y, 7) discutir el papel que ecológicamente juegan los peces en los ecosistemas estuarinos estudiados. La organización del trabajo sigue en parte el modelo de progresión de complejidad propuesto por Yáñez-Arancibia (1975 a) y esquematizado en la figura 1. 1. Reconocimiento del área. Planeación de los muestreos y prospección de la ictiofauna en periodos de seca y lluvia. 2. Evaluación estimativa del potencial íctico. Distribución, diversidad, frecuencia y abundancia. 3. Determinación de los peces: dulceacuícolas, estuarinos, anadromos y catadromos, marinos, visitantes esporádicos. 4. Caracterización del ambiente ictiológico lagunar. Pelágico litoral, bentónico litoral superior, estuarino y manglares. 5. Estudio de las relaciones tróficas. Alimentación y hábitos alimenticios. Relaciones predador - presa. 6. Dinámica de las poblaciones. Crecimiento, madurez gonádica y migraciones. 7. El rol ecológico de los peces. Determinación del flujo energético y los niveles tróficos en la ecología del estuario. 8. Estudio biológico pesquero de especies indígenas y visitantes cíclicos de importancia comercial. Perspectiva de cultivos y/o explotación racional del recurso. Predicción de la captura y captura máxima sostenible. 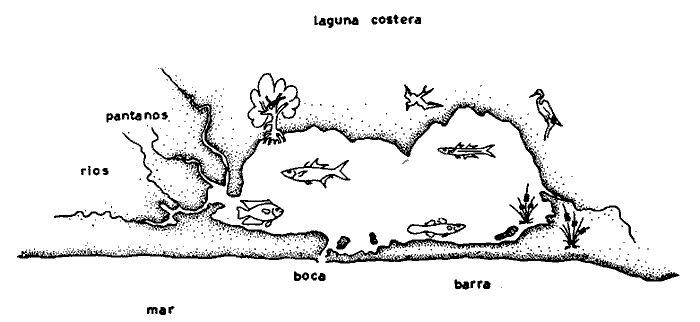 Fig. 1. Progresión de complejidad en el análisis de las investigaciones ictiológicas en lagunas costeras y sistemas estuarinos. ÁREA DE ESTUDIODiversos estudios se han referido al área, describiéndola de diferentes puntos de vista. En ese sentido, pueden clasificarse en las siguientes disciplinas: Geología, Geografía y Geomorfología (Lankford, 1974, 1975; Lankford et al., 1975; Warme y Sánchez, 1975; Carranza-Edwards et al., 1975). Climatología (García, 1973). Hidrografía (Arpi et al., 1974; Castellanos, 1975). Biología, Ecología e Hidrografía general (Ramírez-Granados, 1952, Stuardo et al., 1974; Stuardo y Martínez-Guerrero, 1975; Stuardo y Villarroel, 1976; Weinborn, 1974; Villarroel, 1975 y 1976; Estévez, 1975; Luján, 1975; Román, 1976; Licea et al., 1975 y 1976; Martínez- Guerrero, 1975 y 1978; Yáñez-Arancibia, 1974, 1975a, 1975b, 1976a, 1977a; Yáñez-Arancibia y Nugent, 1976; Yáñez-Arancibia et al, 1976). La totalidad de los trabajos mencionados (exceptuando a Ramírez-Granados, 1952 y García, 1973), discuten los rasgos generales de las diferentes lagunas y la mayoría coincide en definir el área como un sistema lagunar costero. Esto debido a numerosas características generales de la zona litoral, además de otras particulares para cada laguna. El origen geológico es común para todas ellas; el clima es el mismo a lo largo de la costa de Guerrero; reciben aporte de aguas dulces con una marcada variación estacional; se encuentran separadas del mar por una barra arenosa de amplitud y altura variable; existe influencia de aguas marinas en forma cíclica y con intensidad variable; la macrofauna es muy escasa y poco abundante. En general, las lagunas presentan cuerpos de aguas someras de volúmenes variables, dependiendo de la "seca" y del "estio", con temperaturas elevadas que descienden en los meses de diciembre-enero-febrero, fondos predominantemente fangosos, y características de topografía y superficies muy irregulares. En condiciones naturales las 9 lagunas estudiadas presentan un ciclo regular anual de entrada periódica de agua de mar (excepto Mitla por influencia del hombre), que se define y se describe en este trabajo como un ciclo de fisiología ambiental. GEOGRAFÍALa zona costera del Estado de Guerrero, se extiende en una longitud de alrededor de 490 kms, desde la desembocadura del Río Balsas, en el límite norte con Michoacán, hasta la Punta Maldonado, en el límite sur con Oaxaca (Mapa 1) . La mayor parte de la costa se caracteriza por el litoral lagunar pero también presenta algunas zonas rocosas y algunas llanuras de bajo relieve. Los estudios se han desarrollado en las siguientes lagunas costeras señaladas en el mapa 1: Salinas de ApozahualcoSuperficie aproximada 2 km²; se ubica entre Punta Acamama y el Río Marquelia; 98º 50' y 98º 51' W de longitud; profundidad media de 0.50 m; distancia aproximada de la costa en la parte más angosta de la barra 20 m; se orienta de sur a norte; la barra se encuentra al sur de la laguna y se abre directamente a la Bahía Dulce. Chautengo o NexpaSuperficie aproximada 34 km²; se ubica entre el Río Copala y el Río Nexpa; 99º 02' y 99º 09' W de longitud; profundidad 1.10 m; distancia aproximada de la costa en la parte más angosta de la barra 550 m; se orienta de oeste a este, la barra se encuentra al sur de la laguna y se abre directamente al mar. 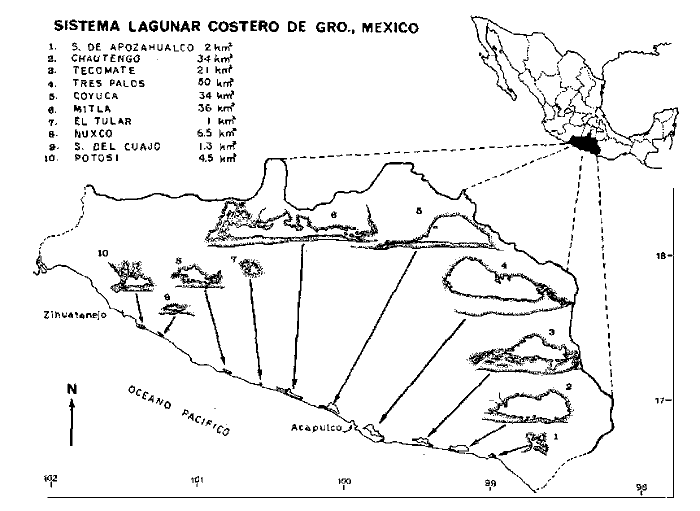 Mapa 1. Zona costera del Estado de Guerrero, México. Se indica en detalle el sistema lagunar, su ubicación geográfica y la relación de superficies entre las lagunas. San Marcos o TecomateSuperficie aproximada 21 km²; se ubica entre el Río Nexpa y el Río Papagayo; 99º 17' y 99º 27' W de longitud; profundidad media de 0.80 m; distancia aproximada de la costa 2,000 m; se orienta de oeste a este; la laguna se abre al mar a través de un largo y profundo canal meándrico. Tres PalosSuperficie aproximada 50 km²; se ubica entre el Río Papagayo y el Río Sabana, al suroeste de Acapulco; profundidad media 2.50 m; distancia aproximada de la costa 2,000 m; se orienta de oeste a este; la laguna se abre al mar a través de un largo y profundo canal meándrico. CoyucaSuperficie aproximada 34 km²; se ubica al noroeste de Acapulco; 99° 58' y 100º 08' W de longitud; profundidad media 2.50 m; distancia aproximada de la costa en el sector de la boca, 500 m; se orienta de oeste a este; la laguna se abre al mar a través de un largo canal meándrico ubicado en su parte norte. MitlaSuperficie aproximada 36 km²; se ubica al noroeste de Acapulco; 100º 14' y 100° 26' W de longitud; profundidad media 2. 90 m; distancia aproximada de la costa 1,000 m; se orienta paralela a la costa; la laguna se abría en forma natural al mar, año con año, pero permanece cerrada artificialmente desde 1968, en una boca situada al este de ella y donde la barra tiene unos 300 m de ancho. TularEn esta laguna no se han efectuado estudios ictiológicos particulares debido a que la laguna se encuentra totalmente aislada del mar y en la actualidad sólo existen allí unos cuantos ejemplares de peces de las familias Cichlidae, Poecillidae, Gobiidae y Elotridae. Superficie apróximada de 1 km² ; se ubica 20 km antes de la ciudad de Tecpan de Galeana; 100º 33' y 100° 34' W de longitud; profundidad media de 0.40 m; distancia aproximada de la costa 1,000 m; se orienta paralela a la costa. Nuxco o El 20Superficie aproximada 5.5 km²; se ubica 20 km al norte del pueblo de Nuxco y frente al pueblito. El 20; 100º 47' y 100° 49' W de longitud; profundidad media 1.90 m; distancia aproximada de la costa 1,000; se orienta de noroeste a sureste; la laguna se abre al mar a través de un corto canal recto ubicado en el sector este de ella. Salinas del CuajoSuperficie aproximada 1.3 km²; se ubica al noroeste de la ciudad de Papanoa; 101° 11' y 101° 13' W de longitud; profundidad media 0.50 m; distancia aproximada de la costa 950 m, se orienta paralela a la costa; la laguna es somera y se seca en gran parte al final del periodo de secas; se abre directamente al mar. PotosíSuperficie aproximada 4.5 km²; se ubica detrás del Morro de Potosí; 101° 24` y 101° 27' W de longitud; profundidad media de 1.50 m; distancia aproximada de la costa 1,000 m en periodo de secas y 550 m durante las lluvias; se orienta de oeste a este; la barra situada al noroeste de la laguna se abre directamente a la Bahía Potosí. CLIMAToda la costa de Guerrero presenta un clima tropical subhúmedo del tipo AW según García (1973), con lluvias en verano y sequías en invierno. El rango anual de la temperatura no excede los 5ºC. En la época de las lluvias los vientos predominantes son del SE y durante la época de secas dominan los vientos del NE. En general los vientos son importantes agentes de la evaporación local así como también la fuerte insolación. La precipitación pluvial más importante ocurre entre mayo y octubre durante la persistencia de los vientos marinos del SE. Por otra parte la evaporación media anual es superior a los valores medios de la precipitación anual. Los valores de evaporación medios anuales para las zonas estudiadas varían entre 1,900 y 2,000 mm, determinando un factor considerable en la variación de los valores de la salinidad de las aguas de las lagunas costeras. La estación climatológica de Acapulco (No. 12-001) detalla los siguientes datos para la zona costera de Guerrero (Tabla 1). En la figura 2 se han graficado los valores promedios mensuales de la temperatura y la precipitación, dado su importancia y relación con el ciclo de fisiología ambiental que presentan las lagunas. HIDROGRAFÍALa descarga fluvial afecta directamente los ecosistemas en cuestión. Castellanos (1975) ha señalado que el volumen anual de descarga está en función de varios factores como: a) área de la cuenca de drenaje, b) precipitación dentro de la cuenca, e) pérdida por evaporación, y d) cantidad de agua consumida por las actividades humanas. 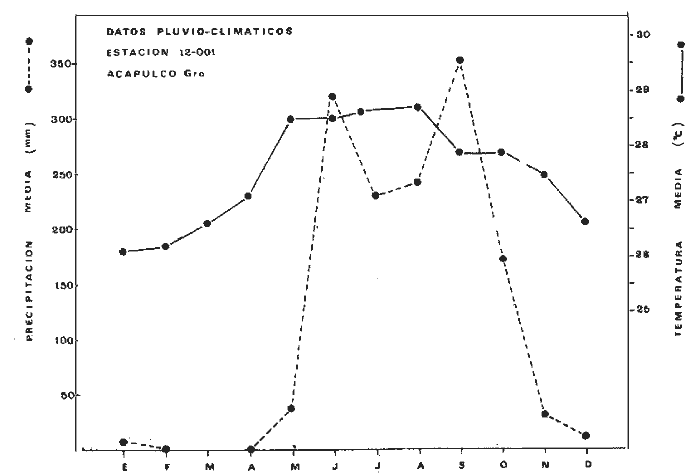 Fig. 2. Relación pluvio-climática, temperatura ambiente y precipitación, en la costa de Guerrero. Datos de la Estación 12-001 de Acapulco, Gro., México. 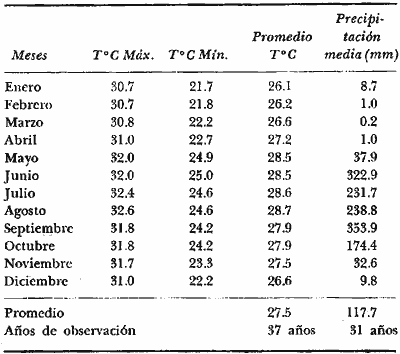 TABLA 1. DATOS CLIMATOLÓGICOS PARA LA COSTA DE GUERRERO, MÉXICO Los sedimentos acarreados por los ríos, contribuyen al asolvamiento paulatino que están sufriendo las lagunas. De todos los ríos del área, sólo unos pocos descargan directamente en el mar (i e, Papagayo, Balsas, Ometepec, entre otros) . La mayor parte de los ríos presentan un ciclo anual de descarga en la época de las lluvias y en gran parte se secan en los meses de intensa sequía. Esto ocurre marcadamente con dos ríos que descargan en Apozahualco, Tecomate, Mitla, Nuxco, Salinas del Cuajo y Potosí. Otros como Chautengo, Tres Palos y Coyuca, reciben un reducido caudal durante la época de sequía. En las figuras 3 y 4 se representan los valores mensuales de temperatura y salinidad del agua (Chautengo y Nuxco respectivamente) que corresponden a dos de las más importantes lagunas en donde se explotan peces comercialmente. Los datos han sido extractados de Castellanos (1975) y el gráfico modificado de ese mismo autor. En la figura 5 se representan valores medios del oxígeno disuelto en cuatro importantes lagunas del área estudiada, en un gráfico modificado de Castellanos (1975). 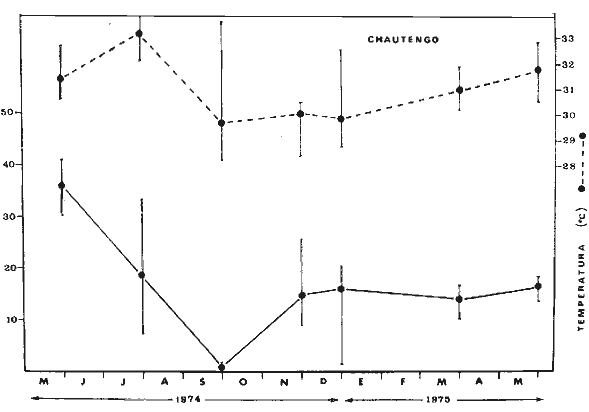 Fig. 3. Promedios mensuales de salinidad y temperatura de las aguas en la laguna de Chautengo, Gro., México. Extractado y modificado de Castellanos (1975). 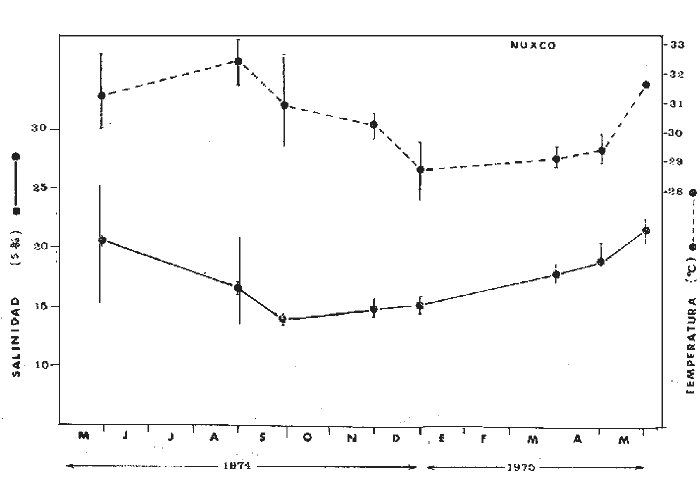 Fig. 4. Promedios mensuales de salinidad y temperatura de las aguas en la laguna de Nuxco, Gro., México. Extractado y modificado de Castellanos (1975). 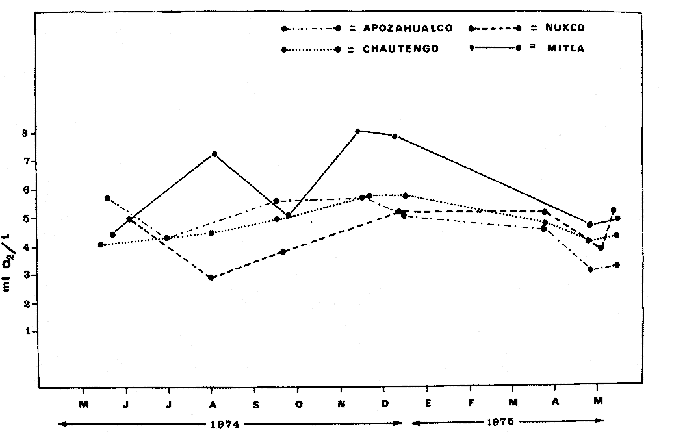 Fig. 5. Promedios mensuales de oxígeno disuelto en cuatro importantes lagunas de Guerrero, México. Modificado de Castellanos (1975). ECOLOGÍA PRELIMINARLas epi e infaunas bentónicas se encuentran escasamente representadas en todas las lagunas (Stuardo y Villarroel, 1976; Villarroel, 1973 y 1976, al igual que la vegetación sumergida, exceptuando manglares y otra vegetación semiacuática (Stuardo et al., 1974). Sin embargo, los peces y el fitoplancton son particularmente abundantes en algunas lagunas (Yáñez-Arancibia, 1974, 1975a, 1975b, 1976b, 1977a; Yáñez-Arancibia y Nugent, 1976 Yáñez-Arancibia et al., 1975 y 1976). El volumen de agua de las diferentes lagunas está en relación directa con los periodos de secas y de lluvias, las temperaturas descienden ligeramente durante el invierno, y las salinidades son tan variables que van desde el agua dulce (0.00 ‰) hasta ambientes hipersalinos (125.0 ‰) en algunas lagunas donde en el periodo de secas precipita la sal (NaCL) y la explotan comercialmente. Sólo las lagunas de mayor volumen, superficie y profundidad (i. e., Tres Palos, Coyuca y Mitla) logran mantener un adecuado balance salinos y los rangos no exceden valores extremos conservándose prácticamente dulceacuícolas durante todo el año con salinidades máximas que no exceden 3.5 ‰. En general todas las lagunas presentan valores de oxígeno lejos de valores letales para comunidades de peces; esto es, menos de 2.0 ml 02/l según Hedgpeth 1975a) y menos de 1.0 ml 02/l para animales estuarinos, según Muus (1967). La acción del viento, lo somero de las aguas, y la existencia de una biomasa considerable de productores primarios (macrofitas, microfitas y fitoplancton) aseguran una buena oxigenación de las aguas de las lagunas, el que eventualmente puede descender durante la noche (i. e., Mitla) por fondos reductores en procesos de oxidación de la materia orgánica que llega al fondo. La zona de las bocas es característica por los sedimentos arenosos, los cuales son fangosos hacia el interior de la laguna y en las orillas de manglares. En las desembocaduras de los distributarios predominan sedimentos poco clasificados. MATERIAL Y MÉTODOS
ACTIVIDADES DE CAMPOLas capturas de los peces fueron realizadas a bordo de dos tipos de embarcaciones. pequeñas canoas denominadas "cayucos", de no más de 3.0 m de eslora, y una lancha metálica de fondo plano de 3.2 m de eslora y con motor fuera de borda de 9.5 HP. Se colectó además desde la orilla empleando como artes de pesca: chinchorro (malla 1/4"), atarraya (malla 1/2" y 5.0 m de diámetro), agallera (± 100 m de largo y malla 2.0"), y anzuelos de diferentes tamaños. Se efectuaron 12 colectas generales: 1a. colecta: del 10 al 18 de septiembre de 1973 2a. colecta: del 20 al 25 de septiembre de 1973 3a. colecta: del 23 al 26 de octubre de 1973 4a. colecta: del 20 al 25 de noviembre de 1973 5a. colecta: del 10 al 14 de enero de 1974 6a. colecta: del 5 al 10 de marzo de 1974 7a. colecta: del 14 al 24 de mayo de 1974 8a. colecta: del 15 al 23 de agosto de 1974 9a. colecta: del 18 al 30 de octubre de 1974 10a. colecta: del 7 al 13 de enero de 1975 11a. colecta: del 17 al 26 de marzo de 1975 12a. colecta: del6 al 20 de julio de 1975 Todas las colectas fueron diurnas, en profundidades que no excedieron los 2.5 m, y planificados de manera que se cubriera de la mejor forma posible la superficie de cada laguna así como también los diferentes ambientes del área. En los mapas 2 al 10 se señalan las estaciones de colectas para cada una de las diferentes lagunas. Para cada estación de colecta se efectuaron 10 lances de pesca y se cuantificó la densidad y biomasa ictiofaunística así como también el esfuerzo de pesca en relación al arte utilizado (i. e., atarraya) . El atarraya, si bien es cierto es una red selectiva, es al mismo tiempo particularmente eficiente en las aguas turbias y someras de las lagunas. El material recolectado era rápidamente llevado a la embarcación usada para impedir la regurgitación, fijándose en formalina 10% neutralizada previamente con Borato de Sodio. A continuación los estómagos fueron inyectados, lo que es muy importante porque el -retardar la fijación del alimento hace que el contenido estomacal sea irreconocible después de 20 minutos. Ball (1948) , Yáñez-Arancibia (1975b, 1976a, 1977a) y Yáñez-Arancibia et al. (1976) han hecho hincapié en esta observación. Posteriormente el material se etiquetaba y envasaba en bolsas de polietileno para su transporte al laboratorio. Mediciones de temperatura, salinidad, oxígeno, profundidad, turbiedad, tipo de sustrato, vegetación sumergida, plancton, macrofauna bentónica, aves y observaciones climatológicas fueron realizadas en el área durante cada muestreo. Cada una de esas investigaciones fue reportada por especialistas (ver Agradecimientos) MATERIAL DE ESTUDIODe las 12 colectas generales en el área de estudio, se consideraron las más representativas para cada uno de los 3 periodos ecológicos que caracterizan al sistema lagunar costero de Guerrero (ver Capítulo de Composición, Diversidad y Abundancia) . Eso determinó que fueran examinados 15,905 peces de una colección total, detallados de la siguiente manera: Salinas de Apozahualco 1,013 ejemplares; Chautengo 4,325 ejemplares; Tecomate 1,353 ejemplares; Tres Palos 3,930 ejemplares; Coyuca 1,064 ejemplares; Mitla 1,240 ejemplares; Nuxco 1,474 ejemplares Salinas del Cuajo 451 ejemplares, Potosí 1,055 ejemplares.  Mapa 2. Laguna Salinas de Apozahualco. Orientación latitudinal y localización de las estaciones de muestreo. 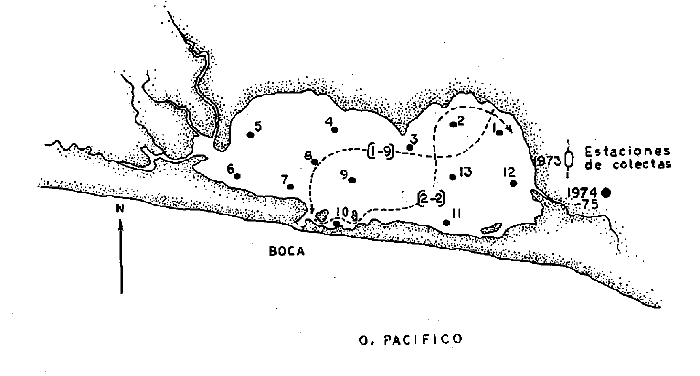 Mapa 3. Laguna Chautengo. Orientación latitudinal y localización de las estaciones de muestreo. 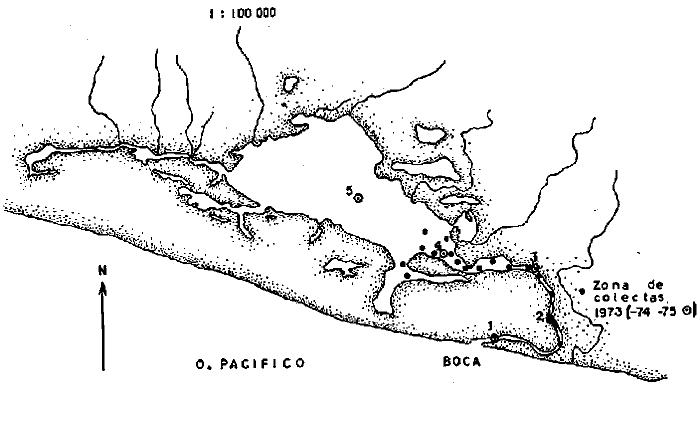 Mapa 4. Laguna Tecomate. Orientación latitudinal y localización de las estaciones de muestreo. 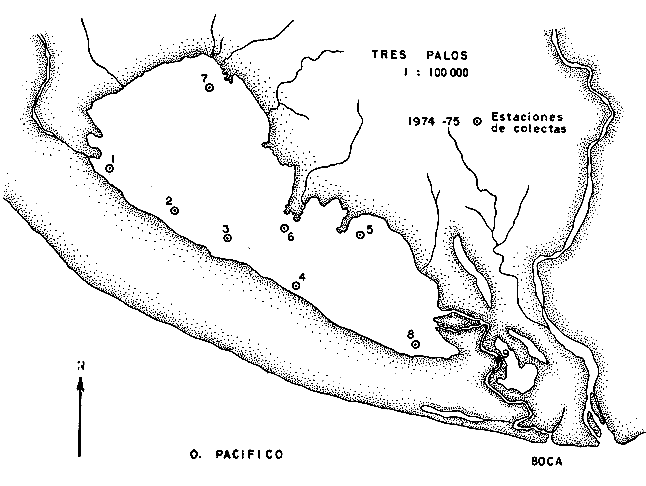 Mapa 5. Laguna Tres Palos. Orientación latitudinal y localización de las estaciones de muestreo. 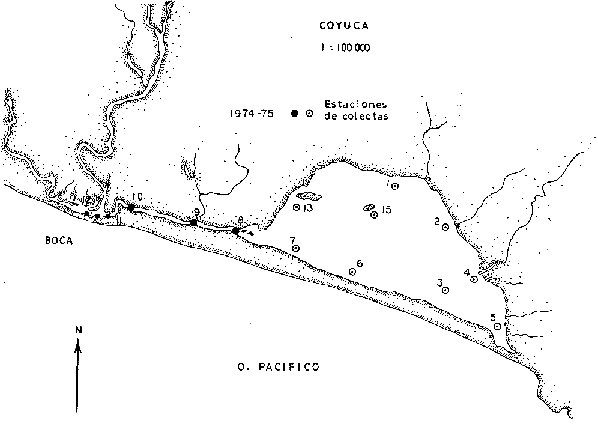 Mapa 6. Laguna Coyuca. Orientación latitudinal y localización de las estaciones de muestreo. 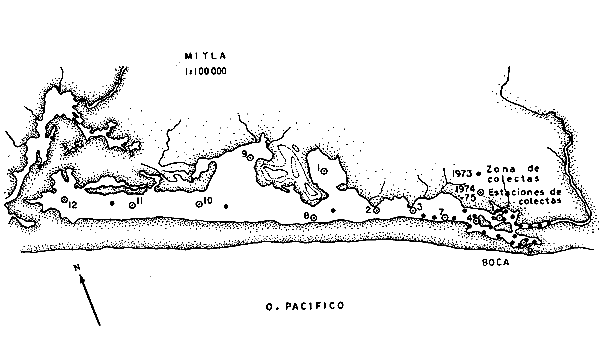 Mapa 7. Laguna Mitla. Orientación latitudinal y localización de las estaciones de muestreo. 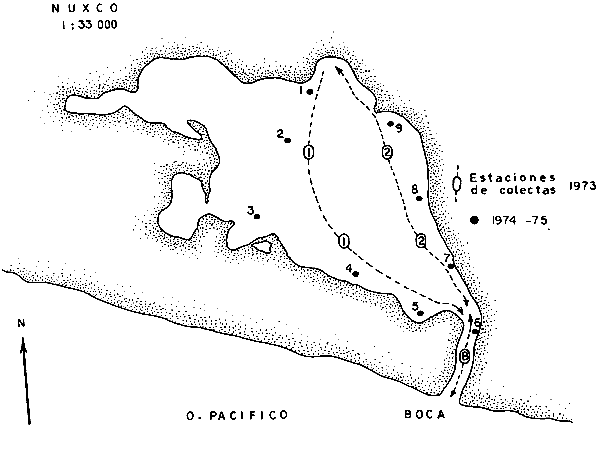 Mapa 8. Laguna Nuxco. Orientación latitudinal y localización de las estaciones de muestreo. 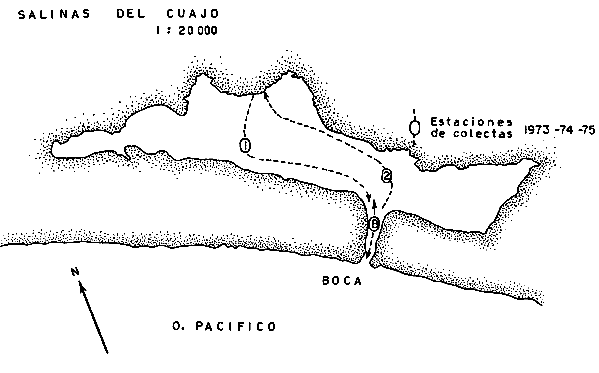 Mapa 9. Laguna Salinas de Cuajo. Orientación latitudinal y localización de las estaciones de muestreo. 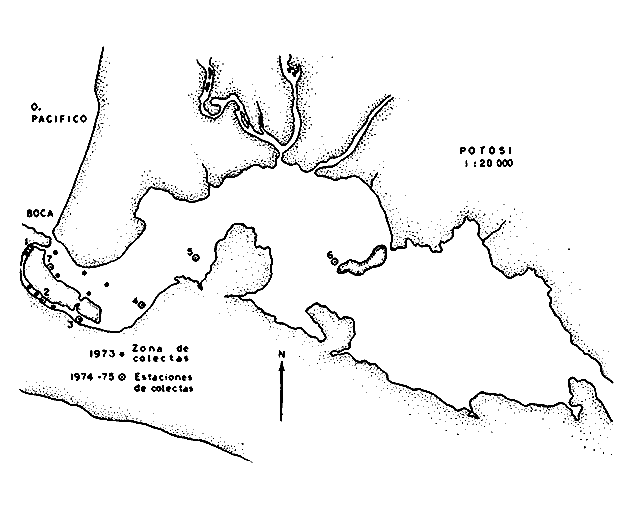 Mapa 10. Laguna Potosí. Orientación latitudinal y localización de las estaciones de muestreo. ACTIVIDADES DE LABORATORIOEn el laboratorio los peces fueron reetiquetados, reenvasados en frascos de vidrio y preservados en alcohol metílico 70 % para el análisis que se detalla a continuación. TAXONOMÍALa determinación de las especies fue hecha con métodos convencionales, empleando la literatura básica, principalmente los trabajos citados en los Antecedentes (ver Introducción). Las proporciones, recuentos y medidas fueron obtenidas con un ictiómetro convencional, siguiendo para la definición de términos técnicos el criterio de Hildebrand (1946). Para la ordenación sistemática se siguió en parte el criterio de Berg (1940) y fundamentalmente el de Greenwood et al. (1966 y 1967) para las categorías supragenéricas. Las diagnosis para las especies fueron elaboradas considerando los rangos de variación de la colección estudiada y, eventualmente, considerando la información publicada en los trabajos más importantes. Después de su análisis, las muestras quedaron depositadas en la Colección Ictiológica del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México, bajo la Clave CCML - PF, Gro. Esta Clave se define de la siguiente manera: institución = CCML = Centro de Ciencias del Mar y Limnología Fauna = PF = Peces/Fishes Localidad = Gro. = Guerrero, México COMPOSICIÓN, DIVERSIDAD Y ABUNDANCIALas comunidades ictiofaunísticas están formadas por diversos componentes faunísticos, los cuales fueron determinados en relación a su origen, tolerancia a las salinidades y frecuencia de aparición. La composición propuesta en este estudio para las lagunas costeras mexicanas, es discutida en relación a los trabajos de Günter (1956), Hedgpeth (1957a), McHugh (1967), y Yáñez-Arancibia (1975a y 1976b). La diversidad fue considerada como número de especies, para cada laguna y su variación en relación al tiempo y a las características bióticas y abióticas predominantes. Además fue discutido un índice de diversidad para cada colecta en cada laguna, de acuerdo a la fórmula de Shannon y Weaver (1963) : 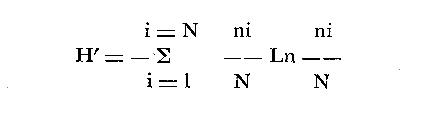 donde, ni = número de individuos de una especie, y N = número total de individuos de todas las especies. Esto sirvió para discutir la afinidad ecología de las lagunas de acuerdo a la diversidad ictiofaunística que presentan. Fue utilizado H' porque su cálculo depende tanto de la riqueza de especies como de la distribución equitativa de los individuos de todas las especies en cada muestra. Poole (1974) y Subrahamanyam y Drake (1975) han discutido detalladamente este aspecto. El índice de Margalef (1969) a menudo refleja los cambios en el número de especies en relación al tamaño de la muestra sin asignar el mismo valor a dos colectas que tienen diferente número de especies (Harima y Mundy, 1974). Como es preferible considerar índices que traten estos aspectos separadamente, puesto que dos componentes de diversidad pueden reaccionar diferentemente a cierto tipo de factores, fue utilizado D como índice de riqueza de especies D = (S - 1) / log N donde S = número de especies y N = número de individuos. El índice de equitatividad J' puede servir para calcular la abundancia relativa de especies y fue el tercer índice utilizado (Pielou, 1966). J' = H' / H max = H' / log S donde log S = máximo valor posible de H'. Entonces H' = H max cuando todas las especies son igualmente abundantes. Todos estos cálculos de diversidad se basan en el uso de logaritmos naturales (log'e). La abundancia fue determinada en términos de densidad (número de ejemplares) y biomasa (peso en fijador) considerando un promedio de esos parámetros para toda la superficie de la laguna, sobre la base de 19.5 m² que es la superficie de colecta del "atarraya", y sobre la base de 10 lances de pesca para cada Estación. Esta última medida fue realizada solamente para las lagunas de Chautengo y Tres Palos; que corresponden a las lagunas "tipos" de los dos grupos propuestos. RELACIONES TRÓFICASEl examen de los estómagos y el estado del pez se hizo siguiendo el criterio de Laevastu (197 1); las fases de digestión del contenido estomacal fueron determinados de acuerdo a Carranza (1969) y Yáñez-Arancibia (1975b). Yáñez-Arancibia (1975b) y Yáñez-Arancibia et al., han discutido la totalidad de los métodos para analizar el contenido estomacal de los peces: método volumétrico, numérico, método gravimétrico, método de frecuencia, cronología alimenticia, índice de importancia relativa, coeficiente de vacuidad, etcétera. De acuerdo al tamaño de los estómagos, al tipo y tamaño del alimento y al grado de digestión, es necesario combinar entre sí diferentes métodos para obtener una información más clara sobre la preferencia alimenticia de las especies en determinadas áreas. Las especies de importancia comercial fueron elegidas para un estudio cuantitativo de esta naturaleza. La alimentación del resto de las especies fue discutida cualitativamente. La elección del método apropiado se indica para cada especie en particular y éste discutido en relación a los trabajos de Aoyama (1953), Yokota (1956), Yasuda (1960), Odum (1971), Odum y Heald (1972), Pinkas et al., (1971), Yáñez-Arancibia et al. (1976). ASPECTOS BIOLOGICOS GENERALES DE LAS POBLACIONESPara los peces de importancia comercial se entrega información sobre madurez, crecimiento y migraciones, como aspectos generales de la biología de sus poblaciones. El examen de las gónadas se hizo considerando las fases de desarrollo sexual recomendadas por Nikolsky (1963). Las apreciaciones de crecimiento fueron hechas por distribución de frecuencia de longitudes en relación al tiempo. La ocurrencia estacional de ciertas poblaciones de peces determina que su comportamiento sea migratorio y es fácil de detectar. CARACTERIZACIÓN ICTIOECOLÓGICA DE LAS LAGUNASCada laguna fue caracterizada en relación a la ictiofauna típica que presenta y su variación en el tiempo. Además fueron reunidas en dos grupos en relación a afinidad ecológica determinado por a) efectos del ciclo de fisiología ambiental, b) profundidades medias, c) rangos de salinidades, d) rangos de temperaturas, e) biomasa fitoplanctónica, f) cantidad de detritus, g) cantidad de manglares presentes, h) biomasa macrobentónica, ¡) patrón de diversidad y abundancia de las especies y poblaciones de peces y j) complejidad de la estructura trófica de las comunidades nectónicas. EL PAPEL ECOLÓGICO DE LOS PECESEl papel ecológico de los peces en las lagunas costeras fue discutido en relación: a) la complejidad de la estructura de las comunidades, b) la alimentación y los hábitos alimenticios de los peces, c) el espectro trófico de cada especie, d) la trama trófica o "food web", y e) las tendencia del flujo de la energía. RESULTADOS
DINÁMICA AMBIENTAL DE LAS LAGUNASPor las características climáticas, geomorfológicas, hidrodinámicas, biológicas y ecológicas, las lagunas costeras de Guerrero corresponden a un sistema lagunar costero. Este sistema lagunar presenta una dinámica ambiental con 3 situaciones ecológicas marcadas que determinan cambios en la estructura ictio faunística de las lagunas y que puede ser definido como un ciclo de fisiología ambiental (Fig. 6). 1. El periodo de barra abierta al mar. Es un periodo normal donde se manifiesta la mayor influencia marina en el ecosistema y mezclas de aguas dulces o salobres y marinas con un gran intercambio biológico, físico y químico. El nivel medio de las lagunas oscila con las marcas pero en un rango limitado. Las salinidades máximas son de 34‰ oscilando desde ± 15‰. Las temperaturas oscilan entre 29 y 31°C. La precipitación es alta al igual que el escurrimiento y la evaporación. (Agosto, septiembre octubre, noviembre) 2. El periodo de secas. Es un periodo que se va haciendo hipersalino. No hay contacto con el mar y por lo tanto se carece de intercambio biológico, físico y químico. Hay un marcado descenso del volumen de agua interno y grandes presiones ambientales, principalmente por aumento de la salinidad y la temperatura. Las salinidades máximas registradas han sido de 125‰ oscilando desde ± 35‰. Las temperaturas oscilan entre 28 y 40°C. No existe precipitación como tampoco escurrimento, pero la evaparación es muy alta. (Noviembre, diciembre, enero, febrero, marzo, abril, mayo). 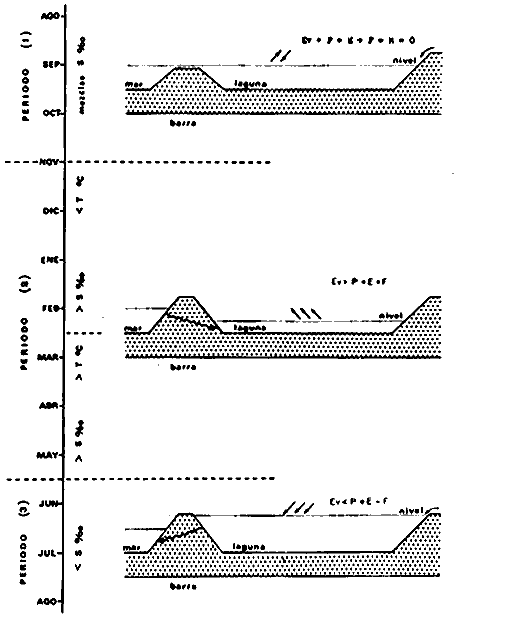 Fig. 6. Ciclo de fisiología ambiental que presenta las lagunas de Salinas de Apozahualco, Chautengo, Tecomate, Nuxco, Salinas de Cuajo y Potosí; y en mucho menor proporcion (en efectos biológicos) las lagunas de Tres Palos, Coyuca y Mitla. La laguna de Chautengo puede ampliar su periodo (1) hasta diciembre, así como la laguna de Nuxco lo reduce a un máximo de 15 días. Ev = evaporación, P = precipitación, E = escurrimiento, F = filtración, M = mareas. Explicación detallada en el texto. 3. El periodo de lluvias. Es un periodo hiposalino. No hay contacto con el mar y por lo tanto se carece de intercambio. biológico, físico y químico. Hay un marcado aumento de volumen de agua interno y un nuevo estres por la disminución brusca de la salinidad. Existe intercambio biológico con alguna fauna dulceacuícola continental. Con la subida del nivel del agua se forma una cabeza hidrostática y en un efecto combinado con la erosión de la barra desde el mar, se fuerza la abertura de la misma para reiniciar el ciclo. Las salinidades van de 0 a 12‰. Las temperaturas oscilan entre 29 y 35°C. La precipitación es muy alta al igual que el escurrimiento y la evaporación. (Mayo, junio, julio, agosto). Este ciclo de fisiología ambiental, resumido en la figura 6, es válido, en mayor o menor medida, para las lagunas Salinas de Apozahualco, Chautengo, Tecomate, Nuxco, Salinas del Cuajo y Potosí. Las lagunas de Tres Palos, Coyuca y Mitla, son grandes cuerpos de agua casi dulce, con salinidades máximas de 3.5‰ que no manifiestan cambios marcados durante, el año. Mitla por permanecer cerrada artificialmente al mar desde hace 9 o 10 años, y Coyuca y Tres Palos por efectos físicos del canal meándrico que las separa del mar. Los factores que intervienen son: a) la precipitación, b) el escurrimiento; c) la evaporación; según Lankford (comunicación personal) d) la filtración a través de la barra y desde el nivel superior; y e) las mareas. FAUNA Y FLORA TÍPICASEn un estudio de Stuardo (bentos), Martínez-Guerrero (bentos y zooplancton), Yáñez-Arancibia (peces y ecología estuarina), Weinborn (crustáceos) y Ruiz (vegetación sumergida) (Stuardo et al., 1974), se determinaron taxonómicamente los componentes faunísticos y florísticos del sistema lagunar costera de Guerrero, haciendo énfasis en aspectos ecológicos generales y en aspectos pesqueros particulares de las especies de importancia comercial. Martínez-Guerrero (1975 y 1978) discute específicamente las características del zooplancton. El enfoque de este trabajo hace necesario considerar a los componentes bióticos de las lagunas para caracterizarlas más adelante integrando, además, a la ictiofauna y el medioambiente. La vegetación costera de Guerrero ha sido abordada parcialmente por Brand (1960), Rzedowski y McVaugh (1966) y Stuardo et al. (1974); pero anterior a ellos Ramírez-Granados (1952) destacó la diferenciación de algunos tipos de vegetales para las lagunas de Coyuca y Tres Palos. La clasificación es interesante y puede ser aplicada, con mayor o menor propiedad, a la totalidad de las lagunas del sistema lagunar. La clasificación de Ramírez-Granados (1952) incluye tanto plantas terrestres, como semiacuáticas y acuáticas: a) palmar, b) lignetum perennifolio de manglar, c) vegetación semiacuática, y d) vegetación acuática. Palmar Representa un tipo de vegetación formado por poblaciones cultivadas de Cocos nucifera observado a lo largo de todo el litoral. Ruiz in Stuardo et al. (1974) señala que Brand (1960) y Dullman (1965) citan también a la palma Orbignya cohume como vegetación primaria hacia los límites nortes de Guerrero. Ruiz in Stuardo et al. (1974) considera como vegetación pionera de playa arenosa a la convolvulacea Ipomea pes-coprae y a la gramínea Jouvea pilosa que constituyen una asociación muy característica en ese habitat. Lignetum perennifolio de manglar Se encuentra en todas las lagunas del sistema lagunar de Guerrero. Se caracteriza por una distribución a menudo irregular predominando dos especies de manglar: Rhizophora mangle ("magle rojo") y Avicenia germinans ("mangle negro"). Además pueden encontrarse asociadas las especies de Cónocarpus erectus, Laguncularia racemosa ("magle blanco") y otras especies incluidas por Rzedowski y McVaugh (1966) en este tipo de vegetación. Vegetación semiacuática Muchas especies de este grupo son características de ambientes con salinidades bajas y pueden comportarse por ello como indicadores ecológicos. Las poblaciones mejor representadas incluyen Arundo donax ("carrizal") y Arundo sp; además especies de Cyperus, Typha y Scirpus ("tular"); y especies de Eichlornia spp ("lirio acuático") presentes en todas las lagunas de bajas salinidades. Vegetación acuática Lo trascendental en esto es que Ruiz in Stuardo et al. (1974) discute que en el sistema lagunar costero de Guerrero este tipo de vegetación contrasta significativamente con la caracterización de Rzedowski y McVatigh (1966), al extremo que las especies Chara sp, Cladophora sp, Ruppia maritima, Diplanthera spp, y la asociación de Phormidium/Microcoleus/Lyngbya/Spirulina subsalsa; se hallan presentes en determinadas lagunas cada una prácticamente en exclusión de las otras. Los crustáceos del sistema lagunar costero de Guerrero tienen una relativa diversidad y por sus características biográficas estas especies pueden considerarse parcialmente Panámicas y Californiensis. Por su comportamiento ecológico pueden caracterizarse en relación a los tipos de habitat que ocupan o de acuerdo con los rangos de distribución de la salinidad. Pueden distinguirse cuatro tipos de facies lagunares. Facie de playa. Caracterizado por especies de Gecarcinidae Grapsidae y Ocypodidae. Facie de manglar. Caracterizado por las mismas familias pero con especies diferentes. Facie bentónico pelágico. Caracterizado por Penaeidae y Palaemonidae. Facie bentónico de fondos arenosos y fangosos. Caracterizado por especies de Balanidae (epizoos), Portunidae, Callianassidae y Pinnotheridae. La predominancia de organismos de origen marino es notoria con respecto a los de origen dulceacuícola, y no existen especies endémicas en el área. Los moluscos constituyen un grupo de transcendental importancia ecológica y comercial. Sus comunidades tienen representantes marinos y dulceacuícolas, siendo estos últimos poco diversificados, solamente con las especies Amnicola sp y Neritina cassiculum. Las especies de origen marino más comunes han sido Felaniella (Z.) sericata, Iphigenia allior, Mytella strigata y Tagelus (T) longisinuatus. Los "ostiones" no son importantes en el sistema lagunar y sólo ocasionalmente ha habido desarrollo de Crassosterea iridescens y C. Palmula por períodos cortos de tiempo Stuardo y Villarroel (1976). En general la fauna bentónica es pobre en todas las lagunas costeras estudiadas y no caracteriza a las lagunas en particular, como ocurre, por el contrario, con la fauna de peces, y aún con el tipo de vegetación presente incluyendo al fitoplancton. SALINAS DE APOZAHUALCOAdemás de manglares distribuidos irregularmente, existen en la laguna Enteromorpha y Cladophora en abundancia relativa, particularmente durante el periodo 1 de la laguna y esporádicamente Phormidium, Lyngbya y Padina durvillaei. Las especies de crustáceos encontrados han sido Penaeus vannamei, P. stylirostris, P. californiensis, Macrobrachium tenellum, Callianasa sp, Callinectes arcuatus, C. toxotes. Los grupos de zooplancton más comunes han sido Copépodos, Quetognatos, larvas de Gasterópodos, larvas de Cirripedios, larvas de Bivalvos, larvas de Poliquetos, larvas de Decápodos, larvas de Cifonautes, Cladoceros y algunas larvas y huevecillos de peces. Entre los moluscos se han encontrado Alvinia sp, Amnicola sp, Felaniella (Z.) sericata, Tagelus (T). longisinuatus. Entre los anélidos, Nereis sp y Serpulidos. En la Lám. 1, se señalan las especies más típicas de esta laguna así como las especies de importancia comercial. CHAUTENGOAdemás de manglares, existen en la laguna Cladophora sp, Enteromorpha spp y algunas asociaciones vegetales menores. Organismos de esponjas de agua dulce Demospongiae también han sido encontrados. Las especies de crustáceos encontrados han sido Penaeus vannamei, Penaeus spp, Macrobrachium tenellum, Clibanarius panamensis, Callinectes arcuatus, C. toxotes., Hexapanopeus orcutti, Uca mordax y Tanaidáceos. Los grupos de zooplancton más comunes han sido Copépodos, larvas de Bivalvos, larvas de Poliquetos, larvas de Decápodos, larvas de Peces, Cladoceros, Tintínidos, Tanaidáceos, larvas de Insectos, Anfípodos, Medusas, Ostrácodos, Dinoflagelados. Entre los moluscos se han encontrado Amnicola sp, Neritina cassiculum, Iphigenia altior, Mytella strigata, Polymesoda spp Tagelus (T.) longisinuatus. Además a veces es frecuente un isópodo Cirolana sp. En la Lám. 2 se señalan las especies más típicas de esta laguna así como las especies de importancia comercial. TECOMATEAdemás de manglares, existen en la laguna Cladophora sp, Enteromorpha sp, con abundancia regular. Las especies de crustáceos encontrados han sido Penaeus vannamei, Penaeus spp, Callinectes arcuatus, C. loxotes, Balanus sp, y una especie de Pinotheridae. Los grupos de zooplancton más característicos han sido Copépodos, larvas de Gastrópodos, larvas de Bivalvos, larvas de Cirripedios, larvas de Decápodos, larvas de Poliquetos, Ostrácodos y algunas larvas de Peces. Entre los moluscos se han encontrado conchas de Alvinia sp, Amnicola sp, Neritina cassiculum, Mytella strigata, Polymesoda sp, Tagelus (T.) longisinuatus. En la Lám. 3 se señalan las especies más típicas de esta laguna así como las especies de importancia comercial. TRES PALOSAdemás de manglares de los géneros Rhizophora, Conocarpus, Laguncularia y Avicenia, se encuentran otros vegetales de las familias Alismaceae (Sagittaria) , Characeae,Ceratophyllaceac, Lemnaceae, Gramineae, Cyperaceae, Nyrnphaceae, Pontedericeae (Eichlornia sp) , Arundo sp, Typha sp. El macrobentos prácticamente no existe pero pueden encontrarse algunos crustáceos como Macrobrachium tenellum, Pennaeus spp, algunos Grapsidos y jaibas Callinectes toxotes y Callinectes arcuatus en la zona del canal. Entre la fauna zooplanctónica destacan Cladocera, Ostracoda, Copepoda, Isopoda, Anphipoda, aunque algunos de ellos no son parte de las comunidades zooplanctónicas pueden ser colectados por lo somero de las aguas. Las larvas de los insectos Chironomus sp y Ch. meigen son muy frecuentes y abundantes, así como también el Isópodo Cirolana sp. COYUCALa misma caracterización anterior para Tres Palos. En la Lám. 4 se señalan las especies más típicas de esta laguna así como las especies de importancia comercial. MITLALa misma caracterización para Tres Palos y Coyuca, agregando algunas especies más frecuentes como Phormidium spp, Chara sp, Cladophora spp, entre los vegetales. Los manglares, los juncos y los carrizales y en menor proporción el lirio acuático, constituyen la vegetación más característica de las lagunas de Tres Palos, Coyuca y Mitla. Entre los grupos del zooplancton más frecuentes para esta laguna, se encuentran los Copépodos, larvas de Macrobrachium, larvas de Peces dulceacuícolas, Cladoceros, larvas de Chironomus spp, Ostrácodos, Entre los moluscos se ha encontrado Amnicola sp, y conchas muertas de Bittium sp, Triphora sp y Mytella strigata. En la Lám, 5 se señalan las especies más típicas de esta laguna así como las especies de importancia comercial. NUXCOAdemás de manglaresde relativa abundancia existen en la laguna Lyngbya spp, Chaetomorphaspp y Ruppia maritima como uno de los principales productores primarios de la laguna. Las especies de crustáceos encontradas han sido Balanus amphitrite, Penaeus spp, Callinectes spp, Hexapanopeus orcutti y Cardisoma crassum. Los grupos del zooplancton más comunes han sido Copépodos, larvas de Cirripedios, larvas de Bivalvos, larvas de Decápodos, larvas de Poliquetos, Ostrácodos, Nemátodos (por lo somero de las aguas) y algunas larvas y huevecillos de peces. Entre los moluscos se han encontrado Amnicola sp, Bittlum sp, Cerithidea mazatlanica, Nassarius (A.) bailyi pero han predominado las conchas muertas de esos organismos; entre los moluscos vivos se ha encontrado Neritina cassiculum, Melongena sp, Felaniella (Z.) sericata, Mytella strigata. Entre los anélidos se han encontrado algunos poliquetos Nereis sp. En la Lám. 6 se señalan las especies más típicas de esta laguna así como las especies de importancia comercial. SALINAS DEL CUAJOAdemás de algunos pocos manglares se encuentran Lyngbya spp, Phormidium spp, Microcoleus sp, Spirulina subsalsa, Cladophora spp, Ruppia maritima. Las especies de crustáceos encontradas han sido Coenobita compressus, Penaeus spp, Callinectes spp, Cardisoma crassum. Los grupos del zooplancton más característicos han sido Copépodos, larvas de Gastrópodos, larvas de Decápodos, insectos acuáticos. Entre los moluscos se ha encontrado Amnicola sp, Bittium sp, pero este último solamente conchas muertas. En la Lám. 7, se señalan las especies más típicas de esta laguna así como las especies de importancia comercial. POTOSIAdemás de manglares se encuentran Dermocarpa sp, Lyngbya mucicola, Lyngbya spp, Radaisia sp, Xenococcus sp, Chaetomorpha spp, Cladophora spp, Enteromorpha spp, Ectocarpus sp,Gelidium pusillum, Heterosiphonia sp, Jania sp, Polysiphonia spp, Halodule sp. Las especies de crustáceos encontrados han sido Penaeus spp,Coenobita compressus, Callinectes arcuatus, Pinnixa sp. Los grupos del zooplancton más comunes han sido Copépodos, larvas de Bivalvos, larvas de Gastrópodos, larvas de Cirripedios, larvas de Decápodos, larvas de Poliquetos, Cladóceros, larvas de Insectos, Tintínidos, Anfipodos, Ostrácodos, Dinoflagelados, Nemátodos (por lo somero de las aguas) , y algunas larvas y huevecillos de peces, e Isópodos. Entre los moluscos se han encontrado vivos ejemplares de Tagelus (T.) longisinuatus y conchas muertas de Acteocina angustior, Alvinia sp, Amnicola sp, Cerithidea mazatlanica, Cerithium (Th.) stercusmusculatum, Natica (N.) sp, Chione sp, Chione (L) subrugosa, Corbula (C.) sp, Crassostrea iridescens, Felaniella (Z.) sericata, Protothaca asperrima, Triphora sp. Algunos hidrozoarios también han aparecido entre los organismos bentónicos y poliquetos serpúlidos y nereidos. En la Lám. 8 se señalan las especies mas típicas de esta laguna así como las especies de importancia comercial. Esta síntesis permite apreciar el panorama general de la diversidad y la distribución de la macro flora y fauna, como también los principales grupos zooplanctónicos existentes en el área. Sin embargo, las características del fitoplancton son un poco más difícil de discutir y eso determina extraer en forma muy general lo que aparentemente parece lo más significativo del trabajo de Licea-Durán et al. (1976). Al respecto esos autores señalan que en la laguna Salinas de Apozahualco predominan las diatomeas y luego en menor proporción le siguen las dinoflageladas, las cianofitas, las clorofitas, las euglenofitas y finalmente las fitoflageladas; esta composición con una densidad promedio anual de 43.2 millones de células por litro. En la laguna de Chautengo dominan las bacilariofitas, luego le siguen las clorofitas, cianofitas, dinoflageladas, euglenofitas y fitoflageladas; esta composición con una densidad promedio anual de 7.8 millones de células por litro. En la laguna de Mitla predominan durante el año las cianofitas y clorofitas con una densidad promedio anual de 109 - 1010 células por litro. En la laguna de Nuxco predominan las basilariofitas y en general la densidad promedio anual es de 6.9 millones de células por litro. En la laguna de Potosí predominan las diatomeas luego le siguen en importancia las cianofitas, las clorofitas, las euglenofitas y las fitoflageladas; esta composición con una densidad promedio anual de 6.2 millones de células por litro. Al tenor de los resultados fitoplanctónicos de Licea-Durán et al. (1976) y en relación a lo que ellos discuten, las lagunas estudiadas tienen una capacidad de producción primaria alta, con las biomasas más bajas al iniciar lo que en este trabajo se ha definido como periodo ecológico 1, misma que aumenta significativamente hacia fines del periodo 1. Otro hecho significativo es lo diferente que resulta la laguna de Mitla, en composición fitoplanctónica y abundancia, frente al resto de las lagunas estudiadas por Licea-Durán et al. (1976). Entre las aves acuáticas del lugar destacan Fulica americana ("gallaretas") Phalacrocorax auritus ("pato buzo") , Ardea herodias y A. condissima ("garzas parda y blanca") y Dafila acuta ("pato golondrino") , además de "pelícanos", "gaviotas", y numerosas pequeñas avecillas marinas. Esta avifauna se distribuye indistintamente por toda la costa de Guerrero. CATÁLOGO DESCRIPTIVO E ILUSTRADO DE LA FAUNA ICTIOLÓGICA. TAXONOMIA Y DISTRIBUCIÓN
Examinados 15 905 especímenes fueron determinadas 2 clases, 2 divisiones, 6 superórdenes, 13 órdenes, 22 subórdenes, 37 familias, 67 géneros y 105 especies. La ordenación sistemática sigue parcialmente el criterio de Berg (1940) para categorías genéricas y específicas, y el criterio de Greenwood et al. (1966 y 1967) para categorías supragenéricas. Queda depositada una colección de referencia en la Sala de Colecciones del Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. LISTA SITEMÁTICA DE LA ICTIOFAUNA A. Clase Chondreichthys Orden Selachii Suborden Heterodontoidea Familia I. Heterodontidae Género 1. Heterodontus Blainville, 1816 1) Heterodontus francisci (Girard, 1854) Suborden Galeoidea Familia II. Orectolobiidae Género 2. Ginglymostoma Müller y Henle 1837 2) Ginglymostoma cirratum (Bonnaterre, 1788) Orden Batoidei Suborden Pristoidea Familia III. Pristidae Género 3, Pristis Klein, 1779 3) Pristis zephyreus Jordan yStarks, 1895 Suborden Myliobatoidea Familia IV. Urolophidae Género 4. Urotrygon Gill, 1863 4) Urotrygon nebulosus Garman 1885 5) Urotrygon asterias (Jordan y Gilbert, 1882) 6) Urotrygan aspidurus (Jordan y Gilbert, 1881) 7) Urotrygon goodei (Jordan y Bollman, 1889) 8) Urotrygon chilensis (Günther, 1859) 9) Urotrygon sp A B. Clase Osteiclithys División I. Tacniopaedia Superorden Elopomorpha Orden Elopiformes Suborden Elopoidei Familia V. Elopidae Género 5. Elops Linnaeus, 1766 10) Elops affinis Regan, 1909 Suborden Albuloidei Familia VI. Albulidae Género 6. Albula Gronow, 1763 11) Albula vulpes (Linnacus, 1758) Género 7. Dixonina Fowler, 1910 12) Dixonina nemoptera Fowler, 1910 Orden Anguilliformes Suborden Anguilloidei Familia VII. Xenocongridae (Myiridae) Género 8. Myrophis Lutken, 1851 13) Myrophis vafer Jordan y Gilbert, 1882 Superorden Clupeomorpha Orden Clupeiformes Suborden Clupeoidei Familia VIII. Clupeidae Género 9. Lile Jordan y Evermann, 1896 Género 10. Opisthonema Gill, 1861 14) Lile stolifera (Jordan y Gilbert, 1896) 15) Opisthonema libertate (Günther, 1866) Género 11. Opisthopterus Gill 1861 16) Opisthopierus dovii (Günther, 1868) Género 12, Pliosteostoma Norman, 1923 17) Pliosteostoma lutipinnis (Jordan y Gilbert, 1881) Familia IX Engraulidae Género 13. Anchovia Jordan y Evermann, 1896 18) Anchovia macrolepidola (Kner y Steindachner, 1865) Género 14. Anchoa Jordan y Evermann, 1927 19) Anchoa panamensis (Steindachner, 1875) 20) Anchoa mundeoloides (Breder, 1928) 21) Anchoa curta (Jordan y Gilbert, 1882) 22) Anchoa schofieldi (Jordan y Culver, 1895) División III. Euteleostei Superorden Protacanthopterygii Orden Gonorynchiformes Suborden Chanoidei Familia X Chanidae Género 15. Chanos Lacépède, 1803 23) Chanos chanos (Forskal, 1775) Superorden Ostariophysi Orden Cypriniformes Suborden Characoidei Familia XI Characidae (Characinidae) Género 16. Astyanax Baird y Girard, 1854 24) Astyanax fasciatus (Cuvier, 1854) Orden Siluriformes Familia XII, Ariidae Género 17. Galeichthys (Cuvier y Valenciennes, 1840) 25)Galeichthys caerulescens (Günther, 1864) 26) Galeichthys Gilberti Jordan y Williams, 1895 Género 18. Arius Cuvier y Valenciennes, 1858 27) Arius liropus (Bristol, 1896) Superorden Atherinomorpha Orden Atheriniformes Suborden Exocoetoidei Familia XIII. Exocoetidae (Hemirhamphidae) Género 19. Hyporhamphus Gill, 1860 28) Hyporhamphus unifasciatus (Ranzani, 1842) 29) Hyporhamphus patris Miller, 1945 Familia XV. Poecilidae Género 20. Strongylura Van Hasselt, 1823 30) Strongylura stoIzmanni (Steindachner, 1878) Género 21. Tylosurus Cocco, 1833 31) Tylosurus fodiator Jordan y Gilbert, 1881 Suborden Cyprinodontoidei Familia XV. Pociliidae Género 22. Poecilia Bloch y Schneider, 1801 32) Poecilia sphenops Cuvier y Valenciennes, 1846 Género 23. Poeciliopsis Regan, 1913 33) Poeciliopsis lucida Miller, 1960 34) Poeciliopsis porosus De Buen, 1943 35) Pocciliopsis balsas Hubbs, 1926 Género 24. Poecilistes Hubbs, 1926 36) Poecilistes pleurospilus Günther, 1866 Suborden Atherinoidei Familia XVI. Atherinidae Género 25. Thyrinops Hubbs, 1918 37) Thyrinops crystallina Jordan y Culver, 1895 Superorden Acanthopterygii Orden Scorpaeniformes Suborden Scorpaenoidei Familia XVII. Triglidae Género 26. Prionotus Lacépède, 1802 38) Prionotus ruscarius Gilbert y Starks, 1904 Orden Perciformes Suborden Percoidei Familia XVIII. Centropomidae Género 27. Centropomus Lacépède, 1802 39) Centropomus nigrescens Günther, 1864
40) Centropomus robalito Jordan y Gilbert, 1881 41) Centropomus pectinatus Poey, 1860 Familia XIX. Serranidae Género 28. Diplectrum Holbrook, 1855 42) Diplectrum pacificum Meek y Hildebrand, 1925 Familia XX. Carangidae Género 29. Caranx Lacépède, 1802 43) Caranx hippos (Linnaeus, 1766) 44) Caranx marginatus (Gill, 1863) 45) Caranx medusicola Jordan y Starks, 1895. 46) Caranx latus Agassiz, 1831. 47) Caranx caballus Günther, 1869 Género 30. Selene Lacépède, 1802 48) Selene brevoorti (Gill, 1863) 49) Oligoplites munus Jordan y Starks, 1896. 50) Oligoplites altus (Günther, 1869) 51) Oligoplites saurus (Bloch y Schneider, 1801) 52) Oligoplites refulgens Gilbert y Starks, 1904 Género. 32. Trachinotus Lacépède, 1802 53) Trachinotus rhodopus Gill, 1863 Familia XXI. Lutjanidae (Lutjanidae, Lutjanidae) Género 33. Lutjanus Bloch, 1790 54) Lutjanus novemfasciatus Gill, 1862 55) Lutjanus argentiventris (Peters, 1869) 56) Lutjanus guttatus (Steindachner, 1869) Familia XXII. Gerridae (Gerridae, Liognthidae) Género 34. diapterus Ranzani, 1840 57) Diapterus peruvianus (Cuvier y Valenciennes, 1821) Género 35. Gerres Cuvier, 1839 58) Gerres cinereus (Walbaum, 1792) Género 36. Eugerres Jordan y Evermann, 1927 59) Eugerres lineatus (Humboldt y Valenciennes, 1821) 60) Eugerrres axillaris (Günther, 1864) Género 37. Eucinostomus Baird y Girard, 1854
61)
Eucinostomus currani Zahuranec, 1967
Trabajo aun no
publicado (ver literatura)
62) Eucinostomus
entomelas Zahuranec , 1967
Trabajo aun no publicado (ver
literatura)
63) Eucinostomus dowii (Gill, 1863) Familia XXIII. Pomadasyidae (Hemulidae) Género 38. Pomadasys Lacépède, 1803 64) Pomadasys sp 65) Pomadasys leucisus (Gunther, 1864) 66) Pomadasys macracanthus (Günther, 1864) 67) Pomadasys branickii (Steindachner, 1879) Familia XXIV. Sciaenidae Género 39. Umbrina Cuvier, 1817 68) Umbrina xanti Gill, 1862 Género 40. Micropogon Cuvier y Valenciennes, 1830 69) Micropogon altipinnis Günther, 1864 70) Micropogon ectenes Jordan y Gilbert, 1881 Género 41. Cynoscion Gill, 1861 71) Cynoscion stolzmanni (Steindachner, 1879) 72) Cynoscion xanthulus Jordan y Gilbert, 1881 73) Cynoscion reticulatus (Günther 1869) Género 42. Menticirrhus Gill, 1861 74) Menticirrhus elongatus (Günther, 1864) 75) Menticirrhus nasus (Günther, 1869) Familia XXV. Kyphosidae (Cyphosidae) Género 43. Kyphosus Lacépède, 1802 76) Kyphosus elegants (Peters, 1869) Familia XXVI. Cichlidae Género 44. Cichlasoma trimaculatum 77) Cichlasoma trimaculatum (Günther, 1868) Género 45. Tilapia Smith, 1849 78) Tilapia mossambica Peters, 1852 Familia XXVII. Pomacentridae Género 46. Abudefaduf Forskal, 1775 79) Abudefduf saxatilis (linnaeus, 1758) Suborden Mugiloidei Familia XXVIII. Mugilidae Género 47. Mugil Linnaeus, 1758 80) Mugil cephalus Linnaeus, 1758 81) Mugil curema Valenciennes, 1836 Suborden Polynemidae Familia XXIX. Polynemidae Género 48. Polydactylus Lacépède, 1803 82) Polydactylus approximans Lay y Bennet, 1839 Suborden Sphyraenoidei Familia XXX. Sphyraenidae Género 49. Sphyraena Klein, 1778 83) Sphyraena ensis Jordan y Gilbert, 1882 Suborden Gobioidei Familia XXXI. Gobiide (Incluye Eleotridae) Género 50. Eleotris (Gronow) Bloch y Schneider, 1763 84) Eleotris pictus Kner y Steindachner, 1864 Género 51. Gobiomorus Lacépède, 1798 85) Gobiomorus maculatus (Günther, 1859) Género 52. Dorminator Gill, 1861 86) Dorminator latifrons (Richardson, 1837) Género 53. Bathygobius Bleeker, 1878 87) Bathygobius soporator (Cuvier y Valenciennes, 1837) Género 54. Microgobius Poey, 1876 88) Microgobius miraflorensis Gilbert y Starks, 1904 Género 55. Gobionellus Girard, 1858 89) Gobionellus microdon (Gilbert, 1891) 90) Gobionellus sagittula (Günther, 1861) Género 56. Awaous Steindachner, 1860 91) Awaous nelsoni Evermann, 1898 Género 57. Chonophorus Poey, 1860 92) Chonophorus sp Género 58. Sicydium Cuvier y Valenciennes, 1837 93) Sicydium sp Familia XXXII. Microdesmidae (Cerdalidae) Género 59. Microdesmus Günther, 1864 94) Microdesmus dipus Günther, 1864 Suborden Scombroidei Familia XXXIII. Scombridae Género 60. Scomberomorus Lacépéde, 1802 95) Scomberomorus maculatus (Mitchill, 1815) Orden Pleuronectiformes (Heterostomata) Suborden Pleuronectoidei Familia XXXIV. Bothidae Género 61. Cyclopsetta Gill, 1888 96) Cyclopsetta querna (Jordan y Bollman, 1890) Género 62. Citharichthys Bleeker, 1862 97) Citharichthys gilberti Jenkins y Evermann, 1889 Género 63. Etropus Jordan y Gilbert, 1881 98) Etropus crossotus Jordan y Gilbert, 1882 Familia XXXV. Soleidae Género 64. Achirus Lacépéde, 1803 99) Achirus mazatlanus (Steindacliner, 1869) 100) Achirus panamensis (Steindachner, 1875) 101) Achirus klunzingeri (Steindachner, 1879) Género 65. Trinectes Rafinesque, 1831 102) Trinectes fonsecensis (Günther, 1862) Orden Tetraodontiformes (Plectognathi) Suborden Tetraodontoidei Familia XXXVI. Tetraodontidae Género 66. Sphoeroides Lacépéde, 1798 103) Sphoeroides lobatus (Steindacliner, 1870) 104) Sphoeroides annulatus (Jenyns, 1842) Familia XXXVII. Diodontidae Género 67. Diodon Linnaeus, 1758 105) Diodon hystrix Linnacus, 1758 A. CLASE CHONDREICHTHYSOrden Selachii. Suborden Heterodontoidea. Familia 1. Heterodontidae. Género 1. Heterodontus Blainville, 1816. 1) Heterodonthus francisci (Girard, 1854). N. v.: "Gata". (Lám, 9, Fig. 1) Cestracion francisci Girard, Proc. Acad. Nat. Sci. Philad., 1854: 196 (descripción original). Gyropleurodus francisci (Girard); Jordan y Gilbert, Bull. U.S., Nat. Mus., 1883, 16:31; Kumada (Ed.) Peces Marinos de la Costa Mexicana del Pacífico, 1940: 1516, Láms. 44 y 45. Heterodontus francisci (Girard); Smith, Bashford Dean Mem. Vol., Arch. Fish., 1942, 8:618. Heterodontus francisci (Girard); Berdegué Tesis profesional, Ese. Nal. Ciencias Biológicas, I. P. N., 1954, :120-121; Ramírez y Arvizú, Inst. Nal, Inv. Biol.-Pesq., 1965, 1 (1) :299; Castro, Arvizú y Páez, An. Inst. Nal. Inv. Biol. Pesq., 1966, 2; Castro, Tesis profesional, Ese. Nal, Ciencias Biológicas, I,P.N, 1967: 13-15; Bailey et al., Amer. Fish. Soc., 1970, Spec. Publ. 6:9; Chirichigno, Inf, Inst. Mar Perú-Callao, 1974, 44:25 y 337. Diagnosis. Cuerpo robusto anteriormente, adelgazándose hacia la cola. Cabeza ligeramente elevada, ancha, fuerte y grande, 5.0 en la longitud total. Hocico de regular tamaño, poco más de 2 veces en la longitud cefálica. órbita redondeada 3.0 en el hocico, sin párpados o membrana nictitante. Espiráculo pequeño, ubicado bajo, el ojo. Narinas rodeadas de un pliegue dérmico y comunicadas con la boca por un canal nasal visible. 5 aberturas branquiales disminuyendo en tamaño hacia atrás; la primera 1.6 en el hocico; las dos primeras insertadas por delante de las aletas pectorales, las otras por arriba de ellas. Primera aleta dorsal insertada sobre la base de las pectorales, con una fuerte espina anterior de menor altura; la segunda dorsal semejante pero más pequeña. Aleta anal pequeña insertada por detrás de la segunda dorsal. Aletas pectorales regulares a grandes, 1.3 en la cabeza. Aleta caudal alargada con el lóbulo superior mayor. Color, Café grisáceo en el dorso, palideciendo hacia el vientre. Castro (1967) indica que la coloración de esta especie es muy variable presentándose matices desde café claro (aún rosado) hasta café muy obscuro, con manchas obscuras y redondeadas. Distribución. Desde la Bahía de Monterrey, California, EE.UU., hasta Mazatlán (distribución común) ; sin embargo su hallazgo en Guerrero arnplía ligeramente su rango, pero su ocurrencia allí es ocasional. Chirichigno (1974) también reporta la especie en Perú. En el área de estudio fue encontrado un ejemplar en la Laguna de Chautengo. Material examinado. 1 ejemplar de 925 mm de longitud total (hembra). Observaciones. A esta especie se le conoce comúnmente con el nombre de "gata" pero también algunos autores la denominan "tiburón cabeza de toro", o "tiburón cornudo". Su distribución natural es en el Golfo de California, de manera que su presencia en Guerrero obedece a una situación extraordinaria más que a un comportamiento biológico. En efecto, el ejemplar examinado fue colectado moribundo en la boca de la Laguna de Chautengo, y estudios anteriores en el Pacífico central de México no lo habían reportado. Es razonable suponer que algunas características oceanográficas circunstanciales han determinado su hallazgo en Guerrero. Estos antecedentes determinan que no sea considerada como una especie normal entre las comunidades ictiofaunísticas del sistema lagunar costero de Guerrero, ni menos de importancia comercial. Corresponde a un visitante marino estenohalino excepcional. Berdegué (1954 y 1956) ha discutido su importancia comercial en el noroeste de México sobre la base de su gran abundancia. Miller y Lea (1972) se refiere a su distribución; y Castro (1967) detalla una descripción morfológica y aspectos de coloración. Una buena referencia para tiburones del Pacífico es Kato et al., (1967) . Suborden Galeoidea Familia II. Orectolobiidae Género 2. Ginglymostoma Müller y Henle, 1837 2) Ginglymostoma cirratum (Bonnaterre, 1788) N. v.: "Gata"Squalus cirratus Bonnaterre, Tableau Encyclo. Ichthy., 1788: 7 (descripción original). Gmelin Syst. Nat., 1789, 1:1492. Squalus punctulatus Lacépéde, Hist. Nat. Poiss, 1800, 2:121), lám. 4, fig. 3. Squalus puncatus Blocli y Schneider, Syst. Ichthy., 1801: :134. Squalus argus Bancroft, Zool. Jour., 1835, 5:82. Ginglymostoma fulvum Poey, Memorias, 1861, 2:342, lám. 19, figs. 15-16. Ginglymostoma caboverdianus Capello, Jour. Sci. Math. Phys. Lisboa, 1867, 1;167, fig. 1. Ginglymostoma cirratum (Gmelin) Günther, Cat. Fish Brit. Mus., 1870, 8:408: Jordan y Evermann, Bull. U.S. Nat. Mus., 1896, 47:26, lám. 1; Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:22. Ginglymostoma cirratum (Bonnaterre) ; Garman, Mern. Mus Comp. Zool. Harv., 1913, 36:54; Meek y Hildebrand, Field Mus. Nat. Hist. Publ. Zool. Ser., 1923, -75 (215):29-31; Bígelow y Schroeder, Mem. Sears Found. Mar. Res., 1948, 1:180, lárn. 1; Berdegué, Tesis profesional, Ese. Nal. Ciencias Biológicas, IPN, 1954 :122; Castro, Tesis profesional, Ese. Nal. Ciencias Biológicas, IPN, 1967, :31-33; Bailey et al., Amer. Fish, Soc., 1970, Spec, Publ. 6:9; Chirichigno, Inf. Inst. Mar Perú-Callao, 1974, 44:26 y 336. Diagnosis. Cuerpo comprimido hacia la cola; la cabeza y la parte anterior del cuerpo deprimidos. Cabeza ancha, deprimida, con el hocico chato y redondeado. Ojos pequeños. Espiráculos muy reducidos. Narinas con unas barbillas largas y carnosas y comunicadas con la boca por medio de un canal nasal. Primera aleta dorsal insertada sobre y posteriormente a las aletas pélvicas. Segunda dorsal semejante pero más pequeña e insertada anteriormente a la aleta anal. Aletas pectorales anchas. Aletas pélvicas de posición torácica. Aleta caudal alargada con el eje inclinado hacia arriba; ambos lóbulos fusionados. 5 aberturas branquiales y las últimas dos muy juntas y sobre la base de las pectorales. Color. Dorso cafesoso o café obscuro. Vientre más claro. Se pueden presentar algunas manchas con la edad. Distribución. Ambas costas de América tropical. En el Atlántico y el Golfo de México es particularmente abundante junto a los arrecifes de coral. En el área de estudio fue colectado un ejemplar en la Laguna de Potosí. Material examinado. 1 ejemplar de 295 mm de longitud total (hembra) . Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000.001 (Gro.) Observaciones. Esta especie pertenece a una familia típica de aguas tropicales y pueden alcanzar grandes tamaños Berdegué (1954 y 1956) señala que G. cirratum tiene una importancia comercial relativa en el noroeste de México, en especial por el aprovechamiento de su aceite. Además su carne es comestible. Castro (1967) discute aspectos morfológicos y de distribución de la especie. En estos estudios, correpondió a una especie sin importancia comercial en el sistema lagunar costero de Guerrero, perteneciendo al grupo de peces marinos que son visitantes excepcionales de los estuarios. Se alimentan preferentemente de invertebrados bentónicos y pequeños peces. Orden Batoidei. Suborden Pristoidea. Familia III. Pristidae. Género 3. Pristis Klein, 1779. 3) Pristis zephyreus Jordan y Starks, 1895. N. v.: "Pez sierra"(Lám. 9, Fig. 3) Pristis zephyreus Jordan y Starks, Proc Calif. Acad. Sci., 1895, 5 (2) :383 (descripción original). Pristis microdon Latham, Trazas. Lino. Soc. London, 1794.280, lam. 26, fig. 4; Meek y Hildebrand, Field Mus. Nat. Hist, Pub¡. Zool. Ser., 1923, 15 (215):65-66. Pristis zephyreus Jordan y Starks; Gilbert y Starks, Mem. Cal. Acad. Sci., 1904, 4:14; Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:23; Castro, An. Inst. Nal. Inv. Biol. Pesq., 1965, 1:183-184; Chirichigno, Inf. Inst. Mar Perú-Callao, 1974, 44:52 y 346. Diagnosis. Cuerpo deprimido acentuándose en el pedúnculo caudal. El pedúnculo presentando una quilla lateral. Hocico prolongado en forma de una hoja aplanada, constituida por el cartílago rostral y provisto a los lados de 14 a 23 pares de dientes (19 en el ejemplar examinado) . Cabeza deprimida formando un disco no tan manifiesto como en las otras familias del orden. Narinas oblicuas. Sin palpos ni tentáculos en la región oral. Boca transversa con numerosos y pequeños dientecillos, con varias series funcionales. Dos aletas dorsales similares, la segunda ligeramente menor. Aleta caudal con lóbulo inferior. Piel cubierta totalmente por pequeños dentículos dérmicos. Color. Dorso gris, vientre pálido sin pigmentación. Aletas dorsales y caudal, cafesosas; las pectorales y pélvicas, grises en la cara dorsal y pálidas en la cara ventral. Distribución. Se encuentran en mares tropicales, en el Pacífico de América desde México hasta Perú, penetrando hacia los ríos. En el área de estudio fue colectado un ejemplar en la Laguna de Chautengo. Material examinado, 1 ejemplar de 819 mm de longitud total (hembra) El hocico (sierra) de 240 mm medido desde el margen anterior de la órbita hasta su extremo. Colección de referencia depositada en e Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000.002 (Gro.). Observaciones. La familia Pristidae agrupa un único género y varias especies de aguas tropicales en ambos hemisferios. Castro (1965) ha señalado que existen 3 especies de Pristis en las costas de México (¡.e., P. zephyreus Jordan y Starks,. P. perotteti Muller y Henle, y P. pectinatus Latham) P. zephireus se diferencia de las otras dos por presentar lóbulo inferior bien definido en la aleta caudal. A su vez, P. pectínatus se diferencia de P. perotteti por presentar 25 a 32 pares de dientes rostrales, la primera de ellas, y menos de 20 pares, la segunda. La especie aquí estudiada se alimenta principalmente de macroinvertebrados bentónicos y ocasionalmente de pequeños peces que viven en cardúmenes (Engráulidos, Clupéidos, Mugílidos). Su reproducción es ovovivípara, presentando la hembra alrededor de dos docenas de embriones. Todas las especies del género prefieren fondos blandos, de aguas someras y salobres, perteneciendo al grupo de peces marinos eurihalinos. P. zephyreus no es un componente importante en las comunidades ictiofaunísticas del sistema lagunar costero de Guerrero. Su presencia en las lagunas es muy ocasional. Sin embargo cuando se le captura, los pescadores consumen su carne salada y secada al sol. Suborden Myliobatoidea Familia IV. Urolophidae Género 4. Urotrygon Gill, 1863Urotrygon Gill, Proc. Acad. Nat. Sci. Philad., 1863:173 (especie tipo: U. Mundus Gill, 1863). En el sistema lagunar costero de Guerrero se han encontrado 6 especies de este género. Esto determina la necesidad. de entregar una diagnosis del género y una clave artificial para determinar sus especies en las lagunas de Guerrero. Diagnosis. Disco subcircular con los ángulos y márgenes redondeados. Hocico proyectado. Numerosos dientes por lo general tan largos como amplios. Cola más larga que el disco, con una fuerte espina aserrada cerca de su zona media. Aleta caudal lanceolada, más larga que ancha. Sin aletas dorsales. Superficie dorsal con pequeñas espinitas, difusas o regulares; también pueden presentarse espinas o aguijones sobre la línea media dorsal en series contínuas o irregulares. Aletas ventrales con los rayos anteriores más largos que los posteriores. CLAVE PARA DETERMINAR LAS ESPECIES DE UROTRYGON EN EL SISTEMA LAGUNAR COSTERO DE GUERRERO A. Sin aguijones fuertes sobre la línea media dorsal - - . . . . . . . . . . . B. AA. Con aguijones fuertes sobre la línea media dorsal . . . . . . . . . . . . . . BB. B, Pequeñas espínuIas en la superficie dorsal de los márgenes laterales, hocico, disco y aun la cola U. nebulosus Garman BB' Con 17 a 32 aguijones sobre la línea media dorsal en serie continua U. asterias (Jordan y Gilbert) BB" Menos (le 10 aguijones sobre la línea media dorsal en serie continua o discontinua . . . . . C. C. Sin aguijones sobre el disco . . . . . . . . . . . . . D. CC. Con aguijones sobre el disco . . . . . . . . . . . . . . . . . . . . . . D. D. Con 1 a 9 aguijones sobre la línea niedia dorsal de la cola, por dejante de la espina caudal, nunca sobre la mitad dorsal del disco U. aspidurus (Jordan y Gilbert) DD' Aguijones sobre el disco pero nunca sobre la cola . . . . . . . . . . . .E. DD" Aguijones sobre el disco y la cola . . . . . . . . . . . . . . . . . . . . . EE. E. Hasta 3 aguijones sobre la línea media dorsal. Color generalmente café uniforme U. goodei (Jordan y Bollman) EE' Hasta 3 aguijones sobre la línea media dorsal del disco y 2 por delante de la espina caudal. Color café claro manchado generalmente con pecas oscuras U. chilensis (Gunther) EE" 8 - 9 aguijones sobre la línea media dorsal, 2 - 3 en el disco y 6 sobre la cola por delante de la espina caudal. Color café uniforme Urotrygon sp A Observaciones. El otro género importante de esta familia es Urolophus que se caracteriza por la cola más corta que el disco, además que la aleta caudal que termina en un margen redondeado y no es tan larga en relación a su anchura. En México existen las especies Urolophus jamaicensis (Cuvier) en el Golfo de México, Urolophus maculatus (Garman) del Golfo de California, y Urolophus halleri Cooper, desde California a Panamá. Esta última no fue encontrada en Guerrero. 4) Urotrygon nebulosus Garman, 1885 N. Y.: "Raya"(Lám. 10, Fig. 2) Urolophus nebulosus Garman, Proc. U. S. Nat. Mus., 1885, 8:45 (descripción original). Urobatis nebulosus Garman; Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:30. Urotrygon nebulosus Garman; Castro, An. Inst. Nal. Inv. Biol.-Pesq., 1965, 1:230-231. Diagnosis. Disco ligeramente más ancho que largo, 1.2 - 1.3 veces, casi circular exceptuando la ligera proyección del hocico. Ojos pequeños. Espiráculos sin pliegues ni cobardes, más grandes que los ojos. Boca transversal con varias series de dientes funcionales. Narinas no comunicadas, separadas por un tabique dérmico. Piso de la boca con tres poesías. Poros endolinfáticos visibles y numerosos poros mucosos cubriendo la superficie dorsal. Cola más larga que el disco. Una espina caudal aserrada. Sin aletas dorsales. Aletas pectorales cubriendo la mitad de las pélvicas. Aletas pélvicas anchas. Aletas caudal larga. Pequeñas espínulas cubren la superficie dorsal y aún la cola en el dorso del hocico y márgenes laterales. Superficie ventral lisa. Color. Dorso cafesoso, vientre blanquecino. Ocasionalmente con manchas o pecas obscuras en la superficie dorsal. Distribución. En el Pacífico, desde el Golfo de California hasta Panamá. En el área de estudio se le ha encontrado en las bocas de las lagunas Chautengo, Nuxco y Potosí. Material examinado. 3 ejemplares de 150, 157 y 160 mm de longitud total (hembras) Colección de referencia, depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México, Catálogo CCML-PF 0.000.003 (Gro.). Observaciones. Esta especie es de fondos arenosos alimentándose de pequeños crustáceos, moluscos, anélidos y algunos peces. Con sus aletas pectorales remueve el fondo en busca de su alimento. Su reproducción es ovovivípara.
No es una especie importante cuantitativamente en la composición de las comuinidades ictiofaunísticas del sistema lagunar costero de Guerrero, No es abundante, es poco frecuente, y por su tamaño y "aspecto" carece de importancia comercial entre los pescadores de las lagunas. Corresponde al grupo de peces marinos estenohalinos que visitan los estuarios ocasionalmente. 5) Urotrygon asterias (Jordan y Gilbert 1822) N. Y.: "Raya"(Lám. 10, Fig. 1) Urolophus asterias Jordan y Gilbert, Proc. U. S. Nat. Mus., 1882, 5:579 (descripción original); Jordan y Evermann, Bull. U. S. Nat. Mus., 1896,17:82; Kumada (Ed.), Peces marinos de la Costa Mexicana del Pacífico 1940: 23, lám. 56. Urolophus rogersi Jordan y Starks; in Jordan, Fishes of Sinaloa, Proc. Cal. Ac. Sci., 1895, 5(2):388. Urotrygon mundus Gill, Proc. Ac. Nat. Sci. Philad., 1863, 15:173; Garman, Mem. Mus, Comp. Zool. Harv., 1913, 36:406, lám. 30. figs. 1-2; Jordan, Evermann y Clark, U. S. Bureau of Fisheries 1930, 2:30. Urotrygon asterias (Jordan y Gilbert); Meek y Hildebrand, Field Mus. Nat. Hist. Publ, Zool. Ser., 1923, 15 (215) :83-84; Castro, An. Inst. Nal. Inv. Biol.-Pesq., 1965, 1.228-229; Ramirez y Arvizú, An. Inst. Nal. Inv, Biol.-Pesq., 1965, 1:301; Ramírez y Páez, An. Inst. Nal. Inv, Biol.-Pesq., 1965, 1:332; Chirichigno, Inf. Inst., Mar Perú-Callao, 1974, 44:66 y 353. Diagnosis. Disco ligeramente más ancho que largo en forma de diamante, y el hocico proyec tándose en forma triangular. Ojos pequeños y menores que los espiráculos 2.0 - 2.2 en el espacio interobital. Espiráculos sin rebordes ni pliegues. Boca transversal con varias series de dientes funcionales. Narinas no comunicadas, separadas por un tabique dérmico y por la cortina nasal. Dientes en forma piramidal, agudos en los machos y pavimentosos en las hembras. Numerosos poros en la región torácica y abdominal. Cola más larga que el disco. Espina caudal larga, aserrada e insertada en la zona media de la cola. Sin aletas dorsales. Aletas pélvicas con los márgenes anteriores casi rectos. Aleta caudal larga. Aletas pectorales cubriendo la mitad de las pélvicas. Pequeñas espínulas difusas cubren la piel de la superficie dorsal, determinando el aspecto rugoso al tacto. Línea media dorsal con 17 a 32 aguijones fuertes recurvados. Superficie ventral lisa. Color. Dorso café claro, vientre blanquecino. Ocasionalmente con manchas o pecas obscuras en la superficie dorsal. Distribución. En el Pacífico, desde Sinaloa, México, hasta Callao, Perú. En el área de estudio en las lagunas de Chautengo, Nuxco y Potosí, en las respectivas bocas. Material examinado. 3 ejemplares de 250, 268 y 270 mm de longitud total (hembras), Colección de referencia, un ejemplar adulto y un embrión, depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000.004 (Gro.). Observaciones. Esta especie es de fondos arenosos alimentándose preferentemente de macroinvertebrados bentónicos. Su reproducción es ovovípara. La hembra de la colección de referencia mide 270 mm de longitud total y contiene un embrión, a punto de eclosionar, de 97 mm de longitud total. El juvenil se encuentra enrrollado sobre sí mismo y con la superficie dorsal hacia el lado ventral de la madre. Al igual que las otras especies de rayas estudiadas, no es frecuente ni abundante y su importancia comercial es discutible. En las costas de Nayarit (más al norte de Guerrero) tampoco es una especie abundante; Amezcua-Linares (1972) sólo registró 2 ejemplares en sus estudios (Yáñez-Arancibia y Nugent, 1975). Amezcua-Linares (1977) la reporta todavía más al norte de Nayarit, en el sistema estuarino Huizache-Caimanero, Sinaloa. Corresponde al grupo de peces marinos estenohalinos que visitan los estuarios ocasionalmente. 6) Urotrygon aspidurus (Jordan y Gilbert, 1881)(Lám. 10, Fig. 3) Urolophus aspidurus Jordan y Gilbert, Bull. U. S. Fish. Comm., 1881, 1:307 (descripción original); Jordan y Evermann, Bull, U. S. Nat. Mus., 1896, 47:81; Gilbert y Starks, Mem. Cal. Acad. Sci., 1904, 4:16; Kendall y Radcliffe, Mem Mus. Comp. Zool. Harv., 1912, 35:80. Urotrygon aspidurus Garmann, Mem. Mus. Comp. Zool. Harv., 1913, 36:405, lám. 69, fig. 3. Urotrygon aspidurus (Jordan y Gilbert); Meek y Hildebrand, Field Mus. Nat. Hist. Publ. Zool. Ser., 1923, -75(215):85; Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:30; Castro, An. Inst. Nal. Inv. Biol.-Pesq., 1965, 1:226-227; Ramírez y Páez, An. Inst. Nal. Inv. Biol.-Pesq., 1965 1:332; Chirichigno, Inf, Inst. Mar Perú-Callao, 1974, 44:66 y 353. Diagnosis. Disco más ancho que largo, 1.3 veces, márgenes anteriores casi rectos, hocico prominente y triangular. Ojos pequeños. Espiráculos poco más grandes que los ojos, sin pliegues ni rebordes. Boca transversal subcircular con varias series de dientes funcionales. Narinas no comunicadas, separadas por un tabique dérmico y cubiertas por la cortina nasal. Superficie ventral de la región branquial cubierta por numerosos poros mucosos. Cola más larga que el disco, 1.1 a 1.3 veces. Aleta caudal poco conspícua. Una espina caudal grande y aserrada de la misma longitud del hocico. Aletas pectorales de márgenes posteriores redondeados. Aletas pélvicas con sus márgenes anteriores rectos y sin lóbulos. Sin aletas dorsales. Piel lisa exceptuando 1 a 9 aguijones en la línea dorsal, por delante de la espina caudal. Pequeñas espinitas en los márgenes lateroposteriores del disco. Color. Café uniforme en el dorso, vientre blanquecino. Nunca se presentan manchas o pecas obscuras como, en otras especies del género. Distribución. En el Pacífico, desde Sinaloa, México, hasta Paita, Perú. En el área de estudio se le ha encontrado en las bocas de las lagunas Chautengo, Tecomate, Tres Palos y Potosí. Material examinado. 4 ejemplares de 200 (2), 210 y 230 mm de longitud total (machos). Colección de referencia, 2 ejemplares de 200 y 230 mm de longitud total, respectivamente, depositados en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México, Catálogo CCML-PF 0,000.005/.006 (Gro.). Observaciones. Esta especie es mucho más abundante en Panamá que en las costas de México. Sus hábitos son bentónicos de fondos arenosos litorales y su alimentación similar a las otras especies de Urotrygon encontradas en Guerrero. Su reproducción es ovovivípara Con anterioridad, había sido reportada en el área por Ramírez y Páez (1965). No es una especie frecuente ni abundante en el sistema lagunar costero de Guerrero. Tampoco es una especie importante en la estructura de las comunidades ictiofaunísticas, y carece de importancia comercial. Corresponde al grupo de peces marinos estenohalinos que visitan los estuarios ocasionalmente. 7) Urotrygon goodei (Jordan y Bollman, 1889) N. v.: "Raya"(Lám. 11; Fig, 1) Urolophus goodei Jordan y Bollman, Proc, U.S. Nat. Mus., 1889, 12:151, (descripción original); Jordan y Evermann, Bull U. S. Nat. Mus., 1896, 17:81. Urotrygon goodei (Jordan y Bollman); Garman, Mem. Mus. Cornp. Zool. Harv., 1913, 36:405; Meek y Hilde brand, Field Mus. Nat. Hist. Publ. Zool. Ser., 1923, 15(215):84-85; Jordan, Evermann y Clark, U. S. Bureau of s 1930, 2:30; Castro, An. Inst. Nal, Inv. Biol.-Pesq., 1965, 1:227-228; Ramírez y Arvizú, An. Inst. Nal. Inv. Biol.-Pesq., 1965, 1:301; Ramírez y Páez, An. Jnst. Nal. Inv. Biol.-Pesq., 1965., 1:332; Chirichigno, Inf. Inst. Mar Perú-Callao, 1974, 44:70 y 353. Diagnosis. Disco ligeramente más ancho que largo, L2-1.3 veces, casi circular exceptuando la ligera proyección del hocico. Ojos pequeños, del tamaño de los espiráculos. Espiráculos sin pliegues ni rebordes, colocados inmediatamente por detrás de los ojos. Boca transversal con numerosos dientes funcionales. Narinas no comunicadas, separadas por un tabique dérmico que se continúa en la Cortina nasal. Numerosos poros mucosos sobre la superficie dorsal. Cola más larga que el disco.. Una espina caudal aserradas implantadas sobre la base de la aleta caudal. Sin aletas dorsales. Aletas péctorales cubren sólo el margen anterior de las pélvicas. Aletas pélvicas de márgenes anteriores subcóncavos y posteriores redondeados. Aleta caudal larga. Dorso del hocico y zona interorbital con unas pequeñas espinitas (más marcadas en los adultos) . Juveniles 1 o 2 espinas fuertes sobre la línea media dorsal; los adultos hasta 3. El resto de la piel completamente lisa. Color. Dorso, cafesoso uniforme, vientre pálido. Aleta caudal de fuerte color café. Un ejemplar macho presentaba algunas pecas o manchas obscuras, irregulares y difusas. Distribución. En el Pacífico desde Bahía Magdalena, Baja California, México, hasta Puerto Pizarro, Perú. En el área de estudio se colectaron ejemplares en las bocas de las lagunas Chautengo, Apozahualco y Nuxco. Material examinado. 3 ejemplares de 196, 197 y 220 mm de longitud total (machos) . Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México, Catálogo CCML-PF 0.000,007 /.008 (Gro.) Observaciones. Esta especie, al igual que las otras "rayas" estudiadas, es de hábitos bentónicos en fondos arenosos donde se alimenta de pequeños invertebrados (moluscos, anélidos y crustá ceos) y ocasionalmente peces. La monografía de Castro (1965) es una buena referencia para el inicio de futuros estudios de las rayas de México. En el sistema lagunar costero de Guerrero, U. goodei no es una especie ni frecuente ni abundante y carece de importancia comercial. 8) Urotrygon chilensis (Günther, 1859) N. v.: "Raya"(Lám. 11, Fig. 2) Urolophus chilensis Günther, Cat. Fish. Brit, Mus. 1859, 1:524,p., 1860, 2:548 p., 1861, 3:586 p. Urotrygon chilensis (Günther); Mann, Inst. Invest. Vetern, Chile, 1954, 114(342 p.); De Buen, Rev. Biol. Mar., 1959, 9 (1, 2 y 3):37; De Buen, Rev, Biol. Mar., 1960, 10 (1, 2 y 3) :S; Castro, An. Inst. Nal. Inv, Biol. Pesq., 1965, 1:231-232; Ramírez y Páez, An. Inst, Nal, Inv. Biol.-Pesq., 1965, 1:332, Chirichigno, Inf. Inst. Mar Perú-Callao, 1974, 44:66, 70 y 353. Diagnosis. Disco más ancho que largo, 1.1-1.3 veces, subcircular, con el hocico ligeramente proyectado. Ojos medianos, de diámetro horizontal casi igual al de los espiráculos. Espiráculos sin pliegues ni rebordes. Boca transversal, subcircular, con dientes piramidales, agudos y funcionales, Narinas no comunicadas, separadas por un tabique dérmico que se continúa al exterior formando la cortina nasal. Numerosos poros mucosos sobre la superficie ventral. Cola más larga que el disco. Una larga espina aserrada sobre la mitad de la cola. Sin aletas dorsales. Aletas pectorales cubriendo la mitad de las pélvicas. Aletas pélvicas subtriangulares. Aleta caudal larga, desarrollada. Piel lisa exceptuando 3 aguijones en el dorso y 2 en la región pre-espinal de la cola. Difusas espinitas en el dorso del hocico. Color. Café claro uniforme en el dorso presentándose varias manchas obscuras o pecas. Ocasionalmente las manchas pueden estar ausentes. Distribución. Se ha reportado para las costas de Chile por Mann (1954), De Buen (1959 y 1960). También se le ha reportado para las costas de Guerrero (Ramírez y Páez, 1965), y para las costas de Guerrero y Chiapas (Castro, 1965). No existen informes sobre su ocurrencia cerca del Ecuador pero sí para el Perú (Chirichigno, 1974). El hallazgo en este estudio confirma su presencia en las costas de México y permite afirmar que su distribución cubre desde Guerrero, México, hasta Chile. En el área de estudio se le ha colectado en las bocas de las lagunas Chautengo, Tecomate y Nuxco. Material examinado. 3 ejemplares de 201 mm (hembra), 221 y 223 mm (machos) de longitud total. Colección de referencia depositada en el Laboratoriode Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000.009/.011 (Gro.). Observaciones. Mann (1954) ha señalado que las heridas causadas por la fuerte espina aserrada de la cola, son muy dolorosas, siendo la toxicidad muy intensa que incluso puede causar la muerte de personas (Mann, 1954: 114). Sus hábitos son bentónicos de fondos arenosos, donde se alimenta de macroinvertebrados y algunos peces pequeños. Su reproducción es ovovivípara. No es una especie frecuente ni abundante y eso determina su poca importancia cuantitativa en la composición de las comunidades ictiofaunísticas del sistema lagunar costero de Guerrero. Carece de importancia comercial. 9) Urotrygon sp A N. v.: "Raya"(Lám. 11, Fig. 3) Diagnosis. Disco ligeramente más ancho que largo, 1.2 veces; márgenes anteriores casi rectos, hocico proyectado, márgenes posteriores redondeados. Ojos regulares del tamaño de los espiráculos en su diámetro máximo. Espiráculos sin pliegues ni rehordes. Boca transversal con varias series de dientes funcionales. Narinas no comunicadas, separadas por el tabique dérmico característico de la familia. Regular cantidad de poros mucosos cubriendo la superficie dorsal. Cola más larga que el disco. Una espina caudal aserrada implantada ligeramente por delante de la mitad de la cola. Sin aletas dorsales. Aletas pectorales cubriendo el primer tercio de las pélvicas. Aletas pélvicas ligeramente anchas y robustas. Aleta caudal notoriamente larga. Pequeñas espínulas cubren la zona dorsal del disco por detrás de la región branquial y en el margen superior de los espiráculos. Numerosas espínulas pequeñas cubren todo el margen latero-posterior del disco. 8-9 espinas fuertes, cortas y de base ancha sobre la línea media dorsal; relativamente espaciadas las que se encuentran sobre el disco. Superficie ventral lisa. Color. Dorso. café uniforme, márgenes del disco más claros; vientre pálido rosáceo. Aleta caudal café obscura. Distribución. Fueron colectados 2 ejemplares en las bocas de las lagunas Chautengo y Potosí. Material examinado. 2 ejemplares de 255 y 282 mm de longitud total (machos). Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000.012 /.013 (Gro.). Observaciones. Las características generales de esta "raya" no corresponden con ninguna de las "rayas" descritas por Castro (1965) para la familia Urolophidae. Por las características de la longitud de la cola en relación al disco, y la aleta caudal, corresponde al género Urotrygon. Para este género Castro. (1965) reconoce 3 grupos. a) los que tienen la piel totalmente lisa exceptuando algunos pequeños aguijones sobre el dorso pero nunca en,la cola (i.e., U. nebulosus) ; b) los que presentan aguijones de regular grosor y tamaño sobre la línea media del dorso, presentando además pequeñas espinitas en el dorso (i.e., U. mundus con la longitud del disco igual al ancho, y U. binghami con la longitud del disco 1.2 veces en el ancho) ; y c) los que sí presentan espinas sobre la línea media del dorso, y la piel es más o menos espinosa (i.e., U. asterias con 17-32 aguijones recurvados sobre la línea media dorsal, extendiéndose hasta la cola; U. aspidurus con la piel totalmente lisa exceptuando de 1-9 aguijones por delante de la espina caudal, pero ausentes en el dorso; U. chilensis con pecas o manchas sobre el dorso, con 1-3 aguijones sobre el dorso y 2 en la región caudal; U. goodei que nunca presenta aguijones sobre la cola). De acuerdo a la diagnosis presentada más arriba para la especie Urotrygon sp A, existen variaciones muy significativas que determinan su diferencia con todas las especies de Urotrygon. Sin embargo presenta cierta afinidad con algunas de ellas. Por sus aguijones de la cola y espinitas de la superficie del dorso no pertenecería al grupo a) . De las 2 especies del grupo b) , de Castro (1965), se encuentra más cerca de U. binghami por la relación de la longitud del disco y su ancho, pero no existe una descripción de comparación; por otra parte U. binghami es aparentemente endémica del Golfo de California. Por el número y distribución de sus aguijones de la línea media dorsal (3 en el dorso y 6 en la cola) se diferencia de todas las especies del grupo c). Otras características interesantes de Urotrygon sp A, es el tamaño de sus ojos iguales al tamaño de los espiráculos, las aletas pectorales que no cubren más del primer tercio de las pélvicas; y las espinitas en la zona dorsal del disco por detrás de la región branquial, en el margen superior de los espiráculos y el margen lateroposterior del disco. B. CLASE OSTEICHTHYSDivisión I. Taeniopaedia. Superorden Elopomorpha. Orden Elopiformes. Suborden Elopoidei. Familia V. Elopidae. Género 5. Elops Linnaeus, 1766 10) Elops affinis Regan, 1909 N. v.: "Chiro", "Machete" (Lám. 12, Fig. 1) Elops affinis Regan, Ann. Mag. Nat. Hist. Ser., 1909, 3 (8):38; Meek y Hildebrand, Field Mus. NaL. Hist. Publ. Zool. Ser., 1923, 15 (215):176; Hildebrand, Bull. U. S. Nat. Mus., 1946; 189:90; Miller y Lea, U. S. Fish Wild, Ser. Fish Bull., 1972, 157:52; Chirichigno, Inf. Inst. Mar Perú-Callao, 1974, 11:144 y 334. Diagnosis. Cuerpo alargado y ligeramente comprimido. Cabeza 3.8 a 4.3 en la longitud patrón, ligeramente baja; hocico corto y ancho de 3.8 a 4.4 en la cabeza; boca larga con una placa gular en la mandíbula inferior; maxilar 4.3 a 4.8 en la cabeza, ojo, de 1.3 a 1.8 y con un párpado adiposo. Altura máxima 5.8 a 6. 4 en la longitud patrón. D. 20-27 e insetada poco más atrás de la línea de las ventrales, con vaina escamosa; A. 13-17 con vaina escamosa. Línea lateral 100 a 120 escamas. Branquiespinas de 17 a 18 en la rama inferior del primer arco. Pectorales de 7.1 a 7.6 en la longitud patrón. Vértebras 79-82. Color. Dorso pardo azulado, vientre plateado metálico. Aletas regularmente obscuras, anal pálida. Distribución. Desde California, EE, UU., hasta Ecuador y Perú. En el área de estudio: Lagunas Salinas de Apozahualco, Chautengo, Tecomate, Tres Palos, Coyuca, Nuxco, Salinas del Cuajo, Potosí. Material examinado. 250 ejemplares de 114 a 351 mm de longitud patrón. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000.014/.016 (Gro.). Observaciones. La especie ha sido reportada como pez marino característico por Berdegué (1954 y 1956) y Ramírez y Páez (1965). Su ocurrencia en el área estudiada es más frecuente en las lagunas con un ciclo anual de entrada de agua de mar y con salinidades altas. E. affinis es una especie muy relacionada con E. saurus más característica del Atlántico. Estudios realizados por Carranza y Amezcua-Linares (1971) , y Amezcua-Linares (1972) también han señalado que son ovíparos y de hábitos carnívoros, depredando sobre Engráulidos, Clupéidos, Aterínidos, Poecílidos y también sobre crustá ceos (especialmente camarones) y algunos insectos. No es muy apreciado como alimento por sus abundantes espinas; sin embargo, por su abundancia relativa y tamaño (hasta 35 cm) debe considerarse inexplotado porque se consume en otras áreas. Esta especie utiliza las lagunas atraído por su elevado trofismo y penetra a ellas asíduamente para alimentarse. Suborden Albuloidei Familia VI. Albulidae Género 6. Albula Gronow, 1763 11) Albula vulpes (Linnaeus, 1758) N. Y.: "Quijo", "Chiles"(Lám, 12, Fig. 2) Esox vulpes Linnaeus, Syst. Nat. Ed. 10, 1758: 313. Albula vulpes (Linnacus) ; Jordan y Evermann, Bull. U. S. Nat. Mus., 1896, 47:411; Gilbert y Starks, Mcm. Cal. Acad. Sci., 1904, 4:39; Meek y Hildebrand, Field Mus. Nat. Hist. Zool. Ser., 1923, 15 (215):178-179; Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:39-40; Hiyama et al., Peces Marinos de la Costa Mexicana del Pacífico, 1940 28, lám 5; Berdegué, Tesis profesional Esc, Nal. Ciene. Biol., IPN, 1954: 165, lám. 10-A; Miller y Lea, U. S. Fish Wild. Sery. Fish. Bull., 1972: 52-53, 212; Chirichigno, Inf. Inst. Mar Perú-Callao, 1974. 14:144 y 324. Diagnosis. Cuerpo alargado moderadamente comprimido. Cabeza 3.4 a 3.7 en la longitud patrón, es baja subcuadrangular; ojos 4.0 a 5.2 en la longitud cefálica; dientes en bandas viliformes sobre las mandíbulas, vomer y palatinos; hocico largo 2,4 a 2.6 en la longitud cefálica, maxilar 2.7 a 3.0 en la longitud cefálica. D. 1520, A. 5-10. De 65 a 75 escamas en una serie sobre la línea lateral. Branquiespinas no desarrolladas. Vértebras 70 a 74. Aletas pectorales 1.7 a 2.0 en la longitud cefálica. Color. Dorso azuloso, flancos y vientre plateados. Líneas obscuras pigmentadas entre las líneas de escamas. Aletas pélvicas con el margen de la dorsal y de la caudal obscuros. Los juveniles presentan bandas obscuras en el dorso y los costados. Distribución. Cosmopolita de mares tropicales y subtropicales. En el Pacífico oriental desde California hasta Panamá. En el área de estudio: Lagunas de Salinas de Apozahualco, Chautengo y Salinas del Cuajo, Material examinado. 10 ejemplares de 70 a 270 mm de longitud patrón. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000.017/.022 (Gro.) . Observaciones. En México estas especies, reciben diferentes nombres vulgares según la localidad. Se les llama "sábalos", "pez señorita", "chiles", "quijo", etcétera. Al igual que en este estudio, Berdegué (1954 y 1956) utiliza el nombre vulgar de "quijo", A. vulpes es la única especie conocida del género. Los juveniles pasan a través de una etapa de metamorfosis, siendo las larvas aplanadas y transparentes y se les ha colectado en ambas costas de América tropical. No es una especie ni frecuente ni abundante en el sistema lagunar costero de Guerrero y carece de importancia comercial. Puede considerarse una especie que utiliza los estuarios como áreas de crianza aún cuando también lo hacen siendo adultos y esto para alimentarse. Género 7. Dixonina Fowler, 1910. 12) Dixonina nemoptera Fowler 1910. N.v.: "Macabi"Dixonina nemoptera Fowler, Proc. Acad. Nat. Sci. Phila., 1910, 42:652; Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:40 S. I.C., Catálogo de Peces Marinos Mexicanos, 1976: 5, 67 y 153. Diagnosis. Cuerpo alargado, moderadamente comprimido. Cabeza baja, subcuadrangular, 3.7 en la longitud patrón; ojos 5.9 en la longitud cefálica; dientes viliformes; hocico 2,5 en la longitud cefálica; maxilar 2.1 en la longitud cefálica. D. 19, A. 7. Branquiespinas 10 rudimentos sobre la rama inferior del primer arco. Color. Dorso cafesoso, flancos más claros, vientre pálido. Líneas obscuras pigmentadas entre las líneas de escamas. Aletas pálidas. Distribución. Cosmopolita de América tropical, En el Pacífico desde Baja California, México, hasta Centro América. En el Atlántico desde Centro América hasta Venezuela. En el área de estudio se le ha encontrado en la boca de la Laguna de Coyuca. Material examinado. 1 ejemplar de 240 mm de longitud patrón. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.001.411 (Gro.). Observaciones. Esta especie no fue colectada en estos estudios. Sin embargo en la colección existe un ejemplar colectado por el ex Instituto Nacional de Investigaciones Biológico-Pesqueras (ahora Instituto Nacional de Pesca) con fecha de enero 1964 y localidad de la boca de la Laguna de Coyuca. Eso determina que sea considerada en este catálogo taxonómico e incorporada a la colección de referencia. Secretaría de Industria y Comercio (5. 1. C., 1976) considera a esta especie entre el catálogo de los peces marinos de México. Corresponde a una especie rara y escasa en la costa de Guerrero y parece ser un visitante excepcional del estuario que puede penetrar como adulto y para alimentarse. Su principal diferencia diagnóstica con Albula vulpes es que presenta el último rayo dorsal y anal considerablemente alargado. Orden Anguilliformes. Suborden Anguilloidei. Familia VII. Xenocongridae. (Myridae, Echelidae, Ophichthyidac). Genero 8. Myrophis Lutken, 1851. 13) Myrophis vafer Jordan y Gilbert, 1882. N. v.: "Morena".(Lám. 12, Fig. 3) Myrophis vafer Jordan y Gilbert, Proc. U. S. Nat. Mus., 1882: 645; Jordan y Evermann, Bull. U. S. Nat. Mus., 1896, 47:372; Gilbert y Starks, Mem. Cal. Acad. Sci., 1904, 4:35; Meek y Hildebrand, Field Mus Has. Hist. Publ. Zool. Ser., 1923, 1:145-146; Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:83; Miller y Lea, U. S. Fish. Wild. Serv. Fish. Bull. 1972: 52-53; S. I. C., Catálogo de Peces Marinos Mexicanos, 1976: 6, 52, 73 y 162; Chirichigno Inf. Inst. Mar Perú-Callao, 1974, 44:103 y 342. Diagnosis. Cuerpo muy alargado, serpentiforme. Cabeza y tronco 2.5 a 3.0 en la longitud total; cola mucho más larga que la cabeza y el tronco 1.5 a 2.0 en la longitud total; la cabeza 3.5 a 3.8 en la longitud de la cabeza más el tronco; profundidad 3. 7 a 4.1 en la cabeza; hocico deprimido, amplio con dos narinas anteriores proyectándose prominentemente más allá de la boca, su longitud 6. 4 a 7. 0 en la cabeza; ojos pequeños 11. 0 a 12.0 en la cabeza; boca grande con el maxilar llegando más allá del ojo, 3.3 a 4.2 en la cabeza; dientes puntiagudos sobre la mandíbula y el vomer. Origen de la dorsal más próximo a las aberturas branquiales que el ano, confluye con la aleta anal rodeando la cola. Pectorales pequeñas, similares al hocico en longitud con la base tan ancha como las aberturas branquiales. Color. Dorso cafesoso con puntuaciones que desaparecen hacia los flancos. Vientre y aletas pectorales pálidas. Distribución. En el Pacífico desde Guaymas, México, hasta Perú. En el área de estudios: Laguna de Salinas de Apozahualco y Potosí. También incluye la costa de California. Material examinado. 3 ejemplares de 350 a 380 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000.023/.024 (Gro.). Observaciones. Meek y Hildebrand (1923) y Miller y Lea (1972) señalan que esta especie puede colectarse en posas de marcas y aguas someras en general. En estos estudios fueron colectados ejemplares moribundos en algunas lagunas que reciben influencia marina. La especie es muy rara y puede considerarse como un visitante excepcional u ocasional de las lagunas. Sus hábitos son carnívoros alimentándose de pequeños peces y algunos organismos invertebrados bentónicos. Myrophis vafer presenta gran afinidad taxonómica con otra especie del Atlántico tropical, M. punctatus Lutken, sin embargo además de tener ambas especies un rango geográfico diferente, la especie vafer se diferencía de punctatus por presentar doble corrida de dientes y menos puntuaciones obscuras sobre el dorso y los flancos; además las narinas, de M. vafer caben 6.4 a 7.0 en la cabeza a diferencia de M. punctatus donde solamente caben 6.0. Superorden Clupeomorpha Orden Clupeiformes Suborden Clupeoidei Familia VIII. Clupeidae Genero 9. Lile Jordan y Evermann, 1896 14) Lile stolifera (Jordan y Gilbert, 1896) N. Y.: "Sardinita"(Lám. 12, Fig. 4) Clupea stolifera Jordan y Gilbert, Proc. U. S. Nat. Mus., 1896: 339. Sardinella stolifera Jordan y Evermann, Bull. U. S. Nat. Mus., 1896, 47:431. Harengula stolifera, Evermann y Radcliffe, 1917: 12; Fowler, 1941, 233. Lile siolifera Hildebrand, Bull. U. S. Nat. Mus., 1946, 189:90-91; Peterson, Bull. Inter. Am. Trop. Tuna Comm., 1956, 1 (5):176-177; Chirichigno, Inf. Inst. Mar Perú-Callao, 1974, 44:157 y 339. Diagnosis. Cuerpo muy comprimido, alargado perfil ventral muy convexo. Cabeza pequeña 3.8 a 4.2 en la longitud patrón; hocico ligeramente más corto que la órbita; Ojos con un párpado adiposo 3.1 a 3.4 en la cabeza; maxilar curvo llegando al margen anterior de la pupila, de 2.6 a 3.4 en la longitud cefálica. Altura máxima 3.4 a 3.7 en la longitud patrón. D. 16-18, A. 19-28; escamas en una serie longitudinal 41 a 44. Branquiespinas cortas 28 a 34 en la rama inferior del primer arco. Pectorales largas, de 1.3 a 1.6 en la longitur cefálica. Dorsal, vertrales y anal con una vaina escamosa. Color. Cuerpo pálido, perfil dorsal con una línea obscura delante y detrás de la aleta. Flancos con una banda plateada notoria; las escamas por sobre la línea lateral con los extremos obscuros. Aletas pálidas, la caudal con el extremo obscuro. Distribución. De Baja California, México, hasta Puerto Pizarro, Perú, abundante en aguas mexicanas. En el área de estudio: Lagunas de Salinas de Apozahualco, Chautengo, Tecomate, Tres Palos, Coyuca, Mitla, Nuxco, y Potosí. Material examinado. 478 ejemplares de 34 a 55 mm de longitud patrón. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000.025/.029 (Gro.). Observaciones. Ramírez-Granados (1952) indicó que Lile stolifera es muy abundante en Coyuca y Tres Palos. En la costa noroccidental de México se le incluye junto a otras sardinas en los enlatados y se conoce con el nombre de "arenque" o "sardina rayada" (Berdegué, 1954 y 1956) Ramírez y Páez (1965) nada indican sobre esta especie para el estado de Guerrero. Estudios posteriores de Carranza (1969), Carranza y Amezcua-Linares (1971) y Amezcua-Linares (1972) también han demostrado que la alimentación de L. stolifera es por filtración, alimentándose exclusivamente de plancton. En estos estudios, y anteriormente Petersen (1956), se han encontrado zooplancton, pequeños crustáceos y larvas de insectos y de peces en estómagos de L. stolifera. De este estudio se puede agregar que su hallazgo fue frecuente y particularmente abundante en Tres Palos, Coyuca y Mitla, pero también se le encuentra en las lagunas más salobres. Ejemplares sexualmente maduros en salinidades hasta de 8% sugiere que la especie puede considerarse tipicamente estuarina. Su importancia comercial es discutible pero la especie tiene mucha importancia ecológica. Genero 10. Opisthonema Gill, 1861. 15) Opisthonema libertate (Günther, 1866). N. v.: "Sardina crinuda"(Lám 13, Fig. 1) Meletta libertatis Günther, Proc. Zool. Soc. London, 1866, 603. Opisthonema libertate (Günther), Meek y Hildebrand, Field. Mus. Nat. Hist. Zool. Ser., 1923, 1:188-189; Jordan, Evermann y Clark, U. S. Bureau of Fisheries Fish. Bull., 1930, 2:44; Hildebrand, Bull. U. S. Nat. Mus., 1946, 189:81-82; Petersen, Bull. Inter. Am. Trop. Tuna Comm., 1956, 1(5):178-179; S. I. C., Catálogo de Peces Marinos Mexicanos, 1976: 5, 67 y 154; Chirichigno, Inf. Inst. Mar Perú-Callao, 1974, 44:154 y 343. Diagnosis. Cuerpo no muy alargado, comprimido. Cabeza 3.5 a 4.1 en la longitud del cuerpo; hocico, ligeramente puntiagudo de 3.8 a 4.3 en la cabeza; mandíbulas proyectándose ligeramente, maxilar amplio, redondeado posteriormente y llegando hasta la mitad del ojo; ojos con párpado adiposo, de 3.5 a 4.2 en la cabeza. Altura máxima 2.8 a 3.4 en la longitud patrón. D. 15-18, A. 19-25, P. 15. Escamas 46 a 53 en una serie lotigitudinal sobre la línea lateral. Branquiespinas muy numerosas, suaves y alargadas; pseudobranquia bien desarrollada. Pectorales 1.4 a 1.6 en la cabeza. Color. Dorso azuloso, flancos plateados y las escamas con un ligero tinte verdoso. Aletas dorsal y caudal obscuras, las otras aletas son pálidas. Una notoria mancha sobre el hombro seguido de pequeños lunares. Hocico y manclíbula obscuros. Distribución. En el Pacífico desde el noroeste de México hasta el sur de Perú; además en las Galápagos. En el área de estudio: Lagunas Safinas de Apozahualco, Chautengo y Potosí. Material examinado. 10 ejemplares entre 100 y 160 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0,000.030/.033 (Gro.). Observaciones. Peterson (1956) ha señalado que esta especie puede reproducirse durante todo el año. Los adultos corresponden a tallas mayores de 75 mm y representan una pesquería importante en el noroeste de México (Comas-Viñas 1976) Sólo se encuentran adultos en las lagunas de Guerrero y son poco frecuentes y abundantes. Penetran a los estuarios para alimentarse. Son fitoplanctófagos. Las tallas máximas reportadas para esta especie han sido de 280 mm en ejemplares de Panamá (Meek y Hildebrand, 1923). El último rayo dorsal de Opisthonema libertate se encuentra modificado en un largo filamento como en el género Dorosoma, y su taxonomía no es dificultosa considerando la literatura reciente de Berdegué (1954 y 1956), Peterson (1950) , Harder (1958) y Berry y Barret (1963). Según Berry y Barret (1963) el número de branquiespinas ceratobranquiales separa completamente las tres especies simpátricas costeras del Pacífico (i.e., O. libertate Günther, O. medirastre Berry y Barret y O. bulleri Regan). Olguín-Quiñones (1976) considera a esta especie entre las de importancia comercial de Baja California. Género 11. Opisthopterus Gill, 1861. 16) Opisthopterus dovii (Günther, 1868). N. v.: "Sardina" (Lám. 13, Fig, 2)Pristigaster argenteus Günther, Proc. Zool. Soc. London, 1866: 603 (no de Cuvier). Pristigaster dovii Günther, Cat. Fish. Brit. Mus., 1968, 7:461. Opisthopterus dovii Jordan y Evermann, Bull. U. S. Nat. Mus., 1896, 17:437; Gilbert y Starks, Mern. Cal. Acad. Sci., 1904,1:41; Kendall y Radcliffe, Mem. Mus. Comp. Zool. Harv., 1912, 35:81; Meek y Hildebrand, Field Mus. Nat. Hist. Zool. Ser., 1923, 15(215):192-193; Jordan, Evermann y Clark, U. S. Bureau of Fish., 1930, 2:45; Kumada (Ed.), Peces Marinos de la Costa Mexicana del Pacífico, 1940, 28, lám 6; Paterson, Bull. Inter. Am Trop Tunna Comm., 1956, 1(5):259-260; Chirichigno, Inf. Jnst. Mar Perú-Callao, 1974, 11:113 y 344. Diagnosis. Cuerpo alargado, fuertemente com primido. Cabeza moderada de 4.3 a 5.2 en la longitud del cuerpo; dientes fuertes sobre las mandíbulas, lengua, palatinos y pterigoides; hocico más corto que la órbita de 4.3 a 4.4 en la longitud cefálica; ojos de 3.0 a 3.2 en la misma longitud; la inandíbula ligeramente proyectada, el maxilar largo pasando ligeramente la mitad del ojo, de 1.8 a 2.2 en la Cabeza. Altura máxima de 4.7 a 5.2 en la longitud patrón. D. 12-13 inser tada más atrás del origen de la anal, A. 53-62. De 53 a 58 escamas en una serie por sobre la línea lateral. Branquiespinas de 17 a 18 en la rama inferior del primer arco. Pectorales más largas que la cabeza, 4.3 a 4.5 en la longitud patrón. Color. Dorso verdoso, flancos plateados; borde dorsal con una banda obscura, extremo del hocico y mandíbula inferior obscuros. Aletas con ligeras puntuaciones. Distribución. En el Pacífico desde el Golfo de California, México, hasta Perú. En el área de estudio: Lagunas de Chautengo y Salinas del Cuajo. Material examinado. 10 ejemplares entre 100 y 185 mm de longitud patrón. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000.034 (Gro.). Observaciones. Opisthopterus dovii difiere de O. equatorialis Hildebrand en la cabeza más grande, boca menos oblicua, grandes dientes, menos branquiespinas, sin banda lateral. Sin embargo, O. dovii puede ser confundida con Pliosteostoma lutipinnis aún cuando esta última presenta el hueso tendido en el ligamento entre el extremo distal del premaxilar y la mitad del maxilar; además P. lutipinnis presenta el origen de la dorsal notoriamente más cerca de la base de la aleta pectoral que de la base de la aleta caudal, ocurriendo lo inverso en O. dovii. Opisthopterus dovii madura sexualmente después de los 160 mm de longitud patrón. Sólo se encuentra ejemplares adultos, pero inmaduros, en las lagunas de Guerrero. La especie se alimenta de pequeños Engráulidos y crustáceos. Es esencialmente carnívora y penetra a los estuarios para alimentarse. Genero 12. Pliosteostoma Norman, 1923. 17) Pliosteostoma lutipinnis (Jordan y Gilbert, 1881). N. v.: "Sardina machete"(Lám 13, Fig. 3) Pristigaster lutipinnis Jordan y Gilbert, Proc, U. S. Nat. Mus., 1881, 1:340. Pliosteostoma lutipinnis (Jordan y Gilbert) ; Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:45; Berdegué, Secretaría de Marina Dir. Gral. Pesc. Ind. Con., 1956: 151; Petersen, Inter. Am. Trop. Tunna Comm., 1956, 1(5):257-258; S. I. C., Catálogo de Peces Marinos Mexicanos, 1976: 67-68. Diagnosis. Cuerpo alargado y muy comprimido Cabeza moderada de 4.5 a 5.2 en la longitud patrón. Un hueso provisto de dientes descansa en el ligamento entre el extremo distal del premaxilar y la mitad del maxilar; boca grande y oblicua; mandíbula inferior sobresaliente; maxilar largo llegando más allá de la mitad de la órbita; dientes fuertes en las mandíbulas lengua y palatinos. Altura máxima 3.5 veces en la longitud patrón. D. 12-13, A. 49-55. Vientre con 28 escudos. Sin aletas pélvicas. Pectorales de igual longitud que la cabeza. Color. Dorso azuloso, flancos plateados, vientre pálido. Aletas ligeramente amarillas. Distribución. En el Pacífico desde el Golfo de California (Mazatlán), México, hasta Colombia. En el área de estudio: Laguna de Chautengo. Material examinado. 6 ejemplares de 140 a 180 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.001,405/1.410. Observaciones. En el noroeste de México se le emplea como carnada y es particularmente abundante en Mazatlán, donde sale en los lances camaroneros (Berdegué, 1954 y 1956). Amezcua-Linares (1977) le reporta entre la ictiofauna del sistema lagunar de Huizache-Caimanero, Sin. La especie madura sexualmente después de los 140 mm de longitud patrón. Su alimentación se compone de pequeños peces y crustáceos juveniles. No es una especie abundante en el sistema lagunar de Guerrero. Familia IX. Engraulidae. Género 13. Anchovia Abordan y Evermann, 1896 18). Anchovia macrolepidota (Kner y Steinda chrier, 1865). N. v.: "Bocón", "Anchoveta"(Lám. 13, Fig. 4) Engraulis macrolepidotus Kner y Steindacliner, Abh. K. Bayer. Ak. Wiss., 1864 (1865), 10:21, lám. 3, fig. 2; Steindacliner, (Sitzb. K. Akad. Wiss. Wien, 72) lehtliy, Beitr. 1875, 1:37. Stolephorus macrolepidotus Jordan y Gilbert, Bull. U. S, Fish. Comm., 1882 (1883), 2:109. Anchovia macrolepidota Jordan Y Evermann, Bull. U. S. Nat. Mus., 1896, 17:449; Grilbert y Starks, Mem. Cal. Ac. Sel., 1904, 4:47; Kendall y Radcliffe, Mem. Mus. Comp. Zool. Harv., 1912, 35:81; Meek y Hildebrand, Field Mus. Nat. Hist. Publ. Zool. Ser., 1923, 15(215). 210-211; Peterson, Bull. Inter. Am. Trop, Tunna Comm., 1956, 1(5):228-230; Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:50; Hildebrand, Bull. Bingh Oceanogr. Coll., 1943, 8(2):20-23. Diagnosis. Cuerpo profundo muy comprimido a menudo corto. Cabeza 3.0 a 3.5 en la longitud patrón, normalmente corta; hocico corto, menor que la órbita 6.0 a 7.0 en la longitud cefálica; ojos de 3.8 a 4.3; maxilar puntiagudo, puede pasar ligeramente el margen inferior del opérculo. Altura máxima 2.6 a 3.4. D. 12-15, A. 27-33, P. 14-15. Escamas en una serie longitudinal de 37 a 43. Branquiespinas numerosas, más de 90 en individuos de 100 mm de longitud patrón. Pectorales largas llegando hasta la base de las ventrales, 1.7 a 1.8 en la longitud cefálica. Escama axilar pectoral de 2.9 a 3.3 en la cabeza. Vértebras de 40 a 43. Color. Dorso café azulado, algo verdoso, vientre plateado; sin banda lateral y aletas pálidas. Dorsal y caudal pueden presentar ligeras puntuaciones. Distribución. En el Pacífico desde Guaymas, México hasta Ecuador. En el área de estudio: Lagunas Salinas de Apozahualco, Chautengo, Nuxco, Tecomate, Tres Palos, Salinas del Cuajo y Potosí. Material examinado. 386 ejemplares de 82 a 250 mm de longitud patrón. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000.035/.041 (Gro.). Observaciones. La especie ha sido indicada como una de las "anchoas" o "anchovetas" más abundantes en el Pacífico mexicano, desde Baja California hasta Chiapas (Berdegué, 1954 y 1956) . Carranza (1969) , Carranza y Amezcua-Linares (1971), y Amezcua-Linares (1972), estudiaron a A. macrolepidota siendo la única especie del género Anchovia encontrada en Nayarit. Amezcua-Linares (1977) también la registra en el sistema lagunar de HuizacheCaimanero, Sinaloa. Peterson (1956) ha encontrado que es el Engratilido más abundante en el Golfo de Nicoya, Costa Rica. Ese mismo autor ha señalado que durante casi todo el año pueden colectarse ejemplares sexualmente maduros. El intestino de A. macrolepidota es mucho más corto que el tamaño de su cuerpo, en contraste con Cetengraulis mysticetus en la cual el intestino es cerca de siete veces la longitud de su cuerpo. Los adultos de esta última especie se alimentan de fitoplancton y detritus (Schaefer, 1954) En estos estudios fue una de las especies más importantes y por su frecuencia, tamaño y abundancia representa un gran potencial económico en el sistema lagunar de Guerrero, particularmente en las lagunas que tienen marcada influencia marina. Son peces planctófagos que extraen los microorganismos por filtración del agua con sus numerosas branquiespinas, las cuales aumentan con la edad, son fito y/o zooplanctófagos. Género 14. Anchoa Jordan y Evermann, 1927 19) Anchoa panamensis (Steindachner, 1875) N. v.: "Anchoa", "Anchoveta"(Lám. 14, Fig. 1) Engraulis panamensis Steindachner, Sitzb. K. Akad. Wiss. Wien., 47 Ichth. Beitr., 1875, 4:39. Stolephorus panamensis Jordan y Gilbert, Bull. U. S. Fish. Commn., 1882 (1883), 2:109 y Proc. U. S. Nat. Mus., 1882: 602; Jordan y Evermann, Bull. U. S. Nat. Mus., 1896, 47:448. Anchovia panamensis Gilbert y Starks, Mem. Cal. Ac. Sci., 1904, 4:44; Meek y Hildebrand, Field Mus. Nat. Hist. Publ. Zool. Ser., 1923, 15(215):207-208. Anchoviella panamensis (Steindachner) ; Jordan, Evermaun y Clark, U. S. Bureau of Fisheries, 1930, 2:50. Anchoa panamensis (Steindachner); Hildebrand, Bull. Bingh. Oceanogr. Coll., 1943, 8(2):42-45, fig. 13; Hildebrand, Bull. U. S. Nat. Mus., 1946, 189:98100; Peterson, Bull. Inter. Am. Trop. Tunna Comm., 1956, 1(5):235236; Amezcua-Linares, Tesis profesional Fac. Ciencias, Univ. Nal. Autón. México, 1972:71-72. Diagnosis. Cuerpo ligeramente profundo, fuertemente comprimido. Cabeza corta 3.7 a 4.7 en la longitud patrón; hocico corto de 3.8 a 4.5 en la cabeza, ojos más grandes que el hocico de 3.2 a 3.7 en la longitud cefálica, maxilar despuntado no llega al margen del opérculo de 1.2 a 1.4 en la cabeza. Altura máxima 3.7 a 5.0 en la longitud patrón. D. 11-14, A. 30-37, P. 12-14. Generalmente 41 escamas en una serie sobre la línea lateral. Branquiespinas de 22 a 24 sobre la rama inferior del primer arco. Pectorales largas de 1.1 a 1.3 en la cabeza. Escama axilar pectoral 2.5 a 3.2 en la cabeza. Vértebras de 41 a 43. Color. Dorso pálido con puntuaciones obscuras, flancos pálidos con una delgada banda plateada no más ancha que el diámetro de la pupila. Mejillas plateadas. Bases de la anal y caudal con puntuaciones oscuras. Distribución En el Pacífico desde Mazatlán, México, hasta Puerto Pizarro, Perú. En el área de estudio: Lagunas Salinas de Apozahualco, Chautengo, Salinas del Cuajo y Potosí. Material examinado. 23 ejemplares de 60 a 87 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000.042 /.052 (Gro.) Observaciones. Anchoa panamensis es una especie muy afin con A. compressa de la cual, sin embargo, puede distinguirse por la banda lateral, la cabeza más corta y el menor número de branquiespinas. Además presenta gran afinidad con A. lucida de la cual difiere por la aleta anal más larga y el mayor número de rayos anales. Asimismo puede ser confundida también con A. mundeoloides pero se diferencia de ella en la posición más anterior de la aleta anal, las aletas pectorales más largas, la escama axilar pectoral más corta y amplia y el cuerpo mucho más comprimido. Definitivamente A. panamensis es una especie difícil de determinar, Hildebrand (1943) y Peterson (1952) difieren en el recuento de branquiespinas en la misma especie de dos áreas diferentes; además difieren en el número de vértebras. Aparentemente los rangos de variación son amplios en la especie, distribuida desde México a Perú. A. panamensis tiene un periodo largo de desove y generalmente alcanzan la madurez después de los 100 mm de longitud total. La alimentación de la especie se basa en el zooplancton y crustáceos juveniles. Rara vez se encuentran mezclas de fito y zooplancton. No es una especie abundante en el sistema lagunar costero de Guerrero y se considera que visita los estuarios al estado adulto y para alimentarse. 20) Anchoa Triundeoloides (Breder, 1928) N. v.: "Anchoa", "Anchoveta"(Lám. 14, Fig. 2) Anchovia mundeoloidos Breder, Bull. Bingh. Oceanogr. Coll., 1928, 2(2):9, fig. S. Anchoa mundeoloides (Breder); Hildebrand, Bull. Bingli. Oceanogr. Coll., 1943, 8(2):45-46, fig. 14; Amezcua-Linares, Tesis profesional Fac, Ciencias Univ. Nal. Autón. México, 1972:73-74. Diagnosis. Cuerpo moderadamente profundo, fuertemente comprimido. Cabeza corta de 4.0 a 4,5 en la longitud patrón; hocico relativamente corto de 4.8 a 5.1 en la cabeza; ojos grandes de 3.2 a 3.6 en la longitud cefálica; maxilar puntiagudo casi llega al margen del opérculo de 1.2 a 1.3 en la cabeza. Altura máxima de 3.9 a 4.5 en la longitud patrón. D. 13-14, A. 29-34, P. 13-15. Entre 37 y 41 escamas en una serie longitudinal por sobre la línea lateral. Branquiespinas de 18 a 21 sobre la rama inferior del primer arco Pectorales largas 1,2 a 1.3 en la cabeza. Escama axilar pectoral 2.1 a 2.6 en la cabeza. Vértebras de 40 a 41. Color. Dorso pálido con puntuaciones obscuras, mejillas plateadas. Flancos con una banda lateral delgada de color plateado, más angosta que el diámetro de la pupila. Aletas pálidas. Distribución. En el Pacífico desde la Bahía de San Francisco, California, incluyendo el Golfo de California, México, hasta Panamá. En el área de estudio: Lagunas de Chautengo y Nuxco. Material examinado 6 ejemplares de 58 a 92 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México, Catálogo CCML-P17 0.000.053/.061 (Gro.). Observaciones. Como se discutió en la especie anterior Anchoa mundeoloides es una especie muy afín con A. panamensis. Además es muy similar con A. lucida pero difiere de ella por la aleta anal más larga, mayor número de rayos anales y la cabeza es más larga. La alimentación se basa fundamentalmente en el zooplancton y los pocos ejemplares que se encuentran en las lagunas costeras de Guerrero penetran a ellas como adultos y para alimentarse. 21) Anchoa curta (Jordan y Gilbert, 1882) N. v.: "Anchoa", "Anchoveta"(Lám, 14, Fig. 3) Stolephorus curtis Jordan y Gilbert, Proc. U. S. Nat. Mus., 1882: 343; Jordan y Evermann, Bull. U. S. Nat. Mus., 1896, 47:445. Anchoviella curta (Jordan y Gilbert); Jordan, Evermann y Clark, U S. Bureau of Fisheries, 1930, 2:48. Anchovia curta Gilbert y Starks, Meni. Cal. Ac. Sci., 1904, 4:42; Meek y Hildebrand, Field Mus. Nat. Hist. Publ., Zool. Ser., 1923, 15(215):206-207; Hildebrand, Bull. Bingli. Oceanogr. Coll., 1943, 8(2):85-87; Hildebrand, Bull. U. S. Nat. Mus., 1946, 189:100-101; Peterson, Bull. Inter. Am. Trop. Tunna Comm., 1956, 1(5):245-246. Diagnosis. Cuerpo alargado, fuertemente comprimido. Cabeza moderada 3.8 a 4.4 en la longitud patrón; hocico corto 4.5 a 5.5 en la longitud cefálica, ojos 3.0 a 3.4; maxilar largo y angosto casi llegando a las aberturas branquiales, 1.2 a 1,4 en la cabeza. Altura máxima 4.4 a 4.8 en la longitud patrón, D. 13-16, A. 22-25, P. 12-13. Branquiespinas 22 a 26 en la rama inferior del primer arco. Normalmente 40 escamas en una serie longitudinal por sobre la línea lateral. Pectorales extendiéndose hasta la base de las ventrales 1.4 a 1,8 en la longitud cefálica. Escama axilar pectoral 2.0 a 2.7 en la longitud cefálica. Vértebras 40 a 42. Color. Cuerpo pálido; una notoria banda plateada en ambos flancos; dorso con puntos cafés. Base de la aleta anal con una serie de puntos obscuros. Distribución. En el Pacífico desde la Bahía de San Juanico, Baja California, México, a Puerto Pizarro, Perú. En el área de estudio: Laguna Salinas de Apozahualeo y Chautengo. Material examinado. 4 ejemplares de 75 a 89 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000.062 (Gro.). Observaciones. Esta especie no fue frecuente, ni abundante y no tiene importancia económica en el área estudiada. Su hallazgo parece más bien ocasional en las lagunas costeras de Guerrero. Las características morfológicas de A. curta se ajustan exactamente a la descripción indicada por Meek y Hildebrand (1923), Hildebrand (1943) y Hildebrand (1956). Pero la especie puede ser fácilmente confundida con A. parva de la costa Atlántica de Panamá. La cabeza de A. curta es más corta que en A. parva, además las branquiespinas son menos y las vértebras más numerosas. Por otra parte la aleta dorsal tiene una posición más anterior que en parva. La especie es de pequeño tamaño, no sobrepasando los 78 mm (Hildebrand, 1943). Su ocurrencia es muy poco constante en las lagunas de Guerrero a donde penetra a alimentarse preferentemente de zooplancton. 22) Anchoa schofieldi (Jordan y Culver, 1895). N. v.: "Anchoa", "Anchoveta"(Lám. 14, Fig. 4) Stolephorus schfieldi Jordan y Culver. Fishes of Sinaloa, 1845: 410; Jordan y Evermann, Bull. U. S, Nat. Mus., 1896, 17:2814. Anchoa schofieldi (Jordan y Culver) ; Hildebrand, Bull. Bingli. Oceanogr. Coll., 1943, 8(2):49-50. Diagnosis. Cuerpo fuertemente comprimido, moderadamente profundo. Cabeza moderadamente corta 3.7 a 4.1 en la longitud patrón, hocico moderado 4.8 a 5.2 en la cabeza, ojos 3.7 a 4.2; maxilar poco puntiagudo 1.2 a 1.3 en la longitud cefálica. Altura máxima 4.5 a 4.7 en la longitud patrón. D. 14, A, 24-26, P. 13-14. Escamas en una serie longitudinal por sobre la línea lateral 38 a 42. Branquiespinas 12 a 14 sobre la rama inferior del primer arco. Pectorales moderadamente cortas llegando hasta la base de las pélvicas, 1.6 a 1.9 en la cabeza, Escama axilar pectoral corta 2.2 a 2.7 en la longitud cefálica, Vértebras 44. Color. Dorso pálido con puntuaciones obscuras; flancos con una banda plateada igual en grosor al diámetro de la pupila. Base de la anal con puntuaciones irregulares al igual que la base de la caudal. Distribución. En el Pacífico desde Mazatlán, México, hasta Ecuador. En el área de estudio: Laguna de Chautengo. Material examinado. 6 ejemplares entre 80 y 95 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000.063/.073. Observaciones. Esta especie es característica por el pequeño número de branquiespinas, lo que al mismo tiempo la hace muy afín con Anchoa eigenmannia (Meek y Hildebrand). Esta última tiene la aleta anal más larga con 2730 rayos, así como también tiene menor número de vértebras, 42 a 43, y presenta puntuaciones dentro de la banda lateral plateada. Anchoa schofieldi es muy rara o poco frecuente. Hildebrand (1943) señala que solamente se le conoce en las localidades extremas de su rango de distribución y nunca se le ha colectado en áreas intermedias. Su hallazgo en las lagunas de Guerrero aparentemente es un primer registro en el Pacífico central americano. Berdegué (1954 y 1956) la enlista entre las Anchoa de México. División III Euteleostei. Superorden Protacanthopterygii. Orden Gonoryrichiformes. Suborden Chanoidei. Familia X. Chanidae. Género 15. Chanos Lacépéde, 1803 23) Chanos chanos (Forskal, 1775). N. v.: "Sabalote", "Sábalo"(Lám. 14. Fig. 5) Mugil chanos Forskal, Descr. Anim., 1775: 74, Red Sea at Djidda. Chanos arabicus Lacépède, Hist. Nat. Poiss., 1803: 396. Chanos mento Cuvier y Valenciennes, Hist. Nat. Poiss., 1846, 19:194 y 198. Chanos indicus Bleeker, Verh. Bat. Gen., 1852, 24:11. Chanos salmoneus Günther, Cat. Fish Brit. Mus., 1868. 7:473. Chanos chanos (Forskal); Jordan y Evermann, Bull. U. S. Nat. Mus., 1896, 47:414-415; Berdegué, Secretaría de Marina Dir. Gral. Pesc. Ind. Con., 1956: 30 y 136; Holguín-Quiñones, Inst. Nal. Pesc. Subsecr. Pese., 1975: 65; Gopalakrislinam, Coastal Aquaculture in the Indo-Pacific Region (Pillay, T. V. R., Ed.), 1972: 120-149. Diagnosis. Cuerpo alargado con el pedúnculo caudal muy comprimido. Cabeza de dorso plano, tamaño moderado 5.2 a 5.5 en la longitud total, boca pequeña, terminal sin dientes, la mandíbula superior sobrepasa a la inferior; ojos grandes con párpado adiposo bien desarrollado de 3.5 a 3.8 en la cabeza; hocico amplio generalmente 0.75 en el ojo. D. II, 13-16; A. II, 9-11; V. 11-12; P. 16-17; C. 19. El origen de la dorsal en el centro de la distancia entre el borde anterior del ojo y la base de la caudal. Pectorales puntiagudas con una alargada escama apendicular en la base. Anal con dos hileras de escamas en la base. Caudal grande y fuertemente furcada con el lóbulo superior ligeramente más grande. Branquiespinas cortas. De 75 a 90 escamas en una serie por sobre la línea lateral. Color. Dorso gris azulado, Flancos y vientre plateados. Hocico café claro. Cabeza amarillo claro oliváceo sobre el dorso. Aletas dorsal y caudal obscuras; pectorales, pélvicas y anal amarillosas con los márgenes obscuros; la caudal con el lóbulo superior ligeramente amarilloso. Distribución. Cosmopolita de mares tropicales y subtropicales del Océano Pacífico y del Indico, Mar Rojo, costa este de África y Madagascar, desde los mares Indicos hasta el archipiélago Malayo, China, Japón, Australia, Melanesia, Polinesia y Hawaii. En el área de estudio: Lagunas de Salinas de Apozahualco, Chautengo, Tres Palos, Nuxco y Potosí. Material examinado, 23 ejemplares de 81 a 140 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000,074/.076 (Gro.). Observaciones. Su extensa distribución a través de costas e islas determina que se hayan reportado numerosas variedades de la especie (Schuster, 1960). A México fueron introducidos desde Hawaii y transplantados en aguas de San Francisco, California en el año de 1877 (Mc Hugh y Fitch, 1951), desde donde radiaron hacia el sur. Berdegué (1956) señala que aunque no hay estadísticas precisas de la abundancia de esta especie desde su introducción, se sabe que ahora son más abundantes en aguas del Golfo de California. En México se les conoce con el nombre vulgar de "sabalotes" (Lindner, 1947; Berdegué, 1954 y 1956) mientras que en los Estados Unidos reciben el nombre de "milk fishes" (Bailey et al., 1970). Carranza (1970) y Yáñez-Arancibia (1976b y 1976c) han indicado que Chanos chanos es una de las especies con perspectivas de cultivos en lagunas costeras del Pacífico mexicano representando un recurso económico potencial. En la región Indo-pocífica se le cultiva intensamente (Gopalakrishnam, 1972; Pillay, 1972). En estos estudios Chanos chanos corresponde a una especie marina que utiliza las lagunas costeras como áreas de crianza para alimentarse, protegerse y crecer. Superorden Ostariophysi. Orden Cypriniformes. Suborden Characoidei. Familia XI. Characidae (Characinidae). Género 16. Astyanax Baird y Girard, 1854) 24) Astyanax fasciatus (Cuvier, 1854). N. Y.: "Sardinita"(Lám. 15, Fig. 1) Astyanax fasciatus (Cuvier); Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:97; Álvarez, Com. Nac. Consul. Pec. Inst. Nac. Inv. Biol.-Pesq., 1970: 4344; Dahl, INDERENA, 1971: 149-150, 2 figs.; Miller, Fieldiana Zoology, 1976, 69(1):1-31. Tetragonopterus mexicanus Filippi; Guerin's Rev. Mag. ZooL, 1853:166; Meek, Field colum. Mus. Zool. Ser., 1904, 5:85. Astyanax mexicanus (Filippi); Jordan, Evermann v Clark. U. S. Bureau of Fisheries, 1930, 2:96; Miller, Fieldiana Zoology, 1976, 69(1):1-31. Diagnosis. Cuerpo comprimido y una pequeña aleta dorsal adiposa posterior, Cabeza de 3.8 a 4.2 en la longitud patrón, más bien baja; ojos 2,5 a 3.8 en la longitud cefálica; huesos suborbitales no fragmentados; dientes premaxilares en 2 series siendo los anteriores fuertes y policúspidos; dientes maxilares no aserrados, uniseriados; dientes mandibulares uniseriados siendo mayores los centrales y pentacúspidos. D 9-12; A. 18-23 (?). De 10 a 17 branquiespinas sobre la rama inferior del primer arco. De 32 a 40 escamas en una serie longitudinal. Aletas pectorales de 4.8 a 5. 1 en la longitud patrón. Color. Cuerpo pigmentado, plateado pálido con una banda obscura en los flancos. Dorso del cuerpo y aleta caudal amarillentos. Distribución. En la costa del Océano Pacífico desde Baja California, México, hasta Argentina. En el área de estudio: Lagunas de Tres Palos, Coyuca y Mitla (muy abundante), además puede encontrarse en Salina de Apozahualco, Chautengo, Tecomate, Nuxco y Potosí. Material examinado. 351 ejemplares de 30 a 85 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000.077/.087 (Gro.). Observaciones. Se ha indicado por Alvarez (1970) que el género Astyanax es de amplia distribución y la especie A. fasciatus, la única de la costa de México. Según Dahl (1972) presenta variaciones del color rojo al amarillo en la aleta caudal. Aparentemente existen numerosas subespecies en territorio mexicano con diferencias muy sutiles entre ellas. Los ejemplares de este estudio presenta 4 características importantes que pueden determinar su posición como pertenecientes a la subespecie Astyanax fasciatus mexicanus Filippi, a saber: 1) los ejemplares corresponden a poblaciones que habitan la cuenca del Río Balsas, 2) presentan una mancha obscura circular muy conspícua al comienzo de la banda lateral, 3) la banda lateral termina en el pedúnculo caudal en otra conspicua mancha obscura de forma rómbica alargada, y 4) la aleta anal puede presentar hasta 27 rayos (1) Alvarez (1970) considera a esta subespecie básicamente por su distribución geográfica pero nada señala sobre características morfológicas evidentemente notorias constatadas en este estudio. La especie es dulceacuícola y llega a las lagunas proveniente de los escurrimientos locales. En las lagunas de Coyuca, Tres Palos y Mitla es particularmente abundante y completa todo su ciclo de vida en el interior de ellas. Es abundante durante la época de lluvias pero su captura se dificulta por su pequeño tamaño. Se alimenta de zooplancton, larvas de insectos y pequenas cantidades de detritus. Orden Siluriformes. Familia XII. Arriidae. Género 17. Galeichthys (Cuvier y Valenciennes, 1840). 25) Galeichthys caerulescens (Günther, 1864) N. v.: "Bagre", "Cuatete", "Chihuil"(Lám. 15, Fig. 2) Arius caerulescens Günther Cat. Fish. Brit. Mus., 1864, 5:149; Álvarez, Com. Nac. Consul. Pec. Inst. Nac. Inv. Biol.-Pesq., 1970;70, Galeichthyis caerulescens (Günther), Jordan y Evermann, Bull. U. S. Nat. Mus., 1900, 17:2 y 776; Regan, Biol. Center.-Amer. Pisces, 1906-1908: 123; Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:150; Berdegué, Secretaría de Marina, Dir. Gral. Pesc. Ind. Con., 1956: 27 y 118; González-Villaseñor, Tesis profesional Fac. Ciencias Univ. Nal. Autón. México, 1972: 1-88; Yáñez-Arancibia Curiel-Gómez y Leyton An. Centro Cienc. del Mar y Limnol. Univ, Nal. Autón. México, 1976, 3(1):125-180. Diagnosis. Cuerpo alargado, comprimido hacia el extremo posterior. Cabeza ligeramente deprimida de 3.2 a 3.7 en la longitud patrón; boca ancha; ojos 5.9 a 8.4 en la longitud cefálica; las barbillas maxilares llegan a la parte basal o media de las aletas pectorales, mayor en ejemplares pequeños. Altura máxima 5.2 a 6.4 en la longitud patrón. D. 1. 7; A. 14-15. De 11 a 14 branquiespinas sobre la rama inferior del primer arco. Dientes viliformes en el maxilar y vomer. Espina pectoral poco más larga que la dorsal, ambas aserradas. Color. Dorso azul negruzco; flancos con algunas pequeñas zonas plateadas sobre la línea lateral. Vientre blanquecino. Aleta caudal pálida de bordes obscuros; pectoral y ventral con la superficie interna obscura. Distribución. En el Océano Pacífico, desde el noroeste de México hasta Guatemala. En el área de estudio: Lagunas de Salinas de Apozahualco, Chautengo, Tecomate, Coyuca, Tres Palos, Mitla, Nuxco, Salinas del Cuajo y Potosí. Material examinado. 3396 ejemplares de 45 a 550 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000.088/.091 (Gro.). Observaciones. Berdegué (1954 y 1956) cita a la especie G. guatemalensis (Günther) para la costa noroccidental de México remarcando su afinidad con G. caerulescens (Günther) y con G. seemani (Günther). De la lista de peces marinos del estado de Guerrero dada por Ramírez-Hernández y Páez (1965) y del estudio posterior de González-Villaseñor (1972) y de YáñezArancibia et al., (1976), se desprende que sólo 4 especies de Galeichthys son frecuentes para las costas de Sonora, Sinaloa, Nayarit y Guerrero, esto es G. caerulescens., guatemalensis, seemani y gilberti. Ramírez-Granados (1952) para algunas lagunas de Guerrero ya había reportado G.caerulescens y González-Villaseñor (1972) indicó que es una de las especies más abundantes en las lagunas litorales del noroeste de México. En el estado de Sinaloa denominan a estas especies "bagres" o "chihuil", pero en el estado de Guerrero se conocen comúnmente como "cuatete". Se consumen frescos o secados en sal, y los pescadores locales les atribuyen grandes propiedades alimenticias. Es una de las especies más características en el sistema lagunar estudiado y por su frecuencia y abundancia parece ser una especie cuyos hábitos la han hecho especialmente adaptable al ambiente de las lagunas costeras. Numerosos estudios parciales se han realizado sobre esta especie (González-Villaseñor, 1972; Amezcua-Linares, 1972 y 1977; Yáñez-Arancibia 1975b, 1977; Yáñez-Arancibia y Leyton Vargas, 1977) y recientemente un completo estudio considerando su alimentación, crecimiento, madurez reproducción, desarrollo embrionario y relaciones ecológicas han realizado Yáñez-Arancibia et al. (1976). Galeichthys caerulescens es una especie que caracteriza al sistema lagunar costero de Guerrero y como además reviste importancia económica, se le discute en forma especial en el capítulo de relaciones tróficas y aspectos generales de dinámica de poblaciones en este trabajo. Corresponde a una especie típicamente estuarina. 26) Galeichthys gilberti Jordan y Williams, 1895 N. v.: "Bagre", "Cuatete", "Chihuil"(Lám. 15, Fig. 3) Galeichthys gilberti Jordan y Williams, Proc. Cal. Ac. Sci., 1895, 5:395, lám, 26, Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:150; González-Villaseñor, Tesis profesional Fac. Ciencias Univ. Nal. Autón, México, 1972: 1-88; Amezcua-Linares, Tesis profesional Fac. Ciencias Univ. Nal. Autón. México, 1972,:85-87. Diagnosis. Cuerpo alargado, ligeramente robusto y comprimido hacia atrás. Cabeza ligeramente deprimida de 3.5 a 4.0 en la longitud patrón; boca ancha; ojos de 5.1 a 6.0 en la longitud cefálica; las barbillas maxilares ligeramente aplanadas en la base llegan a la mitad de la base o sobrepasan el extremo posterior de las pectorales en ejemplares jóvenes. Altura máxima de 4.5 a 5.6 en la longitud patrón. D. I, 7; A. 16-17. De 12 ó 13 branquiespinas sobre la rama inferior del primer arco. Manchas de dientes vomerinos redondos u ovalados, separados, contínuos o subcontínuos de los palatinos ocupando mayor área, en conjunto presentan forma de clava o basto. Espina de la aleta dorsal larga, ligeramente mayor que las espinas pectorales, ambas aserradas. Color. Dorso gris azulado, vientre blanquecino. Aletas anal y caudal pálidas, esta última con el borde de los lóbulos obscuros. Aletas pectorales y pélvicas con la superficie interna obscura. Distribución. En el Pacífico de México desde Sonora hasta Guerrero. En el área de estudio: Lagunas,de Salinas de Apozahualco, Chautengo y Tecomate. Material examinado 5 ejemplares de 187 a 306 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000.092/.095 (Gro.). Observaciones. Galeichthys gilberti fue una especie rara en el sistema lagunar costero de Guerrero. Puede decirse que su ocurrencia fue excepcional. Para Guerrero, además, Ramírez-Granados (1952) y RamírezHernández y Páez (1965) han citado a Galeichthys guatemalensis, pero esa especie nunca ha sido encontrada en las lagunas del Pacífico de México (González-Villaseñor, 1972; Amezcua-Linares, 1972 y 1977, Yáñez-Arancibia y Nugent, 1975). Amezcua-Linares (1972) ha señalado que Galeichthys gilberti es una especie preferentemente carnívora y que se reproduce por grandes huevos de hasta 14 mm de diámetro, teniendo cada gónada un mínimo de 3 y un máximo de 16 huevecillos maduros. Galeichthys gilberti es una especie afín con G. caerulescens sin embargo, existen diferencias notorias entre ellas como el mayor número de rayos anales, la mayor longitud de la espina de la aleta dorsal sobre las pectorales la coloración gris del dorso y negra de la superficie dorsal y carnosidades de las pélvicas en las hembras y la mayor altura corporal, caracteres todos que presenta G. gilberti. De los estudios de Carranza y Amezcua-Linares (1971a y 1971b) , Amezcua-Linares (1972) y González-Villaseñor (1972) se conocía una distribución de G. gilberti solamente para Sonora, Sinaloa y Nayarit, pero no se había reportado para Guerrero, en el Pacífico mexicano. Según GonzálezVillaseñor (1972) es una especie menos frecuente y menos abundante que G. caerulescens en la costa noroccidental de México, y sus hábitos son carnívoros depredando sobre pequeños crustáceos, peces y huevecillos de éstos y otros grupos; más aún, tanto G. caerulescens como G. gilberti soportan amplios rangos de variación de temperatura y salinidad. En nuestros estudios G. gilberti fue menos importante comercialmente que G. caerulescens. Sin embargo, ambas especies son consumidas asiduamente y por su capacidad euritérmica y eurihalina están especialmente adaptadas a un ambiente lagunar. Género 18. Arius Cuvier y Valenciennes, 1858. 27) Arius liropus (Bristol, 1896). N. v,: "Bagre", "Cuatete", "Chihuil"(Lám. 15, Fig. 4) Tachysurus liropus Bristol, in Gilbert, Proc. U. S. Nat, Mus., 1896, 19:438; Jordan y Evermann, Bull. U. S. Nat. Mus., 1900, 47:29 y 784. . Arius liropus (Bristol); Regan, Biol. Cent.-Amer. Pisces, 1906-1908: 127; Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:151; Álvarez, Com. Nac. Consul. Pec. Inst. Nac. Inv. Biol. Pesq., 1970: 69-71; González-Villaseñor, Tesis profesional Fac. Ciencias Univ. Nal. Autón. México, 1972: 1-88; Amezcua-Linares, Tesis profesional Fac. Ciencias Univ. Nal. Autón. México, 1972: 90-94. Diagnosis. Cuerpo alargado y robusto anteriormente. Cabeza deprimida hacia la parte anterior de 3.2 a 4.0 en la longitud patrón; boca ligeramente ancha; ojos de 4.5 a 5.5 en la longitud cefálica; las barbillas maxilares llegan o rebasan ligeramente la base posterior de las aletas pectorales. Altura máxima de 4.3 a 5.8 en la longitud patrón, D. I, 7; A. 18-20. De 12 a 13 branquiespinas sobre la rama inferior del primer arco. Dientes palatinos granulares y molariformes, en grupos pequeños o moderados sin proyecciones hacia atrás; sin dientes vomerinos. Fontanela desarrollada en un surco bien definido que casi alcanza el proceso occipital de 2.2 a 2.9 en la cabeza. Color. Dorso café negruzco flancos ligeramente plateados, vientre pálido. Aletas pélvicas, anal y caudal con ligeras puntuaciones café sobre un fondo pálido. Aletas pectorales con la superficie interna café negruzca. Distribución. En el Pacífico de México desde Sonora hasta Guerrero. En el área de estudio: Laguna de Chautengo. Material examinado. 3 ejemplares de 174 a 253 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México, Catálogo CCML-PF 0.001.400 (Gro.) Observaciones. Esta especie es rara en el sistema lagunar costero de Guerrero y nunca fue colectada en las actividades de campo entre 1973 y 1975. Sólo fueron encontrados 3 ejemplares en agosto de 1976. Amezcua-Linares (1972) señala que Arius liropus en Nayarit se alimenta de pequeños peces, macroinvertebrados y aún vegetales, pero su información sobre reproducción es muy vaga. Superorden Atherinomorpha. Orden Atheriniformes. Suborden Exocoetoidei. Familia XIII. Exocoetidae (Hemirhamphidae). Género 19. Hyporhamphus Gill, 1860. 28) Hyporhamphus unifasciatus (Ranzani, 1842). N. v.: "Pajarito","Aguja", "Chuparrosa"(Lám. 16, Fig. 1) Hemirhamphus unifasciatus Ranzani, Nov. Com. Acad. Sci. Bonon., 1842, 5;326. Hemirhamphus richardi Cuvier y Valenciennes, Hist. Nat. Poiss., 1846, 19:26. Hiporhamphus tricuspidatus Gill, Proc. Ac. Nat. Sci. Phila., 1859: 131. Hemirhamphus roberti Günther, Cat. Fish. Brit. Mus., 1866, 6:263; Meek y Goss, Proc. Ac. Nat. Sei. Phila., 1884: 223; Jordan y Evermann, Bull. U. S. Nat. Mus., 1896, 47:72 1, lám. 117, fig. 312; Kendall y Radcliffe, Mem. Mus. Com. Zool. Harv., 1912, 35:84. Hiporhamphus unifasciatus (Ranzani); Meek y Hildebrand, Field Mus. Nat. Hist. Publ. Zool. Ser., 1923, 15(215):232-241; Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:198; Hildebrand, Bull. U. S. Nat. Mus., 1946, 189:145-146: Cervigón, Los Peces Marinos de Venezuela, 1966, 1(11):221-222; Chirichigno, Inf. Inst. Mar. Perú-Callao, 1974, 44:94 y 338; Reséndez, An. Inst. Biol. Univ. Nal. Autón. México Ser. Cienc, del Mar y Limnol., 1970, 41(1):102; S. I. C., Catálogo de Peces Marinos Mexicanos, 1976: 74-75 y 214. Diagnosis. Cuerpo muy alargado de costados convexos, Cabeza de 4.4 a 5.0 en la longitud patrón; la mandíbula moderadamente prolongada, de longitud variable pero más grande que la cabeza en los juveniles y mucho más corta en los adultos; hocico de 2.5 a 3.1 en la cabeza; ojos de 3,6 a 4.4. Altura máxima de 6.3 a 9.8 en la longitud patrón, D. 1316, A. 15-17. De 20 a 25 branquiespinas sobre la rama inferior del primer arco. De 52 a 59 escamas en una serie longitudinal por sobre la línea lateral. Caudal furcada con el lóbulo inferior más grande; dorsal y anal similares ubicadas posteriormente y densamente escamadas; pélvicas pequeñas; pectorales cortas de 1.4 a 1.9 en la longitud cefálica. Color. Generalmente plateados con el dorso presentando algunas puntuaciones obscuras más conspicuas en el margen de las escamas. La línea media dorsal con tres líneas negras; flancos con una banda plateada marginada de negro en su parte dorsal. Dorso de la cabeza y mandíbula obscuros. Aletas pálidas pero la dorsal, anal y caudal con los bordes obscuros. Distribución. En ambas costas de América. En el Atlántico, desde Maine y Bermudas hasta Argentina incluyendo el Golfo de México. En el Pacífico desde el Golfo de California hasta las islas Galápagos. En el área de estudio: Lagunas Salinas de Apozahualco, Chautengo, Tecomate y Nuxco. Material examinado. 20 ejemplares de 87 a 144 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PI 0.000.096/.100 (Gro.). Observaciones. Hyporhamphus unifasciatus es una especie de pequeño tamaño, muy alargada, con las aletas dorsal y anal de posición muy posterior y de bases iguales, densamente escamadas al menos sobre la base. Este último caracter la diferencia de las otras dos especies del género existentes en aguas mexicanas, (i.e., Hyporhamphus mexicanus Alvarez y H. patris Miller). Además H. mexicanus presenta sólo 13 radios anales y de 53 a 65 escamas en una serie longitudinal. En realidad existe mayor afinidad taxonómica entre H. unifasciatus y H. patris. Hyporhamphus unifasciatus carece de importancia comercial en el sistema lagunar costero de Guerrero. Generalmente penetran pequeños cardúmenes de ejemplares adultos y para buscar alimento. Reséndez (1970) también señala que esta especie carece de importancia comercial en algunas lagunas costeras del Golfo de México. Cervigón (1966) agrega que la especie es de hábitos pelágico-costeros, se alimenta de pequeños organismos y algunas algas, y su distribución alcanza incluso hasta el Atlántico oriental. 29) Hyporhamphus patris Miller, 1945. N. v.: "Pajaritos"Hiporhamphus patris Miller, Proc. U. S. Nat. Mus., 1945, 96:185-192; Álvarez, Com. Nac, Consul. Pec. Inst. Nac. Inv. Biol.-Pesq., 1970: 79. Diagnosis. Cuerpo alargado, flancos convexos. Cabeza 4.5 a 5.0 en la longitud patrón; hocico 2.8 a 2.9 en la longitud cefálica; mandíbula larga de 3.6 a 4.2 en la longitud patrón; ojos 4.0 a 4.3 en la longitud cefálica. Altura máxima 8.0 a 9.6 en la longitud patrón. D. 13-15; A. 1516; P. 10; V. 6, De 21 a 24 branquiespinas sobre la rama inferior del primer arco. De 53 a 59 escamas en una serie longitudinal. El origen de las aletas pélvicas equidistante entre la base de la caudal y las aberturas branquiales, Aletas dorsal y anal sin escamas. Color. Dorso verde-azulado. Aletas amarillentas. Ningún color brillante sobre las mandíbulas. Los ejemplares fijados presentan un color plateado y cafesoso pálido. Distribución. En aguas tropicales de Sonora y Sinaloa en el Pacífico de México. Observaciones. Aunque esta especie no fue encontrada en este estudio, ha sido citada por Ramírez-Granados (1952) para Coyuca y Tres Palos en el sistema lagunar costero de Guerrero. Sólo dos especies de "pajaritos" existen en aguas dulces de México, i.e., Hyporhamphus patris y H. mexicanus Álvarez. Familia XIV. Belonidae. Género 20. Strongylura Van Hasselt, 1823. 30) Strongylura stolzmanni (Steindachrier, 1878). N. v. "Agujón"Belone stolzmanni Steindachner, Sitzb, k. Ak. Wiss. Wien 177, Ichth. Beitr, 1878, 7:21; Chirichigno, Inf. Inst, Mar Perú-Callao, 1974, 44: 90 y 329. Tylosurus sierrita Jordan y Gilbert, Proc. U. S. Nat. Mus., 1881, 4:458. Tylosurus stolzmanni (Steindachner); Jordan y Fordice, Proc. U. S. Nat. Mus., 1886: 349; Jordan y Evermann, Bull. U. S. Nat. Mus., 1896, 47:713, Gilbert y Starks, Mem. Cal. Ac. Sci., 1904, 4:52; Kendall y Radcliffe, Mem. Mus. Comp. Zool. Harv., 1912, 35:84; Meek y Hildebrand, Field Mus. Nat. Hist. Publ. Zool. Ser., 1923, 15(215):228-229. Strongylura stolzmanni (Steindachner); Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:196; Hildebrand, Bull. U.S. Nat, Mus., 1946, 189:143-144; Ramírez-Hernández y Páez, An. Inst. Nal. Iny. Biol. Pesq., 1965, 1:335; Amezcua-Linares, Tesis profesional Fac. Ciencias Univ. Nal. Autón. México, 1972 95-96; S. I. C. Catálogo de Peces Marinos Mexicanos, 1976: 6, 74 y 164. Diagnosis. Cuerpo muy delgado, alargado y suavemente comprimido. Cabeza relativamente grande de 2.7 a 3.1 en la longitud patrón, ambas mandíbulas prolongadas a manera de pico; hocico largo y delgado 1.2 a 1.5 en la cabeza; ojos 9.0 a 13.0 en la longitud cefálica; dientes agudos de tamaños irregulares. Altura máxima 22 a 27 veces en la longitud patrón. D. 14-15; A. 17-19; P. 11; V. 7. Escamas pequeñas, entre 320 y 330 en series laterales, mejillas densamente escamadas. Línea lateral con una notable quilla sobre el pedúnculo caudal. Origen de la aleta dorsal por arriba del quinto radio de la aleta anal, esta última más larga y ambas con los radios anteriores elongados, caudal cóncava con el lóbulo inferior más largo, ventrales pequeñas 0.5 de las pectorales, pectorales anchas y largas de 5.5 a 6.0 en la cabeza. Color. Dorso ligeramente verdoso, flancos con una delgada banda obscura longitudinal, vientre pálido. Cabeza y región dorsal con pequeños puntos obscuros. Extremo de la aleta dorsal obscuro, el resto de la aleta pálida; caudal obscura, pectorales, pélvicas y anal pálidas. Distribución. En el Océano Pacífico desde el Golfo, de California hasta el norte de Perú e Islas Galápagos. En el área de estudio: Lagunas Salinas de Apozahualco, Chautengo, Nuxco y Salinas del Cuajo. Material examinado. 8 ejemplares de 226 a 435 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000.101/.103 (Gro.) Observaciones. Estrongylura stolzmanni aparentemente es una especie común en las aguas costeras, pero difícil de capturar por su constante movilidad y desplazamientos. Ha sido registrada en lagunas costeras de Sonora, Sinaloa, Nayarit y Guerrero (Ramírez-Hernández y Páez, 1965; Amezcua-Linares, 1972 y 1977; Yáñez-Arancibia y Nugent, 1975). En el sistema lagunar costero de Guerrero se comporta como un pez marino que utiliza los estuarios al estado adulto y para alimentarse. Sus hábitos son exclusivamente carnívoros. Su importancia comercial es muy limitada por lo poco frecuente de sus capturas. Existen dos géneros de agujones en aguas mexicanas, Strongylura Van Hasselt y Tylosurus Cocco. Sediferencian básicamente por el número de rayos dorsales presentando Strongylura de 15 a 17 y Tylosurus de 21 a 23. Género 21. Tylosurus Cocco, 1833 31) Tylosurus fodiator Jordan y Gilbert, 1881. N. v.: "Agujón"Tylosurus fodiator Jordan y Gilbert, Proc. U.S. Nat. Mus., 1881, 4:459; Jordan y Fordice, Proc. U. S. Nat. Mus., 1886: 353; Jordan y Evermann, Bull U. S. Nat. Mus., 1896, 47:715, Gilbert y Stark, Mem. Cal. Ac. Sci., 1904, 4:52; Meek y Hildebrand, Field Mus. Nat. Hist. Publ. Zool. Ser., 1923, 15(215):223 226; Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:196; Ramírez-Hernández y Páez, An. Inst. Nal. Inv. Biol.-Pesq., 1965, 1335. Diagnosis. Cuerpo muy alargado, casi cilíndrico, tan amplio como profundo. Cabeza de dorso deprimido, subcuadrada con un surco longitudinal dorsal, de 3.2 a 3.5 en la longitud patrón; ambas mandíbulas prolongadas a manera de pico; hocico fuerte más corto que en otras especies; de 1.5 a 1.7 en la cabeza; ojos de 8.6 a 11.5 en la longitud cefálica; dientes agudos de tamaños irregulares. Altura máxima 14.7 a 25 veces en la longiutd patrón, D. 19-22, A. 16-20. Escamas muy pequeñas, entre 445 y 455 en series laterales; mejillas densamente escamadas. Línea lateral con una quilla dérmica en el pedúnculo caudal. Origen de la aleta dorsal exactamente o ligeramente anterior al origen de la anal, ambas con los radios anteriores elongados en los adultos; aleta caudal con el lóbulo inferior más largo; pélvicas bien desarrolladas, ligeramente más cortas que las pectorales; pectorales moderadas de 3.6 a 4.4 en la longitud cefálica. Color. Dorso verdoso, flancos plateados, vientre pálido. Línea media dorsal obscura. Aleta anal pálida, las otras aletas más o menos obscuras. En los juveniles los flancos y el vientre son obscuros. Distribución. En el Pacífico, desde Sinaloa, México hasta Panamá. En el área de estudio: Lagunas Chautengo y Potosí. Material examinado. 5 ejemplares de 291 a 548 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000.104 (Gro). Observaciones. Tylosurus fodiator ha sido tradicionalmente una especie más bien rara en los ecosistemas costeros del Pacífico de México. Se diferencia fundamentalmente de las otras especies de Tylosurus de México por sus mandíbulas muy fuertes y cortas (i.e., Tylosurus pacificus (Steindachner) en la costa del Pacífico, T. raphidoma (Ranzani) en la costa del Golfo y T. acus (Lacépède) en la costa del Golfo). Penetra rara vez a las lagunas de Guerrero, al estado adulto y supuestamente en busca de alimento. Castro et al. (1970) la consideran una subespecie de Tylosurus crocodilus y la registran entre los peces del Golfo de California. El género Strongylura, anteriormente discutido, presenta otras dos especies en el Pacífico mexicano, aparte de S. stolzmanni estudiada en este trabajo, i.e., S. exilis (Girard) y S. scapularis (Jordan y Gilbert), esta última también penetra aguas estuarinas (ver Ramírez-Hernández y Páez, 1965; Castro et al., 1970; S. I. C., 1976). Suborden Cyprinodontoidei. Familia XV. Poeciliidae. Genero 22. Poecilia Bloch y Schneider, 1801. 32) Poecilia sphenops Cuvier y Valenciennes, 1846(Lám. 16, Fig. 2) Poecilia sphenops Cuvier y Valenciennes, Hist. Nat. Poiss., 1836, 17:98, 130 y 525. Mollienesia sphenops (Cuvier y Valenciennes); Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:192. Poecilia sphenops Valenciennes; Ramírez-Granados, Revta. Soc. mex. Hist. Nat., 1952, 13:199-218; Álvarez y Cortés, An. Esc. Nac. Cienc. biol. Méx., 1962, 11(14):120; Álvarez, Com. Nac. Consul. Pec. Inst. Nac, Inv. Biol. Pesq., 1970: 103-106; Rosen y Bailey, Bull. Am. Mus. Nat, Hist., 1963, 126(1):1-176 (sinonimia completa); Miller, Fieldiana Zoology, 1976, 69(1):14-18. Diagnosis. Cuerpo profundo, de tamaño mediano a grande, dentro de lo común de la familia. Cabeza grande 3.0 a 3.2 en la longitud patrón. Dimorfimo sexual poco aparente, excepto en las especies de aleta dorsal muy amplia. Solamente la rama posterior del cuarto radio, con sierra. D. 9-10 (11). Generalmente 12, rara vez 13 escamas predorsales. Sin prolongaciones mcmbranosas en el labio inferior. El origen de la aleta dorsal por detrás de la mitad de la longitud patrón. Color. Pálido uniforme, sin bandas ni lunares. Distribución. En aguas continentales desde el Río San Juan, México, hasta Centro América y norte de Sudamérica (Colombia). En el área de estudio: Lagunas de Chautengo, Coyuca, Tnes Palos, Mitla, Nuxco, y Potosí. Material examinado. 334 ejemplares de 20 a 58 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000.105/.116 (Gro.). Observaciones. La taxonomía de los Poecílidos es en extremo complicada y se basa en osteología comparada y estructuras gonopodiales (Rosen y Bailey, 1963) . En este estudio no se entrega una amplia diagnosis para esta especie, considerando que existe la documentada monografía de Rosen y Bailey (1963) donde se discuten aspectos taxononómicos, morfológicos, paleontológicos y zoogeográficos de los Poecílidos en el mundo. Actualmente se considera sinónimo de Poecilia Bloch y Schneider, a algunas especies de los géneros Mollienesia Le Sueur Alazon Gistl, Limia Poey, Lebistes Filippi, Acropoecilia Hilgendorf, Acanthophacelus Eigenmann, Phamphorichthys Regan, Neopoecilia Hubbs, Parapoecilia Hubbs, Allopoecilia Hubbs, Micropoecilia Hubbs, Psychropoecilia Myers, Lembesseia Fowler, Curtipenis Rivas y Myers Recepoecilia Whitley (Rosen y Bailey, 1963). Poecilia sphenops es la especie más abundante de este género en aguas mexicanas y se ha considerado por Álvarez (1970) que se compone de Varias subespecies: P. s. pallida en la cuenca del Río Balsas y adyacentes, P. s. sphenops en la cuenca del Río Papaloapan y ríos adyacentes al norte de ella, P. s. vantynei en Tabasco, P. s. macrura. en el Río Campotón y P. s. altissima en el norte de la Península de Yucatán. En el sistema lagunar costero de Guerrero es abundante en las lagunas dulceacuícolas (i.e., Coyuca, Tres Palos y Mitla) pero difícil de colectar por su pequeño tamaño y cuando se le colecta en las restantes lagunas es en forma esporádica y sólo en los pequeños afluentes lagunares. Es una especie dulceacuícola que carece de importancia comercial pero por la densidad de sus poblaciones reviste importancia ecológica como eslabón trófico de peces consumidores superiores. Ramírez-Granados (1952) la había reportado anteriormente para Coyuca y Tres Palos. Género 23. Poeciliopsis Regan, 1913. 33) Poeciliopsis lucida Miller, 1960(Lám. 16, Fig. 3) Poeciliopsis lucida Miller, Occas, Pap. Mus. Zool. Univ, Michigan, 1960, 619:111; Rosen y Bailey, Bull. Am. Mus. Nat, Hist., 1963, 126(1):1-176; Álvarez, Com. Nac. Consul. Pec. Inst, Nac. inv. Biol.-Pesq., 1970: 116-118; Amezcua-Linares, Tesis profesional Fac. Ciencias Univ. Nal. Autón. México, 1972: 97-98; Yáñez-Arancibia y Nugent, Publ. Ciencias Biológicas Univ. Autón. Nuevo León, Vol. in memoriam Dr. E. Caballero, 1975. Diagnosis. Cuerpo profundo, elevado por delante de la aleta dorsal, Cabeza más bien pequeña de 3.7 a 4.0 en la longitud patrón, dientes cónicos. Altura máxima en las hembras de 3.8 a 3.9 en la longitud patrón, de 4.2 a 4.4 en los machos. D. 7-8; A. 9. De 27 a 29 escamas en una serie longitudinal por sobre la línea lateral. Aleta dorsal insertada por detrás del origen de la anal, más cerca de la base de la caudal que del extremo del hocico; pélvicas de igual tamaño en los dos sexos. Gonopodio alargado con los rayos imbricados a manera de un tubo, ápice con un segmento terminal alargado en forma de una pequeña una curva. Aletas pectorales ligeramente más pequeñas que la longitud cefálica. Color. Dorso, flancos y aletas dorsal y anal claros. Los bordes de las escamas con puntuaciones obscuras. Una línea lateral obscura recorre en la zona media alcanzando la base de la caudal. Distribución. Inicialmente Miller (1960) y Rosen y Bailey (1963) indicaron como distribución el Río Sinaloa y Río del Fuerte desde Sonora hasta Sinaloa. Sin embargo su distribución ha sido ampliada hasta Nayarit por Amezcua-Linares (1972) y Yáñez-Arancibia y Nugent (1975) y en este estudio se amplía aún más hasta la cuenca del Río Balsas en Guerrero; Lagunas de Coyuca, Tres Palos, Mitla. Material examinado. 57 ejemplares de 19 a 25 mm de longitud total. Colección de referencia depositada en el Laboratorio, de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000.117 (Gro.) Observaciones. Las hembras son un poco más grandes que los machos y por su escaso tamaño, y poca abundancia carecen de importancia comercial. Son especies típicamente dulceacuícolas. Su hallazgo en Guerrero ampía su rango de distribución mucho más al sur de la zona dada por Miller (1960), Rosen y Bailey (1963) y Álvarez (1970). Álvarez (1970) ha señalado la complejidad taxonómica de estas especies del género Poeciliopsis donde existrían al menos 11 especies para México. Miller (1976) ha desconocido esta especie descrita inicialmente por él en 1960. Sin embargo su criterio sinónimo es confuso y eso determina que en este estudio se siga el criterio taxonómico, de las monografías de Rosen y Bailey (1963) y de Álvarez (1970). Miller (1976) señala que su especie Poecillopsis lucida sería sinónimo de Gambusia fasciata Meek. 34 Poeciliopsis porosus De Buen, 1943(Lám. 16, Fig. 4) Poeciliopsis porosus De Buen, An. Inst. Biol. Univ. Nal. Autón. México, 1943, 14(1):262-283; De Buen, Revta. Soc. mex. Hist. Nat., 1947, 7(14):87-138; Álvarez y Aguilar, Revta. soc. mex. Hist. Nat., 1957, 18(1-4): 153172; Álvarez y Cortés, An. Esc. Nac. Cienc. biol. Méx., 1962, 11(14):118-121. Pocciliopsis intans (Woolman); Rosen y Bailey, Bull. Am. Mus. Nat. Hist., 1963, 126(1):1-126 (en parte); Alvarez, Com. Nac. Consult. Pec. Inst. Nac. Inv. Biol. Pesq., 1970: 116-118. Diagnosis. Cuerpo alargado suavemente comprimido. Cabeza con una escotadura media en el labio superior, de 22.5 a 23.5% de la longitud patrón. D. 8; A, 9-10; P. 13; V.6; C. 13-14. Altura máxima 22.5 a 26.5% de la longitud patrón. Branquiespinas digitiformes sobre la rama inferior del primer arco, 15. De 29 a 30 escamas en una línea longitudinal. Vértebras 32, anteriores 12 y posteriores 20. Gonopodio de los machos 40 a 43% de la longitud, patrón, dos filas de ganchos en su borde posterior. Color. Dorso obscuro, poro genital intensamente obscuro y también la línea que recorre el pedúnculo a partir del término de la aleta anal. Pélvicas pálidas pectorales tenuamente pigmentadas a la largo de sus radios, caudal y dorsal ligeramente obscuras. Los machos son más obscuros aún, y cuando se encuentran en época de "celo" presentan un sorprendente colorido. El cuerpo se torna negro intenso y uniforme resaltando el intenso color amarillo de la aleta dorsal. Distribución. En aguas continentales de la parte media de la cuenca Lerma-Santiago y Duero, en México. Sin embargo esa distribución original queda ampliada hasta la cuenca del Balsas en Guerrero, en las lagunas costeras de Coyuca, Tres Palos, Mitla y Potosí. Material examinado. 53 ejemplares de 13 a 40 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Calálogo CCML-PF 0.000.118/.134 (Gro.) Observaciones. En este estudio no se entrega una diagnosis detallada para esta especie, considerando la detallada descripción de De Buen (1943), además que existe la documentada monografía de Rosen y Bailey (1963) donde se discuten aspectos taxonómicos, morfológicos, paleontológicos y zoogeográficos de los Poecílidos en el mundo. No obstante la situación es muy confusa en México por cuanto Álvarez y Aguilar (1957) y Álvarez y Cortés (1962) reconocen a Poeciliopsis porosus De Buen (1943) para las cuencas de los ríos Lerma, Santiago y Duero y posteriormente el mismo autor Álvarez (1970) desconoce a esta especie. Por otra parte Rosen y Bailey (1963) no revisaron ejemplares de P. porusus y a priori la ubicaron como sinónima de P. infans (Woolman) y por su consecuencia también sinónima de Gambusia infans Woolman. Como la especie de este estudio se ajusta exactamente a la detallada descripción de De Buen (1943) se le considera revalidada y se le denomina Poeciliopsis porosus De Buen. 35) Poeciliopsis balsas Hubbs, 1926(Lám. 17, Fig. 1) Poeciliopsis balsas Hubbs, Univ. Mich, Mus. Zool, Mise. Publ., 1926, 16:66; Jordan, Evermany Clark, U.S. Bureau of Fisheries, 1930,2:189; De Buen, Trab. Est. Limnol, Patz, 1940, 2:1-66; De Buen, Revta. Soc. mex. Hist. Nat., 1947, 7(1-4):131; Grey, Fieldiana Zoology, 1947, 32(2):176; Álvarez y Aguilar, Revta. Soe. mex. Hist. Nat., 1957, 18(14):161; Álvarez y Cortés, An. Esc. Nal. Cienc. biol, Méx., 1962, 11(14):118-121; Alvarez, Com. Nac. Consul. Pec. Inst. Nac, Inv. Biol.-Pesq,, 1970: 116-118; Rosen y Bailey, bull Am, Mus. Nat. Hist., 1963, 126(1):1-176 (sinonimia completa). Poeciliopsis anonas De Buen, An. Inst. Biol. Univ. Nal. Autón, México, 1943, 11(1):262-283. Diagnosis. Cuerpo pequeño, alargado. Boca pequeña. Dientes de la serie externa claramente laminares con forma de incisivos, dispuestos en dos series internas. Origen de la aleta dorsal en la misma vertical que el último radio de la anal. Apice del gonopodio sin segmento alargado en forma de media luna. D. 8-9; A. 9. Con 30 escamas en una serie longitudinal. Color. Costados del cuerpo con 5 o más barras verticales angostas de color obscuro. Una cinta obscura dorsal y otra en el borde ventral del pedúnculo caudal. Distribución. En aguas continentales mexicanas, Cuenca del Río Balsas, Guerrero, y algunas pequeñas cuencas costeras en Michoacán. En el área de estudio: Lagunas de Tecomate, Tres Palos, Coyuca y Mitla. Material examinado, 2085 ejemplares de 15 a 43 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000,1357.51.3 (Gro.) . Observaciones. Poecillopsis balsas es una especie sin grandes, problemas taxonómicos desde su descripción por Hubbs (1926), comparada con otras especies de Poeciliopsis de México. Sus franjas coloreadas en sus costados y su distribución geográfica la identifican claramente. Miller (1976) la considera recientemente una especie válida sin mayor discusión indicando algunos sinónimos de ella. En el sistema lagunar costero de Guerrero es particularmente abundante especialmente durante el período 3. Sin embargo carece de importancia comercial por su diminuto tamaño, lo cual además dificulta su captura. No obstante en ese periodo ecológico dulceacuícola reviste gran importancia ecológica sirviendo de alimento a otros peces consumidores superiores. Género 24. Poecilistes Hubbs, 1926. 36) Poecilistes pleurospilus Günther, 1866 (Poeciliopsis gracilis Heckel)Girardinus pleurospilus Günther, Cat. fish. coll. Brit. Mus., 1866, 6:353. Heterandria lutzi Meek, Field Col. Mus. Zool., 1904, 5:148, fig. 47. Priapichthys lectonai Hildebrand, U. S. Bureau of Fisheries, 1925, 41:258. Poecilistes pleurospilus (Günther); Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:190. Diagnosis. Cuerpo pequeño, de estructura moderada. Cabeza 4.3 veces en la longitud patrón. Altura máxima 3.5 veces en la longitud patrón. D. 7; A. 7-8. Con 28 escamas en una serie longitudinal. Apice del gonopodio con un segmento más largo que los contínuos en forma de uña curva. Sin serie interna de dientes. Color. Uniforme, con 8 a 10 lunares obscuros a lo largo de la línea media de los flancos. Distribución. En aguas continentales desde la parte centrosur de México, hasta Guatemala. Observaciones. Aunque esta especie no fue encontrada en este estudio, ha sido citada por Ramírez-Granados (1952) para las lagunas de Coyuca y Tres Palos en el sistema lagunar costero de Guerrero. La especie ha cambiado de nombre siendo su denominación actual Poeciliopsis gracilis (Heckei) (Rosen y Bailey, 1963). Esos mismos autores señalan además una sinonimia completa para la especie. No obstante, se ha respetado la denominación que señaló Ramírez-Granados (1952) por cuanto no fue colectada en este estudio y por lo tanto no estudiada. Suborden Atherinoidei. Familia XVI Atherinidae. Género 25. Thyrinops Hubbs, 1918. 37) Thyrinops crystallina Jordan y Culver, 1895. N. v.: "Charales"(Lám. 17, Fig. 2) Thyrina crystallina Jordan y Culver, in Jordan et al., Proc. Cal. Ac. Sci., 1895, 5:420; Jordan y Evermann, Bull. U. S. Nat. Mus., 1896, 47:804; Jordan y Hubbs, Stanford Jurn. Univ. Publ. 1919: 58; Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:248; Amezcua-Linares, Tesis profesional Fac. Ciencias Univ. Nal. Autón. México, 1972: 98-99. Atherinella crystallina Jordan et al., Proc. Cal. Ac. Sci., 1895, 5:420. Thyrinops crystallina Jordan y Culver; Álvarez, Com. Nac. Consul. Pec. Inst. Nac. Inv. Biol.-Pesq., 1970, 123. Diagnosis. Cuerpo alargado y comprimido. Cabeza 4.2 en la longitud patrón, boca pequeña, mandíbula superior protráctil; maxilar 3.8 en la longitud cefálica. Altura máxima 4.5 a 5.0 en la longitud patrón. D. IV-I, 8-9; A. 1, 19-21. Escamas en una serie longitudinal 40. Numerosas branquiespinas. Pectorales largas y aguzadas, ligeramente mayor que la longitud cefálica. Color. Casi transparente, con puntos obscuros en el dorso y base de las aletas impares. Flancos con una línea plateada obscura longitudinal Aletas pélvicas obscuras o negras. Distribución. Aguas continentales de Sinaloa, jalisco y Guerrero, México. En el área de estudio: Lagunas de Chautengo, Tecomate, Tres Palos, Coyuca, Mitla, Nuxco y Potosí. Material examinado. 410 ejemplares de 40 a 68 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCXIL-PF 0.000.514/.520 (Gro.). Observaciones. Existen dos especies de Thyrinops entre la ictiofauna mexicana, Le., Th. crystallina y Th. evermanni, ambas descritas por Jordan y Culver (1895) in Jordan et al. (1895). La especie evermanni difiere porque su aleta anal es A. 1, 22-25 y posee hasta 36 escamas en una serie longitudinal; se le encuentra en aguas salobres de Sinaloa. Meek (1902) describió para el Río Balsas en Guerrero, a la especie Melaniris balsanus que estuvo mucho tiempo como sinónimo de Thyrina balsanus. Schultz (1948) y Álvarez (1970) han restablecido el género Melaniris y su especie balsanus para la cuenca del Río Balsas. Miller (1976) señala que la denominación genérica apropiada para estas especies debe ser Melaniris evermanni y Melaniris crystallina puesto que según él la separación entre Melaniris y Thyrinops no los justifica como género diferentes (Miller, 1966 y 1976; Miller y Carr, 1974). De los trabajos anteriores de Jordan y Evermann (1896), Carranza y Amezcua-Linares (1971) y Amezcua-Linares (1972 y 1977), se desprende que sólo se le colecta en aguas dulces salobres de salinidades bajas. Carece de importancia económica en el sistema lagunar costero de Guerrero y sólo puede atribuírsele importancia ecológica, especialmente durante el periodo 3 de las lagunas. Superorden Acanthopterigii. Orden Scorpaeniformes. Suborden Scorpaenoidei. Familia XVII. Triglidae. Género 26. Prionotus Lacépede, 1802. 38) Prionotus ruscarius Gilbert y Starks, 1904. N. v.: "Vacas"(Lám. 17, Fig. 4) Prionotus ruscarius Gilbert y Starks, Mem. Cal. Ac. Sci., 1904, 4:165, lám. 27, figs. 50 y 50a; Meek y Hildebrand, Field Mus. Nat. Hist. Publ. Zool. Ser., 1928, 15(249):850-852; Chirichigno, Inf. Inst. Mar Perú-Callao, 1974, 44:211 y 346. Prionotus birosiratus Jordan, Proc. U. S. Nat. Mus., 1885: 387 (no P. birostratus Richardson). Prionotus horrens Jordan y Evermann, Bull. U. S. Nat. Mus., 1898, 47:2172 (en parte; no P. horrens Richardson). Gurnardus ruscarius (Gilbert y Starks); Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:406. Diagnosis. Cuerpo poco alargado, comprimido hacia atrás. Cabeza amplia de 2.3 a 2.7 en la longitud del cuerpo, hocico deprimido tan largo como amplio 2.1 a 2.4 en la longitud cefálica, ojos 4.2 a 6.4; boca ancha; maxilar llegando cerca del margen anterior del ojo 2.3 a 2.6 en la longitud cefálica, Un prominente borde desde el hocico hasta la espina preopercular, hocico aserrado; 4 espinas sobre el borde a los lados de la cabeza, 1 espina sobre la parte anterior de la órbita y 2 sobre la parte posterior. Altura máxima 3.3 a 4,2 en la longitud del cuerpo, D. X- 12; A. 11. Branquiespinas delgadas, 6 sobre la rama inferior del primer arco. De 96 a 107 escamas en una serie longitudinal. Aleta dorsal espinosa prominentemente elevada, su origen ligeramente más adelante del niargen del opérculo, la segunda espina muy larga; caudal ligeramente cóncava con el lóbulo superior un poco más grande. Aletas pectorales moderadas, llegando casi al origen de la anal, 3.3 a 4.0 en la longitud del cuerpo. Color. Dorso y flancos de color café obscuro, vientre pálido. Aleta dorsal espinosa más obscura que la radiosa, a veces con manchas cafesosas y el margen negruzco. Caudal con manchas obscuras formando, barras cruzadas irregulares. Anales y pélvicas pálidas. Pectorales obscuras con una mancha pálida en el centro y el margen posterior negro. El vientre y la aleta caudal pueden presentarse rojizas. Distribución. En el Océano Pacífico, desde la Bahía Magdalena, Baja California, hasta Perú. En el área de estudio: Lagunas de Chautengo y Potosí. Material examinado 2 ejemplares de 195 y 230 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma México. Catálogo CCML-PF 0.000.521 (Gro.) . Observaciones. Ramírez-Hernández y Páez (1965) habían señalado la existencia de Prionotus horrens Richardson, entre los peces marinos de Guerrero. Prionotus ruscarius difiere de P. horrens por poseer una cabeza un poco más grande; un rayo más en la aleta anal; los bordes, gránulos y espinas humeral, opercular y occipital mucho más prominentes; además que P. horrens normalmente presenta 5 branquiespinas sobre la rama inferior del primer arco. Se considera que Prionotus ruscarius es un visitante muy excepcional en el sistema lagunar costero de Guerrero y no tiene trascendencia económica ni ecológica en la estructura de las comunidades estudiadas. Sus hábitos alimenticios son carnívoros alimentándose de peces y macroinvertebrados Castro et al. (1970) la consideran una especie poco común en las costas del Golfo de California indicando además la presencia de otras 4 especies de Prionotus en esas áreas, i.e., P. loxias Jordan, P. quiescens Jordan y Bollman, P. horrens Richardson y P. xenisma Jordan y Bollman. Orden Perciformes. Suborden Percoidei. Familia XVIII. Gentropomidae. Género 27. Centropornus Lacépède, 1802. 39) Ceniropomus nigrescens Günther, 1864. N. v.: "Robalo", "Robalo Prieto", "Chucumite" a los juveniles(Lám. 17, Fig. 3) Centropomus nigrescens Günther, Proc. Zool. Soc. London, 1864: 144; y Trans. Zool. Soc. London 1869, 6:407; Vaillant y Bocurt, Miss. Sci. Mex. . . , 1874, 1:20, Lám. 1, fig. 1; Jordan y Everniann, Bull U. S. Nat. Mus., 1896, 47:1119; Gilbert y Starks, Mem. Cal. Ac. Sci., 1904, 4:90; Regan, Biol. Centr. Amer. Pise., 1907: 50; Meek y Hildebrand, Field Mus. Nat. Hist. Publ. Zool. Ser., 1923, 15(215):426-428, lám. 42; Hildebrand, Bull. U. S. Nat. Mus., 1946; 189:228-229; Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:306; Berdegué, Secretaría de Marina, Dir. Gral. Pesc. Ind. Con., 1956: 296-300; Ramírez-Hernández y Páez, An. inst. Nal. Inv. Biol. Pesq., 1965, 1:337; Álvarez, Com. Nac. Consul. Pec. Inst. Nac. Iny. Biol. Pesq., 1970, 130-131; Amezcua-Linares, Tesis profesional Fac. Ciencias Univ. Nal. Autón. México, 1972: 102-106; Chirichigno, Inf. Inst. Mar Perú-Callao, 1974, 44:242 y 331; S. I. C., Catálogo de Peces Marino, Mexicanos, 1976: 78 y 175. Diagnosis. Cuerpo alargado, moderadamente elevado y comprimido, Cabeza 2.7 a 3.0 en la longitud patrón, larga y algo deprimida; boca grande, hocico 3,7 a 3.8 en la cabeza, ojos 7.2 a 8.1; maxilar llegando hasta el margen posterior de la pupila, 2.4 a 2.8 en la cabeza; dientes pequeños en las mandíbulas, vómer y palatinos; preopérculo y supraopérculo aserrados. Altura máxima 3,7 a 4,5 en la longitud patrón. D. VIII 8-10 con la tercera y cuarta espina más largas. A. 111, 6 con la segunda espina más corta que la tercera; P. 15. Escamas en una serie longitudinal de 69 a 78. Branquiespinas bien desarrolladas, 9-10 en la rama inferior del primer arco. Pectorales 2.2 a 2.3 en la longitud cefálica. Color. Dorso negruzco, vientre pálido. Opérculo con una mancha obscura. Línea lateral obscura. Aletas impares obscuras, las pares con puntuaciones débiles. Distribución. En el Océano Pacífico, desde Baja California, México, hasta Perú. En el área de estudio: Lagunas Salinas de Apozahualco, Chautengo, Tecomate, Nuxco, y Potosí. Material examinado. 48 ejemplares de 184 a 335 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000.522/.524 (Gro.) Observaciones. Según Berdegué (1954 y 1956), en la costa noroccidental de México se pesca en forma comercial, consumiéndose en fresco, seco y salado y también ahumado. En el sistema lagunar costero de Guerrero, Centropomus nigrescens es un recurso muy esporádico, por su poca abundancia. Puede considerársele como un especie marina que visita cíclicamente los estuarios utilizándolos como áreas naturales de crianza. Sus hábitos alimenticios lo ubican como un carnívoro superior. En el capítulo de relaciones tróficas y aspectos parciales de dinámica de poblaciones de este trabajo se estudia en particular a esta especie analizando un gran número de ejemplares. 40) Centropomus robalito Jordan y Gilbert, 1881 N. v.: "Robalo", "Robalo de Aletas Amarillas" "Pijolín" "Constantino"(Lám. 18, Fig. 1) Centropomus robalito Jordan y Gilbert, Proc. U. S. Nat. Mus., 1881, 4:462; Jordan y Evermann Bull, U. S. Nat. Mus., 1896, 47:1123; Gilbert y Starks, Mem. Cal. Ac. Sci., 1904, 4:94, lám. 13, fig. 25; Regan, Biol. Centr. Amer. Pise., 1907: 51; Kendall y Radcliffe, Mem. Mus. Comp. Zool. Harv., 1912, 35:101; Meek y Hildebrand, Field Mus. Nat. Hist. Publ. Zool. Ser., 1923,15(215):430-431; Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:306; Hiyama et al., Peces Marinos de la Costa Mexicana del Pacífico, 1940: 3839, lám. 20; Berdequé, Secretaría de Marina, Dir. Gral. Pese. Ind. Con., 1956: 296-300; Ramírez-Hernández y Páez, An. Inst. Nal. Inv. Biol.-Pesq., 1965, 1:337; Álvarez, Com. Nac. Consul. Pec, Inst. Nac. Inv. Biol.Pesq., 1970: 130-131; Chirichigno, Inf. Inst. Mar Perú-Callao, 1974, 44:24 y 331; S. I. C., Catálogo de Peces Marinos Mexicanos, 1976: 79, 80 y 179. Castro, Arvizú y Páez, Revta. Soc. mex. Hist. Nat., 1970, 31:133-134. Diagnosis. Cuerpo moderadamente alargado y comprimido, dorso elevado. Cabeza de dorso convexo, larga y deprimida 2.4 a 2.7 en la longitud patrón, hocico largo de 3.1 a 3.4 en la longitud cefálica, ojos 2.4 a 2.7; maxilar llegando a la línea media del ojo, 2.4 a 2,7 en la cabeza; preorbital, preopérculo y supraclavícula aserrados. Altura máxima 3.1 a 3.8 en la longitud patrón. D. VIII-1, 10; A. 111, 6 con la segunda espina muy fuerte y notablemente más grande que la tercera. Escamas en una serie longitudinal de 47 a 56. Branquiespinas numerosas de 13 a 17 sobre la rama inferior del primer arco. Pectorales moderadas casi alcanzan el extremo de las pélvicas 1.2 a 1.6 en la longitud cefálica. Color. Dorso azul-grisáceo pálido, flancos plateados, vientre blanquecino. Aletas pectorales, pélvicas y anal, amarillas. Caudal de base amarilla y borde gris obscuro. Opérculo brillante con matices amarillos. Distribución. En el Océano Pacífico desde el Golfo de California hasta Perú, En el área de estudio: Lagunas de Chautengo, Tecomate, Tres Palos, Coyuca, Nuxco, Salinas del Cuajo y Potosí. Material examinado, 163 ejemplares de 100 a 196 mm. de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000.525/.530 (Gro.). Observaciones. Hiyama et al. (1940) señalaron una especie Centropomus sp la cual, por los caracteres diagnósticos que entregan además de la execelente lámina coloreada que adjuntan, corresponde a Centropomus robalito. Corresponde a la especie de robalo más abundante en el sistema lagunar costero de Guerrero donde se comporta como una especie marina eurihalina que utiliza los estuarios como áreas naturales de crianza. Su ocurrencia masiva en las lagunas, durante el periodo 1 determina su importancia comercial. Eso sí sobre un recurso sexualmente inmaduro. En el capítulo de relaciones tróficas y aspectos parciales de dinámica de poblaciones de este trabajo, se estudia esta especie en forma particular considerando numerosos ejemplares. Castro et al. (1970) afirman que en la costa del Golfo de California es una especie común en la desembocadura de ríos y ambientes estuarinos. 41) Centropomus pectinatus Poey, 1860 N. v.: "Robalo", "Robalo de Aleta Prieta"Centropomus pectinatus Poey, Mem. Hist, Nat. Isla de Cuba, 1860, 2:121; Boulenger, Cat, fish. Brit. Mus. Ed. 2, 1895, 1:368; Jordan y Evermann, Bull. U, S. Nat. Mus., 1896, 47:1122; Regan, Biol. Centr. Amer. Pise., 1907: 46; Meek y Hildebrand, Field Mus. Nat. Hist. Publ. Zool. Ser., 1925, 15(226):419-423; Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:306; Berdegué, Secretaría de Marina, Dir. Gral. Pesc. Ind. Con., 1956, 296-300; Chávez, Ciencia Méx., 1963, 22(5):141-160; Ramírez-Hernández y Páez, An. Inst. Nal. Inv. Biol.-Pesq., 1965, 1:337; Chirichigno, Inf. Inst. Mar Perú-Callao, 1974, 41:242 y 331; S. I. C., Catálogo de Peces Marinos Mexicanos, 1976: 79 y 177. Centropomus undecimalis Cuvier y Valenciennes (en parte, no el de Blocli) Hist. Nat. Poiss., 1828, 2:102; Gúnther, Cat. Fish. Brit. Mus., 1859, 1:79. Centropomus pedimacula Poey, Mem. Hist. Nat. Isla de Cuba, 1860, 2:122, Vaillant y Bocurt, Miss. Sci. Méx., 1874: 29; Jordan y Evermann, Bull. U. S. Nat. Mus., 1896, 17:1119; Gilbert y Starks, Mem. Cal. Ac. Sci., 1904, 4:90; Jordan y Dickerson, Proc. U. S. Nat. Mus., 1908: 14. Centropomus medius Günther, Proc. Zool. Soc. London, 1864: 144. Centropomus cuvieri Bocurt, Ann. Sci. Nat. 5ta. Ser., 1868, 9:91. Centropomus grandoculatus Jenkins, y Evermann Proc. U. S. Nat. Mus., 1888: 139; Jordan y Evermann, Bull. U. S. Nat. Mus., 1896, 47:1120. Diagnosis. Cuerpo moderadamente alargado y comprimido, Cabeza de dorso notablemente cóncavo de 2,8 a 3.2 en la longitud del cuerpo,boca grande y oblícua, hocico largo terminando en una mandíbula prominentemente protruída de 3.1 a 3.7 en la longitud cefálica, ojos grandes y altos 3,2 a 4.7 en la cabeza; maxilar llegando o pasando ligeramente al margen anterior de la pupila 2.2. a 2.5 en la longitud cefálica; preorbital, preopérculo y supraclavícula fuertemente aserradas, el margen preopercular con 3 o 4 sierras más fuertes en el ángulo y 2 espinas. Altura máxima 3.3 a 4.1 en la longitud patrón. D. VIII1, 10; A. 111-7 con la segunda y tercera espina, delgadas alargadas y generalmente del mismo largo un poco más gruesa la segunda, Branquiespinas largas y delgadas de 13 a 15 sobre la rama inferior del primer arco. Escamas 62 a 67 en una serie longitudinal por sobre la línea lateral. Pectorales pequeñas no llegan claramente al extremo de las pélvicas, 1.5 a 1.9 en la longitud cefálica. Color. Dorso azul grisáceo, flancos plateados, vientre pálido grisáceo. Línea lateral obscura. Aletas obscuras con los márgenes y las membratias interespinosas negras. Distribución. En ambas costas de América. En el Océano Pacífico, desde el Golfo de California hasta Perú. En el Golfo de México, y Caribe, en el Atlántico. En el área de estudio: Lagunas de Chautengo, Tecomate y Potosí. Material examinado 16 ejemplares de 153 a 210 mm de longitud total, Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000.531 Observaciones. Ramírez-Granados (1952) sólo indica la existencia de varias especies del género Centropomus en las lagunas cercanas a Acapulco, sin hacer determinaciones específicas. Por otra parte Berdegué (1954) y 1956) ha señalado que Centropomus pectinatus es el robalo de mayor importancia económica en la costa noroccidental de México, consumiéndose fresco, salado o ahumado. La especie ha sido incluída por Ramírez-Hernández y Páez (1965) en la lista de peces marinos de Guerrero. Según Dahl (1972) en Colombia habita preferentemente en lagunas salobres y puede alcanzar hasta 700 mm de longitud. Sin embargo, en Guerrero penetra sólo excepcionalmente a las lagunas y por lo, tanto su importancia comercial allí es discutible. Sus hábitos alimenticios son exclusivamente carnívoros alimetándose de peces y macroinvertebrados. En la costa del Golfo, Chávez (1963) lo incluye entre los robalos de la costa mexicana del Golfo de México. Familia XIX. Serranidae. Género 28. Diplectrum Holbrook, 1855. 42) Diplectrum pacificum Meek y Hildebrand, 1925. N. v.: "Cabaicucho"(Lám. 18, Fig. 2) Diplectrum pacificum Meek y Hildebrand, Field Mus. Nat. Hist, Publ. Zool. Ser., 15(226):477-478, lám. 46, fig. 2; Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:318, Hildebrand, Bull. U. S. Nat. Mus., 1946, 189:185; Berdegué, Secretaría de Marina, Dir. Gral. Pesc. Ind. Con., 1956: 264-265; Ramírez-Hernández y Páez, An. Inst. Nal. Inv. Biol,-Pesq., 1965, 1:338; Ramírez-Henández y Arvizú, An. Inst. Nal. Inv. Biol.-Pesq,, 1965, 1:306; Chirichigno, Inf, Inst. Mar Perú-Callao, 1974, 44:296 y 333; HoIguin-Quiñones, Inst. Nal. Pese. México, 1975: 67; S. I. C., Catálogo de Peces Marinos Mexicanos, 1976: 81, 85 y 190. Castro, Arvizú y Páez, Revta. Soc. mex. Hist. Nat., 1970, 31:135; Bortone, Pacific Science, 1977, 31(1): 49-60. Diplectrum radiale Gilbert y Starks, Mem. Cal. Ac. Se¡., 1904, 1:97 (no el de Quoy y Gairnard); Fowler, Proc, Ac, Nat. Sci. Phila, 1916, 409. Diagnosis. Cuerpo alargado, comprimido, dorso poco elevado. Cabeza grande, 2.9 a 3.1 en la longitud del cuerpo, boca grande, oblícua y terminal, dientes viliformes en las mandíbulas, vómer y palatinos; hocico corto 3.4 a 4.0 en la longitud cefálica; ojos moderados 4.9 a 4.5 en la cabeza; maxilar llegando o sobrepasando el margen posterior de la pupila, 2.1 a 2.6 en la longitud cefálica. Altura máxima de 3.4 a 4.5 en la longitud patrón. D. X, 11-12; A. III, 7. Entre 60 y 70 escamas en una serie longitudinal por sobre la línea lateral. Branquiespinas rudimentarias 10 a 11 sobre la rama inferior del primer arco. Ángulo inferior del preopérculo muy sobresaliente y provisto de un reborde o manojo, de espinas muy fuertes. Pectorales generalmente largas 1.2 a 1.5 en la longitud cefálica. Color. Dorso cafe rojizo, ligeramente amarillento plateado en los flancos y el vientre. Posee una mancha grande sobre la aleta caudal, mucho más ancha que la banda lateral. Parte superior del cuerpo con bandas horizontales de color obscuro y con pequeñas manchas redondas de color café, Distribución. En el Océano Pacífico, desde California y Golfo de California, hasta Perú. En el área de estudio: Lagunas de Chautengo y Nuxco. Material examinado. 2 ejemplares de 135 a 160 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000.532/.533. Observaciones. El género Diplectrum incluye otras varias especies abundantes en aguas mexicanas (Berdegué, 1954, 1956; S. 1. C., 1976). Berdegué ha señalado además que a esta especie se le denomina vulgarmente "pez ardilla", "guavina" y "extranjeros". Su carne es comestible pero se le consume poco, aun cuando es frecuente y abundante en los lances camaroneros del noroeste de México. Holguín-Quiñones (1976) la incluye entre las especies marinas de importancia comercial en Baja California Sur. Diplectrum pacificum carece de importancia económica y ecológicamente su significación es limitada en la estructura de las comunidades estudiadas. Se le considera como una especie marina visitante excepcional al sistema lagunar costero de Guerrero. Sus hábitos alimenticios son carnívoros, alimentándose de peces y macroinvertebrados. Castro et al. (1970) la incluyen entre la ictio fauna del Golfo de California junto a otra especie del género, i. e., D. eryplectrum Jordan y Bollman y D. macropoma (Günther). Estas dos especies han sido objeto de un completo estudio ecológico en la Bahía de Panamá por su particular abundancia en esa área (Bortone, 1977). Familia XX. Carangidae. Género 29. Caranx Lacépéde, 1802. 43) Caranx hippos (Linnaeus, 1766) N. v.: "Jurel", "Toro"(Lám, 18, Fig. 3) Scomber hippos Linnaeus, Syst. Nat., Ed. 12, 1766: 494. Scomber carangus Bloch, Naturg. Ausl, Fische, 1793, 7:69, lám. 340. Caranx erithrurus Lacépéde, Hist. Nat. Poiss., 1802, 3:68. Caranx daubentonii Lacépède, Hist. Nat. Poiss., 1802, 3:71. Caranx carangua Lacépède, Hist. Nat. Poiss., 1802, 3:59 y 74. Caranx xanthopygus Cuvier y Valenciennes, Hist. Nat. Poiss., 1833, 9:109. Caranx ekala Cuvier y Valenciennes, Hist. Nat. Poiss., 1833, 9:117. Caranx antillarum Bennett, Whaling Voyage, 1840, 2: 282. Caranx defensor De Kay, N. Y. Fauna Fishes, 1912: 120. Carangus esculentus Girard, U. S. y Méx. Bound. Surv. Fishes, 1859, 2:23, lám. 2 y 12, figs. 1-3. Carangus hippos Gill, Proc. Ac. Nat. Sci. Phila., 1862: 434. Caranx caninus Günther, Trans. Zool. Soc. London, 1869, 6:432; Walford, Marine Game Fishes Pacific Alaska-Equator, 1937: 72, lám. 51, fig. A; Berdegué, Secretaría de Marina, Dir. Gral. Pesc. Ind. Con., 1956: 190-192. Caranx hippos (Linnaeus); Jordan y Gilbert, Proc. U. S. Nat. Mus., 1882: 269; Jordan y Evermann, Bull. U. S. Nat. Mus., 1896, 47920, lám. 141 fig. 387; Boulenger, Boll. Mus. Zool. Anat. Torino, 1899, 14(346):3, Gilbert y Starks, Mem. Cal. Ac. Sci., 1904, 4:77; Kendall y Radcliffe, Mem. Mus. Comp. Zool. Harv., 1912, 35:99; Fowler, Proc. Ac. Nat. Sci., Phila., 1916, 401 y 409; Meek y Hildebrand, Field Mus. Nat. Hist. Publ. Zool. Ser., 1925, 15(226):350-351; Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:273; H¡yama et al., Peces Marinos de la Costa Mexicana del Pacífico, 1940: 34, lám. 12; Hildebrand, Bull. U. S. Nat. Mus., 1946, 189:208-209; Ramirez-Hernández y , Arvizú, An. Inst. Nal. Inv. Biol.-Pesq., 1965, 1:307; Ramírez-Hernández y Páez, An. Inst. Nal. Inv. Biol.-Pesq., 1965, 1:338; Massay-Camposano, Tesis profesional Fac. Ciencias Químicas y Naturales Univ. Guayaquil, 1967: 1-115; Álvarez, Com. Nal. Consul. Pec. Inst. Nac. Inv. Biol.-Pesq., 1970, 134; Miller y Lea, Fish. Bull. Calif. Dept. Fish Game, 1972, 157: 148-149 y 213; Amezcua-Linares, Tesis profesional Fac. Ciencias Univ. Nal. Autón. México, 1972: 112-114; Chirichigno, Inf. Inst. Mar Perú-Callao; S. I. C., Catálogo de Peces Marinos Mexicanos, 1976: 41, 89, 92 y 228. Diagnosis. Cuerpo robusto, comprimido y ovalado, perfil antero-dorsal fuertemente convexo. Cabeza corta y alta 2.9 a 3,3 en la longitud patrón; hocico achatado 3.6 a 3.7 en la long¡tud cefálica; ojos 3.5 a 5.0 en la cabeza, boca algo oblicua; maxilar llegando al margen posterior de la órbita 2.2 a 2.4 en la cabeza. Altura máxima 2.3 a 3.0 en la longitud patrón. D. VIII-I, 18-23; A. 11-1, 15-18; P. I, 18-21. Alrededor de 130 escamas en una serie longitudinal. Branquiespinas alargadas comprimidas y dentadas en su borde interior, de 15 a 19 sobre la rama inferior del primer arco (raramente 15). Vértebras 24. Sobre la porción recta de la línea lateral 25 a 42 escudos óseos (generalmente de 30 a 40). Línea lateral con un prominente arco anterior, Pectorales 2,6 a 3.4 en la longitud patrón. La región pectoral no posee escamas excepto un parche o corselete situado por delante de las aletas pélvicas. Color, Dorso gris azulado, vientre amarillo plateado. Cabeza obscura con una mancha azul fuerte en la zona superior del opérculo. Cuerpo con 5-6 barras transversales obscuras predominando en los juveniles. Aletas impares obscuras, las pares blanquecinas, estas últimas con la axila obscura. Distribución. Ambas costas de América tropical. En el Océano Pacífico desde el Golfo de California hasta Perú. En el área de estudio: Lagunas Salinas de Apozahualco, Chautengo, Tecomate, Tres Palos, Coyuca, Nuxco, Salina del Cuajo y Potosí. Material examinado. 104 ejemplares de 69 a 152 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias de Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000.534/.540 (Gro.). Observaciones. Caranx hippos ha sido reportada para Baja California y Guerrero como pez característico marino (Ramírez-Hernández y Arvizú, 1965; Ramírez-Hernández y Páez, 196,5). En la actualidad su importancia económica radica solamente en el consumo local; sin embargo, la abundancia de cardúmenes en el pacífico sugiere su potencial económico (Berdegué, 1954 y 1956). Estudios realizados por Cervigón (1966 y 1967), Carranza (1969 y 1970), Carranza y Amezcua-Linares (1 9 7 1), Amezcua-Linares (1972 y 1977) ; Reséndez (1970 y 1973), Yáñez-Arancibia (1974, 1975b), Yáñez-Arancibia y Nugent (1975) demuestran que esta especie frecuenta las lagunas costeras y ambientes de manglar. Sin embargo, no se encuentran adultos en esas áreas y las utilizan para alimentarse, protegerse y crecer. Sus hábitos alimenticios son carnívoros alimentándose de pequeños peces y macroinvertebrados. En el capítulo de relaciones tróficas y aspectos parciales de dinámica de poblaciones de este trabajo, se estudia a esta especie en forma particular analizando un gran número de ejemplares. Por su distribución y frecuencia Caranx hippos es una de las especies que caracteriza al sistema lagunar de Guerrero, especialmente durante el Periodo 1. Álvarez (1970) señala que es la única especie de Caranx que puede penetrar hasta aguas dulces. 44) Caranx marginatus (Gill, 1863). N. v.: "Jurel", "Ojón"(Lám, 18, Fig. 4) Carangus marginatus Gill, Proc. Ac. Nat. Sci., Phila., 1863, 15:166. Caranx hippos Günther, Trans. Zool. Soc. London, 1869, 6:431. Caranx latus Jordan y Bollmann, Proc. U. S. Nat. Mus., 1889: 180. Xurel marginatus (Gill); Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:272. Caranx marginatus (Gill); Meek y Hildebrand, Field Mus. Nat. Hist. Publ. Zool. Ser., 1925, 15(226):356-357, lám. 26, fig. 2; Ramírez-Hernández y Páez, An. Inst. Nal. Inv. Biol.-Pesq., 1965, 1:338; Massay-Cam posano, Tesis profesional Fac. Ciencias Químicas y Naturales Univ. Guayaquil, 1967: 1-115; S. I. C., Catálogo de Peces Marinos Mexicanos, 1976: 89, 92 y 230. Diagnosis. Cuerpo profundo y comprimido, perfil antero dorsal convexo. Cabeza grande 3.0 a 3.3 en la longitud patrón; hocico achatado 3.2 a 3.9 en la longitud cefálica; ojos 3.1 a 3.6 en la cabeza; boca algo oblícua; maxilar sobrepasando suavemente la línea media de la órbita 2.0 a 2.5 en la longitud cefálica. Altura máxima 2.2 a 2.7 en la longitud patrón. D. VIII-1, 19-20; A. ll-I, 15-17. Branquiespinas alargadas del tipo rudimentos 15 a 18 sobre la rama inferior del primer arco. Sobre la porción recta de la línea lateral 25 a 30 escudos óseos. Línea lateral con un prominente arco anterior. Pectorales pequeñas 2.7 a 4.0 en la longitud patrón. Color. Dorso azulado, flancos plateados; 5-6 barras transversales obscuras cruzadas, predominando en los juveniles. No posee una mancha conspícua opercular. Aletas pálidas excepto la dorsal espinosa y parte anterior de la dorsal radiosa que son obscuras. Distribución. En el Océano Pacífico, desde Mazatlán, México, hasta la Bahía de Panamá y norte de Colombia. En el área de estudio: Lagunas de Chautengo, Salinas de Apozahualco y Potosí. Material examinado. 38 ejemplares de 67 a 150 mm de longitud patrón. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000.541/.549 (Gro.) . Observaciones. Es una especie muy afin con Caranx hippos y con C. latus Agassiz, pero se diferencia fundamentalmente de ésta última por el mayor número de branquiespinas y el menor número de escudos laterales. Ni Caranx latus ni C. marginatus poseen un corselete escamoso por delante de las pélvicas, como en C. hippos. En la costa central y norte del Pacífico mexicano sólo ha sido citada en el trabajo de Ramírez-Hernández y Páez (1965) con el nombre de "ojón". Caranx marginatus es una especie mucho menos frecuente y abundante que C. hippos en el sistema lagunar costero de Guerrero. Sus hábitos alimenticios son carnívoros alimentándose de pequeños peces y macroinvertebrados y penetra a las lagunas buscando alimento y protección. 45) Caranx medusicola Jordan y Starks, 1895. N. v.: "Jurel"(Lám. 19, Fig. 1) Caranx medusicola Jordan y Starks, in Jordan et al. Proc. Cal. Ac. Sci., 1895, 5:430; Jordan y Evermann, Bull. U. S. Nat. Mus., 1896, 17:924, lám. 143, fig. 390; Gilbert y Starks, Mem. Cal. Ac. Sci., 1904, 4:78; Meek y Hildebrand, Field Mus. Nat. Hist. Publ. Zool. Ser., 1925, 15(226):355-356. Xurel medusicola (Jordan y Starks); Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:272. Diagnosis. Cuerpo relativamente profundo y comprimido, perfil antero dorsal convexo. Cabeza con hocico a menudo largo 2.9 a 3.0 en la longitud cefálica; maxilar 2.4 a 2,5 en la cabeza. Branquiespinas 17 a 18 sobre la rama inferior del primer arco. D, VIII-1, 20-22; A. 11-1, 1718. Escudos óseos sobre la porción recta de la línea lateral 36 a 38. Color. Dorso gris azulado pálido, vientre blanquecino, aletas amarillo blanquecinas pálidas. Distribución. En el Océano Pacífico, desde Mazatlán, México, hasta Panamá y norte de Colombia. En el área de estudio: Laguna de Chautengo. Material examinado. 1 ejemplar de 74 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000.550 (Gro.). Observaciones. Caranx medusicola difiere de C. marginatus porque posee un cuerpo más profundo y mas escudos óseos sobre la línea lateral. Difiere de C. latus por el maxilar más corto, 2.4 a 2.5 en la cabeza' y el hocico más largo 2.9 a 3.0 en la cabeza; además posee numerosas branquiespinas sobre la rama inferior del primer arco y con mayor número de rayos dorsales y anales. En el sistema lagunar costero de Guerrero es una especie muy rara, carece allí de importancia económica, su importancia ecológica es discutible, y se le considera un pez marino visitante excepcional. 46) Caranx cf. latus Agassiz, 1831 N. v.: "Jurel"(Lám. 19, Fig. 2) Caranx latus Agassiz, in Spix, Pisc. Brasil, 1831, 905; Jordan y Evermann, Bull. U. S. Nat. Mus., 1896, 47:923, lám. 142, fig. 389; Fowler, Proc. Ac. Nat. Sci. Phila., 1917: 132; Meek y Hildebrand, Field Mus. Nat. Hist. Publ. Zool. Ser., 1925, 15(226):354-355, lám. 26, fig, 1; Cervigón, Los Peces Marinos de Venezuela, Fundación La Salle Ciencias Naturales, 1(11):380-381; Reséndez, Revta. Soc. mex. Hist. Nat., 1973, 31:226; S. I. C., Catálogo de Peces Marinos Mexicanos, 1976: 89, 92 y 229. Caranx lepturus Agassiz, in Spix. Pise. Brasil, 1831: 106. Caranx fallax Cuvier y Valenciénnes, Hist. Nat. Poiss., 1833, 9:95. Caranx richardi Halbrook, lchth. South Carolina, Ed. 2, 1860; 94, lám. 13, fig. 1. Carangus fallax Gill, Proc. Ac. Nat. Sci. Phila., 1862: 433. Caranx aureus Poey, Enumeratio, 1875: 76. Xurel lata (Agassiz); Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:272. Diagnosis. Cuerpo moderadamente alargado, comprimido y con el perfil dorso anterior fuertemente convexo. Cabeza grande 2.9 a 3.2 en la longitud patrón; hocico achatado 3.4 a 3.7 en la longitud cefálica; ojos 3.1 a 3.6 en la cabeza; boca oblícua, mandíbulas desiguales; maxilar llegando o sobrepasando ligeramente el margen posterior de la pupila, 2.0 a 2.2 en la longitud cefálica; dientes en ambas mandíbulas, vómer, palatinos y lengua, los frontales externos son caniniformes. Altura máxima 2.3 a 2.6 en la longitud patrón D. VIII-1, 20-22; A. 11-1. 16-18. Sobre la porción recta de la línea lateral 35 a 38 escudos óseos. Branquiespina a menudo delgada 13 ó 14 sobre la rama inferior del primer arco. Pectorales largas y falcadas en los adultos, proporcionalmente más cortas en los juveniles 2.7 a 4.3 en la longitud del cuerpo. Color. Dorso verdoso obscuro con reflejos plateados, flancos y vientre plateados. Borde opercular con una mancha obscura no tan conspícua. La dorsal blanda con el margen antero superior negruzco. Dorsal espinosa negruzca. Pectorales pálidas. Caudal amarillo verdoso con borde terminal negro. Anal y pélvicas blanquecino pálidas. Distribución. En ambas costas de América tropical. En el Océano Atlántico desde New jersey y Bermudas hasta Río de Janeiro, incluyendo el Golfo de México. En el Pacífico desde México hasta Panamá. En el área de estudio: Lagunas de Chautengo y Potosí. Material examinado. 5 ejemplares de 95 a 183 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000.551/. 553 (Gro.). Observaciones. Caranx latus es una especie muy rara en el Pacífico tropical de América. Todos sus registros anteriores la señalan como una especie frecuente y abundante en la costa Atlántica de América. Meek y Hildebrand (1925), sobre la base de informes de Gilbert y Starks (1904) dudan de la existencia de Caranx latus en el Pacífico, suponiendo que su registro allí se deba a un error de determinación y/o de confusión con C. marginatus o C. medusicola. En estos estudios fueron analizados 5 ejemplares de Caranx cuyos datos merísticos y morfométricos aseguran que se trata de la presencia de Caranx latus en el Pacífico tropical de América. En el sistema lagunar costero de Guerrero corresponde a una especie marina estenohalina que muy excepcionalmente penetra a las lagunas. Sus hábitos alimenticios son carnívoros alimentándose de peces y macroinvertebrados. 47) Caranx caballus Günther, 1869. N. v.: "Jurel", "Caballa", "Cocinero"(Lám. 19, Fig. 3) Thrachurus boops Girard (House of Repr. Ex. Doc. 91) Rept. Expl. and Surv. Miss. R. to Pac. 0, 1858, 10:108, lám. 4 (no Caranx boops Cuvier y Valenciennes). Caranx boops Gill, Proc. Ac. Nat. Sci. Phila., 1862. Caranx girardi Steindachner (Sitzb. k. Ak. Wiss. Wein., 60) Ichth. Notizen., 1869, 9:25. Paratractus caballus (Günther); Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:272. Caranx caballus Günther, Trans. Zool. Soc. London, 1869, 6:431; Gilbert y Starks, Mem. Cal. Ac. Sci., 1904, 4:78; Kendall y Radcliffe, Mem. Mus. Comp. Zool. Harv., 1912, 35:99; Fowler, Proc. Ac. Nat. Sci. Phila., 1916: 409; Meek y Hildebrand, Field Mus. Nat. Hist. Publ. Zool. Ser., 1925, 15(226):359-360, lám. 28; Hiyaina et al., Peces Marinos de la Costa Mexicana del Pacífico, 1940: 35, lám. 13; Hildebrand, Bull. U. S. Nat. Mus., 1946, 189:208211; Massay-Campozano, Tesis profesional Fac. Ciencias Químicas y Naturales Univ. Guayaquil, 1967: 1-115, Ramírez-Hernández y Páez, An. Inst. Nal. Inv. Biol.-Pesq., 1965, 1:338; Amezcua-Linares, Tesis profesional Fac. Ciencias Univ. Nal. Autón. México, 1972: 115-116; Miller y Lea, Fish. Bull. Calif, Dept. Fish. Game, 1972, 157:148-149; Chirichigno, Inf. Inst. Mar Perú-Callao, 1974, 44:224 y 330; S. I. C., Catálogo de Peces Marinos Mexicanos, 1976: 90, 91 y 226. Diagnosis. Cuerpo alargado, fusiforme, no tan comprimido. Cabeza pequeña, más bien baja, 3.4 a 3.7 en la longitud patrón; hocico chato de 3.2 a 3.7 en la longitud cefálica; ojos 3.2 a 4.3 en la cabeza; boca larga ligeramente oblícua, el maxilar no alcanza la parte media del ojo, 2.7 a 2.8 en la longitud cefálica; dientes presentes en ambas mandíbulas, vómer, palatinos y lengua. Altura máxima 3.2 a 3.8 en la longitud patrón. D. VIII-1, 21-24; A. 11-1, 17-21; P. 20. De 38 a 52 escudos óseos sobre la porción recta de la línea lateral. De 25 a 31 branquiespinas sobre la rama inferior del primer arco. Vértebras 25. Pectorales muy largas y falcadas, llegan más allá del origen de la anal, de 2.5 a 2.9 en la longitud patrón, más cortas en los juveniles. Color. Dorso gris metálico, flancos plateados, vientre con tonalidades aniarillas más acentuadas en los juveniles. Una mancha obscura supraopercular presente. Aletas obscuras. Distribución. En el Océano Pacífico, desde California, EE. UU., incluyendo el Golfo de California hasta Perú; e Islas Galápagos. En el área de estudio: Laguna de Chautengo. Material examinado. 6 ejemplares de 151 a 248 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Lininología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.001.401/1.404 (Gro.) . Observaciones. Caranx caballus es una de las especies de Caranx más abundantes en el Pacífico de América y reviste una trascendental importancia comercial en México. La especie ha sido reportada en sistemas lagunares del Pacífico mexicano por Carranza y Amezcua-Linares (1971a y 1971b), Amezcua-Linares (1972) y Yáñez-Arancibia y Nugent (1975). En las lagunas de Guerrero es un visitante excepcional y sólo se le colectó una vez (6 ejemplares) en agosto de 1976. Tolera pocas variaciones de salinidad y eso limita su ocurrencia en los sistemas lagunares. Sus hábitos alimenticios son carnívoros alimentándose de peces y macroinvertebrados. Género 30. Selene Lacépéde, 1802 48) Selene brevoorti (Gill, 1863). N. v.: "Caballito", "Luna", "Jorobado"(Lám. 19, Fig. 4) Argyriosus brevoorti Gill, Proc. Ac. Nat. Sci. Phila., 1863, 15:83; Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:276. Argyreiosus pacificus Lockington, Proc. Cal. Ac. Sci., 1876, 7:84. Argyreiosus vomer Lutken (Dan: Vid. Selsk. Skr. Sta. Ser., 12) Spolia Atlantica, 1880: 137. Selene vomer Jordan y Gilbert, Bull. U. S. Nat. Mus., 1883, 16:439 y Proc. U. S. Nat. Mus., 1882: 625; Gúbert y Starks, Mem. Cal. Ac. Sei., 1904, 4:82 (no el de Linnaeus). Selene brevoorti (Gill), Meek y Hildebrand, Field Mus. Nat. Hist. Publ. Zool. Ser., 1925, 15(226):374-375, lám. 32; Hildebrand, Bull. U. S. Nat. Mus., 1946, 184:224-225; Berdegué, Secretaría de Marina, Dir. Gral. Pese. Ind. Con., 1956: 184; Massay-Campasano, Tesis profesional Fac. Ciencias Químicas y Naturales Univ. Guayaquil, 1967: 1-115; Amezcua-Linares, Tesis profesional Fac. Ciencias Univ. Nal. Autón. México 1972: 123-125, lám. 7, fig. 2, y An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, 1977, 1(1):1-25; Chirichigno, Inf. Inst. Mar Perú-Callao, 1974, 44:225 y 349; S. I. C., Catálogo de Peces Marinos Mexicanos, 1976: 91, 93 y 239. Diagnosis. Cuerpo ovalado, fuertemente comprimido, dorso muy elevado y el perfil antero dorsal asciende en un conspícuo ángulo, cabeza corta y muy alta 2.3 a 2.6 en la longitud patrón; hocico no tan largo 1.7 a 2.0 en la longitud cefálica; ojos pequeños de 4.2 a 5.5 en la cabeza; boca oblícua, moderada, el maxilar no llega al margen anterior del ojo 2.8 a 3.3 en la longitud cefálica; dientes en la mandíbula superior formando una banda delgada, los de la inferior colocados en series; con dientes en el vómer y lengua, estos últimos, viliformes. Altura máxima 1.3 a 1.6 en la longitud patrón. D. VII u VIII-1 21-22; A. 11-1 17-19; P. 18-19. Branquiespinas delgadas y aserradas en su borde interno 28 a 32 sobre la rama inferior del pri mer arco. Primeros rayos de la aleta dorsal muy alargados. Pectorales largas y falcadas 2.3 a 2.6 en la longitud del cuerpo; en los juveniles hasta 3-7. Color. Dorso azul grisáceo pálido, flancos y vientre plateados. Opérculo y mejillas plateadas blanquecinas. Aletas pálidas, excepto el filamento de la dorsal que es obscuro. Distribución. En el Océano Pacífico, desde el Golfo de California, México, hasta Callao, Perú. En el área de estudio: Lagunas Salinas de Apozahualco, Chautengo y Tecomate. Material examinado 19 ejemplares de 65 a 135 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000.554/.558 (Gro.). Observaciones. Selene brevoorti suele ser confundida con S. vomer (Linnaeus) (13 a 16 branquiespinas) de la costa del Atlántico, pero se diferencia fundamentalmente en el elevado número de branquiespinas de S. brevoorti (28 a 32) ; además de su distribución geográfica. Por otra parte S. oerstedi Lutken, una especie simpátrica con S. brevoorti también presenta un menor número de branquiespinas (13 a 16) sobre la rama inferior del primer arco. Asimismo la proporción de la altura corporal es diferente en las tres especies. Berdegué (1954 y 1956) les atribuye cierta importancia comercial, particularmente a S. brevoorli. No obstante, en el sistema lagunar costero de Guerrero no son abundantes ni frecuentes y sólo se les colecta durante el periodo 1 en las lagunas con mayor influencia marina. Normalmente penetran ejemplares adultos para buscar alimento en el interior del estuario. Con anterioridad Carranza y Amezcua-Linares (1971a y 1 971b) y Amezcua -Linares (1972) reportan a la especie S. brevoorti en sistemas lagunares de Nayarit; y Ramírez-Hernández y Páez (1965) y los otros dos autores anteriores indican también a S. oerstedi como especie común en el Pacífico mexicano. Género 31. Oligoplites Gill, 1863 49) Oligoplites mundus Jordan y Starks, 1896. N. v.: "Monda", "Cacana", "Jurel", "Palometa", "Quiebra cuchillos"(Lám. 20, Fig. 1) Oligoplites mundus Jordan y Starks, in Jordan y Everniann, Sept., U. S. Fisco. Coma., 1896, 21:344; Jordan y Starks, in Jordan y Evermann, Bull. U. S. Nat. Mus., 1898, 47:2 y 844; Gilbert y Starks, Manto. Cal. Ac. Sci. 1904, 1:74, lám. 12, fig. 21; Starks, Proc. U S. Nat. Mus., 1906: 784; Meek y Hildebrand, Field Mus. Nat. Hist. Publ, Zool. Ser., 1925, 15(226):389-390, lám. 33, fig. 2; Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:278; Hildebrand, Bull. U. S. Nat. Mus., 1946, 189:222; Berdegué, Secretaría de Marina, Dir. Gral. Pese. Ind. Con., 1956: 194; Ramírez-Hernández y Arvizú, An. Inst. Nal. Inv. Biol.-Pesq., 1965, 1:307; Ramírez-Hernández y Páez, An. Inst. Nal. Inv. Biol.-Pesq., 1965 1:339; Massay-Camposano, Tesis profesional Fac. Ciencias Químicas y Naturales Univ. Guayaquil, 1967, 1-115: Amezcua-Linares, Tesis profesional Fac. Ciencias Univ. Nal. Autón. México, 1972: 118-120; Chirichigno, Inf. Inst. Mar Perú-Callao, 1974, 44:229 y 343; S. 1. C., Catálogo de Peces Marinos Mexicanos, 1976: 90, 93 y 237. Diagnosis. Cuerpo alargado, alto y coprimido. Cabeza con el perfil anterior recto 3.8 a 4.1 en la longitud patrón; boca oblícua; hocico puntiagudo 3.8 a 4.5 en la longitud cefálica; ojos 4.2 a 4.5 en la cabeza; maxilar largo y delgado, llega al margen posterior del ojo, de 1.5 a 1.7 en la longitud cefálica; dientes presentes en el vómer, palatinos y lengua y dispuestos en bandas en ambas mandíbulas. Altura máxima 2.7 a 3.1 en la longitud patrón. D. IV o V, 18-21; A. II-I 18-21. Línea lateral con un arco corto no curvado. Branquiespinas 7 a 9 (generalmente 9) con tres rudimentos, sobre la rama inferior del primer arco. Pectorales cortas 1.5 a 1.8 en la longitud cefálica. Color. Dorso azul grisáceo, flancos más pálidos, vientre amarillento-plateado. Aletas pélvicas y anal amarillentas; pectorales con una mancha obscura en la axila, dorsal y caudal amarillas con tonos obscuros. Distribución. En el Océano Pacífico desde Baja California, México, hasta el Callao, Perú. En el área de estudio: Lagunas de Salinas de Apozahualco, Chautengo, Tecomate, Nuxco y Potosí. Material examinado. 29 ejemplares de 166 a 231 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000.559/.560 (Gro.) . Observaciones. Oligoplites mundus difiere de las otras especies del género por el gran tamaño de su boca; el maxilar que llega, a veces sobrepasa, al margen posterior del ojo; el poco número de branquiespinas; y los numerosos poros sobre la cabeza, en canales que se ramifican debajo de la piel. Algunos ejemplares alcanzan más de 300 mm representando un tamaño comercial importante. Suele venderse fresco en los lugares de captura. En la zona de Mazatlán, recibe varios nombres como "palometas", "perritos" y "pelones", entre otros (Berdegué, 1954 y 1956). El género Oligoplites fue referido por Ramírez-Hernández (1965) como muy abundante en la costa del Pacífico desde Sinaloa hasta Chiapas. Posteriormente O. mundus fue reportada en los trabajos de Ramírez-Hernández y Arvizú (1965) y Ramírez-Hernández y Páez (1965) como netamente marina. Según Carranza (1969, 1970), Carranza y Amezcua-Linares (1971a y 1971b) y Amezcua-Linares (1972) es una especie de hábitos principalmente carnívoros predando sobre Engráulidos y crustáceos, incluyendo camarones. En el sistema lagunar costero de Guerrero es frecuente pero poco abundante en las lagunas que reciben marcada influencia marina durante el periodo 1. Su importancia comercial es eventual y los ejemplares que se colectan son preferentemente juveniles por lo que puede deducirse que la especie utiliza los ambientes estuarinos como áreas naturales de crianza. 50) Oligoplites altus (Günther, 1869). N. v.: "Cacana" "Jurel", "Quiebra cuchillos" "Monda", "Chaqueta de cuero"(Lám. 20, Fig. 2) Chorinemus altus Günther, Trans. Zool. Soc. London, 1869, 6:433. Oligoplites altus (Günther); Jordan y Gilbert, Proc. 11. S. Nat. Mus., 1882: 371; Jordan y Evermann, Bull. U. S. Nat. Mus., 1896, 47:899; Gilbert y Starks, Mem. Cal. Ac. Sci., 1904, 4:72, lám. 2, fig. 20; Hildebrand, Field Mus. Nat. Hist. Publ. Zool. Ser., 1925, 15(226): 388-389, lám. 38, fig. 1; Hiyama et al., Peces Marinos de la Costa Mexicana del Pacífico, 1940: 33, lám. 62, fig. A; Ramírez-Hernández y Páez, An. Inst. Nal. Inv. Biol.-Pesq., 1965, 1:339; Massay-Camposano, Tesis profesional Fac. Ciencias Químicas y Naturales Univ. Guayaquil, 1967: 1-115; Chirichigno, Inf. Inst. Mar Perú-Callao, 1974, 44:229 y 343. Diagnosis. Cuerpo alargado, suave y comprimido. Cabeza corta con el perfil anterior casi recto, 4.2 a 4.3 en la longitud patrón; hocico 4.4 en la longitud cefálica; ojos 3.7 en la cabeza: maxilar llegando apenas al margen posterior de la órbita 1.6 a 1.8 en la longitud cefálica; dientes pequeños y agudos en las mandíbulas, vómer y palatinos. Altura máxima 3.0 a 3.2 en la longitud patrón. D. IV o V-1, 20; A. 11-1, 20. Línea lateral con un arco anterior, a veces formando un amplio ángulo obtuso. Branquiespinas cortas 10 a 11 en la rama inferior del primer arco. Pectorales cortas 1.4 en la longitud cefálica. Color. Dorso azulado; flancos plateados, vientre blanquecino. Aletas verde amarillentas pálidas. Distribución. En el Océano Pacífico, desde Mazatlán, México, hasta el norte del Perú. En el área de estudio: Lagunas de Salinas de Apozahualco, Chautengo y Nuxco. Material examinado. 17 ejemplares de 121 a 173 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000.561/.563 (Gro.) . Observaciones. Oligopliles altus es una especie muy relacionada con O. mundus. Las diferencias más notables son, además de la imbricación más profunda de las escamas de O. mundus, la profundidad corporal y el número de branquiespinas. Hiyama et al. (1940) y Ramírez-Hernández y Páez (1965) citan la especie entre la lista de peces marinos del Pacífico mexicano, más no hay referencias posteriores a O. altus en la costa del Pacífico mexicano. Sin embargo, RamírezHernández (1965) reporta Oligoplites spp como muy abundantes desde Sinaloa a Chiapas. En el sistema lagunar costero de Guerrero esta especie es escasa y poco frecuente y puede colectársele en las lagunas que reciben marcada influncia marina durante el periodo 1. Sus hábitos son carnívoros alimentándose de peces y macroinvertebrados (incluyendo camarones) y utiliza los ambientes estuarinos como áreas naturales de crianza. 51) Oligoplites saurus (Bloch y Schneider, 1801). N. v.: "Zapatero"(Lám. 20, Fig. 3) Scomber saurus Bloch y Schneider, Syst. Ichth., 1801: 321. Centronotus argenteus Lacépède, Hist. Nat. Poiss., 1802, 3:316. Lichia quiebra Quoy y Gaimard, in Freycinet, Voy. Uranie et Physicienne, Zool., 1825: 365. Chorinemus saltans Cuvier y Valenciennes, Hist. Nat. Poiss., 1831, 8:289 y 393. Chorinemus occidentalis Günther, Cat. Fish. Brit. Mus., 1860, 2:475, (no Gasterosteus accidentalis Linnaeus); Boulenger Boll. Mus. Zool. Anat. Torino, 1899, 1-1 (346):3. Oligoplites inornatus Gill, Proc. Ac. Nat. Sci. Phila., 1863: 166. Oligoplites occidentalis Jordan y Gilbert, Bull. U. S. Nat. Mus., 1883, 16:447. Oligoplites saurus (Bloch y Schneider); Gilbert y Starks, Mem. Cal. Ac. Sci., 1904, 1:70; Starks, Leland Stanford Jr. Univ. Publ., Univ. Ser., 1913: 43; Meek y Hildebrand, Field Mus. Nat, Hist. Publ. Zool. Ser., 1925, 16(226):390-392, lám. 39, fig. 1; Jordan, Evermann y Clark, U. S., Bureau of Fisheries, 1930, 2:227; Cervigón, Los Peces Marinos de Venezuela, La Salle, 1966, 1(11):396-400; Massay-Camposano, Tesis profesional Fac. Ciencias Químicas y Naturales Univ. Guayaquil, 1967: 1-115.: Miller y Lea, Fuiste. Bull. Casar. Dept, Fish Garne, 1972, 157:146-147; Amezcua-Linares, Tesis profesional Fac. Ciencias Univ. Nal. Autón. México, 1972: 121-122; Chirichigno, Inf. Inst. Mar Perú-Callao, 1974, 44:226 y 343; S. I. C., Catálogo de Peces Marinos Mexicanos, 1976: 90, 93 y 333. Diagnosis. Cuerpo alargado, delgado, suave y muy comprimido Cabeza grande 4.2 a 4.8 en la longitud patrón; perfil dorsal no angulado; hocico 3.5 a 4.2 en la longitud cefálica; ojos 3.4 a 4.2 en la cabeza; maxilar delgado llegando a la mitad de la órbita 1.7 a 1.9 en la longitud cefálica. Altura máxima 3.3 a 4.0 en la longitud patrón. D. IV ó V-1, 19-21; A. 11-1, 19-21. Línea lateral con un arco anterior formando un ángulo obtuso. Branquiespinas cortas 13 a 14 sobre la rama inferior del primer arco. Vértebras 26. Pectorales cortas 1.5 a 1.9 en la longitud cefálica y 6.8 a 7.2 en la longitud del cuerpo. Color. Dorso azulado aclarándose hacia los flancos, vientre plateado. Aletas amarillas, pectorales con una mancha obscura en la axila. Distribución. En ambas costas de América. En el Océano Atlántico desde el Golfo de Maine hasta Uruguay incluyendo el Golfo de México. En el Océano Pacífico desde California, EE. UU., hasta Perú, incluyendo el Golfo de Cah fornia y las Islas Galápagos. En el área de estudio: Lagunas de Salinas de Apozahualco, Chautengo, Tecomate, Tres Palos, Salinas del Cuajo y Potosí. Material examinado. 212 ejemplares de 76 a 139 mm de longitud patrón. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000.564/.578 (Gro.) Observaciones, Una de las diferencias fundamentales entre Oligoplites saurus y O. altus es el número de poros en la superficie dorsal de la cabeza, notablemente numerosos en O. altus. En el sistema lagunar costero de Guerrero es una de las especies de Oligoplites más abundante representada por grandes cardúmenes de ejemplares-juveniles que penetran masivamente durante el periodo 1 de las lagunas, Es un recurso comercial relativo por el tamaño pequeño de los ejemplares, además que las poblaciones son sexualmente inmaduras. Al igual que las otras especies de Oligoplites, estos "Jureles" desaparecen durante los periodos 2 y 3 de las lagunas, puesto que corresponden a especies marinas estenohalinas. Oligoplites saurus utiliza estas áreas estuarinas como áreas naturales de crianza, alimentándose, protegiéndose y creciendo. Según Cervigón (1966) la del Caribe y Golfo de México sería la subespecie Oligoplites saurus según Chirichigno (1974) la del Pacífico sería la Subespecie Oligoplites saurus inornatus. 52) Oligoplites refulgens Gilbert y Starks, 1904. N. v.: "Volador"(Lám. 20, Fig. 4) Oligoplites refulgens Gilbert y Starks, Mem. Cal. Ac. Sci., 1904, 1:73, lárn. 11, fig. 19; Meek y Hildebrand, Field Mus. Nat. Hist. Publ. Zool. Ser., 1925, 15(226): 392-393, lám. 39, fig. 2; Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:278; Massay-Campo-Tesis profesional Fac. Ciencias Químicas y Naturales Univ. Guayaquil, 1967: 1-115; Amezcua-Linares, Tesis profesional Fac. Ciencias Univ. Nal. Autón. Mé xico, 1972: 122-123, lám. 7, fig. 1; Chirichigno, Inf. Inst. Mar Perú-Callao, 1974, 44:226 y 343; S. I. C., Catá logo de Peces Marinos Mexicanos. 1976: 90, 93 y 238. Diagnosis. Cuerpo muy delgado, suave y comprimido. Cabeza pequeña, sin poros, 3,8 a 4.6 en la longitud patrón; hocico puntiagudo de 3.3 a 4.2 en la longitud cefálica; ojos de 3.4 a 4.6 en la cabeza; maxilar delgado pasa ligeramente el margen anterior de la órbita 2.3 a 2.5 en la cabeza; dientes sobre las mandíbulas vómer, palatinos y lengua. Altura máxima 4.3 a 4.5 en la longitud patrón. D. IV a VI-1, 19-21; A. 11-1, 19-20. Línea lateral con un extenso arco anterior. Branquiespinas numerosas 16 a 20 sobre la rama inferior del primer arco. Pectorales cortas 1.6 a 1.9 en la longitud cefálica y de 7.3 a 7,8 en la longitud del cuerpo. Color. Dorso azul obscuro, vientre plateado. Una mancha obscura en la axila pectoral. Extremo del hocico y las mandíbulas de color negro. Aletas pectorales y pélvicas amarillentas; dorsal y caudal obscuras. Distribución En el Océano Pacífico desde Nayarit, México, hasta Perú. En el área de estudio: Laguna Chautengo. Material examinado. 1 ejemplar de 57 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-P17 0.000.579 (Gro.). Observaciones. Oligoplites refulgens y O. saurus no poseen ni poros ni canales, en la cabeza. O. refulgens posee el maxilar y las aletas pectorales más cortas que en O. saurus y posee, además, mayor número de branquiespinas. Esta especie es rara en el sistema lagunar costero de Guerrero donde sólo fue colectado un ejemplar en la Laguna Chautengo, juvenil en los primeros estadíos de desarrollo. Con anterioridad Amezcua-Linares (1972) y Yáñez-Arancibia y Nugent (1975) la habían reportado en ecosistemas lagunares de Nayarit. Género 32. Trachinotus Lacépède, 1802. 53) Trachinotus rhodopus Gill, 1863. N. v.: "Pámpano", "Pampanillo", "Pampanito".(Lám. 20, Fig. 5) Trachinotus rhodopus Gill, Proc. Ac. Nat. Sci. Phila., 1863, 15:85; Meek y Goss, Proc. Ac. Nat. Sci. Phila., 1884: 125 (en parte; no el de Gill). Trachinotus nasutus Gill Proc. Ac. Nat. Sci. Phila., 1863, 15:85. Trachinotus fasciatus Gill Proc. Ac. Nat. Sci., Phila., 1863, 15:86. Trachinotus glaucoides Günther, Proc. Zool. Soc. London, 1864: 150. Trachinotus rhodopus (Gill), Jordan y Evermann, Bull. S. Nat. Mus,, 1896, 17:941; Gilbert y Starks, Mem. Cal. Ac. Sci., 1904, 4:82; Kendall y Radcliffe, Mem. Mus. Comp. Zool. Harv., 1912, 35:100; Meek y Hildebrand, Field Mus. Nat, Hist, Publ. Zool. Ser., 1925, 15(226):383-384, lám. 37; Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:276; Hiyama et al. Peces Marinos de la Costa Mexicana del Pacífico, 1940: 36, lám. 15; Hildebrand, Bull. U. S. Nat. Mus., 1946, 189:213-214; Berdegué, Secretaría de Marina, Dir. Gral. Pes. Ind. Con., 1956: 195-197; Ramírez-Hernández y Arvizú, An. Inst. Nal. Inv. Biol.-Pesq., 1965, 1:307; Ramírez-Hernández y Páez, An. Inst. Nal. Inv. Biol. Pesq., 1965, 1:339; Massay-Campasano, Tesis profesional Fac. Ciencias Químicas y Naturales Univ. Guayaquil, 1967: 1-115; Miller y Lea, Fish. Bull. Calif. Dept. Fish. Game, 1972, 157:148; Amezcua-Linares, Tesis profesional Fac. Ciencias Univ. Nal. Autón, México, 1972: 116-117; Chirichigno, Inf. Inst. Mar Perú-Callao, 1974, 14:230 y 352; S. I. C., Catálogo de Peces Marinos Mexicanos, 1976: 91, 93 y 246; Amezcua-Linares, An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón, México, 1977, 41-25. Diagnosis. Cuerpo profundo, comprimido, dorso alto. Cabeza moderadamente larga 3,0 a 4.0 en la longitud patrón; hocico chato 3.7 a 4.4 en la longitud cefálica; ojos 3.8 a 4.1 en la cabeza; boca oblicua, el maxilar llega a la mitad del ojo 2.3 a 2.7 en la longitud cefálica, dientes en el vómer, palatinos y lengua, en las mandíbulas viliformes y dispuestos en bandas. Altura máxima 2.3 a 2.6 en la longitud patrón. D. V (-) VI-I, 19-21; A. 11-1, 17-21; P. 17-11). Vértebras 24. Branquiespinas más bien largas y delgadas 13 a 17 sobre la rama inferior del primer arco. Pectorales más cortas que la cabeza 4,6 a 5.0 en la longitud patrón. Color. Dorso pardo con algunos tonos azulados, vientre plateado; flancos con 4 o 5 barras delgadas, transversas obscuras. Prolongaciones de la segunda dorsal y anal muy obscuras; dorsal, pectoral y caudal más o menos obscuras; pélvicas y el resto de la anal pálida. Distribución. En el Océano Pacífico, desde California, incluyendo el Golfo de California, hasta Perú, e Islas Galápagos. En el área de estudio: Lagunas de Chautengo, Tecomate, Nuxco y Potosí. Material examinado. 16 ejemplares de 112 a 238 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000.580/1.419 (Gro.). Observaciones. Berdegué (1954 y 1956) ha señalado que todos los pámpanos son comestibles, teniendo bastante demanda en el país. Se les consume en fresco, secos o ahumados. Frecuentemente son capturados en los lances con chinchorros camaroneros, pero no salen con la abundancia de una explotación particular. Sus hábitos son carnívoros y frecuentan los fondos arenosos del litoral llegando a penetrar en las lagunas costeras que tienen marcada influencia marina. Los juveniles son los más asiduos a realizar estas migraciones. En el sistema lagunar costero Trachinotus rhodopus no ha sido una especie ni abundante ni frecuente. Sin embargo su ocurrencia habitual se debe a algunos juveniles que recurren a estas áreas en busca de alimento (Amezcua-Linares, 1972; Yáñez-Arancibia y Nugent, 1975). En el Pacífico de México Trachinotus rhodopus es una especie simpátrica con T. paloma Jordan y Starks, T. kennedi Steindachner y T. paitensis C. La especie paitensis no presenta barras oscuras transversales y sólo posee como máximo 10 branquiespinas sobre la rama inferior del primer arco. A su vez la especie kennedi sólo posee 17 a 18 radios dorsales y 16 a 20 radios anales y sus aletas dorsal y anal no son tan elevadas. La especie paloma posee 23 a 27 radios dorsales y más de 20 radios anales. Las barras oscuras transversales son típicas de T. rhodopus. Familia XXI. Lutjanidae. Género 33 Lutjanus Bloch, 1790. 54) Lutjanus novemfasciatus Gill, 1862. N. v. "Pargo prieto", "Huachinango"(Lám. 21, Fig. 1) Lutjanus novemfasciatus Gill, Proc. Ac. Nat. Se¡. Phila., 1862, 16:251. Mesoprion pacificus Bocurt, Ann. Sci. Nat. 5ta. ser., 1868, 10:223. Lutjanus prieto Jordan y Gilbert, Proc. U. S. Nat, Mus., 1881, 4:353. Lutjanus pacificus Vaillant y Bocourt, Miss. Sci. Méx..., 1883, 4:123, lám. 3, fig. 2. Neomaenis novemfasciatus (Gill); Jordan y Evermann, Bull. U. S. Nat. Mus., 1898, 47:1252; 1252; Hiyama et al. Peces Marinos de la Costa Mexicana del Pacífico, 1940: 45-46, lám. 27. Lutjanus novemfasciatus o Lutianus novemfasciatus (Gill); Gilbert y Starks, Mem. Cal. Ac. Sci., 1904, 4:102, Meek y Hildebrand, Field Mus. Nat. Hist. Publ. Zool. Ser., 1925, 15(226):497-498; Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:325; Berdegué, Secretaría de Marina, Dir. Gral. Pes, Ind. Con., 1956: 243244; Ramírez-Hernández y Arvizú, An. Inst. Nal. Inv. Biol,Pesq., 1965, 1:308; Ramírez-Hernández y Páez, An. Inst. Nal. Inv. Biol. Pesq., 1965, 1:340; Amezcua-Linares, Tesis profesional Fac, Ciencias Univ. Nal. Autón. México, 1972: 127-128; Chirichigno, lnf. Inst. Mar Perú-Callao, 1974, 41:301 y 340; Holguín-Quiñones, Inst. Nal. Pes., 1976: 79, S. I. C., Catálogo de Peces Marinos Mexicanos, 1976: 95, 96 y 257; Amezcua-Linares, An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, 1977, 4:1-25. Diagnosis. Cuerpo muy alargado, comprimido. Cabeza con el perfil anterior curvo 2.4 a 2.7 en la longitud patrón; hocico prominente 2.9 a 3.4 en la cabeza; ojos 4.0 a 5.0; maxilar alargado y curvo llegando a la parte media de la órbita 2.3 a 2.5 en la longitud cefálica; dientes mandibulares colocados en bandas delgadas, viliformes, maxilar con un solo par de dientes caninos colocados enfrente, mandíbula con 6 a 7 caninos laterales, dientes linguales en una mancha oval mayor y dos más pequeñas, vomerinos arreglados en forma de V invertida sin prolongación hacia atrás en la región media. Altura máxima 2,9 a 3,4 en la longitud patrón. D X, 14; A III, 8 escamas en una serie longitudinal bajo la línea lateral 46 a 49. Branquiespinas 7 a 8 en la ram a inferior del primer arco. Pectorales puntiagu das en los adultos 1.3 a 1.5 en la cabeza y 3.3 a 3.8 en la longitud del cuerpo. Color. Dorso pardo obscuro, flancos claros, vientre pálido; sin líneas longitudinales ni puntuaciones. Aletas impares oscuras, la pares pálidas; la base de las pectorales oscuras. Distribución. En el Océano Pacífico desde el Sur de California, hasta Perú; incluyendo a las Islas Galápagos. En el área de estudio: Lagunas Salinas de Apozahualco, Chautengo, Tecomate, Nuxco, Salinas del Cuajo y Potosí. Material examinado. 73 ejemplares de 64 a 256 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000.581/.588 (Gro.) Observaciones. Es una de las especies importantes del género Lutjanus denominándose en inuchas ocasiones "pargo negro," "pargo more no". Se diferencia fundamen talmente de L. argentiventris (Peters) por la menor profundidad corporal, el menor número de branquiespinas, y el menor número de escamas en una serie longitudinal. Berdegué (1954 y 1956) hace notar la abundancia de Lutjanus novemfasciatus en la costa noroccidental del Pacífico mexicano; a su vez Ramírez-Hernández (1965) cita a Lutjanus spp. entre Baja California y Chiapas en el Pacífico Ramírez-Hernández y Arvizú (1965) y RamírezHernández y Páez (1965) citan a L. novemfasciatus como pez netamente marino de la costa noroccidental mexicana y del estado de Guerrero, respectivamente. Posteriormente a estos estudios Carranza y Amezcua-Linares (1971), y Amezcua-Linares (1972), lo registran como "pargo rojo”, que al parecer es una de las denominaciones que le dan en la costa noroeste de México. Por su tamaño y consistencia es una especie comestible de gran importancia económica, constituyendo un buen alimento que se distribuye en muchos mercados con el nombre de "huachinango". En el sistema lagunar estudiado fue una especie frecuente, pero no abundante. Se le captura especialmente en las lagunas que presentan un cielo periódico de entrada de agua de mar. Es una especie marina que utiliza las lagunas como áreas naturales de crianza y también el estado adulto para alimentarse. Sus hábitos son carnívoros alimentándose de peces y microinvertebrados. En el capítulo de relaciones tróficas y aspectos parciales de dinámica de poblaciones de este trabajo se estudia esta especie en forma particular. 55) Lutjanus argentiventris (Peters, 1869). N. v. "Huachinango", "Pargo amarillo"(Lám. 21, Fig, 2) Mesoprion argentiventris Peters, Monatsb. K. Ak. Wiss. Berlin, 1869: 704; Boulenger, Bull. Mus. Zool. Anat. Torino, 1899, 14(346):2. Neomaenis argentiventris (Peters); Jordan y Evermann, Bull. U. S. Nat. Mus., 1898, 47:1260; Hiyama et al., Peces Marinos de la Costa Mexicana del Pacífico, 1940: 44, lám. 25. Lutjanus argentiventris ó Lutianus argentiventris (Peters); Jordan y Swain, Proc. U. S. Nat. Mus., 1884: 434; Gilbert y Starks, Mem. Cal. Ac. Sci., 1904, 4:102; Starks, Proc, U. S. Nat. Mus., 1906, 30:788; Kendall y Radcliffe, Mem. Mus, Comp. Zool. Harv., 1912, 35: 112; Meek y Hildebrand, Field Mus. Nat. Hist. Publ. Zool. Ser., 1925, 15(226):513-514; Jordan, Evermann y Clark, U.S. Bureau of Fisheries, 1930, 2:326; Hildebrand, Bull. U. S. Nat. Mus., 1946, 189.230-231; Berdegué, Sría. de Marina, Dir. Gral. Pes. Ind. Con., 1956, 244-245; Ramírez-Hernández y Arvizú, An. Inst. Nal. Inv. Biol.-Pesq., 1965, 1:308; Ramírez-Hernández y Páez, An. Inst. Nal. Inv, Biol.-Pesq., 1965, 1:340; Castro, Arvizú y Páez, Revta. Soc. mex. Hist. Nat., 1970, 31:137; Amezcua-Linares, Tesis profesional Fac. Ciencias Univ, Nal, Autón, México, 1972: 129130; Chirichigno, Inf. Inst. Mar Perú-Callao, 1974, 44:302 y 340; Holguín-Quiñones, Inst. Nal. Pes., 1976: 77; S. I. C., Catálogo de Peces Marinos Mexicanos, 1976: 95, 96 y 335; Amezcua-Linares, An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, 1977, 4:1-25. Diagnosis. Cuerpo alargado, fuertemente comprimido. Cabeza larga 2.5 a 2.8 en la longitud patrón, con el perfil anterior ligeramente cóncavo; hocico prominente 2.5 a 3.2 en la cabeza, ojos 3.54.5; maxilar corto apenas llega al margen anterior de la pupila 2.4 a 2.8 en la longitud cefálica y con 1 a 2 pares de caninos; dientes de la mandíbula inferior alargados, pero no tan grandes como los caninos, vomerinos en forma de ancla o flecha con una notable prolongación hacia atrás en la parte media, palatinos y linguales colocados en bandas. Altura máxima 2,5 a 2.7 en la longitud patrón D. X, 14; A. III, S. Escamas en una serie longitudinal 38 a 45 por debajo de la línea lateral. Branquiespinas 8 a 9 en la rama inferior del primer arco. Pectorales escamadas en la base, más largas que las ventrales 3.4 a 3.5 en la longitud del cuerpo y 1.2 a 1.4 en la cabeza. Color. Dorso ligeramente oscuro con tonalidades pardas, flancos aclarados, vientre pálido. Una banda azul debajo de cada ojo, características de la especie. Aletas impares ligeramente oscuras, las pares amarillentas. Distribución. En el Océano Pacífico, desde Baja California hasta Perú, incluyendo las Islas Galápagos, en el área de estudio: Lagunas Salinas de Apozahualco, Chautengo, Tecomate, Nuxco y Potosí. Material examinado. 37 ejemplares de 84 a 158 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Lininología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000.589/.590 (Gro.). Observaciones. La familia tiene gran importancia económica especialmente por el gran valor comercial de las especies del género Lutjanus, de gran demanda en el mercado por el aspecto y calidad de su carne. Se les captura con el nombre de "huachinangos" en la mayoría de los puertos del Pacífico mexicano, pero también se les conoce con el nombre de "pargos". Berdegué (1954) indica que L. argentiventris es uno, de los Lutjanus que más se captura en la región noroccidental. Ramírez-Hernández y Arvizú (1965) y Ramírez-Hernández y Páez (1965), también la señalan como una de las especies importantes de la familia. De los estudios de Carranza y Amezcua-Linares (1971), y Amezcua-Linares (1972) se desprende que L. argentiventris está muy relacionado con L. guttatus y L. novemfasciatus, diferenciándose, sin embargo, a simple vista de éstos por la banda azul bajo los ojos. Se ha indicado que las especies del género habitan áreas situadas sobre fondos rocosos y que no frecuentan las lagunas costeras a excepción de L. griseus o "pargo mulato" (Ramírez-Hernández, 1965). Sin embargo tal aseveración es discutible puesto que la fam llia con las 3 especies estudiadas en este trabajo, (i.e., L. novemfasciatus, L. argentiventris y L. guttatus) es una de las importantes en el sistema lagunar estudiado. Todas estas especies no son abundantes pero sí frecuentes. Castro et al. (1970) también ha señalado que L. argentiventris penetra a los estuarios al estado juvenil. Ramírez-Hernández (1965) señala a Lutjanus spp. como muy abundantes en ambas costas de México y, en particular, en el Pacífico entre Baja California y Chiapas, indicando además que estas especies son de hábitos carnívoros depredando preferentemente sobre peces, crustáceos y moluscos. L. argentiventris y L. novemfasciatus son dos especies características y de gran importancia económica en Salinas de Apozahualco, Chautengo, Nuxco, y Potosí, lagunas que presentan un ciclo periódico de entrada de agua de mar. En el capítulo de relaciones tróficas y aspectos parciales de dinámica de poblaciones de este trabajo se estudia esta especie en forma particular. 56) Lutjanus guttatus (Steindachner) 1869. N. v. "Pargo flamenco", "Pargo lunarejo"(Lám, 21, Fig. 3) Mesoprion guttatus Steindachner (Sitzb. k. Ak. Wiss. Wien, 60) Ichth. Notizen, 1869, 9:18, lám. 8; Boulenger, Boll. Mus. Zool, Anat. Torino, 1899, 14(335);2. Neomaenis guttatus. Jordan y Evermann, Bull. U. S. Nat. Mus., 1898, 47:1269; Hiyama et al., Peces Marinos de la Costa Mexicana del Pacífico, 1940: 44, láms. 26 y 71 fig. A. Lutjanus guttatus o Lutianus guttatus (Steindachner); Jordan y Gilbert, Proc, U. S. Nat. Mus., 1881: 354; Gilbert y Starks, Mem. Cal. Ac. Sci., 1904, 4:103; Ken dall y Radcliffe, Mern. Mus. Comp. Zool. Harv., 1912, 35:112; Meek y Hildebrand, Field Mus. Nat. Hist. Publ. Zool. Ser., 1925, 15(226):503-504; Jordan, Evermann y Clark, U. S. Bureau of Fisheries 1930, 2:326; Berdegué, Secretaría de Marina, Dir. Gral. Pes. Ind. Con., 1956: 241-242, fig. 169; Ramírez-Hernández y Arvizú, An. Inst. Nal. Inv. Biol.-Pesq., 1965, 1:308; Ramírez-Hernández y Páez, An. Inst, Nal. Inv. Biol-Pesq., 1965, 1:340; Castro, Arvizú y Páez, Revta. Soc. mex. Hist. Nat., 1970, 31:137; Chirichigno, Inf. Inst. Mar Perú-Callao, 1974, 41:302 y 340; Holguín-Quiñones, Inst. Nal. Pes., 1976: 78, S. I. C., Catálogo de Peces Marinos, Mexicanos, 1976: 95, 96 y 255. Diagnosis. Cuerpo alargado y comprimido con la región dorsal moderadamente alargada. Cabeza moderada 2.6 a 3.0 en la longitud patrón, hocico puntiagudo 2.5 a 3.6 en la longitud cefálica ; ojos 3.2 a 5.0 en la cabeza; boca grande casi horizontal, la mandíbula inferior ligeramente proyectada, el maxilar llegando o pasando ligeramente el margen anterior de la pupila; dientes en bandas viliformes en ambas mandíbulas reduciéndose a una sola serie hacia atrás en la niandíbula inferior, 4 caninos en la parte anterior de la mandíbula superior, los dientes de la lengua y palatinos muy pequeños, los vomerinos sobre un parche relativaniente ancho y con una prolongación media muy corta hacia atrás, Altura máxima 2.3 a 3.0 en la longitud patrón D X-XI, 12-13; A. 111, 8. De 47 a 54 escamas en una serie longitudinal por sobre la línea lateral, Branquiespinas numerosas de 10 a 11 sobre la rama inferior del primer arco. Pectorales puntiagudos (le 1. 1 a 1.4 en la longitud cefálica. Color. Dorso verdoso, flancos plateados rojizos, vientre pálido amarillento. Un gran lunar presente ligeramente sobre la línea lateral y bajo la base de la porción anterior de la dorsal blanda. Hileras de escamas sobre la línea lateral con manchas amarillo verdoso. Aletas dorsal y caudal rojizas, anal y pélvicas doradas, pectorales pálidas. Distribución. En el Océano Pacífico, desde el Golfo de California, México, hasta Perú. En el área de estudio: Lagunas de Chautengo, Tres Palos y Potosí. Material examinado. 9 ejemplares de 138 a 212 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000.591/.598 (Gro.) Observaciones. Lutjanus guttatus recibe otros nombres vulgares en las costa del Pacífico, i. e., "pargo lunarejo" en Guaymas y "pargo chivato" en Mazatlán (Berdegué, 1954 y 1956; Lindner, 1947). En el noroeste de México pueden capturarse ejemplares de hasta 50 cm de longitud y reviste gran importancia comercial. La especie se diferencia a simple vista de los otros Lutjanus por la conspícua mancha, del tamaño del ojo, que se ubica entre la línea lateral y la base de la dorsal blanda, y las escamas debajo de la línea lateral con una serie de manchas amarillas formando hileras. En el sistema lagunar costero de Guerrero, no fue ni abundante ni frecuente y su importancia comercial allí es discutible. Se le considera un visitante más bien excepcional en esos ecosistemas. La especie llega hasta Perú (Morrow, 1957; Chirichigno, 1974) y es particularmente abundante en el Sur del Golfo de California (Castro et al., 1970). Familia XXII. Gerridae (Gerreidae, Liognathidae). Género 34. Diapterus Ranzani, 1840. 57) Diapterus peruvianus (Cuvier y Valencienties, 1830). N. v.: "Malacapa", "Mojarra china", "Mojarra de aletas amarillas", "Mojarra peineta"(Lám. 21, Fig. 4) Gerres peruvianus Cuvier y Valenciennes, Hist. Nat. Poiss., 18.30, 4:351(467); Evermann y Meek, Proc. Ac. Nat. Sci., Phila., 1886: 266; Jordan y Evermann, Bull. U. S. Nat. Mas., 1898, 47:1376; Gilbert y Starks, Mem. Cal. Ac. Sci., 1940, 4:115; Starks, Proc. U. S, Nat. Mus., 1906: 792; Kendall y Radcliffe, Mem. Mus. Comp. Zool. Harv., 1912, 35:118, Fowler, Proc. Ac. Nat. Sci. Phila., 1916: 410; Evermann y Radcliffe, Bull. U. S. Nat. Mus., 1917, 95:92; Hiyama et al., Peces Marinos de la Costa Mexicana del Pacífico, 1940:50, lám. 34; Álvarez y Cortés, An. Esc. nal. Cienc. biol. Méx., 1962, 11(14):98 y 132; Álvarez., Coni. Nac, Consul. Pes. Inst. Nal. Inv. Biol.-Pesq, 1970: 135. Gerres brevirostus Sauvage, Bull. Soc. Philom. Paris, 7 Ser., 1879, 3:208. Diapterus peruvianus (Cuvier y Valenciennes); Meek y Hildebrand, Field Mus. Nat. Hist. Publ. Zool. Ser., 1925, 15(226):597-598; Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:342; Tortonese Boll. Mus. Zool. Anat. Comp. Univ. Torino, 1939 b, 47 ser. 3(100):340; Hildebrand, Bull, U. S. Nat. Mus., 1946, 189:240; Ramírez-Hernández y Arvizú, An. Inst. Nal. Inv. Biol. Pesq., 1961, 1:308, Ramírez-Hernández y Páez, An. Inst. Nal. Inv. Biol. Pesq., 1965, 1:340; Castro, Arvizú y Páez, Revta. Soc. mex. Hist. Nat., 1970, 31:141; Amezcua-Linares, Tesis profesional Fac. Ciencias Univ. Nal. Autón. México, 1972: 134-1,35, lám. 8, fig. 3; Chirichigno, Inf. Inst. Mar Perú-Callao, 1974, 41:279 y 333; Holguín-Quiñones, Inst. Nal. Pes., 1976. 82; S. I. C., Catálogo de Peces Marinos Mexicanos, 1976: 45, 97, 98 y 271; Amezcua-Linares, An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, 1977, 4:1-25. Diagnosis. Cuerpo corto, comprimido y profundo. Cabeza 2.9 a 3.3 en la longitud patrón, perfil anterior empinado; hocico corto y puntiagudo 3.4 a 3.9 en la longitud cefálica; ojos 2.5 a 3.5 en la cabeza; preopérculo aserrado; maxilar alcanzando hasta la mitad de la órbita, 2.7 a 3.3 en la longitud cefálica. Altura máxima 1.9 a 2.2 en la longitud patrón. D IX, 9-10; A 111, 8, P. 15-16. Escamas en una serie longitudinal 35 a 40, por arriba de la línea lateral. Branquiespinas cortas 12 a 14 en la rarna inferior del primer arco, Pectorales largas y lanceoladas llegando al origen de la anal; 1.0 a 1.2 en la longitud cefálica. Caudal fuertemente furcada. Color. Dorso pardo claro; puntuaciones oscuras en los flancos de los adultos. Todas las aletas excepto las pectorales presenta puntuaciones oscuras; ventrales amarillas con puntuaciones. Hocico oscuro. Los ejemplares frescos son fuertemente plateados. Distribución. En el Océano Pacífico, de Sonora Golfo de California, México, hasta Perú. En el área de estudio: Lagunas Salinas de Apozahualco, Chautengo, Tecomate, Tres Palos, Coyuca, Mitla, Nuxco, Salinas del Cuajo y Potosí. Material examinado 1831 ejemplares de 20 a 128 mm de longitud patrón. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000.599/.658. Observaciones. Las especies de Diapterus son consideradas propiamente marinas, sin embargo, ascienden comúnmente hacia aguas salobres. D. peruvianus es una de las más importantes en el sistema lagunar costero estudiado (ver Tabla 3 a 47) teniendo gran importancia económica tanto por su abundancia como por la calidad de su carne. Por lo general las "mojarras" son comunes y abundantes en el Pacífico y Atlántico; la separación de los géneros y especies es difícil, siendo caracteres importantes la profundidad corporal, longitud y forma de las espinas anales, número de escamas y branquiespinas, etcétera. Berdegué (1954 y 1956) cita a la especie Gerres Peruvianus (Cuvier y Valenciennes) pero tal denominación está descartada de la literatura y presumiblemente su cita corresponde a Diapterus peruvianus aquí tratada. Ramírez-Hernández (1965) registra a D. peruvianus para el pacífico mexicano como una de las "mojarras" importantes dentro de la familia. Ramírez-Hernández y Arvizú (1965) y Ramírez-Hernández y Páez (1965) también incluyen a esta especie entre los peces marinos de la costa del noroeste y centro del Pacífico mexicano. Todos estos autores consideran a D. peruvianus dentro de la familia Liognathidae, sin embargo, Carranza (1969), Carranza y Amezcua-Linares (1971) y Amezcua-Linares (1972) citan a D. peruvianus en la familia Gerridae siguiendo el criterio de Greenwood et al. (1966) . Castro et al. (1970) también señala que la especie penetra aguas continentales. De estos estudios se desprende que D. peruvianus es una de las especies más importantes en las lagunas estudiadas y caracteriza el sistema lagunar del punto de vista ictiológico. Se puede agregar que son de hábitos preferentemente carnívoros predando sobre pequeños peces, anélidos, crustáceos y moluscos y eventualmente vegetales y detritus. En el capítulo de relaciones tróficas y aspectos parciales de dinámica de población de este trabajo se estudia esta especie en forma particular. En el sistema lagunar costero de Guerrero es una especie de gran importancia comercial por su presencia masiva en las lagunas durante el peiodo 1. No obstante los carclúmenes que penetran a los estuarios son de ejemplares sexualmente inniaduros y debe llamarse la atención sobre ésto por cuanto Diapterus peruvianus es una especie marina que utiliza las lagunas y estuarios como áreas naturales de crianza. Género 35. Gerres Cuvier, 1839. 58) Gerres cinereus (Walbaum, 1792). N. v. "Mojarra blanca", "Mojarra", "Mojarra plateada"(Lám. 22, Fig. 1) Turdus cinereus peltatus Catesby, Nat. Hist. Carolinas, 1743, 2:11. Mugil cinereus Walbaum, Artedi Pisc., 1792: 228 (basándose en Catesby). Gerres aprion Cuvier, Regne Animal, Ed. 2, 1829, 2:188 (basándose en Catesby). Gerres zebra Muller y Troschel, in Schomburgk, Hist. Barbados, 1848: 668. Gerres squamipinnis Günther, Cat. Fish. Brit. Mus., 1859, 1:349 y Trans. Zool. Soc. London, 1869, 6:391. Xystaema simillimum Evermann y Radcliffe, Bull. U. S. Nat. Mus., 1917,95:91. Gerres cinereus (Walbaum); Jordan, Proc. U. S. Nat. Mus., 1885: 384; Meek y Hildebrand, Field. Mus. Nat. Hist. Publ. Zool, Ser., 1925, 15(226):589-590; Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:341-342; Hildebrand, Bull. U. S. Nat. Mus., 1946, 1,99:238-240; Berdegué, Secretaría de Marina, Dir. Gral. Pes. Ind. Con., 1956: 261-262, fig. 181; Ramírez-Hernández y Arvizú, An. Inst. Nal. Inv. Biol.-Pesq., 1965, 1:308; Ramírez-Hernández y Páez, An. Inst. Nal. Inv. Biol. Pesq., 1965, 1:340; Amezcua-Linares, Tesis profesional Fac. Ciencias Univ. Nal. Autón. México, 1972: 131132, lám. 8, fig. 1; Chirichigno, Inf. Inst. Mar Perú-Callao, 1974, 41:278 y 336; Holguín-Quiñones, Inst. Nal. Pes., 1976: 81; S. I. C., Catálogo de Peces Marinos Mexicanos, 1976: 98 y 269; Amezcua-Linares, An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, 1977, 4;1-25. Diagnosis. Cuerpo alargado, dorso moderadamente elevado. Cabeza 2.8 a 3.1 en la longitud patrón, perfil anterior con una ligera curva; hocico puntiagudo 2.7 a 3.3 en la cabeza, ojos 2.7 a 3.8; maxilar llegando al margen anterior de la órbita, preopérculo liso. Altura máxima 2.3 a 2.7 en la longitud patrón. D IX, 10; A 111, P. 15; de 39 a 45 escamas en una serie longitudinal por arrib a de la línea lateral. Branquiespinas cortas, 7 a 8 sobre la rama inferior del primer arco. Pectorales más largas que la cabeza llegando al origen de la aleta anal, 2.7 a 3.0 en la longitud del cuerpo. Color. Dorso pardo grisáceo plateado; flancos más o menos con 7 u 8 barras delgadas e irregulares ligeramente azuladas; vientre pálido. Aletas con puntuaciones oscuras, pectorales pálidas. Distribución. Ambas costas de América, De Florida a Sudamérica en el Atlántico y de Baja California, México, hasta Perú en el Pacífico, incluyendo las Islas Galápagos. En el área de estudio. Lagunas Salinas de Apozahualco, Chautengo, Tecomate, Tres Palos, Coyuca, Mitla, Nuxco, Salinas del Cuajo y Potosí. Material examinado 267 ejemplares de 46 a 237 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000.659/.665 (Gro.) Observaciones. Según Meek y Hildebrand (1925) Gerres cinereus se encuentra mejor representada en el Atlántico que en el Pacífico. Sin embargo, ha sido estudiada como especie importante en el Pacífico mexicano por Berdegué (1954 y 1956), Ramírez-Hernández (1965), RamírezHernández y Arvizú (1965), Ramírez-Hernández y Páez (1965), Carranza (1970), Carranza y Amezcua-Linares (1971), Amezcua-Linares (1972 y 1977), Yáñez-Arancibia y Nugent (1975 y 1976) y Yáñez-Arancibia (1975 b) . Por el contrario ni Darnell (1962), ni Reséndez (1970 y 1973) la señalan entre los peces de algunas lagunas costeras mexicanas de la costa del Golfo de México. En estos estudios G. cinereus corresponde a una de las especies más representativas del sistema lagunar de Guerrero y por su frecuencia y abundancia caracteriza al sistema lagunar del punto de vista ictiológico. Su importancia económica es muy grande y es uno de los principales recursos pesqueros de las lagunas. La especie por lo general no alcanza grandes tallas pero su carne es excelente. Sus hábitos biológicos la han hecho especialmente adaptable al sistema lagunar estudiado. Sin embargo la explotación del recurso se efectúa sobre poblaciones sexualmente inmaduras por cuanto Gerres cinereus utiliza las lagunas y estuarios como áreas naturales de crianza. Sus hábitos alimenticios son de consumidor primario del tipo omnívoro. En el capítulo de relaciones tróficas y aspectos parciales de dinámica de poblaciones de este trabajo, se estudia esta especie en forma particular. Género 36. Eugerres Jordan y Evermann, 1927. 59) Eugerres lineatus (Humboldt y Valenciennes, 1821). N. v.: "Mojarra rayada", "Mojarra china"(Lám. 22, Fig. 2) Smaris lineatus Humboldt y Valenciennes, in Humboldt y Bonpland, Rec. Observ., Zool., 1821, 2:185, lám. 46. Gerres lineatus; Evermann y Meek, Proc. Ac. Nat. Sci. Phila., 1886: 269; Jordan y Evermann, Bull. U. S, Nat. Mus., 1898, 47:1377. Diapterus lineatus, Meek y Hildebrand, Field Mus. Nat. Hist. Publ. Zool. Ser., 1925, 15(226):602; Álvarez, Com. Nac. Consul. Pes. Inst.. Nac. Inv. Biol. Pesq., 1970: 136. Eugerres lineatus (Humboldt y Valenciennes); Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:342; Ramírez-Hernández y PáC7, An, Inst, Nal. Inv. Biol.-Pesq., 1965, 1:341. Diagnosis. Cuerpo moderadamente comprimido. Cabeza 3,2 a 3.3 en la longitud patrón; hocico puntiagudo tan largo como la órbita, 3.2 a 3,3 en la longitud cefálica, ojos 3.3 en la cabeza; preorbital finamente aserrado; proceso premaxilar amplio extendiéndose poco más atrás de la mitad de la órbita. Altura máxima 2.2 a 2.3 en la longitud patrón. D. IX, 10; A 111, 8. Branquiespinas pequeñas, 11 sobre la rama inferior del primer arco. Escamas grandes de 36 a 40, en una lírica longitudinal por sobre la línea lateral. Pectorales poco más largas que la cabeza, 3.3 en la longitud patrón y alcanzando hasta la primera espina anal. Color. Ligeramente oscuro a lo largo de cada serie de escamas; flancos ligeramente plateados, vientre pálido. Aletas ventrales oscuras, pectorales pálidas. Distribución En el Océano Pacífico, desde Mazatlán, México, hasta Colombia. En el área de estudio- Laguna de Salinas de Apozahualco, Chautengo, Tecomate, Tres Palos, Coyuca, Mítla, Nuxco, Salinas del Cuajo y Potosí. Material examinado 337 ejemplares de 99 a 154 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000.666/.675 (Gro.) . Observaciones. Eugerres lineatus es un pez comestible de importancia comercial en las lagunas Salinas de Apozahualco, Chautengo, Tecomate y Nuxco, principalmente, aún cuando se le colecta en todas. La información de los pescadores locales indica que se pesca con frecuencia en el periodo de abertura de las barras. En las costas de Guerrero se le domina "mojarra china" y "mojarra rayada", nombres que también han sido citados para E. axillaris (Günther) por Ramírez-Hernández y Páez y por Amezcua-Linares (1972) . Seguramente la similitud de las especies permite que los pescadores generalicen los nombres vulgares creando confusiones y más aún denominando "mojarras" a casi todas las especies de la familia Gerridae. Por lo general los hombres se aplican tanto a las especies de Diapterus como Gerres, Eugerres e incluso, Eucinostomus. Eugerres lineatus ha sido citada para el Pacífico mexicano por Ramírez-Hernández (1965) especialmente en las lagunas de Coyuca y Tres Palos, y posteriormente por RamírezHernández y Páez (1965) dando una distribución que se extiende desde Acapulco, hasta Colombia. Por su distribución y frecuencia Eugerres lineatus es una especie que caracteriza al sístema lagunar costero de Guerrero, Durante el periodo 1 de las lagunas penetran cardúmenes de juveniles, masivamente desde el mar, para utilizar estas áreas como localidades naturales de crianza. Castro et al. (1970) destaca la observación de que el género Eugerres fue propuesto por Jordan y Everinann (1927) para incluir las especies con el preopérculo fuertemente aserrado y con espinas dorsales y anales muy fuertes. En el capítulo de relaciones tróficas y aspectos generales (le dinámica de poblaciones de este trabajo se estudia esta especie en forma particular, Sus hábitos alimenticios la ubican como consumidor primario del tipo omnívoro. 60) Eugerres axillaris (Günther, 1864). N. v.. "Mojarra china", "Mojarra rayada"(Lám. 22, Fig. 3) Gerres axillaris Günther, Proc. Zool. Soc. London, 1864: 152. Diapterus axillaris, Meek y Hildebrand, Field Mus. Nat. Hist. Publ. Zool. Ser., 1925, 15(226):599-600. Eugerres axillaris (Günther); Jordan y Evermann, Proc. Cal. Ac. Sci., 1927, 16(15):506; Ramírez-Hernández y Páez, An. Inst. Nal. Inv. Biol.-Pesq., 1965, 1:340; Castro, Arvizú y Páez, Revta. Soc. mex, Hist. Nat., 1970, 31:140; Amezcua-Linares, Tesis profesional Fac. Ciencias, Univ- Nal. Autón México, 1972: 132133, lám. 8, fig. 2, y An, Centro Cienc, del Mar y Lininol. Univ. Nal. Autón. México, 1977, 4:1-25, S. I. C., Catálogo de Peces Marinos Mexicanos, 1976: 98, 99 y 274. Diagnosis. Cuerpo corto y comprimido dorso muy elevado, Cabeza 2.9 a 3.2 en la longitud patrón; hocico 3.4 a 3.7 en la longitud cefálica; ojos 3.3 a 3.9 en la cabeza; preorbital y preopérculo finalmente aserrados. Altura máxima 2.1 a 2.4 en la longitud patrón. D IX, 10; A III, S. Escamas grandes 34 a 36 en una serie longitudinal por sobre la. línea lateral, Branquiespinas cortas y gruesas, 14 a 1,5 sobre la rama inferior del primer arco. Pectorales más largas que la cabeza, 2.7 a 3.0 en la longitud patrón. Color. Dorso ligeramente oscuro, flancos plateados, vientre pálido. Listas de color pardo oscuro a lo largo de la serie de escamas; vientre sin listas. Aletas impares oscuras, pectorales pálidas. Distribución. En el Pacífico mexicano desde Sonora, Baja California, hasta Chiapas; suele alcanzar hasta Panamá. En el área de estudio: Lagunas de Chautengo, Tres Palos y Nuxco. Material examinado 7 ejemplares de 89 a 115 mm de longitud patrón. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000.676/.679 (Gro.). Observaciones. En las lagunas de Guerrero se denomina "mojarra rayada" o "mojarra china" a Eugerres lineatus y a Eugerres axillaris, explicable por la similitud entre ambas especies. Sin embargo, pueden diferenciarse fácilmente por el mayor tamaño de la cabeza y de las pectorales en F. axilaris; además, esta especie prescrita una coloración dorsal poco más clara y las membranas interespinosas de la dorsal no tan pigmentadas de negro como en E. lineatus. El número de branquiespinas es otro carácter distintivo. Carranza (1969), Carranza y Amezcua-Linares (1971) y Amezcua-Linares (1972) han señalado la especie para el sistema de Agua Brava en el noroeste de México. RamírezHernández (1965) y Ramírez-Hernández y Páez (1965), la señalan como una de las dos especies de Eugerres en el Pacífico de México y Castro et al. (1970) agregan que la especie penetra aguas interiores. La distribución de E. axillaris está más restringida al hemisferio norte (Sonora, México a Panamá) , mientras que E. lineatus puede alcanzar más al sur (Guerrero, México, a Colombia), teniendo ambas una zona simpatrica en el Pacífico central mexicano. Eugerres axillaris es una especie más bien rara en el sistema lagunar costero de Guerrero. Por otra parte, sus hábitos alimenticios y reproductivos son similares a E. lineatus y penetra a las lagunas durante el período 1 buscando alimento y protección. Género 37. Eucinostomus Baird y Girard, 1854. 61) Eucinostomus currani Zahuranec, 1967. N. v. "Mojarra aleta de bandera", "Mojarra cantileña''(Lám. 22, Fig. 4) Gerres dowii (error de identificación, no la de Gill, 1863); Steindachner, Sitzb. Akad. Wiss. Wien, 1876, 72(1):551-616; Jordan y Gilbert, Bull. U. S. Fish. Comm. for 1882, 1883, 2: III (probablemente en parte) y Bull. U. S. Fish. Comm. 1882, 1:329; Evermann y Meek, Proc. Ac. Nat. Sci. Phila., 1883: 120. Gerres gracilis (error de identificación, no la de Gill, 1863); Evermarin y Jenkins, Proc. U. S. Nat. Mus., 1891, 14:159. Eucinostomus gracilis, Curran, Ph. D. dissertation, Univ. of Michigan, 1942: 1-183 (107). Eucinoslomus californiensis (error de identificación, no la de Gill, 1862), Jordan et al., Proc. Cal. Ac. Sci., 1895, 5(2):469; Meek y Hildebrand, Field Mus. Nat. Hist. Publ. Zool, Ser., 1925, 15(226):584, lám. 62, fig. 1; Jordan, Evermann y Clark, U. S. Burcau of Fisheries, 1930, 2:341; Seale, Allan Hancock Pacific Exp., 1940, 9:26, Morrow, Bull Bingham Oceanogr. Coll., 1957, 16:34, fig. 11; Brittan, Ichthyologica the Aquarium Journal, 1966, 37(3):122. Eucinostomus currani Zahuranec, M. Sci. Thesis Univ. of California, 1967: 1-74. Diagnosis. Cuerpo comprimido, moderada mente alargado. Cabeza 0.31 a 0.35 en la longitud patrón, el perfil dorsal generalmente derecho pero suavemente convexo sobre el hocico; hocico 0.10 a 0.11 en la longitud cefálica; ojos 0.27 a 0,34 en la cabeza; surco premaxilar variable y elongado, escamado en los lados pero no anteriormente. Altura máxima 0.32 a 0.40 en la longitud patrón. D IX, 10; A 111, 7; C 9+8; P 15-17, V 1, 5. Branquiespinas 7 a 9 (general mente 8) sobre la rama inferior del primer arco. Color. Dorso y flancos plateados. En ejemplares fijados pueden presentar diferentes tonalidades de café. Lo dorsal espinosa notablemente tricoloreada de negro, blanco y gris, el gris corresponde a melanóforos del tercio basal de la aleta. La dorsal blanda, las pélvicas y la anal sin pun. tuaciones grises. Distribución. En el Océano Pacífico desde California EE.UU., incluyendo el Golfo de California, hasta Perú, e incluso las Islas Galápagos. En el área de estudio: Lagunas de Salinas de Apozahualco, Chautengo, Tecomate, Tres Palos, Coyuca, Nuxco, Salinas del Cuajo y Potosí. Material examinado 78 ejemplares de 57 a 153 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000.680/.690 (Gro.). Observaciones. Esta especie fue descrita por Zahuranec (1967) sobre la base de una amplia revisión de las mojarras del género Eucinostomus en el Pacífico de América. A la fecha no se conoce la publicación oficial del trabajo y ese problema lo han denunciado Amezcua-Linares (1972 y 1977), Miller y Lea (1972), Chirichigno (1974) y YáñezArancibia y Nugent (1975). La necesidad de hacer una determinación exacta de las especies de este trabajo, motiva la idea de considerar la tesis de Zahuranec (1967) como una publicación y adjudicarle la especie; por ese mismo motivo, la diagnosis aquí entregada considera el tipo de mediciones morfométricas que él utiliza y la sinonimia presentada se basa en su trabajo. La mayor parte de los caracteres morfométricos de Eucinostomus currani se sobrelapan con los de E. dowii y E. entomelas, y es evidente, por su sinonimia, que ha sido común la confusión de los Eucinostomus en el Pacífico de América. Sin embargo E. currani se diferencia por lo notorio de la dorsal espinosa tricoloreada como bandera. Por su tamaño no es una especie económicamente importante en el área, pero por su distribución y frecuencia es característica en el sistema lagunar costero de Guerrero. Sus hábitos alimenticios corresponden a un consumidor primario tipo omnívoro. Una diagnosis para esta especie, de acuerdo al patrón taxonómico seguido en este trabajo sería: Cuerpo moderadamente alargado o comprimido. Cabeza 3 0 a 3.3 en la longitud patrón; hocico de 3.3 a 3.4 en la longitud cefálica; ojos 2.8 a 3.2 en la cabeza; boca pequeña, el maxilar rebasa ligeramente la parte anterior del ojo. Altura máxima 2.8 a 3.0 en la longitud patrón. D IX, 10; A 111, 7. Escamas de 41 a 45 en una línea longitudinal por sobre la línea lateral. Branquiespinas cortas, 7 a 8 en la rama inferior del primer arco. Pectorales largas sobrepasan el extremo de las pélvicas, de 1.1 a 1.3 en la longitud cefálica. 62) Eucinostomus entomelas Zahuranec, 1967 N. v.: "Mojarra blanca"(Lám. 23, Fig. 1) Gerres dowii (error de identificación, no la de Gill, 1864); Steindachner, Sitzb. Akad. Wiss. Wien, 1876, 72(1):563. Gerres gracilis (error de identificación, no la de Gill, 1862); Evermann y Jenkins, Proc. U. S. Nat. Mus., 1891, 14.159. Eucinostomus californiensis (error de identificación, no el de Gill, 1862); Jordan et al., Proc. Cal. Ac. Sci., 1895, 5(2):469; Wilson, Ann. Carn. Mus., 1916, 10(1-2):67; Meek y Hildebrand, Field Mus. Nat. Hist. Publ. Zool. Ser., 1925, 15(226):584 no la lám. 62, fig. 1; Jordan, Evermann y Clark, 1930, 2:341; Seale, Allan Hancock Pacific Exp., 1940, 9:26, Brittan, Ichthyologica The Aquarium Journal, 1966, 37(3):122 y 124. Eucinostomus argenteus (error de identificación, no la de Baird y Girard in Girard, 1855); Curran, Ph. D. dissertation Univ. of Michigan, 1942: 42. Eucinostomus entomelas Zahuranec, M. Sci. Thesis Univ, of California, 1967: 1-74 Diagnosis. Cuerpo comprimido, moderada mente alargado. Cabeza 0.30 a 0.36 en la longitud patrón; perfil dorsal generalmente derecho con una suave concavidad sobre el ojo, hocico 0.10 a 0,12 en la longitud cefálica. Altura máxima 0.34 a 0.41 en la longitud patrón. D IX, 10; A III, 7; C 9+8; P 15-16; V I, 5. Branquiespinas cortas 8 (raramente 7 o 9) sobre la rama inferior del primer arco. Color. Dorso y flancos plateados, ligeramente cafesoso arriba y amarillento abajo. 4 barras verticales de color oscuro sobre los flancos. La tonalidad de las barras y el número de ellas puede variar, Zahuranec (1967) detalla una amplia descripción del color de esta especie, señalando como significativo y específico lo negro de la cámara branquial. Distribución. En el Océano Pacífico, desde Baja California, incluyendo el sur del Golfo de California, hasta Ecuador y aún norte del Perú, En el área de estudio: Lagunas de Chautengo y Potosí. Material examinado 5 ejemplares de 70 a 182 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000.691/.696 (Gro.). Observaciones. Esta especie fue descrita por Zahuranec (1967) sobre la base de una amplia revisión de las mojarras del género, Eucinostomus en el Pacífico de América. A la fecha no se conoce la publicación oficial del trabajo y ese problema lo han denunciado Amezcua-Linares (1972 y 1977), Chirichigno (1974) y Yáñez-Arancibia y Nugent (1975). Como se aclaró en la especie recién discutida anteriormente, la necesidad de hacer una determinación exacta de las especies de este trabajo, motiva la idea de considerar la tesis de Zahuranec (1976) como una publicación y adjudicarle la especie; por ese mismo motivo, la diagnosis aquí entregada considera el tipo de mediciones morfométricas que él utiliza. Eucinostomus entomelas se diferencia de E. currani y E. dowii por las barras oscuras de los costados y lo negro del techo de la cámara bratiquial. Además de la coloración negra del bulbo que forma el músculo dilator del opérculo. Por su tamaño no es una especie económicamente importante en el área. De todas maneras es una especie común en los estuarios y lagunas, En este estudio sólo fueron colectados 5 ejemplares subadultos y por los datos de Zahuranec (1967) su captura debería ser más frecuente en las lagunas costeras; como ese autor dispuso de ejemplares adultos colectados en bahías profundas, se puede asumir razonablemente que la especie utiliza las lagunas y estuarios como áreas naturales de crianza. Sus hábitos alimenticios corresponden a un consumidor primario tipo omnívoro. Una diagnosis para esta especie, de acuerdo al patrón taxonómico seguido en este trabajo sería: Cuerpo moderadamente alargado, comprimido Cabeza con el perfil anterior levemente curvo 3,0 a 3.2 en la longitud patrón; hocico 3.0 a 3.4 en la longitud cefálica; ojos de 3.0 a 3.4 en la cabeza; boca pequeña el maxilar llega al mar gen posterior de la órbita; preorbital y preopércu lo lisos. Altura máxima 2.7 a 2.9 en la longitud patrón, D IX, 10; A 111, 7. Escamas más bien grandes 42 a 45 en una serie longitudinal por sobre la línea lateral. Branquiespinas cortas 7 a 8 sobre la rama inferior del primer arco. Pectorales largas sobrepasan el extremo de las pélvicas, 3.1 a 3.4 en la longitud del cuerpo. 63) Eucinostomus dowii (Gill, 1863) N. v. "Mojarra cantileña"(Lám. 23, Fig. 2) Diapterus dowii Gill, Proc. Ac. Nat. Sci. Phila., 1863: 162. Gerres dowi Günther, 1966: 448 (posiblemente en partc; descripción tomada de Gill, 1863) Steindachner, Stizb. Akad. Wiss. Wien, 1876, 72(1):563. Eucinostomus dowii Snodgrass y Heller, Proc. Wash. Ac. Sci., 1905, 6:380. Gerres cinereus Eigenmann, Amer. Naturalist, 1891, 25 (291):155 (var. nov.). Gerres gracilis (error de identificación, no la de Gill, 1862), Evermann y Jenkins, Proc. U. S. Nat. Mus., 1891, 14:159. Eucinostomus californiensis (error de identificación, no la de Gill, 1862); Jordan et al., Proc. Cal. Ac. Sci., 1895 5(2):469(?); Gilbert y Stark, Mem. Cal. Ac. Sci., 1904, 4:113; Starks y Morris, Univ. Cal. Publ. Zool, 1907, 3(11):196; Meek y Hildebrand, Field Mus. Nat. Hist. Publ. Zool. Ser., 1925, 15(226):584, no. lám. 62, fig. 1; Ulrey y Greeley, Bull, Soc. Cal. Ac. Sci., 1928, 28(1):18; Jordan, Evermann y Clark, 1930, 2:341; Barnhart, Univ. Cal. Press. 1936: 43(?); Hiyama et al., Peces Marinos de la Costa Mexicana del Pacífico, 1940: 50, lám. 74, fig. B; Seale, Allan Hancock Pacific Exp., 1940 9, 26. Eucinostomus argenteus (error de identificación, no la de Baird y Girard in Baird, 1855), Curran, Ph. D. dissertation Univ. of Michigan, 1942: 84. Diagnosis. Cuerpo alargado moderadamente comprimido. Cabeza 0.30 a 0.36 en la longitud patrón, con el perfil dorsal normalmente recto excepto el hocico que es suavemente convexo, 0.10 a 0.12 en la longitud cefálica; ojos 0.26 a 0.33 en la cabeza. Altura máxima 0.31 a 0.37 en la longitud cefálica. D IX, 10; A 111, 7; C 9+8; P 15- 16; V. I, 5. Branquiespinas cortas 8 (raramente 7 ó 9) sobre la rama inferior del primer arco. Pectorales 0.24 a 0.34 en la longitud. del cuerpo llegando más allá de la vertical sobre el ano. Color. Dorso café claro con puntuaciones, flancos plateados, vientre pálido. Aletas pares y anal pálidas, dorsal y caudal sólo con débiles puntuaciones. Algunas ligeras barras diagonales sobre los flancos, no muy oscuras y predominando en los juveniles. Distribución. En el Océano Pacífico, desde el Sur de California EE.UU., incluyendo el Golfo de California, hasta Panamá, e Islas Galápagos. Podría encontrarse en Colombia, Ecuador y norte de Perú. En el área de estudio. Lagunas de Chautengo, Tecomate, Nuxco y Potosí. Material examinado. 14 ejemplares de 55 a 104 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000.697/.699(Gro,). Observaciones. Eucinostomus dowii puede diferenciarse de E. entomelas porque no posee el intenso color negro de la cámara branquial, además el bulbo formado por el músculo dilator del opérculo se encuentra libre de melanóforos exceptuando un pequeño borde a lo largo del filo dorsal . E. dowii también puede separarse de E. currani por la notoria coloración de bandera de este último en la dorsal espinosa; y puede separarse de E. gracilis (Gill) por el cuerpo mucho más profundo que este último y por su segunda espina anal mucho más robusta. Zahuaranec (1967) considera que estas son las únicas 4 especies de Eucinostomus en la costa del Pacífico de América y detalla amplias descripciones y caracteres diagnósticos para separarlas. Sin embargo su trabajo ha sido tan poco conocido que las confusiones sobre los Eucinostomus siguen vigentes. En el sistema lagunar costero de Guerrero esta especie carece de importancia económica. No obstante todos los Eucinostomus revisten gran importancia ecológica como eslabones tróficos para niveles superiores. Todas estas especies penetran a las lagunas durante el periodo 1 en busca de protección y alimento para completar una importante etapa de su desarrollo. Familia XXIII. Pomadasyidae (Haemulidae) Género 38. Pomadasys Lacépéde, 1803 64) Pomadasys sp. N. v. "Burrito"(Lám. 23, Fig. 3) Distribución. En el área de estudio: Laguna de Chautengo. Material examinado. 1 ejemplar de 116 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo 0.000.700 (Gro.) . Observaciones Este ejemplar no pudo ser determinado a nivel específico por cuanto sus caracteres se traslapan entre Pornadasys leuciscus (Günther) y P. branickii (Steindachner) . Por otra parte sólo fue colectado un solo ejemplar y no es apropiado estructurar alguna diagnosis, El espécimen es un macho juvenil de color café pardo claro, unifornie, y debería corresponder a alguna de las 5 especies de Pomadays del Pacífico mexicano (i.e., macracanthus, leuciscus, branickii, panamensis y bayanus) 65) Pomadasys leuciscus (Günther, 1864) N. v. "Burrito"Pristipoma leuciscus Günther, Proc. Zool. Soc. London, 1864: 147 y Trans. Zool. Soc. London, 1869, 6:416, lám. 66, fig. 3; Steindachner, Denskschr. Akad. Wiss. Wien, 1879 b, 11: 30, 52, lám. 9, fig. 2; Boulenger, Bull. Mus. Zool. Anat. Torino, 1899, 14(346):2. Pristipoma (Haemulopsis) nitidum Steindachner (Sitzb. k. Ak. Wiss. Wien, 60) Ichth. Notizen, 1869, 8:5, lám. 3. Pomadasys elongatus Jordan y Gilbert, Proc. U. S. Nat. Mus., 1882: 352. Pomadasys nitidus Jordan y Fesler, Rept. U. S. Fish. Comm., 1889-1891 (1893), 17:494. Brachydeuterus nitidus Jordan y Evermann, Bull. U. S. Nat. Mus., 1898, 47:1326; Gilbert y Starks, Mem. Cal. Ac, Sci., 1904, 4:109. . Brachydeuterus leuciscus Jordan y Evermann, Bull. U. S. Nat. Mus., 1898, 47:1327; Gilbert y Starks, Mem. Cal. Ac. Sci, 1904, 1:109; Evermann y Radcliffe, Bull. U. S. Nat. Mus., 1917, 95:84; Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:333; Hildebrand, Bull. U. S. Nat. Mus., 1946, 189:254-256; Castro, Arvizú y Páez, Revta. Soc. mex. Hist. Nat., 1970, 31:142; Chirichigno, Inf. Inst. Mar Perú-Callao, 1974, 44:307 y 330. Poniadasys leuciscus Jordan y Gilbert, Proc. U. S. Nat. Mus., 1881: 387; Jordan y Fesler, Rept, U. S. Fish. Comm., 1889-1891 (1893), 17:495; Regan, Biol. Centr, Amer. Pisc., 1907, 42; Meek y Hildebrand, Field Mus. Nat. Hist. Publ. Zool. Ser., 1925, 15(226):551-552, lám. 55, fig. 2; Berdegué, Secretaría de Marina, Dir. Gral. Pes. Ind. Con., 1956: 253-258; Álvarez y Cortés. An. Esc. nac. Cienc. biol. Méx., 1962, 11(14):97 y 131; RamírezHernández y Arvizú, An. Inst. Nal. Inv. Biol. Pesq., 1965, 1:309; Ramírez-Hernández y Páez, An. Inst. Nal. Inv. Biol.-Pesq., 1965, 1:341; Álvarez, Com. Nac. Consul. Pes. Inst, Nal. Inv. Biol.-Pesq., 1970: 136137; Amezcua-Linares, Tesis profesional Fac. Ciencias Univ. Nal. Autón. México, 1972: 143-144, lám. 9, fig. 3, y An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, 1977, 43-25. Diagnosis. Cuerpo alargado, comprimido y de dorso ligeramente elevado. Cabeza larga y baja 2.7 a 3.3 en la longitud, patrón; hocico puntiagudo 2.5 a 3.4 en la longitud cefálica; ojos 3.8 a 4.7 en la cabeza; maxilar corto, no llega al margen anterior de la órbita 3.0 a 3.6 en la longitud cefálica. Altura máxima 2,8 a 3.2 en la longitud patrón. D XII, 14-15; A 111, 7-8; P. 17. Escamas en una serie longitudinal de 50 a 56 entre la supraclavícula y la base de la caudal, Branquiespinas cortas 12 a 13 bien desarrolladas en la rama inferior del primer arco y 2 a 3 rudimentos. Pectorales llegan o pasan ligeramente el extremo de las ventrales, 1.2 a 1.6 en la longitud cefálica. Color. Dorso pardo grisáceo, flancos plateados, vientre pálido. Una mancha oscura al final del opérculo e inicio de la línea lateral cerca de la inserción de las pectorales. Aletas impares oscuras, las pares pálidas; base de la pectoral oscura. Líneas tenuemente oscuras a lo largo de las escamas. Distribución. En el Océano Pacífico, desde Baja California, México, hasta Perú. En el área de estudio: Laguna Salinas de Apozahualco, Chautengo, Tecomate, Nuxco y Salinas del Cuajo. Material examinado. 15 ejemplares de 90 a 103 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo 0.000.701/.703 (Gro.). Observaciones. Existe una gran cantidad de sinónimos de Pomadasys leuciscus, en la literatura, debido a la notable variación de sus caracteres (Meek y Hildebrand 1925). En general la separación de las diferentes especies de Pomadasys presenta problemas. Diferenciarlas por la longitud de las pectorales, el tamaño de las mandíbulas coloración, espinas, etcétera, puede ser en muchos casos simple, pero en la mayoría de las veces es necesario utilizar además otros caracteres merísticos y morfométricos. Berdegué (1954 y 1956) ha indicado que existe una gran confusión en cuanto a los nombres vulgares de las especies de Pomadasys y recomienda que mientras no exista una aclaración, es recomendable la denominación general de "burritos". Este mismo autor ha señalado que la frecuencia de estas especies es considerable en el Pacífico mexicano y son particularmente abundantes en los fondos rocosos del Golfo de California; desgraciadamente no precisa nada en particular sobre P. leuciscus. Castro et al. (1970) consideran a P. leuciscus y P. panamensis (Steindachner) entre los peces del Golfo de California. La especie ha sido citada por Ramírez-Hernández y Arvizú (1965) y por Ramírez-Hernándes Páez (1965). Éstos últimos indicando para la costa de Guerrero (además de P. leuciscus) a las especies P. panamensis (Steindachner) y P. bayanus Jordan y Evermann. Aunque la especie parece frecuente en lagunas del Pacífico mexicano, puesto que también fue estudiada por Castro et al. (1970), Carranza y Amezcua-Linares (1971), Amezcua-Linares (1972 y 1977) y Yáñez-Arancibia y Nugent (1975), carece de importancia económica en el sistema lagunar estudiado. Penetran a las lagunas duran te el periodo 1 pequeños ejemplares adultos en busca de alimento y protección. Sus hábitos alimenticios son preferentemente carnívoros, comportándose como un consumidor secundario. 66) Pomadasys macracanthus (Günther, 1864) N. v. "Burro"(Lám. 23, Fig. 4) Pristipoma macracanthum Günther, Proc. Zool. Soc. London, 1864, 146 y Trans. Zool. Soc. London, 1869, 1:116, lám. 64, fig. 1. Pomadasys macracanthus o Pomadasis macracanthus; Jordan y Fesler, Rept. U. S. Fish. Comm., 1889-1891 (1893): 493; Jordan y Evermann, Bull. U. S. Nat. Mus., 1898, -17:1332; Gilbert y Starks, Mem. Cal. Ac. Sci., 1904, 4: 110; Regan, Biol. Centr. Amer. Pisc., 1907: 42 Meek y Hildebrand, Field Mus. Nat, Hist. Publ. Zool. Ser., 15(226):252-253; Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:334; Berdegué, Secretaría de Marina, Dir. Gral, Pes. Ind. Con., 1956: 253-258; Álvarez y Cortés, An. Ese. nac. Cienc. biol. Méx., 1962, 11(14):97 y 131; Álvarez, Con. Nac. Consul. Pes. Inst. Nal. Inv. Biol.-Pesq., 1970: 136-137; Amezcua-Linares, Tesis profesional Fac. Ciencias Univ. Nal. Autón México, 1972: 145-147, lám. 9, fig. 4; S. 1. C. Catálogo de Peces Marinos Mexicanos, 1976: 100, 101 y 279; Amezcua-Linares, An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, 1977, 4(1):125. Diagnosis. Cuerpo alto, ligeramente comprimido, dorso elevado. Cabeza de perfil casi recto, grande, 2.5 a 2.8 de la longitud patrón; hocico largo puntiagudo de 2.7 a 3.0 en la longitud cefálica; ojos 4.3 a 5.3 en la cabeza; boca pequeña horizontal, labios gruesos, maxilar pequeño, puede llegar escasamente al margen anterior del ojo, 3.1 a 3.8 en la longitud cefálica. Altura máxima 2.5 a 3.0 en la longitud patrón. D XII u XI, 13; A 111, 7-8. De 45 a 50 escamas en una serie longitudinal por sobre la línea lateral. Branquiespinas 11 a 14 bien desarrolladas y 2 ó 3 rudimentos. Pectorales largas sobrepasan el extremo de las ventrales, de 1.1 a 1.3 en la longitud cefálica. Color. Dorso pardo grisáceo variando hasta pardo oscuro o pardo gris metálico; flancos con 4 ó 5 barras ligeramente transversales, de color pardo; vientre plateado. Aletas impares oscuras, pectorales y pélvicas con pequeñas puntuaciones. Distribución. En el Océano Pacífico desde Mazatlán, México, hasta Ecuador. En el área de estudio: Lagunas de Chautengo. Material examinado 21 ejemplares de 94 a 189 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000.704/.708 (Gro.). Observaciones Normalmente Pomadasys macracanthus es una especie de gran importancia comercial por la calidad de su carne y su tamaño. Se le denomina "burro" en los sistemas lagunares de Sinaloa, Nayarit y Guerrero (Carranza y Amezcúa-Linares, 1971a y 1971b; Amezcua-Linares, 1972 y 1977; Yáñez-Arancibia y Nugent 1975). No fue una especie importante en el sistema lagunar costero de Guerrero y por su limitada distribución y abundancia, mas bien correspondió a una especie rara. Sólo fueron colectados 21 ejemplares en la laguna de Chautengo. Sus hábitos son preferentemente carnívoros alimentándose de peces y macroinvertebrados; no obstante en el interior de las lagunas puede eventualmente ingerir algo de detritus, como todos los consumidores de segundo orden. La especie penetra a las lagunas durante el periodo 1 al estado adulto y para alimentarse. 67) Pomadasys branickii (Steindachner, 1879) N. v. "Burrito"(Lám. 24, Fig. 1) Pristipoma branickii Steindachner, Denkschr. k. Ak. Wiss. Wien, 1879, 41:28, lám. 9, fig. 1. Rhonciscus branicki Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:334. Pomadasys branickii Jordan y Fesler, Rept. U. S. Fish. Comm., 1889-1891 (1893), 17:493; Jordan y Evermann, Bull, U. S. Nat. Mus., 1898, 47:1333; Gilbert y Starks, Mem. Cal. Ac. Sci., 1904, 4:110; Regan, Biol. Centr. Amer., Pisc., 1907: 43; Evermann y Radcliffe, Bull. U.S. Nat. Mus., 1917, 95:86; Meek y Hildebrand, Field Mus. Nat. Hist. Publ. Zool. Ser., 1925, 15(226): 555-556, Hildebrand, Bull. U. S. Nat. Mus., 1946, 189: 256-257; Berdegué, Secretaría de Marina, Dir. Gral, Pes. Ind. Con., 1956: 253-258; Álvarez y Cortés, An. Esc. nac. Cienc. biol. Méx., 1962, 11(1-4):97 y 131; Álvarez, Com. Has. Constar. Pes. Inst. Nal. Inv. Biol. Pesq., 1970: 136-137; Amezcua-Linares Tesis profesional Fac. Ciencias Univ. Nal. Autón. México, 1972: 147-148, lám. 9, fig. 5; Amezcua-Linares, An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, 1977, 4(1):1-25. Diagnosis. Cuerpo moderadamente comprimido alargado. Cabeza comprimida, 2.8 a 3.1 en la longitud patrón, perfil anterior inclinado y derecho sobre los ojos; hocico más bien regular 3.0 a 3.3 en la longitud cefálica, ojos 2.6 a 3.2 en la cabeza; maxilar llegando al margen anterior de la órbita 3.3 a 3.7 en la longitud cefálica; preopérculo y supraopérculo aserrados. Altura máxima 2.8 a 3.2 en la longitud patrón. D XIII, 11-12; A 111, 7; P. 16. Escamas en una serie longitudinal 47 a 50 por sobre la línea lateral. Branquiespinas cortas y gruesas 8 a 9. 12 incluyendo rudimentos, en la rama inferior del primer arco. Pectorales largas hasta o pasando el extremo de las ventrales, 1.2 a 1.4 en la longitud cefálica. Color. Dorso azulado, algo plateado; flancos con puntuaciones oscuras; vientre plateado. Aletas relativamente oscuras, dorsal y caudal con un margen negro; dorsal blanda con barras oscuras o manchas en la base. Distribución. En el Océano Pacífico, desde Mazatlán, México, hasta Perú, En el área de estudio: Lagunas de Chautengo y Potosí. Material examinado. 8 ejemplares de 71 a 94 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México, Catálogo CCML-PF 0.000.709 (Gro.) Observaciones. En la costa del Pacífico se les conoce con el nombre de "burritos", "blanquillo", "roncadores" o "sargo". En general las semejanzas entre las especies de Pomadasys y Anisostremus son grandes y existe confusión de nombres vulgares para las diferentes especies. Las mismas especies de Pomadasys son de difícil separación, presentando todas la dorsal escotada con más de 11 espinas; no presentan dientes en la lengua o en el paladar, Las diferencias más notables se encuentran en la longitud de las pectorales, color y tamaño de la boca. Son especies comestibles en la costa del Pacífico mexicano y de considerable importancia económica; no obstante no son abundantes en el sistema lagunar estudiado. Su ocurrencia en Chautengo, y Potosí es explicable por la abertura de la barra en la época del periodo 1. Ramírez-Hernández (1965) cita a Pomadasys spp como especies importantes desde Baja California a Chiapas. Estudios posteriores de Ramírez-Hernández y Arvizú (1965), Ramírez-Hernández y Páez (1965), Carranza y Amezcua-Linares (1971), y AmezcuaLinares (1972-1977) incuyen a P. branickii entre los peces de la familia Pomadasyidae estudiados por ellos en los sistemas lagunares de Sinaloa y Nayarit. En general, las 4 especies de Pomadasys estudiadas en este trabajo no han sido trascendentes desde el punto de vista económico; sin embargo, si bien es cierto no, fueron ni muy abundantes ni frecuentes, tienen importancia ecológica, como consumidores de segundo orden y como componentes estructurales de las comunidades ictiofaunísticas estudiadas. Penetran a las lagunas, durante el periodo 1 generalmente como adultos aún cuando inmaduros sexualmente y para alimentarse. Familia XXIV. Sciaenidae Género 39. Umbrina Cuvier, 1817 68) Umbrina xanti Gill, 1862 N. v. "Roncador", "Codorniz"(Lám. 24, Fig. 2) Umbrina xanti Gill, Proc. Ac. Nat. Se¡. Phila., 1862, 11: 257; Jordan y Evermann, Bull. U. S. Nat. Mus., 1898, 17: 1467; Gilbert y Starks, Mem. Cal. Ac. Sci., 1904, 4:133; Meek y Hildebrand, Field Mus. Nat. Hist. Publ. Zool. Ser., 1925, 15(226):615-616; Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:350; Evermann y Radcliffe, Bull. U. S. Nat. Mus., 1917, 95:105; Hildebrand, Bull. U. S. Nat. Mus., 1946,189:267-268; Ramírez-Hernández y Arvizú, An. Inst. Nal. Inv. Biol.-Pesq., 1965, 1:309; Ramírez-Hernández y Páez, An. Inst. Nal. Inv. Biol.-Pesq., 1965, 1:342; Castro, Arvizú y Páez, Revta. Soc. mex. Hist. Nat., 1970, 31:143; Chirichigno, Inf. Inst. Mar Perú-Callao, 1974, 44:245 y 353; S. I. C., Catálogo de Peces Marinos Mexicanos, 1976: 106, 108 y 338. Diagnosis. Cuerpo moderadamente alargado, dorso elevado. Cabeza baja, amplia y cónica 3.5 a 4.0 en la longitud patrón; hocico corto, 3.0 a 3.6 en la longitud cefálica; ojos 3.2 a 4.8 en la cabeza, excepcionalmente hasta 5.5; margen del preopérculo finalmente aserrado; maxilar extendiéndose hasta el margen anterior de la pupila, 2.7 a 3.1 en la longitud cefálica; un cirro grueso mentoniano. Altura máxima 3.2 a 3.5 en la longitud patrón. D X-1, 26-30; A 11, 5-6; P 17-18. Escamas de 55 a 70 en una serie longitudinal por sobre la línea lateral. Branquiespinas cortas y mas notorias en los juveniles, 7 a 11 bien desarrolladas sobre la rama inferior del primer arco. Pectorales muy cortas no llegan al tope de las pélvicas, 1.4 a 1.7 en la longitud cefálica y 5.6 a 6.0 en la longitud del cuerpo. Color. Dorso café verdoso, vientre plateado. Líneas oscuras a lo largo de la línea de escamas sobre el dorso y los flancos; estas líneas son oblicuas y sinuosas en el dorso con matices amarillos. Aletas dorsal, pectorales y caudal relativamente oscuras. Pélvicas y anal amarillas en ejemplares frescos. Distribución. En el Océano Pacífico desde Baja California, México, hasta Perú. En el área de estudio: Lagunas de Chautengo y Potosí. Material examinado. 6 ejemplares de 193 a 308 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000.710 (Gro.) Observaciones. Las líneas coloreadas diagonales del dorso y flancos es uno de los caracteres típicos de Umbrina xanti. Esta especie es considerada rara en el sistema lagunar costero de Guerrero. Los ejemplares capturados son adultos que durante el periodo 1 pueden penetrar a las lagunas en busca de alimento. Sus hábitos alimenticios la ubican como una especie consumidora de segundo orden alimentándose demacroinvertebrados bentónicos, peces y eventualmente restos de materia orgánica. Ramírez-Hernández (1965) ha señalado que Umbrina spp. es un grupo de peces comunes en el Pacífico de México, y Ramírez-Hernández y Arvizú (1965) y Ramírez-Hernández y Páez (1965) precisan que U. xanti es uno de los peces marinos característicos de Baja California y de Guerrero, Castro et al. (1970) la considera entre los peces del Golfo de California y S. 1. C. (1976) incluye también esta especie entre los peces niarinos mexicanos. La mayoría de estos autores consideran que Umbrina xanti no es muy abundante pero Ricker (1957a) afirma que es una especie muy abundante en la costa occidental de México. Una referencia útil para Sciaenidos del Pacífico es el trabajo de McPhail (1960) Género 40. Micropogon Cuvier y Valenciennes. 1830 69) Micropogon altipinnis Günther, 1864 N. v. "Berrugato"Micropogon altipinnis Günther, Proc. Zool. Soc. London, 1864, Jordan y Gilbert, Bull. U. S. Fish. Comm., 1882, 2, 1883, 3; Jordan y Eigenmann, Rept. U. S. Fish. Comm., 1886, 14 (1889): 419; Gilbert y Starks, Mem. Cal. Ac. Sci., 1904, 1: 132; Starks, Proc. U. S. Nat. Mus., 1906: 796; Meek y Hildebrand, Field Mus. Nat. Hist. Publ. Zool. Ser., 1925, 15(226):617-618; Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:349; Ramírez-Hernández y Arvizú, An. Inst. Nal. Inv. Biol. Pesq., 1965, 1:309; Ramírez-Hernández y Páez, An. Inst. Nal. Inv. Biol -Pesq., 1965, 1:342; Castro, Arvizú y Páez, Revta. Soc. mex. Hist. Nat., 1970, 31:143; Chirichigno, Inf. Inst. Mar Perú-Callao, 1974, 44:247 y 341. Diagnosis. Cuerpo moderadamente robusto y comprimido Cabeza ligeramente grande y comprimida 3.1 a 3.5 en la longitud patrón; hocico largo proyectándose mas allá de los premaxilares 2.7 a 3.6 en la longitud cefálica; ojos de tamaño variable 4.0 a 6.0 en la cabeza; boca moderada, inferior, suavente oblícua, el maxilar llega al margen anterior de la pupila; barbillas mentonianas a los lados de la mandíbula sin reunirse en grupo en el extremo anterior. Altura máxima 3.1 a 3.6 en la longitud patrón. D X-1, 20-23; A 11, S. Escamas 47 a 54 en una serie longitudinal por sobre la línea lateral. Branquiespinas cortas 14 a 16 (incluyendo rudimentos) sobre la rama inferior del primer arco. Preopérculo fuertemente aserrado y dientecillos en el ángulo. Pectorales más bien grandes. Color. Dorso café plateado, flancos plateados, Hileras de escamas sobre la línea lateral con líneas oscuras long¡tudinales; además presentan 8 barras oblicuas sobre los flancos, cruzando la porción arqueada de la línea lateral. Algunas puntuaciones oscuras a los lados, desde la base de las pectorales hasta la base de la caudal. Distribución. En el Océano Pacífico desde el Golfo de California, México, hasta Perú. En el área de estudio: Laguna de Chautengo. Material examinado. 5 ejemplares de 141 a 203 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000. 711/.712 (Gro.) Observaciones. La distribución natural de Micropogon altipinnis ha sido confusa en el Pacífico de América, Meek y Hildebrand (1925) la señalan para Panamá, RamírezHernández y Arvizú (1965) la señalan para la costa de Baja California hasta el Sur de Guerrero, RamírezHernández y Páez (1965) la señalan para la costa de Guerrero hasta Panamá, y Chirichigno la reporta con una distribución desde Guatemala hasta Perú (1974). Sin análisis parciales parece razonable indicar que la especie se distribuye desde Baja California hasta Perú. Micropogon altipinnis se puede diferenciar de M. ectenes por el mayor número de branquiespinas, la menor profundidad corporal y menor número de barras oscuras cruzadas diagonalmente sobre los flancos en la parte central del cuerpo. Fue una especie rara en el sistema lagunar costero de Guerrero y puede colectársele muy esporádicamente durante el periodo 1 en las lagunas que reciben marcada influencia marina. Utiliza estas áreas al estado adulto y para alimentarse comportándose como un consumidor de tercer orden, alimentándose de macroinvertebrados y peces. Castro et al. (1970) la destacan como una de las especies más abundantes del Golfo de California. 70) Micropogon ectenes Jordan y Gilbert, 1881 N. v. "Berrugato"(Lám. 24, Fig. 3) Micropogon ectenes Jordan y Gilbert, Proc. U. S. Nat. Mus., 1881, 4:355; Jordan y Evermann, Bull. U. S. Nat. Mus., 1898, 47:1 y 463; Jordan, Evermann y Clark U. S. Bureau of Fisheries, 1930, 2:349; Hiyama et al., Peces Marinos de la Costa Mexicana del Pacífico, 1940: 54, lám. 38; Berdegué, Secretaría de Marina, Dir. Gral. Pes. Ind. Con. 1956:-223-224, fig. 162; Amezcua-Linares, Tesis profesional Fac. Ciencias Univ. Nal. Autón. México, 1972: 1.51154, lám. 10, fig. 2; y Ancestro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, 1977, 4(1):1-25. Diagnosis. Cuerpo alargado, moderadamente comprimido. Cabeza ligeramente ancha, cónica, 3.1 a 3.4 en la longitud patrón; preopérculo aserrado y dos espinas más fuertes en el ángulo inferior; hocico largo y achatado se prolonga más allá de los premaxilares, 3.2 a 3.5 en la longitud cefálica ojos 4.2 a 5.0 en la cabeza; maxilar llegando o pasando el margen anterior del ojo; alrededor de 4 barbillas en el margen de los huesos dentarios. Altura máxima 3.6 a 4.0 en la longitud patrón. D X-1, 24-25; A 11, 7-8. Escamas 52 a 55 en una serie longitudinal por sobre la línea lateral; línea lateral prolongándose hasta el extremo de la caudal, Branquiespinas bien desarrolladas, 13 a 14 sobre la rama inferior de¡ primer arco, Pectorales largas y puntiagudas sobrepasan ligeramente el extremo de las ventrales, 1.3 en la longitud cefálica. Color. Dorso gris, flancos plateados, vientre pálido. 10 u 11 pequeñas barras cruzadas del color del dorso atraviesan la línea lateral en la parte central del cuerpo. La dorsal con las membranas interespinales e interradiales con puntuaciones grises; caudal gris clara; pectorales pálidas; ventrales y anal pálidas con ligeras manchas amarillas. Distribución. Por todo el Pacífico Mexicano. En el área de estudio, Lagunas de Chautengo, Tecomate, Nuxco. Material examinado. 10 ejemplares de 175 a 201 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000. 713 /.728 (Gro.). Observaciones. Micropogon ectenes se diferencia fundamentalmente de Cynoscion stolzmanni por el mayor número de rayos dorsales y el menor número de rayos anales. M. ectenes presenta además un hocico alargado, pequefias barbillas mentonianas y 10 u 11 barras grises cruzadas en los flancos. Carranza y Amezcua-Linares (1971a y 1971b) estudiaron esta especie considerándola como muy abundante en el sistema Teacapan-Agua Brava, Nay. De los estudios de estos autores y Amezcua-Linares (1972 y 1977) y los resultados aquí entregados, se conoce que esta especie es ovípara y de hábitos carnívoros predando sobre celenterados, poliquetos, moluscos y pequeños crustáceos y peces. La disposición de la boca en esta especie sugiere preferencia por alimentación de tipo bentónico. Al parecer no es importante económicamente en el sistema lagunar estudiado y su hallazgo en Chautengo. Tecomate y Nuxco puede ser explicado por el prolongado periodo de abertura de las barras durante el periodo 1 de las lagunas. Penetran a las lagunas al estado adulto (pero sexualmente inmaduras) y para alimentarse. por sus hábitos alimenticios corresponde a un consumidor de tercer orden. Género 41. Cynoscion Gill, 1861 71) Cynoscion stolzmanni (Steindachner, 1879) N. Y.: "Corvinilla", "Corvina"(Lám. 24, Fig. 4) Otolithus stolzmanni Steindachner, Denkschr. k. Ak. Wiss. Wien, 1979, 41, BI. 1, Abth. 35, lám. 2, fig. 1. Cestreus stolzmanni Jordan y Eigenmann, Rept, U. S. Fish. Comm., 1886 (1889), 14:370. Eriscion stolzmanni Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:356. Cynoscion stolzmanni (Skindachner); Jordan y Gilbert, Bull. U. S. Fish. Comm., 1881 (1882) 1:320; Jordan y Evermann, Bull. U. S. Nat. Mus., 1898, 47; 1412; Gilbert y Starks, Mem. Cal. Ac. Sci., 1904, 4:119; Meek y Hildebrand, Field. Mus. Nat. Hist. Publ. Zool. Ser., 1925, 15(226):663-664; Tortonese, Bull. Mus. Zool. Anat. Comp. Univ. Torino, 1939, 3(100):304; Hiyama et al., Peces Marinos de la Costa Mexicana del Pacífico, 1940: 52, lám. 37, Hildebrand, Bull. U. S. Nat. Mus., 1946, 189:278-279; RamírezHernández y Arvizú, An. Inst. Nal. Inv. Biol.-Pesq., 1965, 1:310; RamírezHernández y Páez, An. Inst. Nal. Inv. Biol.-Pesq., 1965, 1:342; Castro, Arvizú y Páez, Revta. Soc, mex. Hist. Nat., 1970; 31:146; Chirichigno, Inf. Inst. Mar Perú-Callao, 1974, 44:254 y 332. Diagnosis. Cuerpo alargado, ligeramente comprimido, Cabeza algo comprimida, cónica, 3.6 a 4,0 en la longitud patrón; hocico largo 3.4 a 4.4 en la longitud cefálica; ojos 5.2 a 7.6 en la cabeza; maxilar llegando o pasando el margen posterior de la órbita, 2.0 a 2.3 en la longitud cefálica; dientes en 2 series y caninos en la mandíbula superior. Altura máxima 3.8 a 4.9 en la longitud patrón. D IX-I o X-1, 19-21; A 11, 9. Escamas en una serie longitudinal sobre la línea lateral 72 a 85; línea lateral prolongándose hasta el extremo de la caudal. Branquiespinas aserradas, 6 a 8 sobre la rama inferior del primer arco. Pectorales más cortas que las ventrales, 1.8 a 2.1 en la longitud cefálica. Caudal rombica. Color.Dorso gris azulado, flancos más claros con puntuaciones oscuras; vientre y flancos plateados. Línea opercular superior oscura. Aletas más o menos oscuras, excepto las ventrales que son pálidas; dorsal blanda marginada de negro. Distribución. En el Pacífico tropical de América, desde México hasta Perú. En el área de estudio: Lagunas Chautengo, y Nuxco. Material examinado. 7 ejemplares de 158 a 182 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México, Catálogo CCML-PF 0.000.729 (Gro.). Observaciones. Es una familia que reviste gran importancia económica y sus especies son tan abundantes que en muchas regiones constituyen la principal actividad pesquera. Meek y Hildebrand (1925) asigna a Cynoscion stolzmanni un rango de distribución desde Panamá a Perú al igual que Chirichigno (1974). Sin embargo Ramírez-Hernández (1965) señala a Cynoscion spp. en ambas costas de México. Este hallazgo en Guerrero confirma el rango de distribución de C. stolzmanni dado por Ramírez-Hernández y Arvizú (1965) y por Ramírez-Hernández y Páez (1965) ; estos últimos la mencionan con el nombre de "gallina" para Guerrero. Junto a C. stolzmanni se ha reportado para el Pacífico mexicano a C. parvipinnis Ayres, C. macdonaldi Gilbert, C. xanthulus Jordan y Gilbert, C. reticulatus (Günther) y a C. albus (Günther) (Ramírez-Hernández) y Arvizú, 1965; Ramírez-Hernández y Páez, 1965; Castro el al. 1970; S. I. C. 1976). Además de las especies ya mencionadas Berdegué (1954 y 1956) reporta a C. nobilis (Ayres) , C. othonopterus Jordan y Gilbert, pero no a C. stolzmanni. Agrega ese mismo autor que en el noroeste de México las corvinas tienen una importancia comercial tracendental y la mayor parte de las capturas es exportada a EE.UU. En estos estudios Cynoscion stolzmanni no fue una especie ni abundante ni frecuente y por lo tanto carece de importancia comercial. Eventualmente penetran a las lagunas algunos ejemplares durante el periodo 1, adultos pero sexualmente inmaduros, en busca de alimento. Es un consumidor de tercer orden, alimentándose de peces y macroinvertebrados. 72) Cynoscion xanthulus Jordan y Gilbert, 1881 N. v.: "Corvina", "Corvina de aletas amarillas"(Lám. 25, Fig. 1) Cynoscion xanthulus Jordan y Gilbert, Proc. U. S. Nat. Mus., 1881, 4:460; Berdegué, Secretaría de Marina, Dir. Gral. Pes. Ind. Con., 1956: 228-238 (234); Castro, Arvizú y Páez, Revta. Soc. mex. Hist. Nat., 1970, 31: 146; Amezcua-Linares, Tesis profesional Fac. Ciencias Univ. Nal. Autón. México, 1972: 154-156, lám. 10, fig. 3; y An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, 1977, 4(1):1-25. Eriscion xanthulus Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:356. Diagnosis. Cuerpo delgado, alargado y moderadamente comprimido. Cabeza larga y comprimida 2.9 a 3.2 en la longitud patrón; hocico puntiagudo 4.2 a 4.6 en la longitud cefálica; ojos 6.0 a 7.0 en la cabeza; boca oblicua, el maxilar puede llegar hasta poco más alla del margen posterior de la órbita, dientes en bandas y 2 caninos presentes sobre la parte anterior de la mandíbula superior; preopérculo liso. D IX-1, 20; A 11, S. Escamas 64 a 68 en una serie longitudinal por sobre la línea lateral. Branquiespinas gruesas 7 a 8 bien desarrolladas y 1 o 2 rudimentos, sobre la rama inferior del primer arco. Pectorales alcanzan el extremo de las ventrales, 1.6 a 1.9 en la longitud cefálica. Caudal rómbica. Color. Dorso azul, vientre plateado. Parte media de los flancos con puntuaciones oscuras. Parte interna de la boca de color amarillo intenso. Aletas dorsal y caudal oscuras a veces con tonalidades amarillas; pélvicas, pectorales y anal pálidas. Distribución. En el Pacífico, de México, desde Mazatlán, hasta Guerrero. En el área de estudio: Laguna de Chautengo. Material examinado. 3 ejemplares de 171 a 223 mm de longitud total, Colección de referencia depositada en el Laboratorio de Ictiología del Centro (le Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000.730/.731 (Gro.). Observaciones. Al igual que Cynoscion stolzmanni, C. xanthulus fue una especie rara en el sistema lagunar estudiado. Los ejemplares capturados eran adultos pero sexualmente inmaduros. Su presencia en las lagunas obedece a la busca de alimento. Son consumidores de tercer orden alimentándose de peces e invertebrados. Cynoscion xanthulus no es una especie abundante pero como lo demuestra este trabajo frecuenta los ambientes lagunares en el Pacífico mexicano (Amezcua-Linares, 1972 y 1977; Yáñez-Arancibia y Nugent, 1975). Su distribución anterior era desde el Golfo de California hasta Acapulco (Roedel, 1953; McPhail, 1960; Castro et al., 1970) pero en este estudio su distribución se amplía ligeramente hacia el sur. 73) Cynoscion reticulatus (Günther, 1869) N. v.: "Corvina", "Corvina rayada", "Trucha de mar"(Lám. 25, Fig. 2) Otolithus reliculatus Günther, Proc. Zool. Soc., London, 1864: 149. Cynoscion reticulatum Jordan y Gilbert, Proc, U. S. Nat. Mus. 1881: 232. Cestreus reticulatos Jordan y Eigenmann, Rept. U. S. Fish. Comm., 1886 (1889), 14:368. Eriscion reticulatus Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:355. Cynoscion reticulatus (Günther) Meek y Hildebrand, Field Mus. Nat. Hist. Publ. Zool. Ser., 1925, 15(226): 661-662; Hiyarna et al., Peces Marinos de la Costa Mexicana del Pacífico, 1940: 52, lám 77, Berdegué, Secretaría de Marina, Dir. Gral. Pes. Ind. Con., 1956: 228238 (231-232), fig. 166; Ramírez-Hernández y Arvizú, An. Inst. Nal. Inv. Biol.-Pesq,, 1965, 1:310; Ramírez-Hernández y Páez, An. Inst. Nal. Ano. Biol.-Pesq., 1965, 1:342; Castro, Arvizú y Páez, Revta. Soc. mex. Hist. Nat., 1970, 31:145; S. I. C., Catálogo de Peces Marinos Mexicanos, 1976: 104, 106 y 307. Diagnosis. Cuerpo alargado moderadamente comprimido. Cabeza cónica 3.4 a 3.7 en la longitud patrón; hocico 3.4 a 4.1 en la longitud cefálica; ojos 4.2 a 5.2 en la cabeza; mandíbula inferior proyectada, boca grande, oblicua, el maxilar llegando hasta el margen posterior de la órbita, 1.8 a 2.1 en la cabeza. Altura máxima 4.2 a 4.5 en la longitud patrón, D X-1, 25 a 28 (generalmente 28) ; A 11, 9. Escamas 89 a 102 en una serie longitudinal por sobre la línea lateral. Branquiespinas moderadamente fuertes aserradas en su borde interno, 6 a 8 sobre la rama inferior del primer arco. Pectorales más bien largas, llegando al tope de las pélvicas, 1.3 a 1.6 en la longitud cefálica. Caudal doble truncada. Color. Dorso gris azulado o ligeramente café; flancos y dono con manchas o reticulaciones; vientre plateado. Aleta caudal y dorsal ligeramente grisáceas o amarillentas. Distribución. En el Océano Pacífico, desde Baja California, México, hasta Panamá. En el estudio: Lagunas de Chautengo y Potosí. Material examinado. 5 ejemplares de 180 a 236 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México, Catálogo CCML-PF 0.000,732 (Gro.). Observaciones. Cynoscion reticulatus fue, al igual que C. stolzmanni y C. xanthulus, una especie rara en el sistema lagunar estudiado. Se consideró por mucho tiempo que la distribución natural de esta especie era de Mazatlán hasta Panamá. Berdegué (1954 y 1956) y Fitch (1952 y 1953) confirmaron un nuevo rango desde Baja California hasta Panamá. Castro et al. (1970) la considera una especie abundante en el Golfo de California. Los caracteres diagnósticos más evidentes que separan estas tres especies son, además del color, el número de escamas en series longitudinales (i. e., C. reticulatus 89 a 102, C. stolzmanni 72 a 85, y C. xanthulus 64 a 68), la fórmula dorsal y anal (i. e., C. reticulatus D X-1, 25 a 28 (28) ; A 11, 9; C. stoIzmanni D IX-1 o X-I, 19-21; A 11, 9; y C. xanthulus D IX-1, 20; A 11, 8). Los ejemplares capturados fueron adultos pero sexualmente inmaduros. Su ocurrencia allí se debe a la búsqueda de alimento; sus hábitos son carnívoros, consumidor de tercer orden. Género 42. Menticirrhus Gill, 1861 74) Menticirrhus elongatus (Günther, 1864) N. v.: "Berrugato", "Bocadulce", "Corvina"(Lám. 25, Fig. 3) Umbrina elongata Günther, Proc. Zool. Soc. London, 1864: 148. Menticirrhus elongatus Jordan y Gilbert, Bull. U. S. Fish. Comm., 1882 (1883), 2:107; Gilbert y Starks, Mem. Cal. Ac. Sci., 1904, 4:134. Umbrula elongata Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:351. Menticirrhus elongatus (Günther) Jordan y Evermann, Bull. U. S. Nat. Mus., 1898, 17:1476; Meek y Hildebrand, Field Mus. Nat. Hist. Publ. Zool. Ser., 1925, 15(226): 667-668; Berdegué, Secretaría de Marina, Dir. Gral. Pes. Ind. Con., 1956: 224-225, fig. 163; Ramírez-Hernández y Paéz, An. Inst. Nal. Inv. Biol.-Pesq., 1965, 1:342; S. I. C., Catálogo de Peces Marinos Mexicanos, 1976: 105, 107 y 316; Amezcua-Linares, An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, 1977, 4(1):125. Diagnosis. Cuerpo alargado poco comprimido. Cabeza larga, cónica, 3.3 a 3.4 en la longitud patrón; hocico poco prolongado más allá de los maxilares, 2.9 a 3.0 en la longitud cefálica; ojos 5.7 a 5.8 en la cabeza; boca horizontal pequena, el maxilar llega o pasa ligeramente al margen anterior de la pupila; dientes en bandas sobre las mandíbulas, poco más alargados los de la serie externa de la mandíbula superior; preopérculo con un borde membranoso y algunos dientes separados y cortos. Altura máxima 4.5 a 4.7 en la longitud patrón. D X-1, 22-24: A 1, 7. Escamas 80 a 85 en una serie longitudinal por sobre la línea lateral. Branquiespinas cortas y romas 3 a 5 sobre la rama inferior del primer arco y cerca del ángulo. Pectorales a menudo cortas y amplias, pasando ligeramente el extremo de las pélvicas, 1.4 en la longitud cefálica. Caudal con el lóbulo superior más alargado. Color. Dorso azuloso, flancos grisáceos, vientre pálido plateado. No presenta estrías ni reticulaciones. Aletas dorsal y caudal con algunas puntuaciones; pectorales y pélvicas grises; anal pálida. Distribución. En el Océano Pacífico, desde Sinaloa, Golfo de California, México, hasta Panamá; puede llegar a Colombia, En el área de estudio: Laguna de Chautengo. Material examinado. 2 ejemplares de 146 a 189 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000.733/.734 (Gro.) Observaciones. Como en la mayoría de los peces del Pacífico mexicano, en Menticirrhus elongatus existe confusión en su nombre vulgar. Berdegué (1954 y 1956) señala que recibe el nombre de "chano" y "boca dulce en la región de Guaymas, el de "berrugato" en Mazatlán y el de "gurrubata" en México D. F. En la costa de Guerrero recibe el nombre de "berrugato", "boca dulce" y "corvina". Estos últimos nombres también fueron reconocidos por Ramírez-Hernández y Páez (1965). En el sistema lagunar estudiado correspondió a una especie rara. Los dos ejemplares capturados eran adultos sexualmente inmaduros. Menticirrhus elongatus puede penetrar a las lagunas en busca de alimento pero sus hábitos son preferentemente de playas arenosas abiertas. Por su poca frecuencia y abundancia carece de importancia económica en las lagunas de Guerrero. Anterior a este trabajo, Amezcua-Linares (1977) considera a esta especie entre la ictiofauna de un sistema lagunar de Sinaloa, 75) Menticirrhus nasus (Günther, 1869) N. Y. "Berrugato", "Boca dulce(Lám. 25, Fig. 4) Umbrina nasus Günther, Trans. Zool. Soc. London, 1869, 6:387 y 426. Menticirrhus simus Jordan y Eigenmann, Rept. U. S. Fish Comm., 1886 (1889), 11:427. Menticirrhus nasus ó Menticirrus nasus Jordan y Gilbert, Bull, U. S. Fish. Comm., 1882 (1883), 2.107 y 111; Gilbert y Starks, Mem. Cal. Ac. Sci., 1904: 133; Jordan y Evermann, Bull. 11. S. Nat. Mus., 1898, 47: 1473; Meek y Hildebrand, Field Mus. Nat. Hist. Publ. Zool. Ser., 1925, 15(226):668-669; Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:351; Berdegué, Secretaría de Marina, Dir. Gral. Pes. Ind. Con., 1956: 226, fig. 164; Ramírez-Hernández y Páez, An. Inst. Nal. Inv. Biol.-Pesq,, 1965, 1:343; Castro, Arvizú y Paéz, Revta. Soc. mex. Hist. Nat., 1970, 13: 146; Amezcua-Linares, Tesis profesional Fac. Ciencias Univ. Nal. Autón. México, 1972: 149-150, lám. 10, fig. 1; Chirichigno, Inf. Inst. Mar Perú-Callao, 1974, 11:247 y 340. Diagnosis. Cuerpo alargado, ligeramente comprimido, dorso bajo. Cabeza larga, cónica, 3.2 a 3.6 en la longitud patrón, hocico largo y semipuntiagudo rebasando el maxilar una distancia igual 0.5 a 0.7 en la órbita, 3.1 a 3.5 en la longitud cefálica; ojos 4,2 a 5.1 en la cabeza; el maxilar llega a la mitad del ojo; preopérculo con un borde membranoso; una sola barba gruesa sobre la región anterior de la mandíbula inferior. Altura máxima 3.5 a 4.4 en la longitud patrón. D X-1, 21-23; A 1, 8 (raramente 9). Escamas 53 a 64 en una serie longitudinal por sobre la línea lateral. Pectorales largas, rebasan el extremo de las pélvicas, 1.2 en la longitud cefálica. Caudal con el lóbulo superior más alargado. Color. Dorso gris, vientre pálido. Aletas intensamente oscuras a excepción de la dorsal blanda y las pélvicas que son más claras. Distribución. En el Océano Pacífico, desde Sinaloa, México, hasta Perú. En el área de estudio: Lagunas de Chautengo y Potosí. Material examinado. 5 ejemplares de 180 a 220 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México, Catálogo CCML-PF 0.000.735 (Gro.) Observaciones. Menticirrhus nasus se diferencia básicamente de M. elongatus, por la menor altura corporal, la carencia de branquiespinas bien desarrolladas, el mayor número de rayos anales, el menor número de escamas en series longitudinales y el mayor tamafio de las aletas pectorales. Ésta especie también fue rara en el sistema lagunar estudiado. Los ejemplares capturados eran adultos sexualmente inmaduros que penetraron eventualmente a las lagunas durante el período 1 en busca de alimento. Por su poca frecuencia y abundancia carece de importancia económica en los ecosistemas estudiados. Anterior a este trabajo, Amezcua-Linares (1972) considera a esta especie entre la ictiofauna de un sistema lagunar de Nayarit. Como todas las especies de Menticirrhus, esta especie es frecuente en los lances camaroneros en la costa del Pacífico mexicano y frecuenta fondos lodosos y arenosos. Familia XXV. Kyphosidae (Cyphosidae) Género 43. Kyphosus Lacépéde, 1802 76) . Kyphosus elegans (Peters, 1869) N. v. "Chopa", "Salema", "Chopa gris"(Lám. 26, Fig. 1) Pimelopterus elegans Peters, Monatsb. K. Ak. Wiss. Berlin, 1864: 707. Pimelopterus sandvicensis Sauvage, Bull. Soc. Philom., 1880, 4(7):221. Kyphosus elegans (Peters); Jordan y Evermann, Bull. U. S. Nat. Mus., 1898, 47:1387; Gilbert y Starks, Mem. Cal. Ac. Sci., 1904, 4:116; Kendall y Radckiffe, Mem. Mus. Comp. Zool. Harv., 1912, 35:118; Meek y Hildebrand, Field Mus. Nat. Hist. Publ. Zool. Ser., 1925, 15(226):607, lám. 64; Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:339; Berdegué, Secretaría de Marina, Dir. Gral, Pes, Ind. Com., 1956: 246-248, fig. 171; Ramírez-Hernández y Páez, An. Inst. Nal. Inv. Biol-Pesq., 1965, 1:343; S. 1. C., Catálogo de Peces Marinos Mexicanos, 1976: 110 y 348; Holguín-Quiñones, Inst. Nal. Pes., 1976: 93. Diagnosis. Cuerpo profundo, comprimido, peril anterior convexo. Cabeza no más larga que su profundidad, 3.0 a 3.7 en la longitud patrón; hocico pequeño a moderado 2,8 a 3. 8 en la longitud cefálica; ojos 3.0 a 3.6 en la cabeza; boca pequeña, la niandíbula inferior ligeramente incluída, el maxilar puede rebasar ligeramente el margen anterior de órbita, 3.0 a 3.2 en la longitud cefálica; dientes aplanados, fuertes, alrededor de 38 en la mandíbula superior. Altura máxima 1.9 a 2.3 en la longitud patrón. D XI, 13; A 111, 12. Escamas 58 a 62 en una serie longitudinal por debajo de la línea lateral. Branquiespinas delgadas 14 a 17 sobre la rama inferior del primer arco. Los rayos dorsales y anales difíciles de contar por estar muy revestidos de tegumento. Pectorales cortas insertadas por delante de las pélvicas, 1.3 a 1.7 en la longitud cefálica. Color. Dorso gris oscuro, flancos grices claro, vientre pálido. Aletas oscuras, igual que el cuerpo, exceptuando las pélvicas que son pálidas o blanquecinas. Distribución. En el Océano Pacífico, desde el Golfo de California, México, hasta Panamá; puede llegar a Colombia e Islas Galápagos. En el área de estudio: Laguna de Chautengo. Material examinado. 1 ejemplar de 286 nim de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000. 736. Observaciones. Kyphosus elegans es una especie muy rara en el sistema lagunar costero de Guerrero. Se encontró solamente un ejemplar durante el periodo 1 de la laguna de Chautengo. Se diferencia de K. analogus (Gill) , la otra especie del Pacífico, porque K. analogus posee 14 rayos dorsales y la anal y dorsal blandas muy alargadas. Ramírez-Hernández y Páez (1965) la incluyen entre la lista de peces marinos de Guerrero y Holguín-Quiñones (1976) la registran entre los peces de importancia comercial en la costa de Baja California Sur pero haciendo la salvedad de que su pesquería es incipiente. Sus hábitos alimenticios lo ubican como un consumidor primario del tipo omnívoro. Es una especie intranscendente en la estructura de las comunidades estudiadas. Familia XXVI. Cichlidae Género 44. Cichlasoma Swainson, 1792 77) Cichlasoma trimaculatum (Günther, 1868) N. v. "Charro", "Mojarra prieta"(Lám. 26, Fig. 2) Heros trimaculatum Günther, Trans. Zool. Soc. London, 1868, 6:461, lám. 76; Jordan y Evermann, Bull. U. S. Nat. Mus., 1896,17:1592 y 1530. Parapetenía trimaculata; Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:420. Cichlasoma trimaculatum (Günther) Álvarez, Com. Nac. Cónsul. Pes. Inst. Nal. Inv. Biol.-Pesq., 1970; 144. Diagnosis. Cuerpo relativamente profundo, suavemente comprimido. Cabeza alargada 2.7 en la longitud patrón; hocico más pequeño que la distancia postorbital; ojos 5,0 en la longitud cefálica; espina del premaxilar (proceso ascendente) un medio de la mitad de la longitud cefálica; caninos fuertes; última espina dorsal 2.1 a 2.7 en la cabeza; base de la dorsal con vaina escamosa; el ápice de las pectorales no llega al origen de la anal. Altura máxima 2.0 a 2.3 en la longitud patrón. D XVII, 11; A VI-VIII, 9. Escamas 30 a 31 en una serie longitudinal. Color. Pardo verdoso olivo, con tres manchas obscuras en cada flanco, una sobre el origen de la línea lateral, otra en la mitad del costado y la tercera en la base de la caudal; el resto de las manchas son poco definidas. Distribución. Vertientes del Pacífico de Guerrero, México, hasta Guatemala. En el área de estudio: Lagunas Salinas de Apozahualco, Chautengo, Tecomate, Tres Palos, Coyuca, Mitla, Nuxco, Salinas del Cuajo y Potosí. Material examinado. 384 ejemplares de 38 a 236 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México, Catálogo CCML-PF 0.000.737/.743 (Gro.). Observaciones. Los Cichlasoma no poseen dientes viliformes en la serie externa, el proceso ascendente del premaxilar es menor que la longitud cefálica y nunca poseen más de 36 escamas en una serie longitudinal. Estos son caracteres fundamentales para distinguirlos de las especies del género Petenia el único otro género de cíclidos de la fauna ictiológica de México, también con abundantes especies (Álvarez, 1970), pero Miller (1976), por otra parte, considera que tres son los géneros de Cíclidos con especies en México (i.e., Cichlasoma, Neotroplus y Thorichthys) Cichlasoma es el género que presenta el mayor número de especies entre los peces de agua dulce mexicanos; aproximadamente 15 (Miller, 1976). En nuestros estudios C. trimaculatum es una de las especies con más amplia distribución en las lagunas de Guerrero, y es característica, en mayor o menor grado, de la ictiofauna del sistema lagunar. Aun cuando no se recolectaron muchos ejemplares, en relación a su gran abundancia, por información de los pescadores se sabe que su frecuencia es común y su carne es apreciada, por lo que puede representar un recurso económico importante. En el capítulo de relaciones tróficas y aspectos generales de dinámica de poblaciones de este trabajo se estudia a esta especie en forma particular. Cichlasoma trimaculatum es uno de los componentes dulceacuícolas en la estructura de las comunidades y sus hábitos alimenticios la ubican como un consumidor primario del tipo omnívoro. Género 45. Tilapia Smith, 1849 78). Tilapia cf. mossambica Peters, 1852 N. v. "Tilapia", "Mojarra de agita dulce"(Lám. 26, Fig. 3) Tilapia mossambica Peters; Vaas, y Hofstede, Contr. Inl. Fish. Res. Stat. Bogor., 1952,1-1-68; Chimits, FAO Fish. Bull., 1955, 8(1).-133; Chimits FAO Fish. Bull., 1957, 10(1): 1-24; Gopalakrishnan, Coastal Aguaculture in the Indo-Pacific Region, 1972: 142-143. Diagnosis. Cuerpo relativamente profundo y robusto. Cabeza 2.7 a 3.0 en la longitud total; hocico redondeado, tan amplio como largo; ojos 4.5 a 6.5 en la longitud cefálica; boca grande casi tan amplia como la cabeza, llegando hasta el margen anterior del ojo; dientes en 4 a 8 series, 60 a 100 en la serie externa de la mandíbula superior. Altura máxima 2.5 a 2.8 en la longitud total. D XV-XVIII, 10-12; A III-IV, 910. Escamas grandes 29 a 32 sobre la línea lateral. Branquiespinas cortas, 17 a 20 sobre la rama inferior del primer arco. última espina dorsal larga 0.3 a 0.4 en la longitud cefálica. Pectorales del largo, o casi del largo, de la cabeza, alcanzando hasta el ano y el origen de la anal. Caudal redondeada y truncada en los juveniles. Color. Dorso cafesoso, oliva o negrusco, Aletas dorsal y caudal oscuras a veces marginadas de amarillo; pélvicas oscuras. Algunas barras delgadas y poco definidas de color oscuro sobre el pedúnculo caudal. Distribución. Su distribución natural es en África Oriental. Ha sido introducida en diversos países. En el área estudiada: Laguna de Tres Palos. Material examinado. 5 ejemplares (2 adultos y 3 juveniles) . Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México, Catálogo CCML-PF 0.000.744/.745 (Gro.). Observaciones. Esta especie de origen dulceacuícola ha sido introducida premeditadamente o por accidente en el sistema lagunar estudiado, particularmente en la Laguna de Tres Palos. Gopalakrishnan (1972) señala que Tilapia mossambica es la única especie de "tilapia" cultivada en aguas salobres en Indonesia, Malasya, India, Burma, Pakistan, Yáñez-Arancibia (1976b y 1976c) la incluye entre la lista de especies con perspetivas de cultivos en las lagunas costeras mexicanas. Tilapia mossambica se desarrolla óptimamente en rangos de temperaturas entre 20 y 350C y puede reproducirse en aguas dulces o salobres y tolerar salinidades hasta de 30‰ o más. Sus hábitos alimenticios la ubican como un consumidor primario del tipo omnívoro, consumiendo una gran variedad de plantas y animales; los juveniles se suelen alimentar de diatomeas, algas verdes y pequeños crustáseos; los adultos incluyen en su dieta plancton, vegetación variada y detritus. Vaas y Hofstede (1952) y Gopalakrishanan (1972) discuten amplios aspectos biológicos y ecológicos de esta especie, por sus perspectivas de cultivos en aguas de temperaturas y salinidades variables. En el área estudiada sólo se le colectó en la laguna de Tres Palos y por su poca frecuencia y abundancia no es una especie transcendente en la estructura ictiofaunística de esa laguna. Al parecer ha sido introducida muy recientemente y puede esperarse que aumente considerablemente sus poblaciones. Situaciones de esta naturaleza en forma no controlada deben evitarse puesto, que los daños sobre la fauna indígena pueden ser mucho más grande que los beneficios (Zaret y Paine, 1973) . Familia XXVII, Pomacentridae Género 46. Abudefduf Forskal, 1775 79) . Abudefduf saxatilis (Linnaeus, 1758) N. v. "Chopa", "Señorita"(Lám. 26, Fig. 4) Chaelodon saxatilis Linnaeus, Syst. Nat., Ed. X, 1758: 276. Chaetodon sargoides Lacépéde, Hist. Nat. Poiss., 1803, 1:471, lám. 10, fig. 3. Glyphisodon moucharra Lacépéde, Hist. Nat. Poiss., 1803, 1:543. Glyphisodon saxatilis Cuvier y Valenciennes, Hist. Nat. Poiss., 1830, 5:446; Gilbert y Starks, Mem. Cal. Ac. Sci., 1904, 4:143. Glyphisodon troshelii Gill, Proc, Ac, Nat. Sci. Phila., 1862: 150, Abudefduf declivifrons Kendall y Radcliffe, Mem. Mus. Comp. Zool. Harv., 1912, 35:135; Fowler, Proc. Ac. Nat. Sci. Phila., 1916: 410. Abudefduf mauritii Fowler, Proc. Ac. Nat. Sci. Phila., 1916: 405 y 410, 1917: 133. Abudefduf saxatilis (Linnaeus), Jordan y Evermann, Bull. U. S. Nat. Mus., 1898, 47:1561, lám. 234, fig. 590; Kendall y Radcliffe, Mem. Mus. Comp. Harv., 1912, 35:134; Meek y Hildebrand, Field Mus. Nat. Hist. Publ. Zool. Ser., 1925, 15(226):701-702, lám. 70; Hildebrand, Bull. U. S. Nat. Mus., 1946, 189:338-340; Ramírez-Hernández y Arvizú, An. Inst. Nal. Inv. Biol. Pesq., 1965, 1:311; Ramírez-Hernández y Páez, An. Inst. Nal. Inv. Biol.-Pesq., 1965, 1:344; S. I.C., Catálogo de Peces Marinos Mexicanos, 1976: 112 y 361. Diagnosis. Cuerpo profundo, ovalado, comprimido, dorso elevado. Cabeza corta 2.7 a 3.5 en la longitud patrón; hocico corto 3.8 a 4.2 en la longitud cefálica; ojos 2.4 a 3.6 en la cabeza; boca pequeña el maxilar ligeramente alcanzando el margen anterior del ojo en los adultos; dientes en una sola serie contínua, aplanados y suavemente bífidos; preopérculo, liso. Altura máxima 1.5 a 1,9 en la longitud patrón. D XII, 13-14 (raramente 12) ; A 11, 11-12 (raramente 10) ; P 19-20. Escamas 26 a 28 en series verticales en el centro de los flancos. Branquiespinas 16 a 21 (generalmente 18 o 19) sobre la rama inferior del primer arco. Pectorales amplias con el margen suavemente convexo, tan largas como la cabeza 2.8 a 3.6 en la longitud del cuerpo. Color. Dorso obscuro cafesoso de tonalidades variables en los diferentes especímenes. Los flancos con 5 barras oscuras verticales; los juveniles con un lunar delante de los rangos de la dorsal blanda y puntos azules sobre la cabeza y en la base de la dorsal y anal. Pectorales verdosas con la axila negra. Distribución. En ambas costas de América. En el Océano Pacífico des-de Baja California, México, hasta Perú. En el Atlántico desde Rhode Island, EEUU, hasta Uruguay, En el área de estudio: Lagunas de Salinas de Apozahualco y Potosí. Material examinado 11 ejemplares de 12 a 29 mm de longitud total, Colección de referencia depositada en el Laboratorio de lctiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000.746/.753 (Gro.). Observaciones. Hildebrand (1946) encontró variaciones entre Abudefduf saxatilis de Perú y de Panamá Los de Perú son de color más oscuro, poseen los lóbulos de la dorsal, caudal y anal menos fuertemente angulados, y los dientes son mucho más amplios y definitivamente bicúspidos. Las variaciones merísticas y morfométricas en un gradiente clinal son relativamente comunes entre los peces y bastante conspicuos en la familia Pomacentridae (Yáñez-Arancibia, 1975c) . Esta especie fue colectada en las bocas de las lagunas de Salinas de Apozahualco y Potosí, en ambos casos entremezclados en una colonia (le elorofitas de los géneros Enteromorpha y Chaetomorpha. Por otra parte se conoce que los Pomacentridae son consumidores primarios del tipo omnívoro y eventualmente predominantemente hervívoros. La especie parece rara y poco frecuente en el sistema lagunar estudiado. Corresponde a un componente marino estenohalino. Como su reproducción es en la zona litoral eventualmente pueden encontrarse algunos ejemplares en la proximidad de las lagunas y aún adentrarse un poco en sus bocas. De acuerdo a Ramírez-Hernández y Arvizú (1965) yS.I.C. (1976) existirían al menos otras dos especies de Abudefduf en el Pacífico mexicano, i. e., troschelii (Gill) y declivifrons (Gill) Suborden Mugiloidei Familia XXVIII. Mugilidae Género 47. Mugil Linnaeus, 1758 80). Mugil cephalus Linnaeus, 1758 N. v. "Lisa", "Lisa macho", "Lisa cabezona".Mugil cephalus Linnaeus, Syst. Nat., Ed. 10, 1758: 316. Mugil albula Linnaeus, Syst. Nat., Ed. XII, 1766: 520. Mugil lineatus MitchilI, in Cuvier y Valenciennes, Hist. Nat. Poiss., 1836, 11:71(96). Mugil rammelsbergii Tschudi, Fauna Peruana, Ichth., 1845: 20, Mugil berlandieri Girard, U. S. and Mex. Bound, Surv., 1859: 20, lám. 10, figs. 1-4. Mugil quentherii Gill, Proc. Ac. Nat. Sci. Phila., 1863, 21:169 (no la de Steindachner). Mugil mexicanus Steindachner, Ichth. Beitr., 1875, 3:58. Mugil cephalus Linnacus, Jordan y Evermann, Bull. U. S. Nat. Mus., 1896, 47: 811, lám. 126, fig, 343; Meek y Hildebrand, Field Mus. Nat. Hist. Publ. Zool. Ser., 1923, 15 (215):275-276; Jordan, Evermann y Clark, U.S. Bureau of Fisheries, 1930, 2:252; Hildebrand, Bull. U.S. Nat. Mus., 1946, 189:422-424; Berdegué, Secretaría de Marina, Dir. Gral. Pes. Ind. Con., 1956: 127-129, fig. 123; Álvarez y Cortés An. Esc. nac. Cienc. biol. Méx., 1962, 11(1-4):128-129; RamírezHernández y Arvizú, An. Inst. Nal. Inv. Biol.-Pesq., 1965, 1:305; Álvarez, Com. Nac. Consul. Pes. Inst. Nal. Inv. Biol.-Pesq., 1970: 119; Castro, Arvizú y Páez, Revta. Soc. mex. Hist. Nat., 1970, 31:133; Reséndez, An. Inst. Biol, Univ. Nal. Autón. México Ser. Cienc. del Mar y Limnol 1970, 41(1):132-133 fig. 49 y Revta. Soc. mex. Hist. Nat., 1973, 34:258-261, fig. 50; Gopalakrishnan, Coastal Aquaculture in the Indo Pacific Region, 1972: 132-134; Miller y Lea, Fish. Bull. Cal. Dept. Fish Game, 1972, 157:167; Amezcua-Linares, Tesis profesional Fac. Ciencias Univ. Nal. Autón. México, 1972: 164-166, Lám. 11, fig. 3; y An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, 1977, 4(1):1-25; Kobelkowsky y Reséndez, An. Inst. Biol. Univ. Nal. Autón. México Ser. Cienc. del Mar y Limnol., 1972, 43(1)33-84, 31 láms.; Chirichigno, Inf. Inst. Mar Perú-Callao, 1974: 44:161 y 341; Holguín-Quiñones, Inst. Nal. Pes., 1976: 95; S. 1. C., Catálogo de Peces Marinos Mexicanos, 1976: 78 y 171. Diagnosis. Cuerpo oblongo, robusto, algo comprimido; línea ventral ligeramente más convexa que el dorso Cabeza ancha, apenas más alta que amplia, 3.6 en la longitud patrón y 4.5 a 4.7 en la longitud total; hocico corto 4.0 a 5.0 en la longitud cefálica; ojos 3,2 a 3.3 en la cabeza con un párpado adiposo muy desarrollado en los adultos; el maxilar llegando al borde de la órbita, 3.8 a 4.1 en la longitud cefálica., dientes secundarios siempre bífidos en batidas anchas (3 ó 4 filas) y presentes en la mándibula superior (en todas las edades) y en la inferior (en los adultos) Altura máxima 3,4 a 4.4 en la longitud patrón y 5.3 a 5.6 en la longitud total, D IV-V, + 1, 6-8; A 111, 8; V 1, P 15-18; C 18-20. Escamas en una serie longitudinal 37 a 44 generalmente 41 a 44. Branquiespinas delgadas haciéndose muy cortas anteriormente alrededor de 73 sobre la rama inferior del primer arco en especímenes entre 350 y 380 mm. Pectorales llegan a la base de las ventrales, pero no al origen de la primera dorsal, 1.3 a 1.5 en la longitud cefálica. Vértebras 24, la segunda dorsal y la anal sin escamas. Color. Pardo azulado en el dorso aclarándose hacia los flancos. Costados con cuatro líneas longitudinales siguiendo la serie de escarrias; vientre pálido. Pectorales, dorsales y caudal obscuras; ventrales y anal pálidas amarillentas. Distribución. En ambas costas de América, desde Cabo Cod. hasta Brasil en el Océano Atlántico y desde Monterrey, California, hasta Chile en el Pacífico. Se ha reportado también en Hawaii y Japón. En el área de estudio: Lagunas de Safinas de Apozahualco, Chautengo, Tecomate, Tres Palos, Coyuca, Nuxco, Salinas del Cuajo y Potosí. Material examinado. 402 ejemplares de 103 a 324 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000.753/,757 (Gro.). Observaciones. M. cephalus se diferencia notoriamente de las otras especies de Mugil por la amplitud de la cabeza, el dorso azul obscuro y líneas longitudinales oscuras en los flancos. Los Juveniles pueden presentar la aleta dorsal D II 9. Se le denomina "lisa cabezona" en el noroeste de México y "mullets" como en Estados Unidos. Es una especie muy abundante en bahías, esteros y lagunas de aguas salobres. Berdegué (1954 y 1956) ha mencionado que es una de las especies más importantes del grupo de las "lisas" consumiéndose sus huevos junto a ejemplares frescos y secos. Ramírez-Hernández (1965) la señala como la especie de mayor importancia económica en la familia Mugilidae, y también han indicado su importancia Ramírez-Hernández y Arvizú (1965). Estudios posteriores de Álvarez (1970), Carratiza y Amezcua-Linares (1971) y Amezcua-Linares (1972) hacen ver su importancia comercial, su distribución cosmopolita de mares cálidos y templados, su ocurrencia en aguas dulces y/o salobres de ambas costas de México y sus hábitos filtradores de detritus y plancton. Gophalakrishnan (1972) ha sintetizado una buena información taxonómica y biológica para esta especie. Ese mismo autor agrega que Mugil cephalus tolera rango de salinidades de 0 a 75‰ y rangos de temperaturas de 12 a 25°C, este último dato puede ampliarse por cuanto en el sistema lagunar costero de Guerrero se le ha colectado en aguas de 30°C. Investigaciones sobre su crecimiento en cultivos de agita dulce han indicado que puede ser de 400 mm en un año y de 2.2 a 2.7 Kg de peso en 2 años. Sin embargo el ritmo promedio normal sería de 140 mm el primer año, 240 mm en el segundo, 330 mm en el tercero y 390 en el cuarto (Gopalakrishnan, 1972). Patnaik (1966) agrega que la alimentación de esta especie se basa en microalgas, detritus, pequenos crustáceos, foraminíferos y sedimentos, inorgánicos. En el capítulo de relaciones tróficas y aspectos parciales de la dinárnica de las poblaciones de este trabajo, se discute la alimentación de esta especie comparándola con Mugil curema y otras 3 especies de Mugil. Su posición trófica y sus rangos de tolerancia a la salinidad y a la temperatura son antecedentes que considera Yáñez-Arancibia (1976 b y 1976 c) para incluirla entre las especies en perspectivas de cultivos en lagunas costeras mexicanas, áreas que utiliza la especie para su crianza natural. Es una de las especies que por distribución y frecuencia caracteriza al sistema lagunar estudiado pero es menos abundante que Mugil curema. 81) Mugil curema Valenciennes, 1836 N. v.: ''Lisa'', "Lisa blanca", "Lebrancha"(Lám, 27, Fig. 1) Mugil curema Valenciennes in Cuvier y Valenciennes, Hist. Nal. Poiss., 1836, 11:64(87). Mugil petrosus Cuvier y Valenciennes, Hist. Nal. Poiss., 1836, 11:65(89). Myxus harengus Günther, Cal. Fish. Brit. Mus., 1861, 3:467. Querimana curema Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:253. Mugil curema Valenciennes; Jordan y Evermann, Bull. U. S. Nat. Mus., 1896, 17:813, lám. 126, fig. 344; Gilbert y Starks, Mem. Cal. Ac. Sc¡., 1904, 1:60; Meek y Hildebrand, Field Mus, Nat. Hist. Publ. Zool. Ser., 1923, 15(215):279-280; Hildebrand, Bull. U. S. Nal. Mus., 1946, 189:426-428; Berdegué, Secretaría de Marina, Dir. Gral. Pes. Ind. Con., 1956, 127-130, fig. 124; Álvarez y Cortés, An. Ese. nac. Cienc. biol. Méx., 1962, 11 (1-4):128-129; Ramírez-Hernández y Arvizú, An. Inst. Nal. Inv. Biol.-Pesq., 1965, 1:305, Ramírez-Hernández y Páez, An. Inst. Nal. Inv. Biol. Pesq., 1965, 1:336; Álvarez, Com. Nac. Consul. Pes. Inst. Nal. Inv. Biol. Pesq., 1970: 119; Reséndez, An. Inst. Biol. Univ. Nal. Autón. México Ser. Cienc. del Mar y Limnol., 1970, 41(1):113, fig. 50; y Revta. Soc. mex, Hist. Nal., 1973, 31:258-260, fig. 49; Amezcua-Linares, Tesis profesional Fac. Ciencias Univ. Nal. Autón. México, 1972: 166-167, lám. 11, fig, 4; y An. Centro Cienc. del Mar y Limnol. Univ. Nal, Autón. México, 1977, 4(1):1-25; Kobelkowsky y Reséndez, An. Inst. Biol. Univ. Nal. Autón. México Ser. Cienc. del Mar y Limnol., 1972, 43(1):33-84, 31 láms., Chirichigno, Inf. Inst. Mar Perú-Callao, 1974, 44:163 y 341; S. I. C., Catálogo de Peces Marinos Mexicanos, 1976: 78 y 172; Yáñez-Arancibia, An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, 1976, 3(1):93-124. Diagnosis. Cuerpo oblongo, robusto; línea ventral más convexa que el dorso. Cabeza moderada, baja, suavemente comprimida, en general más alta que amplia, 3.5 a 4.3 en la longitud patrón; hocico corto y a menudo amplio 6.5 a 7.1 en la longitud cefálica; ojos de tamaño variable 3.8 a 4.5 en la cabeza con parpado adiposo en los adultos; el maxilar alcanza el margen anterior de la órbita, 4.0 a 4,7 en la longitud cefálica; dientes secundarios simples y en filas uniseriales o dispersos detrás de la fila principal y no presentes en la mandíbula inferior; mejillas con dos hileras de escamas. Altura máxima 3,8 a 4.4 en la longitud patrón. D IV-1, 8; A 111, 9 (los juveniles 11, 10); P 15. Escamas en una serie longitudinal 35 a 40. Branquiespinas muy numerosas sobre la rama inferior del primer arco, verían con la edad llegando hasta 65. Pectorales no sobrepasan el origen de la primera dorsal, 1.7 a 2.2 en la longitud cefálica. La segunda dorsal y la anal escamadas. Color. Dorso pardo oscuro, sin rayas oscuras longitudinales en los flancos, vientre ligeramente plateado pálido, pélvicas y ánal pálidas. El resto de las aletas oscuras; base y axila de las pectorales oscuras; opérculo plateado. Distribución. En ambas costas de América, desde Cabo Cod hasta Brasil en el Atlántico y desde el Golfo de California, México, hasta Chile en el Pacífico. También hay registros del África Occidental. En el área de estudio: Lagunas Salinas de Apozahualco, Chautengo, Tecomate, Tres Palos, Coyuca, Nuxco, Salinas del Cuajo y Potosí. Material examinado. 2 825 ejemplares de 60 a 276 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000.758/.765 (Gro.). Observaciones. El género Mugil se diferencia de otros géneros de la familia porque no posee dientes viliformes en la mandíbula, pero presenta más de 25 branquiespinas en la rama inferior del primer arco. La distribución de M. curema tanto en el Atlántico como en el Pacífico no ha determinado diferencias significativamente constantes en las poblaciones de ambos oceános; al menos, se ha indicado así después de un estudio de 368 ejemplares en ambas zonas, por Meek y Hildebrand (1923). De las 5 especies de Mugil de México, i. e., M cephalus, M. curema, M. tricodon Poey, M. hospes Jordan y Culver, y M. setosus Gilbert, al menos las 4 primeras penetran aguas continentales (Álvarez, 1970; Amezcua-Linares 1977; Yáñez-Arancibia, 1976 a). Como todas las especies de la familia Mugilidae, M. curema tiene gran importancia económica. De los estudios de Berdegué (1954 y 1956) se desprende que su ocurrencia es más frecuente en el oceáno abierto, constituyendo un gran recurso comercial en el Noroeste de México. Ha sido estudiada por Ramírez-Hernández y Arvizú (1965) con el nombre de "lebrancha", y Ramírez-Hernández y Páez (1965) en sus registros del Pacífico mexicano. Su presencia en sistemas costeros, especialmente de juveniles, ha sido constatada por Carranza (1969 a, b y c) Carranza y Amezcua-Linares (1971), Amezcua-Linares (1972 y 1977) y Yáñez-Arancibia (1976 a), quienes dispusieron de bastantes ejemplares para sus estudios. En la costa Atlántica, Cervigón (1966 a 1967) también indica que M. curema en muchas ocasiones es característica de algunas lagunas costeras con ambiente pelágico litoral, Álvarez (1970) agrega que esta especie suele remontar los ríos y Dahl (1971), señala que ejemplares que remontan ríos por decenas de kilómetros pueden alcanzar unos 60 cm de longitud Ramírez-Hernández (1965) señala que esta especie es muy abundante frente a la costa de Guerrero; de la misma manera, en estos estudios fue recolectada abundantemente en el sistema lagunar costero de Guerrero. En el sistema lagunar estudiado representa un buen recurso pesquero puesto que por sus hábitos penetra a las lagunas al abrirse sus bocas. Su carne es apreciada. Mugil curema utiliza las lagunas CGMO áreas naturales de crianza. Yáñez-Arancibia (1976 a) señala que la alimentación de la especie se basa fundamentalmente en el detritus, de sedimentos inorgánicos y algas filamentosas clorofíceas. En el sistema lagunar costero de Guerrero el ritmo de crecimiento es de aproximadamente 130 mm para el primer año y 100 mm para el segundo año. Asimismo los juveniles penetran a las lagunas con una edad de 6 a 8 meses y abandonan estas áreas con una edad de 18 a 20 meses (Yáñez-Arancibia, 1976 a) Las perspectivas de cultivos de Mugil curema parecerían tener mejores resultados en las lagunas de Tres Palos, Coyuca y Mitla, considerando el amplio rango de tolerancia de la especie a las bajas salinidades. Esas lagunas son grandes cuerpos de aguas casi dulces y ausencia casi absoluta de peces predadores de segundo y tercer orden. En el capítulo de relaciones tróficas y aspectos parciales de la dinámica de las poblaciones principales de este trabajo, se estudia a esta especie en forma particular. M. curema tiene transcedental importancia económica y por su frecuencia y gran abundancia es una de las especies que caracteriza a las comunidades ictiofaunísticas del sistema lagunar estudiado. Suborden Polynemoidei Familia XXIX, Polynemidae Género 48. Polydactylus Lacépède, 1803 82) Polydactylus approximans Lay y Bennet, 1839 N. v.: "Ratón", "Barbudo"(Lám. 27, Fig. 2) Polynemus approximans Lay y Bennet, Bcechey's Voyage, Zool. Fish., 1839: 57. Polynemus californiensis Thominot, Bull. Soc. Philom. Paris Séance, 1886, 10(7):161. Polynemus approximans Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2;256; Hildebrand, Bull. U. S. Nat. Mus., 1946, 189:436-437; Amezcua-Linares, Tesis profesional Fac. Ciencias Univ. Nal. Autón. México, 1972: 168-169, lám. 11, fig. 5; y An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, 1977, 4(1):1-25; Chirichigno, Inf. Inst. Mar Perú-Callao, 1974, 14:158 y 345. Polydactylus approximans Lay y Bennet: Berdegué, Secretaría de Marina, Dir. Gral. Pes, Ind. Com., 1956: 121-122, fig. 121; Ramírez-Hernández y Arvizú, An. Inst. Nal. Inv. Biol.-Pesq., 1965, 1:305; Ramírez-Hernández y Páez, An. Inst. Nal. Inv. Biol.-Pesq., 1965, 1:336; Castro, Arvizú y Páez, Revta. Soc. mex. Hist. Nat., 1970, 31:133; Miller y Lea, Fish. Bull. Cal. Dept. Fish. Game, 1972, 157:168-169; S. I. C., Catálogo de Peces Marinos Mexicanos, 1976: 78 y 173. Diagnosis. Cuerpo alargado, comprimido el cuerpo y el pedúnculo caudal. Cabeza moderada 3.1 a 3.5 en la longitud patrón; hocico cónico proyectado más adelante de la boca 4.5 a 5.5 en la longitud cefálica; ojos 4.0 a 5.5 en la cabeza; boca larga casi horizontal; el maxilar llega más atrás del ojo 2.3 a 2.5 en la longitud cefálica; propérculo aserrado. Altura máxima 3.0 a 3.5 en la longitud patrón. D VIII-1, 13-15; A 111, 14; P 13-14. Escamas 55 a 62 en una serie longitudinal. Branquiespinas moderadamente largas 15 a 17 sobre la rama inferior del primer, arco. Vértebras 24. Pectorales con 5 o 6 rayos libres el primero es el más largo, generalmente llega o pasa ligeramente el origen de la anal; la pectoral es larga de 3.5 a 3.8 en la longitud del cuerpo y de 1.1 a 1.2 en la cabeza. Color. Dorso café verdoso o azulado; flancos y vientre amarillento. Una notoria mancha oscura en el opérculo. Aletas pectorales muy oscuras, filamentos pálidos; las otras aletas con puntuaciones más o menos oscuras. Distribución. En el Océano Pacífico desde los Ángeles California, EE.UU., hasta Perú; incluyendo el Golfo de California y las Islas Galápagos. En el área de estudio: Laguna de Chautengo. Material examinado. 6 ejemplares de 88 a 183 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-P17 0.001.394 (Gro.). Observaciones. Polydactylus approximans debe considerarse un visitante excepcional en el sistema lagunar estudiado siendo un componente marino estenohalino. Sólo fueron colectados 6 ejemplares en agosto de 1976 durante el periodo 1 de la laguna de Chautengo. En el Pacífico existe otra especie de Polydactylus, P. opercularis (Gill) la cual posee 8-9 filamentos pectorales libres, y 68 a 75 escamas en una serie longitudinal, además presenta un menor número de rayos dorsales y anales. Berdegué (1954 y 1956) y Castro et al. (1970) encontraron que Polydactylus approximans es una de las especies más abundantes en el Golfo de California. La especie puede ser colectada en aguas interiores sólo en forma excepcional. No es una especie trascendente en la estructura de las comunidades estudiadas. Suborden Sphyraenoidei Familia XXX. Sphyraenidae Género 49. Sphyraena Klein, 1778 83) Sphyraena ensis Jordan y Gilbert, 1882 N. v.: "Picuda", "Barracuda".(Lám. 27, Fig. 3) Sphyraena ensis Jordan y Gilbert, Bull. U. S. Fish. Comm., 1882, 2:106; Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:255; H¡yama et al., Peces Marinos de la Costa Mexicana del Pacífico, 1940: 30, lám. 7, fig. 3; Berdegué, Secretaría de Marina Dir. Gral. Pes. Ind. Con., 1956: 124-125, fig. 122; Ramírez-Hernández y Arvizú, An. Inst. Nal. Inv. Biol.-Pesq., 1965, 1:305; Ramírez-Hernández y Páez, An. Inst. Nal. Inv. Biol.-Pesq,, 1965, 1:336; Chirichigno, Inf. Inst. Mar Perú-Callao, 1974, 44:185 y 350; S. I. C., Catálogo de Peces Marinos Mexicanos, 1976: 77 y 214. Diagnosis. Cuerpo muy alargado. Cabeza baja y alargada, la profundidad poco mayor que la amplitud; hocico largo y puntiagudo 1.9 a 2.2 en la longitud cefálica; boca grande y ligeramente oblicua; mandíbula inferior ligeramente sobresaliente; dientes grandes caniniformes y puntiagudos. Altura máxima 7.0 a 9.0 en la longitud patrón. D V-I, 9-10. Escamas muy pequeñas 108 a 116 en una serie longitudinal. Aleta caudal bifurcada; pélvicas insertas por delante de la primera dorsal. Color. Dorso plateado café verdoso, vientre plateado. Flancos con unas 20 barras oscuras cruzando la línea lateral, estas barras pueden ser tenues. Distribución. En el Océano Pacífico, desde el Golfo de California, México, hasta Perú. En el área de estudio: Lagunas de Chautengo y Potosí. Material examinado. 4 ejemplares de 187 a 258 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México, Catálogo CCML-PF 0.000.766/.767 (Gro.). Observaciones. Sphyraena ensis es una especie rara en el sistema lagunar estudiado. En estos estudios se le considera un componente marino estenohalino visitante excepcional. Sus hábitos son carnívoros alimentándose de peces y macroinvertebrados. Se diferencia de Sphyraena argentea Girard porque esta especie posee 160 a 170 escamas pequeñas en una serie longitudinal y las aletas pélvicas de posición más abdominal. Berdegué (1954 y 1956), Castro et al. (1970) y Holguín-Quiñones (1976) señalan que S. argentea es más abundante que S. ensis en el Golfo de California. Eso determina que su importancia comercial sea mayor. S. ensis no fue una especie transcendente en la estructura de las comunidades estudiadas y sólo eventualmente pueden penetrar algunos ejemplares durante el periodo 1 de las lagunas, distribuyéndose en la proximidad de las bocas. Suborden Gobioidei Familia XXXI. Gobiidae (incluye Eleotridae) Género 50. Eleotris (Gronow) Bloch y Schneider, 1763 84) Eleotris pictus Kner y Steindachner, 1864 N. v.: "Guavina"(Lám. 27 Fig. 4) Eleotris pictus Kner y Steindachner, Abk., Ak. Wiss. Wien., 1864, 10:18, lám. 3, fig. 1. Eleotris picta Regan, Biol. Centr. Amer. Pisces, 1908, 8; Álvarez, Com. Nac. Consul. Pes., Inst. Nal. Inv. Biól.Pesq., 1970: 151. Culius aequidens Jordan y Gilbert, Proc. U. S. Nat. Mus., 1881, 4:461. Eleotris pictus Kner y Steindachner; Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:437; Amezcua-Linares, Tesis profesional Fac. Ciencias Univ, Nal, Autón. México, 1972: 173-175, lám. 12, fig. 2; y An. Centro Cienc. del Mar y Limnol. Univ. Nal, Autón. México, 1977, 4(1):1-25. Diagnosis. Cuerpo alargado y comprimido en el pedúnculo caudal. Cabeza deprimida 2.9 a 3.5 en la longitud patrón, con el perfil dorsal continuo; hocico 4.8 en la longitud cefálica; ojos muy pequeños cerca de 10.0, en la longitud cefálica; maxilar casi llega al margen posterior de la órbita. Altura máxima 5.0 a 6.0 en la longitud patrón; altura del pendúnculo caudal 3.4 en la longitud cefálica. D VI-1, 8; A 1, 8; Escamas en una serie longitudinal 60 a 70 sobre la línea lateral. Pectorales llegan a poco más de la mitad de la base de la primera dorsal, 1.8 a 1.9 en la longitud cefálica; caudal redondeada. Color. Dorso gris negruzco, flancos grises, vientre más pálido. Aletas oscuras; ventrales pálidas; segunda dorsal y anal con manchas muy oscuras. Distribución. Vertientes del Pacífico, desde California México, hasta Ecuador. En el área de estudio: Lagunas de Chautengo, Tres Palos Coyuca, Mitla y Potosí. Material examinado. 84 ejemplares de 85 a 181 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0,000.768/770 (Gro.). Observaciones. Eleotris pictus no es una especie muy abundante en las lagunas costeras de Guerrero. Anteriormente el género había sido mencionado por Ramírez-Granados (1952), pero sin determinación de especie. Álvarez (1970) ha indicado que E. pictus es una de las especies de Eleotridae que penetra a los ríos en la costa del Pacífico de México. El género incluye numerosas especies, de las cuales E. pictus y E. pisonis Gmelin son dos de las más comunes. E. pisonis se distribuye en la costa del Golfo de México y Centroamérica, presenta de 54 a 57 escamas en una serie longitudinal, la altura máxima 4.0 a 4.6 en la longitud patrón y la cabeza 3.0 a 3.5. Puede agregarse que E. Pictus es una especie frecuente pero no abundante en el sistema lagunar estudiado, En este estudio se le considera un componente dulceacuícola, aun cuando de origen marino, cuyos hábitos alimenticios lo ubican como un consumidor primario del tipo detritívoro. Género 51. Gobiomorus Lacépéde, 1798 85) Gobiomorus maculatus (Günther, 1859) N. v.: "Guavina", "Puritos", "Aboma"(Lám. 27, Fig. 5) Lembus maculatus Günther, Cat. Fish. Brit. Mus., 1859: 505. Philypnus lateralis Jordan y Evermann, Bull. U. S. Nat. Mus., 1898, 17:2195. Eleotris lateralis Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:436. Gobiomorus maculatus (Günther), Álvarez, Com. Nac. Consul. Pes. Inst. Nal. Inv. Biol.-Pesq., 1970: 150-152; Amezcua-Linares, Tesis profesional Fac. Ciencias Univ. Nal. Autón. México, 1972, 170-171, lám. 11, fig. 6; y An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, 1977, 4(1):1-25. Diagnosis. Cuerpo alargado, ligeramente deprimido, anteriormente y moderadamente comprimido hacia el pedúnculo caudal. Cabeza 2.6 a 2.9 en la longitud patrón; hocico 3.2 a 3.8 en la longitud cefálica; ojos pequeños 6.0 a 7.0 en la cabeza; boca grande y oblicua; maxilar 2.5 a 2.8, en la longitud cefálica llega a la mitad del ojo. Altura máxima 4.9 a 5,4 en la longitud patrón. D VI, 1, 9; A 1, 10: Escamas 52 a 57 en una serie longitudinal. Branquiespinas cortas, 16 sobre la rama inferior del primer arco, Pectorales moderadas, 1.5 a 1.9 en la longitud cefálica. Color. Dorso café, vientre pálido; una notoria franja café oscura o negruzca se extiendo desde la base de las pectorales a la base de la caudal. Dorsales, pectorales y caudal oscuras; ventrales y anal pálida. Distribución. En ríos y vertientes de la costa del Pacífico mexicano y América Central desde Sonora hasta Ecuador. En el área de estudio: Laguas de Salinas de Apozahualco, Chautengo, Tecomate, Tres Palos, Coyuca, Mitla y Potosí. Material examinado. 106 ejemplares de 85 a 186 mm de longitud total, Colección de refe rencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo 0.000.771./.778 (Gro.) Observaciones. Jordan y Evermann (1896) señalan a Philypnus lateralis con el nombre de "aboma de mar". Aun cuando esta especie es de origen marino es característica de aguas dulces, su presencia en las lagunas litorales indica que ocasionalmente puede llegar al mar y/o aguas salobres. Taxonómicamente el género ha tenido problemas pero su denominación actual es Gobiomorus. Ramírez-Granados (1952) menciona al género Philypnus para algunas lagunas de Guerrero, pero sin una determinación específica. Según Álvarez (1970) existirían tres especies del género en aguas mexicanas, i.e., G. polylepis Ginsburg, G. dormitor Lacépède, y G. maculatus (Günther). Por su escasa abundancia y tamaño G. maculatus no es un recurso comercial en el sistema lagunar estudiado, sin embargo por su frecuencia y distribución es una de las especies típicas del sistema lagunar estudiado, donde se le considera un componente dulceacuícola y de hábitos alimenticios de consumidor primario del tipo detritívoro. Género 52. Dormitator Gill, 1861 86) Dormitator latifrons (Richardson, 1937) N. v. "Popoyote", "Guavina", "Puyeque"(Lám. 28, Fig. 1) Eleotris latifrons Richardson, Voy. Sulphur. Fishes, 1837: 57, lám. 35, figs. 4 y 5; Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:436. Dormitator latifrons Jordan y Evermann, Bull. U. S. Nat. Mus., 1896, 47:2197; Regan, Biol. Centr. Amer, Pisces, 1908: 9; Álvarez, Com. Nac. Consul. Pes., Inst. Nal. Inv, Biol.-Pesq., 1970. 152; Miller y Lea, Fish. Bull. Cal. Dept. Fish. Game, 1972, 157:184-185; Amezcua-Linares, Tesis Profesional Fac, Ciencias Univ. Nal. Autón. México, 1972: 172-173, lám. 12, fig. 1; Miller, Fieldiana Zoology, 1976, 69(1):23; Amezcua-Linares, An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, 1977, 4(1):1-25. Diagnosis. Cuerpo corto y robusto, ligeramente comprimido. Cabeza ancha de dorso plano 2.8 a 3.1 en la longitud patrón; hocico 3.3 a 3.8 en la longitud cefálica; ojos 4.7 a 5.7 en la cabeza; el maxilar llega al margen anterior de la órbita. Altura máxima 3.0 a 3.3 en la longitud patrón. D VII-1, 8; A 1, 9 (S); P 1, 13-15; V 1, 5 De 30 a 35 escamas en una serie longitudinal. Pectorales de base ancha, los radios medios más largos 1.2 a 1.4 en la longitud cefálica; caudal redondeada. Color. Dorso obscuro azul verdoso, vientre claro; la cabeza presenta 4 barras oscuras irregulares por detrás del ojo y una oblícua a continuación. Aletas pares con puntuaciones oscuras; dorsal con manchas oscuras regulares; caudal con las membranas inter-radiales muy oscuras. Distribución. En las vertientes costeras del Pacífico, desde California, EE. UU., hasta Ecuador y Perú. En el área de estudio se le encuentra en todas las lagunas costeras estudiadas siendo particularmente abundante en Tres Palos, Coyuca y Mitla. Material examinado. 425 ejemplares de SP a 257 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000.779/.786 (Gro.). Observaciones. El género Dormitator es muy abundante en las aguas salobres y costeras, pero de las dos especies de aguas mexicanas: D. maculatus (Bloch) y D. latifrons (Richardson) , la última es menos frecuente. Álvarez (1970), Yáñez-Arancibia (1974, 1975b), Stuardo et al. (1974) y Yáñez-Arancibia y Díaz (1977) han reafirmado que se trata de una especie de origen marino pero especialmente adaptada a vivir en ambientes salobres. Ramírez-Granados (1952) ha mencionado el género en la ictiofauna de algunas lagunas del estado de Guerrero , aunque sin una determinación específica. Las recolecciones hechas en este estudio de muestran que D. latifrons tiene una amplia distribución en las lagunas y por ello representa una de las especies más características, en especial en las lagunas de Tres Palos, Coyuca y Mitla. Sin embargo, su importancia comercial es aún discutible. La otra especie del género existente en México, D. maculatus, tiene una importancia económica mejor definida, al ser utilizada como carnada de pesca en las lagunas de Tamiahua y Alvarado en el Golfo de México (Reséndez, 1970 y 1973), además de ser expendida como alimento en el mercado de Ciudad del Carmen, Camp. (Laguna de Términos) como lo ha constatado el autor de este estudio en observaciones personales En el capítulo de relaciones tróficas y aspectos generales de dinámica de las poblaciones principales se estudia esta especie en forma particular. Yáñez-Arancibia y Díaz (1977) han destacado que la alimentación y hábitos alimenticios de Dormitator latifrons (Richardson) en el sistema lagunar costero de Guerrero, México, se basa fundanientalmente en el detritus y algunos restos vegetales, correspondiendo por lo tanto a un consumidor primario del tipo detritívoro. Sin embargo, de acuerdo a la época del año, a la localidad y a la disponibilidad del alimento, puede comportarse también como un consumidor primario del tipo omnívoro, incorporando en su dieta, anélidos, copépodos y otra microfauna, con cierta proporción. Por su posición trófica compite interespecíficamente con otros peces detritívoros; entre los más importantes Mugil curema, M. cephalus, Gobionellus microdon, Eleotris pictus y Gobiomorus maculatus. Es una especie de fundamental importancia ecológica transformando energía potencial del detritus en energía utilizable por niveles tróficos superiores donde se ubican otros peces, aves acuáticas y eventualmente el hombre. Su abundancia particular en algunas lagunas de características ecológicas similares (Tres Palos, Coyuca, Mitla) sugiere aparentemente que esta especie puede comportarse como un indicador biológico. Género 53. Bathygobius Bleeker, 1878 87) Bathygobius soporator (Cuvier y Valenciennes, 1837) N. v.: "Mapo", "Gobio"(Lám. 28, Fig. 2) Gobius soporator Cuvier y Valenciennes, Hist. Nat. Poiss., 1837, 12:56; Jordan y Evermann, Bull. U. S. Nat. Mus., 1898, 47:2216; Boulenger, Boll. Mus., Zool. Anat. Torino, 1899, 14(34):3; Gilbert y Starks, Mem. Cal. Ac. Sci., 1904, 1:171; Breder, Zoologica, 1925, 4:157, lám. 4. Gobius catulus Girard, Proc. Ac. Nat. Sci. Phila., 1858, 10:169. Gobius mapo Poey, Memorias Hist. Nat. Isla de Cuba, 1861, 2:277. Gobius lacertus Poey, Memorias Hist. Nat. Isla de Cuba, 1861, 2:278. Gobius caroliniensis Gill, Proc. Ac. Nat. Sci. Phila., 1863, 15:268. Evorthodus catulus Jordan y Gilbert, Bull. U. S. Nat. Mus., 1882, (1883) 16:632. Mapo soporator Kendall y Radcliffe, Mem. Mus. Camp. Zool. Harv., 1912, 35:147; Fowler, Proc. Ac. Nat. Sci. Phila., 1916, 405 y 411. Bathygobius soporator (Cuvier y Valenciennes); Meek y Hildebrand, Field Mus. Nat. Hist. Publ. Zool, Ser., 1925, 15(249):867-868; Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:440; Hildebrand, Bull. U. S. Nat. Mus., 1946, 189:380-381; Ramirez y Arvizú An. Inst. Nal. Inv. Biol-Pesq., 1965, 1,313; Castro, Arvizú y Páez Revta. Soc. mex. Hist. Nat., 1970, 31:158; Reséndez, Revta. Soc. mex. Hist. Nat., 1973, 34:267269, fig. 56; S. I. C., Catálogo de Peces Marinos Mexicanos, 1976: 120 y 390. Diagnosis. Cuerpo alargado, comprimido posteriormente. Cabeza amplia 2.9 a 3.5 en la longitud patrón; hocico corto y romo 3.0 a 4.2 en la longitud cefálica; ojos 3.5 a 4.9 en la cabeza; boca moderada, terminal, ligeramente oblicua, mandíbula llegando, hasta cl margen anterior de la pupila, dientes puntiagudos en las mandíbulas dispuestas en amplias bandas; porción anterior de la lengua con una notoria hendidura; aletas pectoraIes con los radios superiores libres a manera de sedas. Altura máxima 4.0 a 5.3 en la longitud patrón. D VI-I, 8-9; A 1, 8. De 35 a 40 escamas en una serie longitudinal. Numerosos poros y papilas sobre la cabeza. Aleta caudal redondeada, pectorales amplias y redondeadas con los rayos centrales más largos y los superiores con las terminaciones libres, 1.1 a 1.4 en la cabeza. Color. Dorso, cafesoso, mentón blanquecino, flancos con banners cruzadas. Cabeza café uniforme y una mancha negra lateral detrás del ojo. Aletas dorsales y anal oscuras; pectorales y disco pélvico de color blanquecino. Distribución. En ambas costas de América tropical. En cl 0céano Atlántico desde Carolina del Norte y Golfo de México hasta las Antillas y Brasil. En cl Pacífico desde cl norte de California hasta Perú En cl área de estudio: Laguna de Chautengo. Material examinado. 2 ejemplares de 18 a 35 mm de longitud total. Colección de referencia depositada en cl Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnologia de la Universidad Nacional Autónoma de México Catálogo CCML-PF 0.000.787 (Gro). Observaciones Reséndez (1973) subraya que han sido reconocidas, al menos, 4 subespecies de Bathygobius soporator, i. c., B. s. catulus, B. s. soporator, B. s. longiceps y B. s. sextaneus. No Obstante, en este estudio sólo se hizo una determinación a nivel específico porque se dispuso solamente de 2 ejemplares. Castro et al. (1970) encontraron que esta especie es abundante en las pozas de merea don habita debajo do piedrecillas, en cl Apollo de California. Sin embargo. en cl sistema lagunar estudiado en Guerrero Bathygobius soporator es una especie rara e intranscendente en la estructura de las comunidades ictiofaunísticas. Sus hábitos alimenticios son de consumidor primario preferentemente detritivoro y es un visitante excepcional en las lagunas estudiadas. Dos rasgos morfológicos son característicos de esta especie, en primer lugar una clara contricción en el extremo anterior de la lengua y, luego, los radios superiores de las pectorales con terminaciones libres. Jordan y Evermann (1898) indican una gran cantidad de sinónimos y la confusión que sobre ello ha existido, a causa de la heterogencidad de la coloraci6n observada en esta especie. Exis ten ejemplares oscuros y claros, los claros presentan manchas o barras oscuras. Aleta dorsal y caudal con manchas o barras oscuras; anal con las mismas tonalidades y el margen pálido; pélvicas y pectorales pálidas o suavemente oscuras en la base. Aún cuando la especie se encuentra en ambas costas de América, Meek y Hildebrand (1928) no encontraron diferencias morfológicas notables entre los ejemplares de las poblaciones del Atlántico y el Pacífico, pero los del Pacífico presentan una coloración más oscura. Ramírez-Hernández y Arvizú (1965) reportan a Bathygobius soporotor para la costa noroccidental de México sin asignarle algún nombre vulgar. Sin embargo, en la costa de Guerrero se les denomina vulgarmente como "mapo". La especie carece de importancia comercial. Género 54. Microgobius Poey, 1876 88) Microgobius miraflorensis Gilbert y Starks, 1904(Lám. 28, Fig. 3) Microgobius miraflorensis Gilbert y Starks, Mem. Cal. Ac. Sci., 1904, 4; 176, lám. 29, fig. 54; Meek y Hildebrand, Field Mus. Nat. Hist. Publ. Zool. Ser., 1928, 15(249):873; Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:444; Álvarez, Com. Nac. Consul. Pes. Inst. Nal. Inv, Biol.-Pesq., 1970: 155; Amezcua-Linares Tesis profesional Fac. Ciencias Univ. Nal. Autón. México, 1972. 175-176, lám. 12, fig, 3. Diagnosis. Cuerpo alargado comprimido, perfil dorsal casi recto. Cabeza ancha y larga 3.0 a 3.7 en la longitud total; hocico 3.0 a 3.5 en la longitud cefálica; ojos 3.1 a 3.6 en la cabeza; boca grande y oblicua; maxilar en los machos 1.5 a 1.6 y en las hembras 2.2 a 2.3 en la longitud cefálica; dientes en 2 hileras siendo alargados y curvos los de la serie externa. Altura máxima 4.6 a 4.8 en la longitud patrón, D VII-1, 16-17; A 1, 16-17. De 42 a 52 escamas en una serie longitudinal. La primera aleta dorsal con las espinas tercera, cuarta y quinta muy alargadas en los machos, sus extremos casi llegan a los extremos de la caudal, las hembras no presentan estas prolongaciones; disco pélvico ligeramente mayor en los machos. Color. Dorso gris oliváceo. Una mancha oscuras sobre la base de las pectorales. Aletas relativamente oscuras y el disco evidentemente oscuro y todavía más acentuado en los machos. Distribución. En el Océano Pacífico desde el sur de Sinaloa, México, hasta Panamá, En el área de estudio: Lagunas Chautengo, Tres Palos y Coyuca. Material examinado. 10 ejemplares de 30 a 44 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000.788 (Gro.). Observaciones. Microgobius miraflorensis fue una especie poco abundante en el sistema lagunar costero estudiado y parece restingida a las lagunas más dulceacuícolas. Con anterioridad Álvarez (1970) la reporta para la laguna de Tres Palos y también señala que se le puede encontrar en aguas salobres. La especie es carecterística por sus escamas ctenoides y la ausencia de pliegue cutáneo sobre la nuca y la región occipital. Es un consumidor primario predominantemente detritívoro y carece de importancia comercial en el sistema lagunar costero de Guerrero. Género 55. Gobionellus Girard, 1858 89) Gobionellus microdon (Gilbert, 1891) N. v.: "Purito"(Lám. 28, Fig. 4) Gobius microdon Gilbert, Proc. U. S. Nat. Mus., 1891: 554. Gobionellus microdon Gilbert y Starks, Mem. Cal. Ac. Sci., 1904, 4:171, lám. 28, fig. 51; Meek y Hildebrand, Field Mus. Nat. Hist. Publ. Zool. Ser. 1928, 15(249): 879; Jordan, Evermann y Clark, U. S. Burcau of Fisheries, 1930, 2:441; Ginsburg, Bull. Bingh. Oceanogr. Coll., 1933, 4(2):34-35; Alvarez, Com. Nac. Consul. Pes. Inst. Nal. Inv. Biol.-Pesq., 1970: 153-154; Amezcua-Linares, Tesis profesional Fac, Ciencias Univ. Nal. Autón. México, 1972: 179180, lám. 12, fig. 5; Miller, Fieldiana Zoology, 1976, 69(1):23; Amezcua-Linares, An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, 1977, 4(1):1-25. Diagnosis. Cuerpo alargado, comprimido. Cabeza más alta que ancha y angosta 4.0 a 4.3; ojo 4.0 a 4.8 en la longitud cefálica; el hocico es más grande que el diámetro ocular; boca débilmente-oblicua, mandíbulas delgadas; el maxilar llega al margen posterior de la pupila; dientes pequeños Altura máxima 5.0 a 5.4 en la longitud patrón. D VI, 13; A 1314. De 63 a 64 escamas en una serie longitudinal medida desde la base de la pectoral. Mejillas y opérculo sin escamas. Papila anal en las hembras es corta, gruesa y ancha de forma bulbosa. Espinas dorsales prolongadas en filamentos; disco pélvico poco ancho; pectorales del tamaño de la cabeza. Color. Dorso pardo pálido; flancos con 5 o 6 manchas oscuras sobre la línea media lateral, alargadas transversalmente y con puntuaciones oscuras entre las barras. Una mancha oscura sobre el origen de la aleta pectoral no aparente; opérculo con una mancha oscura en forma de espina, Espinas filamentosas de la aleta dorsal muy oscuras, casi negras en su parte distal, el resto y la dorsal blanda con manchas reticuliformes; caudal con manchas en los espacios interradiales; anal, disco ventral y pectorales pálidas. Distribución En las vertientes del Océano Pacífico desde la Laguna de San Juan, México, hasta Panamá, En el área de estudio: Lagunas Salinas de Apozahualco, Chautengo, Tecomate, Tres Palos, Coyuca, Mitla, Nuxco, Salinas del Cuajo y Potosí. Material examinado. 145 ejemplares de 38 a 135 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000.789/.794 (Gro.). Observaciones. Álvarez (1970) señala que el origen de Gobionellus microdon sería dulceacuícola. En estos estudios se deduce que la especie se ha adaptado espléndidamente a vivir en aguas salobres y, al menos en Guerrero, completa todo su ciclo de vida en el interior de las lagunas. Meek y Hildebrand (1928), Amezcua-Linares (1972) Yáñez-Arancibia y Nugent (1975), Miller (1976), Yáñez-Arancibia y Díaz (1977) y Amezcua-Linares (1977) señalan la predilección de esta especie por aguas salobres. Gobionellus microdon es una de las especies mejor distribuidas en el área y caracteriza al sistema lagunar estudiado; en la Laguna de Tres Palos se les de nomina "puritos". Sus hábitos. alimenticios son de consumidor primario del tipo detritívoro y por este motivo juega un importante papel eco lógico en la estructura de las comunidades estu diadas, aun cuando su papel económico pueda ser discutido. 90) Gobionellus sagittula (Günther, 1861) N. v.: "Purito"(Lám. 28, Fig. 5) Euctenogobius sagittula, Günther, Proc. Zool. Soc. London, 1861: 371-372, lám. 3; Boulenger, Boll. Mus. Zool, Anat. Torino, 1899, 14(346):3. Gobius sagittula Jordan y Eigenmann, Proc. U. S. Nat. Mus., 1886: 497; Jordan y Evermann, Bull. U. S. Nat. Mus., 1898, 47:2228. Gobius longicaudus Jenkins y Evermann, Proc. U. S. Nat. Mus., 1888, 9:146. Gobionellus sagittula Gilbert y Starks, Mem. Cal. Ac. Sci., 1904, 4:171; Meek y Hildebrand, Field Mus. Nat. Hist. Publ. Zool. Ser., 1928, 15(249):879-880; Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:441; Ginsburg, Bull. Bingh. Oceanogr. Coll., 1933, 4(2):31; Amezcua-Linares, Tesis profesional Fac. Ciencias Univ. Nal. Autón. México, 1972: 177-179, lám. 12, fig. 4; y An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón, México, 1977, 4(1):125; Chirichigno Inf, Inst. Mar Perú-Callao, 1974, 44:124 y 336. Diagnosis. Cuerpo alargado y comprimido. Cabeza más ancha que alta y deprimida 4.0 a 4.5 en la longitud patrón; hocico romo; ojos pequeños ubicados superiormente 4.0 a 5.0 en la longitud cefálica; el maxilar llega al margen posterior de la pupila 2.8 a 3.1 en la cabeza; bandas externas de dientes muy alargados pero en la mandíbula inferior de las hembras este caracter no es notorio. Altura máxima muy varíable de 6.0 a 7.0 en la longitud patrón. D VI 13-14; A 14. De 58 a 68 escamas en una serie desde la base la pectoral a la base de la anal; escamas ctenoides sobre el dorso pero faltan sobre las mejillas y opéculo. La papila anal de los machos es alargada, puntiaguda y comprimida, en las hembras es corta y redondeada y de forma bulbosa. Ninguna espina dorsal es filamentosa. Disco pélvico de igual longitud que las pectorales, estas últimas 1.3 a 1.4 en la longitud cefálica. Color. Dorso pardo claro, vientre pálido; flancos con 5 manchas oscuras longitudinalmente alargadas sobre la línea media lateral. Cuatro pequeñas bandas oscuras sobre la cabeza convergen en el ojo, otra banda más grande cruza la mejilla en sentido longitudinal; una pequeña mancha oscura sobre el opérculo. Aletas con pequeñas nianchitas oscuras. Distribución. En el Océano Pacífico desde San Diego California, EE.UU., y Golfo de California hasta Perú. En el área de estudio: Lagunas Chautengo, Tres Palos, Coyuca y Potosí. Material examinado. 19 ejemplares de 54 a 82 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000.795/.798 (Gro.). Observaciones. Gobionellus sagittula es menos importante que G. microdon en la estructura de las cornunidades estudiadas. G. sagittula no presenta espinas dorsales filamentosas en ninguno de los sexos, las escamas dorsales se extienden hata el nivel del preopérculo, en ambos sexos la hilera externa de dientes de la mandíbula superior son alargados y tienen una mancha sobre el hombro y manchas longitudinales sobre los flancos. Ninguno de estos caracteres se presenta en G. microdon, en el caso de las escamas dorsales ellas pueden extenderse hasta la zona sobre el ojo y las manchas sobre los flancos están alargadas transversalmente. Gobionellus sagittula puede llegar, en su distribución por el norte, hasta San Diego. Miller y Lea (1972) reportan para California a la especie Gobionellus longicaudus con una distribución desde Guaymas, Sonora, hasta San Diego. Esa denominación es sinónimo de G. sagittula y es probable que la cita errónea de Miller y Lea (1972) corresponda a la especie aquí estudiada. En el sistema lagunar costero de Guerrero, Gobionellus sagittula es un consumidor primario del tipo detritívoro y además completa todo su ciclo de vida en el interior de los estuarios. Género 56. Awaous Steindachner, 1860 91) Awaous nelsoni Evermann, 1898(Lám. 28, Fig. 6) Awaous nelsoni Evermann, Proc. Biol. Soc. Wash., 1898, 12:3; Álvarez, Com. Nac, Consul. Pes. Inst. Nal. Inv. Biol.-Pesq., 1970: 154. Chonophorus nelsoni, Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:442. Diagnosis. Cuerpo alargado y amplio Cabeza grande. Altura máxima 5,7 a 6.0 en la longitud patrón. Más de 60 escamas en una serie longitudinal, (le 15 a 18 escamas en una serie entre la segunda aleta dorsal y la base de la anal. Los dientes de las series externas ligeramente mayores que los demás. Color. Dorso gris oscuro; flancos poco más claros. Aletas con puntuaciones. Distribución. En la costa del Pacífico mexicano desde Sinaloa hasta Guerrero. En el área de estudio: Laguna de Coyuca. Material examinado. 5 ejemplares de 38 a 131 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF. 0.001.411/1.415 (Gro.). Observaciones. Álvarez (1970) asegura que las especies de Awaous son muy variables, difíciles. de diferenciar y presentan dimorfismo sexual. Ginsburg (1933) explica que Chonophorus es un sinónimo de Awaous y posteriormente Miller (1976) señala que A. nelsoni es un sinónimo de A. transandeanus registrado para Baja California. Como parecen poco claros los antecedentes esgrimidos, en este trabajo se sigue el criterio de Álvarez (1970) denominando a la cspecie A. nelsoni. Esta especie fue muy rara y sólo se le colectó en agosto de 1976, un año después de finalizar las actividades de campo de este trabajo. La especie es un componente dulceacuícola de las comunidades estudiadas y sus hábitos alimenticios son de consumidor primario del tipo detritívoro. Carece de importancia comercial. Género 57. Chonophorus Poey, 1860 92) Chonophorus sp.Observaciones. Esta especie no fue colectada en este estudio. Ramírez-Granados (1952) cita a una especie Chonophorus sp., para las lagunas de Coyuca y Tres Palos, que es la que ahora se refiere como especie No. 92 en este trabajo. Es probable que corresponda a la especie Awaous nelsoni discutida más arriba; pero como no conocemos alguna colección de referencia del trabajo de Ramírez-Granados (1952) nada se puede asegurar y se ha optado por respetar su cita, sin mayor comentario. Género 58. Sicydium Cuvier y Valenciennes, 1837 93) Sicydium sp.Observaciones. Esta especie no fue colectada en este estudio, Ramírez-Granados (1952) cita a una especie Sicydium sp. para las lagunas de Coyuca y Tres Palos, que es la que ahora se refiere como especie No. 93 en este trabajo. Álvarez y Cortés (1962) han -referido una especie Sicydium gymnogaster Grant para vertientes en Michoacán. Es difícil inferir alguna discusión por cuanto no conocemos alguna colección de referencia dejada por Ramírez-Granados (1952) después de su trabajo. De todas formas, aparentemente el género ha pasado a sinonimia. Familia XXXII. Microdesmidae (Cerdalidae) Género 59. Microdesmus Günther, 1864 94) Microdesmus dipus Günther, 1864(Lám. 29, Fig. 1) Microdesmus dipus Günther, Proc. Zool. Soc. London., 1864: 26, lám. 3, fig. 1; Lockington, Proc. Ac. Nat., Sci. Phila., 1881: 114; Jordan y Evermann, Bull. U. S. Nat. Mus., 1898, 47:2450; Gilbert y Starks, Mem. Cal. Ac. Sci., 1904, 4:195; Meek y Hildebrand, Field Mus. Nat. Hist. Publ. Zool. Ser., 1928, 15(249):956-957; Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:473. Diagnosis. Cuerpo muy alargado, comprimido. Cabeza corta más de 10 veces en la longitud patrón; hocico muy corto y chato 4.0 en la longitud cefálica; ojos muy pequeños ubicados superiormente; boca pequeña oblicua; espacio interorbital casi igual que la longitud del hocico; mandíbula inferior proyectada; dientes fuertes; aberturas branquiales no más grandes que las base de las pectorales; escamas pequefias embebidas, no imbricadas; miomeros muy evidentes, alrededor de 33 en la cola. Altura máxima más de 20 veces en la longitud patrón. D 55; A 38. La aleta dorsal confluye con la caudal, su origen sobre el extremo de las pectorales; caudal larga y redondeada casi del tamaño de la cabeza; anal similar a la dorsal pero más corta, confluye con la caudal; pectorales moderadas 12 rayos, 1.8 en la longitud cefálica. Color. Dorso y flancos blanquecinos, aletas blancas casi transparentes. Aspecto general pálido. Distribución. En el Océano Pacífico desde La Paz, Baja California hata Panamá. En el área de estudio: Laguna de Potosí. Material examinado 1 ejemplar de 96 mm de longitud total. Colección de referencia, depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000.799 (Gro.). Observaciones. Microdesmus dipus es una especie muy rara en el Pacífico nororiental y su hallazgo en Guerrero es una notable excep ción. La determinación de esta especie pudo realizarse de acuerdo a Meek y Hildebrand (1928). Ecológicamente es intrascendente en la estructura de las comunidades estudiadas. Sus hábitos alimenticios, de acuerdo al ejemplar analizado, parecen ser preferentemente detritívoros. Suborden Scombroidei Familia XXXIII. Scombridae Género 58. Scomberomous Lacépède, 1802 95) Scomberomorus maculatus (Mitchill, 1815) N. v. "Sierra", "Macarela"(Lám. 29, Fig. 2) Scomber maculatus Mitchill, Trans. Lit. Phil. Soc. N. Y., 1815, 1:426. Scomberomorus sierra Jordan y Starks, in Jordan et al. Proc. Cal. Ac. Sc¡., Fishes of Sinaloa, 1895, 5:428; Jordan Evermann y Clark, U. S. Bureau. of Fisheries, 1930, 2:257; Hiyama et al. Peces Marinos de la Costa Mexicana del Pacifico, 1940, 31, lám. lo; Berdegué, Secretaría de Marina, Dir. Gral. Pes. Ind. Con., 1956: 177-178, fig. 141, Miller y Lea, Fish. Bull. Cal. Dept. Fish. Game, 1972, 157:192-193; Holguín-Quiñones, Instituto Nacional de Pesca, 1976: 100. Scomberomous maculatus, Meek y Hildebrand, Field Mus. Nat. Hist. Publ. Zool. Ser., 1923, 15(215):324; Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:257; Hildebrand Bull. U. S. Nat. Mus., 1946, 189:376-377; Ramírez-Hernández An. Inst. Nal. Inv. Biol.-Pesq., 1965, 1:345; Castro, Arvizú y Paéz, Revta. Soc, mex. Hist. Nat., 1970, 31:156; Amezcua-Linares, Tesis profesional Fac. Ciencias Univ. Nal. Autón. México, 1972: 182-184, lám. 13, fig. 1; Chirichigno, Inf. Inst. Mar. Perú-Callao, 1974, 14:324 y 349; S. I. C. Catálogo de Peces Marinos Mexicanos, 1976. 119 y 339; Amezcua-Linares, An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, 1977, 4(1):1-25. Diagnosis. Cuerpo alargado, comprimido; perfil dorsal. y ventral redondeados. Cabeza larga y baja 3.9 a 4.9 en la longitud patrón; hocico puntiagudo 2.5 a 3.0 en la longitud cefálica; ojos pequeños y de tamaño variable 5.0 a 7.5 en la cabeza; boca grande ligeramente oblicua, maxilar largo y redondeado, llega al margen posterior del ojo, 1.6 a 1.9 en la cabeza; dientes en las mandíbulas, vómer y palatinos. Altura máxima 4.4 a 5.8 en la longitud patrón. D XVI-XVIII, 15-18 y 8-9 pínulas; A 11, 15-18 y 7-9 pínulas; P 19-20. Branquiespinas gruesas y de tamaño moderado 11 a 12 sobre la rama inferior del primer arco. Alrededor de 165 poros sobre la línea lateral. Vértebras 47 a 49. Quilla dérmica pequeña. Pedúnculo caudal angosto. Pectorales moderadas 6.8 a 7.0 en la longitud del cuerpo y 1.5 a 1.8 en la longitud cefálica. Color. Dorso azul, flancos grises brillantes con manchas amarillo bronceadas dispuestas longitudinalmente en líneas irregulares, vientre plateado. Aletas dorsales, pectorales y caudal oscuras, ventrales pálidas; anal con puntuaciones oscuras; pínulas pálidas. Distribución. En ambas costas de América. En el Océano Atlántico desde Maine, Canadá, liasta Brasil. En el Pacífico desde el sur de California, hasta Perú, e Islas Galápagos. En el área de estudio: Laguna de Chautengo. Material examinado. 45 ejemplares de 261 a 405 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCM1-PF 0.001.395/1.399 (Gro.). Observaciones. Scomberomorus maculatus es la denominación actual de esta especie incluyendo como sinónimo a S. sierra. De todas maneras anibas denominaciones siguen utilizándose indistintamente en México (ver sinonimia) . Por otra parte Chirichigno (1974) menciona a esta especie con una denominación subespecífica de S. maculatus sierra. Esta especie reviste fundamental importancia en México, consumiéndose en fresco, ahumado y enlatado. Sus capturas en aguas nerítico oceánicas son comunes y abundantes (Berdegué, 1956,: Castro et al., 1970; Holguín-Quiñones, 1976). Con anterioridad Ramírez-Hernández y Páez (1965) han reportado esta especie en la costa de Guerrero. No obstante su ocurrencia en las lagunas no es frecuente y en este estudio se colectaron 45 ejemplares un año, después de haberse finalizado las actividades de campo de este trabajo. Sus hábitos alimenticios son de carnívoro superior, consumidor de tercer orden, y corresponde a una especie marina estenohalina visitante excepcional en los estuarios. Orden Pleuronectiformes (Heterosomata). Suborden Pleuronectoidei. Familia XXXIV. Bothidae (Pleuronectidae). Género 61. Cyclopsetta Gill, 1888. 96) Cyclopsetta querna (Jordan y Bollman, 1890). N. v. "Lenguado", "Medio pez", "Huarache"Azevia querna Jordan y Bollman, Proc, U, S. Nat. Mus., (1889) 1890, 12:174. Cyclopsetta querna Jordan y Evermann, Bull. U. S. Nat. Mus., 1898, 17:2675; Gilbert y Starks, Mem. Cal. Ac. i 1904,4:200; Meek y Hildebrand, Field Mus. Nat. Hist. Publ. Zool. Ser., 1928, 15(249):991-992; Jordan, Evermann y Clark, U. S. Burcau of Fisheries, 1930, 2:221; Norman, Trustees of the British Muscum (Natural History), 1934, 1:135-136, fig, 8; Hildebrand, Bull. U. S. Nat. Mus., 1946, 189:466-467; Ramírez-Hernández y Paéz, An. Inst. Nal. Inv. Biol.-Pesq., 1965, 1:346; Castro, Arvizú y Paéz, Revta. Soc. Mex. Hist. Nat., 1970, 31:164; Chirichigno, Inf. Inst. Mar. Perú-Callao, 1974, -14:170 y 332; S. I. C. Catálogo de Peces Marinos Mexicanos, 1976: 124, 125 y 409. Diagnosis. Cuerpo alargado y elíptico, perfil sobre los ojos casi recto. Cabeza corta y profunda 3.5 a 4,0 en la longitud patrón; hocico más grande que los ojos 5.1 a 5.4 en la cabeza; ojos 6.0 a 6.4 en la longitud cefálica y casi el doble de la amplitud interorbital; maxilar extendiéndose más alla del ojo 1.8 a 2.0 en la cabeza, con un par de caninos; mandíbula inferior 1.5 a 1.6 en la longitud cefálica. Altura máxima 2,1 a 2.3 en la longitud patrón. D 89-93; A 70-74; P 14-16. Branquiespinas 8 a 9 sobre la rama inferior del primer arco. Escamas cicloides 90 a 98 en la línea lateral. Túbulos de la línea lateral profusamente ramificados y una red similar sobre la parte posterior de la cabeza. La dorsal se inicia delante de los ojos por sobre las narinas. Pectoral del lado oculado 2.0 en la longitud cefálica. Caudal doblemente truncada. Color. Sobre el lado oculado uniformemente café. Algunas manchitas claras sobre las pectorales. Distribución. En el Océano Pacífico desde la Bahía de la Paz, Golfo de California, México, hasta el norte de Perú. En el área de estudio: lagunas de Chautengo y Potosí. Material examinado. 6 ejemplares de 64 a 92 mm de longitud patrón. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000.800/.801 (Gro.). Observaciones. Cyclopsetta querna es, en general, una especie poco común. Este género posee otras especies en aguas mexicanas, i. e., C. chittendeni Bean en la costa del Golfo de México, C. fimbriata (Goode y Bean) en aguas profundas del Golfo de México y C. panamensis (Steindachner) con la cual es simpátrica en el Pacífico mexicano. En estos estudios se considera a Cyclopsetta querna como un pez que puede utilizar las áreas estuarinas como naturales de crianza. Sus hábitos alimenticios son carnívoros siendo un consumidor de tercer orden que se alimenta de pequeños peces y macroinvertebrados bentónicos. La especie fue recolectada en la zona de la boca de las lagunas cerca de los manglares sobre un sustrato arenoso. Se diferencia fundamentalmente de C. panamensis estudiada por Amezcua-Linares (1972 y 1977) y Yáñez-Arancibia y Nugent (1975), por el menor número de rayos dorsales y anales y el mayor número de branquiespinas, el mayor número de escamas sobre la línea lateral y la mayor altura corporal (ver Norman, 1934). En la costa de Guerrero carece de importancia comercial por su tamaño y escasa abundancia. Género 62. Citharichthys Bleeker, 1862 97) Citharichthys gilberti Jehkins y Evermann, 1889 N. v. "Lenguado", "Medio pez", "Huarache"(Lám. 29, Fig. 3) Citharichthys spilopterus Günther, Trans. Zool. Soc., London, 1869,6:471, lám. 80, fig. 2 (no el de Günther, 1862); Jordan y Gilbert, Bull. U. S. Fish. Comm., 1882 (1883), 2:108 y 111. Citharichthys sumichrasti Jordan y Goss, Rep. U. S. Com. Fish., 1889 (1886), 14:276. Citharichthys gilberti Jenkins, y Evermann, Proc. U. S. Nat. Mus., 1889 (1888), 11:157; Gilbert, Proc. U. S. Nat. Mus., 1891 (1890), 13:454; Jordan y Evermann, Bull. U. S. Nat. Mus., 1898, 47;2682; Gilbert y Starks, Mem. Cal. Ac. Sci., 1904, 1:200; Starks, Proc. U. S. Nat. Mus., 1906, 30;800; Regan, Biol. Centr. Amer. Pisc., 19061908: 2; Evermann y Radcliffe, Bull. U. S. Nat. Mus., 1917, 95:141; Meek y Hildebrand, Field Mus. Nat. Hist. Publ. Zool. Ser., 1928, 15(249): 987-988; Jordan, Evermann y Clark, U. S. Bureau. of Fisheries, 1930, 2:219, Norman, Trustees of the British Museum (Natural History), 1934, 1:152, fig. 105; Hildebrand, Bull. U. S. Nat. Mus., 1946, 189:468-469; Berdegué, Secretaría de Marina, Dir, Gral. Pes. Ind. Con., 19,56: 309-310; Álvarez y Cortés, An. Esc. nal. Cienc. biol. Méx., 1962, 11;135; Ramírez-Hernández y Páez, An. Inst. Nal. Inv. Biol.-Pesq., 1965, 1:346; Álvarez, Com. Nac. Consul. Pes. Inst. Nal. Inv. Biol.-Pesq., 1970- 155156; Castro, Arvizú y Páez, Revta. Soc. mex. Hist. Nat., 1970, 31:164; Amezcua-Linares Tesis profesional Fac, Ciencias Univ, Nal. Autón. México, 1972: 188-189, lám. 13, fig. 4; y An. Centro Cienc. del Mar y Limnol, Univ. Nal. Autón. México, 1977, 4(1):1-25; Chirichigno, Inf. Inst. Mar Perú-Callao, 1974, 41:173 y 331. Diagnosis. Cuerpo alargado y muy comprimido. Cabeza pequeña 3.3 a 3,8 en la longitud patrón; hocico 5.3 a 5.7 en la longitud cefálica; ojos 5.0 a 7.0 en la cabeza; boca grande, fuertemente oblicua; maxilar llegando hasta el margen posterior de la pupila, 2.5 a 2.7 en la cabeza. Altura máxima 2.0 a 2.3 en la longitud patrón. D 77-89; A 57-68; P 10-11 sobre el lado oculado; P 9-10 sobre el lado ciego. Escamas 40 a 43 sobre la línea lateral y 46 a 50 en una serie longitud¡nal sobre el lado oculado y 44 a 47 sobre el lado ciego. Branquiespinas de longitud moderada 12 a 15 sobre la rama inferior del primer arco. Las escamas son ligeramente etenoides sobre el lado oculado y cicloides sobre el lado ciego. La aleta caudal con los rayos centrales ligeramente más alargados; pectorales puntudas, las del lado oculado 1.7 a 2.0 en la cabeza y 2.2 a 2.5 las del lado ciego. Color. Café pardo pálido con manchas oscuras dispersas, aletas un poco más claras con partes oscuras indefinidas. Distribución. En el Océano Pacífico desde la costa occidental de Baja California y Golfo de California, hasta Perú. En el área de estudio. Lagunas de Salinas de Apozahualco, Chautengo, Nuxco, Salinas del Cuajo y Potosí. Material examinado. 42 ejemplares de 83 a 182 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCMI -PF 0.000.802/.817 (Gro.). Observaciones. Citharichthys gilberti es una especie muy afín con C. spilopterus Günther de la costa del Golfo de México. Además de estas dos especies el género presenta otras para las costas mexicanas, i. e., C. sordidus (Girard) en la costa occidental de Baja California, C. fragilis Gilbert, en el Golfo de California, C. xanthostigma en ambas costas de Baja California, C. macrops Dresel en la costa del Golfo de México, y C. stigmaeus Jordan y Gilbert en la costa noroeste mexicana. Numerosos trabajos han mencionado la capacidad de Citharichthys gilberti de penetrar en aguas salobres y aún dulces; entre otros, Meek y Hildebrand (1928), Norman (1934), Hildebrand (1946), Álvarez (1970), Castro, et al. (1970), Amezcua-Linares (1972 y 1977) YáñezArancibia (1974), Yáñez-Arancibia y Nugent (1975). En este trabajo se considera que Citharichthys gilberti utiliza las lagunas como áreas naturales de crianza donde completa parte de su desarrollo. Sus hábitos alimenticios son carnívoros siendo un consumidor de tercer orden que se alimenta de pequeños peces y especialmente macroinvertebrados bentónicos. Siempre la especie fue recolectada en la zona de las orillas de las lagunas cerca de los manglares y sobre sustrato arenoso y a veces fangoso. En la costa de Guerrero su importancia comercial es limitada; de todos los "lenguados" colectados en las lagunas de Guerrero Citharichthys gilberti es el único que tiene cierto consumo porque presenta tamaños mayores que las otras especies. Género 63. Etropus Jordan y Gilbert, 1881. 98) Etropus crossotus Jordan y Gilbert, 1882 N. v.: "Lenguado", "Medio pez", "Huarache"(Lám. 30, Fig. 1) Etropus crossotus Jordan y Gilbert, Proc. U. S. Nat. Mus., 1882 (1881), 4:364. Etropus micyostomus Jordan, Proc. U. S. Nat. Mus., 1886: 29 (no Citharichthys microstomus Gill). Citharichthys crossotus Parr, Bull. Bingham Oceanogr. Coll., 1931, 4(1):13. Citharichthys crossotus atlanticus Parr, Bull. Bingham Oceanogr. Coll., 1931, 4(1):16. Citharichthys crossotus crossotus Parr, Bull, Bingham Oceanogr. Coll., 1931, 4(1):16. Etropus crossolus Jordan y Gilbert; Jordan y Gilbert, Proc. U. S. Nat. Mus., 1883, 5:305 y 618; Jordan y Gilbert, Bull U. S. Nat. Mus., 1883, 16:839; Jordan y Swain, Proc. U. S. Nat. Mus., 1885, 7:234; Jordan y Goss, Rep. U. S. Com. Fish., 1889, 14:278; Jordan y Evermann, Bull. U. S. Nat. Mus., 1898, 47:2689, lám. 386, fig. 946; Evermann y Marsh, Bull. U. S. Com. Fish. 1902, 20.328, fig. 107; Meek y Hildebrand, Field Mus. Nat. Hist. Publ. Zool. Ser., 1928, 15(249):992993; Hildebrand y Schroeder, U. S. Bureau of Fisheries, 1928, 43(1):173, fig. 88; Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:220; Norman, Trustees of the British Museum. (Natural History), 1934, 1:158-160, fig. 112; Berdegué, Secretaría de Marina, Dir. Gral. Pes. Ind. Con., 1956: 310-311, fig. 199; Ramírez-Hernández y Páez, An. Inst. Nal. Inv, Biol.-Pesq., 1965, 1:314; Castro, Arvizú y Páez, Revta. Soc. mex. Hist, Nat., 1970, 31.162; Amezcua-Linares, Tesis profesional Fac. Ciencias Univ. Nal. Autón. México, 1972: 189-191, lám. 14, fig. 1; Chirichigno, Inf. Inst. Mar Perú-Callao, 1974, 41:173 y 334; S. J.C., Catálogo de Peces Marinos Mexicanos, 1976: 125 y 410. Diagnosis. Cuerpo oval, fuertemente comprimido, perfil dorsal y ventral iguales. Cabeza muy pequeña 3.8 a 4.8 en la longitud patrón; hocico corto ligeramente puntiagudo, más pequeño que la órbita 5.0 a 6.4 en la longitud cefálica; ojos 3.9 a 4.5 en la cabeza; boca pequeña, el maxilar rebasa el margen anterior del ojo 3.8 a 4,3 en la cabeza; dientes pequeños, colocados en series simples y de iguales tamaños. Altura máxima 1.8 a 2,0 en la longitud patrón. D 75-87; A 58-68 (60-65) ; P 10 sobre el lado oculado. Escamas cicloides o ctenoides 41 a 47 en la línea lateral, no hay escamas suplementarias. Branquiespinas moderadas 6 a 9 (7-8) sobre la rama inferior del primer arco. Ojo inferior ligeramente más adelante que el superior, el hocico sin escamas. Pectorales del lado oculado mayores que las del lado ciego, 1.2 a 1.4 en la longitud cefálica. Color. Lado oculado pardo con algunas zonas con tonos más oscuros en forma irregular. Una mancha oscura conspícua sobre la base de la aleta caudal; bajo la pectoral del lado oculado se presenta un manchón más oscuro que el resto del cuerpo. Aletas con puntuaciones oscuras, dispuestas más o menos regulares en la dorsal y anal, en las otras van irregularmente. Distribución. En ambas costas de América. En el Océano Atlántico, desde Chasapeake Bay, EE.UU., y Golfo de México, hasta las Antillas y Brasil; en el Pacífico desde Baja California hasta Perú. En el área de estudio: Lagunas de Salinas de Apozahualco y Potosí. Material examinado 6 ejemplares de 68 a 106 mm. de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000.818 (Gro.) Observaciones. Etropus crossotus es una especie relativamente frecuente en la costa central y norte del Pacífico mexicano, no obstante, su pequeño tamaño determina que su importancia comercial sea limitada. Parece ser la única especie del género Etropus en las costas mexicanas. Meek y Hildebrand (1928), Parr (1931) y Norman (1934) no encontraron diferencias significativas entre ejemplares de Etropus crossotus de la costa Atlántica y Pacífico. Sin embargo, Parr (1931), sobre la base de ciertas diferencias en el desarrollo ontogénico de la amplitud del cuerpo, propuso las subespecies E. crossotus atlanticus (Atlántico) y E. crossotus crossotus (Pacífico) Por otra parte, Norman (1934) señala que en el Atlántico la especie puede crecer hasta alrededor de 140 mm, mientras que en el Pacífico puede crecer más de 190 mm. En este trabajo se considera que Etropus crossotus utiliza las lagunas como áreas naturales de crianza, en forma no muy abundante. Sus hábitos alimenticios son carnívoros siendo un consumidor de tercer orden que se alimenta de pequefios peces y especialmente macroinvertebrados bentónicos. Siempre la especie fue recolectada cerca de manglares y en las proximidades a las bocas de las lagunas, sobre sustrato arenoso y/o lodoso. Castro et al. (1970) señalan que en el Golfo de California es abundante en los fondos arenosos y lodosos. Por su tamaño y escasa abundancia carece de importancia comercial en el sistema lagunar costero de Guerrero. Familia XXXV. Soleidae. Género 64. Achirus Lacépéde, 1803. 99) Achirus mazatlanus (Steindachner, 1869) N. v.: "Lenguado", "Mediopez", "Huarache"(Lám. 30, Fig. 2) Solea mazatlana Steindachner, Ichth, Noticen., 1869, 9:23. Solea pilosa Peters, Monatsb. k. Ak. Wiss. Berlin, 1869: 709. Achirus mazatlanus Jordan, Proc. U. S. Nat, Mus., 1885: 391; Jordan y Evermann, Bull. U. S. Nat. Mus., 1898, 47:2698; Kendall y Radcliffe, Mem. Mus. Comp. Zool. Harv., 1912, 35:161; Meek y Hildebrand, Field Mus. Nat. Hist. Publ. Zool. ser., 1928, 15(249): 1000; Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:230; H¡yama et al., Peces Marinos de la Costa Mexicana del Pacífico, 1940: 64, lám. 97, fig. A; Berdegué, Secretaría de Marina, Dir. Gral. Pes. Ind. Con., 1956: 308, fig. 197; Alvarez y Cortés, An. Esc. nal. Cienc. biol., Mex. 1962, 11(14):136; Ramírez-Hernández y Páez, An. Inst. Nal. Inv. Biol.-Pesq., 1965, 1:347; Castro, Arvizú y Páez, Revta. Soc. mex. Hist. Nat., 1970, 31:165-166; Álvarez, Com. Nac. Consul. Pes, Inst. Nal. Inv. Biol.-Pesq. 1970: 156; Amezcua-Linares, Tesis profesional Fac Ciencias Univ. Nal. Autón. México, 1972. 191-192, lám. 14, fig. 2 y An. Centro Cienc. del Mar y Limnol. Univ, Nal. Autón. México, 1977, 4(1): 1-25; Chirichigno, Inf. Inst. Mar Perú-Callao, 1974, 44:175 y 327; S. I. C., Catálogo de Peccs Marinos Mexicanos, 1976: 126 y 419. Diagnosis. Cuerpo alto, ovalado casi circular, muy comprimido. Cabeza corta de 3.1 a 3.5 en la longitud patrón; hocico redondeado 2.9 a 3.6 en la longitud cefálica; ojos, el superior por delante del inferior 6.0 a 7.5 en la cabeza; interorbital igual o poco menor que la mitad del ojo; el maxilar sobrepasa ligeramente el margen anterior de la pupila, 2.7 a 3.2 en la cabeza. Altura máxima 1.4 a 1.6 en la longitud patrón. D 5560; A 41-47. Escamas en una serie longitudinal 54 a 61. Branquiespinas rudimentarias 8 a 9. Línea lateral casi recta, escamas fuertemente etonídeas, pilosas. Pectorales con el rayo más largo 3.3 a 4.4 en la logitud cefálica, la del lado ciego desaparece, la del lado oculado con una espinita débil, 3 a 6 rayos. La dorsal se origina sobre el hocico; caudal redondeada. Color. Pardo oscuro uniforme con 8 a 9 líneas delgadas oscuras y transversales mucho más notorias en los juveniles. Aletas oscuras y la dorsal y anal con algunas manchas. Distribución. En el Océano Pacífico, desde Baja California, México, hasta Perú. En el área de estudio: Lagunas de Salinas de Apozahualco, Chautengo, Tecomate, Tres Palos, Coyuca, Nuxco y Potosí. Material examinado. 38 ejemplares de 61 a 148 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000.819/.832 (Gro.). Observaciones. Kumada e H¡yama (1940) han indicado que ocasionalmente se les denomina "lenguados de río" y "tepalcates"; también se les llama "lenguados" y "sol" y con esas denominaciones fueron estudiados por Ramírez-Hernández y Páez (1965). Carranza y Amezcua-Linares (1971) y Amezcua-Linares (1972) lo incluyen con el nombre de "comalito"; sin embargo, en las costas de Guerrero la más frecuente es la denominación de "medio pez". Así es citado también por Ramírez-Granados (1952) en algunas lagunas de Guerrero. La especie fue recolectada cerca de la boca de las lagunas sobre sustrato arenoso, próximo a los manglares, Alvarez (1970) y Castro et al., (1970) señalan que Achirus mazatlanus penetra a los ríos y vertientes del Pacífico mexicano puesto que sus hábitos la llevan a invadir ambientes costeros superiores siendo común encontrarlo en los estuarios. Al respecto, Cervigón (1967) señala que especies del género Achirus y Trinectes caracterizan en mayor o menor medida la fauna ictiológica de fondos arenosos y/o fangosos en un ambiente de manglares. Por su tamaño pequeño y abundacia escasa su importancia económica en las lagunas de Guerrero es discutible, sin embargo, según Berdegué (1954 y 1956) Achirus mazatlanus parece tener cierta importancia en la costa noroccidental de México ya que los ejemplares de mayor tamaño son utilizados como alimento. En estos estudios se considera a Achirus mazatlanus como una especie que con frecuencia utiliza los estuarios como área donde completa parte de su desarrollo. Sus hábitos alimenticios son preferentemente carnívoros pero incorporan además detritus en su alimentación siendo, por lo tanto, un consumidor de segundo orden. 100) Achirus panamensis (Steindachner, 1875) N. v.: "Lenguado", "Medio pez", "Huarache"(Lám. 31, Fig. 1) Citharichthys panamensis Steindachner, Ichth. Beitr., 1875, 3:62. Solea panamensis Steindachner, Ichthyol. Beitrage, 1876, 5:10. Azevia panamensis; Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:22 1. Achirus panamensis; Jordan y Evermann, Bull. U. S. Nat. Mus., 1900, 47:2702; Kumada et al., Peces Mari nos de la Costa Mexicana del Pacífico, 1940: 64, lám. 97, fig. IR; Amezcua-Linares, Tesis profesional Fac. Ciencias Univ. Nal. Autón, México, 1972: 192-194, lám. 14, fig. 3; y An. Centro Cienc. del Mar y Limnol. Univ. Nal, Autón. México, 1977, 4(1):1-25. Diagnosis. Cuerpo alto, muy comprimido y ovoide. Cabeza corta 3.5 a 3.7 en la longitud patrón; hocico ancho, redondeado, 2.9 a 3.3 en la longitud cefálica; ojos pequeños, el superior más adelante, 5.5 a 5.8 en la longitud cefálica; interorbital delgado, aproximadamente a la mitad de la órbita; boca moderada el maxilar 2.8 a 3.0 en la cabeza, Altura máxima 1.8 a 2.0 en la longitud patrón. D 54-57; A 42-43. Escamas pequeñas ctenoides, de 64 a 66 en una serie longitudinal. Sin aletas pectorales. Color. Pardo grisáceo, con 12 rayos delgados transversales oscuros sobre la cabeza y cuerpo. Las aletas con manchas oscuras. Distribución. En el Pacífico tropical americano desde Sinaloa, México, hasta Panamá. En el área de estudio: Lagunas de Chautengo y Tecomate. Material examinado. 5 ejemplares de 61-93 mm. de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0,000.833/.834 (Gro.) Observaciones. Se denomina en forma generalizada a Bótidos y Soléidos, como lenguados". Achirus panamensis recibe el nombre de "lenguados de río" en la costa de Guerrero siendo incluída en la costa del Pacífico de México, por Kumada (1940) y estudiada más tarde por Carranza y Amezcua-Linares (1971) y Amezcua-Linares (1972 y 1977). Sin embargo, no es una especie abundante ni frecuente y por su escaso tamaño parece no tener importancia comercial en las lagunas estudiadas. Se le recolectó en la boca de las lagunas Chautengo y Tecomate sobre substrato arenoso, cerca de los manglares. Achirus panamensis se diferencia fundamentalmente de A. mazatlanus por el menor tamaño de la cabeza, la altura máxima, el mayor número de rayos de la aleta dorsal y la coloración. La especie es rara y ha sido poco. frecuente encontrarla en la costa del Pacífico mexicano. Hay pocos registros para la especie. Aparte de las dos especies recién tratadas en este trabajo, el género incluye otras para las costas mexicanas, i. e., A. fasciatus Lacépède y A. lineatus (Linnaeus) en la costa del Golfo de México, A. scutum (Günther) y A. klunzingeri (Steindachner) en el Pacífico central y sur mexicano y A. barnharti Jordan en el norte de Baja California. En estos estudios se considera que Achirus panamensis es una especie rara donde algunos juveniles pueden penetrar a los estuarios buscando alimento y protección. Sus hábitos alimenticios son perfectamente carnívoros incorporando, además, detritus en su dicta y siendo por lo tanto un consumidor secundario. Por su pequeño tamaño y escasa frecuencia, carece de importancia comercial en el sistema lagunar costero de Guerrero. 101) Achirus klunzingeri (Steindachner, 1879) N. v.: "Lenguado" "Medio pez", "Huarache"(Lám. 31, Fig. 2) Solea Klunzingeri Steindachner, Zur Fische des Canca und der Flusse be¡ Guay., 1879: 44; Denkschr. Ak. Wiss. Wien, 1880,42:96, lám. 9, fig. 3. Achirus klunzingeri, Jordan y Evermann, Bull. U. S. Nat. Mus., 1898, 47:2697; Gilbert y Starks, Mem. Cal. Ac. Sci., 1904, 1:200; Kendall y Radcliffe, Mem. Mus. Comp. Zool. Harv., 1912, 35:162; Meek y Hildebrand, Field Mus. Nat. Hist. Publ. Zool. Ser., 1928, 15(249):997-998; Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930,2:229; Chirichigno, Inf. Inst. Mar. Perú-Callao, 1974, 44:175 y 327. Diagnosis. Cuerpo ovalado, muy comprimido, de aspecto romboidal. Cabeza corta 3.3 a 3.6 en la longitud patrón; hocico chato 3.4 a 3.7 en la longitud cefálica; ojos pequeños el superior ligeramente más adelante 8.0 a 12.0 en la cabeza; interorbital escamado tan amplio como los ojos 10.0 a 13.0 en la longitud cefálica; boca moderada, el maxilar se extiende basta la línea media del ojo inferior, 2.7 a 3.0 en la cabeza. Altura máxima 114 a 1.7 en la longitud patrón, D 59-66; A 4651; P 2-6. Escamas pilosas fuertemente etenoides 79 a 81 en una serie longitudinal sobre la línea lateral, esta última derecha. Aleta caudal redondeada fuertemente convexa; pélvicas bien desarrolladas; pectorales del lado oculado variables en tamaño y número de rayos, 4.0 a 9.0 en la longitud cefálica, las del lado ciego casi desaparecen. Color. Pardo marrón casi uniforme pueden presentarse algunas manchas oscuras y numero sas y tenues líneas verticales oscuras. Escamas con pelos negros. Distribución. En el Océano Pacífico desde Guerrero, México, hasta Perú. En el área de estudio: Laguna de Chautengo. Material examinado. 1 ejemplar de 127 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000,835 (Gro.). Observaciones. Archirus Klunzingeri es una especie poco común donde quiera se le haya recolectado. Aparentemente es el primer registro en el Pacífico mexicano. Al mismo tiempo su presencia en el sistema lagunar costero de Guerrero debe considerarse excepcional, pero como el único ejemplar capturado no era adulto sexualmente maduro puede pensarse que eventualmente los ejemplares jóvenes de la especie pueden acercarse a la costa e incluso Penetrar aguas interiores salobres. El examen del contenido estomacal revela que la especie es preferentemente carnívora pero también incorporando detritus en su dieta. Puede definirse como un consumidor secundario. Por su escasa abundacia y frecuencia carece de importancia comercial en los ecosistemas estudiados. Género 65. Trinectes Rafinesque, 1831. 102) Trinectes fonsecensis (Günther, 1862). N. v. "Lenguado" "Medio pez", "Huarache"(Lám. 31, Fig. 3) Solea fonsecensis Günther, Cat. Fish. Brit. Mus., 1862, 1:475. Solea panamensis Steindachner, Sitzb. K. Ak. Wiss, Wien, 74; Ichth. Beitr., 1876, 5:10, lám. 2. Solea fischeri Steindachner, Denkschr. Ak. Wiss. Wien., 1879, 11:161, lám. 2., fig. 8. Achirus fonsecensis Jordan y Evermann, Bull. U. S. Nat. Mus., 1898, 47:2702;: Gilbert y Starks, Mem. Cal. Ac. Sci., 1904, 4:201; Kendall y Radcliffe, Mem. Mus Comp. Zool. Harv., 1912, 35:162; Meek y Hildebrand, Field Mus. Nat. Hist. Publ. Zool. Ser., 1928, 15(249): 996-997; Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:230; Álvarez y Cortés, An. Esc. nal. Cienc. biol. Méx., 1962, 11(14):136. Achirus panamensis Jordan y Evermann, Bull. U.S, Nat. Mus., 1898, 47:2702. Achirus fischeri Jordan y Evermann, Bull. U. S. Nat. Mus., 1898, 47:2699. Trinectes fonsecensis (Günther) Ramírez-Hernández y Páez, An. Inst. Nal. Inv. Biol.-Pesq., 1965, 1:347; Álvarez, Com. Nac. Consul, Pes. Inst. Nal. Inv. Biol. Pesq., 1970: 156-157; Castro, Arvizú y Páez, Revta. Soc. mex. Hist. Nat., 1970, 31:166; Chirichigno, Inf. Inst. Mar Perú-Callao, 1974, 44:174 y 352; S. 1. C, Catálogo de Peces Marinos Mexicanos, 1976: 126 y 420; Miller, Fildiana Zoology, 1976, 69(1):24. Diagnosis. Cuerpo ovalado, ancho y muy comprimido. Cabeza corta 3,3 a 3.9 en la longitud patrón; hocico redondeado 3.1 a 3.5 en la longitud cefálica; ojos pequeños el superior más adelante, 7.4 a 9.0 e interorbital 12.0 a 18.0 en la longitud cefálica; el maxilar llegando al margen anterior de la pupila 2.6 a 2. 8 en la longitud cefálica. Altura máxima 1.7 a 2.0 en la longitud patrón. D 57-61; A 42-46. Escamas fuertemente ctenoides, en una serie longitudinal 60 a 65. Branquiespinas rudimentarias. Pectoral ausente en el lado ciego y rudimentaria en el otro con 1 a 3 rayos, y más pequefia que los ojos 10.0 a 18.0 en la cabeza. Las pélvicas con 5 rayos y la del lado oculado se continúa con la anal. La dorsal se origina en el extremo del hocico; caudal redondeada. Color. Lado oculado café oscuro, con 11 a 13 líneas oscuras transversales en la cabeza y el cuerpo, prolongándose a través de las aletas dorsal y anal. Aleas impares más claras que el cuerpo y manchadas de negro. Distribución. En el Océano Pacífico desde Baja California, México, hasta Perú. En el área de estudio: Lagunas de Chautengo, Salinas del Cuajo y Potosí. Material examinado, 10 ejemplares de 75 a 97 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF O.000.836/.851 (Gro.). Observaciones Álvarez (1970) ha indicado que la sinonimia del género Trinectes ha sido muy debatida, pero el consenso actual es el de separarlo del género Achirus con el cual estuvo reunido mucho tiempo. Trinectes fonsecensis ha sido reportada recientemente por Ramírez-Hernández y Páez (1965) Álvarez (1970) y Castro et al. (1970) en el Pacífico mexicano, agregando que pentra aguas continentales. Cervigón (1967) señala que especies del género Trinectes y Achirus caracterizan, en parte, la fauna ictiológica de fondos arenosos y/o fangosos en un ambiente de manglares. En México se conocen otras especies del género, i. e., T. fasciatus Lacépéde (= T. maculatus Bloch y Sclineider) . Por su escaso tamaño y abudancia T. fonsecensis no es una especie de importancia económica en el sistema lagunar costero estudiado. En este estudio se considera a Trinectes fonsecensis como una especie que utiliza los estuarios como áreas de crianza. Sus hábitos alimenticios son preferentemente carnívoros pero en las lagunas incorpora además detritus en su dicta comportándose como consumidores secundarios. Orden Tetraodontiformes (Plectognathi) Suborden. Tetraodontoidei. Familia XXXVI. Tetraodontidae Género 66. Sphoeroides Lacépède, 1798. 103) Sphoeroides lobatus (Steindachner, 1870) N. v. "Botete", "Tambor", "Pez globo"(Lám. 32, Fig. 1) Canthogaster lobatus Steindachner, Sitzb. K. Ak. Wiss. Wien, 61; Ichth. Noticen, 1870, 10:18, lám. 5, fig. 3. Sphocroides lobatus Jordan, Bull. U. S. Nat. Mus., 1898, 47:1731; Gilbert y Starks, Mem. Cal. Ac. Sci., 1904, 1:156; Kendall y Radcliffe, Mem. Mus. Comp. Zool. Harv., 1912, 35:165, Meek y Hildebrand, Field Mus. Nat. Hist. Publ. Zool, Ser., 1928, 15(249):814-815; Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2;498; H¡yama et al., Peces Marinos de la Costa Mexicana del Pacífico, 1940: 58, lám. 88, fig, A; RamírezHernández y Arvizú, An. Inst. Nal. Inv. Biol.-Pesq., 1965, 1:315; Ramírez-Hernández y Páez, An. Inst. Nal. Inv. Biol.-Pesq., 1965, 1:348; Castro, Arvizú y Páez, Revta. Soc. mex, Hist. Nat., 1970,31:168; Chirichigno, Inf. Inst. Mar. Perú. Callao, 1974, 44:115 y 350. Diagnosis. Cuerpo relativamente alargado, robusto. Cabeza grande 2.4 en la longitud patrón; hocico largo casi recto 1.9 a 2.0 en la longitud cefálica; ojos 3.8 a 4.6 en la cabeza; interobital 5.5 a 7.5 en la longitud cefálica; espinitas presentes en el dorso de la cabeza y hocico. Altura máxima 3.0 a 3.5 en la longitud patrón. D 8; A 6. Aleta caudal redondeada y larga; dorsal ubicada posteriormente casi en la mitad de la distancia entre el ojo y el extremo de la caudal; anal similar a la dorsal se origina por detrás de la vertical del último rayo dorsal; pectorales amplias 2.0 a 2. 4 en la longitud cefálica. Color. Dorso oscuro; flancos con una hilera de manchas oscuras redondeadas limitando el área oscura del dorso y el blanco del abdomen; sin líneas pálidas o reticulaciones en el dorso y flancos. Vientre pálido; una barra oscura cruzada entre los ojos; aleta caudal. con una barra oscura en la base, el tercio distal negro; las otras aletas pálidas, Distribución. En el Océano Pacífico desde el Golfo de California, México, hasta Perú, e Islas Galápagos. En el área de estudio: Lagunas de Chautengo y Potosí. Material examinado 2 ejemplares de 82 a 103 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Linmología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000,852 (Gro.). Observaciones. Sphoeroides lobatus ha sido una especie rara donde quiera se le haya recolectado (Meek y Hildebrand, 1928; Castro et al., 1970; Chirichigno, 1974). En este trabajo sólo fueron capturados 2 ejemplares, juveniles, cuyo análisis estomacal indicaba detritus y restos de macroinvertebrados moluscos y crustáceos. Aparentemente la especie puede utilizar los estuarios como áreas de crianza comportándose como un consumidor secundario. En el sistema lagunar costero de Guerrero Sphoeroides lobatus es instrascendente en la estructura de las cornunidades estudiadas y carece de importancia comercial. Taxonómicamente es difícil diferenciar a las especies del género Sphoeroides por cuanto existen grandes variaciones merísticas y morfométricas (especialmente estas últimas) entre los especímenes, aun de la misma especie. 104) Sphoeroides annulatus (Jenyns, 1842). N. v. "Botete", "Tambor", "Pez globo"(Lám. 32, Fig. 2) Tetrodon annulatus Jenyns, in Darwin, Zool. Voy. Beagle, Fish., 1842, 4:153. Anchisomus geometricus Kaup, in Richardson, in Forbes, Zool. Voy., Herald, 1854: 156, lám. 30 (no el de Bloch y Schneider). Tetrodon politus Girard, House of Repr. Ex. Doc. 91; Rept. Expl. y Surv. Miss. R. to Pac. 0., 1858, 10(4): 340. Tetrodon heraldi Günther, Cat. Fish. Brit. Mus., 1870, 7:283. Tetrodon geometricus Günther, Trans. Zool. Soc. London, 1869, 6:489. Sphoeroides testudineus var, annulatus Jordan y Edwards, Proc. U. S. Nat. Mus., 1882: 240. Sphoeroides politus Jordan y Bollman, Proc. U. S. Nat. Mus., 1889 (1890): 183. Cheilichthys annulatus Jordan, Evermann y Clark, U. S. Bureau of Fisheries, 1930, 2:499. Sphoeroides annulatus Jordan y Evermann, Bull. U. S. Nat. Mus., 1898, 17:1735; Gilbert y Starks, Mem. Cal. Ac. Sci., 1904, 4:157; Kendall y Radcliffe, Mem. Mus. Comp. Zool, Harv., 1912, 35:165; Fowler, Proc. Ac. Nat, Sci. Phila., 1916: 411; Meek y Hildebrand, Field Mus. Nat, Hist. Publ. Zool. Ser., 1928, 15(249): 816-817, lám. 78, fig. 1; Hiyarna et al., Peces Marinos de la Costa Mexicana del Pacífico, 1940: 58, lám. 87; Hildebrand, Bull. U. S. Nat. Mus., 1946, 189:484-486; Ramírez-Hernández y Arvizú, An. Inst. Nal. Inv. Biól.-Pesq., 1965, 1:316; Ramírez-Hernández y Páez, An. Inst. Nal. Inv. Biol.-Pesq., 1965, 1:348; Castro, Arvizú y Páez, Revta, Soc, mex. Hist. Nat., 1970, 31:168; Miller y Lea, Fish. Bull. Cal. Dept. Fish. Game, 1972, 157:208-209; Amezcua-Linares, Tesis profesional Fac, Ciencias Univ. Nal. Autón. México, 1972: 195-197, lám. 14, fig. 5; y An. Centro Cienc. del Mar y Limnol. Univ, Nal. Autón. México, 1977, 4(1):1-25, Chirichigno, Inf. Inst. Mar Perú-Callao, 1974, 44:116 y 350; 5. 1. C. Catálogo de Peces Marinos Mexicanos, 1976: 129 y 432. Diagnosis. Cuerpo algo alargado, grueso, robusto y subcilíndrico. Cabeza larga 2.7 a 3.0 en la longitud patrón; hocico moderadamente romo 2.0 a 2.5 en la longitud cefálica; ojos pequenos 5.0 a 7.0 en la cabeza; interorbital ancho y plano 2.5 3.0 en la cabeza; sin espinas evidentes sobre el hocico, si las hay son apenas perceptibles, tampoco se presentan por detrás de las aletas dorsal y anal ni tampoco en los flancos. Altura máxima 3.4 a 4.0 en la longitud patrón. D 0-1, 7-8; A 01, 6-8; P 16. Branquiespinas, 8 sobre la rama inferior del primer arco. Aleta dorsal implantada muy atrás, rayos altos; anal ubicada por abajo de la dorsal y de menor tamaño; pectorales muy anchas de 2.1 a 2.3 en la longitud cefálica; caudal ligeramente convexa. Vértebras 18 a 19. Color. Dorso pardo oscuro con reticulaciones o líneas pálido amarillentas que encierran áreas elípticas o circulares y ocupan una posición longitudinal, una elipse pequeña encerrada en una más grande (Lám. 33, Fig. 2). Vientre pálido. Distribución. En el Océano Pacífico desde el Golfo de California, México, hasta Perú, e Islas Galápagos. En el área de estudio: Lagunas de Chautengo, Nuxco y Potosí. Material examinado. 15 ejemplares de 97 a 244 mm de longitud total. Colección de referencia depositada en el Laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-PF 0.000.854/.856 (Gro.). Observaciones. Sphoeroides annulatus es una especie mucho más frecuente que S. lobatus pero no necesariamente abundante en el sistema lagunar costero de Guerrero. Castro et al. (1970) encontraron que esta especie es muy común en el Golfo de California. Agregando además que penetra a los estuarios y a veces se congrega en cantidades numerosas frente a la desembocadura de los ríos. En efecto, en este trabajo se considera que Sphoeroides annulatus puede utilizar las, lagunas cosieras como áreas de crianza para completar parte de su desarrollo. Sus hábitos alimenticios son de consumidor secundario puesto que son preferentemente carnívoros, pero incluyen también detritus en su dieta, dentro de las lagunas. Amezcua-Linares (1972) encontró moluscos, crustáceos y peces en los estómagos de esta especie en Nayarit. La importancia comercial de las especies deSphoeroides es todavía discutida, por la toxicidad de algunas partes del cuerpo del pez. Sin embargo, los filetes pueden ser consumidos sin problemas. Esa es una explotación que está empezando a tomar auge en ambas costas de México, en especial con la especie Sphoeroides testudineus (Linnaeus) en el Golfo de México. Familia XXXVII. Diodontidae. Género 67. Diodon Linnaeus, 1758 105) Diodon hystrix Linnaeus, 1758. N. v. "Pez erizo", "Pez puercoespín"(Lám. 32, Fig. 3) Diodon hystrix Linnaeus, Syst. Nat. Ed. 10, 1758: 335. Guamajacu guara Maregrave, Hist. Nat. Bras., 1648: 159. Diodon plumieri Lacépéde, Hist. Nat. Poiss., 1798, 2: 1, lám. 3, fig. 3. Diodon atinga Bloch, Naturg. Ausl. Fische, 1785, 1:67, lám. 125 (no el de Linnaeus). Diodon brachiatus Bloch y Schneider, Syst. Ichth., 1801: 513. Diodon punctatus Cuvier, Mem. Mus. d'Hist, Nat., 1818, 4:132. Diodon echinus Rafinesque, in Bonaparte, Cat. Met. Pesci Eur., Atti Sci. Ital., 1846: 87. Diodon hystrix Linnaeus; Günther, Cat. Fish. Brit. Mus., 1870, 8:306; Jordan y Evermann, Bull. U. S. Nat. Mus. 1898,17:1745, lám. 266, fig. 648; Fowler, Proc. Ac. Nat. Sci. Phila., 1916: 411; Meek y Hildebrand, Field Mus. Nat. Hist. Publ. Zool. Ser., 1928,15(249):827829; Jordan, Evermann y CIark, U. S. Bureau of Fisheries, 1930, 2:501; Ramírez-Hernández y Páez, An. Inst. Nal. Inv. Biol.-Pesq., 1965, 1:348; Miller y Lea, Fish. Bull. Cal. Dept. Fish. Game, 1972, 157:208-209; Chirichigno, Inc. Inst. Mar Perú-Callao, 1974: 114 y 333; S. I. C, Catálogo de Peces Marinos Mexicanos, 1976: 1,30 y 432. Diagnosis. Cuerpo robusto, generalmente tali amplio como profundo. Cabeza deprimida, mucho más amplia que deprimida, 2.2 a 2.4 en la longitud patrón; hocico corto 2.8 a 3,1 en la longitud cefálica; ojos 2.8 a 3.5 en la cabeza; interorbital muy amplio, suavemente cóncavo 1.4 a 1.5 en la longitud cefálica; boca grande, labios delgados; espinas dérmicas moderadas, proporcionalmente más cortas en los adultos. Altura máxima 3.2 a 3,0 en la longitud patrón, D 12-15; A 13-15; P 21-23. Branquiespinas rudimentarias 6 sobre la rama inferior del primer arco. Vértebras 20. Aletas dorsal y anal similares colocadas posteriormente, la dorsal colocada un poco más adelante que la anal; caudal redondeada ligeramente más grande que las pectorales; pectorales amplias, suavemente truncadas con el lóbulo superior más grande 1.6 a 2.3 en la longitud cefálica. Color. Dorso oliváceo, vientre pálido. El dorso anterior, el hocico y las aletas con manchas más oscuras redondeadas. Una barra oscura cruzando debajo de las pectorales, A veces se presentan reticulaciones oscuras y claras entre las espinas dérmicas del dorso y los flancos. Aletas amarillentas. Distribución. Cosmopolita de mares tropicales. En el Océano Pacífico desde el Golfo de California hasta Chile, incluyendo Islas Galápagos, Hawaii y otras islas del Pacífico sur. En el Atlántico desde Massachusetts hasta Brasil, incluyendo el Golfo de México, las Antillas, Panamá y Colombia. En el área de estudio: Lagunas de Chautengo, Nuxco y Salinas del Cuajo. Material Examinado 8 ejemplares de 85 a 113 mm de longitud total. Colección de referencia depositada en el laboratorio de Ictiología del Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Catálogo CCML-P17 0.000.857/.859 (Gro.). Observaciones. Diodon hystrix puede considerarse una especie rara en sistema lagunares del Pacífico mexicano. Es en realidad un visitante excepcional en las lagunas costeras de Guerrero donde algunos adultos se aproximan cerca de las bocas en busca de alimento. Por sus hábitos alimenticios es un consumidor secundario. Carece de importancia económica en el área estudiada y también es intrascendente en la estructura de las comunidades. Numerosas discusiones debaten la validez de Diodon holacanthus Linnaeus frente a D. hystrix. Meek y Hildebrand (1928) separan estas dos especies sobre la base de la longitud de las espinas dérmicas, presentando D. hystrix las espinas frontales iguales o menores en tamaño que las espinas postpectorales. En D. holcanthus las espinas frontales serían mucho más grandes. Sin embargo, Clark (1949) y Ricker (1959a y 1959b) señalan que éstas y otras diferencias pudieran deberse a la edad y al crecimiento alométrico. No obstante la especie holacanthus sigue siendo válida y numerosos autores recientes la reportan en aguas tropicales, también de México. CONSIDERACIONES ZOOGEOGRÁFICASEs conocido que la radiación de la fauna tropical Indo-Pacífica en el Pacífico, disminuye progresivamente hacia el este hasta interrumpirse bruscamente en lo que Ekman (1953), Briggs (1961) y Rosemblatt (1967) han denominado inicialmente la Barrera Este del Pacífico, discutida recientemente por Castro et al. (1970) para la costa de México y por Yáñez-Arancibia (1975 c) para islas del Pacífico sur. Esta barrera corresponde a una extensión pelágica considerable y separa esencialmente la fauna Americana de la de Oceanía. Aparentemente esta barrera determina en gran medida que la fauna de peces costeros de América tropical sea tan diferente de la fauna IndoPacífica. Aun cuando Briggs (1961, 1964, 1966, 1970 y 1974) y Castro et al. (1970) han encontrado no menos de 63 especies transpacíficas que han colonizado las aguas del Pacífico Oriental provenientes del Indo-Pacífico y aparentemente ninguna lo habría hecho en sentido contrario. La dispersión de la ictiofauna Americana hacia occidente sólo ha llegado a ciertas islas del Pacífico (Rosemblatt y Walker, 1963; Yáñez-Arancibia, 1975 c) , pero se ha demostrado recientemente que algunas de esas especies se encuentran en el Golfo de México y el Caribe (Rosemblatt et al., 1972; Rosen, 1975). Estos planteamientos parecen sencillos. Sin embargo hay complejidad para entender la dispersión de las poblaciones y comunidades de peces. Rosemblatt y Walker (1963) y Ricker (1959 a) entre otros, han notado similitud ictiofaunística entre el litoral de Cabo San Lucas y el sector oceánico del Archipiélago de Revillagigedo. Castro et al, (1970), por otra parte, hacen hincapié en la semejanza entre algunas especies del norte del Golfo de California y la costa occidental de Baja California, situación que Hubbs (1960) ha tratado de explicar por diferentes hipótesis que resumidamente establecen: 1) fauna templado-cálida y templado-fría que radiaron hacia el sur durante las primeras glaciaciones, 2) fauna templado-fría que llega hasta Cabo San Lucas e invade el interior del Golfo, 3) algunas especies anadromas alcanzan las aguas continentales de la costa occidental de México en Sonora, 4) fauna invasora y ahora característica de la fauna del sur de California y noroeste de Baja California han sobrevivido hasta la era actual adaptando su reproducción y desarrollo, de menores temperaturas durante el invierno. Ahora bien, de algunos trabajos puede deducirse que los sistemas lagunares costeros deben ser considerados como unidades biogeográficas muy particulares, por cuanto sus características ecotónicas les confieren, más que características eventuales o de transición, propiedades específicas y de precisa definición (ver Ayala-Castañares, 1966; Chávez, 1972; Yáñez-Arancicibia 1975 c y 1977). En ese contexto el sistema lagunar costero de Guerrero, puede considerarse una unidad ictiobiogeográfica bastante interesante. Analizando el panorama ictiofaunístico litoral del Pacífico Oriente (Tabla 2, Fig. 6 a) . Se puede constatar, que las lagunas de Guerrero comparten sólo un par de géneros con los peces del Pacífico de Canadá y prácticamente ninguna especie (ver Hart, 1973). Por otra parte, las lagunas costeras de Guerrero comparten con California, FEUU, 16 especies (15%), con el Golfo de California 33 especies (31%), con el sistema lagunar costero de Huizache-Caimanero, Sinaloa, 48 especies (45%), con el sistema lagunar costero de Agua Brava, Nayarit, 51 especies (48%), con la ictiofauna del litoral de Guerrero 60 especies (60%) (probablemente debe ser mayor la afinidad), con el Pacífico Oriental Tropical de Panamá-Colombia-Ecuador 70 especies (67%), con la ictiofauna litoral de Perú 62 especies (60%), con el litoral del norte de Chile 4 especies (4%), con las islas Galápagos 17 especies (16%), con la costa del Sur del Golfo de México y Caribe 16 especies (15%), con la ictiofauna continental sudamericana 5 especies (5%) especies introducidas 2 (2%) y 11 especies son endémicas del Pacífico mexicano (10%). Canadá y Chile representan los extremos en la dispersión ictiofaunística del Pacífico Oriental y su afinidad ictiogeográfica obviamente es despreciable con el sistema lagunar costero de Guerrero; ver Meek y Hildebrand (1923, 1925 y 1928), Hildebrand (1946), Roedel (1953), Mann (1954a y 1954b), Berdegué (1956), De Buen (1959 y 1960), Ricker (1959b) , Koepcke (1962a, 1962b, 1962c, 1963a, 1963b y 1964) Rosemblatt y Walker 1963), Díaz (1965), Ramírez-Hernández y Arvizú (1965), Ramírez-Hernández y Páez (1965), Thompson y Eger (1966), Massay-Camposano (1967), Castro et al. (1970), Chirichigno (1969 y 1974), Dahl (1972), Miller y Lea (1972), Amezcua-Linares (1972 y 1977), Yáñez-Arancibia y Nugent (1975), Yáñez-Arancibia (1977, 1978 a y 1978 b) 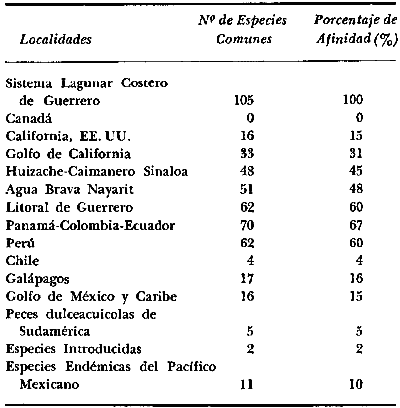 TABLA 2. DISTRIBUCIÓN DEL NÚMERO DE ESPECIES Y SU PORCENTAJE DE AFINIDAD EN LA COSTA OCCIDENTAL DE AMÉRICA (PACÍFICO ORIENTAL) 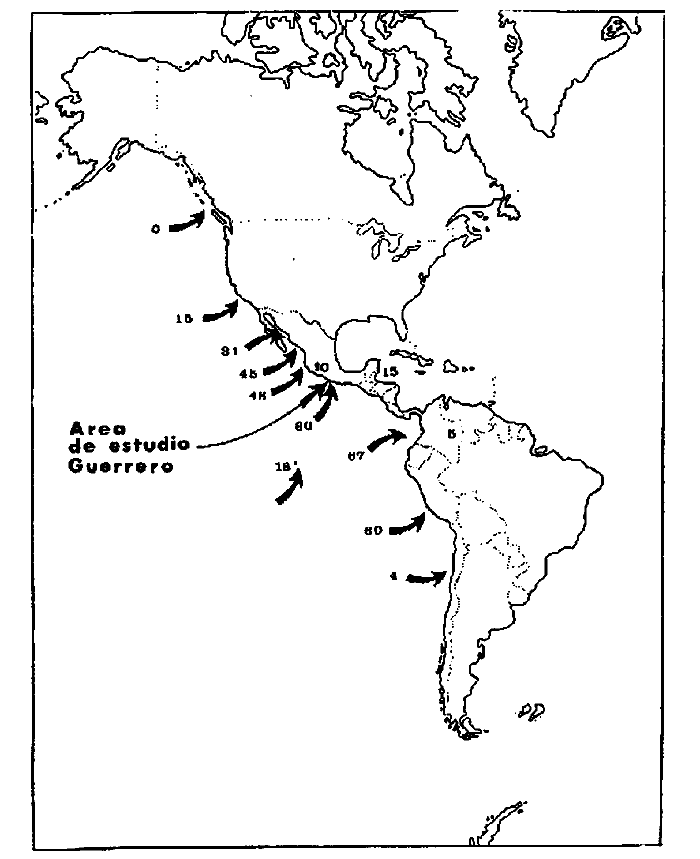 Fig. 6a. Ubicación latitudinal del Sistema Lagunar Costero de Guerrero, México, en el contexto del Pacífico Oriental. Los números corresponden a los porcentajes (%) de afinidad ictiogeográfica entre el área de estudio y las diferentes localidades consideradas en la discusión. Es evidente que existe un gran contraste con la ictiofauna Nororiental Pacífica y una gran afinidad con el Trópico Oriental y el sur del Pacífico Americano. Es sorprendente cómo la ictiofauna lagunar de Guerrero puede llegar hasta Perú con una afinidad de 60%, y, por el contrario, con California, EE.UU., esa afinidad es apenas del 15% y "cero" con Canadá. La vecindad de esas localidades, al norte de Guerrero, lo hace más evidente, todavía cuando algunas especies del sistema lagunar costero de Guerrero se encuentran en las islas Revillagigedo, las Galápagos (16%) y aún la costa del Atlántico tropical de América (15%). Esta última situación puede tener su explicación por la presencia de paleogrupos relictos del circumglobal Mar de Thetys. y/o por efectos recientes del Canal de Panamá (ver Rosemblatt et al., 1972; Rosen, 1975). Revisando los estudios de Ekman (1953), Hedgpeth (1957), López (1963), Rosemblatt (1967), Bakus (1969), Mead (1970), Briggs, (1974) y Yáñez-Arancibia (1975c) , se puede asumir como hipótesis que la ictiofauna costera del Pacífico Oriental ha seguido ciertos patrones de radiación limitados más bien por el avance en el grado de evolución y adaptación a las masas de aguas fríotemperadas, por una capacidad de desplazamiento de los peces. COMPOSICIÓN Y DIVERSIDAD DE LAS COMUNIDADES. ABUNDANCIA DE LAS ESPECIES Y POBLACIONESSe acepta que el origen y la distribución de la fauna estuarina deriva parcialmente de la fauna dulceacuícola y parcialmente de la fauna marina; reconociéndose, por consiguiente, diversos componentes faunísticos. Particularmente en el caso de los peces, Yáñez-Arancibia (1975a y 1976b) y Yáñez-Arancibia y Nugent (1977) considera que en las lagunas costeras de México pueden presentarse seis componentes ictiofaunísticos. La dinámica ecológica del ambiente se refleja en la composición cual¡ y cuantitativa de esas comunidades ictiofaunísticas, las que pueden estar formadas por todos o solamente algunos de los siguientes grupos (Fig. 7) : 1) peces dulceacuícolas que ocasionalmente penetran en las aguas salobres, 2) peces anadromos y catadromos, en tránsito a través del estuario, 3) peces verdaderamente estuarinos, los cuales permanecen toda su vida en el estuario, pudiendo penetrar ocasionalmente al mar o al agua dulce, 4) peces marinos que utilizan el estuario como áreas de crianza, o para desovar, pero pasan la mayor parte de su vida en el mar, regresando al estuario estacionalmente, 5) peces marinos que efectúan visitas al estuario, generalmente como adultos y para alimentarse, 6) visitantes marinos ocasionales que irregularmente penetran al estuario por diferentes razones (marejada, tormentas, etcétera) , no son muy importantes cuantitativa mente pero es necesario señalarlos (Fig. 7) Las comunidades varían en su composición y abundancia relativa de especies de acuerdo a: 1) las condiciones hidrológicas del sistema, consecuencia de 2) la estación del año, 3) la localidad dentro del estuario y sus gradientes de salinidad y, eventualmente, puede existir un 4) factor, la disponibilidad de alimento. Considerando las 105 especies encontradas en el sistema lagunar costero de Guerrero, pueden ser caracterizadas de las siguiente manera: 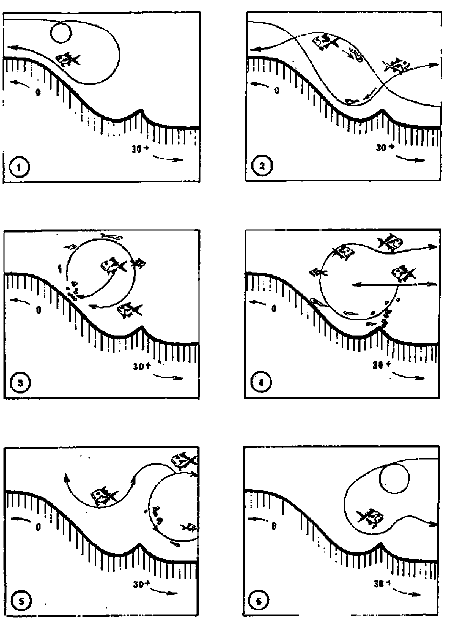 Fig. 7 Composición de las comunidades ictiofaunísticas en estuarios y lagunas costeras de México. (1) Peces dulceacuícolas, (2) peces migratorios en tránsito, (3) y (4) peces marinos eurihalinos, (5) y (6) peces marinos estenohalinos. Explicación en el texto. PECES DULCEACUÍCOLAS: (±: 14 %) Astyanax fasciatus Poecilia sphenops Poeciliopsis lucida Poeciliopsis porosus Poeciliopsis balsas Poecilistes pleurospilus Thyrinops crystallina Cichlasoma trimaculatum Tilapia mossambica Eleotris pictus Gobiomorus maculatus Dormitator latifrons Microgoblus miraflorensis Awaous nelsoni Chonophorus sp Sicydium sp PECES ANADROMOS: (0%) .................. PECES CATADROMOS: (0%) .................. PECES PROPIAMENTE ESTUARINOS: (6%) Lile stolifera Galeichthys caerulescens Galeichthys gilberti Arius liropus Gobionellus microdon Gobionellus sagittula PECES MARINOS QUE UTILIZAN EL ESTUARIO COMO ÁREAS DE CRIANZA: (± 28 %) Albula vulpes Chanos chanos Centropomus nigrescens Centropomus robalito Caranx hippos Caranx marginatus Caranx latus Caranx caballus Oligoplites mundus Oligoplites saurus Oligoplites altus Diapterus peruvianus Gerres cinereus Eugerres lineatus Eugerres axillaris Eucinostomus currani Eucinostomus entomelas Eucinostomus dowii Mugil cephalus Mugil curema Polydactilus approximans Cyclopsetta querna Citarichthys gilberti Etropus crossotus Achirus mazatlanus Achirus panamensis Achirus klunsingeri Trinectes fonsecensis Sphoeroides lobatus Sphoeroides annulatus PECES MARINOS QUE UTILIZAN EL ESTUARIO COMO ADULTOS PARA ALIMENTARSE: (± 31%) Elops affinis Albula vulpes Dixonina nemoptera Opisthonema libertate Opisthopterus dovii Pliosteostoma lutipinnis Anchovia macrolepidota Anchoa panamensis Anchoa mundeoloides Anchoa curta Anchoa schofieldi Hyporhamphus unifasciatus Hyporhamphus patris Strongylura stolzmanni Tylosurus fodiator Centropomus Pectinatus Selene brevoorti Trachinotus rhodopus Lutianus novemfasciatus Lutjanus argentiventris Lutjanus guttatus Pomadasys leuciscus Pomadasys macracanthus Pomadasys branickii Umbrina xanti Micropogon altipinis Micropogon ectenes Cynoscion stolzmanni Cynoscion xanthulus Menticirrhus elongatus Menticirrhus nasus Scomberomorus maculatus Diodon hystrix PECES MARINOS VISITANTES OCASIONALES: (±21 %) Heterodontus francisci Ginglymostoma cirratum Pristis zephyreus Urotrygon nebulosus Urotrygon asterias Urotrygon aspidurus Urotrygon goodei Urotrygon chilensis Urotrygon sp A Myrophis vafer Prionotus ruscarius Diplectrum pacificum Caranx medusicola Oligoplites refulgens Trachinotus rhodopus Pomadasys branickii Menticirrhus elongatus Menticirrhus nasus Kyphosus elegans Abudefduf saxatilis Sphyraena ensis Bathygobius soporator Microdesmus dipus Los porcentajes encontrados; esto es, 14%, de peces dulceacuícolas, 6%, de peces propiamente estuarinos, 28% de peces marinos que utilizan el estuario como área de crianza o para desovar, 31% de peces marinos que utilizan el estuario como adultos y para alimentarse, y 21% de visitantes marinos ocasionales; son cifras relativas. No obstante, dan un panorama general de la composición de las comunidades las cuales, sin embargo, están estructuradas con diferentes composiciones de acuerdo a las diferentes lagunas, como se discute a continuación. El estoc de peces dulceacuícola (por su limitada tolerancia a variaciones de salinidades) proporcionan un buen patrón de comparación ecológica entre las diferentes lagunas y es conveniente considerar dos grupos principales de peces (i. e., dulceacuícolas y marinos) para apreciar las variaciones mayores en la estructura de las comunidades. SALINAS DE APOZAHUALCODiversidad Examinados 1013 especímenes fueron determinadas 39 especies (Tabla 3), lo que arrojó un índice de diversidad total H' de 2.7076. Sin embargo, la diversidad varía en el tiempo según el momento ecológico de la laguna. Durante el periodo 1, en septiembre, fueron encontradas 27 especies con un índice H' de 2.2677 y en octubre fueron encontradas 35 especies con un índice H' de 2.5287. Durante el periodo 2, fueron encontradas 8 especies con un índice H' de 1.6665. Durante el periodo 3 fueron encontradas 9 especies con un índice H' de 2.0360. La ictiofauna durante el Periodo 1 es predominante marina y la laguna puede alcanzar niveles de alta producción con una gran actividad pesquera en los poblados locales. Los peces adulceacuícolas alcanzan un 7.4%, en septiembre y un 20% en octubre como componentes comunitarios (i. e., 13.7% promedio) . Las especies más importantes de acuerdo al índice de diversidad han sido Mugil curema, M. cephalus, Diapterus peruvianus, Elops affinis, Lutjanus novemfasciatus, Caranx hippos, Oligoplites saurus, Anchovia macrolepidota, Eucinostomus currani y Centropomus spp. Durante el periodo 2 resisten algunas pocas especies que al mismo tiempo son poco abundanten en número de ejemplares porque además de muerte natural son objeto de sobrepesca en los meses anteriores. El aumento de la salinidad y la temperatura, además de la reducción de más de un 50% del volumen de agua de la laguna, determinan estres muy marcados que ocasionan la muerte de la mayoría de la fauna en general. Los peces dulceacuícolas alcanzan sólo un 1.25% como componentes comunitarios. Mugil curema y Diapterus peruvianus predominan en este periodo. Durante el periodo 3 la diversidad sigue siendo baja pero ligeramente superior al periodo anterior por el aporte de ictiofauna netamente dulceacuícola, abundante en términos de densidad de sus poblaciones. Las especies Lile stolifera Astyanax fasciatus, Cichlasoma trimaculatum, Gobiomorus maculatus, Dormitatur latiforons Gobionellus microdon y algunos Poecílidos son particularmente característicos durante este periodo. Las especies dulceacuícolas alcanzan un 76.6% como componentes comunitarios. Muy pocas especies pueden encontrarse durante todo el año (10%). Entre ellas las más importantes han sido Galeichthys caerulescens (poco abundante), Lile stolifera, Mugil curema y Diapterus peruvianus, siendo L. stolifera poco significativa y durante el periodo 2 eventualmente se le colecta pero hacia el interior de los arroyuelos. En las tablas 4 a 7 se señalan los valores de N, n y H` para cada colecta. Abundancia A comienzos del periodo 1, en septiembre, fueron colectados 360 ejemplares en 60 lances de pesca (Mapa 2; estaciones 1, 2, 3, 4, 5, B) . Cada lance cubre una superficie de 19.5 m² lo que determina una superficie total muestreada de 1 170 m². La densidad promedio de captura correspondió a 6 ejemplares por cada 19.5 m². Considerando toda la superficie de la laguna i. e., 2 km² o bien 4 millones de m²) puede ser estimada una densidad total del momento de 12,307.692 peces, de los cuales (Tabla 3) el 51 % fueron "lisas", el 11 % "mojarras", el 8% "carángidos", el 6% "pargos", el 4% "anchovetas", el 3%, "robalitos", entre los principales peces. 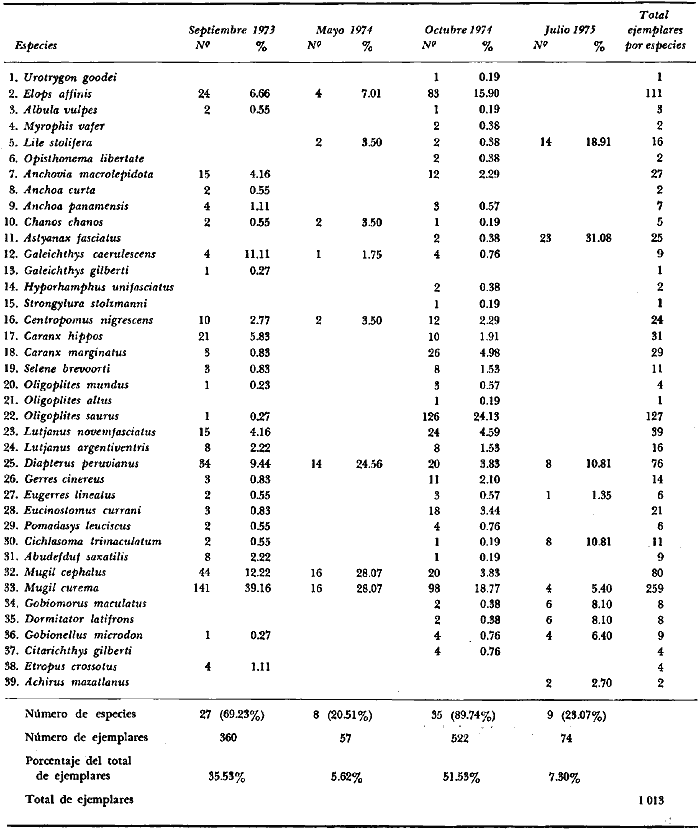 TABLA 3. LAGUNA SALINAS DE APOZAHUALCO En el mes de octubre del mismo periodo 1, fueron colectados 522 ejemplares en 90 lances de pesca (Mapa 2; estaciones 1, 2, 3, 4 (2), 5, 7, 8, B) La superficie total muestreada fue de 1 755 m² La densidad promedio de captura correspondió a 5.8 ejemplares por cada 19.5 m². Considerando toda la superficie de la laguna puede ser estimada una densidad total del momento de 11,897,435 peces, de los cuales (Tabla 3) el 33% son "carangidos", el 23% son "lisas", el 16%, son "machetes", el 10% son "mojarras", el 6% son "pargos", el 2% son "anchovetas", entre los principales peces. 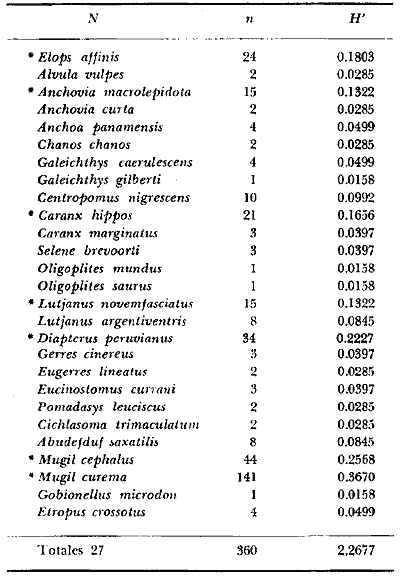 TABLA 4. SALINAS DE APOZAHUALCO. Periodo 1 - Septiembre  TABLA 5. SALINAS DE APOZAHUALCO. Periodo 1 - Octubre  TABLA 6. SALINAS DE APOZAHUALCO. Periodo 2 - Mayo 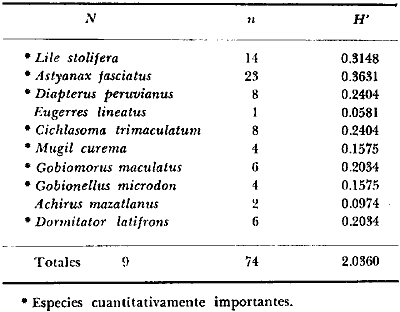 TABLA 7. SALINAS DE APOZAHUALCO. Periodo 3 - Julio En el periodo 2 fueron colectados 57 ejemplares en 20 lances de pesca (Mapa 2; estaciones 8 y 4). El resto de la laguna s 1 e encuentra seca. La superficie total muestreada fue de 390 m². La densidad promedio de captura correspon dió a 2.85 ejemplares por cada 19,5 m². La laguna sólo tiene un 25% de su superficie con agua. Puede ser estimada una densidad total del momento de 1,461.538 peces, de los cuales (Tabla 3) el 56% son "lisas", el 25% son "mojarras y el 7% son "machetes", entre los principales peces. En el periodo 3 fueron colectados 74 ejemplares en 90 lances de pesca (Mapa 2; estaciones 1, 2, 3, 4 (2), 5, 7, 8, B). La superficie total muestreada fue de 1755 m². La densidad promedio de captura correspondió a 0.8 ejemplares por cada 19.5 m². La laguna nuevamente ha recuperado su superficie total de agua y puede ser estimada una densidad total del momento de 1,641.025 peces, de los cuales (Tabla 3) el 31% son Astyanax, el 19% son Lile, el 12% son "mojarras", el 11%, son "charros- entre los más importantes. CHAUTENGODiversidad Examinados 4 325 especímenes fueron determinadas 85 especies (Tabla 8) , lo que arrojó un índice de diversidad total H' de 2.1588. Esta diversidad vería en el tiempo. Durante el periodo 1, en septiembre, fueron encontradas 61 especies con un índice H' de 1.9848. Durante el periodo 2 fueron encontradas 18 especies con un índice H' de 1.5237. Durante el periodo 3 fueron encontradas 22 especies con un índice H' de 1.8776. En octubre del periodo 1 fueron encontradas 70 especies con un índice H' de 2,2798. Al igual que la laguna de Apozahualco, la ictiofauna de esta laguna durante el periodo 1 es predominantemente marina y se alcanzan niveles de alta producción pesquera. Los peces dulceacuícolas alcanzan un 9.8% en septiembre y un 10.0% en octubre como componentes comunitarios (i. e., 9.9% promedio). Las especies más importantes de acuerdo al índice de diversidad han sido Diapterus peruvianus, Mugil curema, Galeichthys caerulescens, Anchovia macrolepidota y Centropomus robalito. Durante el periodo 2 el fenómeno es similar a la laguna de Apozahualco, sin embargo la reducción del volumen de aguas no sobrepasa el 10% Los peces dulceacuícolas alcanzan un 16.6% cfomo componentes comunitarios pero son muy poco abundantes. Diapterus peruvianus, Galeichthys caerulescens, Mugil curema y Anchovia macrolepidota predominan en este periodo. 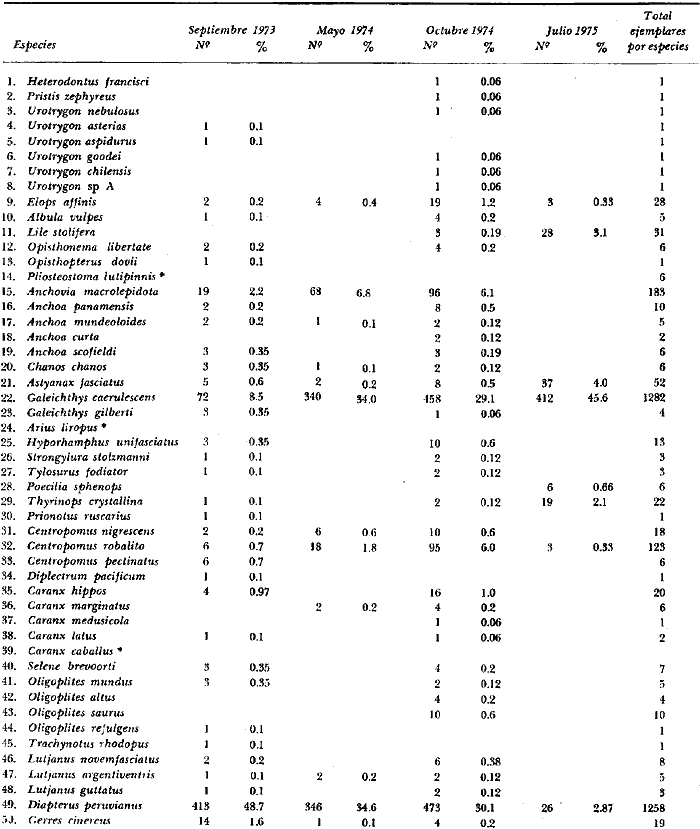 TABLA 8. LAGUNA DE CHIAUTENGO 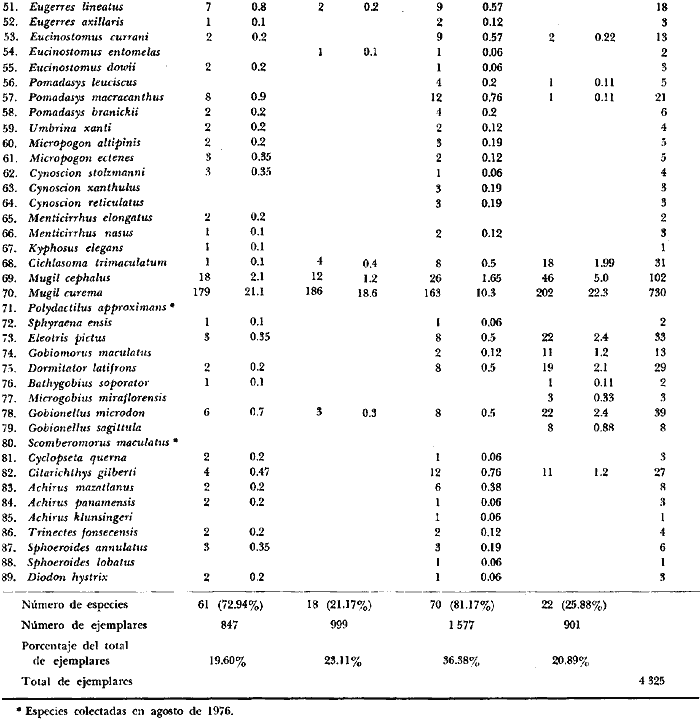 TABLA 8 (continuación) Durante el periodo 3 la diversidad aumenta en relación al periodo anterior con aporte de fauna dulceacuícola. Galeichthys caerulescens y Mugil curemason muy abundantes. Asi mismo son característicos de este periodo Lile stolifera, Astyanax fasciatus, Thyrinops crystallina, Diapterus peruvianus, Cichlasoma trimaculatum, Mugil cephalus, Elotris pictus, Dormitator latifrons y Gobionellus microdon. Las especies dulceacuícolas alcanzan un 50.0 % como componentes comunitarios. Muy pocas especies se encuentran durante todo el año. Entre ellas las más importantes han sido Elops affinis, Astyanax fasciatus, Galeichthys caerulescens, Centropomus robalito, diapterus peruviannus, Cichlasoma trimaculatum, Mugil cephalus, M. Curema y Gobionellus sólo en las desembocaduras de distributarios. En las tablas 9 a 12 se señalan los valores de N, n y H' para cadad colecta. 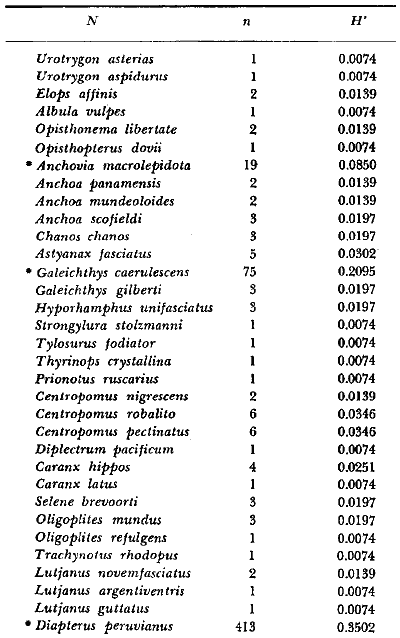 TABLA 9. CHAUTENGO. Periodo 1 - Septiembre  TABLA 9 (continuación) Abundancia A comienzos del Periodo 1, en septiembre, fueron colectados 847 ejemplares en 70 lances de pesca (Mapa 3; estaciones 1-9 y 2-2). La superficie total muestreada fue de 1 365 m². La densidad promedio de captura correspondió a 12 ejemplares por cada 19.5 m². Considerando toda la superficie de la laguna (i. e., 34 km² o bien 1.156,000.000 m²) puede ser estimada una densidad total del niomento de 7.113,894.615 peces, de los cuales (Tabla 8) el 52% son "mojarras", el 23% son "lisas", el 30% son "anchovetas", el 2% son "robalitos" y el 1% son "carangidos", entre las especies más importantes. 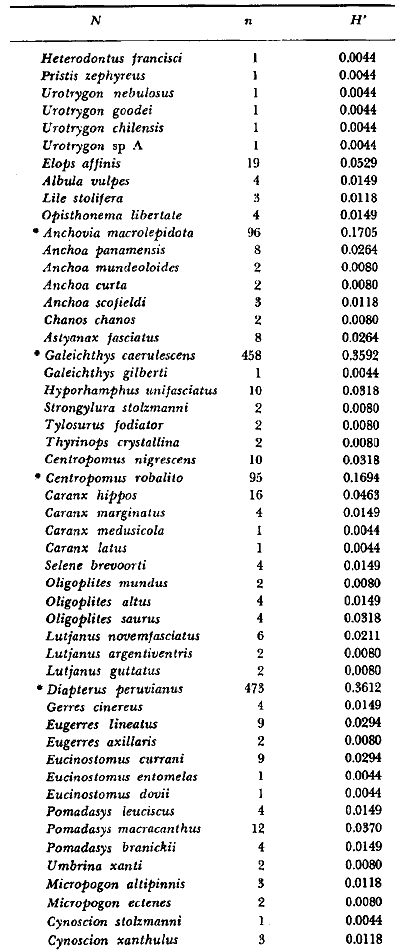 TABLA 10. CHAUTENGO. Periodo 1 - Octubre 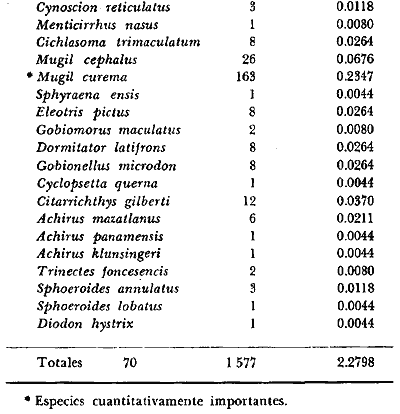 Tabla 10 (continuación) En el mes de octubre del mismo periodo 1 fueron colectados 1572 ejemplares en 130 lances de pesca (Mapa 3; estaciones 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 y 13). La superficie total muestreada fue de 2 525 m². La densidad promedio de captura correspondió a 12.1 ejemplares por cada 19.5 m². Considerando toda la superficie de la laguna puede ser estimada una densidad total del momento de 7.113,894,615 peces, de los cuales (Tabla 8) el 32%, son "mojarras", el 29% son "bagres", el 12% son "lisas" el 7% son "anchovetas, el 6% son "robalitos", el 2% son "carangidos" y el 1% son "machetes", entre los principales peces. En el periodo 2 fueron colectados 999 ejemplares en 130 lances de pesca (ídem estaciones periodo 1 ) . La superficie total muestreada fue de 2 525 m². La densidad promedio de captura correspondió a 7.68 ejemplares por cada 19.5 m². Considerando toda la superficie de la laguna puede ser estimada una densidad total del momento de 455,286.154 peces, de los cuales (Tabla 8) el 35% son "mojarras", el 34% son "bagres", el 20% son "lisas" el 7% son "anchovetas y el 2% son "robalitos" entre los más importantes. 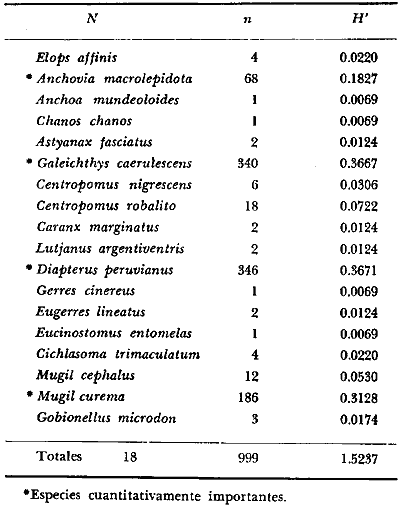 TABLA 11. CHAUTENGO. Periodo 2 - Mayo En el Periodo 3 fueron colectados 903 ejemplares en 130 lances de pesca (ídem estaciones periodos 1 y 2) La superficie total muestreada fue de 2 525 m². La densidad promedio de captura correspondió a 6.9 ejemplares por cada 19.5 m². Considerando toda la superficie de la laguna puede ser estimada una densidad total del momento de 409,046.153 peces, de los cuales (Tabla 8) el 46% son "bagres", el 27% son "lisas", el 9% son"gobidos", el 4%, son "charales" y el 3% son "mojarras", entre los principales peces. Para esta laguna en particular (además de la laguna de Tres Palos) fueron calculados valores de biomasa promedios. Durante el periodo 1, el promedio fue de 1,300 g (peso en fijador) por cada 19.5 m². Durante el periodo 2 el promedio fue de 864 g (peso por fijador) por cada 19.5 m². Durante el periodo 3 el promedio fue de 756 g (peso en fijador) por cada 19.5 m². 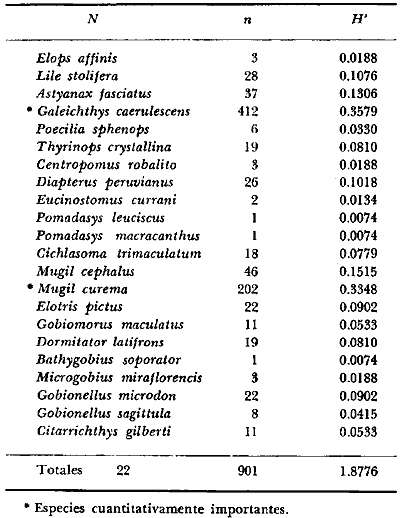 TABLA 12. CHAUTENGO. Periodo 3 - Julio TECOMATEDiversidad Examinados 1 353 especímenes fueron determinadas 33 especies (Tabla 13), lo que arrojó un índice de diversidad total H' de 2.4952. Esta diversidad varía en el tiempo. Durante el periodo 1 en septiembre (muestreo defectuoso), fueron encontradas 7 especies con un índice H' de 1.3165 y en octubre, en un muestreo normal 30 especies con un índice H' de 2.2880. Durante el periodo 3 fueron encontradas 13 especies con un índice H' de 2.1379 puesto que en el mes de junio ya comienzan las lluvias y alguna ictiofauna dulceacuícola invade la laguna. En esta laguna predominan, durante el periodo 1, los peces marinos, situación similar a las lagunas Salinas de Apozahualco y Chautengo. Los peces dulceacuícolas alcanzan un 16.6% en octubre como componentes comunitarios. Las especies más importantes de acuerdo al índice de diversidad han sido Diapterus peruvianus, Anchovia macrolepidota, Mugil curema, Euguerres lineatus, Galeichthys caerulescens y Lile stolifera. 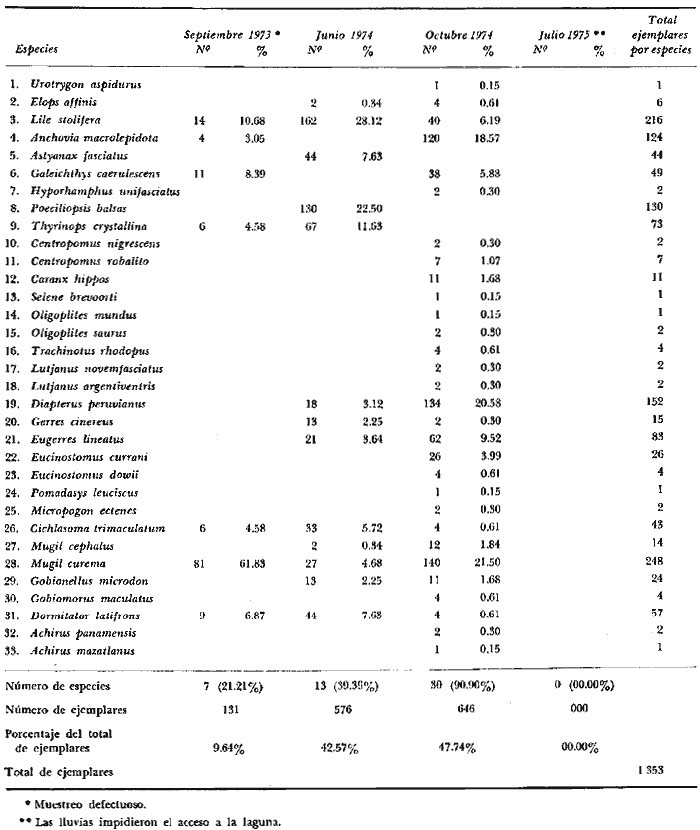 Tabla 13. LAGUNA DE TECOMATE Durante el periodo 3 esta laguna fue muesteada en junio ya comenzando las lluvias y la diversidad dulceacuícola aumenta hasta un 46.2%. En realidad junio corresponde al inicio del periodo 3 y eso explica el brusco aumento de la diversidad. Las especies más importantes de acuerdo al índice de diversidad han sido Lile stolifera, Poeciliopsis balsas, Thyrinops crystallina, Dormitator latifrons, Cichlasoma trimaculatum, Astyanax fasciatus, Mugil curema, Diapterus peruvinus y Euguerres lineatus. Durante el periodo 2 gran parte de esta laguna se seca y las actividades pesqueras sólo se concentran en la zona del canal. Dificultades económicas impidieron muestrear este periodo. Entre las especies que se encuentran todo el año en la laguna, las más importantes has sido Lile stolifera, Elops affinis, Diapterus peruvianus, Gerres cinereus, Euguerres lineatus, Thyrinops crystallina, Cichlasoma trimaculatum, Mugil cephalus, M. curema, Gobionellus microdon, Dormitator latifrons y Galeichthys caerulescens; lo que corresponde a un 33.3%. Durante el periodo 2 se colecta Lile, Thyrinops, Gobionellus y Dormitator sólo en las desembocaduras de distributarios. En las tablas 14 y 16 se señalan los valores de N, n y H' para cada colecta. 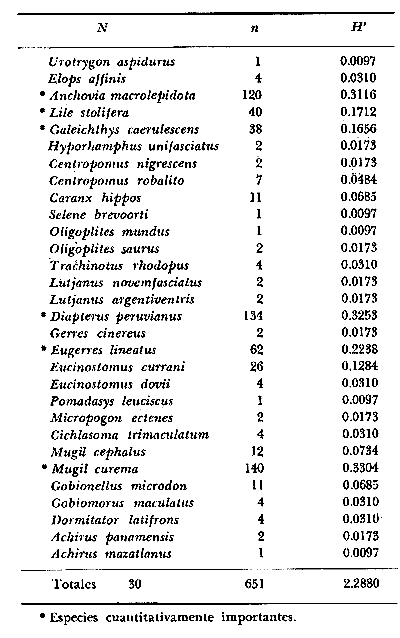 Tabla 14. TECOMATE. Periodo 1 - Octubre  Tabla 15. TECOMATE. Periodo 1 - Septiembre  Tabla 16. TECOMATE. Periodo 3 - Junio Abundancia Considerando solamente el muestreo de octubre del periodo 1, fueron colectados 646 ejemplares en 50 lances de pesca (Mapa 4; estaciones 1, 2, 3, 4, 5). La superficie total muestreada fue de 975 m². La densidad promedio de captura correspondió a 19 ejemplares por cada 19.5 m². Considerando toda la superficie de la laguna (i.e., 21 Km² o bien 252,000.000 m² puede ser estimada una densidad total del momento de 240,410.256 peces de los cuales (Tabla 13) el 35% son "mojarras", el 23% son "lisas", el 19% son "anchovetas" y el 6% son "bagres", entre los peces más importantes. En el periodo 3 fueron colectados 576 ejemplares en 67 lances de pesca (Mapa 4; estaciones 1, 2, 3, 4, 5, + zonas). La superficie total muestreada fue de 1307 m². La densidad promedio de captura correspondió a 8.5 ejemplares por cada 19.5 m². Considerando tada la superficie de la laguna puede ser estimada una densidad total del momento de 109, 738. 461 peces, de los cuales el 28% son "sardinitas", el 23% son "poecilidos", el 12% son "charales", el 6% son "charros", el 5% son "lisas", entre los principales peces. TRES PALOSDiversidad Examinados 3 930 especímenes fueron determinadas 31 especies (Tabla 17), lo que arrojó un índice de diversidad total H' de 1.9898. Esta diversidad varía en el tiempo. Durante el periodo 1, en septiembre, fueron encontradas 26 especies con índice H' de 1.8580 y en octubre fueron encontradas 24 especies con un índice H' de 2.1093. Durante el periodo 2 fueron encontradas 19 especies con un índice de 1.6924. Durante el Periodo 3 fueron encontradas 26 especies con un índice H' de 2.5335. Esta laguna contrasta notoriamente con las otras tres analizadas anteriormente. Durante el periodo 1 los peces dulceacuícolas alcanzan un 43.3% en septiembre y un 41.7% en octubre como componentes comunitarios (i. e., 42.5%, promedio) las especies más importantes de acuerdo al índice de diversidad han sido Poeciliopsis balsas, Galeichthys caerulescens, Poecilia sphenops, Poeciliopsis balsas, Mugil curema, Thyrinophs crystallina, Diapterus peruvianus, Dormitator latifrons y Gobiomorus maculatus. Durante el periodo 2 las variaciones no son significativas y la ictiofauna dulceacuícola alcanza un 52.6% como componentes comutitarios. Las especies más importantes de acuerdo al índice de diversidad han sido Galeichthys caerulescens, Poeciliopsis balsas, Eugerres lineatus Thyrinops crystallina, Mugil curema, y Dormitator latifrons. Durante el periodo 3 la diversidad es tan similar como en el periodo 1. Las especies dulceacuícolas alcanzan un 53.8% como componentes comunitarios. Las especies mejor representadas de acuerdo al índice de diversidad han sido Galeichtys caerulecens, Mugil curema, M. cephalus, Poeciliopsis balsas, Poeciliopsis spp, Poecilia sphenops, Gobiomorus maculatus, Astyanax fasciatus, Lile stolifera, Cichlasoma trimaculatum Eugerres lineatus, Eleotris pictus, Dormitator latifrons y Gobionellus microdon. En las tablas 18 a 21 se señalan los valores de N, n y H' para cada colecta. Entre los peces que se encuentran todo el año en la laguna, los más importantes han sido Lile stolifera, Astynax fasciatus Galeichthys caerulescens, Poecilia sphenops, Poeciliopsis lucida, Poeciliopsis porosus, Poeciliopsis balsas, Thyrinops crystallina, Diapterus peruvianus, Gerres cinereus, Eugerres lineatus, Eucinostomus currani, Cichlasoma trimaculatum, Mugil cephalus, M. curema, Eleotris pictus, Gobiomorus maculatus, Dormitator latifrons y Achirus mazatlanus. Es decir, un 59.4% de la ictiofauna total lo que demuestra la estabilidad del ambiente. 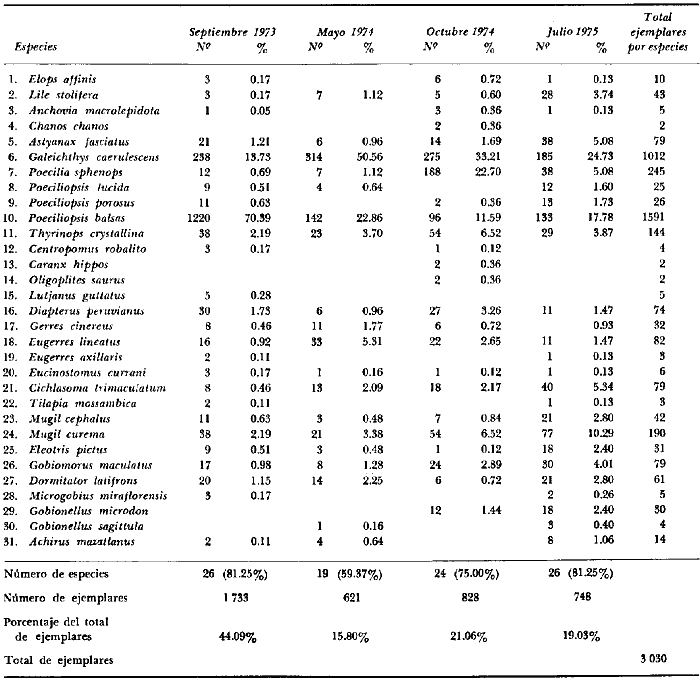 TABLA 17. LAGUNA DE TRES PALOS Abundancia A comienzos del periodo 1, en septiembre, fueron colectados 1,733 ejemplares en 90 lances de pesca (Mapa 5; estaciones 1, 2, 3, 4, 5, 6, 7, 8, 9). La superficie total muestreada fue de 1755 m² La densidad promedio, de captura correspon dió a 19 ejemplares por cada 19.5 m². Considerando toda la superficie de la laguna ¡.e., 50 km² o bien 2.500,000.000 m²) puede ser estimada una densidad total del momento de 2.436,250.410 peces de los cuales (Tabla 17) el 72% son "poecílidos", el 14% son "bagres", el 4% son "mojarras", el 30% son "lisas", el 3% son "góbidos", el 2% "charales" y el 1% son "sardinitas", entre los peces más representativos. 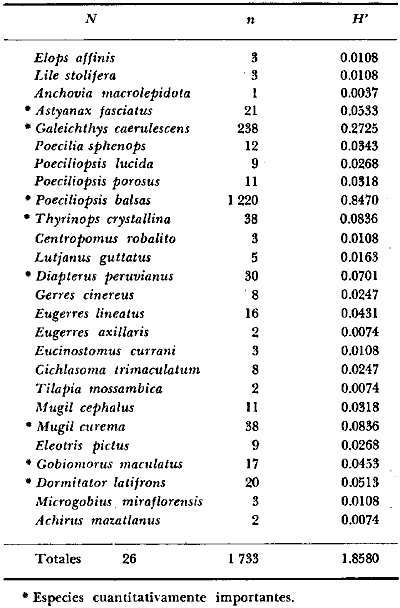 TABLA 18. TRES PALOS. Periodo 1 - Septiembre En el mes de octubre del mismo periodo 1 fueron colectados 828 ejemplares en 90 lances de pesca (Mapa 5; estaciones 1, 2, 3, 4, 5, 6, 7, 8, 9). La superficie total muestreada fue de 1 755 m². La densidad promedio de captura correspondió a 9.2 ejemplares por cada 19.5 m². Considerando toda la superficie de la laguna puede ser estimada una densidad total del momento de 1.153,846.000 peces, de. los cuales (Tabla 17) el 35% son "poecilidos" el 33% son "bagres", el 7% son "charales'', el 7% son "lisas", el 6% son "mojarras", el 5% son "góbidos" y el 2% son "sardinitas", entre los principales peces. En el periodo 2 fueron colectados 621 ejemplares en 90 lances de pesca (ídem estaciones otros periodos) . La superficie total muestreada fue de 1755 m² . La densidad promedio de captura correspondió a 6.9 ejemplares por cada 19.5 m². Considerando toda la superficie de la laguna puede ser estimada una densidad total del momento de 897,435. 897 peces, de los cuales (Tabla 17) el 51% son "bagres", el 31%, son "poecilidos", el 14% son "mojarras", el 4% son "charales", el 4% son "góbidos" y el 2% son "sardinitas", entre los principales peces. 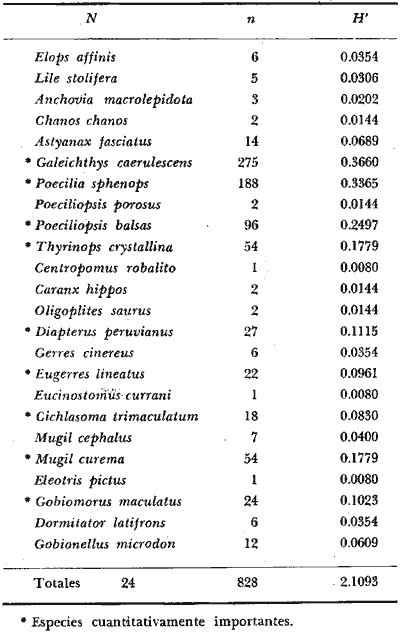 TABLA 19. TRES PALOS. Periodo 1 - Octubre Durante el periodo 3 fueron colectados 748 ejemplares en 90 lances de pesca (ídem estaciones periodos 1 y 2) . La superficie total muestreada fue de. 1 755 m² . La densidad promedio de captura correspondió a 8.3 ejemplares por cada 19.5 m². Considerando toda la superficie de la laguna puede ser estimada una densidad total del momento de 10,256.410.256 peces, de los cuales (Tabla 17) el 26%, son "poecílidos", el 25%, son "bagres", el 13% son "lisas", el 12% son "góbidos", el 9% son "sardinitas", el 4% son "charales" y el 4% son "majarras", entre los principales peces. Para esta laguna en particular (además de la Laguna de Chautengo) fueron calculados valores de biomasa promedios. Durante el periodo 1 el promedio fue 840 g (peso en fijador) por cada 19.5 m². Durante el periodo 2 el promedio fue de 420 g (peso en fijador) por cada 19.5 m². Durante el periodo 3 el promedio fue 480 g (peso en fijador) por cada 19.5 m².  TABLA 20. TRES PALOS. Periodo 2 - Mayo 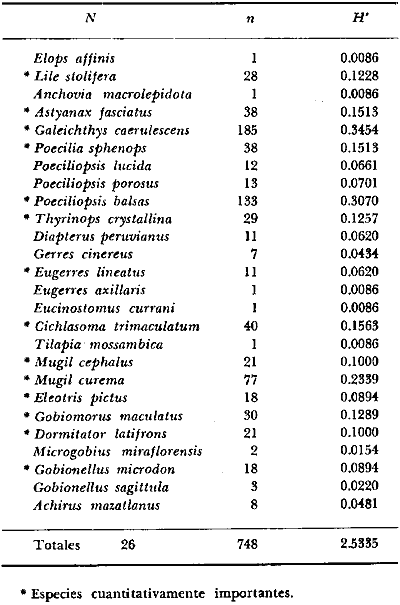 TABLA 21. TRES PALOS. Periodo 3 - Julio COYUCADiversidad Examinados 1 064 especímenes fueron determinadas 25 especies (Tabla 22) lo que arrojó un índice de diversidad total H' de 2.463. Esta diversidad varía en el tiempo. Durante el periodo 1, en septiembre, fueron encontradas 23 especies con un índice H' de 2.1599 y en octubre fueron encontradas 20 especies con un índice H' de 2.3217. Durante el periodo 2 fueron encontradas 15 especies con un índice H' de 2.3116. Durante el periodo 3 fueron encontradas 20 especies con un índice H' de 2.4142. 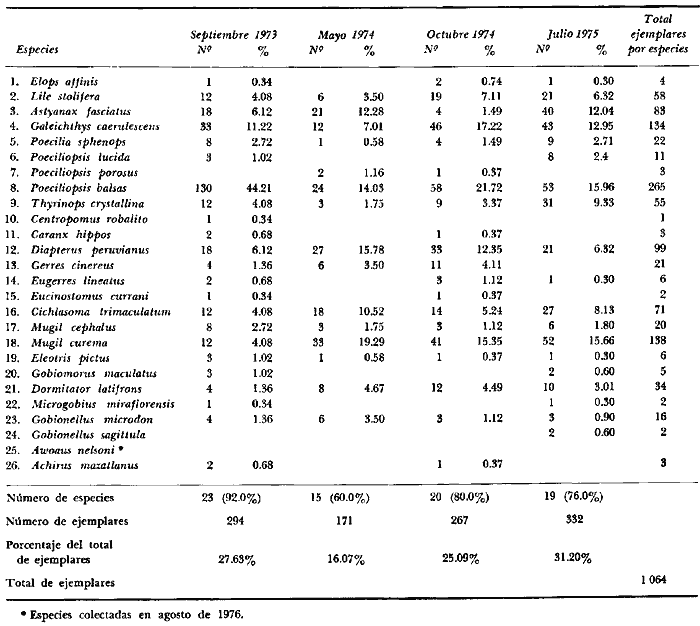 TABLA 22. LAGUNA DE COYUCA Esta laguna contrasta notoriamente con las lagunas Salinas de Appozahualco, Chautengo y Tecomate, pero es muy similar a Tres Palos. Durante el periodo 1 los peces dulceacuícolas alcanzan un 52.2% en septiembre y un 45%, en octubre, como componentes comunitarios (i. e., 48.6% promedio). Las especies más importantes de acuerdo al índice de diversidad han sido Lilestolifera, Astyanax fasciatus, Galeichthys caerulescens, Poeciliopsis balsas, Thyrinops crystallina, Diapterus peruvianus, Cichlasomatrimaculatum, Mugil curema y Dormitator latifrons. Durante el periodo 2 las variaciones no son manifiestas y la ictiofauna dulceacuícola alcanza un 60% como componentes comunitarios. Las especies más importantes de acuerdo al índice de diversidad han sido Lile stolifera, Astyanax fasciatus, Galeichthys caerulescens, Poeciliopsis balsas, Diapterus peruvianus, Gerres cinereus, Cichlasoma trimaculatum, Mugil curema, Dormitator latifrons y Gobionellus microdon. Durante el periodo 3 la diversidad es tan similar como en los periodos 1 y 2. Las especies dulceacuícolas alcanzan un 68.4%, como componentes comunitarios. Las especies mejor representadas de acuerdo al índice de diversidad han sido Lile stolifera, Astyanax fasciatus, Galeichthys caerulescens, Poeciliopsis balsas, Thyrinops crystallina, Diapterus peruvianus, Cich1asoma trimaculatum, mugil curema, Dormitator latifrons. En las tablas 23 a 26 se señalan los valores de N, n y H para cada colecta. 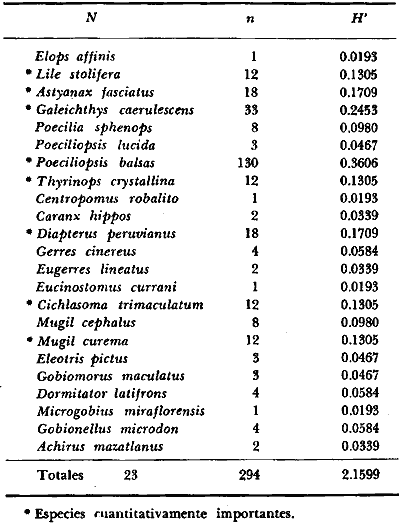 TABLA 23. COYUCA. Periodo 1 - Septiembre 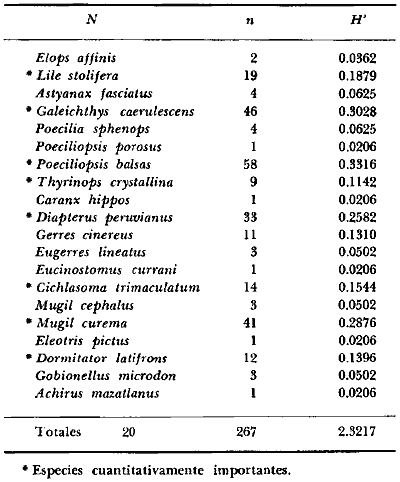 TABLA 24. COYUCA. Periodo 1 - Octubre Entre los peces se encuentran todo el año en la laguna, los más importantes han sido Lile stolifera, Astyanax fasciatus, Galeichthys caerulescens, Poecilia sphenops, Poeciliopsis balsas, Thyrinops crystallina, Diapterus peruvianus, Gerres cinereus, Cichlasoma trimaculatum, Mugil cephalus, Mugil curema, Eleotris pictus, Dormitator latifrons y Gobionellus microdon. Es decir, un 56% de la ictiofauna total, lo que demuestra la estabilidad del ambiente. Abundancia A comienzos del periodo 1, en septiembre, fueron colectados 294 ejemplares en 140 lances de pesca (Mapa 6; estaciones 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 y 15). La superficie total muestreada fue de 2730 m² . La densidad promedio de captura correspondió a 2.1 ejemplares por cada 19.5m². Considerando toda la superficie de la laguna (i.e., 34 km² o 1156,000.000 de m²) puede ser estimada una densidad total del momento de 118,461.538 peces, de los cuales el 48% son "poecilidos", el 11% son "bagres", el 10%, son "sardinitas", el 9% son "mojarras", el 7% son "lisas", el 4%, son "charros"y el 4% son "charales" entre las especies mejor representadas. En el mes de octubre del mismo periodo 1 fue ron colectados 267 ejemplares en 140 lances de pesca (ídem estaciones anteriores). La superficie total muéstresela fue de 2730 m². La densidad promedio de captura correspondió a 1.9 ejemplares por cada 19,5 m² Considerando toda la superficie de la laguna puede ser estimada una densidad total del momento de 112,620.512 de peces, de los cuales el 24%, son "poecílidos", el 18% son "mojarras", el 17% son "bagres", el 16% son "lisas", el 9% son "sardinitas", el 5% son "popoyotes" y el 4%, son "charales" entre los principales peces. En el periodo 2 fueron colectados 171 ejemplares en 140 lances de pesca (ídem estaciones Periodo 1). La superficie total muestreada fue de 2730 m². la densidad promedio de captura correspondió a 1.2 ejemplares por cada 19.5 m2. Considerando toda la superficie de la laguna puede ser estimada una densidad total del momento de 71,143.589 peces, de los cuales el 21 % son "poecílidos", el 18% son "sardinitas", el 17% son "lisas", el 13% son "bagres", él 8% son "charros", el 7% son "mojarras" y el 3% son "popoyotes". En el periodo 3 fueron colectados 332 ejemplares en 140 lances de pesca (ídem estacionesperiodos 1 y 2). La superficie total muestreada fue de 2730 m². La densidad promedio de captura correspondió a 1 ejemplar por cada 19,5 m². Considerando toda la superficie de la laguna puede ser estimada una densidad total del momento de 59,282.051 peces, de los cuales el 21% son "poecílidos", el 13%, son "bagres", el 18% son "sardinitas", el 17% son "lisas", el 9% son "charales", el 8% son "charros", el 7% son "mojarras" y el 3% son "popoyotes", entre los principales peces. 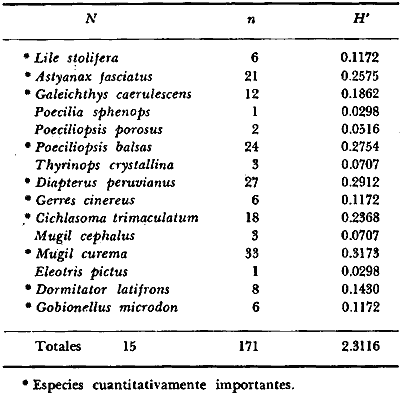 TABLA 25. COYUCA. Periodo 2 - Mayo 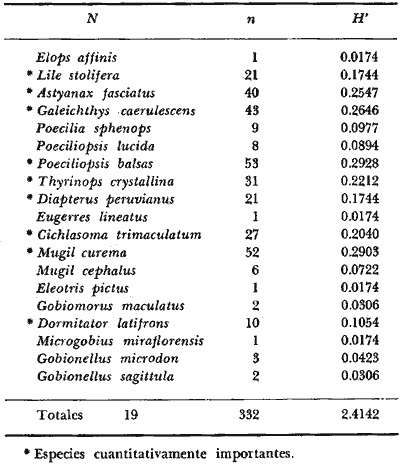 TABLA 26. COYUCA. Periodo 3 - Julio MITLADiversidad Examinados 1 240 especímenes fueron determinadas 16 especies (Tabla 27) lo que arrojó un índice de diversidad total H' de 1.8352. Esta diversidad varía en el tiempo. Durante el periodo 1, en septiembre, fueron encontradas 13 especies con un índice H' de 1.9444 y en octubre 8 especies con un índice H' de 1.4598. Durante el periodo 2 fueron encontradas 11 especies con un índice H' de 1.6327. Durante el periodo 3 fueron encontradas 9 especies con un índice H' de 1.7968. 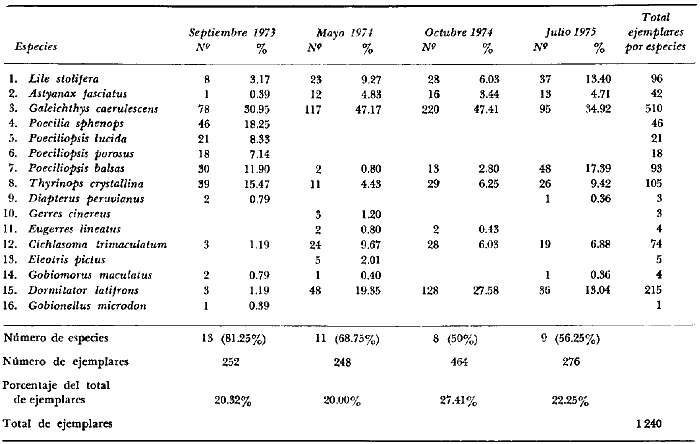 TABLA 27. LAGUNA DE MITLA Esta laguna contrasta notoriamente con las lagunas Salinas de Apozahualco, Chautengo, Tecomate, Nuxco, Salinas del Cuajo y Potosí, pero es muy similar, ecológicamente, a Coyuca y Tres Palos. Durante el periodo 1 los peces dulceacuícolas alcanzan un 69.2%, en septiembre y un 50.0%, en octubre, como componentes comunitarios (i. e., 59.617, promedio) . Las especies más importantes de acuerdo al índice de diversidad han sido Lile stolifera, Astyanax fasciatus, Galeichthys caerulescens, Poecilia sphenops, Poeciliopsis porosus, Poeciliopsis balsas., Thyrinops crystallina, Cichlasoma trimaculatum y Dormitator latifrons. Durante el periodo 2 las variaciones no son manifiestas y la ictiofauna dulceacuícola alcanza un 63.6% como componentes comunitarios. Las especies más importantes de acuerdo al índice de diversidad han sido Lile stolifera, Astyanax fasciatus, Galeichthys caerulescens, Thyrinops crystallina, Cichlasoma trimaculatum y Dormitator latifrons. Durante el periodo 3 la diversidad es tan similar como en los periodos 1 y 2. Las especies dulceacuícolas alcanzan un 66.6% como componentes comunitarios. Las especies mejor representadas de acuerdo al índice de diversidad han sido Lile stolifera, Astyanax fasciatus, Galeichthys caerulescens, Poeciliopsis balsas, Thyrinops crystallina, Cichlasoma trimaculatum y Dormitator latifrons. En las tablas 8 a 31 se señalan los valores de N, n y H' para cada colecta. 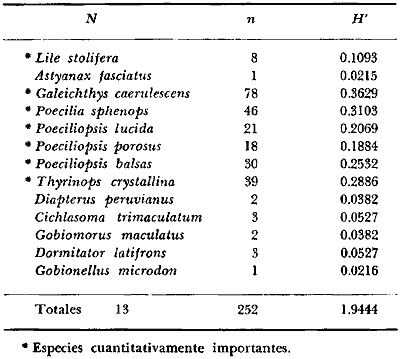 TABLA 28. MITLA. Periodo 1 - Septiembre Entre los peces que se encuentran todo el año en la laguna los más importantes han sido Lile stolifera, Astyanax fasciatus, Galeichthys caerulescens, Poeciliopsis balsas, Thyrinops crystallina, Cichlasoma trimaculatum, Gobiomorus maculatus, Dormitator latifrons. Es decir, un 50% de la ictiofauna total, lo que demuestra la estabilidad del ambiente. Abundancia A comienzos del Periodo 1, en septiembre, fueron colectados 252 ejemplares en 120 lances de pesca (Mapa 7; estaciones 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 y 12). La superficie total muestreada fue de 2340 m² La densidad promedio de captura correspondió a 2.1 ejemplares por cada 19.5 m². Considerando toda la superficie de la laguna (i. e., 36 km² o bien 1.296,000.000 m²) puede ser estimada una densidad total del momento de 137,847.715 peces, de los cuales el 45% son "poecílidos", el 31% son "bagres", el 16% son "charales", el 3% son "sardinitas" y el 2% son "charros", entre los peces mejor representados. 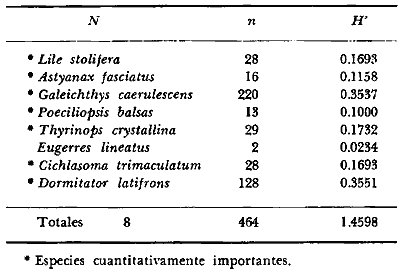 TABLA 29. MITLA. Periodo 1 - Octubre 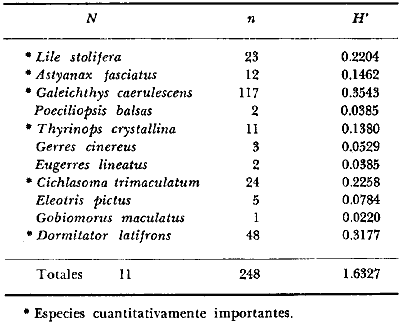 TABLA 30. MITLA. Periodo 2 - Mayo En el mes de octubre del mismo periodo 1, fueron colectados 467 ejemplares en 120 lances de pesca (idem estaciones otros periodos) . La superficie total muestreada fue de 2 340 m². La densidad promedio de captura correspondió a 3.8 ejemplares por cada 19,5 m². Considerando toda la superficie de la laguna puede ser estimada una densidad total del momento de 252,553.846 peces, de los cuales el 47% son "bagres", el 28% son "popoyotes", el 9% son "sardinitas", el 6% son "charales" y el 6% son "charros", entre los peces mejor representados. Durante el periodo 2 fueron colectados 248 ejemplares en 120 lances de pesca (ídem estaciones periodo 1) La superficie total muestreada fue de 2 340 m² . La densidad promedio de cap tura correspondió a 1.2 ejemplares por cada 19.5 m². Considerando toda la superficie de la laguna puede ser estimada una densidad total del momento de 137,847.715 peces, de los cuales el 47% son "bagres", el 19%, son "popoyotes", el 14% son "sardinitas", el 10% son "charros" y el 4% son "charales", entre los principales peces. 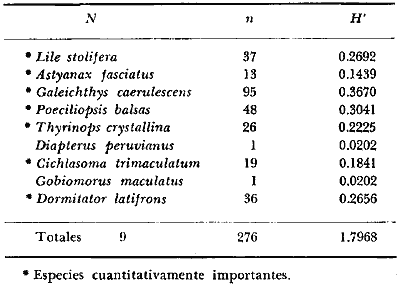 TABLA 31. MITLA. Periodo 3 - Julio Durante el periodo 3 fueron colectados 276 ejemplares en 120 lances de pesca (ídem estaciones periodos 1 y 2) . La superficie total muestreada fue de 2 340 m². La densidad promedio de captura correspondió a 2.3 ejemplares por cada 19.5 m². Considerando toda la superficie de la laguna puede ser estimada una densidad total del momento de 152,857.897 peces, de los cuales el 35% son "bagres", el 18% son "sardinitas", el 17% son "poecilidos", el 13% son "popoyotes" y el 9% son "charales", entre los peces más característicos. NUXCODiversidad Examinados 1474 especímenes fueron determinadas 43 especies (Tabla 32), lo que arrojó un índice de diversidad total H' de 1.8892. Esta diversidad varía en el tiempo. Durante el periodo 1, en septiembre, fueron encontradas 33 especies con un índice H' de 2.0901 y en octubre 33 especies con un índice H' de 2.071. Durante el periodo 2 fueron encontradas 6 especies con un índice H' de 0.9943. Durante el periodo 3 fueron encontradas 13 especies con un índice H' de 1. 1540. Esta laguna contrasta en su diversidad con Tres Palos, Coyuca y Mitla. Por el contrario es muy similar a Salinas de Apozahualco, Chautengo y Tecomate. Durante el periodo 1 los peces dulceacuícolas alcanzan un 9% como componentes comunitarios en septiembre y un 6% en octubre (i. e., 7.5 % promedio). Las especies más importantes de acuerdo al índice de diversidad han sido Elops affinis, Galeichthys caerulescens, Diapterus peruvianus, Gerres cineteus, Eugerres lineatus, Mugil curema y M. cephalus. Durante el periodo 2 los peces dulceacuícolas alcanzan un 1617, como componentes comunitarios, pero no es porque aumenten sino porque disminuyen los peces marinos. Las especies más importantes de acuerdo al índice de diversidad han sido Galeichthys caerulescens, Eugerres lineatus, Cichlasoma trimaculatum y Mugil curema. Durante el periodo 3 los peces dulceacuícolas alcanzan un 38.5% como componentes comunitarios Las especies más importantes de acuerdo al índice de diversidad han sido Galeichthys caerulescens, Eugerres lineatus, Mugil curema y Gobionellus microdon. En las tablas 33 a 36 se señalan los valores de N, n y H' para cada colecta. Entre los peces que se encuentran todo el año en la laguna los más importantes han sido Galeichthys caerulescens, Diapterus peruvianus, Gerres cinereus, Eugerres lineatus, Cichlasoma trimaculatum y Mugil curema, es decir un 13.9%, de la ictiofauna total. Abundancia A comienzos del periodo 1, en septiembre, fueron colectados 280 ejemplares en 50 lances de pesca (Mapa 8; estaciones 1 (2) , 2 (2) , B) La superficie total muestreada fue de 975 m². La densidad promedio de captura correspondió a 5.6 ejemplares por cada 19.5 m². Considerando toda la superficie de la laguna (i. e., 6.5 km² o bien 42.250,000 m²) puede ser estimada una densidad total del momento de 1210.000 peces, de los cuales el 48% son "lisas",el 17% son "bagres", el 15% son "mojarras" y el 9% son "machetes", entre los principales peces. 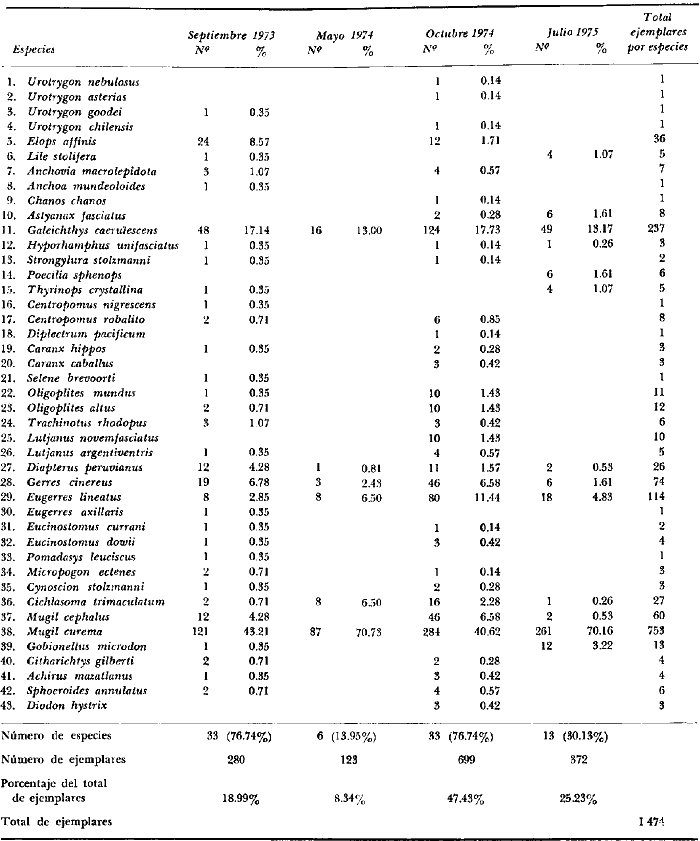 TABLA 32. LAGUNA DE NUXCO. 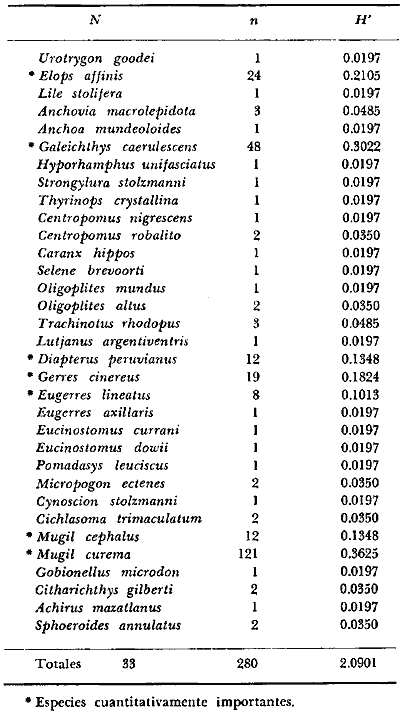 TABLA 33. NUXCO. Periodo 1- Septiembre En el mes de octubre del mismo Periodo 1, fueron colectados 699 ejemplares en 90 lances de pesca (Mapa 8; estaciones 1, 2, 3, 4, 5, 6, 7, 8 y 9) . La superficie total muestreada fue de 1755 m² . La densidad promedio de captura correspondió a 7.8 ejemplares por cada 19.5 m². Considerando toda la superficie de la laguna puede ser estimada una densidad total del momento de 16,900.000 de peces, de los cuales el 47% son "lisas", el 20% son "mojarras", el 18% son "bagres", el 3% son "charros", entre los principales peces. 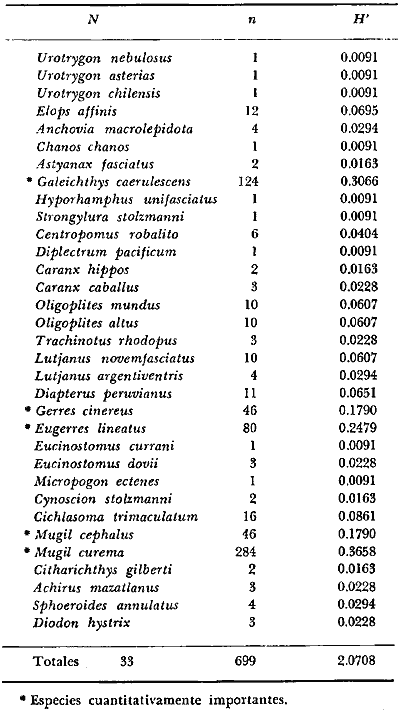 TABLA 34. NUXCO. Periodo 1 - Octubre  TABLA 35. NUXCO. Periodo 2 - Mayo  TABLA 36. NUXCO. Periodo 3 - Julio Durante el periodo 2 fueron colectados 123 ejemplares en 90 lances de pesca (idem estaciones periodo 1) La superficie total muestreada fue de 1755 m². La densidad promedio de captura correspondió a 1.3 ejemplares por cada 19.5m². Considerando toda la superficie de la laguna puede ser estimada una densidad total del momento de 2,816.666 peces, de los cuales el 71% son "lisas", el 13% son "bagres", el 1091, son "mojarras" y el 7% son "charros" entre las especies mejor representadas. Durante el periodo 3 fueron colectados 722 ejemplares en 90 lances de pesca (idem estaciones periodo 1 y 2). La superficie total muestreada fue de 1755 m². La densidad promedio de captura correspondió a 8 ejemplares por cada 19.5 m². Considerando toda la superficie de la laguna puede ser estimada una densidad total del momento de 17,333.333 peces, de los cuales el 71% son "lisas", el 13% son "bagres" y el 7% son "mojarras" entre los principales peces. SALINAS DEL CUAJODiversidad Examinados 451 ejemplares fueron determinadas 25 especies (Tabla 37) lo que arrojó un índice de diversidad total H' de 2.5748. Esta diversidad varía en el tiempo, Durante el periodo 1, en septiembre, fueron encontradas 18 especies con un índice H' de 2.2551 y en octubre 20 especies con un índice H' de 2.5353. Durante el Periodo 2 fueron encontradas 3 especies con un índice 0.6127. Durante el periodo 3 fueron encontradas 11 especies con un índice H' de 2.0297. Esta laguna presenta los estres más marcados por aumento de temperatura y salinidad. Se han registrado salinidades hasta de 126 %o durante el periodo 2. La laguna presenta características más próximas a Salinas de Apozahualco, Chautengo, Tecomate, Nuxco. y Potosí. Contrasta notoriamente con Tres Palos, Coyuca y Mitla. Durante el periodo 1 los peces dulceacuícolas alcanzan un 11 % en septiembre y un 5% en octubre (i. e., 8% promedio), como componentes comunitarios. Las especies más importantes de acuerdo al índice de diversidad han sido Elops affinis, Anchovia macrolepidota, Galeichthys caerulescens, Oligoplites saurus, Caranx hippos, Eucinostomus currani, Diapterus peruvianus, Gerres cinereus, Mugil curema y M. cephalus. Durante el periodo 2 no, se encontró ningún pez dulceacuícola. Durante el periodo 3 los peces dulceacuícolas alcanzan un 277, como componentes comunitarios. Las especies más importantes de acuerdo al índice de diversidad han sido Elops affinis, Diapterus peruvianus, Cichlasoma trimaculatum, Mugil cephalus, Mugil curema, Dormitator latifrons y Gobionellus microdon. En las tablas 38 a 40 se señalan los valores de N, n y H' para cada colecta. Entre los peces que se encuentran todo el año en la laguna los más importantes han sido,Gerres cinereus y Mugil curema. Es decir, un 8 % de la ictiofauna total. 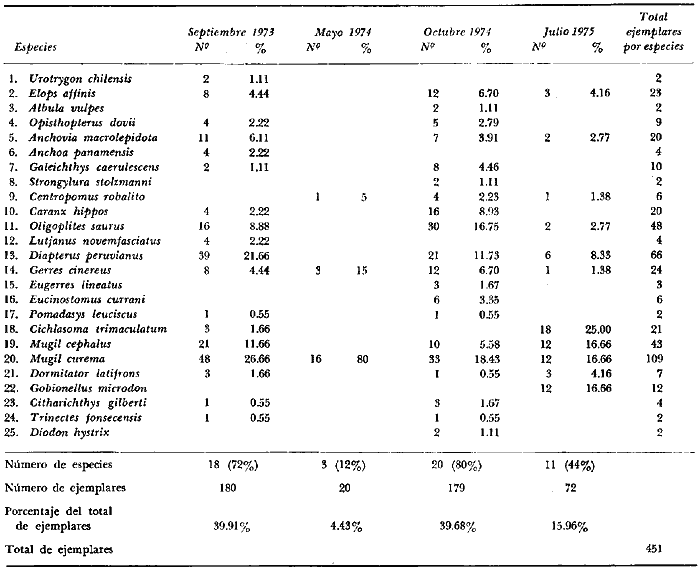 TABLA 37. LAGUNA SALINAS DEL CUAJO Abundancia A comienzos del periodo 1, en septiembre, fueron colectados 180 ejemplares en 30 lances de pesca (Mapa 9; estaciones 1, 2, B) . La superficie total muestreada fue de 585 m² . La densidad promedio de captura fue de 6 ejemplares por cada 19.5 m². Considerando, toda la superficie de la laguna (i. e., 1.3 km² o bien 1,690.0OO m²) puede ser estimada una densidad total del momento de 520.000 peces, de los cuales el 38% son "lisas", el 25% son "mojarras", el 11% son "carangidos", el 8% son "anchovetas" y el 4%, son "machetes", entre los principales peces. En el mes de octubre del mismo periodo 1, fueron colectados 179 ejemplares en 30 lances de pesca (idem estaciones anteriores) . La superficie total muestreada fue de 585 m². La densidad promedio de captura fue 6 ejemplares por cada 19.5 m². Considerando toda la superficie de la laguna puede ser estimada una densidad total del momento de 520,000 peces de los cuales el 26% son "caragidos", el 24% son "lisas", el 23% son "mojarras", el 7% son "machetes", el 6% son "anchovetas" y el 5% son "bagres", entre los peces más importantes. Durante el periodo 2 fueron colectados 20 ejemplares en 10 lance de pesca (Mapa 9; estación B) puesto que el resto de la laguna se encuentra seca. La superficie total muestreada fue de 195 m² . La densidad promedio de captura fue de 2 ejemplares por cada 19.5 m² y no pudo ser estimada una densidad total de la laguna. Las "lisas" correspondieron al 80% de la captura total. 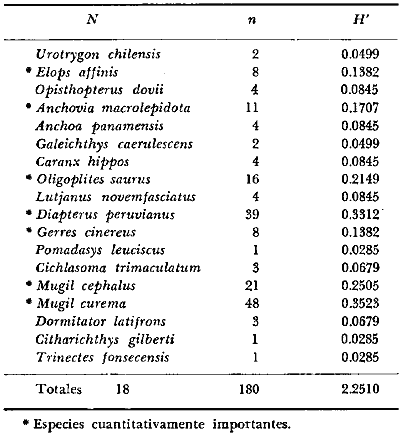 TABLA 38. SALINAS DEL CUAJO. Periodo 1 - Septiembre 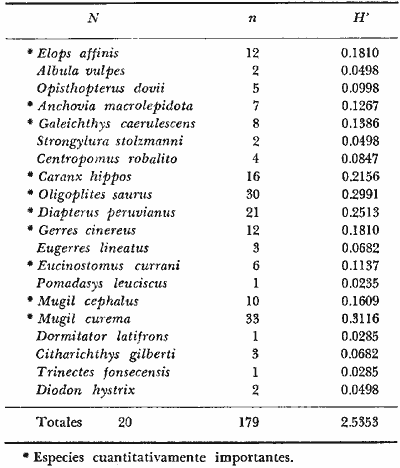 TABLA 39. SALINAS DEL CUAJO. Periodo 1 - Octubre Durante el Periodo 3 fueron colectados 72 ejemplares en 30 lances de pesca (idem estaciones periodo 1) La laguna ha recuperado toda su superficie inundada. La superficie total muestreada fue de 585 m². La densidad promedio de captura fue de 2.4 ejemplares por cada 19.5 m². Considerando toda la superficie de la laguna puede ser estimada una densidad total del momento de 208.000 ejemplares, de los cuales el. 33 % son "lisas", el 25% son "charros", el 17% son "gobidos", el 9% son "mojarras", el 4%, son "popoyotes" y el 4% son "machetes", entre los principales peces.  TABLA 40. SALINAS DEL CUAJO. Periodo 2 - Mayo 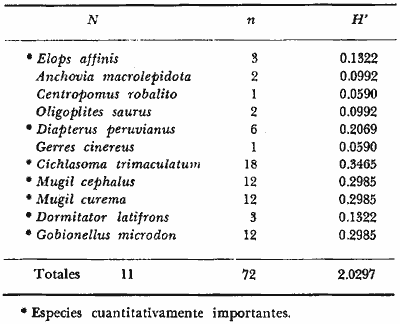 TABLA 41. SALINAS DEL CUAJO. Periodo 3 - Julio POTOSÍDiversidad Examinados 1 055 ejemplares fueron determinadas 58 especies (Tabla 42) lo que arrojó un índice de diversidad total H' de 2.8537. Esta diversidad varía en el tiempo. Durante el periodo 1, en septiembre, fueron encontrados 39 especies con un índice H' de 2.4521 y en octubre 44 especies con un índice H' de 2,3649. Durante el periodo 2 fueron encontradas 12 especies con un índice H' de 1.5696. Durante el periodo 3 fueron encontradas 22 especies con un índice H' de 2.4864. Esta laguna se identifica con las características generales de Salinas de Apozahualco, Chautengo, Tecomate, Nuxco y en menor medida Salinas del Cuajo. Al mismo tiempo contrasta notablemente con Tres Palos, Coyuca y Mitla. Durante el periodo 1 los peces dulceacuícolas alcanzan un 12.817, en septiembre y 9% en octubre (i. e., 10.9%, promedio) como componentes comunitarios. Las especies más importantes de acuerdo al índice de diversidad han sido Anchovia macrolepidota, Galeichthys caerulescens, Oligoplites saurus, Diapterus peruvianus, Gerres cinereus, Eugerres lineatus, Mugil curema y M. cephalus. Durante el periodo 2 las especies dulceacuícolas alcanzan un 16.6% como componentes comunitarios pero este aumento se debe a la disminución de la diversidad marina. Las especies más importantes de acuerdo al índice de diversidad han sido Galeichthys caerulescens, Centropomus robalito, Diapterus peruvianus, Mugil cephalus y M. curema. Durante el periodo 3 las especies dulceacuícolas alcanzan un 40.9% como componentes comunitarios Las especies más importantes de acuerdo al índice de diversidad han sido Lile stolifera., Astyanax fasciatus, Galeichthys caerulescens, Poecilia sphenops, Poeciliopsis porosus, Diapterus peruvianus, Cichlasoma trimaculatum, Mugil cephalus, Mugil curema, Eleotris pictus y Dormitator latifrons. En las tablas 43 a 46 se señalan los valores de N, n y H' para cada colecta. Entre los peces que se encuentran todo el año en la laguna, los más importantes han sido Diapterus peruvianus, Gerres cinereus, Eugerres lineatus, Cichlasoma trimaculatum, Mugil cephalus, Mugil curema, Dormitator latifrons, Galeichthys caerulescens y Centropomus robalito. Es decir, un 1.5.5% de la ictiofauna total. Abundancia A comienzos del periodo 1, en septiembre, fueron colectados 260 ejemplares en 70 lances de pesca (Mapa 10 estaciones 1, 2, 3, 4, 5, 6 y 7). La superficie total muestreada fue de 1 365 m². La densidad promedio de captura fue de 3,7 ejemplares por cada 19.5 m². Considerando toda la superficie (le la laguna (i. e., 4.5 km². o bien 20.250,000 m²) puede ser estimada una densidad total del momento de 3,842.307 peces, de los cuales el 41% son "lisas", el 17% son "bagres", el 15% son "mojarras" y el 804 son "carangidos", entre los principales peces. En el mes de octubre del mismo periodo 1, fueron colectados 521 ejemplares en 70 lances de pesca (idem estaciones anteriores) La superficie total muestreada fue de 1,365 m² . La densidad promedio de captura fue de 9.8 ejemplares por cada 19.5 m². Considerando toda la superficie de la laguna puede ser estimada una densidad total del momento de 10,171,794. Durante el periodo 2 fueron locetados 81 ejemplares en 40 lances de pesca (Mapa 10; estacio nes 1, 2, 3 y 4) el resto de la laguna se encuentra seca. La superficie total muestreada fue de 780 111 2. La densidad promedio de captura fue de 2 ejemplares por cada 19.5 m² . Lo reducido del volumen de agua de la laguna no fundamentó la necesidad de estimar una densidad total del momento, 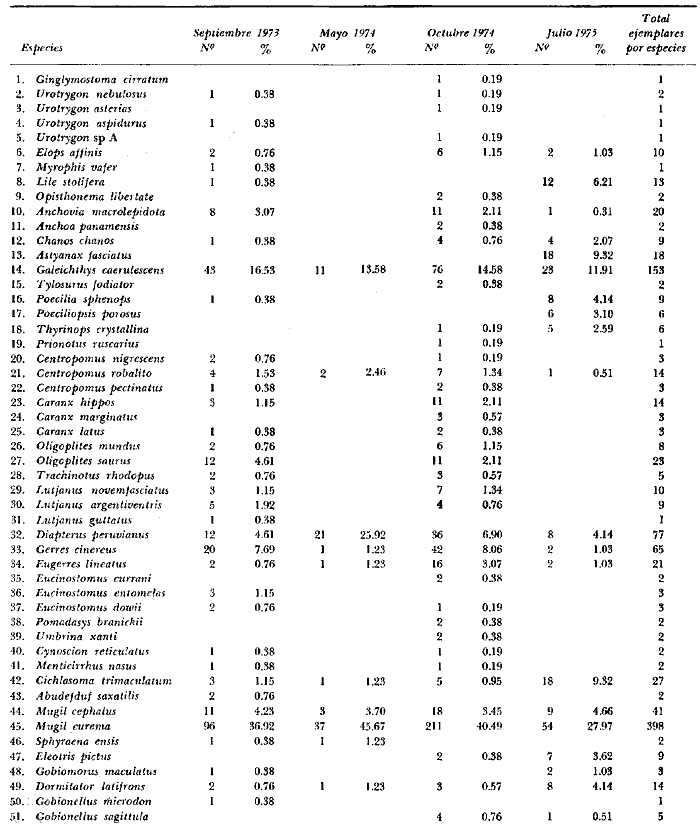 TABLA 42. LAGUNA DE POTOSÍ  TABLA 42 (continuación)  TABLA 43. POTOSÍ. Periodo 1 - Septiembre 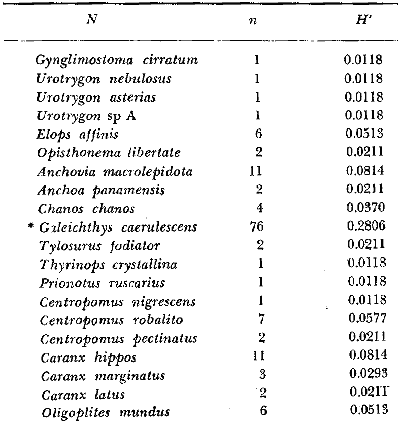 TABLA 44. POTOSÍ. Periodo 1 - Octubre 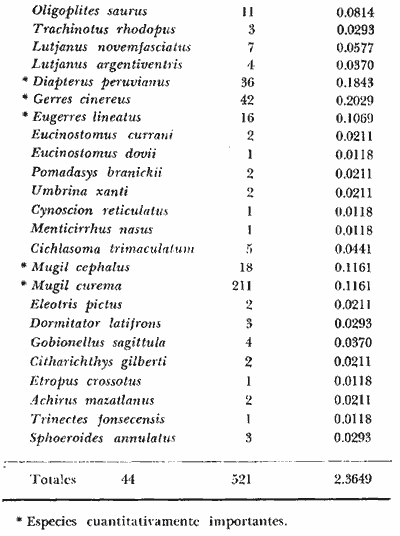 TABLA 44 (continuación) 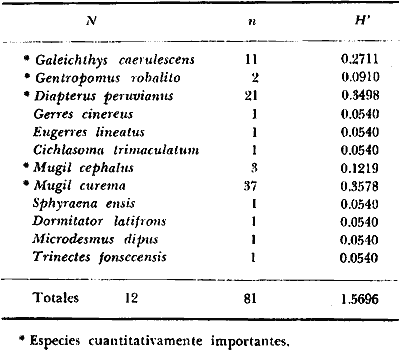 TABLA 45. POTOSÍ. Periodo 2 - Mayo 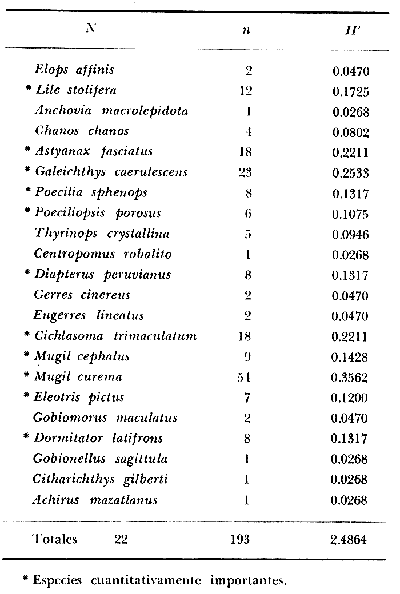 TABLA 46. POTOSÍ. Periodo 3 - Julio Durante el periodo 3 fueron colectados 193 ejemplares en 70 lances de pesca (idem. estaciones periodo 1) . La superficie total muestreada fue de 1365 m² La densidad promedio de captura fue de 2.7 ejemplares por cada 19.5 m². Considerando toda la superficie de la laguna puede ser estimada una densidad total del momento de 2,025.000 peces, de los cuales el 32% son "lisas", el 15% son "sardinitas", el 12% son "bagres", el 10% son "poecilidos", el 9% son "charros" y el 6% son "mojarras", entre los principales peces. PATRONES DE DIVERSIDAD Y ABUNDANCIALa colección total de 15 905 individuos que comprendió 37 familias y 105 especies, se distribuyó estacionalmente en un gradiente de diversidad. Esto puede apreciarse claramente en las tablas 3, 8, 13, 17, 22, 27, 32, 37 y 42. Sin embargo, algunas especies fueron encontradas durante todo el año y a través de todo el sistema lagunar estudiado. Esas especies fueron 9 (8.5%) y en número de individuos fueron 10,152 (64%) de las colectas, i. e., Galeichthys caerulescens (3 396) , Mugil curema (2 825), Diapterus peruvianus (1 831), Lile stolifera (478) Dormitator latifrons (425) , Mugil cephalus (402), Cichlasoma trimaculatum (384), Gerres cinereus (267) y Gobionellus microdon (145). En el capítulo siguiente se discute que Cichlasoma trimaculatum y Dormitator lat¡frons son especies dulceacuícolas; Lile stolifera, Galeichthys caerulescens y Gobionellus microdon son especies propiamente estuarinas; Mugil curema, Mugil cephalus, Diapterus peruvianus y Gerres cinereus son especies marinas que utilizan las lagunas y estuarios como áreas naturales de crianza. Estas especies son las que caracterizan al sistema lagunar costero de Guerrero. El índice de diversidad estudiado permite resurnir una información concerniente a la estructura numérica de las poblaciones. Su valor empírico aislado es vago y debe considerarse como información dentro de un contexto ecológico muy amplio. Pianka (1966) y Dahlberg y E. P. Odum (1970) consideran al menos 11 factores que pueden regular la diversidad: 1) variedad de nichos, 2) tamaño de los nichos o sobreposición de nichos 3) estabilidad del medio ambiente o clima, 4) rigurosidad del medio ambiente, 5) sucesión o tiempo geológico, 6) productividad, 7) acumulación de biomasa, 8) competencia 9) espacio, 10) tamaño de los organismos y 11) longitud de las cadenas alimenticias. En este estudio es claro que la diversidad debe ser discutida en términos de: 1) número de especies (riqueza o variabilidad) y 2) un índice de diversidad. Las tablas incluidas para cada una de las la gunas ilustran esos dos aspectos. La función H' muestra variación estacional que no es otra cosa sino el reflejo de los cambios en la abundancia relativa de las especies. Análisis (le variariza revelan que los 3 periodos ecológicos (o "estaciones tienen un efecto significativamente alto sobre la abundancia relativa y sobre el número de especies y especímenes. Al mismo tiempo el contraste estadístico mayor es entre el periodo 1 y el periodo 2, pero es menor entre el periodo 1 y el periodo 3; la explicación es muy simple y se debe a la sucesión de ictiofauna dulceacuícola que invade esas áreas durante la época de lluvias. Ese mismo análisis estadístico permite apreciar que existe Un incremento en el número de individuos. Esa es la razón principal por la cual H' que es relativamente alto en el periodo 1 desciende bruscamente durante el periodo 2 y su incremento durante el periodo 3 no se ve muy marcado precisamente por el bajo número de individuos que componen el nuevo incremento de especies. En capítulos siguientes se discute y se refuerza que las lagUnas de Tres Palos, Coyuca y Mitla constituyen un grupo ecológicamente afín y relativamente estable. Paradojalmente son las lagunas con diversidad más baja. El resto de las lagunas, por el contrario, son inestables ecológicamente y exhiben la diversidad más alta.
Considerando los 11
factores que discuten Pianka (1966) y Dahlberg y E. P. Odum (1970), se puede
precisar (adelantando algunas consideraciones ecológicas discutidas en
detalles en los siguientes capítulos
Ver Caracterización
Ictioecológica de las Lagunas y Estructura de sus Comunidades
1) Variedad de nichos En las lagunas del Grupo A la variedad de nichos es mayor y la relación es directa con la diversidad. En las lagunas del Grupo B la variedad de nichos es menor y también es menor la diversidad. Luego, la variedad de nichos se en cuentra en relación directa con la variedad de ambientes, con los gradientes de salinidad y con la diversidad. 2) Tamaño de los nichos o sobreposición de nichos En las lagunas del Grupo A el tamaño de los nichos no es amplio en rangos y el sobrelape pequeño para la mayoría de las especies. En las lagunas del Grupo B el tamaño de los nichos es amplio pero el sobrelape es casi total dentro de las lagunas. Para ambos casos el sobrelape tiene una relación inversa con la diversidad. 3) Estabilidad del medioambiente o clima Para ambos grupos de lagunas el clima es similar pero el efecto de estabilidad es diferente. En las lagunas del Grupo A con un ambiente inestable y cíclico la diversidad es mayor, lo que puede explicarse asumiendo que el ciclo de fisiología ambiental de las lagunas influye directamente en la variedad de nichos y de habitats y de esa manera, directamente en la diversidad. En las lagunas del Grupo B la estabilidad del ambiente es marcada y de esa manera puede propiciarse un gran sobrelape de nichos incidiendo en la baja diversidad. Esto puede ser válido sólo en medioambientes lagunares estuarinos. 4) Rigurosidad del medioambiente En las lagunas del Grupo A la rigurosidad es marcada como consecuencia del ciclo de fisiología ambiental de periodicidad anual; en estas lagunas la diversidad varía estacionalmente de acuerdo a las tablas ya discutidas; la diversidad puede ser alta pero variable. En las lagunas del Grupo B el medioambiente no es riguroso y la diversidad es relativamente constante durante el año, aun cuando baja. La sucesión de especies es marcada en las lagunas del Grupo A. 5) Sucesión o tiempo geológico La edad geológica del ecosistema puede influir directamente en una mayor diversidad. En el caso de las lagunas costeras de Guerrero este es un factor poco claro de discutir por cuanto todas las lagunas tienen la misma edad geológica, y las diversidades son variables. El aspecto de sucesión es claro y fue discutido anteriormente. 6) Productividad En las lagunas del Grupo A la productividad es alta y la relación es directa con la mayor diversidad. No obstante en las lagunas del Grupo B la diversidad es baja aun cuando la productividad es todavía mucho más alta. En este último caso la situación puede explicarse por efectos ecológicos de eutroficación que aparentemente es lo que predomina en esas lagunas. El factor "productividad" y su valor de incidencia en la "diversidad", debe ser rediscutido en un futuro próximo por cuanto Schelske y E. P. Odum (1961) han establecido claramente que los estuarios se encuentran entre los ecosistemas naturales más productivos del mundo, y muchos autores, por otra parte, destacan la baja diversidad de los mismos. En México este principio no sería válido por cuanto más y más estudios están demostrando la alta diversidad faunística o florística en el medioambiente lagunar estuarino de algunas lagunas tropicales y subtropicales. 7) Acumulación de biomasa En las lagunas del Grupo A la biomasa bentónica y nectónica es mayor que en las otras lagunas y la diversidad también es mayor; se puede asumir que la relación es directa. En las lagunas del Grupo B casi no existe biomasa macrobentónica y también la biomasa nectónica es baja; sin embargo la biomasa fitoplanctónica es alta pero con predominio de cianofitas. Todo ello redunda en la baja diversidad de este último grupo de lagunas. 8) Competencia En ambos grupos de lagunas puede haber alta competencia. Sin embargo, en las lagunas del Grupo B la competencia se atenúa por la variedad de nichos, la rigurosidad del ambiente y la productividad, incidiendo en una alta diversidad. Lo inverso se presenta en las lagunas del Grupo B, donde principalmente el sobrelape de nichos ocasiona una franca competencia y exclusión de especies. 9) Espacio Este factor es poco claro de discutir por cuanto el mayor espacio se presenta en las lagunas del Grupo B y es allí donde se presenta la menor diversidad. Este factor puede ser totalmente menospreciado frente a otros de efectos principales. 10) Tamaño de los organismos Para ambos grupos de lagunas predominan organismos de tamaño pequeño y especialmente poblaciones sexualmente inmaduras. No obstante siempre los organismos más grandes fueron capturados en las lagunas del Grupo B, explicación que puede encontrarse en el menor número de especies, la mayor disponibilidad de alimento, la estabilidad del ambiente, el menor efecto de sucesión biológica y el mayor espacio. Es una situación reconocida que estas son áreas naturales de crianza utilizadas por juveniles de numerosas especies que requieren de ambiente estuarinos paTa completar parte de su desarrollo (ver Smith et al., 1966; Sykes y Finucane, 1966; Cronin y Mansueti, 1971; Carr y Adams, 1973; Yáñez-Arancibia, 1976a) 11) Longitud de las cadenas alimenticias En ambos grupos de lagunas la longitud de la trama trófica es la misma con 4 niveles tróficos. Por lo tanto, lo transcendental está en la complejidad de cada uno de los niveles. En las lagunas del Grupo A la complejidad es muy grande en el segundo nivel trófico y puede ser un factor que incida directamente en la mayor diversidad. Lo inverso ocurre en las lagunas del Grupo B (Figs. 67 y 68). RELACIONES TRÓFICAS DE LAS ESPECIES Y OTROS ASPECTOS BIOLÓGICOS GENERALES DE LAS POBLACIONES PRINCIPALESLa literatura sobre los hábitos alimenticios de algunos peces que penetran a lagunas del Pacífico mexicano son escasos y la mayoría se refieren a la costa noroccidental; es más, se trata de estudios relativamente vagos en ese aspecto y no analizan sistemáticamente las relaciones tróficas de la ictiofauna considerada (Berdegué, 1954 y 1956; Carranza, 1969a, 1969b, 1969c y 1970; Carranza y Amezcua-Linares, 1971a y 1971b; Amezcua-Linares, 1972; González-Villaseñor, 1972). En la costa mexicana del Golfo sólo el estudio de Darnell (1962). Asimismo, y particularmente en el área de Guerrero sólo existen los trabajos de Yáñez-Arancibia (19751), 1976a, 1977), Yáñez Arancibia y Díaz (1977) y Yáñez-Arancibia et al. (1976), para algunas especies en particular que son discutidas en detalle. El estudio de la alimentación y los hábitos alimenticios de los peces que forman parte de las comunidades ictiofaunísticas, es importante por diversas razones: 1) por una parte, nos ¡ndica las relaciones tróficas de las diferentes especies e indirectamente un aspecto del flujo de la energía en las comunidades lagunares; 2) por otra, nos indica las relaciones entre predador-presa productor-consumidor, lo que es especialmente valioso cuando existen en el ambiente otros grupos que también revisten importancia económica (i. e., vegetación sumergida, crustáceos, moluscos y otros peces) , y finalmente; 3) nos indica las relaciones ecológicas de los organismos, lo que sirve para interpretar mejor la dinámica general de las lagunas estudiadas y efectuar recomendaciones para la administración adecuada de sus recursos pesqueros. CATEGORÍAS ICTIOTRÓFICASA nivel mundial son numerosos los estudios sobre tendencias alimenticias de las comunidades ictiofaunísticas, aunque en general estos aspectos están escasamente estudiados en las comunidades lagunares. No obstante, trabajos en otras áreas y latitudes son tan útiles y básicos que, además de tener resultados extrapolables, a nivel muy general, es importante incluirlos en la discusión de los grupos tróficos predominantes y en la trama ictiotrófica de cada una de las lagunas estudiadas (Hiatt, 1947b; Gneri y Angelescu, 1951; Yokota, 1956; Reid et al., 1956; Darnell, 1958 y 196 1; Olivier et al., 1968 y 1972; Springer y Woodburn, 1960; Yasuda, 1960; Teal, 1962; J. H. Day, 1967; Qasim, 1970; W. E. Odum y Heald, 1972; J. W. Day et. al., 1973a y 1973b; Zaret y Paine, 1973; Hodgkin, 1973; Lenanton, 1973; Heald et. al. (1974) ; De Sylva, 1975; Snedaker y Brook, 1976). Los estudios de este trabajo permiten proponer que en las lagunas costeras y estuarios existen tres categorías dentro de la trama ictiotrófica: 1) Consumidores Primarios, categoría en la que se incluyen, a) Planctófagos (fito y/o zoo) , b) Detritívoros (y otros restos. vegetales) y c) Omnívoros (detritus, vegetales y fauna de pequeño tamaño). 2) Consumidores Secundarios, categoría en la que se incluyen los peces predominan teniente carnívoros, aun cuando pueden incluir en su dieta algunos vegetales y detritus pero sin mucha significación cuantitativa. 3) Consumidores de Tercer Orden, categoría en la que se incluyen peces exclusivamente carnívoros, donde los vegetales y el detritus es m un alimento accidental. La definición de estas tres categorías puede quedar mejor aclarada discutiendo, algunos trabajos en relación a ellas. Hiatt (1947b) en sus conclusiones sobre la interacción biótica en el ciclo de alimentación de los peces de lagunillas salobres de Hawaii, considera peces consumidores primarios y secundarios. De acuerdo a las características tróficas de esas dos categorías, se identifican en alguna medida con los consumidores primarios y secundarios aquí definidos. Hiatt no encontró consumidores de tercer orden, aunque de acuerdo a la latitud y la disponibilidad de alimento, numerosos autores han señalado que un segundo y tercer nivel a veces pueden sobreponerse. Evidentemente, el sistema lagunar de Guerrero es algo más complejo (en su totalidad) que los ecosistemas estudiados por Hiatt (1947b) ; sin embargo, en algunas lagunas de las consideradas en este estudio, no existe la secuencia de las tres categorías definidas, sino que puede faltar alguna de ellas. Yasuda (1960) define cuatro categorías de niveles tróficos en los peces de un área de Japón que de acuerdo al espectro trófico, denomina: peces piscívoros (se alimentan exclusivamente de peces) ; peces carnívoros (se alimentan de peces y macroinvertebrados) ; peces omnívoros (se alimentan de animales, vegetales y otros) ; y peces planctófagos En las lagunas de Guerrero los peces exclusivamente piscívoros se presentan excepcional ni ente, y eso determina que no jueguen un papel determinante en la trama trófica de las lagunas. Sin embargo, algunas categorías dentro de la definición de consumidores primarios aquí propuesta, pueden coincidir, en mayor o menor medida, con las categorías definidas para esos estudios, especialrilente en el caso de los peces omnívoros y planctófagos de Yasuda (1960). Darnell (1958) en su estudio de] complejo trófico de la comunidad estuarina del Lago Pontchartrain indica dos niveles para los peces. Componentes primarios y componentes secundarios. La ictiofauna que él incluye en el primero de los niveles mencionados correspondería al nivel de consumidores primarios definido en este trabajo. Por otra parte, el otro nivel correspondería al nivel de consumidores secundarios o de segundo orden aquí definido. En realidad el ecosistema estudiado por Darnell (1958 y 1961) tiene bastantes similitudes con algunas de las lagunas aquí consideradas. J. H. Day (1967) en la trama trófica de un estuario de África del Sur distingue, aparentemente, tres niveles tróficos para los peces. El primero correspondería a los zooplanctófagos y detritívorGs, luego consumidores secundarios, y finalmente un nivel (le peces piscívoros. A grandes rasgos, la definición dada en este estudio para peces consumidores primarios incluiría a los zooplarictófagos y detritívoros de J. H. Day, y la definición dada para consumidores secundarios incluiría en gran medida al supuesto segundo nivel indicad o por J. H. Day (1967). Nuevamente se presenta la alternativa de no tener peces exclusivamente piscívoros significativamente iniportantes en el balance energético de las lagunas estudiadas en Guerrero. W. E. Odum (1971) y Heald et al. (1974) se han preocupado de analizar el nivel superior de los peces, y en gran medida la definición de los tres niveles ictiotróficos aquí propuesta se identifica con los tres niveles propuestos por ellos para una comunidad estuarina de Florida, esto es: un nivel inferior que comprende hervíboros, omnívoros y carnívoros primarios; un nivel secundario y un nivel superior de peces exclusivamente carnívoros. J. W. Day et al. (1973a y 1973b) considera cuatro niveles tróficos para los peces de una comunidad estuarina de Louisiana: hervíboros, carnívoros primarios (zooplanctófagos) , carnívoros secundarios y carnívoros de tercer orden. Considerando a los hervíboros y a los carnívoros primarios de J. W. Day dentro del segundo nivel donde se ubican los consumidores primarios de la clasificación aquí propuesta, es muy similar la estructura general a los niveles tróficos de los peces existentes en Barataria Bay, Louisiana. En general, la estructura trófica de los ecosistemas lagunares y/o estuarinos es muy diversa en las diferentes latitudes y determinada por muchos factores ambientales bióticos y abióticos. Si bien es cierto pareciera existir una cierta similitud entre diferentes áreas estudiadas; son más evidentes las diferencias y particularmente las características propias de cada estuario y laguna en particular. No obstante parece adecuado reunir a la ictiofauna en alguna clasificación ictiotrófica lo cual facilita la comprensión del ecosistema y determina apreciar claramente la dinámica de las comunidades. CATEGORIZACIÓN GENERAL DE LA ICTIOFAUNALa ictiofauna general de las lagunas costeras de Guerrero puede quedar agrupada de las siguiente manera en relación a las tres categorías o niveles ictiotróficos definidos en el punto anterior. 1) Consumidores primarios (a) Planctófagos: Lile stolifera Opisthonema libertate Opisthopterus dovii Pliosteostoma lutipinnis Anchovia macrolepidata Anchoa panamensis Anchoa mundeoloides Anchoa curta Anchoa scofieldi Hyporhamphus unifasciatus Thyrinops crystallina (b) Detritívoros: Mugil cephalus Mugil curema Eleotris pictus Gobiomorus maculatus Dormitator latifrons Bathygobius soporator Microgobius miraflorensis Gobionellus microdon Gobionellus sagittula Awaous nelsoni Microdesmus dipus (c) Omnívoros: Chanos chanos Asyanax fasciatus Poecilia sphenops Poeciliopsis lucida Poeciliopsis porosus Poeciliopsis balsas Poecilistes pleurospilus Kyphosus elegans Gerres cinereus Eugerres lineatus Eugerres axillaris Eucinostomus currani Eucinostomus entomelas Eucinostomus dowii Cichlasoma trimaculatum Tilapia mossambica 2) Consumidores secundarios A lvula vulpes Myrophis vafer Galeichthys caerulescens Galeichthys gilberti Diapterus peruvianus Elops affinis Pomadasys sp Pomadasys leuciscus Pomadasys macracanthus Pomadasys branickii Caranx hippos Caranx marginatus Caranx medusicola Caranx latus Caranx caballus Selene brevoorti Oligoplites mundus Oligoplites saurus Oligoplites altus Oligoplites refulgens Umbrina xanti Menticirrhus elongatus Menticirrhus nasus Abudefduf saxatilis Polydactilus approximans Achirus mazatlanus Achirus panamensis Achirus klunsingeri Trinectes fonsecensis Sphoeroides lobatus Sphoeroides annulatus Diodon hystrix 3) Consumidores de tercer orden Heteroduntus francisi Ginglymostoma cirratum Pristis zephyreus Urotrygon nebulosus Urotryogon asterias Urotrygon aspidurus Urotrygon goodei Urotrygon chilensis Urotrygon sp A Arius liropus Strongylura stolzmanni Tylosurus fodiator Prionotus ruscarius Centropomus nigrescens Centropomus robalito Centropomus pectinatus Diplectrum pacificum Trachinotus rhodopus Lutianus novem fasciatus Lutianus argentiventris Lutjanus guttatus Micropogon altipinnis Micropogon ectenes Cynoscion stolzmanni Cynoscion xanthulus Cynoscion reticulatus Sphyraena ensis Cyclopsetta querna Citharichthys gilberti Etropus crossotusEsta categorización determina que en el sistema lagunar costero de Guerero, el 38% de la ictiofauna son consumidores primarios (11% de planctófagos, 11% de detritívoros y 16% de omnívoros), cifras que pueden variar cuando algunos peces señalados como detritívoros, circunstancialmente pueden comportarse como omnívoros. Los consumidores secundarios alcanzan un 32% y un 30% los consumidores de tercer orden. Estas últimas cifras también pueden variar ligeramente cuando circunstancialmente algunos consumidores secundarios pueden comportarse como, consumidores de tercer orden, todo ello determinado por algunos factores discutidos más adelante. Por otra parte el porcentaje individual de consumidores varía en cada laguna dependiendo de sus características ecológicas. En las lagunas más dulceacuícolas (i.e., Tres Palos, Coyuca y Mitla) prácticamente desaparecen los consumidores de tercer orden y son cuantitativamente importantes los consumidores primarios. En realidad los consumidores de tercer orden se encuentran mejor representados en aquellas lagunas que reciben marcada influencia marina durante el periodo 1. ANÁLISIS TRÓFICOS DE LAS PRINCIPALES ESPECIESLas especies que representan un recurso económico en las lagunas de Guerrero, no son muchas. La mayoría de los componentes ictiofaunísticos tienen importancia biológica y ecológica en la estructura de las comunidades. Las especies de importancia comercial son alrededor de 13, es decir un 12.4%, de total de los peces lagunares en Guerrero. Elops affinis ReganLa especie ha sido mucho menos estudiada que Elops saurus, una especie muy afín pero característica del Golfo de México y del Altántico. Günther (1945) encontró que cada 5 ejemplares de E. saurus examinados, 3 contenían camarones del género Penaeus. Darnell (1958) al revisar los trabajos de Linton (1940), Günther (1945), Hiatt (1947a), Knapp (1949) y Reid (1945), concluyó junto con su propios estudios que E. saurus se alimenta de camarones y peces, Springer y Woodburn (1960) y Cervigón (1966) han agregado que E. saurus presenta un régimen alimentacion similar en tampa Bay y Venezuela, respectivamente, prendando sobre. crustáceos y peces. Carles (1967) encontró que E. saurus, en el sistema lagunar Tunas de Zaza en Cuba, se alimenta preferentemente de Penaeus sp. Callinectes sp y algunos Engráulidos. Recientemente W.E. Odum (197 1) y W.E Odum y Heald (1972) encontraron que E. saurus, de tamaño entre 19 y 38 mm, ingieren copépodos y algunas larvas zoea; por otra parte, los especímenes mayores, entre 223 y 346 mm, consumen un 44% envolviendo de camarones carídeos y 567, en volumen de pequeños peces como Poecilia latipinna, Eucinostomus gula, Menidia beryllina y Anchoa hepsetus. Los ejemplares adultos se alimentan preferentemente al anochecer. Otra especie del mismo género, E. machnata, estudiada por Hiatt (1947a) en aguas someras de Hawaii, se alimenta de peces pequeños y cantidades menores de crustáceos y conchas de caracGles. Entre los peces depredados se encuentran Mugílidos, Góbidos y Poecílidos. Respecto de E. affinis, Dill y Woodhull (1942) encontraron, en el análisis estomacal de ejemplares colectados en el Lago Salton California, pequeños peces e insectos coleópteros. Carranza (1969c y 1970) ha señalado que E. affinis es una especie predominantemente carnívora que incluye en su dieta insectos, peces y principalmente crustáceos, Afirma ese autor que en la localidad de Huizache-Caimanero, los estómagos de 38 peces examinados, el 80%, contenía insectos (hemípteros y dípteros), aproximadamente un 25% contenían peces y sólo el 20% contenían crustáceos. Con respecto al volumen ingerido, ese autor considera que los insectos constituyen también un alimento importante, especialmente las larvas de dípteros; les siguen en importancia los peces, incluyendo Poecílidos, Engráulidos y Clupéidos. Entre los crustáceos, el "camarón" constituye más del 10% del volumen, pero la frecuencia con que se ingiere es muy baja (Fig. 8). 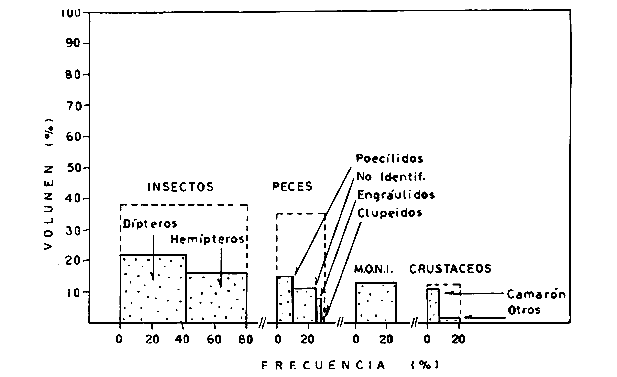 Fig. 8. Espectro trófico del volumen y frecuencia de Elops affinis en el sistema lagunar costero de Huizache-Caimanero, Sinaloa. (N=38). Modificado de Carranza (1969 c y 1970) Carranza y Amezcua-Linares (1971b), Amezcua-Linares (1972) y Yáñez-Arancibia (1975b) han indicado que E. affinis es de hábitos carnívoros depredando sobre Engráulidos, Clupéidos, Aterínidos, Poecílidos y también sobre crustáceos (especialmente camarones) y algunos insectos. Sin embargo, el último de esos autores agrega además que E. affinis puede ingerir algo de vegetales y detritus, por lo que correspondería a un consumidor secundario. En estos estudios fueron examinados 113 ejemplares de E. affinis, 77 ejemplares recolectados durante el periodo 1 en las lagunas de Apozahualco y Chautengo, 20 ejemplares recolectados durante el periodo 2 en las mismas lagunas, y 16 ejemplares recolectados durante el periodo 3 en las mismas lagunas. En Salinas de Apozahualco el espectro trófico indica que son predominantemente carnívoros predando sobre peces, crustáceos y accidentalmente algunos vegetales. Los peces constituyen su alimento preferencial aunque otros estudios han encontrado que los crustáceos pueden constituir uno de sus principales alimentos. Además del método volumétrico y de frecuencia el empleo del método numérico es bastante adecuado en esta especie, puesto que consume organismos de tamaño homogéneo, y de acuerdo al grado de digestión (fases estomacales) pueden ser contados con facilidad. Cuantitativamente durante el periodo 1 (47 ejemplares analizados) el contenido estomacal estuvo presentado por peces con un 82.5% en volumen y 100% de frecuencia, destacando Gobionellus microdon, Diapterus peruvianus, Eucinostomus spp, Anchovia macrolepidota y Mugil curema; restos de peces no determinados con 12.1% en volumen y 61.9% de frecuencia; crustáceos del género Penaeus con un 3.7% de volumen y 1901, de frecuencia y restos vegetales con un 1.7% de volumen y 9.5% de frecuencia (Figs. 9 y 11) Durante el periodo 2 los penéidos desaparecen del espectro trófico de E. affinis, la predación sólo se concentra sobre Mugil curema y los restos vegetales y el detritus son más importantes cuantitativamente con un 3% de volumen y 10% de frecuencia. Durante el periodo 3 disminuyen los restos vegetales del contenido estomacal, aparece gran cantidad de larvas de dípteros Chironomus con un 5% de volumen y 25% de frecuencia, y la predación se concentra sobre Mugil curema y Gobionellus microdon además de otros peces no determinados. 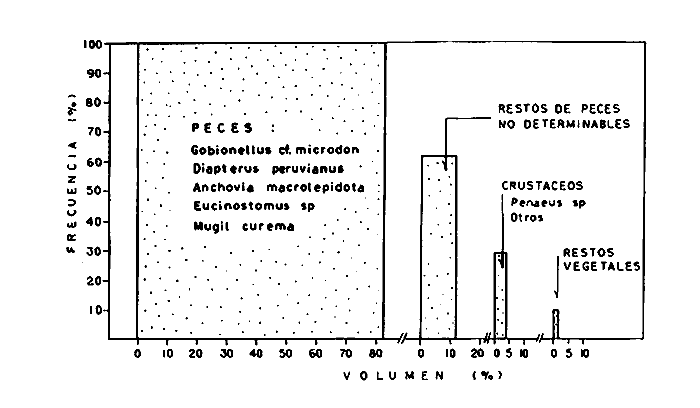 Fig. 9. Espectro trófico del volumen y frecuencia de Elops affinis en el sitema lagunar costero de Guerrero, durante el periodo 1. Salinas de Apozahualco (N= 47). Septiembre de 1973 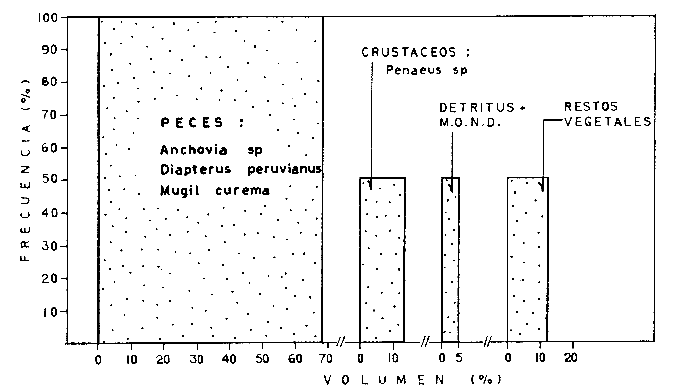 Fig. 10. espectro trófico de volumen de frecuencia de Elops affinis en el sistema lagunar costero de Guerrero, durante el periodo 1. Chautengo (N=30). Septiembre de 1973.  Fig. 11. Espectro trófico volumétrico de Elops affinis en el sistema lagunar costero de Gurerrero durante el periodo 1. Salinas de Apozahualco (N=47). Chautengo (N=30). En chautengo el espectro trófico es similar pero con un ligero aumento en la presencia de vegetales en la dieta (Figs. 10 y 11). Cuantitativamente durante el periodo 1 (30 ejemplares analizados) el contenido estomacal estuvo representando por peces con un 69% de volumen y 100% de frecuencia; crustáceos del género penaeus con un 13.5% de volumen y 50% de frecuencia; restos vegetales con un 12.5% de volumen y 50% de frecuencia; detritus y materia orgánica no determinable con un 5% de volumen y 50% de frecuencia. Durante el periodo 2 los camarones penéidos casi desaparecen de la dicta de E. affinis reduciendo su volumenta un 3% y la frecuencia no llega al l0%; los restos vegetales, el detritus y los peces conservan su proporción pero la predación se concentra sobre Mugil curema por cuanto otras especies que le sirven de alimento han desaparecido durante este periodo. Durante el periodo 3 los crustáceos se encuentran representados por jaibas del género Callinectes pero sin mucha significación cuantitativa; sin embargo aumenta ligeramente el consumo de algunos restos vegetales y detritus, aparentemente incomporados cuando capturan organismos bentónicos. La predación sobre peces, durante este periodo, se concentra sobre Mugil curema, Gobionellus microdon, Lile stolifera y eventualmente algunos Poecílidos. Los resultados de estos estudios muestran una cierta similitud cualitativa con los resultados de Carranza (1969c), pero hay diferencias cuantitativamente significativas en cuanto a la frecuencia de la ingestión de ciertos grupos tróficos. Lo más evidente es la ingestión de restos vegetales y detritus por parte de Elops affinis en las lagunas costeras de Guerrero. Considerando que en otras áreas Elops affinis también consume asiduamente peces, insectos y crustáceos, se puede decir que en general la especie es predominantemente carnívora, consumidor de segundo orden y, dependiendo de la disponibilidad del alimento, consumidor de tercer orden. Generalmente preda peces (Gobionellus microdon, Diapterus peruvianus, Anchovia macrolepidota, Eucinostomus spp, Mugil curema, Lile stolifera y Poecílidos) , crustáceos (Penaeus spp, Callinectes spp), insectos (dípteros Chironomus), además ingiriendo, con poca significación cuantitativa vegetales y detritus. Darnell (1958 y 1961), Hiatt (1947a) y en parte W. E. Odum (1971), W. E. Odum y Heald (1972), J. W. Day (1973a y 1973b) y Heald et al. (1974) han señalado que otras especies de Elops (i. e., saurus y machnata) son consumidores de segundo orden; por lo tanto E. affinis desempeña un papel ecológico similar en ambientes lagunares y/o estuarinos del Pacífico mexicano. De acuerdo con Mc Hugh (1967) y Yáñez-Arancibia (1975a, 1976b y 1976c), Elops affinis correspondería a una de las especies marinas que visitan cíclicamente el estuario y/o las lagunas, tanto al estado adulto para alimentarse, así como también en estados juveniles para completar algunas etapas de su desarrollo (Fig. 7). Por las evidencias ecológicas de los ecosistemas discutidos en este trabajo, es razonable suponer que la dinámica de esta especie sea muy similar en las lagunas Salinas de Apozahualco, Chautengo, Tecomate, Nuxco y Potosí. Los tamaños de los ejemplares examinados a lo largo de todo este estudio, variaron entre 145 y 285 mm y con predominancia de inmadurez sexual por debajo de los 230 mm. El incremento en peso no es muy marcado en las primeras etapas de su desarrollo (menos de 220 mm), pero posteriormente, conforme aumenta la maduración sexual con la longitud del pez, el incremento en peso es más pronunciado. Galeichthys caerulescens GüntherLa especie homóloga de G. caerulescens, en la costa del Golfo de México, corresponde a Arius felis, por mucho tiempo denominada también Galeichthys felis, especie que ha sido objeto de numerosos y completos estudios. Darnell (1958 y 1961) encontró que dicha especie pasa por tres etapas alimenticias durante su vida. Los ejemplares menores de 100 mm de longitud se alimentan de pequeños crustáceos, principalmente copépodos al aumentar de tamaño son más importantes en su dicta los pequeños invertebrados del fondo; y finalmente después de los 200 mm los cangrejos y peces predominan en su régimen alimenticio, Knapp (1949) y Harris y Rose (1968) han señalado que Arius felis es un activodepredador de camarones penéidos consumiendo más del 80% en su dicta, W. E. Odum (1971) y W. E. Odum y Heald (1972) no encontraron en sus estudios de la misma especie la sucesión alimenticia descrita por Darnell (1958). W. E. Odum. y Heald (1972), en el análisis de 62 estómagos de Arius felis de la localidad de North River Florida, encontraron 11 tipos de alimento en ejemplares midiendo entre 205 y 331 mm de longitud. Entre estos tipos los que representaron volumétricamente menos de 5% de la dieta fueron: nemátodos, cangrejos, larvas, algunos peces, insectos adultos, Brachidontes exustus, isópodos, restos de algas, Penaeus duorarum, Palaemonetes spp, A lpheus heterochaelis. El principal alimento fueron los antípodos con un 28%, la jaiba Rhithropanopeus harrisi con un 47%, y misidáceos con un 7% Al mismo tiempo en el análisis del alimento de 14 ejemplares juveniles de la localidad de Whitewater Bay, encontraron dominancia de anfípodos, y en menor grado misidáceos, larvas de Chironomus, isópodos, y pequeños congrejos. Darnell (1958 y 1961), Reid (1954), Günther (1945), Smith (1907) y Gudger (1916), han coincidido en destacar la importancia de los camarones y peces en la alimentación de Arius (Galeichthys) felis. Carranza (1969c y 1970) encontró que Galeichthys gilberti (una especie simpátrica con G. caerulescens) ingiere en su dicta volumétricamente un 43% de crustáceos de los cuales el 37% es camarón, pero la frecuencia es sólo de 8%; los peces representan el 22% del volumen de alimento ingerido, con una frecuencia del 44%; por otra parte, anélidos poliquetos aparecieron con una frecuencia del 12% pero fueron volumétricamente bajos (Fig. 12). En el Pacífico de México, Galeichthys caerulescens ha sido parcialmente estudiada en su alimentación por Carranza (1969c y 1970), Carranza y Amezcua-Linares (1971a y 1971b) , Amezcua-Linares (1972 y 1977) y González-Villaseñor (1972) ; y estudiada más ampliamente por Yáñez-Arancibia (1975b y 1977) y Yáñez-Arancibia et al. (1976) donde se ha discutido su alimentación, madurez, reproducción, desarrollo embrionario, crecimiento y relaciones ecológicas, examinando 870 ejemplares en un ciclo anual. La discusión planteada en este trabajo se basa en los trabajos de Yáñez-Arancibia, donde se han examinado 605 estómagos de G. caerulescens (390 por los métodos volumétricos y de frecuencia y 215 por los métodos gravimétricos) . Numerosas figuras ilustran esos trabajos, así como también discusión y proposición de metodologías, de tal manera que en este estudio solamente se destaca lo más trascendente de la alimentación de G. caerulescens. 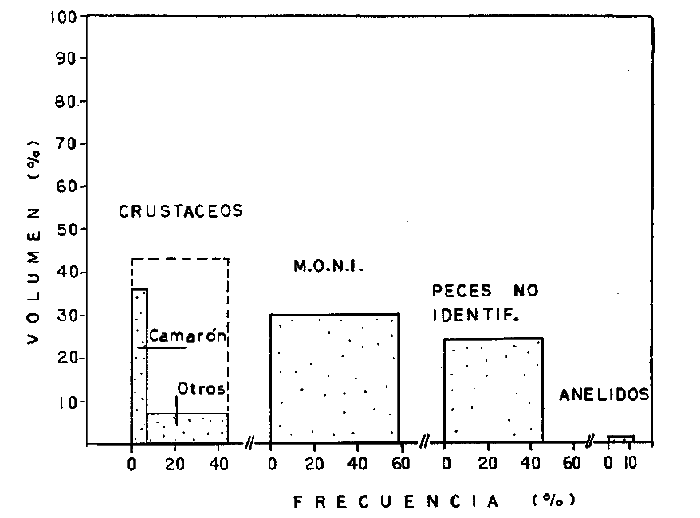 Fig. 12. Espectro trófico de volumen y frecuencia de Galeichthys gilberti en el sitema lagunar costero de Huizache-Caimanero, Sinaloa. (N=47). Modificado en Carranza (1970). La mayoría de los estudios mencionados considera a Galeichthys caerulescens como una especie de hábitos preferentemente carnívoros. El alimento principal en la etapa juvenil son pequeños crustáceos, insectos, moluscos pequeños peces, anélidos y algas con muy poca frecuencia; entre los crustáceos los copépodos, anfípodos y peneidos son los más importantes. Yáñez-Arancibia (1975b) ha señalado que es una especie predominantemente carnívora consumidor de segundo y tercer orden, predando sobre peces, crustáceos, insectos, moluscos, anélidos, y también incorporando algunos vegetales y detritus en su dieta. Agrega ese autor que el factor alimenticio más importante fueron los peces y restos de materia orgánica no determinable, luego los crustáceos, moluscos, insectos, anélidos y algunos restos vegetales con poca significación cuantitativa. Resultados muy similares señalan Yáñez-Arancibia et al. (1976). Por todas las observaciones se permite precisar que Galeichthys caerulescens es una especie predominante carnívora, consumidor de segundo y eventualmente de tercer orden. Su alimento lo constituyen peces, camarones, decápodos, insectos, moluscos, anélidos, isópodos, nemátodos, copépodos, ostrácodos, detritus y materia orgánica, restos de vegetales y algunos sedimentos inorgánicos. Invariablemente el principal alimento lo constituyen los peces, decápodos (camarones) y el detritus orgánico (Figs. 13 a 27). Sin embargo, el predominio de los diferentes grupos tróficos encontrados en este estudio depende de: a) la disponibilidad del alimento, b) la estación del año, c) la localidad, y d) la edad del pez. Las especies identificadas en la dieta de Galeichthys caerulescens han sido: peces: Gobionellus microdon, Mugil curema, Anchovia macrolepidota, Cichlasoma trimaculatum, Dormitator latifrons, Gerres cinereus, Diapterus peruvianus, Eugerres lineatus, Eucinostomus spp, Astyanax fasciatus, Poecilia sphenops, Poecilliopsis spp; crustáceos: Callinectes toxotes, C. arcuatus, Penaeus stylirostris, P. californiensis, P., duorarum, Macrobrachium tenellum; moluscos: Mytella strigata, Polymesoda sp, Neritiña sp, Amnicola sp. Durante el periodo 3 y en las áreas más dulceacuícolas de cada localidad, predominan en el aspectro trófico algunos copépodos del género Cyclops, isópodos, ostrácodos, insectos y larva de Chironomus, el langostino Macrobrachium el microgastrópodo Amnicola y los peces Gobionellus, Cichlasoma, Dormitator, Astyanax, Poecilia y Poecilliopsis. Además de la localidad, la estación del año (periodo 1, 2 y 3) , y la disponibilidad del alimento, el espectro trófico de G. caerulescens varía ligeramente con la edad del pez, predominando el zooplancton (Cyclops en aguas dulces y Acartia en aguas salobres y marinas) y pequeños organismos bentónicos en los ejemplares de 100 mm, de longitud total. Posteriormente la variación del espectrófico trófico se basa fundamentalmente en relación al ambiente y sus variaciones (Figs. 13 a 27). Interesantes resultados muestra el estudio de la relación gravimétrica del alimento ingerido por Galeichthys caerulescens. En los primeros estados de desarrollo siendo el pez pequeño consume mayor cantidad de alimento, en relación a su peso total (Fig. 28). Conforme crece la especie y se incrementa el peso total, la necesidad gravimétrica de alimento es mucho menor. Esto es un aspecto económico interesante cuando se piensa en especies susceptibles de ser cultivadas y deben conocerse las necesidades económicas de alimento de la especie en estudio, conforme avanza su desarrollo y crecimiento (Yáñez-Arancibia et al. 1976). En la citada figura 28 se compara a G. caerulescens, consumidor de segundo y tercer orden, con Dormitator latifrons, consumidor de primer orden. Galeichthys caerulescens presenta ejemplares en fases gonádicas mayores de III después de los 200 mm de longitud total y 60 g de peso total. Esta fase gonádica, se considera como adulta. Sin embargo algunas hembras entre 180 y 200 mm de longitud total y de aproximada mente 50 g de peso total ya inician su desarrollo gonádico III. Asimismo, existen machos en fases gonádicas II que pueden alcanzar hasta 220 mm o más de longitud total y más de 70 p de peso total. 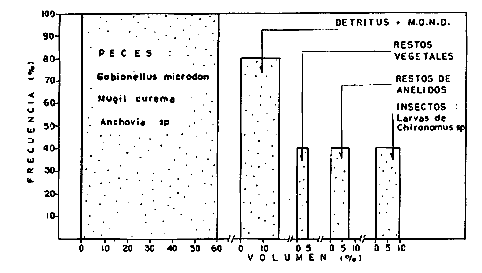 Fig. 13. Espectro trófico de volumen y frecuencia de Galeichthys caerulescens en el sistema lagunar costero de Guerrero, durante el periodo 1. Salinas de Apozahualco (N=10). Septiembre de 1973. 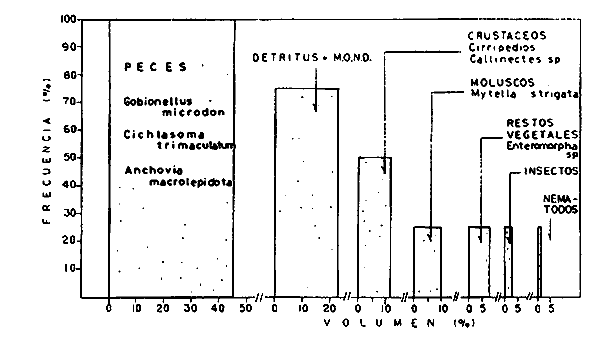 Fig. 14. espectro trófico de volumen y frecuencia de Galeichtys caerulescens en el sistema lagunar costero de Guerrero, durante el periodo 1. Chautengo (N=08). Septiembre de 1973. 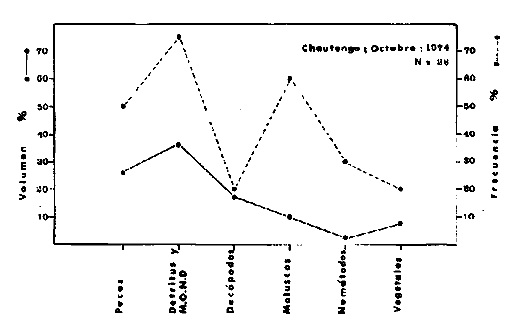 Fig. 15.Espectro trófico de volumen y frecuencia de Galeichthys caerulescens en el sistema lagunar costero de Guerrero, durante el periodo 1. Chautengo (N=26). 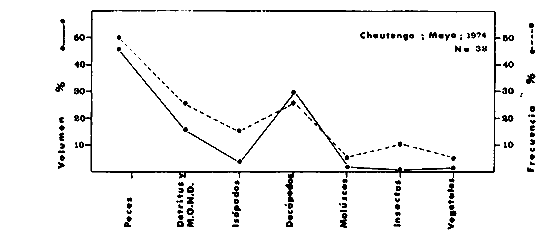 Fig. 16. Espectro trófico de volumen y frecuencia de Galeichhyus caerulescens en el sistema lagunar costero de Guerrero, durante el periodo 1. Chautengo (N=38). 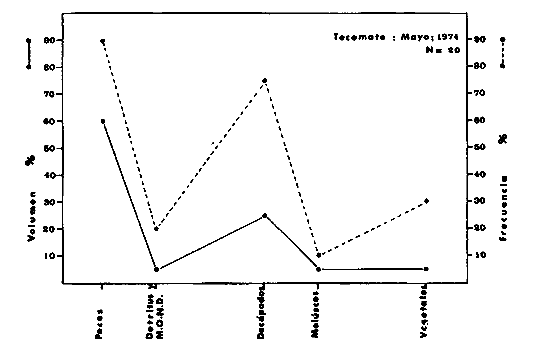 Fig. 17. Espectro trófico de volumen y frecuencia de Galeichthys caerulescens en el sistema lagunar costero de Guerrero, durante el periodo 1. Tecomate (N=20). 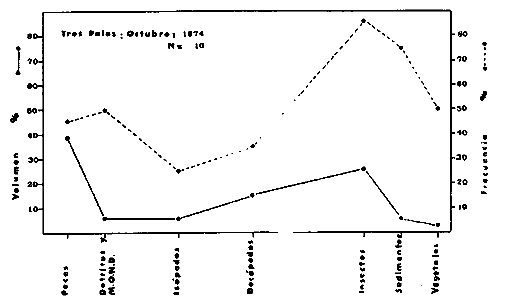 Fig. 18. Espectro trófico de volumen y frecuencia de Galeichthys careulescens en el sistema lagunar costero de Guerrero, durante el periodo 1. Tres Palos (N=10). 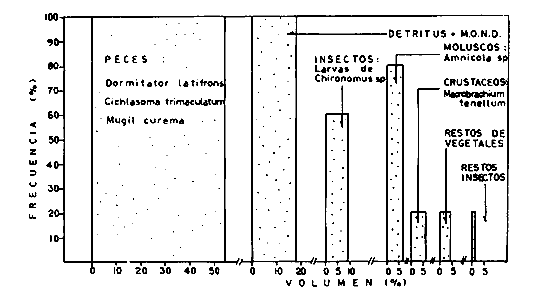 Fig. 19. Espectro trófico de volumen y frecuencia de Galeichthys careulescens en el sistema lagunar costero de Guerrero, durante el periodo 1. Mitla (N=10). Septiembre de 1973. 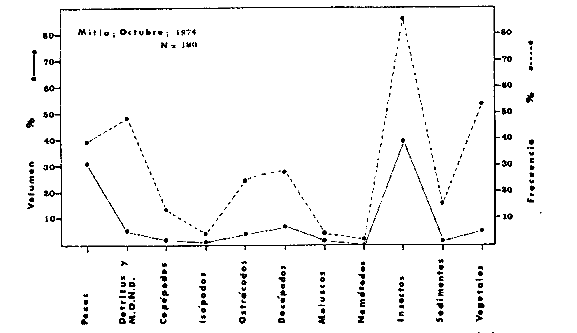 Fig. 20. Espectro trófico de volumen y frecuencia de Galeichthys careulescens en el sistema lagunar costero de Guerrero, durante el periodo 1. Mitla (N=180). 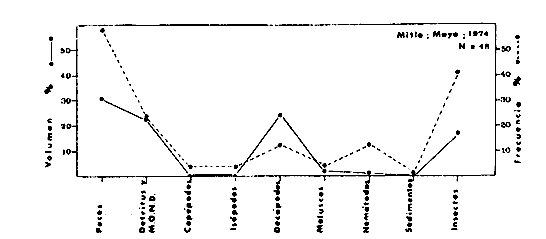 Fig. 21. Espectro trófico de volumen y frecuencia de Galeichthys careulescens en el sistema lagunar costero de Guerrero, durante el periodo 2. Mitla (N=48). 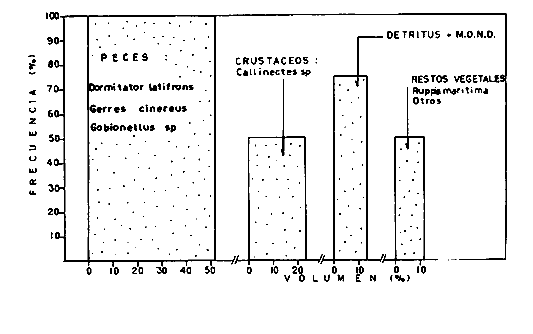 Fig. 22. Espectro trófico de volumen y frecuencia de Galeichthys careulescens en el sistema lagunar costero de Guerrero, durante el periodo 1. Nuxco (N=08). Septiembre de 1973. 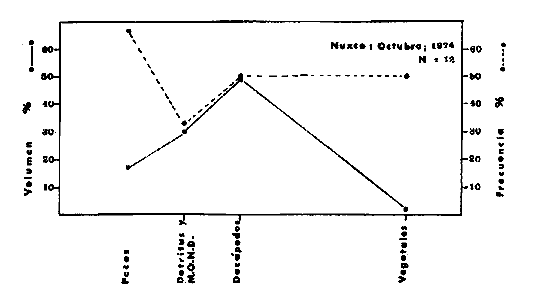 Fig. 23. Espectro trófico de volumen y frecuencia de Galeichthys careulescens en el sistema lagunar costero de Guerrero, durante el periodo 1. Nuxco (N=12). 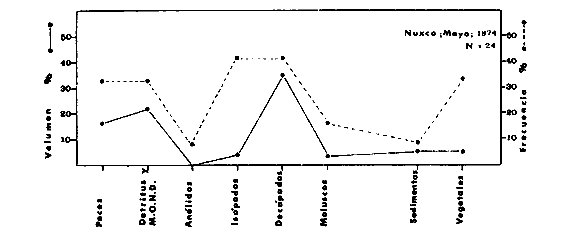 Fig. 24. Espectro trófico de volumen y frecuencia de Galeichthys careulescens en el sistema lagunar costero de Guerrero, durante el periodo 1. Nuxco (N=24). Esto permite precisar que la talla regular a la cual Galeichtys caerulescens. alcanza el estado adulto es de aproximadamente 200 mm de longitud y aparentemente las hembras maduran poco antes que los machos, en talla. Después de los 220 mm de longitud total existe una mezcla de fases sexuales que van de III a VII lo que dificulta precisar la edad de los peces, su crecimiento, o si se trata de la primera o una posterior madurez gonádica. Yáñez-Arancibia y Leyton (1977) han enfatizado, por esto, la necesidad de estudios de otolitos en ejemplares adultos. 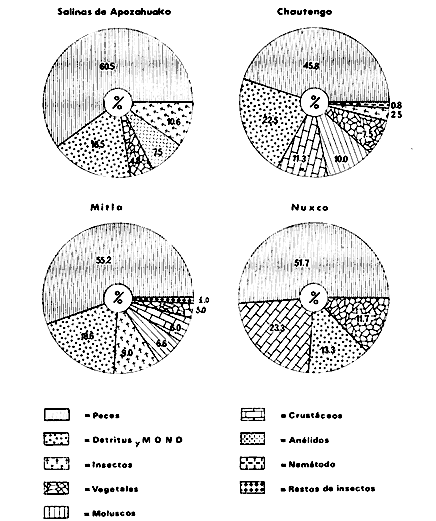 Fig. 25. Espectro trófico volumétrico de Galeichthys caerulescens en el sistema lagunar costero de Guerrero, durante el periodo 1. Salinas de Apozahualco (N=10), Chautengo (N=08), Mitla (N=10), Nuxco (N=08). Septiembre de 1973. 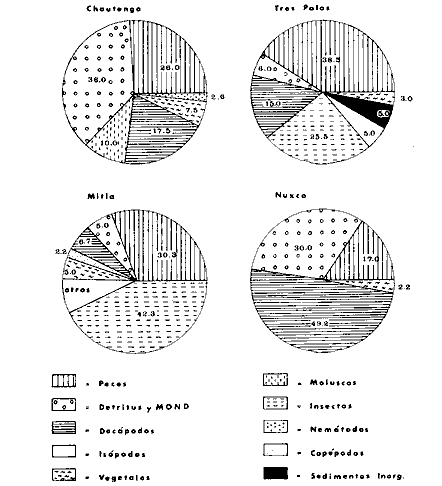 Fig. 26. Espectro trófico volumétrico de Galeichthys caerulescens en el sistema lagunar costero de Guerrero, durante el periodo 1. Chautengo (N=26), Tres Palos (N=10), Mitla (N=180), Nuxco (N=12). Octubre de 1974. 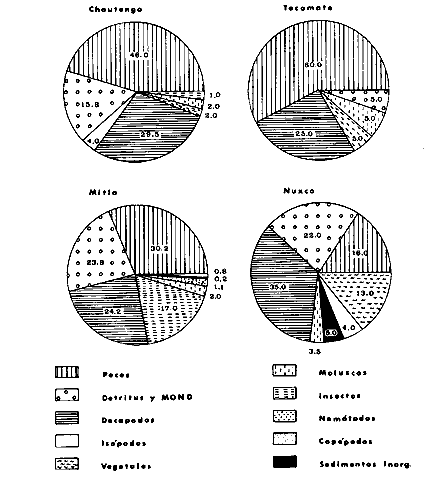 Fig. 27. Espectro trófico volumétrico de Galeichthys caerulescens en el sistema lagunar costero de Guerrero, durante el periodo 2. Chautengo (N=38), Tecomate (N=20), Mitla (N=48), Nuxco (N=24). Mayo de 1974. 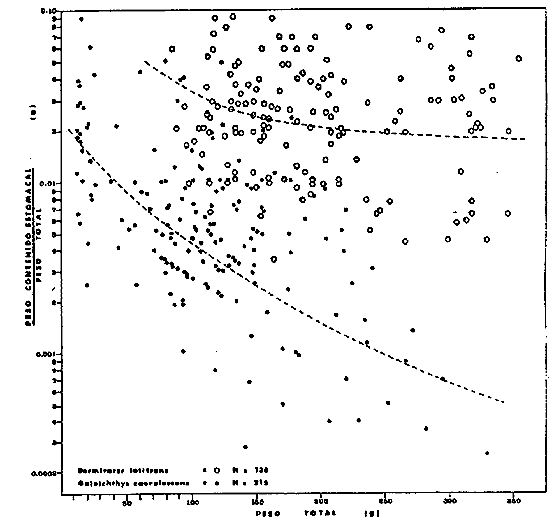 Fig. 28. Relación gravimétrica del alimento de Galeichthys caerulescens (consumidor secundario y/o de tercer orden) vs. relación gravimétrica del alimento de Dorminator latifrons (consumidor primario) en el sistema lagunar costero de Guerrero. Los estudios de reproducción indican un marcado dimorfismo sexual en relación a esa actividad fisiológica. Existe una gran proporción de hembras en las poblaciones, se reproducen por grandes huevos de abundante vitelo, fertilizados externamente e incubados en la cavidad oral de los machos. El desarrollo ontogénico, pasa por 5 etapas embrionarias definidas por primera vez por Yáñez-Arancibia et al. (1976). El período de reproducción es muy amplio presentándose la mayor cantidad de huevos y larvas de incubación durante los meses de mayo y octubre. Se reproducen a salinidades menores de 15 ‰. La especie no sufre presiones de predación por otros peces pero es un exportador de energía del ecosistema al ser predada por: 1) el hombre y 2) ciertas aves. Tolera rangos de temperatura de 19 a 35°C y rangos de salinidades de 0 a 45‰. Esta especie es la más abundante en número y biomasa y una de las mejor adaptatadas fisiológica y morfológicamente a los sistemas lagunares del Pacífico mexicano. De acuerdo a su reproducción y comportamiento corresponde a una especie típica estuarina (Fig. 7), de origen dulceacuícola, que pudiendo o no realizar migraciones, completa todo su ciclo de vida en el interior de las lagunas costeras y estuarios. Sus hábitos son bentónicos, es un activo nadador, se agrupa en densos cardúmenes, es un gran predador y está provisto de tres fuertes espinas aserradas (aleta dorsal y pectorales) con un alto poder tóxico al causar una herida. Centropomus robalito Jordan y GilbertEs una de las especies del grupo de los "robalos" y "constantinos" más apreciadas en las costa del Pacífico de México. Sin embargo, se encuentra pobremente estudiada en contraste con Centropomus undecimalis, C. parallelus, C. pectinatus y C. poeyi que se encuentran en la costa del Golfo de México siendo probablemente las especies de Centropomidae mejor estudiadas en las costas mexicanas. Sobre aspectos alimenticios Marshall (1958) estudió 128 ejemplares de Centropomus de Florida, de tallas entre 230-285 mm encontrando que los peces correspon dieron al alimento más importante presente en más del 57% de los estómagos examinados; ellos incluían Eucinostomus sp, Mugil cephalus, Lagodon rhomboides, Orthopristis chrysopterus, Anchoa spp, Poecilia latipinna, Gambusia sp y Mollienesia affinis. Otro alimento encontrado fue camarones carideos del género Palaemonetes, y peneidos Penaeus duorarum en un 41%, cangrejos en un 18% y Cambarus sp en un 8.2%. Los resultados de otros autores son variados. Cervigón (1966) encontró que C. undecimalis de las lagunas costeras de Venezuela preda sobre camarones, anchoas y pequeños peces del tipo Bagre sp. Según Springer y Woodburn (1960) los ejemplares menores de 56 mm comen pequeños crustáceos , pero Harrington y Harrington (1961) concluyeron que los pequeños ejemplares de C. undecimalis se alimentan de peces y en menor grado de camarones y Linton y Rickard (1965) encontraron que los juveniles de C. undecimalis consumen camarones carideos y algunas pocas Gambusia. W.E. Odum (1971) y W.E. Odum y Heald (1972) han sintetizado y discutido los resultados de estos autores en relación a comunidades de manglares de South Florida. Sin embargo no han considerado el trabajo de Chávez (1963) , probablemente el trabajo más importante sobre Centropomus de los últimos años. Chávez ha hecho una extensa revisión de C. undecimalis, C. parallelus, C. pectinatus y C. poeyi desde los puntos de vista taxonómico, biológico y ecológico, discutiendo una gran cantidad de información. Respecto de los hábitos alimenticios de estas especies es importante destacar lo esencial del trabajo de Chávez (1963) para complementar los estudios de C. robalito y C. nigrescens de este trabajo e interpretar mejor el papel ecológico de los robalos en las cadenas tróficas de los ambientes costeros. Ese autor ha encontrado que los adultos de Centropomus undecimalis (18 ejemplares examinados) se alimentan de peces (Diapterus rhombeus, D. olisthostomus, Stellifer lanceolatus y Anchoa mitchilli diaphana) con un 51.6% en volumen y 44.4% de frecuencia; crustáceos (Penaeus sp, Penaeus aztecus, Palaemone tes sp, Callinectes sapidus y Pagurus sp) con un 36.2%, en volumen y 44.4%, de frecuencia; restos de peces no identificados con un 10.9%, en volumen y 27.7%, de frecuencia; restos de crustáceos no identificados con un 0.5%, de volumen y 11.1%, de frecuencia; restos de moluscos con un 0.3%, de volumen y 5.5%, de frecuencia; restos de vegetales con un 0.4%, de volumen 11.1% de frecuencia, y materia orgánica con un 0.1% de volumen y 5.5% de frecuencia, Los ejemplares juveniles de la misma especie (51 ejemplares examinados) tienen una alimentación con una variación en las especies de los grupos tróficos. Así aparece Eucinostomus entre los peces comidos, y Penaeus setiferus, ejemplares de Pilumnidae e isópodos entre los crustáceos, además de insectos. Para Centropomus parallelus Chávez (1963) ha encontrado que los ejemplares adultos (121 ejemplares examinados) se alimentan de peces (Anchoa sp. Dormitator maculatus, Polydactylus octonemus, Arius (Galeichthys) felis y Góbidos) con un 37.4%, en volumen y 13.2% de frecuencia; crustáceos (Penacus sp. Penaeus setiferus, Macrobrachium sp. Cirolana sp; portúnidos; pilumnidos, además de isópodos) con un 21.2%, en volumen y 17.3%, de frecuencia; restos de peces no identificados con un 27.6% en volumen y 45.4% de frecuencia; restos de crustáceos no identificados con un 7.6%de volumen y 90% de frecuencia; materia orgánica con 4.9%en volumen y 24.7% de frecuencia; moluscos (Brachidontes recurvus) con un 0.3% en volumen y 0.8% de frecuencia, y restos vegetales con un 1 % en volumen y 9%, de frecuencia. Los ejemplares juveniles de la misma especie (17 ejemplares examinados) tienen una alimentación similar, pero aumenta el porcentaje de materia orgánica y aparecen insectos en el espectro trófico. Para Centropomus pectinatus Chávez (1963) ha encontrado que los ejemplares adultos (13 ejemplares examinados) se alimentan de peces con un 12% en volumen y 7.6% de frecuencia; restos de peces con un 48% en volumen y 76.9% de frecuencia; crustáceos con un 26.4% en volumen y 23%, de frecuencia; materia orgánica no identificable con un 4.807, en volumen y 23%, de frecuencia y algunos restos de vegetales con un 1.6% en volumen y 15.3% de frecuencia. Para Centropomus poeyi Chávez (1963) examinó 50 ejemplares encontrando, que se alimentan de peces (Dormitator maculatus, Cichlasoma sp, Gobionellus sp, Pleuronéctidos) con un 75% en volumen y 40%, de frecuencia; restos de peces no identificados con un 15.1% en volumen y 60% de frecuencia, crustáceos (Penaeus sp, Palaemóneles sp, Crangon sp, Callinectes sapidus astácidos) con un 6.5% en volumen y 20% de frecuencia; restos de crustáceos no identificados con un 0.6%, en volumen y 8% de frecuencia; moluscos (gasterópodos, Pleurocera sp) con un 2.3% en volumen y 4% de frecuencia, insectos (Odonata) con un 0. 1% en volumen 2%, de frecuencia, y restos vegetales con un 0.4% en volumen y 8% de frecuencia. Por el análisis del volumen de cada grupo trófico incorporado como alimento, además de la frecuencia con que es ingerido, puede deducirse del trabajo de Chávez (1963) que los robalos del Golfo de México son consumidores de tercer orden en los ecosistemas costeros. Centropomus pectinatus es la única especie presente en ambas costas de México y sólo ha sido estudiada parcialmente por Beebe y Tee-Van (1928). Comen camarones y Engráulidos al igual que en las costas del Pacífico. Recientemente Carvajal (1975) ha hecho un estudio sobre Centropomus undecimalis y C. poeyi en la Laguna de Términos, Campeche, en el sureste mexicano. Respecto de la alimentación de esas especies Carvajal (1975) ha encontrado que C. undecimalis (327 ejemplares) se alimenta de peces (Sardinella sp, Dorosoma sp, Cetengraulis edentulatus, Arius felis, Arius melanopus, Oligoplites saurus, Eugerres plumieri, Bairdiella rhonchus, Cichlasoma geddesi, Cichlasoma charripotonis, Eleotris pisonis, Dormitator maculatus) con un 55,56% en número; crustáceos (Penaeus setiferus P. schmitti, P. brasiliensis, Trachypenaeus sp, Xiphopenaeus kroyeri, Macrobrachium acanthurus, M. carcinus, Callinectes sp, restos de estomatópodos) con un 43.96% en número; moluscos (Mulinia sp) con un 0.48% en número. Por otra parte, el método graviamétrico indicó un 47.45%, de peces, 28.26% de restos de peces, 11.30% de crustáceos, 2.56%, de restos de crustáceos 0.187, de algas, 0.01% de moluscos, 0.01% de restos de vegetales, y 10,22% de materia orgánica no identificable. La otra especie analizada por Carvajal (1975) fue Centropomus poeyi (94 ejemplares examinados) para la cual encontró en el contenido estomacal, peces (Astyanax fasciatus, Arius sp, Anguilla rostrata, Rivulus tenuis, Eugerres plumieri, Cichlasoma geddesi, Cichlasoma fenestratum, Cichlasoma sp, Dormitator maculatus, Gobiomorus dormitator) con un 54.8% en número; crustáceos (Penaeus sp, Xiphopenaeus kroyeri, Macrobrachium sp, Palemon schmitti, Callinectes sp) con un 32.3% en número; nemátados con un 10.8% en número: insectos con un 2.1% en número. Por otra parte el método gravimétrico indicó peces con un 50.86%; restos de peces con 30.74% crustáceos con un 7.16% restos de crustáceos con un 1.46%,; moluscos con un 0. 11 %; algas con un 1.84% fanerógamas (Thalassia testudinum y restos de Rhizophora mangle) con un 0.33%; huevos de peces con un 0.247; nemátados con un 0.02%; insectos con un 0.04%, y materia orgánica no identificable con un 7.14%. Estos estudios demuestran también que los robalos son exclusivamente carnívoros, donde los vegetales y el detritus son un alimento accidental. En la costa del Pacífico de México, Carranza (1969c) ha encontrado que en las lagunas costeras Centropomus robalito come peces en un 70% en volumen y 42%, de frecuencia (especialmente Sciénidos con 11% en volumen y 13% de frecuencia, Gérridos con 307, en volumen y 5% de frecuencia, Eleótridos con un 2% en volumen y 3% de frecuencia) . Los crustáceos son consumidos con un 21% en volumen y 29% de frecuencia; entre ellos, los camarones constituyen en 13%, en volumen con una frecuencia del 12%. Los insectos acuáticos aparecen con un frecuencia de 75%, pero su valor volumétrico es apenas del 1%. En la figura 29 se representan los resultados de Carranza (1969c). Con posterioridad, Carranza y Amezcua-Linares (1971b) y Amezcua-Linares (1972) han señalado que Centropomus robalito es una especie carnívora que se alimenta principalmente de peces y crustáceos, aunque en ocasiones incluye larvas de insectos en su dieta. 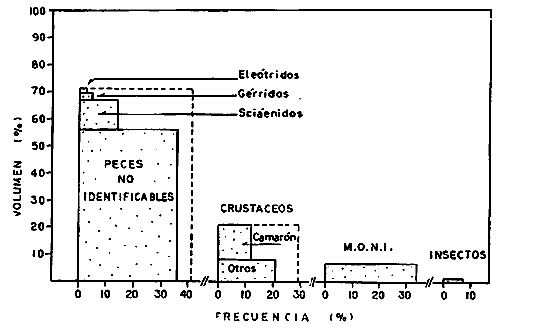 Fig. 29. Espectro trófico de volumen y frecuencia de Centropomus robalito en el sistema lagunar costero de Huizache-Caimanero, Sinaloa. (N=41). Modificado de Carranza (1969 c). 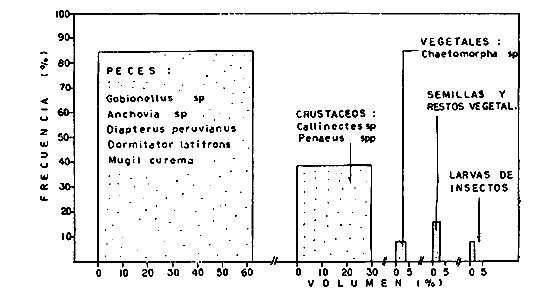 Fig. 30. Espectro trófico de volumen y frecuencia de Centropomus robalito en el sistema lagunar costero de Guerrero, durante el periodo 1. Salinas de Apozahualco. (N=41). Septiembre de 1973 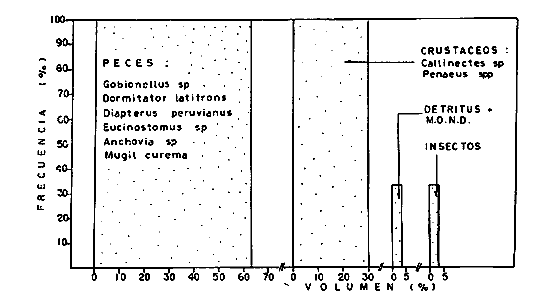 Fig. 31. Espectro trófico de volumen y frecuencia de Centropomus robalito en el sistema lagunar costero de Guerrero, durante el periodo 1. Chautengo. (N=26). Septiembre de 1973 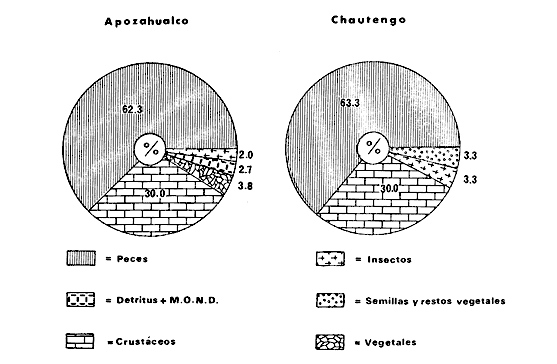 Fig. 32. Espectro trófico de volumen y frecuencia de Centropomus robalito en el sistema lagunar costero de Guerrero, durante el periodo 1. Salinas de Apozahualco. (N=46). Chautengo (N=26). En estos estudios Centropomus robalito se encuentra principalmente en las lagunas que presentan una marcada influencia marina durante el periodo 1. En salinas de Apozahualco el espectro trófico durante el periodo 1, para 46 ejemplares examinados (Figs. 30 y 32) indica que se alimenta de peces (Gobionellus sp, Anchovia sp, Diapterus peruvianus Dormitator latifrons y Mugil curema) con un 62.3% en volumen y 100% de frecuencia; crustáceos (Penaeus spp, Callinectes sp) con un 30% en volumen y 38.504 de frecuencia; larvas de insectos (Diptera Chironomus sp) con un 2% en volumen y 7.7%, de frecuencia; vegetales (Chaetomorpha sp) con un. 3.8% en volumen y 7.7% de frecuencia; otros restos vegetales y semillas con un 2.7% en volumen y 15.4% de frecuencia. Durante el periodo 2 desaparecen totalmente de los estómagos los restos vegetales encontrados en el Periodo 1, y la predación se concentra sobre Mugil, Diapterus y Callinectes. Pocos ejemplares de Centropomus resisten vivos durante el periodo 2 y desaparecen de la estructura trófica de las lagunas durante el periodo 3. En Chautengo, el espectro trófico (Figs. 31 y .512), durante el periodo 1, para 26 ejemplares examinados, indica que el principal alimento lo constituyeron los peces (Gobionellus sp, Dormitator latifrons, Diapterus peruvianus, Eucinostomus spp, Anchovia sp, Mugil curema) con un 63.3% en volumen y 1007, de frecuencia; crustáceos (Penaeus spp, Callinectes sp) con un 30% en volumen y 100% de frecunecia; insectos (Diptera Chironomus sp) con un 3.3% en volumen y 33.3% de frecuencia, y detritus y materia orgánica no determinable con un 3.3% en volumen y 33.3%, de frecuencia. Durante el periodo 2, no se encuentran vegetales en el contenido estomacal y la predación se concentra sobre Gobionellus, Mugil, Diapterus y Callinectes. No se encontraron Centropomus con estómagos llenos durante el periodo 3, en Chautengo. Se puede precisar que Centropomus robalito es exlusivamente carnívoro, consumidor de tercer orden, alimentándose de peces, crustáceos, moluscos, insectos y accidentalmente de detritus y algunos vegetales. Las tallas de los ejemplares examinados variaron entre 79 y 212 mm de longitud total con predominancia de fases sexuales 11 por debajo de 180 mm. La relación con el incremento en peso no es muy marcada en las primeras etapas del desarrollo (menos de 170 mm) pero posteriormente con el aumento de la madurez sexual y conforme crece la especie, el incremento en peso se acentúa. La dinámica de esta especie es similar en todas las lagunas que reciben notoria influencia marina durante el periodo 1. Las lagunas casi dulceacuícolas no son importantes para el establecimiento de poblaciones de Centropomus. De acuerdo con McHugh (1976) y Yáñez-Arancibia (1975a, 1976b y 1976c) y Yáñez-Arancibia y Nugent (1977) Centropomus robalito correspondería a una especie marina que visita cíclicamente áreas lagunares y/o estuarinas utilizando esos ambientes como áreas naturales de crianza, además de algunos adultos que penetran para alimentarse. Su ocurrencia masiva en estas circunstancias determina su importancia comercial y al mismo tiempo el peligro de la explotación incontrolada de este recurso al pescársele en estados en que no han alcanzado la madurez sexual. Centropomus nigrescens GüntherSe encuentra menos estudiada que Centropomus robalito. Berdegué (1954 y 1956) indica que en la costa noroccidental de México se pesca en forma comercial consumiéndose en fresco, seco y salado, y también ahumado. Carranza y Amezcua-Linares (1971a y 1971b) y Amezcua-Linares (1972) sólo analizaron 2 ejemplares pero aparenteniente es más abundante en la costa central del Pacífico mexicano, y particularmente en Guerrero tiene un papel ecológico similar a C. robalito, discutido anteriormente. Para esta especie Carranza (1969c) ha indicado que se alimentan de peces con un 70% en volumen, y camarones con un 15% en volumen. Predominan entre los peces que le sirven de alimento, la lisa Mugil sp, luego Hermiránfidos y otros especímenes no identificados. En la figura 33 se indican los resultados de Carranza, (1969c) a modo de comparación con los de este estudio. 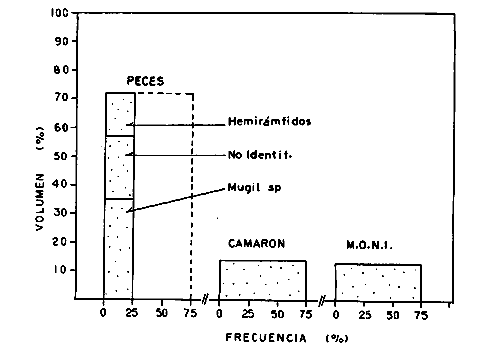 Fig. 33. Espectro trófico de volumen y frecuencia de Centropomus nigrescens en el sistema lagunar costero de Huizache-caimanero, Sinaloa. (N=04). Modificado de Carranza (1969 c). 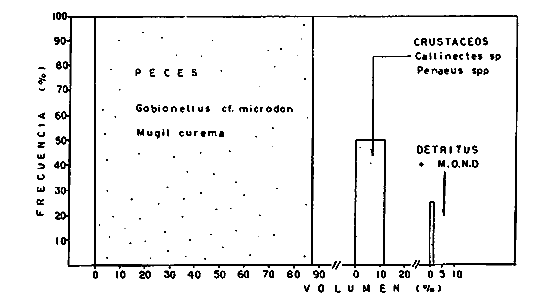 Fig. 34. Espectro trófico de volumen y frecuencia de Centropomus nigrescens en el sistema lagunar costero de Guerrero, durante el periodo 1. Salinas de Apozahualco. (N=19). Septiembre de 1973 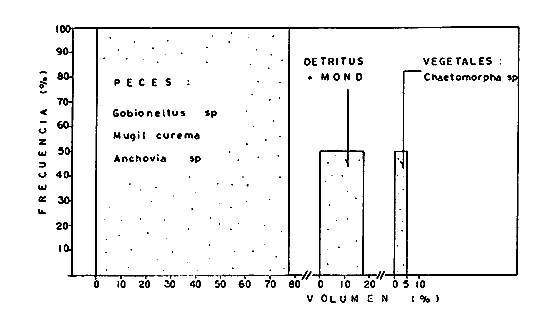 Fig. 35. Espectro trófico de volumen y frecuencia de Centropomus nigrescens en el sistema lagunar costero de Guerrero, durante el periodo 1. Chautengo. (N=33). Septiembre de 1973 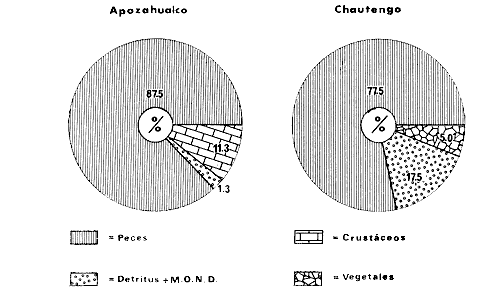 Fig. 36. Espectro trófico de volumétrico de Centropomus nigrescens en el sistema lagunar costero de Guerrero, durante el periodo 1. Salinas de Apozahualco. (N=19). Chautengo (N=33). En este trabajo fueron examinados 64 ejemplares de las lagunas Salinas de Apozahualco (19), Chautengo (33) y Salinas del Cuajo (12) colectados durante el periodo 1, además de 24 ejemplares en la laguna de Chautengo durante el periodo 2. En Salinas de Apozahualco, el espectro trófico (Figs. 34 y 36) indica que el principal alimento corresponde a peces (Gobionellus microdon y Mugil curema y otros restos no identificados) con un 87.5 % en volumen y 100% de frecuencia, crustáceos (Penaeus spp y Callinectes spp) con un 11.3% en volumen y 50% de frecuencia, y detritus y otra materia orgánica no determinable con 1.3% en volumen y 25% de frecuencia. El detritus y la materia orgánica probablemente es ingerido cuando predan sobre organismos bentónicos como algunas jaibas o peces Góbidos o Eleótridos. En Chautengo, el espectro trófico (Figs. 35 y 36) indica que se alimentan de peces (Gobionellus sp, Mugil curema, Anchovia sp, Diapterus peruvianus) con un 77.5% en volumen y 100% de frecuencia; materia orgánica no determinable con un 17.5%, en volumen y 50% de frecuencia, y restos vegetales (Chaetomorpha sp) con un 5 % en volumen y 50% de frecuencia. En Salinas del Cuajo, el espectro indica que se alimentan de peces con un 75% en volumen y 100% de frecuencia; crustáceos con un 12% en volumen y 80% de frecuencia; moluscos con un 8% en volumen y 50% de frecuencia, y materia orgánica no determinable con un 5% en volumen y 25% de frecuencia. Durante el periodo 2 sólo fueron colectados ejemplares en la laguna de Chautengo y allí el espectro trófico indica que la predación se concentra sobre Diapterus peruvianus, Mugil curema, Callinectes spp y Mytella strygata. Durante el periodo 3, las dos especies de robalos estudia das prácticamente desaparecen de la estructura trófica de las lagunas de Guerrero. Puede concluirse que tanto Centropomus robalito como C. nigrescens tienen un papel ecológico similar como consumidores de tercer orden y en las lagunas de Guerrero se alimentan de peces (Gobionellus microdon, Dormitator latifrons, Diapterus peruvianus, Eucinostomus spp, Anchovia macrolepidota, Anchovia sp, Mugil curema, Hemiránfidos, crustáceos (Penaeus spp, Callinectes spp) , insectos (Diptera Chironomus sp) , y algunos vegetales y detritus de manera accidental. Las tallas de los ejemplares examinados variaron entre 115 y 234 mm de longitud total con predominancia de inmadurez sexual. La madurez sexual de esta especie se alcanza después de los 260 mm. Correspondería a una especie marina que visita cíclicamente las lagunas en etapas pre-adultas, para alimentarse y completar parte de su desarrollo. Su ocurrencia masiva en estas circunstancias determina su importancia comercial y al mismo tiempo el peligro de la extracción de un recurso que no ha completado su desarrollo sexual. Caranx hippos (Linnaeuus)Se encuentra en ambas costas de América tropical. Darnell (1962) la señaló entre la ictiofauna de lagunas costeras asociadas al complejo del Río Tamesí en el noreste de México, pero sin asignarle importancia comercial. Por el contrario Reséndez (1974 y 1975) ha sefialado la gran importancia económica de Carans hippos en algunas lagunas costeras del Golfo de México bastante más al sur del complejo lagunar estudiado por Darnell (1962). En la costa del Pacífico de México su importancia económica radica solamente en un consumo local. Sin embargo, la abundancia de cardúmenes y su visita cíclica masiva a las lagunas sugiere su potencial económico. Darnell (1958 y 1961) señaló que en el norte del Golfo de México Caranx hippos es un predador de peces, cangrejos, calamares, camarones y pequeños invertebrados. Hildebrand y Schroeder (1928) y Reid (1954) lo han descrito como un carnívoro piscívoro, De Sylva et al. (1962) analizaron 40 ejemplares de C. hippos de la localidad de Delaware Bay, que medían entre 30 y 160 mm de longitud, encontrando que los misidáceos predominan en la alimentación de los ejemplares de menos de 70 mm, mientras que ejemplares de Palaemonetes sp predominan en la alimentación de ejemplares entre 100 y 150 mm. Entre los pocos peces encontrados por esos autores en los estómagos de C. hippos, se encuentran Góbidos, Engráulidos y Aterínidos. W.E. Odum (1971) y W,E. Odum y Heald (1972) analizaron unos pocos especímenes de 147 a 241 mm de longitud total y encontraron en forma preliminar, predominancia de Penaeus sp en los estómagos. Carranza (1969b y 1969c), Carranza y Amezcua-Linares (1971a y 1971b), Amezcua-Linares (1972) y Yáñez-Arancibia (1975b), han señalado que se trata de una especie de hábitos carnívoros que preda sobre Engráulidos, Aterínidos, Clupéidos, así como también sobre algunos crustáceos e insectos. En estos estudios fueron examinados 48 ejemplares de las lagunas Chautengo (09) , Tecomate (1l), Nuxco (16) y Potosí (12). Todos los ejemplares provienen del periodo 1. Durante el periodo 2 y 3 son escasos y/o desaparecen de la estructura trófica de las lagunas. Las cuatro lagunas mencionadas tienen marcada influencia marina durante el periodo 1. En Chautengo el espectro trófico indica que se alimentan de peces (Anchovia sp, Anchoa mundeoloides, Lile stolifera, Eucinostomus spp) con un 70% en volumen y 100% de frecuencia, crustáceos (Penaeus sp) con un 20% de volumen y 45% de frecuencia, insectos con un 8%, en volumen y 60% de frecuencia, y 2% de restos vegetales y detritus con un 100% de frecuencia. En Tecomate y Potosí no fue determinado cuantitativamente el alimento pero cualitativamente estuvo formado por peces, crustáceos, moluscos (Mytella strigata) y restos vegetales y detritus orgánicos en el 100%, de los estómagos. En Nuxco el espectro trófico indica que se alimentan de peces (Eucinostomus sp, Mugil curema, Gobionellus sp, Anchovia sp, Lile stolifera) con un 80% en volumen y 100% de frecuencia; crustáceos (Callinectes sp, Penaeus sp,Cardisoma sp) con un 8% en volumen y 75% de frecuencia; moluscos (Mytella strigata) con un 4% en volumen y 60% de frecuencia, y restos vegetales (Ruppia) y detritus con un 8% en volumen y 100% de frecuencia. La aparición de restos vegetales y detritus con poca significación volumétrica pero importantes en la frecuencia de aparición determina que no sean alimentos accidentales. De esa manera Caranx hippos se comporta como un consumidor secundario en el sistema lagunar costero de Guerrero. J.W. Day et al. (1973a y 1973b) también indica que esta especie es un consumidor secundario. De acuerdo a Mc Hugh (1967), Yáñez-Arancibia (1975a y Yáñez-Arancibia y Nugent (1977), correspondería a una de las especies marinas que visita cíclicamente las lagunas y/o estuarios especialmente al estado juvenil y para alimentarse, protegerse y crecer. Las tallas de los ejemplares examinados variaron entre 85 y 166 mm, prodominando estados sexuales 1-11. Caranx hippos alcanza la madurez sexual después de los 170 mm de longitud total. Lutjanus argentiventris (Peters)Berdegué (1956) ha señalado que Lutjanus argentiventris es uno de los Lutjanus que más se capturan en la costa noroccidental. Estos estudios demuestran que tanto L. argentiventris como L. novemfasciatus son dos especies características y de gran importancia económica en las lagunas costeras de Guerrero que presentan marcada influencia marina durante el periodo 1. Lutjanus argentiventris sólo ha sido estudiado parcialmente desde el punto de vista de su alimentación por Yáñez-Arancibia (1975b). El resto de la literatura sólo informa de algunos trabajos realizados en otras especies del género. Springer y Woodburn (1960) han señalado que los juveniles de L. griseus pasan los primeros meses de su vida entre comunidades de pastos marinos y conforme van creciendo sólo se alimentan de peces. A su vez los ejemplares juveniles se alimentan preferentemente durante el día, consumiendo pequeños crustáceos (Randall, 1967). W. E. Odum y Heald (1972) han complementado esta información agregando que después de los 50 mm los especímenes abandonan su lecho de pastos y se trasladan hacia áreas de fondos rocosos o costas de manglares. Este cambio de habitat va acompañado por el cambio de la dieta, predando preferentemente sobre peces y crustáceos más grandes (Randall, 1967) Longley e Hildebrand (1941) encontraron que L. griseus se alimentan de cangrejos, camarones, calamares y anélidos. Tabb et al. (1962) han señalado que los pargos se alimentan de camarones, cangrejos y diferentes peces pequeños, en la localidad de White Water Bay. 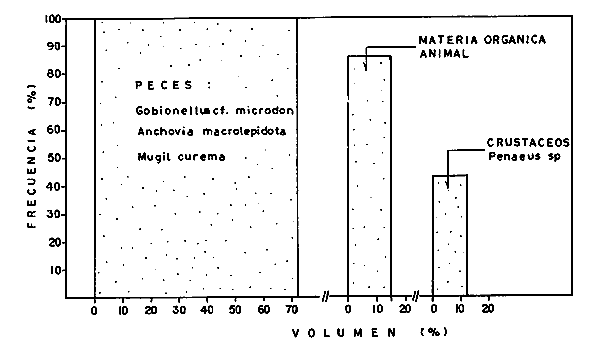 Fig. 37. Espectro trófico de volumen y frecuencia de Lutjanus argentiventris en el sistema lagunar costero de Guerrero, durante el periodo 1. Salinas de Apozahualco. (N=24). Septiembre de 1973 W. E. Odum (1971) y W. E. Odum y Heald (1972) analizaron 112 pargos predominantemente juveniles, coincidiendo en mucho sus resultados con los de Croker (1962) respecto a la afluencia de juveniles en ciertas épocas del año y las consiguientes migraciones. Los estudios de contenidos estomacales de W. E. Odum y Heald (1972) muestran que no hay diferencias en la alimentación de los juveniles y los adultos; sin embargo, en la dieta diurna predominan los peces y en la dieta nocturna los crustáceos. Croker (1962) había encontrado en el examen de los estómagos de L. griseus que los crustáceos (predominando camarones) constituían el principal alimento en un 61.6% en número y 76.7% en volumen; luego seguian los peces y cangrejos con un 34% en número y 27% en volumen. Por otra parte W. E. Odum y Heald (1972) encontraron para la misma especie, en la dieta diurna, 63% en volumen de peces y 377, de crustáceos (18% de Rhithropanopeus harrisi, 12% de Alphezs heterochaelis y 7% de Palaemonetes sp) ; para la dicta nocturna y del amanecer, encontraron un 90% de crustáceos (45% de Rhithropanopeus harrisi, 26% de Alpheus heterochaelis, 9% de Palaemonetes sp, 6% de Procambarus alleri, 4%, de Penaeus duorarum) y sólo un 10% de peces. Entre los peces ingeridos destacaban como más comunes: Lophogobius cyprinoides, Microgobius gulosus, Anchoa hepsetus, A. mitchilli, Gambusia affinis, Poecilia latipinna, Fundulus grandis y Anguilla rostrata. Randall (1967) estudió la alimentación de Lutjanus analis, L. apodus, L. cyanopterus, L. jocu, L. mahogoni, L. synagris y L. griseus, de los cuales, al menos los dos últimos se encuentran en la costa mexicana del Golfo. Todos ellos fueron especies exclusivamente carnívoras en el Caribe, alimentándose de peces y macroinvertebrados. Claro y Lapín (1971) encontraron que L. synagris es carnívoro alimentándose principalmente de crustáceos y peces y accidentamente de Thalassia. En estos estudios fueron examinados 53 ejemplares de Lutjanus argentiventris, de los cuales 24 fueron de la laguna Salinas de Apozahualco, 12 de la laguna Nuxco y 17 de la laguna Potosí. Todos durante el periodo 1. En Salinas de Apozahualco el espectro trófico (Figs. 37 y 40) indica que la especie es carnívora alimentándose de peces (Gobionellus microdon, Anchovia macrolepidota, Diapterus peruvianus y Mugil curema) con un 70% volumen y 100% de frecuencia; crustáceos (Penaeus sp) con un 12.10/, en volumen y 42.9 % de frecuencia, materia orgánica animal con un 15% en volumen y 85% de frecuencia. En Nuxco, el espectro trófico señala que se alimentan de peces con un 65% en volumen y 85% de frecuencia, crustáceos (Callinectes sp y Cardisoma sp) con un 8.5% en volumen y 70% de frecuencia y restos de moluscos con un 6.5%, en volumen y 40% de frecuencia. En Potosí el espectro, trófico también indica los hábitos exclusivamente carnívoros de esta especie, alimentándose de peces (Diapterus sp, Eucinostomus sp, Anchoa sp, Anchovia macrolepidota, Mugil curema) con un 75% en volumen y 90% de frecuencia; crustáceos (Penaeus sp) con un 13% en volumen y 65% de frecuencia, y restos de materia orgánica animal con un 12% en volumen y 75% de frecuencia. Estos resultados indican que en las lagunas de Guerrero esta especie es carnívora consumidor de tercer orden. Los ejemplares examinados variaron entre 96 y 160 mm de longitud total y con predominancia de fases sexuales entre II y IV, De acuerdo, a Mc Hugh (1967), Yáñez-Arancibia (1975a, 1976b y 1976c) y Yáñez-Arancibia y Nugent (1977) , correspondería al grupo de peces marinos que penetra cíclicamente a los estuarios (Fig. 7) generalmente para alimentarse pero que pasan la mayor parte de su vida en el mar. Lutjanus novemfasciatus GillSu importancia en el Pacífico mexicano ha sido señalada por Berdegué (1954 y 1956), Ramírez-Hernández y Páez (1965), Carranza y Amezcua-Linares (1971b) y recientemente por Yáñez-Arancibia (1975b). 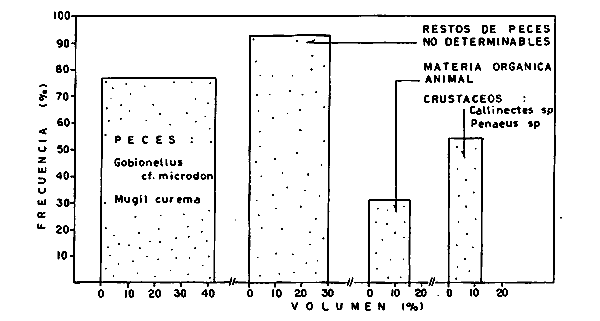 Fig. 38. Espectro trófico de volumen y frecuencia de Lutjanus novemfasciatus en el sistema lagunar costero de Guerrero, durante el periodo 1. Salinas de Apozahualco. (N=31). Septiembre de 1973 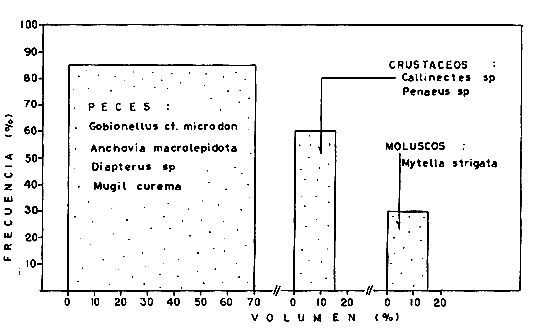 Fig. 39. Espectro trófico de volumen y frecuencia de Lutjanus novemfasciatus en el sistema lagunar costero de Guerrero, durante el periodo 1. Chautengo (N=31). Septiembre de 1973 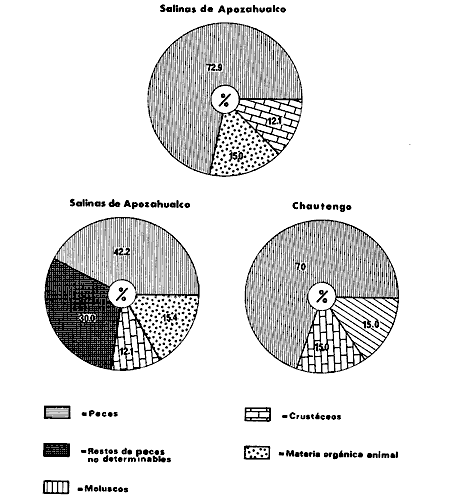 Fig. 40. Espectro trófico volumétrico de Lutjanus argentiventris (círculo superior) en el sistema lagunar costero de Guerrero, durante el periodo 1. Salinas de Apozahualco. (N=24). El mismo espectro para Lutjanus novemfasciatus (círculos inferiores); Salinas de Apozahualco (N=31), Chautengo (N=31). Para el análisis de la alimentación se examinaron 31 ejemplares de la laguna Salinas de Apozahualco, 12 ejemplares de Tecomate, 31 ejemplares de Chautengo, 10 ejemplares de Nuxco; todos colectados durante el periodo 1. En Salinas de Apozahualco el espectro trófico (Figs. 38 y 40) indica que la especie es carnívora alimentándose de peces (Gobionellus microdon Eucinostomus sp, Mugil curema) con un 42.2% en volumen y 76.9%, de frecuencia; crustáceos (Penaeus sp y Callinectes sp) con un 12.1% en volumen y 53.8% de frecuencia; restos de peces no determinables con un 30% en volumen y 92.3% de frecuencia, y restos de materia orgánica animal no determinable con un 15.4% en volumen y 31% de frecuencia. Esta materia orgánica animal se encontraba en avanzado estado de digestión y probablemente su origen son peces y crustáceos. En Tecomate el espectro trófico indica que se alimentan de peces con un 65% en volumen y 80% de frecuencia crustáceos con un 8% en volumen y 50% de frecuencia; moluscos (Mytella strigata) con un 12% de volumen y 25% de frecuencia; restos de materia orgánica animal no determinable con un 15% en volumen y 100% de frecuencia. En Chautengo el espectro trófico (Figs. 39 y 40) indica que el alimento se compone de peces (Gobionellus microdon, Diapterus sp, Anchovia macrolepidota, Mugil curema) con un 70% en volumen y 85% de frecuencia; crustáceos (Penaeus spp, Callinectes spp) con un 15% en volumen y 60% de frecuencia; moluscos (Mytella strigata) con un 15% en volumen y 28% de frecuencia. En Chautengo el espectro trófico (Figs. 39 y 40) indica que el alimento se compone de peces (Gobionellus microdon, Diapterus sp, Anchovia macrolepidota, Mugil curema) con un 70% en volumen y 85% de frecuencia; crustáceos (Penaeus spp, Callinectes spp) con un 15% en volumen y 60%, de frecuencia; moluscos (Mytella strigata) con un 15% en volumen y 28% de frecuencia. Estos resultados muestran que Lutjanus novemfasciatus también es un carnívoro, predominantemente consumidor de tercer orden, representando un papel ecológico similar a L. argentiventris en todas las lagunas que reciben marcada influencia marina durante el periodo 1. Estas dos especies son escasas o raras durante el periodo 2 y prácticamente desaparecen durante el periodo 3. Las tallas de los ejemplares examinados variaron entre 82 y 235 mm de longitud total con predominancia de estados sexuales II a IV. La especie alcanza la madurez sexual después de los 145 mm de longitud total. No existen estudios poblacionales sobre estas especies a diferencia de algunas especies del Golfo de México (i. e., Lutjanus synagris, L. griseus) sobre las cuales se han efectuado estudios de crecimiento y aspectos morfobiológicos particulares (Claro y Lapín, 1973; Bashirullah, 1975; Guerra-Campos y Bashirullah, 1975). Gerres cinereus (Walbaum)Esta especie se encuentra en ambas costas de América tropical y subtropical. Según Meek y Hildebrand (1925) se encuentra mejor representada en el Atlántico que en el Pacífico (?) . No obstante Reséndez (1974 y 1975) no la ha registrado entre la ictiofauna de lagunas costeras de la costa mexicana del Golfo. Tabb et al. (1962) Hoese y Jones (1963) han señalado que G. cinereus es una de las especies más importantes entre ambientes salobres del norte del Golfo de México. En el Pacífico de México se le reconoce como una de las especies económicamente importantes (Berdegué, 1954 y 1956; Ramírez-Hernández, 1965; Ramírez-Hernández y Arvizú, 1965; Ramírez-Hernández y Páez, 1965; Carranza 1969a, 1969b y 1969c; Carranza y Amezcua-Linares, 1971a y 1971b; Amezcua-Linares, 1972; Castro et al. 1974; Yáñez-Arancibia, 1974, 1975b) . Los últimos dos autores destacan la penetración de esta especie marina hacia los estuarios y lagunas costeras en México. Gerres cinereus no ha sido estudiada en ninguno de sus aspectos biológicos, a pesar de los numerosos trabajos que la señalan como una de las mojarras de mayores perspectivas como recurso pesquero. Otras especies de mojarras de los géneros Gerres, Eucinostomus, Diapterus y Eugerres (género también presente en el sistema lagunar de Guerrero) han sido estudiadas en otras latitudes por la importancia comercial que reviste la familia Gerridae en general. Randall (1967) discutió la alimentación de Eucinostomus argenteus y Gerres cinereus en el Caribe, encontrando una gran variedad de grupos tróficos en la alimentación de estos Gérridos (i. e., cangrejos, anfípodos, poliquetos, gasterópodos, bivalvos, camarones, tenaidáceos, copépodos, sipuncúlidos, estomatópodos, hemicordados, ofiuros y otros restos no identificados) esto es, al menos doce tipos diferentes de alimento. Prabhakara Rao (1968) ha estudiado la alimentación y hábitos alimenticios de Gerres oyena, G. filamentosus G. limbatus G. setifer y G. oblongus del Lago Pulicat, India. Antes que él Job (1940) estudió la alimentación de G. punctatus (= G. filamentosus) . A su vez Chacko (1949) estudió la alimentación y hábitos alimenticios de G. filamentosus, G. oyena y G. abbreviatus del Golfo de Mannar, India. Basheeruddin y Nagappan Nayar (1961) estudiaron los hábitos alimenticios de ejemplares juveniles de Gerres setifer y G. abbreviatus en las aguas costeras frente a Madras, Jhingran (1963) y Jhingran y Natarajan (1966) estudiaron la alimentación de G. setifer de lago Chilka, India. Todos esos estudios han coincidido en señalar la homogeneidad y lo variado de los grupos tróficos en la alimentación de las diferentes especies de la familia Gerridae. Prabhakara Rao (1968) en una discusión muy extensa ha encontrado que las cinco especies de Gerres estudiadas por él son comedoras del fondo con hábitos alimenticios casi idénticos, ingiriendo bivalvos, detritus, anfiópodos, poliquetos, gastrópodos, copépodos, crustáceos, decápodos, vegetales, etcétera; esto es, al menos nueve tipos diferentes de alimento. Los Juveniles de Gerres examinados por él, comían preferentemente copépodos y diatomeas, pero al estado adulto su alimentación es más variada incorporando otros grupos tróficos en su dieta. En estos estudios, Gerres cinereus ha sido una de las especies más representativas del sistema lagunar costero de Guerrero. Su importancia económica y ecológica es grande y por ello requeriría un estudio biológico particular en el futuro. Para el análisis del contenido estomacal fueron examinados 172 ejemplares de cinco lagunas: Salinas de Apozahualco (25 en el periodo 1, 8 en el periodo 2 y 10 en el periodo 3), Chautengo (18 en el periodo 1, 14 en el periodo 2 y 11 en el periodo 3), Nuxco (22 en el periodo 1, 15 en el periodo 2 y 6 en el periodo 3), Salinas de Cuajo (8 en el periodo 1 y 6 en el periodo 2), Potosí (16 en el periodo 1, 7 en el periodo 2 y 6 en el periodo 3). 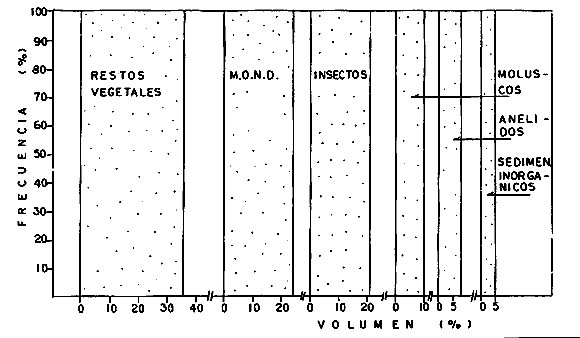 Fig. 41. Espectro trófico de volumen y frecuencia de Gerres cinereus en el sistema lagunar costero de Guerrero, durante el periodo 1. Salinas de Apozahualco (N=25). Septiembre de 1973 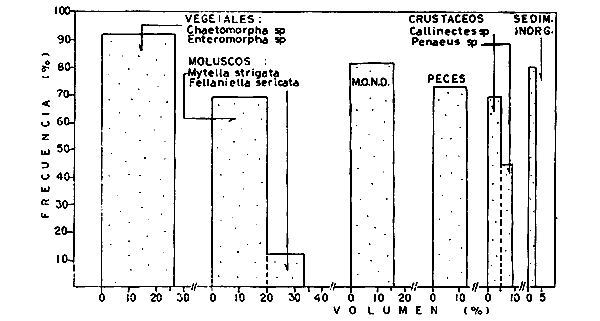 Fig. 42. Espectro trófico de volumen y frecuencia de Gerres cinereus en el sistema lagunar costero de Guerrero, durante el periodo 1. Chautengo (N=18). Septiembre de 1973 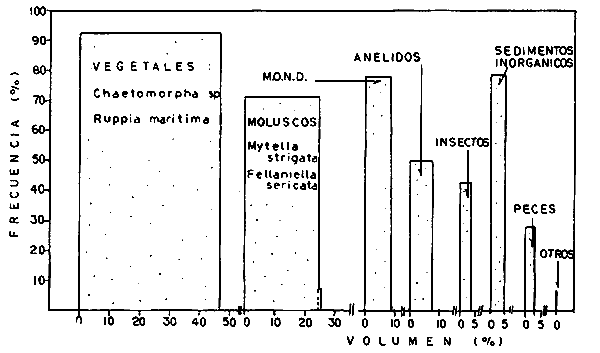 Fig. 43. Espectro trófico de volumen y frecuencia de Gerres cinereus en el sistema lagunar costero de Guerrero, durante el periodo 1. Nuxco (N=22). Septiembre de 1973 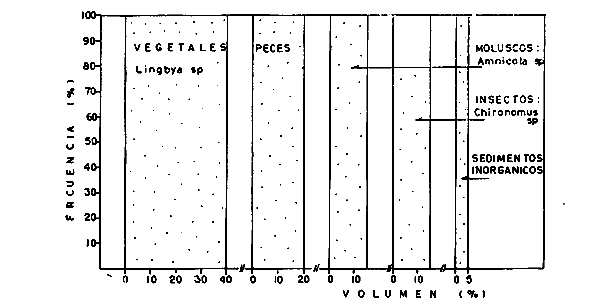 Fig. 44. Espectro trófico de volumen y frecuencia de Gerres cinereus en el sistema lagunar costero de Guerrero, durante el periodo 1. Salinas de Cuajo (N=08). Septiembre de 1973 En Salinas de Apozahualco el espectro trófico (Figs. 41 y 46) indica que durante el periodo 1 se alimentan de restos vegetales con un 36% en volumen y 100% de frecuencia; materia orgánica no determinable con un 24%, en volumen y 100%, de frecuencia; insectos (huevecillos, larvas y adultos de Chironomus sp) con un 21% en volumen y 100% de frecuencia; moluscos gasterópodos (Amnicola sp) con un 10%, en volumen y 100% de frecuencia; restos de poliquetos con un 8% en volumen y 100%, de frecuencia; sedinientos inorgánicos con un 5% en volumen y 100% de frecuencia. Todos los ejemplares examinados presentaban los grupos tróficos indicados. Durante el periodo 2 desaparecieron los insectos, los moluscos y los poliquetos del espectro trófico. Durante el Periodo 3 siguen ausentes los anélidos, pero aumentan significativamente los Chironomus y el microgastrópodo Amnicola. En Chautengo el espectro trófico (Figs. 42 y 46) señala que su alimento se compone de vegetales (Chatemorpha sp y Enteromorpha sp) con un 26.5% en volumen y 92% de frecuencia; moluscos (Mytella strigata, con un 20% en volumen y 69% de frecuencia, Fellaniella sericata con un 13.6% en volumen y 12.3%, de frecuencia); peces (Gobionellus sp y otros restos) con un 12.8% en volumen y 72.5% de frecuencia; crustáceos (Callinectes sp con un 5% en volumen y 69% de frecuencia, Penaeus sp juveniles con un 4.2% en volumen y 44.4% de frecuencia) ; materia orgánica no determinable con un 16%, en volumen 81.5% de frecuencia; sedimentos inorgánicos con un 2.5% en volumen y 80%, de frecuencia. Durante el Periodo 2 los mismos grupos tróficos se encuentran presentes en esta laguna, aún cuando no fueron analizados cuantitativamente. Durante el periodo 3 no fueron encontrados peces en el espectro trófico y tampoco crustáceos, pero aparecen algunos anélidos en la alimentación de Gerres cinereus. En este último periodo los moluscos fueron encontrados con un 25% en volumen y 80% de frecuencia; anélidos poliquetos con un 30% en volumen y 75% de frecuencia; materia orgánica no determinable con 40% en volumen y 80% de frecuencia, y vegetales con un 5% en volumen y 55% de frecuencia. En Nuxco, el espectro trófico (Figs, 43 y 46) indica que se alimentan de peces (huevecillos y otros restos) con un 3% en volumen y 28.6% de frecuencia; vegetales (Chaetomorpha sp y Ruppia maritima) con un 47.1% en volumen y 92.9%, de frecuencia; moluscos (Mytella strigata con un 24.8% en volumen y 71.4% de frecuencia, Fellaniella sericata con un 0.3% en volumen y 7.1% de frecuencia) ; materia orgánica no determinable con un 8.7% en volumen y 78.6% de frecuencia; restos de poliquetos con un 7.7% en volumen y 50% de frecuencia; sedimentos inorgánicos con un 5.1% en volumen y 78.6%, de frecuencia; foraminíferos (Amonnia becarii) con 0.1% en volumen y 7.1% de frecuencia; crustáceos balánidos con un 0.4% en volumen y 7.1%, de frecuencia. Durante el periodo 2 y el periodo 3 desaparecen los balánidos, los foraminíferos y Chaetomorpha del espectro trófico de Gerres cinereus. A su vez aumenta considerablemente el consumo de Ruppia y de insectos Chironomus especialmente larvas. Entre los peces que consume en el periodo 3 son más importantes los Poecílidos y los Góbidos. En Salinas del Cuajo, el espectro trófico, (Figs. 44 y 47) señala que se alimentan de peces (restos no determinables) con un 20% en volumen y 100%, de frecuencia; vegetales, (Lyngbya sp y otros restos no determinables) con un 40% en volumen y 100% de frecuencia; moluscos (Amnicola sp) con un 15% en volumen y 100% de frecuencia; insectos (huevecillos, larvas y adultos de Chironomus sp) con un 15,5% en volumen y 100% de frecuencia, y sedimentos inorgánicos con un 5% en volumen y 100% de frecuencia. Todos los ejemplares examinados presentaban los grupos tróficos señalados, Durante el periodo 2 resisten algunos pocos ejemplares de Gerres cinereus cuya alimentación se basa fundamentalmente en insectos, detritus y restos vegetales; los estres de salinidad determinan la muerte de la especie a fines de este periodo. En Potosí, el espectro trófico (Figs. 45 y 47) indica que se alimentan de peces (restos no determinables) con 12.4%, en volumen y 77.8% de frecuencia; crustáceos (Callinectes sp con un 1.2% en volumen y 44.4%, de frecuencia, Cardisoma crassum con un 2.7% en volumen y 22.2% de frecuencia, Penaeus sp con un 3% en volumen y 44.4% de frecuencia) ; moluscos (microgastrópodos Caecum sp con un 3% en volumen y 55.5% de frecuencia, Cerithium sp con un 1.9%, en volmen y 22.2% de frecuencia, Amnicola sp y Bittium sp con un 0.6% en volumen y 22.2%, de frecuencia, Natica sp con un 0.6% en volumen y 11. 1 % de frecuencia, bivalvos Tagelus sp con un 0.6% en volumen y 11. 1 % de frecuencia, Corbula sp con un 0.9% en volumen y 22.2% de frecuencia, Fellaniella sericata con un 2.3%, en volumen y 66.7% de frecuencia) ; materia orgánica no determinable con un 34.6% en volumen y 100%, de frecuencia; foraminíferos (Amonnia becarii) con un 1,8% en volumen y 88.9% de frecuencia; poliquetos con un 4% en volumen y 44.4% de frecuencia; anfipodos con un 1.9% en volumen y 44.4% de frecuencia; ostrácodos con un 1.2% en volumen y 33.3% de frecuencia; briozoos con un 0.05% en volumen y 11. 10/, de frecuencia; insectos (huevecillos y larvas de Chironomus sp) con un 5.1 % en volumen y 56.6%, de frecuencia; vegetales (Caulerpa sp y otros restos) con un 8.1 % en volumen y 77.8% de frecuencia, sedimentos inorgánicos con un 9% en volumen y 88.9% de frecuencia. Durante el periodo 2 y 3 los estómagos de Gerres cinereus fueron analizados sólo cualitativamente encontrándose que los moluscos desaparecen del espectro trófico y aumenta considerablemente el consumo de poliquetos e insectos; también desaparecen los anfipodos, ostrácodos y briozoos. La predación se concentra sobre pequeños Góbidos y Poecílidos y jaibas Callinectes que se encuentran mudando. 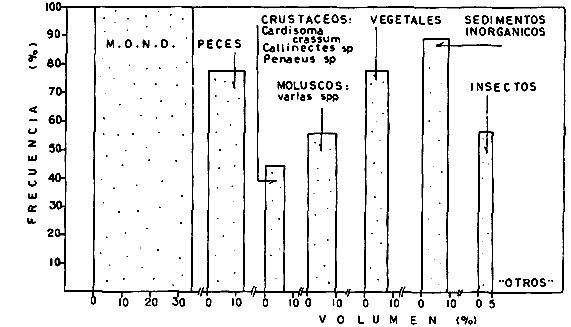 Fig. 45. Espectro trófico de volumen y frecuencia de Gerres cinereus en el sistema lagunar costero de Guerrero, durante el periodo 1. Potosí (N=16). Septiembre de 1973 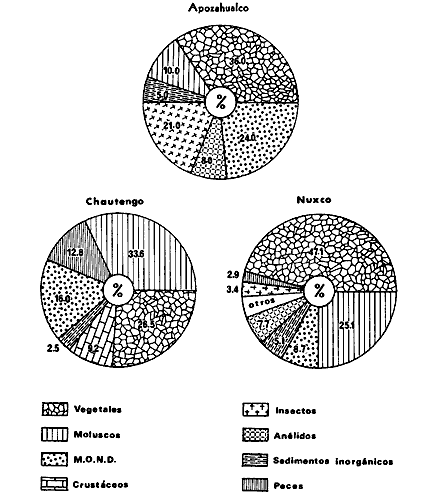 Fig. 46. Espectro trófico volumétrico de Gerres cinereus en el sistema lagunar costero de Guerrero, durante el periodo 1. Salinas de Apozahualco (N=25), Chautengo (N=18), Nuxco (N=22). 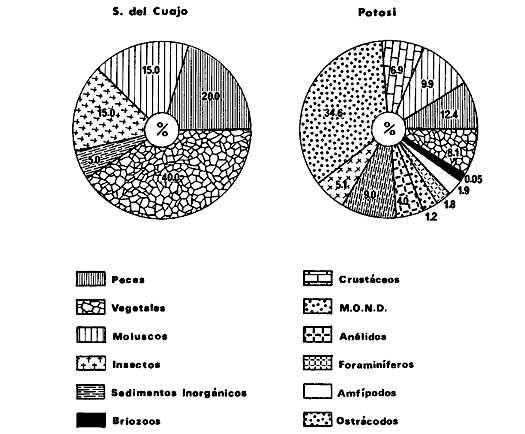 Fig. 47. Espectro trófico volumétrico de Gerres cinereus en el sistema lagunar costero de Guerrero, durante el periodo 1. Salinas de Cuajo (N=08), Potosí (N=16). Es interesante la ingestión de sedimentos inorgánicos en todas las lagunas consideradas, aún cuando no muy abundantes en volumen. Darnell (1967b) ha demostrado que el detritus puede presentarse mezclado con sedimentos inorgánicos y este a su vez asociado con microfauna y flora, que puede ser el material aprovechado por la especie que lo consume. Por los resultados encontrados puede decirse que Gerres cinereus es una especie predomicarnívora consumidor de primer y/o segundo orden. En el sistema lagunar costero de Guerero se alimenta de vegetales, peces, moluscos, crustáceos, insectos, anélidos, ostrácodos, copépodos, foraminíferos, anfípodos, briozoos y sedimentos inorgánicos. Estos grupos tróficos son más o menos frecuentes de acuerdo a las difrentes lagunas y sus variaciones de salinidades. En los ejemplares juveniles los grupos tróficos predominantes fueron vegetales, copépodos, insectos ostrácodos, pequeños moluscos y materia orgánica no determinable. Conforme crece la especie la alimentación se hace más variada y prenantemente omnívora y circunstancialmente de pequeños organismos. Las tallas de los ejemplares examinados variaron entre 61 y 185 mm de longitud total, con predominancia de ejemplares en fases de desarrollo gonádico II - III. La especie alcanza la madurez sexual después de los 145 mm de longitud total. Existe un marcado incremento en peso con el desarrollo gonádico y el tamaño del pez. Pero en general son raros los ejemplares sexualmente maduros dentro de las lagunas de Guerrero. Cuando se abren las barras de las lagunas esta especie penetra masivamente, al estado juvenil, para completar parte de su desarrollo, alimentarse y crecer. En las lagunas que reciben marcada influencia marina durante el periodo 1 la especie representa uno de los principales recursos pesqueros. De acuerdo a Mc Hugh (1967), Yáñez-Arancibia (1975a, 1976b y 1976c) y Yáñez-Arancibia y Nugent (1977) correspondería a una especie marina que visita cíclicamente los estuarios para completar parte de las primeras etapas de su desarrollo (Fig. 7). Eugerres lineatus (Humboldt)Es otra de las mojarras de gran importancia comercial especialmente en las lagunas de Chautengo y Nuxco pero también es abundante en otras lagunas. Se le pesca con frecuencia durante el periodo 1 en forma generalizada en el sistema lagunar costero de Guerrero, pero en Chautengo y Nuxco los pescadores la capturan prácticamente todo el año. Su importancia en la costa de Guerrero también ha sido señalada por Ramírez-Hernández (1965) y posteriormente por Ramírez-Hernández y Páez (1965) No obstante, no se han efectuado estudios biológicos de esta especies sobre ninguno de sus aspectos. En la costa del Golfo de México se presenta una especie homóloga que es Eugerres (= Diapterus) plumieri. Springer y Woodburn (1960), Darnell (1962) , Reséndez (1974 y 1975) han señalado que es una especie eurihalina que penetra a las lagunas costeras del Golfo y reviste importancia comercial. Springer y Woodburn (1960), en un rápido examen del contenido estomacal de Eugerres (= D.) plumieri encontraron poliquetos, ostrácodos y copépodos. Harrington y Harrington (1961) estudiaron la alimentación de los juveniles de esa especie encontrando un 86% en volumen de copépodos y 9% de insectos. Cervigón (1966) ha señalado que Diapterus rhombeus una especie simpátrica y muy afín con Eugerres (= D.) plumieri, come algas, Thalassia, esponjas, poliquetos, bivalvos y crustáceos (ostrácodos y copépodos). W. E. Odum (1971) y W. E. Odum y Heald (1972) no encontraron ninguna diferencia en la alimentación de Eugerres (=D.) plumieri entre juveniles y adultos. En 12 estómagos analizados determinaron volumétricamente un 44% de misidáceos, 36%, de anfípodos, 6%, de Chironomus sp, 4%, de copépodos harpacticóides, 4% de detritus vegetal, 3% de ostrácodos y 3% de pequeños bivalvos. En estos estudios fueron examinados 96 ejemplares de Eugerres lineatus, solamente de las lagunas Chautengo y Nuxco donde representa un recurso económico trascendental. En Chautengo, el espectro trófico durante el periodo 1, para 20 ejemplares examinados (Figs. 48 y 50), indica que la especie se alimenta de peces (Góbidos y Engráulidos) con un 16% en volumen y 60% de frecuencia; moluscos (restos de bivalvos) con un 40% en volumen y 75% de frecuencia; materia orgánica no determinable con un 18.5% en volumen y 100% de frecuencia; crustáceos (Callinectes sp y Penaeus sp) con un 5%, en volumen y 75% de frecuencia; vegetales (Chaetomorpha sp y Enteromorpha sp) con un 17% en volumen y 100% de frecuencia; sedimentos inorgánicos con un 3.5% en volumen y 90% de frecuencia. Durante el periodo 2 el espectro trófico para 10 ejemplares examinados indica que se alimentan de peces (Góbidos, Eleótridos, Engráulidos) con un 20% en volumen y 60% de frecuencia; moluscos (restos de Mytella strigata) con un 36% en volumen y 75% de frecuencia; materia orgánica no determinable además de detritus con un 30%, en volumen y 100% de frecuencia; vegetales (Chaetomorpha sp y Enteromorpha sp) con un 6% en volumen y 25% de frecuencia; copépodos con un 2% en volumen y 50% de frecuencia; decápodos (restos de Penaeus sp) con un 3%, en volumen y 60% de frecuencia; sedimentos inorgánicos con un 3% en volumen y 75% de frecuencia. Durante el periodo 3 fueron examinados 16 ejemplares y la alimentación estuvo compuesta por peces (Góbidos, Poecílidos, Aterínidos y Clupéidos de pequeños tamaños) con un 35% de volumen y 80% de frecuencia; crustáceos decápodos (Callinectes sp) con un 5% en volumen y 45% de frecuencia; moluscos (restos de Mytella strigata) con un 87, en volumen y 50% de frecuencia; materia orgánica no determinable además de detritus con un 25% en volumen y 75% de frecuencia; vegetales (Chaetomorpha sp y principalmente Ruppia maritima) con un 18% en volumen y 80% de frecuencia; insectos (Chironomus sp) con un 8% en volumen y 90% de frecuencia; sedimentos inorgánicos con 1% en volumen y 25% de frecuencia. 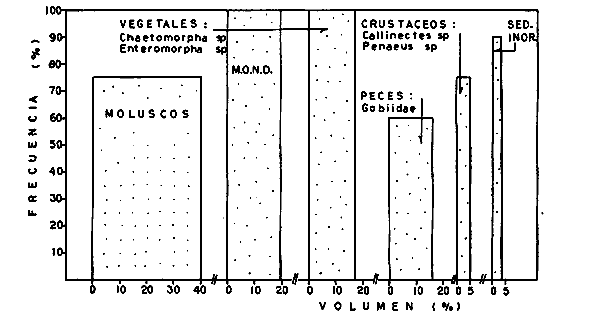 Fig. 48. Espectro trófico de volumen y frecuencia de Eugerres lineatus en el sistema lagunar costero de Guerrero, durante el periodo 1. Chautengo (N=20). Septiembre de 1973 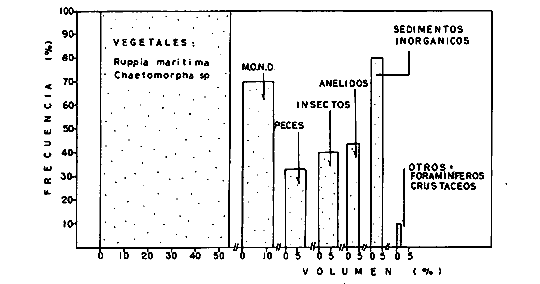 Fig. 49. Espectro trófico de volumen y frecuencia de Eugerres lineatus en el sistema lagunar costero de Guerrero, durante el periodo 1. Nuxco (N=30). Septiembre de 1973 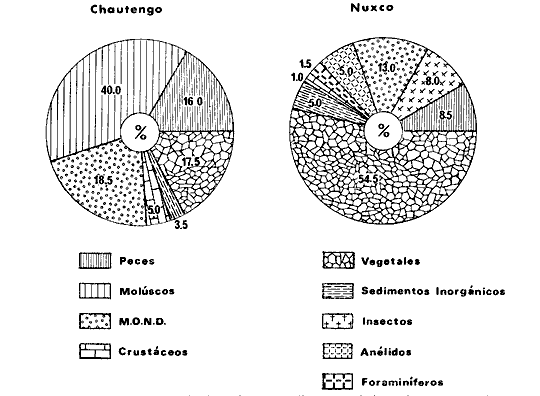 Fig. 50. Espectro trófico volumétrico de Eugerres lineatus en el sistema lagunar costero de Guerrero, durante el periodo 1. Chautengo (N=20), Nuxco (N=30). En Nuxco, el espectro trófico durante el periodo 1, para 30 ejemplares examinados (Figs. 49 y 50) , señala que la especie se alimenta de peces (huevecillos, restos y pequenos Góbidos y Engráulidos) con un 8.5%, en volumen y 33.5% de frecuencia; vegetales (Ruppia maritima y algas filamentosas Chaetomorpha sp) con un 54.5% en volumen y 100% de frecuencia; materia orgánica no determinable además de detritus con un 13% en volumen y 70% de frecuencia; anélidos poliquetos (Nereidae y Serpulidae) con un 5% en volumen y 43.8% de frecuencia; sedimentos inorgánicos con un 5% en volumen y 80% de frecuencia; insectos (huevecillos y restos de Chironomus sp) con un 8%, en volumen y 40% de frecuencia; foraminíferos (Amonnia becarii) con un 1.5% en volumen y 10% de frecuencia; crustáceos balánidos con un 1% en volumen y 10% de frecuencia. Durante el periodo 2 fueron examinados 10 ejemplares encontrándose que el alimento se compone de pequeños peces no identificados con un 30% en volumen y 80% de frecuencia; moluscos (restos de Mytella strigata) con un 12%, en volumen y 75% de frecuencia; materia orgánica no determinable además de detritus con un 28% de volumen y 90% de frecuencia; vegetales (Chaetomorpha sp, Enteromorpha sp y especialmente Ruppia maritima) con un 18% en volumen y 75% de frecuencia; sedimentos inorgánicos con un 3% en volumen y 25% de frecuencia; anélidos poliquetos (Nereidae y Serpulidae) con un 5% en volumen y 25% de frecuencia; insectos (restos) con un 3.5% en volumen y 50% de frecuencia. Durante el periodo 3 fueron examinados 10 ejemplares pero sólo cualitativamente; el alimento estaba compuesto por pequeños peces, restos de moluscos, restos de insectos, restos de crustáceos y ostrácodos significativamente importantes; restos de Ruppia sedimentos inorgánicos, materia orgánica no determinable y detritus, copépodos del género Cyclops, y sedimentos inorgánicos. En consecuencia se puede precisar que Eugerres lineatus es una especie consumidora de primer orden predominantemente omnívora. En el sistema lagunar costero de Guerrero su alimento está constituido por vegetales, pequeños moluscos, peces y crustáceos, poliquetos, insectos, detritus, ostrácodos, copépodos, foraminíferos y sedimentos inorgánicos. Desde el punto de vista ecológico reviste trasrendencia el pastoreo que realiza sobre algunos vegetales específicos, situación que ha sido anteriormente estudiada en otros peces por Randall (1965) y W. E. Odum. (1970). Las tallas de los ejemplares examinados variaron entre 134 y 187 mm de longitud total con predominancia de estados sexuales III y IV. La especie alcanza la madurez sexual después de los 145 mm de longitud total. De acuerdo con Mc Hugh (1967), Yáñez-Arancibia (1975a, 1976b y 1976c) y Yáñez-Arancibia y Nugent (1977) esta especie correspondería a una especie marina eurihalina que penetra las lagunas y estuarios, generalmente al estado adulto y para alimentarse. Al cerrarse las barreras en las lagunas de Guerrero puede quedar atrapada y alcanzar grandes tallas, pero solamente en las lagunas Chautengo y Nuxco resisten durante el periodo 2 y hasta el periodo 3. En las otras lagunas casi desaparecen en el periodo 2 y son escasos o raros durante el periodo 3. 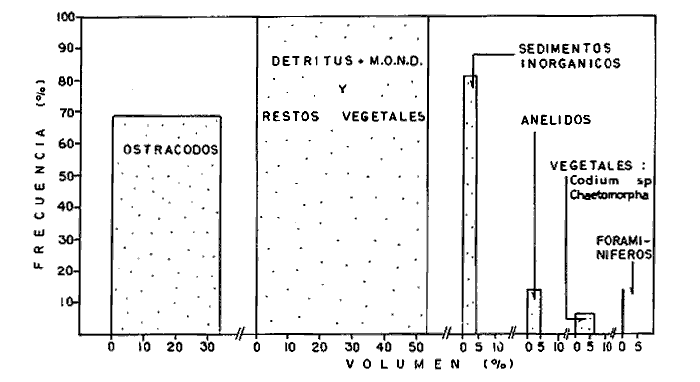 Fig. 51. Espectro trófico de volumen y frecuencia de Diapterus peruvianus en el sistema lagunar costero de Guerrero, durante el periodo 1. Salinas de Apozahualco (N=32). Septiembre de 1973 Diapterus peruvianus (Cuvier y Valenciennes)Es otra de las mojarras más importantes en la economía pesquera del sistema lagunar costero de Guerrero. Ramírez-Hernández (1965), Ramírez-Hernández y Arvizú (1965) y Ramírez-Hernández y Páez (1965) consideran a Diapterus peruvianus entre las mojarras importantes de la parte central y norte del Pacífico mexicano. Apreciaciones preliminares de Yáñez-Arancibia (1974 y 1975b) consideran la abundancia de D. peruvianus en las lagunas de Guerrero y la calidad de su carne, agregando además que sus hábitos son preferentemente carnívoros predando pequeños organismos. En estos estudios fueron examinados 124 ejemplares de Diapterus peruvianus. En la laguna Salinas de Apozahualco, 32 durante el periodo 1, y 20 durante el periodo 2. En Chautengo, 40 durante el periodo 1, 20 durante el periodo 2 y 12 durante el periodo 3. En Salinas de Apozahualco, durante el periodo 1, el espectro trófico (Figs. 51 y 53) señala que el alimento se compone de ostrácodos con un 33.2% en volumen y 68.8%, de frecuencia; detritus y materia orgánica no determinable con un 53.1% en volumen y 100%, de frecuencia; restos de poliquetos (Nereidae, Serpulidae y Arenicolidae) con un 3.8% en volumen y 18.8% de frecuencia; vegetales (Codium sp, Chaetomorpha sp) con un 5.6% en volumen y 6.3% de frecuencia; foraminíferos (Amonnia becarii) con un 0.4% en volumen y 18.8%, de frecuencia; sedimentos inorgánicos con un 3.8% en volumen y 81.3% de frecuencia. Durante el periodo 2 la alimentación se compuso de pequeños peces no determinados con un 15%, en volumen y 75% de frecuencia; detritus y materia orgánica con un 11% en volumen y 75%, de frecuencia; ostrácodos con un 8%, en volumen y 80% de frecuencia; restos de moluscos bivalvos con un 15% en volumen y 80% de frecuencia; crustáceos (pequeños Callinectes sp) con un 38% en volumen y 100% de frecuencia; sedimentos inorgánicos con un 7% en volumen y 25% de frecuencia; insectos con un 57, en volumen y 50% de frecuencia. 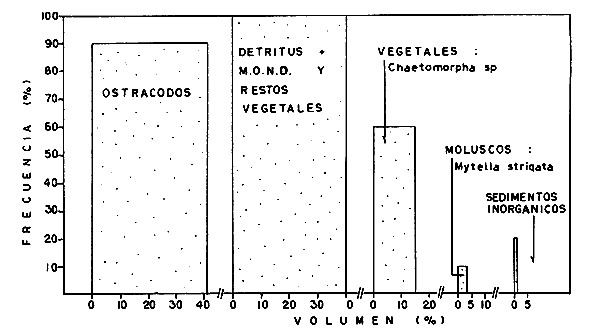 Fig. 52. Espectro trófico de volumen y frecuencia de Diapterus peruvianus en el sistema lagunar costero de Guerrero, durante el periodo 1. Chautengo (N=40). Septiembre de 1973 En Chautengo, durante el periodo 1, el espectro trófico (Figs. 52 y 53) señala que la alimentación estuvo compuesta de ostrácodos con un 41% en volumen y 90% de frecuencia detritus y materia orgánica no determinable con un 40.5% en volumen y 100% de frecuencia; moluscos (Mylella strigata) con un 3% en volumen y 10% de frecuencia; sedimentos inorgánicos con un 1% en volumen y 20% de frecuencia; vegetales (Chaetomorpha sp) con un 14.5% en volumen y 60% de frecuencia. Durante el periodo 2 se encontraron ostrácodos con un 30% en volumen y 75% de frecuencia; detritus y materia orgánica con un 9% en volumen y 50%, de frecuencia; moluscos (restos de bivalvos) con un 10%, en volumen y 80% de frecuencia; crustáceos (Penaeus sp, Callinectes sp, de pequeños tamaños) con un 20% en volumen y 75% de frecuencia; anélidos poliquetos (Nereidae y Arenicolidae) con un 17% en volumen y 60% de frecuencia; restos de vegetales con un 2% en volumen y 25% de frecuencia; sedimentos inorgánicos con un 2% en volumen y 50%, de frecuencia; copépodos con un 3% en volumen y 25% de frecuencia restos de peces con un 6% en volumen y 70% de frecuencia. Durante el periodo 3 el alimento se compuso principalmente de copépodos (Cyclops sp) con un 60% en volumen y 80% de frecuencia; restos de poliquetos con un 8% en volumen y 75% de frecuencia; ostrácodos con un 17% en volumen y 90 de frecuencia; sedimentos inorgánicos con un 3% en volumen y 50% de frecuencia; vegetales (Ruppia maritima, Enteromorpha sp) con un 4% en volumen y 25% de frecuencia; restos de peces con un 8% en volumen y 50% de frecuencia. 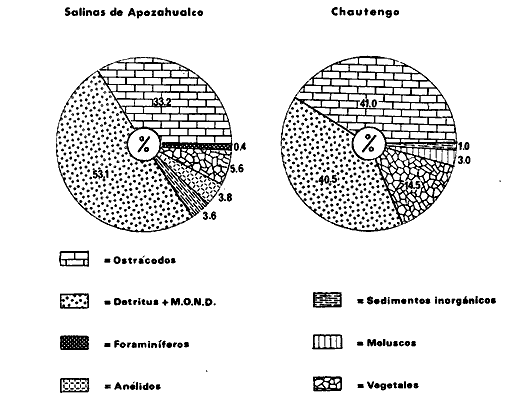 Fig. 53. Espectro trófico volumétrico de Diapterus peruvianus en el sistema lagunar costero de Guerrero, durante el periodo 1. Salinas de Apozahualco (N=32), Chautengo (N=40) Estos resultados indican que Diapterus peruvianus se comporta preferentemente como un carnívoro de primer y segundo orden, predando sobre ostrácodos, copépodos, moluscos, poliquetos, peces, foraminíferos, decápodos y comiendo con poca significación cuantitativa algunos vegetales, detritus y sedimentos inorgánicos. W.E. Odum (1971) y W.E Odum y Heald (1972) han estudiado, además, la alimentación de Eucinostomus argenteus y E. gula. De sus estudios se desprende que son carnívoros de primer orden. Brook (1975) también tiene resultados parecidos para las mismas especies. En las lagunas costeras de Guerrero existen tres especies deEucinostomus (i.e., currani, dowii, entomelas) y su comportamiento trófico es similar a las especies de Gerres, Eugerres y Diapterus. Las tallas de los ejemplares examinados variaron entre 28 y 128 mm de longitud total con predominancia de ejemplares en fases sexuales I-II por debajo de los 110 mm. La especie alcanza la madurez sexual después de los 120 mm de longitud total. De acuerdo con Mc Hugh (1967), Yáñez-Arancibia (1975a, 19761) y 1976c) y Yáñez-Arancibia y Nugent (1977), correspondería a una especie marina que penetra cíclicamente a las lagunas costeras y estuarios, a completar parte de su desarrollo, alimentándose y creciendo (Fig. 7). Durante el periodo 1 son muy abundantes en todas las lagunas de Guerrero. Sin embargo, el recurso es explotado principalmente sobre poblaciones sexualmente inmaduras Mugil curema ValenciennesEn particular la alimentación y hábitos alimenticios de una especie simpátrica y muy afín, Mugil cephalus, ha sido estudiada ampliamente por Hiatt (1947a), Eguza (1950), Darnell (1958, 1961 y 1962), Suzuki (1965) W.E. Odum (1966, 1968a, 1968b, 1970, 1971), W.E. Odum y Heald (1972 y 1975) . De acuerdo con los trabajos citados esta especie se alimenta fundamentalmente de la capa superficial del fondo seleccionando partículas finas, incluyendo diatomeas bentónicas, algas filamentosas, detritus de origen vegetal, y sedimentos inorgánicos. El contenido incluiría aproximadamente un 46% de sedimentos inorgánicos, 40% de partículas finas de detritus proprovienentes de restos vegetales y 14% microalgas vivientes (W.E Odum y Heald, 1972). Thompson (1951 y 1954) ha estudiado la alimentación de Mugil dobula encontrando detritus, diatomeas, algas filamentosas y micromoluscos. Pillay (1953) ha estudiado la alimentación de Mugil tade con resultados relativamente similares a los obtenidos por Albertine (1973) sobre la alimentación de Mugil auratus M. capito y M. saliens. Albertine (1973) ha encontrado que los juveniles de 15 a 50 mm de longitud patrón son micrófagos carnívoros comiendo, principalmente crustáceos, mientras que los de tallas entre 50 y 65 mm son micrófagos herbívoros comiendo diatomeas bentónicas y otras microalgas. Bardach et al. (1972) señalan que Mugil corbula de la India, Pakistán y Burma prefiere copépodos y pequeños insectos y que los adultos de todas las especies del género son comedoras del fondo. Jacot (1920) ha señalado que Mugil curema tiene hábitos similares a M. cephalus y los pequeños los juveniles no comen crustáceos como en otras especies del género, sino que sus estómagos se encuentran llenos de fango obscuro y materia orgánica. Eberling (1957) ha indicado que estas especies consumen diatomeas y algas filamentosas. Carranza (1969c y 1970) encontró que en los estómagos de Mugil en general se encuentra lodo con materia orgánica y detritus revueltos, y a veces restos vegetales. Schroeder (1924) indica que Mugil curema remueve el fatigo buscando su alimento. Hildebrand y Schroeder (1928) agregan que comen pequeños organismos, y Pearse (1932) afirma que se alimentan del fango del fondo. Randall (1967) encontró solamente vegetales en la dicta alimenticia del Mugil curema. Yáñez-Arancibia (1975b y 1976) ha hecho un extenso estudio de Mugil curema en relación a su alimentación, crecimiento, madurez y relaciones ecológicas generales, examinando 1 285 ejemplares en un ciclo anual, de los cuales 501 de ellos fueron examinados para el estudio de la alimentación. Eso determina que en este trabajo sólo se destaque lo más trascedente de M. cureme. En relación a su espectro trófico (Figs. 54, 55 y 56). Estos resultados permiten concluir que Mugil curema en el sistema lagunar costero de Guerrero se alimenta preferentemente de detritus, sedimentos inorgánicos finos (a cuyas partículas vive asociada micro fauna y flora) y algas filamentosas. Como alimento variable circunstancial puede aprovechar además ostrácodos, nemátodos, foraminíferos, microgastrópodos, anélidos, isópodos, fragmentos de vegetales y diatomeas bentónicas. En consecuencia es una especie consumidora primaria preferentemente detritívora vegetal. Este tipo de alimentación presenta un patrón relativamente definido y constante que sin embargo puede sufrir ligeras variaciones de acuerdo a la zona o lugar, la época del año (periodos ecológicos) y la disponibilidad del alimento. Mugil curema penetra a las lagunas al inicio del periodo 1 en grades cardúmenes de pequeños juveniles entre 50 y 70 mm de longitud total promedio. Permanecen en el sistema lagunar durante los tres períodos ecológicos debido a su gran capacidad euriterma y eurihalina. Un año más tarde tiene tallas de 230 mm de longitud promedio y un desarrollo gonádico en avanzado estado de maduración (preferente estado III). Al abrirse nuevamente las batas en el nuevo periodo 1 estos cardúmenes abandonan las lagunas adentrándose en el mar para desovar en los próximos 4 a 6 meses (Fig. 7). Nuevamente el sistema lagunar es invadido por grandes cardúmenes de pequeños ejemplares que corresponden al producto del desove del año anterior. Durante el periodo 1 el incremento en peso es muy marcado y el crecimiento en longitud. muy marcado; durante el periodo 2 este ritmo disminuye y nuevamente se intensifica durante el periodo 3. El ritmo de crecimiento es aproximadamente de 130 mm para el primer año y 100 mm para el segundo año de vida, promedio. Los ejemplares juveniles que penetran al sistema lagunar durante el periodo 1 tienen entre 6 y 8 meses de edad y abandonan el sistema lagunar cuando tienen entre 18 y 20 meses de edad. Durante el periodo 1 los ejemplares se encuentran en fases gonádicas I-II; durante el periodo 2 prevalecen las fases gonádicas II-III, y durante el periodo 3 son frecuentes los ejemplares en fases gonádicas III-IV 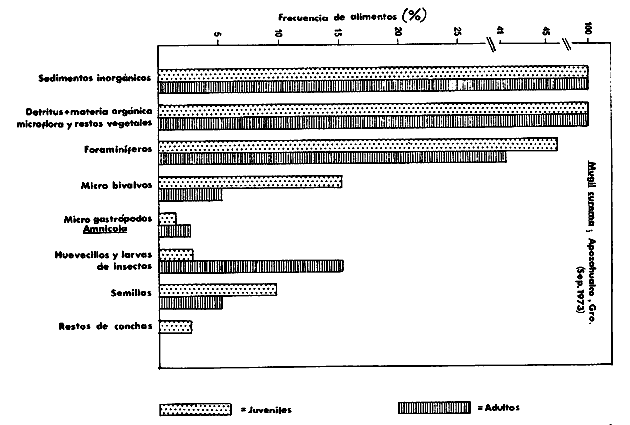 Fig. 54. Espectro trófico de volumen y frecuencia de Mugil curema en el sistema lagunar costero de Guerrero, durante el periodo 1. Salinas de Apozahualco (N=111). 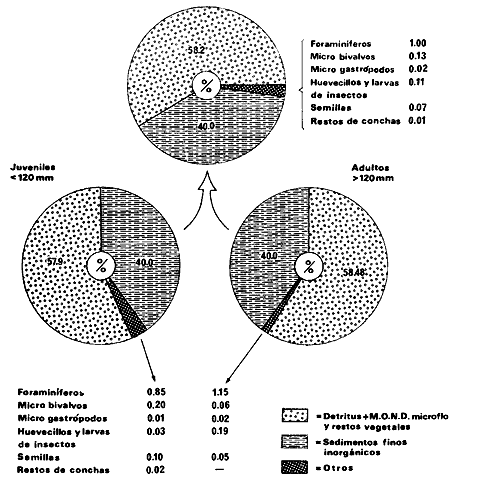 Fig. 55. Espectro trófico volumétrico de Mugil curema en el sistema lagunar costero de Guerrero, durante el periodo 1. Salinas de Apozahualco (N=111). Septiembre de 1973 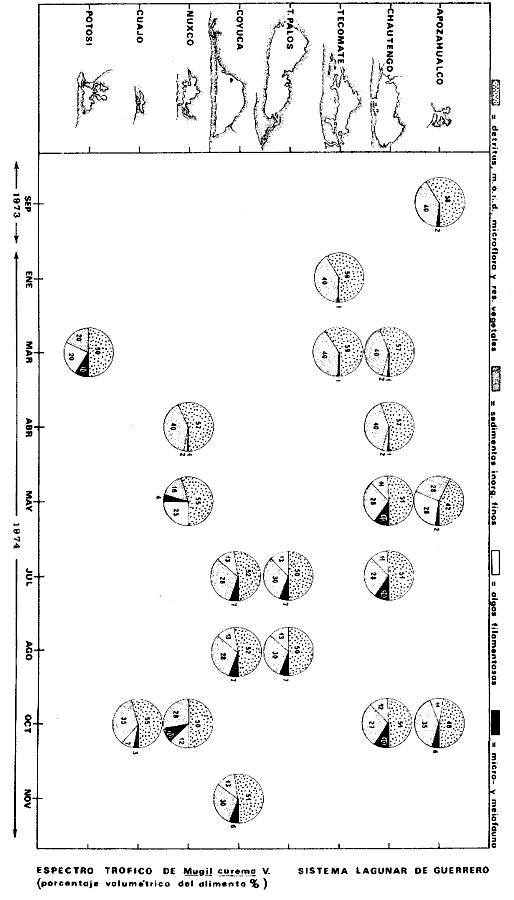 Fig. 56. Espectro trófico volumétrico de Mugil curema en el sistema lagunar costero de Guerrero en un ciclo natural (N=501). Se aprecian ligeros cambios en relación a los periodos ecológicos de las lagunas. Las perspectivas de semicultivos de Mugil curema parecerían tener mejores resultados en las lagunas Tres Palos, Coyuca y Mitla, considerando el amplio rango de tolerancia de las lisas a las bajas salinidades. Estas lagunas son grandes cuerpos de aguas casi dulces, con bastante disponibilidad de alimento y ausencia casi absoluta de peces predadores de segundo y tercer orden. Sus variaciones anuales no son marcadas. La especie sirve de alimento a otros peces, aves acuáticas y al hombre teniendo un importantísimo papel ecológico por la conversión de la energía potencial del detritus, en energía aprovechable por otros niveles tróficos. Cichlasoma trimaculatum (Günther)Es una de las especies con distribución más amplia en el sistema lagunar costero de Guerrero y caracteriza, en mayor o menor grado, la ictiofauna del área. Su abundancia es estimable y su carne apreciada, por lo que representa un recurso económico importante. En México existen dos géneros indígenas de Cíclidos: Petenia y Cichlasoma. Este último presenta el mayor número de especies dulceacuícolas mexicanas (Álvarez, 1970). Sin embargo, no se han efectuado estudios biológicos exhaustivos en ninguna especie de Cíclidos mexicanos, con excepción del trabajo de Darnell (1962) y algunos estudios para especies introducidas (Signoret, 1974). Estudiando los trabajos de Álvarez y Cortez (1962), Álvarez (1970), Carranza y Amezcua-Linares (1971a y 1971b), Toral y Reséndez (1973), Amezcua-Linares (1972), Reséndez (1974 y 1975), Yáñez-Arancibia (1974), se puede apreciar que existe una gradación en el aumento del número de especies de Cíclidos hacia el sureste de México y Centro América. Cichlasoma trimaculatum es la única especie indígena de Cíclido presente en las lagunas costeras de Guerrero pero es considerablemente abundante representando un importante recurso pesquero del área.  Fig. 57. Espectro trófico volumétrico de Cichlasoma trimaculatum en el sistema lagunar costero de Guerrero, durante el periodo 1. Chautengo (N=24). Septiembre de 1973 Darnell (1962) ha encontrado en algunos sistemas lagunares del Golfo, que dos especies de Cíclidos presentan un patrón de alimentación bastante definido y selectivo, son: Cichlasoma cyanoguttatum y C. steindachneri. La primera de ellas es una especie omnívora que se alimenta en un 25% de vegetales (Chara sp, Lyngbya sp. Oscillatoria sp, Hyalotheca sp, Mougeotia sp, Rhizoclonium sp, Spirogyra sp, Ulotrix sp, Pinnularia sp y otros) , 5%, de pequeños invertebrados (coleópteros, dípteros, cladóceros) y alrededor de un 70% de detritus y algo de sedimentos inorgánicos. Por el contrario, la segunda especie es predominantemente carnívora ya que se alimenta de un 20% de moluscos (Cochliopa sp, Ferrisia sp y Pachychilus spp) 45% de insectos acuáticos (coleópteros, dípteros, efemerópteros, neurópteros, odonatos, tricópteros y otros), 3% de otros invertebrados, 6% de peces (huevecillos, larvas y juveniles) y sólo un 5%, de algas filamentosas (Lyngbya sp, Gleotrichia sp, Spirogyra sp). El es detritus y mezclas. Darnell (1962) hace una extensa discusión de estas especies y sus hábitos alimenticios. En estos estudios fueron examinados 131 ejemplares. En Chautengo 24 ejemplares durante el periodo 1, 12 ejemplares durante el periodo 3. En Mitla 12 ejemplares durante el periodo 1, 12 durante el periodo 2 y 35 durante el periodo 3. En Nuxco 24 ejemplares durante el periodo 1 y 12 ejemplares durante el periodo 3. 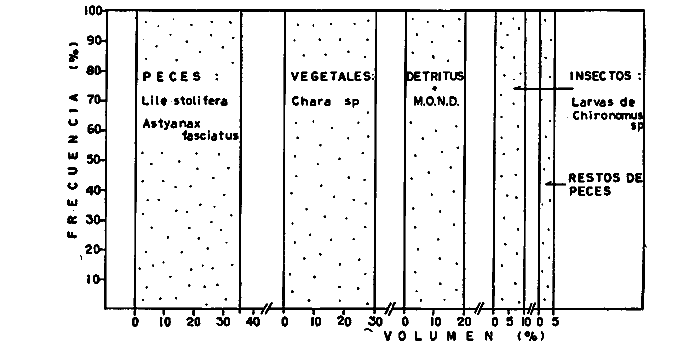 Fig. 58. Espectro trófico de volumen y frecuencia de Cichlasoma trimaculatum en el sistema lagunar costero de Guerrero, durante el periodo 1. Mitla (N=12). Septiembre de 1973 En Chautengo el espectro trófico (Figs. 57 y 60) señala que durante el periodo 1, la especie se alimenta de peces (restos) con un 10% en volumen y 100% de frecuencia; detritus y materia orgánica no determinable con un 20% en volumen y 100% de frecuencia; moluscos (Mytella strigata) con un 357, en volumen y 100% de frecuencia; restos vegetales con un 35% en volumen y 100% de frecuencia. Durante el periodo 3 la alimentación se compuso de peces (Lile stolifera, Thyrinops crystallina) con un 35% en volumen y 80% de frecuencia; detritus y materia orgánica con un 30% en volumen y 100% de frecuencia; moluscos (Mytella strigata) con un 10% en volumen y 100% de frecuencia; insectos (Chironomus sp) con un 15% en volumen y 80% de frecuencia; restos vegetales con un 10% en volumen y 100% de frecuencia. En Mitla el espectro trófico (Figs. 58 y 60) señala que durante el periodo 1 la alimentación se compone de peces (Lile stolifera, Astyanax fasciatus) con un 35%, en volumen y 100%, de frecuencia; detritus y materia orgánica no determinable con un 20% en volumen y 100% de frecuencia; restos de peces no identificados con un 5% en volumen y 100% de frecuencia; insectos (Chironomus sp, hemípteros no identificados) con un 10% en volumen y 100% de frecuencia; restos de vegetales (Chara sp) con un 30% en volumen y 100% de frecuencia. Durante el periodo 2 la alimenta ción se compone de peces (Lile stolifera, Astyanax fasciatus, Thyrinops crystallina) con un 40% en volumen y 80% de frecuencia; restos de peces no identificados con un 5% en volumen y 100% de frecuencia; detritus y materia orgánica no determinable con un 15% en volumen y 100%, de frecuencia; insectos (dípteros y hemípteros) con un 15% en volumen y 80% de frecuencia; restos de vegetales con un 25%, en volumen y 90% de frecuencia. Durante el periodo 3 el alimento se compuso de peces (Lile stolifera, Astyanax fasciatus, Thyrinops crystallina, Poecilia sphenops, Poeciliopsis balsas, Poeciliopsis porosus) con un 55% en volumen y 100% de frecuencia; detritus y otra materia orgánica con un 15% en volumen y 80% de frecuencia insectos (huevecillos, larvas y adultos de Chironomus sp) con un 25% en volumen y 100% de frecuencia; restos vegetales con un 5% en volumen y 60% de frecuencia. En Nuxco, el espectro trófico (Figs. 59 y 60) señala que el alimento se compone de peces (Lile stolifera, Mugil curema, Anchoa sp) con un 30% en volumen y 100% de frecuencia; otros restos de peces con un 2% en volumen y 100% de frecuencia; detritus y materia orgánica no determinable con un 30% en volumen y 100% de frecuencia; restos vegetales (Ruppia maritima, Chaetomorpha sp) con un 38% en volumen y 100% de frecuencia. Durante el periodo 3 el espectro trófico señala que el alimento se compone de peces (Lile stolifera, Astyanax fasciatus, Thyrinops crystallina, Poecilia sphenops, Poeciliopsis balsas, Poeciliopsis porosus) con un 45%, en volumen y 80% de frecuencia; moluscos (Mytella strigata) con un 10% en volumen y 90% de frecuencia; insectos (huevecillos, larvas y adultos de Chironomus sp) con un 10% en volumen y 100% de frecuencia; detritus y otra materia orgánica no determinable con un 20% en volumen y 100% de frecuencia; restos de vegetales (Ruppia maritima, Chara sp, Chaetomorpha sp) con un 15% en volumen y 100% de frecuencia. 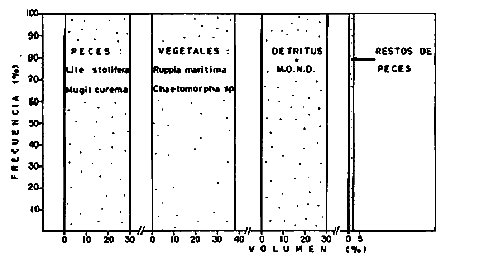 Fig. 59. Espectro trófico de volumen y frecuencia de Cichlasoma trimaculatum en el sistema lagunar costero de Guerrero, durante el periodo 1. Nuxco (N=24). Septiembre de 1973 Estos resultados muestran que Cichlasoma trimaculatum tiene mayor similitud en su patrón de alimentación con Cichlasoma cyanoguttatum. Se puede precisar que es una especie con un patrón muy definido en su alimentación, consumidor primario del tipo omnívoro, que se alimenta de peces, moluscos, insectos, detritus y vegetales. En observaciones anteriores se ha constatado la presencia de crustáceos y la disminución de vegetales en la dicta de los adultos, lo que parece indicar que circunstancialmente puede ser un carnívoro de primer orden o consumidor secundario. Esto ocurrió en la laguna de Mitla en muestras analizadas en octubre de 1976 (no discutidas aquí) donde aparecieron Macrobrachium tenellum en los estómagos de estos peces al mismo tiempo que carecían de restos vegetales en su dieta. 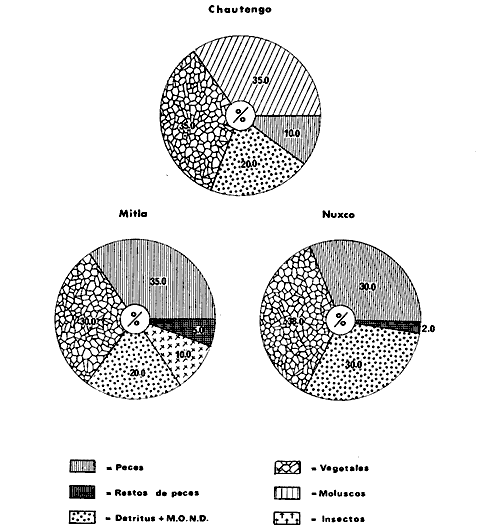 Fig. 60. Espectro trófico volumétrico de Cichlasoma trimaculatum en el sistema lagunar costero de Guerrero, durante el periodo 1. Chautengo (N=24), Mitla (N=12), Nuxco (N=24) Las tallas de los ejemplares estudiados variaron entre 129 y 180 mm de longitud total con predominancia de estados sexuales III-IV. La especie alcanza la madurez gonádica después de los 130 mm. El incremento en peso es muy marcado con la longitud y el desarrollo sexual, incluso desde las primeras etapas de vida. Esto es interesante cuando se trata de especies susceptibles de cultivos, un rápido crecimiento y una versatilidad de su alimentación. De acuerdo a Mc Hugh (1967), Yáñez-Arancibia (1975a, 19761) y 1976c.) y Yáñez-Arancibia y Nugent (1977) , corresponde a una especie dulceacuícola (Fig. 7), que circunstancialmente puede invadir aguas salobres de las lagunas costeras y estuarios, generalmente al estado adulto y para alimentarse. Durante el periodo 3 de las lagunas la biomasa de esta especie aumenta en todo el sistema lagunar estudiado. Dormitator latifrons (Richardson)El género Dormitator es muy abundante en las aguas salobres y costeras de México, con dos especies, D. maculatus en el Golfo y D. latifrons en el Pacífico. Yáñez-Arancibia y Díaz (1977), recientemente han señalado la importancia de D. latifrons en el sistema lagunar costero de Guerrero. Probablemente no corresponda a una especie de amplio consumo como pez de mesa, pero su particular abundancia y su gran adaptación a las lagunas costeras lo convierte en un potencial económico susceptible de ser utilizado en subproductos pesqueros, además de ser una especie ecológicamente importante en esos ecosistemas. La especie habita en aguas salobres prácticamente durante toda su vida, aun cuando Günther (1956) ha aclarado que las familias Gobiidae y Eleotridae son de origen marino. Ningún estudio anterior sobre Dormitator latifrons considera aspectos de su biología, exceptuando el de Yáñez-Arancibia y Díaz (1977) que discuten la ecología trofodinámica de la especie en el sistema lagunar costero de Guerrero. Ese antecedente determina que en este trabajo sólo se considera lo más trascendente de la alimentación de D. latifrons así como también precisar su posición trófica en la estructura de las comunidades estudiadas. Para el análisis de la alimentación y hábitos alimenticios fueron examinados 267 ejemplares. El espectro trófico volumétrico (Fig. 6 1) , indica que Dormitator latifrons se alimenta principalmente de detritus y materia orgánica no determinable, además de restos vegetales, pero además incluye en su dicta, micromoluscos, ostrácodos, nemertinos, tremátodos, escamas de peces, copépodos, anélidos, larvas de insectos y eventualmente sedimentos inorgánicos. El análisis de la composición de su dieta, en el espacio y en el tiempo, indica que durante todo el año y en todas las localidades estudiadas prevalecen el detritus, la materia orgánica y luego algunos vegetales y restos de los mismos. Esos grupos tróficos sirven de alimento a la especie en forma relativamente variable, dependiendo de la localidad, el periodo ecológico de las lagunas y la disponibilidad de ese alimento. En consecuencia Dormitator latifrons es un consumidor primario dentro de la estructura trófica de las comunidades ictiofaunísticas lagunares, siendo predominantemente detritívoro vegetal, pero que sin embargo, dependiendo de las variables consideradas en el párrafo anterior, puede comportarse como un consumidor primario del tipo omnívoro. 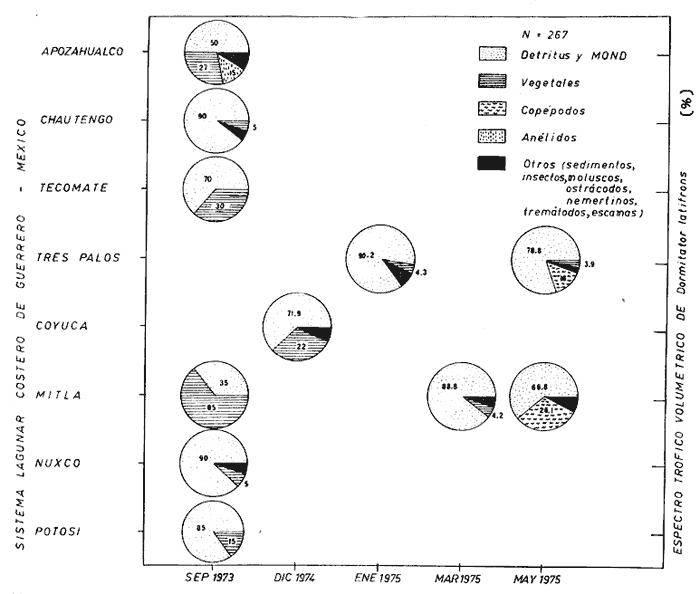 Fig. 61. Espectro trófico volumétrico de Dormitator latifrons en el sistema lagunar costero de Guerrero en un ciclo anual (N=267). Se aprecian ligeros cambios en relación a los periodos ecológicos de las lagunas. Resultados interesantes ha mostrado el estudio de la relación gravimétrica del alimento ingerido por Dormitator latifrons (Fig. 28). Se aprecia que en los primeros estados de desarrollo, el pez consume mayor cantidad de alimento en relación al peso de su cuerpo; sin embargo, conforme avanza su crecimiento, sus necesidades alimenticias no disminuyen ostensiblemente en comparación con un pez como Galeichthys caerulescens que es predominantemente carnívoro. D. latifrons tiene un estómago proporcionalmente más grande que G. caerulescens y por consiguiente una capacidad mayor para almacenar alimento. Por su posición trófica compite interespecíficamente con otros peces detritívoros; entre los más importantes: Mugil curema, M. cephalus, Gobionellus microdon, Eleotris pictus y Gobiomorus maculatus. Es una especie de fundamental importancia ecológica transformando energía potencial del detritus en energía utilizable por niveles tróficos superiores donde se ubican otros peces, aves acuáticas y eventualmente el hombre. Su abundancia particular en algunas lagunas de características ecológicas similares (i. e., Tres Palos, Coyuca y Mitla) sugiere, aparentemente, que esta especie puede comportarse como un indicador biológico. Los ejemplares examinados variaron entre 106 y 282 mm de longitud total. Más del 85% fueron adultos. La especie se reproduce en salinidades bajas (menos de 5%) pero pasa toda su vida en el interior de las lagunas. LOS GRUPOS TRÓFICOS EN LAS COMUNIDADES ESTUDIADASEl estudio del significado trófico de los peces en comunidades y ecosistemas es importante porque además de precisar la alimentación de las especies envueltas y las relaciones ecológicas entre las especies, indica la estructura trófica o trama ictiotrófica del ecosistema y los patrones principales del flujo energético. Numerosos grupos tróficos fueron encontrados en los ecosistemas lagunares de Guerrero. Por la dinámica de las lagunas consideradas para el estudio de los peces, es probable que estos grupos varíen o desaparezcan estacionalmente y eso sea otro factor que determine algún cambio en el espectro trófico de los diferentes peces. Vegetales Este grupo trófico incluye hojas y raíces de manglares, pastos marinos y pastos pantanosos, así corno, también algas filamentosas verdes y verde-azules. Puede ser considerado aquí también al fitoplancton. Todos ellos aprovechados como alimento por peces y macroinvertebrados. Detritus El detritus es extraordinariamente abundante en las lagunas de Guerrero y su fuente principal son las plantas vasculares de la vegetación periférica, el fitoplancton y tal vez la fauna de invertebrados y peces que mueren masivamente por efectos de cambios marcados de la sanilindad y temperatura. El mayor o menor aporte de estas fuentes primarias de detritus varía en las diferentes lagunas. En las lagunas de Tres Palos, Coyuca y Mitla la principal fuente son los manglares y en esas lagunas se acumulan grandes cantidades de detritus ya que en esas lagunas, la exportación hacia el mar es muy limitada por la barrera hidrodinámica y geomorfológica que representa el canal meándrico que las comunica con el mar. Este detritus se encuentra asociado con sedimentos inorgánicos al estado coloidal, y todo esto a su vez asociado con bacterias y diatomeas bentónicas, los que son comidos por protozoos ciliados y foraminíferos. W.E. Odum y Heald (1972) sugieren que los organismos que se alimentan de detritus e ingieren sedimentos inorgánicos, presumiblemente ingieren además bacterias, diatomeas y protozoos, asociados junto con la materia orgánica a la capa superficial del fondo. Esta situación también se presenta en las relaciones tróficas del sistema lagunar costero de Guerrero. Hidrozoos Algunos hidrozoarios no identificados fueron encontrados en los estómagos de ciertos peces, especialmente de peces capturados cerca de las bocas de las lagunas en la vecindad del mar. Sin embargo, fueron poco abundantes en realidad, pero por correponder a un phylum individual se le considera un grupo trófico particular. No fueron significativamente importantes en la dieta de los peces que los presentaron y además desaparecen estacionalmente en los periodos 2 y 3 de las diferentes lagunas. Los hidrozoarios se al¡mentan de zooplancton. Nemátodos Nemátodos no determinados han sido encontrados como parásitos en algunos peces, pero otros han aparecido dentro de la cavidad abdominal y como no presentan armadura bucal ni cutícula resistente a los jugos digestivos, se sugiere que son nemátodos de vida libre que los peces obtienen como alimento de la meiofauna. No son abundantes como alimento y difíciles de cuantificar y de determinar taxonómicamente por la rápida digestión que sufren, W. E. Odum y Heald (1972) consideran que el papel ecológico de los nemátodos en las comunidades estuarinas es más importante como agente en los procesos de descomposición de las hojas de manglares para constituir el detritus, que como alimento mismo. Anélidos Algunos poliquetos aparecen con relativa frecuencia en los estómagos -de los peces. Han sido de las familias Nereidae, Serpulidae, Arenicolidae y Sabellidae. W. E. Odum y Heald (1972) sugieren que algunos poliqueteros característicos de ambientes estuarinos de Florida, como Nereis pelagica y Neanthes succinea, son omnívoros y se alimentan de detritus vegetal, algas y ocasionalmente pequeños crustáceos (copépodos y anfípodos) . Serpúlidos y sabélidos son generalmente carnívoros y arennicólidos y nereidos son omnívoros, en el sistema lagunar costero de Guerrero. Moluscos Bivalvos y gastrópodos han sido comunes en los estómagos de algunos peces, pero nunca extraordinariamente significativos volumétricamente en el espectro trófico de los peces. Los bivalvos se alimentan de detritus y materia orgánica en suspensión y/o sedimentación, fitoplancton, diatomeas epifíticas y sedimentos inorgánicos. Los gastrópodos, por lo general son omnívoros alimentándose de detritus, fanerógamas, algas epifíticas y pequeños microorganismos animales Crustáceos Dentro de este grupo trófico fueron encontrados ostrácodos, copépodos (harpacticoides y ciclopoides) , isópodos, decápodos (Palaemonidae, Penaeidae, Portunidae, Gecarcinidae) . Ostrácodos Fueron encontrados con frecuencia en los estómagos, especialmente de la familia Gerridae, pero no fueron identificadas ni especies ni generos. Permak (1953) ha señalado que los ostrácodos se alimentan de bacterias, hongos, algas y finas partículas de detritus vegetal. Copépodos Los copépodos harpactioides son importantes en las dietas de muchos peces e invertebrados. Green (1968) ha señalado que estos grupos son comedores del fondo (algas unicelulares y detritus) . Los copépodos ciclopoideos como Cyclops sp se han encontrado en algunos estómagos y se alimentan de detritus de plantas vasculares, fitoplancton y diatomeas epifíticas (W. E. Odum y Heald, 1972). Isópodos Con poca frecuencia han aparecido algunos isópodos en los estómagos de Gérridos y Góbidos. Estudios en estuarios de Florida han señalado que el tracto digestivo de algunos isópodos como Limnoria contiene microalgas y partículas de detritus y se alimentan principalmente por la noche. Pero otras especies de esa área, como Leptochelia, se alimentan de pequeñas partículas de detritus vegetal, sedimentos inorgánicos y algunas diatomeas bentónicas. No fueron determinados ni especies ni géneros en las lagunas de Guerrero. Decápodos En este grupo fueron encontradas cuatro familias en las lagunas de Guerrero: Palaemoidae, Penaeidae Portunidae y Grapsidae. Palaemonidae. El único palemonido fue Macrobrachium tenellum. En condiciones artificiales Sánchez (1975) ha cultivado con relativo éxito a esta especie alimentándola con trozos de pescado y alimento sintético (Porrillo 11) . Sin embargo la alimentación natural es diferente en las lagunas donde se presenta en Guerrero, comiendo microfauna, restos vegetales y detritus. W. E. Odum y Heald (1972) han discutido el trabajo de Hunt (1953) y Kawanabe et al. (1965) y además de sus estudios, han señalado que, en general, las especies de Palaemonetes se alimentan de cinco grupos tróficos: 1) partículas inorgánicas, 2) partículas orgánicas e inorgánicas del tamaño de las arcillas, que probablemente contienen sustancias orgánicas coloidales, 3) diatomeas bentónicas, dinoflageladas, algas filamentosas verdes y verde-azules, 4) partículas de detritus de plantas vasculares provenientes de manglares y juncos, y 5) restos de animales como ostrácodos, anfípodos y copépodos. Los hongos, bacterias y protozoos son ingeridos junto con el punto 1) y 2) . Penaeidae. Fueron encontradas tres especies de esta familia: Penaeus vanamei, P. califorciensis y P. stylirostris. Dall (1968) ha señalado que los peneidos son omnívoros que se alimentan de animales que pueden capturar fácilmente, algas celulares y filamentosas, partículas de sedimentos (bacterias) ; todo obtenido de la capa superficial del fondo. Idyll et al. (1967) y W. E. Odum y Heald (1972) han señalado la importancia de la película de bacterias, levaduras y hongos que existen sobre las partículas de lodo que le sirven de alimento a Penaeus. Estos últimos autores agregan que P. duorarum se alimenta de partículas inorgánicas, detritus de plantas vasculares, algas filamentosas verdes y verde-azules, diatomeas bentónicas, ostrácodos, micromoluscos y copépodos harpacticoides. En el sistema lagunar costero de Guerrero, es probable que los peneidos tengan un comportamiento omnívoro alimentándose de microfauna, detritus y algas filamentosas. Portunidae. Fueron encontradas dos especies de esta familia: Callinectes arcuatus y C. toxotes. En la costa del norte del Golfo de México, Darnell (1958) encontró que C. sapidus (blue crab) se alimenta de moluscos, cangrejos y detritus. Tagatz (1968) encontró resultados similares puesto que sus estudios indicaban moluscos, peces, crustáceos, plantas, anélidos, insectos y briozoos. W. E. Odum y Heald (1972) han señalado que C. sapidus se alimenta de moluscos (Congeria leucophaeta y Brachidontes exustus) cangrejos (Rhithropanopeus harrisii), anfípodos, restos de peces, granos de arena y algo de detritus. Los Callinectes en las lagunas costeras de Guerrero se comportan preferentemente como carnívoros, pero además ingieren algunas cantidades de detritus. Gecarcinidae. La única especie presente en el Pacífico es Cardiosoma crassum, un cangrejo terrestre que excava galerías en la periferia de las lagunas, entre los cocoteros y los manglares. Este cangrejo se alimenta de pequeños organismos que puede atrapar, restos vegetales y algo de detritus. Al igual que las jaibas tiende a comportarse como carnívoro, pero circunstancialmente y dependiendo de la disponibilidad del alimento, ingiere detritus. Insectos El grupo de insectos dominintes fueron Diptera Chironomidae del género Chironomus sp. En menor proporción fueron encontrados Hemípteros en los estómagos de algunos peces. W. E. Odum y Heald (1972) han discutido los trabajos de Hunt (1953), Pennak (1953) Thienemann (1954), Walshe (1947 y 1951) y Jansson (1967), y de toda esa información puede concluirse que los Chironamidae se alimentan de algas, plantas vasculares, detritus, diatomeas y partículas en suspensión. CARACTERIZACIÓN ICTIOECOLÓGICA DE LAS LAGUNAS Y ESTRUCTURA DE SUS COMUNIDADES
DIAGNOSIS ICTIOECOLÓGICALos diferentes aspectos ecológicos anteriormente discutidos pueden ser reunidos en un panorama general para cada laguna, lo cual permite caracterizarlas ictioecológicamente por medio de una diagnosis en función de los periodos ecológicos definidos en este trabajo. SALINAS DE APOZAHUALCODiversidad íctica total anual: 39 especies, H' 2.7076. Peces presentes todo el año: 10%. Profundidad media anual: 1 m. Alta biomasa fitoplanctónica. Variable cantidad de detritus. Pocos manglares. Variable biomasa macrobentónica. Estructura trófica y comunidades nectónicas complejas durante el periodo 1, simplificándose durante los periodos 2 y 3. Periodo 1 Diversidad íctica total: 35 especies, H' 2.5287. Peces dulceacuícolas: 13.7% Peces marinos: 82.3%. Densidad de las poblaciones: 6 especímenes por 19.5 m². Rangos de temperaturas: 29-31°C. Rangos de salinidades: 15-34‰ Periodo 2 Diversidad íctica total: 8 especies, H' 1.6665. Peces dulceacuícolas: 1.25%. Peces marinos: 98.75%. Densidad de las poblaciones: 2.85 especímenes por 19.5 m². Rangos de temperaturas: 28-40°C. Rangos de salinidades: 35-125‰. Periodo 3 Diversidad íctica total: 9 especies H' 2.0360. Peces dulceacuícolas. 76.6%, Peces marinos: 23.4%. Densidad de las poblaciones: 0.8 especímenes por 19.5 m² . Rangos de temperaturas: 29-35°C. Rangos de salinidades: 0-14‰. CHAUTENGODiversidad íctica total anual; 85 especies, H' 2.1588. Peces presentes todo el año: 10.6%. Profundidad media anual: 1 m. Alta biomasa fitoplanctónica. Variable cantidad de detritus. Pocos manglares. Variables biomasas macrobentónicas. Estructura trófica y comunidades nectónicas complejas durante el periodo 1, simplificándose durante los periodos 2 y 3. Periodo 1 Diversidad íctica total: 70 especies, H' 2.2728. Peces dulceacuícolas: 10%. Peces marinos: 90%. Densidad de las poblaciones: 12 especímenes por 19.5 m². Biomasa (peso húmedo) 1,300g por 19.5 m². Rangos de temperaturas: 2931°C. Rangos de salinidades: 15-34‰. Periodo 2 Diversidad íctica total: 18 especies, H' 1.5237. Peces dulceacuícolas: 16%. Peces marinos: 84% Densidad de las poblaciones: 8 especímenes por 19.5m². Biomasa (peso húmedo): 864 g por 19.5 m². Rangos de temperaturas: 28-40°C. Rangos de salinidades. 25-45‰. Periodo 3 Diversidad íctica total: 33 especies, H' 2.4952. Peces dulceacuícolas: 50%. Peces marinos: 50%. Densidad de las poblaciones: 7 especímenes por 19.5 m². Biomasa (peso húmedo) : 756 g por 19.5 m² . Rangos de temperaturas: 29-35°C. Rangos de salinidades: 0-20‰. TECOMATEDiversidad íctica total anual: 33 especies, H' 2.4952. Peces presentes todo el año: 33.3%. Profundidad media anual: 1 m. Alta biomasa fitoplanctónica. Variable cantidad de detritus. Pocos manglares. Variable biomasa macrobentónica. Estructura trófica y comunidades nectónicas complejas durante el periodo 1, simplificándose durante los periodos 2 y 3. Periodo 1 Diversidad íctica total: 30 especies, H' 1.2880. Peces dulceacuícolas: 16.6%. Peces marinos: 83.4%. Densidad de las poblaciones: 19 especímenes por 19.5 m² . Rangos de temperaturas: 29-31°C. Rangos de salinidades: 15-34 ‰. Periodo 2 Rangos de temperaturas: 28-40°C. Rangos de salinidades: 30-45 ‰. Periodo 3 Diversidad íctica total. 13 especies, H' 2.1379. Peces dulceacuícolas 46.2%. Peces marinos: 53.8% Densidad de las poblaciones: 8.5 especímenes por 19.5 m² . Rangos de temperaturas 29-35°C. Rangos de salinidades: 0-14 ‰. TRES PALOSDiversidad íctica total anual: 32 especies, H' 1.9898. Peces presentes todo el año: 59.4%. Profundidad media anual: 2 m. Biomasa fitoplanctónica muy alta. Gran cantidad de detritus en sedimentación. Gran superficie de manglares. Muy baja biomasa macrobentónica. Estructura trófica y comunidades nectónicas complejas durante el periodo 1 en la zona del canal, siniplificándose mucho durante este mismo periodo en el resto de la laguna, y a través de toda la laguna durante los periodos 2 y .3. Periodo 1 Diversidad ictica total: 32 especies, H' 1.9898. Peces dulceacuícolas: 42.5%. Peces marinos: 57.5%. Densidad de las poblaciones: 14 especímenes por 19.5 m². Biomasa (peso húmedo) : 840 g por 19.5 m². Rangos de temperaturas: 2931°C. Rangos de salinidades: 0-3.5 ‰. Periodo 2 Diversidad íctica total: 19 especies, H' 1.6924. Peces dulceacuícolas: 52.6%. Peces marinos: 47.4%. Densidad de las poblaciones: 6.9 especímenes por 19.5 m². Biomasa (peso húmedo,) : 420 g por 19.5 m². Rangos de temperaturas: 30-35°C. Rangos de salinidades: 0-4 ‰. Periodo 3 Diversidad íctica total: 26 especies, H' 2.5335. Peces dulceacuícolas: 53.8% Peces marinos: 46.2%, Densidad de las poblaciones: 8.3 especímenes por 19.5 m². Biornasa (peso húmedo) : 480 g por 19.5 m². Rangos de temperaturas: 29-33° C. Rangos de salinidades: 0-3.5 ‰. COYUCADiversidad íctica total anual: 25 especies, H' 2.4630. Peces presentes todo el año: 56%. Profundidad media anual: 2 m. Biomasa fitoplanctónica muy alta. Gran cantidad de detritus en sedimentación. Gran superficie de manglares. Muy baja biomasa macrobentónica. Estructura trófica y comunidades nectónicas complejas durante el periodo 1 en la zona del canal, simplificándose mucho durante este mismo periodo en el resto de la laguna, y a través de toda la laguna durante. los periodos 2 y 3. Periodo 1 Diversidad íctica total: 23 especies, H' 2.1599. Peces dulceacuícolas 52.2%. Peces marinos: 47.8%. Densidad de las poblaciones; 2 especímenes por 19.5 m². Rangos de temperaturas: 29-31°C. Rangos de salinidades, 03.5 ‰. Periodo 2 Diversidad íctica total: 15 especies, H' 2.3116. Peces dulceacuícolas: 60%. Peces marinos: 40%. Densidad de las poblaciones: 1.2 espéciménes por 19.5 m². Rangos de teniperaturas: 30-33°C. Rangos de salinidades. 0-4 ‰. Periodo 3 Diversidad íctica total: 20 especies, H' 2.4142. Peces dulceacuícolas: 68.4%. Peces marinos: 31.6%. Densidad de las poblaciones, 1 especimen por 19.5 m². Rangos de temperaturas: 29-33°C. Rangos de salinidades: 0-3 ‰. MITLADiversidad íctica total anual: 16 especies, H' 1.8352. Peces presentes todo el año; 50% Profundidad media anual 2 m. Biomasa fitoplanctónica muy alta. Gran cantidad de detritus en sedimentación. Gran superficie de manglares. Muy baja biomasa macrobentónica. Estructura trófica y comunidades nectónicas muy simples durante los tres periodos ecológicos de la laguna. Periodo 1 Diversidad íctica total: 13 especies, H' 1.9444. Peces dulceacuícolas: 59.6%. Peces marinos: 41.4%. Densidad de las poblaciones: 3 especímenes por 19.5 m². Rangos de temperaturas: 29-31°C. Rangos de salinidades: 0-3.5 ‰. Periodo 2 Diversidad íctica total: 11 especies, H' 1.6327. Peces dulceacuícolas: 63.6%. Peces marinos. 36.4%. Densidad de las poblaciones: 1.2 especímenes por 19.5 m². Rangos de temperaturas: 30-33°C. Rangos de salinidades: 04% Periodo 3 Diversidad íctica total: 9 especies, H' 1.7968. Peces dulceacuícolas: 66.6%. Peces marinos: 33.4%. Densidad de las poblaciones: 2.3 especímenes por 19.5 m². Rangos de temperaturas: 29-33°C. Rangos de salinidades: 0-3 ‰. NUXCODiversidad íctica total anual: 43 especies, H' 1.8892. Peces presentes todo el año: 13.9%. Profundidad media anual: 1 m. Alta biomasa fitoplanctónica. Variable cantidad de detritus. Pocos manglares. Variable biomasa macrobentónica. Estructura trófica y comunidades nectónicas complejas durante el periodo 1, simplificándose durante los periodos 2 y 3. Periodo 1 Diversidad íctica total: 33 especies, H' 2.0901. Peces dulceacuícolas: 7.5%. Peces marinos: 92.5%, Densidad de las poblaciones: 6.8 especímenes por 19.5 m². Rangos de temperaturas: 2931°C. Rangos de salinidades: 15-34 ‰. Periodo 2 Diversidad íctica total: 6 especies, H' 0.9943. Peces dulceacuícolas: 16%. Peces marinos: 84%. Densidad de las poblaciones: 1.3 especímenes por 19.5 m². Rangos de temperaturas. 28-40°C. Rangos de salinidades: 25-45 ‰. Periodo 3 Diversidad íctica total: 13 especies, H' 1,1540. Peces dulceacuícolas: 38.5%. Peces marinos 61.5%. Densidad de las poblaciones: 8 especímenes por 19.5 m². Rangos de temperaturas: 29-35°C. Rangos de Salinidades: 0-20 ‰. SALINAS DEL CUAJODiversidad íctica total anual: 25 especies, H' 2.5748. Peces presentes todo el año: 8%. Profundidad media anual: 1 m. Variable cantidad de detritus. Pocos manglares. Variable biomasa macrobentónica. Estructura trófica y comunidades nectónicas complejas durante el periodo 1, simplificándose durante los periodos 2 y 3. Periodo 1Diversidad íctica total: 20 especies, H' 2.5353. Peces dulceacuícolas: 870. Peces marinos. 92%. Densidad de las poblaciones: 6 especímenes por 19.5 m². Rangos de temperaturas : 29-31°C. Rangos de salinidades: 15-34%. Periodo 2 Diversidad íctica total: 3 especies, H' 0.6127. Peces dulceacuícolas, 0%. Peces marinos: 100%. Densidad de las poblaciones: 2 especímenes por 19.5 m2. Rangos de temperaturas: 28-40°C. Rangos de salinidades: 35-125 ‰. Periodo 3 Diversidad íctica total: 11 especies, H' 2.0297. Peces dulceacuícolas: 27%. Peces marinos: 73%. Densidad de las poblaciones: 2.4 especímenes por 19.5 m², Rangos de temperaturas: 29-35°C. Rangos de salinidades: 0-20 ‰. POTOSÍDiversidad íctica total anual: 58 especies, H' 2.8537. Peces presentes todo el año: 15.5%. Profundidad media anual: 1 m. Alta biomasa fitoplanctónica. Variable cantidad de detritus. Pocos manglares. Variable biomasa macrobentónica. Estructura trófica y comunidades nectónicas complejas durante el periodo 1, simplificándose durante los periodos 2 y 3. Periodo 1 Diversidad íctica total: 44 especies, H' 2.3649. Peces dulceacuícolas: 10.9% Peces marinos: 89.1%. Densidad de las comunidades: 9.8 especímenes por 19.5m². Rangos de temperaturas: 29-31°C. Rangos de salinidades: 15-34 ‰. Periodo 2 Diversidad íctica total: 12 especies, H' 1.5696. Peces dulceacuícolas: 16.6%. Peces marinos: 83.4%. Densidad de las poblaciones: 2 especímenes por 19.5 m². Rangos de temperaturas: 28-40ºC. Rangos de salinidades: 25-45 ‰. Periodo 3 Diversidad íctica total: 22 especies, H' 2.4864. Peces dulceacuícolas: 40.9%. Peces marinos: 59.1%. Densidad de las poblaciones: 2.7 especímenes por 19.5 m². Rangos de temperaturas: 29-35°C. Rangos de salinidades: 0-15 ‰. AFINIDAD ECOLÓGICA Y GRUPOS DE LAGUNASEl análisis detallado de las diagnosis ecológicas recién discutidas, permite apreciar que varias lagunas responden a un esquema general (i. e., Salinas de Apozahualco, Chautengo, Tecomate, Nuxco, Salinas del Cuajo y Potosí) , por una parte, y (i. e., Tres Palos, Coyuca y Mitla) por otra. El ciclo de fisiología ambiental de tres periodos ecológicos por el cual pasan anualmente las lagunas, tiene mayor o menor influencia en cada una de las áreas y es lo que básicamente determina un patrón de comportamiento general de las lagunas. La afinidad ecológica entre ellas respondería al siguiente esquema: 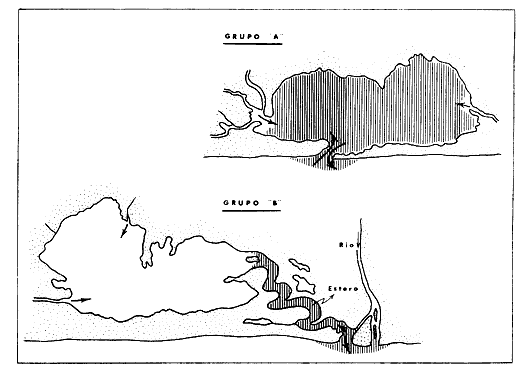 Fig. 62. Esquema geomorfológico de las lagunas de los Grupo A y B en el sistema lagunar costero de Guerrero, señalándose el área de influencia marina durante el periodo 1. 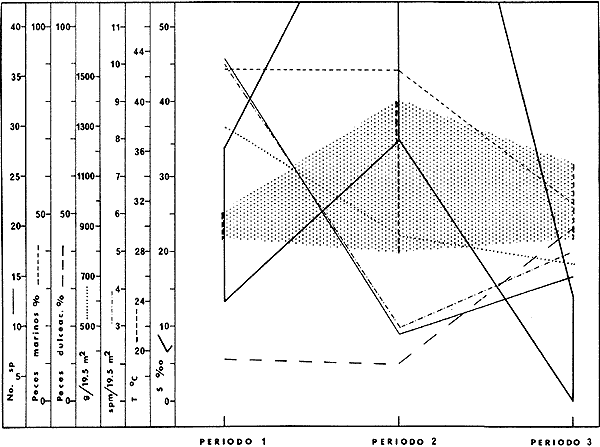 Fig. 63. Relaciones entre la diverdidad, densidad, standing crop, peces marinos, peces dulceacuícolas, temperatura y salinidad, en los tres periodos ecológicos de las lagunas del Grupo A. Los valores son promedios para las seis lagunas del Grupo A y están tomados en la Tabla 47. En estas lagunas el 15 % de su ictiofauna total se encuentra presente todo el año, siendo un reflejo de la inestabilidad del ambiente. Lagunas del Grupo A (Laguna tipo: Chautengo)Pertenecen Salinas de Apozhualco, Chautengo, Tecomate, Nuxco, Salinas del Cuajo y Potosí. En este grupo el ciclo afecta a toda la laguna (Fig. 62). Profundidades medias anuales: 1 m. Temperaturas de 29 a 35°C. Salinidades de 2 a 125 ‰. Alta biomasa fitoplanctónica con un máximo de 43X106 cel./l, biomasa zooplanctónica máxima de 105 indiv./m³ y 1.0 g/m³. Variable cantidad de detritus puesto que en el periodo 1 hay una manifiesta exportación hacia el mar. Pocos manglares y de distribución irregular. Variable biomasa macrobentónica. Estructura trófica y comunidades nectónicas compejas en diversidad durante el periodo 1, simplificándose durante los periodos 2 y 3 (Figs. 63, 64 y 67). El bajo porcentaje de peces que se encuentran presentes todo el año es el reflejo de la inestabilidad del ambiente (i. e., 15%). En la figura 67 se utiliza la simbología sugerida por H. T. Odum y Copeland (1974). Lagunas del Grupo B (Laguna tipo: Tres Palos)Pertenecen Tres Palos, Coyuca y Mitla. En este grupo. el ciclo afecta sólo el área del canal (Fig. 62) . Profundidades medias anuales: 2 m. Temperaturas de 29 a 33°C. Salinidades de 0 a 4 ‰. Biomasa fitoplanctónica muy alta con un máximo de 109 a 1010 cel./l, biomasa zooplanctónica máxima de 10³ indiv./m³ y 3.0 g/m³. Gran cantidad de detritus acumulado en sedimentación por su limitada exportación hacia el mar ; esto porque el ciclo es de efecto restrigido además de la barrera que representa el canal meándrico que las comunica con el mar; Mitla no posee canal pero se encuentra cerrada y el efecto ecológico es similar. Gran superficie de manglares presentes en la periferia de las lagunas y de distribución continua. Muy baja biomasa macrobentónica (casi ausente) . Estructura trófica y comunidades nectónicas relativamente complejas en diversidad durante el periodo 1 en la zona del canal, simplificándose mucho durante este mismo periodo en el resto de la laguna, y a través de toda la laguna durante los periodos 2 y 3 (Figs. 65, 66 y 68). El alto porcentaje de peces que se encuentran presentes todo el año es el reflejo de la estabilidad del ambiente (i. e., 55%). En la figura 68 se utiliza la simbología sugerida por H. T. Odum y Copeland (1974). 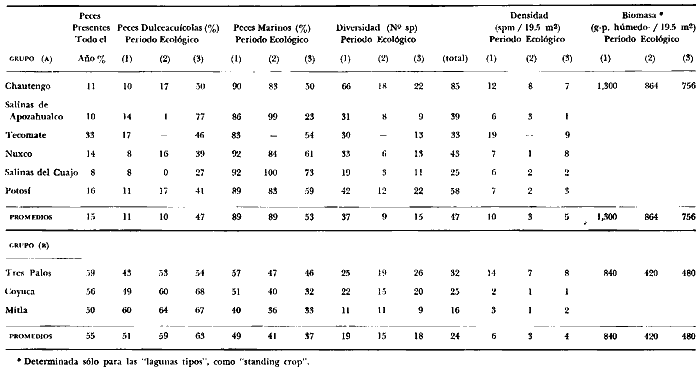 TABLA 47. VALORES GLOBALES DE ALGUNOS PARÁMETROS BIÓTICOS DE LAS LAGUNAS DE LOS GRUPOS A Y B En la tabla 47 se presentan los valores globales de peces dulceacuícolas, peces marinos, diversidad, densidad y biomasa, y su variación estacional, en las lagunas ecológicamente similares. PATRON DE DIVERSIDAD Y ABUNDANCIA DE LAS LAGUNAS DE LOS GRUPOS A Y BPara esta discusión sólo se consideran las lagunas Chautengo y Tres Palos, las cuales corresponden a las lagunas tipos deambos grupos. ChautengoEsta laguna esta dominada por la influencia estacional de peces marinos eurihalinos y estenohalinos. Estas fluctuaciones se reflejan en los tres índices calculados (Tabla 48) Significativa fluctuación estacional ocurre en el índice de Shannon y Weaver, es decir la distribución del número de ejemplares entre las especies (Fig. 64). El índice H', sin embargo, no es alto y aparece dentro del rango reportado por otros autores en otras latitudes para comunidades de peces (Tablas 50 y 51). Por otra parte no se aprecian cambios evidentes en el índice J' de abundancia relativa de especies. Desde luego, hay inmigración y emigración de especies durante el periodo 1 en las lagunas y también sucesión con especies dulceacuícolas durante el periodo 3 y, por lo tanto, ese reajuste no permite detectar cambios con el índice J'. Mayor evidencia sugiriendo un reemplazo de especies se obtiene por el índice de riqueza de especies D. Este índice muestra significativa variación estacional de acuerdo a los periodos ecológicos de las lagunas. Un desaparecimiento y/o reemplazo de especies tiene lugar en estas condiciones. Distintas especies utilizan el estuario durante diferentes épocas del año depediendo de la adaptación del nicho de cada especie. Tres palosMientras las fluctuaciones estacionales son características de la Laguna de Chautengo, esto no ocurre en la Laguna de Tres Palos (Tabla 49). Cuando las especies marinas desaparecen del estuario por mortalidad natural o por pesca durante el periodo 1, ellas son reemplazadas por otras manteniéndose valores de H' relativamente constantes.  TABLA 48. ANÁLISIS DE LA VARIACIÓN DE ÍNDICES ECOLÓGICOS POR EFECTO DE LOS PERIODOS ECOLÓGICOS ESTACIONALES EN LA LAGUNA DE CHAUTENGO 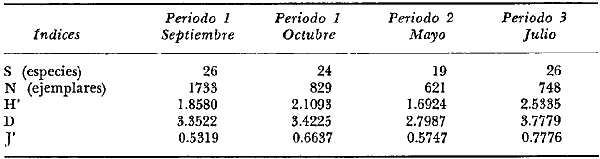 TABLA 49. ANÁLISIS DE LA VARIACIÓN DE ÍNDICES ECOLÓGICOS POR EFECTO DE LOS PERIODOS ECOLÓGICOS ESTACIONALES EN LA LAGUNA DE TRES PALOS Sin embargo, existen fluctuaciones significativas de H' entre el periodo 2 y 3. Este incremento de especies y su abundancia relativa y biomasa durante el periodo 3 se debe a especies dulceacuícolas que se presentan en la laguna durante el periodo de lluvias y la laguna se encuentra aislada del mar. Aun esta situación, la laguna muestra una gran estabilidad ecológica (Fig. 66). El indice J' varía razonablemente desde el periodo 2 hasta el periodo 3 debido al porte de- ictiofauna dulceacuícola, pero en general J' permanece constante durante todo el año El decremento del índice D durante el periodo 2 se debe fundamentalmente al estrés por la baja concentración de oxígeno disuelto en el fondo, especialmente durante la noche, además de la poca disponibilidad de alimento. Casi todas las especies en esta laguna contribuyen con numerosos ejemplares en respuesta a las características del habitat. No hay variaciones significativas en la temperatura y la salinidad, pero el oxígeno disuelto, la disponibilidad del alimento y los bloom de fitoplancton, así como el rango muy bajo de salinidades limitan a las especies nectónicas capaces de colonizar este habitat. El análisis de las tablas 50 y 51 permite apreciar que la biomasa de peces, normalmente es considerablemente menor que el potencial de productividad primaria de las lagunas. No obstante, además de los valores encontrados en este estudio, existen otras excepciones donde la productividad pesquera puede ser muy alta en un periodo breve de tiempo. Lagler et al. (1971) encontró entre 33.7 y 59.2 g/m² en la laguna Kafue Flats, África. Mago (1970) encuentra 100 g/m² en una laguna de Venezuela. Bonetto et al. (1970) encuentra entre 55 y 128.7 g/m² en cuatro lagunas permanentes del Paraná. Holcik (1970) encuentra 32.1 g/m² en la Laguna Sabanilla y 32.5 g/m² en la Laguna Luisa, ambas en Cuba. Detallada discusión de esto y otros aspectos de las comunidades de peces tropicales hace Lowe-Mc Connell (1975) con énfasis en aguas dulces. 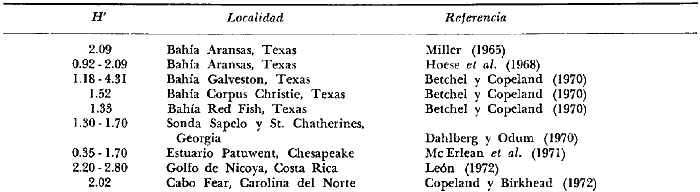 TABLA 50. VALORES DE DIVERSIDAD DE COMUNIDADES DE PECES EN SISTEMAS ESTUARINOS DE CENTRO Y NORTEAMÉRICA  TABLA 50 (continuación) 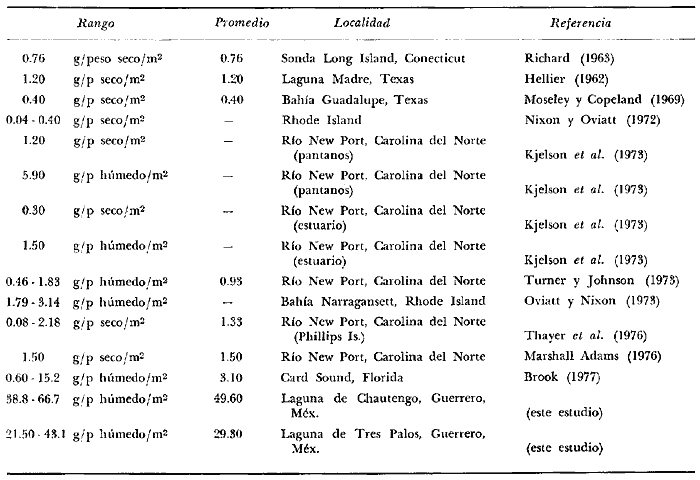 TABLA 51. VALORES DE BIOMASA DE COMUNIDADES DE PECES EN SISTEMAS ESTUARINOS DE NORTEAMÉRICA 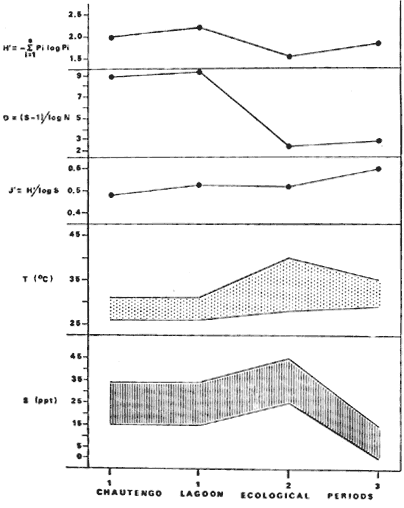 Fig. 64. Variación temporal y relaciones entre la diversidad de especies, temperatura y salinidad, en la Laguna de Chautengo. ESTRUCTURA TRÓFICA DE LOS GRUPOS A Y B Y MODELOS DE SUS ECOSISTEMASLos aspectos trofodinámicos de la ecología no han sido abordados en los estudios de comunidades lagunares y/o estuarinas en México (excepto algunos de los trabajos del autor de este estudio, aún considerando que estos conceptos fueron destacados en un trabajo pionero de Lindeman (1942). Las tramas tróficas que caracterizan a los dos grupos de lagunas son similares en el número de niveles tróficos, pero difieren en diversidad de especies de cada uno de esos niveles y en las relaciones tróficas de esos niveles (Figs. 67 y 68). GRUPO A La estructura trófica de estas lagunas está compuesta por cuatro niveles tróficos (Fig. 67). En el 1er. nivel se ubican los productos primarios: microfitobentos, pastos pantanosos, manglares y fitoplancton. Se incluye además al detritus por su origen y resultado. En el 2do. nivel se ubican todos los consumidores primarios en complejas relaciones tróficas. Desde la microfauna asociada al proceso de formación de detritus: bacterias, protozoos, hongos y nemátodos; además de macro y meio bentos incluyendo gastrópodos, bivalvos, jaibas y camarones; además, zooplancton, insectos y los peces consumidores primarios. 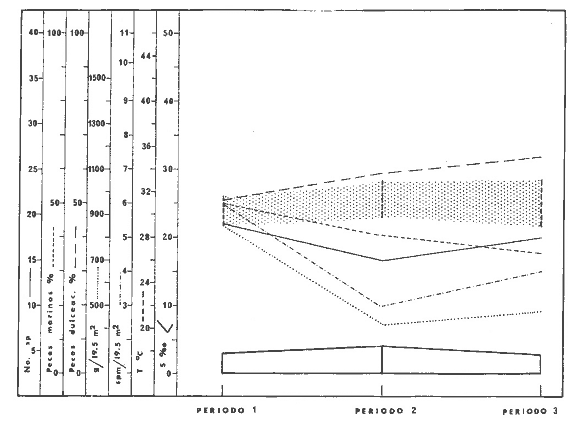 Fig. 65. Relaciones entre la diversidad, densidad, standing crop, peces marinos, peces dulceacuícolas, temperatura y sanidad, en los tres periodos ecológicos de las lagunas del Grupo B. Los valores son promedios para las tres lagunas del Grupo B y están tomados en la Tabla 47. En estas lagunas el 55 % de su ictiofauna total se encuentra presente todo el año, siendo un reflejo de la estabilidad del ambiente. 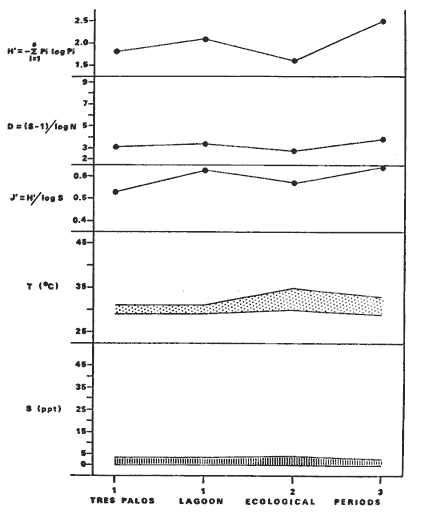 Fig. 66. Variación temporal y relación entre la diversidad de especies, temperatura y salinidad, en la Laguna de Tres Palos. 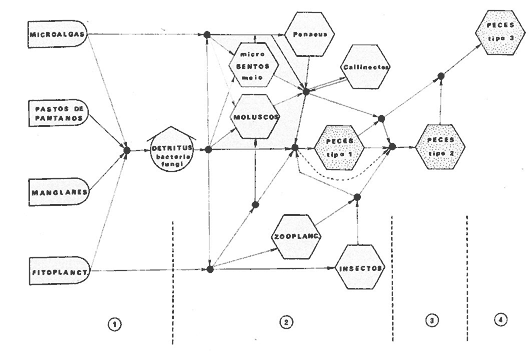 Fig. 67. Trama trófica (food web) en las lagunas del Grupo A, que reciben marcada influencia marina durante el periodo 1 del ciclo de fisiología ambiental del sistema lagunar costero de Guerrero. Las variaciones cuali y cuantitativas de los 4 niveles tróficos en el tiempo, son discutidas en el texto. Las flechas señalan las principales vías de flujo energético a través de las relaciones tróficas comunes. En el 3er. nivel se ubican los Peces consumidores secundarios, y en el 4to. nivel los peces consumidores de tercer orden y/o los carnívoros superiores. Esta trama trófica (Fig. 67) se pesenta durante el periodo 1 de todas las lagunas del Grupo A. Sin embargo, se manifiestan variaciones cuali y cuantitativas en los otros periodos. Durante el periodo 2 en el 1er. nivel disminuye la biomasa del microfitobentos y del fitoplancton. En el 2do. nivel desaparecen los camarones y los insectos de la trama trófica y si se encuentran son en realidad excepcionales; el zooplancton, los macromoluscos, las jaibas y los peces consumidores primarios disminuyen en un 50% la diversidad, la densidad y la biomasa. En el 3er. nivel los peces consumidores secundarios disminuyen en un 75% la diversidad y la densidad, y en un 50% la biomasa. En el 4to. nivel desaparecen completamente los peces consumidores de tercer orden, quedando solamente como carnívoros superiores algunas aves acuáticas. Durante el periodo 3 en el 1er. nivel se recupera la biomasa de microfitobentos y de fitoplancton por la proliferación de especies dulceacuícolas. La cantidad de detritus aumenta significativamente a un máximo de materia orgánica descompuesta acumulada en sedimentación; posteriormente gran parte de ella será exportada hacia el mar. En el 2do. nivel se recupera en un 100% la diversidad y biomasa de insectos; también se recupera en un 100% la biomasa de peces consumidores primarios pero sólo aumenta en un 25% la diversidad por presencia de especies dulceacuícolas; y se mantiene y/o disminuye ligeramente la diversidad, densidad y biomasa de macromoluscos y jaibas; los camarones no se puede recuperar puesto que no hay contacto con el mar; aumenta en un 100% la biomasa y densidad del zooplancton pero la diversidad aumenta sólo en un 25% por presencia de especies dulceacuícolas. En el 3er. nivel se recupera en un 100% la biomasa de peces consumidores secundarios, pero la densidad y biomasa sólo se recupera en un 25% por la presencia de especies dulceacuícolas. En el 4to. nivel no existen peces consumidores de tercer orden cuantitativamente importantes porque la mayoría de ellos son marinos. Los carnívoros superiores sólo están representados por aves. Componentes ictiotróficosLos componentes ictiotróficos varían en el tiempo según el periodo ecológico de las lagunas. La máxima diversidad se alcanza durante el periodo 1 y en ese momento el modelo tiene su máxima complejidad. Consumidores primarios. Los planctófagos se encuentran representados por Anchovia, Anchoa, Hyporhamphus, Ophistonema, Opisthopterus y Pliosteostoma en las zonas más salobres, y por Lile y Thyrinops en las áreas más dulceacuícolas. Eventualmente Ophistonema, Opisthopterus, Pliostoestoma y Lile pueden comportarse como carnívoros primarios puesto que la disponibilidad del alimento los hace ser a veces exclusivamente zooplanctófagos. En otros momentos todas las especies mencionadas se alimentan tanto de fito como de zooplancton. La más abundante de estas especies es Anchovia macrolepidota tanto en número como en biomasa y son particularmente importantes ya que miden hasta 130 mm de longitud patrón y formando compactos cardúmenes que se desplazan constantemente dentro de lo reducido de su ambiente ecológico, alimentándose de fitoplancton, algas filamentosas, zooplancton y en menor proporción detritus. Las Anchovia y Anchoa en general presentan un ciclo vital rápido y una fecundidad elevada, y por su gran adaptabilidad a las lagunas son muy importantes en las cadenas tróficas puesto que sirven de alimento a otros peces, a algunas aves costeras y aun al hombre. 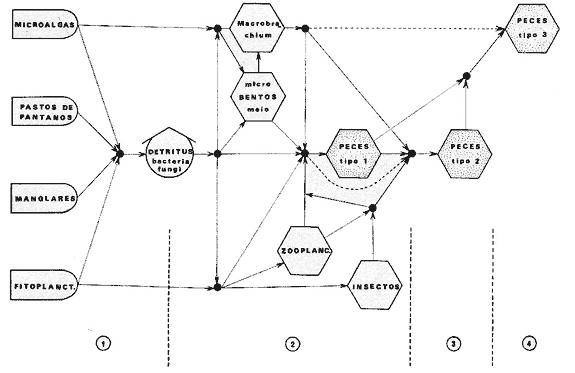 Fig. 68. Trama trófica (food web) en las lagunas del Grupo B, oligohalinas que reciben poca influencia marina durante el periodo 1 del ciclo de fisiología ambiental del sistema lagunar costero de Guerrero. Las variaciones cuali y cuantitativas de los 4 niveles tróficos en el tiempo, son discutidas en el texto. Las flechas señalan las principales vías de flujo energético a través de las relaciones tróficas comunes. Los detritívoros se encuentran representados por Mugil y Gobionellus durante todo el año y por Eleotris, Gobiomorus, Dormitator, Microgobius durante la época del periodo 3. En el ambiente pelágico lagunar es muy importante Mugil curema por sus grandes cardúmenes de juveniles durante el periodo 1 y cardúmenes de ejemplares mayores durante el resto del año; así como también es importante Gobionellus microdon en el ambiente bentónico de fondos fangosos. En comparación con los planctófagos, los detritívoros son menos abundantes en términos de diversidad pero sus poblaciones son muy densas en número de individuos, a pesar de sufrir uno de los mayores índices de predación por los niveles tróficos superiores. En el balance energético del ecosistema los detritívoros forman uno de los grupos ictiotróficos de mayor importancia ecológica por su papel de convertir energía potencial del detritus en energía utilizable por los niveles tróficos superiores además de aportar con una gran biomasa. Además algunos de ellos revisten importancia comercial para el hombre como Mugil curema (Yáñez-Arancibia, 1976a) y Dormitator latifrons (Yáñez-Arancibia y Díaz, 1977). Los omnívoros se encuentran representados por Chanos, Kyphosus, Gerres, Eugerres, Eucinostomus y Diapterus en las zonas más salobres, y por Astyanax, Cichlasoma y algunos Poecílidos en las áreas más dulceacuícolas. En este grupo las especies claves son las mojarras que se distribuyen indistintamente por todos los ambientes de las lagunas, predominando en diversidad, densidad y biomasa. Las relaciones interespecíficas dentro de estos peces son complejas y en su dieta carnívora predan sobre detritívoros y sobre otros omnívoros. Gerres, Diapterus y Eugerres son muy importantes por servir de alimento a otros peces de niveles tróficos superiores, además de aves acuáticas y al hombre. Los peces consumidores secundarios, se encuentran representados fundamentalmente por Albula, Galeichthys, Diapterus (que con frecuencia cambia a este nivel) , Elops, Pomadasys, Caranx, Oligoplites, Menticirrhus, Achirus, Trinectes, Sphoeroides y Diodon. En las cercanías de las bocas y asociados a sustrato arenoso se encuentran Achirus y Trinectes. En las zonas más salobres dominan Elops affinis, Caranx spp y Oligoplites spp distribuidos por toda la laguna. Todas estas especies tienen gran importancia comercial, pero exceptuando a Galeichthys, las restantes son visitantes cíclicos del estuario que invaden las lagunas durante el periodo 1. Su aporte en biomasa disminuye considerablemente en periodos posteriores. Las relaciones interespecíficas en este grupo son complejas puesto que además de predar sobre niveles tróficos inferiores existe predación entre ellos. Los peces consumidores de tercer orden no siempre son fáciles de determinar por cuanto muchos peces consumidores secundarios pueden cambiar a este nivel de acuerdo a la disponibilidad del alimento y aun estacionalmente. Las especies más importantes han sido Arius y Galeichthys (que en algunas épocas son exclusivamente carnívoros) , Strongylura, Centropomus, Trachinotus, Lutjanus, Micropogon, Cynoscion, Cyclopsetta, Citarichthys y Etropus con mayor frecuencia; y esporádicamente Tylosurus, Prionotus, Diplectrum y Sphyraena. En las áreas de mayor salinidad y con sustrato predominantemente fangoso se encuentran más abundantes los Centropomus, Lutjanus, Cynoscion y Micropogon, pero cerca de las bocas donde predomina el sustrato arenoso se encuentran mejor representados los lenguados. Los bagres, robalos, pargos y curvinas revisten gran importancia comercial en las lagunas y son especies muy importantes en el balance energético de las lagunas especialmente durante el periodo 1 donde son predados por aves acuáticas y por el hombre. Los tiburones y rayas (i. e., Ginglymostoma, Heterodontus, Carcharhinus y Urotrygon) no son abundantes, pero cuando excepcionalmente penetran a las lagunas se incorporan en este nivel trófico. GRUPO BLa estructura trófica de estas lagunas está compuesta por cuatro niveles tróficos (Fig. 68) de relaciones más simples que la trama trófica del Grupo A. En el 1er. nivel se ubican los productores primarios: microfitobentos, pastos pantanosos, manglares (los más abundantes) , y fitoplancton (muy abundantes en biomasa). Se incluye además al detritus (muy abundante) por su origen y resultado. En el 2do, nivel se ubican todos los consumidores primarios que por la baja diversidad tienen relaciones tróficas simples. Se incluye la microfauna asociada a los procesos de formación del detritus: bacterias, protozoos, hongos y otros; macro y meio fauna considerando gastrópodos, bivalvos y el langostino Macrobrachium tenellum; además zooplancton, insectos y los peces consumidores primarios En el 3er. nivel se ubican los peces consumidores secundarios, y en el 4to. nivel los peces consumidores de tercer orden y/o los carnívoros superiores. Esta trama trófica (Fig. 68) se presenta durante el periodo 1 de todas las lagunas del Grupo B, pero con Macrobrachium disminuido en términos de densidad y biomasa. Sin embargo se nianifiestan variaciones cuali y cuantitativas en los otros periodos. Durante los periodos 2 y 3 en el 2do. nivel se recupera la densidad y biomasa de Macrobrachium en la trama trófica. En el 3er. nivel disminuye en un 50% la diversidad, densidad y biomasa de los peces consumidores secundarios. En el 4to. nivel desaparece en un 100% la diversidad, densidad y biomasa de los peces consumidores de tercer orden. Los carnívoros superiores sólo se encuentran representados por aves acuáticas. Lo significativo de esta trama trófica es que los productores primarios permanecen con igual significación cuantitativa durante todo el año. Por otra parte, los camarones y las jaibas no juegan un papel trascendente en el balance energético del ecosistema; su ocurrencia es fugaz y poco significativa, presentándose solamente en la zona de la boca de las lagunas y durante el periodo 1. Asimismo Macrobrachium tenellum es una especie interesante en esta trama trófica; durante el periodo 1 es poco abundante y se distribuye en las áreas más dulceacuícolas de estas lagunas por lo que es poco frecuente que sea predada por peces consumidores de tercer orden que generalmente son marinos; durante los periodos 2 y 3 esta especie aumenta considerablemente pero ya no puede sufrir presiones de predación por parte de los peces consumidores de tercer orden ya que han desaparecido del ecosistema por estres de salinidad, También es interesante apreciar en esta trama trófica, y a diferencia de la trama trófica del Grupo A, que los 3 primeros niveles permanecen prácticamente inalterables durante todo el año, siendo otro aspecto que refuerza la validez de la estabilidad de esos ecosistemas. Componentes ictiotróficosLos componentes ictiotróficos varían en el tiempo pero sólo en la zona del canal de este grupo de lagunas. La mayor parte de los peces se mantiene presente todo el año con baja diversidad y en un ambiente estable. Consumidores primarios. Los planctófagos se encuentran representados por las especies de Lile y Thyrinops muy abundantes en toda la laguna. En la zona del canal se encuentran Anchovia y Anchoa. Los detritívoros forma un grupo de peces consumidores primarios extraordinariamente abundantes predominando Mugil, Eleotris, Gobiomorus, Dormitator, Microgobius, Gobionellus, Awaous. Los más importantes cuantitativamente han sido Mugil curema( Yáñez-Arancibia, 1976a) y Dormitator latifrons Yáñez-Arancibia y Diaz, 1977). Todas estas especies se encuentran todo el año y en abundantes poblaciones que aprovechan las grandes cantidades de detritus que existe acumulado en estas lagunas. La mayoría de ellas no tienen importancia comercial pero su importancia ecológica es significativa y ya se ha discutido anteriormente. Los omnívoros se encuentran representados por Gerres, Eugerres, Eucinostomus, Diapterus y Chanos que son poco abundantes, y particularmente por Astyanax, Poecilia, Poeciliopsis y Cichlasoma que son extraordinariamente abundantes y forman grandes cardúmenes de pequeños ejemplares, aprovechando la gran disponibilidad de alimento de detritus, algas filamentosas, larvas y adultos de insectos, copépodos dulceacuícolas, etcétera. Las mojarras tiene importancia comercial sólo estacionalmente y Cichlasoma prácticamente todo el año. Los peces consumidores secundarios se encuentran representados por algunos lenguados como Achirus y Trinectes en la zona arenosa del canal adyacente a la boca y especialmente durante el periodo 1. El resto de la laguna, además de la zona del canal, presenta ejemplares de Elops, Caranx, Galeichthys, Oligoplites y Diapterus. De los cuales Diapterus peruvianus y en especial Galeichthys caerulescens son los únicos verdaderamente transcendentes en estas lagunas, por su gran adaptación a ellas, su distribución y su abundancia (Yáñez-Arancibia et al., 1976). Las relaciones interespecíficas en este nivel son simples y la única especie que preda dentro de este mismo nivel es Galeichthys caerulescens. Los consumidores de tercer orden desaparecen de estas lagunas durante la mayor parte del año. Durante el periodo 1 pueden encontrarse algunos Centropomus, Lutjanus, Strongylura y algunos Sciaénidos y Bótidos, pero en los otros periodos ecológicos de las lagunas desaparecen. No son abundantes ni aún en el periodo 1. En ese momento Galeichthys caerulescens puede trasladarse a este nivel trófico. VÍAS DE FLUJO ENERGÉTICO. LA IMPORTANCIA DEL DETRITUSLas observaciones de campo y el análisis de laboratorio permiten precisar que la gran mayoría de componentes faunísticos de las comunidades (en términos de diversidad) consumen cantidades variables de detritus con mayor o menor significación cuantitativa (Figs. 67 y 68) . Como el crecimiento de algas bentónicas es muy espaciado al igual que espaciado y esporádico son los pastos marinos y pastos pantanosos, la mayor cantidad de detritus proviene de descomposición de restos de hojas de manglar en las lagunas de los Grupos A y B, agregando, con gran significación, al fitoplancton de las lagunas del Grupo B. La transcendencia de esto, determina discutir algunos antecedentes conocidos en otros ambientes estuarinos, cuyos resultados pueden, en mayor o menor medida, se aplicables como principios generales a los ecosistemas lagunares aquí estudiados. El concepto del detritus ha sido ampliamente discutido por E. P. Odum y De la Cruz (1963) y replanteado por Darnell (1967a y 1976b) Heald (1971) y Heald et al., (1974) Al respecto puede definirse como materia orgánica en cualquier estado de descomposición microbiana representando una fuente potencial de energía para consumo de las especies. De esa manera se consideran restos de plantas y animales, desde organismos completos recién muertos hasta detritus finamente particulado y aún agregados de partículas de tamaño coloidal. Este detritus siempre se encuentra asociado con bacterias, hongos y protozoos, materia orgánica disuelta y absorbida por las partículas, compuestos inorgánicos y a veces sedimentos terrígenos. El detritus representa un significativo aporte de energía disponible como alimento en muchos ecosistemas, como son: estuarios, pantanos salobres, comunidades del suelo, bosques, lagos temperados, tropicales, ríos, y aun el océano abierto (W. E. Odum, 1971). En ambientes estuarinos tropicales y subtropicales parece ser que los manglares son el principal aporte como fuente de detritus, Heald (1971) estimó que principalmente Rhizophora mangle y secundariamente Juncus sp producen 12 400 toneladas métricas de peso seco por año de restos vegetales, o bien 8.8 toneladas de peso seco por hectárea por año (2.41 g peso seco/m2/ día) de los cuales el 83% se compone de hojas. Este detritus sufre transporte, procesos y utilización variada y conforme aumenta su tasa de descomposición, aumenta su nivel nutritivo (E. P. Odum y De la Cruz, 1967; Ferguson-Wood et al., 1969; Heald, 1971). De los productores primarios indicados en el primer nivel trófico de los modelos en las figuras 67 y 68, los manglares son los más importantes en ambos grupos de lagunas y secundariamente el fitoplancton. A partir de ellos existen al menos cuatro vías de flujo energético hacia los heterótrofos: 1) Hojas de manglar y fitoplancton que proveen sustancias orgánicas disueltas --> micro organismos --> consumidores. 2) Sustancias orgánicas disueltas --> absorción por sedimentos y por detritus particulado ya existente --> consumidores. 3) Hojas y restos de hojas --> consumidores, 4) Hojas y restos de hojas --> bacterias y hongos consumidores. Las primeras dos rutas de intercambio de energía se basan sobre la rápida pérdida de sustancias orgánicas solubles en agua (véase González-Villaseñor, 1977), lo que ocurre durante las primeras semanas después que las hojas caen al agua, Estas sustancias orgánicas solubles en agua pueden ser utilizadas por bacterias y otros microorganismos o pueden ser absorbidas por partículas orgánicas e inorgánicas en suspensión o en la superficie de los sedimentos (Mac Ginitie, 1932; Bond, 1933; Pearl, 1974). Luego esas partículas y esos microorganismos pueden ser ingeridos y asimilados por invertebrados y peces. La tercera ruta puede tener significación en alguna hojas y restos de hojas todavía frescas o recién defoliadas pero al parecer no tienen importancia cuantitativa en el flujo energético por cuanto sólo algunos insectos (directamente del follaje) y algunos cangrejos y anfípodos (en hojas de pocos días en el agua) tienen la habilidad de pastorearlas. La cuarta ruta parecería ser la más importante, de manera que representa el "émbolo" en los modelos de las figuras 67 y 68. El significado trófico de las bacterias y hongos, en peces, cangrejos, larvas de insectos, anfípodos, moluscos y otros ha sido estudiado por numerosos autores y W. E. Odum (1971) detalla una discusión resumida sobre la mayoría de esos trabajos. Algunos animales las consumen como alimento directo pero otros las ingieren como ayuda digestiva para reducir metabólicamente a otro tipo de alimento (i. e., para asimilar algunas diatomeas). El proceso microbiano de descomposición de detritus y su subsecuente utilización como fuente de alimento, puede ser resumido de la siguiente manera. El detritus es atacado por bacterias y hongos los cuales comienzan la oxidación, hidrólisis y asimilación del carbono estructural básico de las partículas de detritus. Conforme avanza este proceso las bacterias son continuamente pastoreadas por protozoos (generalmente ciliados) generándose una relación (Protozoos-Bacterias-Hongos-Detritus) que representa un valioso potencial alimenticio. Esta relación es en realidad un "micro food web" dentro de la trama trófica general del ecosistema en cuestión, puesto que todo ese microscópico complejo es ingerido por los organismos detritívoros y comedores de fondo en general. Las figuras 67 y 68 representan en esquema que los consumidores de detritus son la clave de la trama trófica en las lagunas costeras de Guerrero. El PAPEL ECOLÓGICO DE LOS PECESTal como se enfatizó en la introducción de este trabajo, la complejidad ambiental de los ecosistemas lagunares y/o estuarinos hacen de su ecología un extenso y multidisciplinario tópico que no es fácil de entender en términos ordinarios. Las interacciones bióticas son difíciles de describir cuantitativamente y con frecuencia sólo tienen aplicación local. No obstante, considerando el complejo ecológico en el sentido más amplio, el significado biocenótico de los peces puede ser discutido, para las lagunas costeras y estuarios, con relativa validez y generalidad. No existen estudios específicos que discutan el papel ecológico de los peces en lagunas costeras y estuarios; sin embargo algunos trabajos sobre estructura de comunidades y aspectos cuali y/o cuantitativos del flujo de la energía, son tan útiles y básicos que deben considerarse fundamentales para la discusión aquí planteada: Hiatt (1947b), Günther (1956), Hedgpeth (1957a), Thompson (1957), Springer y Woodburn (1960), Darnell (1958 y 1961), Teal (1962), J. H. Day (1967), Mc Hugh (1967), Ferguson-Wood et al., (1969), Dahlberg y Odum (1970), Qasim (1970), Thomas et al. (197 1), W. E. Odum (197 1), W. E. Odum y Heald (1972 y 1975), W. E. Odum et al. (1973), J. W. Day et al. (1973a y 19731b) Carr y Adams (1973), Hodgkin (1973), Lenanton (1973), Nixon y Oviatt (1973), Wiley et al. (1973), Heald et al. (1974), Brook (1975), Saila (1975), De Sylva (1975 y 1976), Subralimanyam y Drake (1975), Snedaker y Brook (1976), Amezcua-Linares (1977) y Yáñez-Arancibia y Nugent (1977). Considerando la progresión de complejidad que se ha ido discutiendo en el transcurso de los diferentes capítulos de este trabajo, se comprende que el papel ecológico que juegan los peces en estos ecosistemas depende de la fisiología ambiental de las lagunas costeras y estuarios, y fundamentalmente de acuerdo a: 1) los niveles tróficos, 2) la trama trófica, 3) la tendencia del flujo energético en el ecosistema, y 4) la biología de las especies en el sistema ecológico estuarino. Evidentemente la base radica en el conocimiento del flujo de la energía. A su vez, se entiende el flujo energético sobre la base del conocimiento general de la trama trófica y en particular del conocimiento de la alimentación y hábitos alimenticios de los peces y sus espectros tróficos específicos. Este razonamiento implica una secuencia un¡direccional en la complejidad de conceptos que conducen a la determinación del papel ecológico de los peces en las lagunas costeras y estuarios. Papel Ecológico de los Peces î Flujo de la Energía î Trama Trófica o Food Web î Espectro Trófico de Cada Especie î Alimentación y Hábitos Alimenticios Para estimar la productividad biológica del necton en un estudio es fundamental conocer el comportamiento de las comunidades; i. e., crecimiento, madurez, reclutamiento, mortalidad, migración y su composición en relación a su origen y tolerancia a las salinidades. Asimismo es imperativo conocer los hábitos alimenticios de las especies y la transformación de la energía. Para entender la estructura trófica es necesario conocer de qué manera la materia orgánica se encuentra disponible para los consumidores, considerando la gran diversidad de productores primarios y su potencial de producción; por cuanto en lagunas costeras y estuarios se asume que el 10% de esa producción primaria se transforma en proteínas de peces, moluscos y crustáceos. Estos antecedentes permiten concluir que los peces desarrollan el siguiente papel ecológico dentro de las comunidades lagunares y estuarinas. Transformación del potencial energético del detritus ya sea por: a) consumo directo y/o por b) predación sobre organismos detritóvoros. De esa manera, niveles tróficos superiores continúanla progresión de la cadena alimentaria iniciada a partir del detritus. Conducción de la energía de los niveles tróficos inferiores convirténdola en energía utilizable por otros niveles tróficos. De esa manera la energía es utilizable por: a) otros peces, b) aves acuáticas y e) el hombre. Intercambio de energía con ecosistemas veci., nos por: exportación de energía a través de a) aves predadoras, b) migraciones de peces adultos para desovar en el mar, c) peces que penetran a alimentarse y se retiran luego, y d) por pesca del hombre; además por importación de energía por a) peces que penetran a alimentarse y son predados o capturados, adultos y juveniles, b) penetración de juveniles que utilizan el estuario como áreas naturales de crianza, c) adultos que penetran a desovar. Se ha encontrado que más del 80% de los peces litorales utilizan los estuarios y lagunas costeras y/o sus áreas de influencia, en algún niomento de su vida. Almacenamiento de energía a través de peces juveniles que penetran al estuario y pasan gran parte de su vida allí completando una importante etapa de su desarrollo. Losestuarios y lagunas costeras representan ecosistemas donde se alimentan, protegen, crecen y se reproducen. Por tratarse de poblaciones nectónicas, que se trasladan, entran y salen del estuario, cíclica o irregularmente, los peces desarrollan una situación de balance o de regulación energética del ecosistema. ConclusionesEste estudio entrega información para ayudar a comprender la dinámica natural en el ciclo de las lagunas costeras que presentan bocas efímeras. Este tipo de lagunas puede ser caracterizado típicamente por tener una marcada heterogeneidad espacial y teniporal de las comunidades, sucesiones y migraciones. El tabajo general propone un modelo conceptual de interpretación para este tipo particular de ecosistemas lagunares. Para CONCLUSIONES en detalle se recomienda ver el RESUMEN. La diversidad ictiofaunística y la productividad pesquera están directamente relacionadas con la influencia marina que reciben las lagunas durante el periodo 1. Las especies de peces más importantes en todo el sistema lagunar han sido: Galeichthys caerulescens, Mugil curema, Diapterus peruvianus, Dormitator latifrons y Cichlasoma trimaculatum. En general, estas lagunas presentan alta productividad primaria y además, una alta productividad pesquera pero en un periodo corto de tiempo, El mayor número de especies y biomasa se presenta durante el periodo 1. En las lagunas del Grupo A un incremento de materia orgánica por hojas de Rhizophora mangle es exportada a la plataforma continental adyacente durante el periodo 1. En las lagunas del Grupo B un incremento de materia orgánica acarreada por distributarios, por hojas de Rhizophora mangle y por florecimientos del fitoplancton, limitan el establecimiento de poblaciones de macroconsumidores por efectos ecológicos directos e indirectos (eutroficación, por ejemplo). Ambos grupos de lagunas presentan intercambio de agua con el mar adyacente, pero esto es muy limitado en las lagunas del Grupo B. En este grupo, la materia orgánica y nutrientes aportados por la agricultura local, los escurrimientos y los productores primarios del ecosistema, crean excesivas demandas de oxígeno de la columna de agua y de los sedimentos, Adicionalmente este material orgánico puede actuar como fuente de nutrientes estimulando el crecimiento del fitoplancton. La concentración de nutrientes puede ser elevada en respuesta al bajo intercambio de agua y provoca el crecimiento rápido de algas. Esta productividad de algas puede contribuir a la disminución del oxígeno. La respiración nocturna y las condiciones creadas por materia orgánica muerta son los principales causantes de mantener bajas concentraciones de oxígeno. Para la situación particular del litoral de Guerrero, el estudio forma parte de un inventario básico de información adecuada diseñado para establecer bases para la futura detección, evaluación y control de la contaminación que pudiera resultar del impacto de nuevas industrias y del turismo. En este contexto ha sido prioritario considerar la importancia que tiene un registro de la fauna y el estudio de la estructura de sus comunidades en términos de diversidad, distribución, abundancia y relaciones tróficas de las especies y poblaciones. La información contribuye además a la evaluación de los recursos bióticos del Sistema Lagunar Costero de Guerrero. Todo esto, previo a futuros cambios ambientales que pudieran resultar de las actividades humanas. AgradecimientosInstituciones y personas han tenido que ver en forma directa o indirecta en la existencia de estos estudios que representaron, en parte, la tesis doctoral del autor. A todas ellas se les está infinitamente agradecidos. La Organización de los Estados Americanos (O. E. A.) por cuyo intermedio y a través de una beca FEMCIEC 34474 se realizó la primera parte de los estudios de posgrado entre 1973 y 1974. El Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México por todas las facilidades y apoyo Tecibidos a través de la dirección y una beca otorgada durante 1975 para finalizar los estudios de posgrado. La Comisión del Río Balsas de la entonces Secretaría de Recursos Hidráulicos del gobierno de México bajo cuya gestión se financió gran parte de las actividades de campo de este trabajo entre 1973 y 1975 en un programa de investigación denominado: "Uso de la zona costera de los estados de Michoacán y Guerrero y su óptiaprovechamiento." Contratos de Estudios No. OC-E03-73 y No. OC-E-03 74. Al Dr. Galo Gómez Oyarzún (en 1973 vicerrector de la Universidad de Concepción, Chile); profesor Mario Ricardi Salinas (en 1973 director del Instituto de Biología de la Universidad de Concepción) ; Dr. Victor Ariel Gallardo (en 1973 jefe del Departamento de Biología Marina y Oceanografía del Instituto de Biología de la Universidad de Concepción); Dr. Lisandro Chuecas y profesor Hugo, Saelzer (de aquella misma institución); sus apoyos para realizar estudios de posgrado en México. Al Dr. José Stuardo (moluscos y ecología del bentos), M. en C. Alfredo Martínez Guerrero (zooplancton), M. en C. Jorge A. Weinborn (crustáceos), Biol. José Ruiz (vegetación acuática y semiacuática), M. en C. Sergio Licea Durán (fitoplancton) , ingeniero Lisandro Castellanos (hidrología) , su ayuda trabajando en colaboración en la misma área y sus valiosos datos comunicados en numerosos informes técnicos, Al Dr. Richard S. Nugent (entre 1973 y 1976 experto de UNESCO en Biología Marina en el Centro de Ciencias del Mar y Limnología de la UNAM) actualmente en NUS Corporation Ecological Sciences Division, T-1. S. A., la dirección de este estudio, su gran ayuda bibliográfica y su incondicional apoyo para continuar desarrollando investigaciones en ecosistemas lagunares-estuarinos. Igualmente al Dr. Agustín Ayala-Castañares (coordinador de la Investigación Científica en la UNAM) su constructivo interés en asuntos de Ciencias del Mar y su gran apoyo durante el desarrollo de este trabajo. Al Dr. Alfredo Laguarda Figueras (director del Centro de Ciencias del Mar y Limnología de la UNAM), Dr. Antonio García-Cubas, Dr. Gerardo Green, Dr. Enrique Boschi Dr. Luis Capurro y Dr. Craig Kensler, todos de la misma institución, por leer el manuscrito en algunas etapas de su desarrollo haciendo valiosos comentarios y atinadas sugerencias. Por esto último agradezco al Dr. John W. Day, Jr. (Louisiana State University), Dr. William E. Odum (University of Virginia), Dr. Pierre Lasserre (Université de Bordeaux, Arcachon) A los compañeros del Laboratorio de Ictiología y Ecología Estuarina; M. en C. Felipe Amezcua Linares su ayuda con algunos problemas taxonómicos; Biól. Ernesto Bravo Núñez la catalogación de la colección de referencia y su ayuda en algunos cálculos estadísticos; Biól. Violeta Leyton Vargas su ayuda durante algunas colectas del material y el posterior procesamiento de algunos análisis tróficos. A Edna Clara Hernández la escritura de parte del manuscrito. LITERATURAALBERTINE-B., J., Aquaculture Biologie des stades juveniles de téleostéens Mugilidae Mugil auratus Risso 1810, Mugil capito Cuvier 1829 et Mugil saliens Risso 1810. 1. Regimen alimentaire. 1973. 251-266. 2: ALLEN, L G. y M. H. HORN, Estuar. Coast. mar. Sci. Abundance, diversity and seasonality of fishes in Colorado Lagoon, Alamitos Bay, California 1975. 371-380. 3: ÁLVAREZ DEL V., J., Peces Mexicanos (Claves). Inst. Nac. Inv. Biol, Pesq,, Com. Nal. Consul. Pes., 1970. 166 p.,62 figs. ALVAREZ DEL V., J. y F. AGUILAR, Revta. Soc. mex. Hist. Nal. Contribución al conocimiento de la suspensión gonopódica del género Poeciliopsis, con descripción de una nueva especie fósil, procedente de El Salvador, Centro América. 1957. 153-172. (1-4): 18 ALVAREZ DEL V., J. y M. T. CORTÉS, An. Esc. nac. Cienc. biol., Méx. Ictiología michoacana. I. Claves y catálogo de las especies conocidas. 1962. 85-142. (1-4): 11 AMEZCUA-LINARES, F. Aportación al conocimiento de los peces del sistema de Agua Brava, Nayarit. Tesis profesional, Fac. Ciencias, Univ. Nal. Autón. México. 1972. 209 p., 14 láms. AMEZCUA-LINARES, F. An. Centro Cienc, del Mar y Limnol. Univ. Nal. México Generalidades ictiológicas del sistema lagunar costero de Huizache-Caimanero, Sinaloa, México. México, 1977. 1-25. (1) : 1 ARPI, B., L. I. GONZÁLEZ-VILLASEÑOR, A. VÁSQUEZ-BOTELLO, A. ORTEGA y V. MARTÍNEZ Informe Final 1ra. Elapa Programa Uso de la Zona Costera de Michoacán y Guerrero. Convenio Comisión del Río Balsas, S. R. H., y Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México. Contrato de. Estudios No. OC-E-03-73, Informe sobre la pre-investigación hidrográfica en las lagunas costeras del estado de Guerrero, In: 1974. 43 p., 15 tabl., 48 map. AYALA-CASTAÑARES, A. I Seminario Latinoamericano Sobre el Océano Pacífico Oriental, Lima, Perú: Algunos estudios de geología marina en lagunas litorales mexicanas y su posible proyección al Océano Pacífico Oriental en los países latinoamericanos. 1966. 173-175. BAKUS, G. J. Int. Review Gen. Exper. Zool. Energetics and feeding in shallow marine waters. 1969. 275-369. 4: BAILEY, R. M., J. E. FITCH, E. S. HERALD, E. A. LACIINER, C. C. LINDSEY, C. R. ROBINS y W. E. SCOTT, Amer. Fish. Soc., Spec. Publ. A list of common and scientific names of fishes from the United States and Canada. 3th Ed. 1970. 1-150 6: BALL, R. C., Tech. Bull. Michigan st. Call, Agr. Esp. Sta. Relationships between available fish food, feeding habits of fish and total fish production in a Michigan Lake. 1948. 1-59. 206: BARDACH, J. E., J. H RYTHER Y W. O. Mc LARNEY, Aquaculture. The Farming and Husbandry of Freshwater and Marine Organisms. Wiley-Interscience New York, 1972. 868 p. BARNHART, P. S., . Marine Fishes of Southern California Univ. California Press. 1936. 209 p., 290 figs BASHEERUDIN, S. y K. NAGAPPAN NAYAR, Indian J. Fish. A preliminary study of the juvenile fishes of the coastal waters off the Madras city. 1961. 169-188. (1) 8 BASHIRULLAH, A. K. M., Bol. Inst. Oceanogr. Univ. Oriente Biology of Lutjanus griseus (L.) of the Cabagua Island, Venezuela. I. lengthweight, body lengthgut length relationships and condition factor. 1975. 101-107. (1) : 14 BEEBE, W. y J. TEE-VAN, Zoologica The fishes of Port-Au Prince Bay, Haiti. 1928. 1-279. (1): 10 BEEBE W. y J. TEE-VAN, Zoologica Fishes from the tropical Eastern Pacific (From Cedros Island, Lower California, South to the Galapagos Island and Norther Perú). Eastern Pacific Expedition of the New York Zoological Society. 28. 1941. 89-92, 93-122, 245-280, 39 figs., 4 láms. (1):, (2):, (3): 26 BERDEGUE, J., Contribución al conocimiento de los peces de importancia comercial en la costa noroccidental de México. Tesis profesional Esc. Nal. Ciencias Biológicas, IPN México, 1954. 360 p., 50 láms. BERDEGUE, J. Peces de importancia comercial en la costa noroccidental de México. Secretaría de Marina, Dir. Gral. Pes. Ind. Con. México, 1956. 345 p., 206 figs, BERG, L. S. Classification of the Fishes, both Recent and Fossil. Russian and English Lithoprint. 1947, Edwards, L. W. (Ed.), Ann Arbor, Michigan: 1940. 517 p. BERRY, D. H. y I. BARRET, Bull. Inter, Am. trop, Tuna Comm. Gillraker analysis and speciation in the thread-herring, genus Opisthonema, 1963. 1-153. (2): 7 BETCHEL T. J. y B. J. COPELAND, Publ. Inst. Mar. Sci. Univ. Texas Fish species diversity indices as indicators of pollution in Galveston Bay, Texas. 1970. 103-132. 15: BOND, R. M., Bull. Bingham Oceanogr. Coll. A contribution to the study of the natural food cycle in aquatic environment, with particular consideration of micro organisms and dissolved organic matters. 1933. 1-89. (4): 4 BONETTO, A., W. DIONDI Y C. PIGNALBERDI, Physis, Nuevos datos sobre las poblaciones de peces en ambientes lénticos permanentes del Paraná Medio. B. Aires 1970. 54-141. (80): 30 BOULENGER, G, A., Proc. Zool. Soc. London Catalogue of the fishes in the collection of the British Museum Ed. II, 1895. 1-524. 1: BRAND, D. D., The Hague Coalcoman and Motines del Oro, Mich. 1960. 403 p.: 270-285. BREDER, C. M. Bull. Bingham Oceanogr. Coll. Nematognathi, Apodes, Isospondyli, Synentognatlii, and Thoracostraci from Panama to Lower California with a generic analysis of the Exocoetidae. Scientific Results, of the Second Oceanographic Expedition of the "Pawnee", 1926. , 1928. 1-25, (2): 2 BREDER, C. M. Bull. Bingham Oceanogr. Coll. Heterosomata to Pediculati from Panama to Lower California. Scientific results of the Second Oceanographic Expedition of the "Pawnee", 1926. , 1936. 1-56. (3): 2 BRIGGS, J. C., Marine Zoogeography Mc Graw-Hill. Book Company 1974. 475 p., figs.-texto. BRITTAN, M. R., Ichthyologica The Aquarium Journal A small collection of shore fishes from the west coast of Costa Rica. 1966. 121-134. (3): 37 BROOK, I. M. Some aspects of the tropic relationships among the higher consumers in a seagrass community (Thalassia testudinum Konig) in Card Sound, Florida. Ph. D. Dissertation University of Miami, 1975. 133 p. BROOK, I. M. Trans. Amer. Fish. Soc., Trophic relationships in a seagrass cominunity (Thalassia testudinum) in Card Sound, Florida. Fisco diet in relation to macrobenthic and cryptic faunal abundance. 1977. 219-229. (3): 106 CAIN, R. L. y J. M. DEAN, Mar. Biol. Annual occurrences, abundance, and diversity of fish in a South Carolina intertidal creak. 1976. 369-379. 36: CÁRDENAS, F. M. Lagunas Costeras un Simposio. Mem. Simp. Intern. Lagunas Costeras. UNAM-UNESCO, México, Nov. 28-30, 1967 Pesquerías en las lagunas litorales de México Ayala-Castañares, A. y F. B. Phleger (Eds.) 1969. 645-652. CARLES, C. A., Datos sobre la biología del banano Elops saurus Linnaeus (Teleostómi: Elopidae) Centro de Investigaciones Pesqueras. La Habana, 1967. 1-53. 27: CARR, W. E. S. y C. A. ADAMS, Trans. Amer. Fish Soc. Food habits of juvenile marine fishes occupying seagrass beds in the estuarine zone near Crystal River, Florida. 1973. 511-540. 102: CARRANZA-EDWARDS, A,, M. GUTIÉRREZ-ESTRADA y R. RODRÍGUEZ-TORRES, An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México Unidades morfo-tectónicas continentales de las costas mexicanas. 1975. 81-88. (1): 2 CARRANZA, J., 1er Informe Secretaría de Recursos Hidráulicos e Instituto de Biología Univ. Nal. Autón. México. Contrato de Estudios No. El-63-51, 31 Reconocimiento preliminar de la fauna ictiológica en las áreas de los Planes Piloto Escuinapa y Yavaros y programa de las investigaciones. 1969a. p., 12 figs., 2 láms. CARRANZA, J. 2do. Informe Secretaría de Recursos Hidráulicos e Instituto de Biología Univ, Nal. Autón. México. Contrato de Estudios No. El-69-51, 33 Primer informe sobre el estudio taxonómico de la fauna de peces de los planes pilotos Escuinapa y Yavaros. 1969b. p., 14 figs., 3 map. CARRANZA, J. 3er. Informe Secretaria de Recursos Hidráulicos e Instituto de Biología, Univ, Nal. Autón. México. Contrato de Estudios No. El-69-51, 50 Informe preliminar sobre alimentación y hábitos alimenticios de las prinicipales especies de peces de las zonas de los planes pilotos Yavaros y Escuinapa. 1969c. p., 7 figs. CARRANZA, J. Informe Final Secretaría de Recursos Hidráulicos e Instituto de Biología Univ. Nal. Autón. México. Contrato de Estudios No. El-69-51, 28 Informe final sobre la primera etapa del estudio de la fauna ictiológica y depredadores del camarón en las lagunas y esteros de los planes pilotos Escuinapa y Yavaros. 1970. p., 5 figs. CARRANZA, J. y F. AMEZCUA-LINARES, 2da. Parte Informe Secretaría de Recursos Hidráulicos e Instituto de Biología. Univ. Nal. Autón. México. Contrato de Estudios No. NAY-EST-7:58-80, Plan Nayarit, S. R. H. Informe de avance de trabajo, incluyendo información ecológica básica, datos de distribución de postlarvas e informe preliminar sobre fauna ictiológica en el sistema Teacapán-Agua Brava 1971a. 1 fig. CARRANZA, J. y F. AMEZCUA-LINARES, 2da. Parte Informe Final Secretaría de Recursos Hidráulicos e Instituto de Biología. Univ. Nal, Autón. México. Contrato de Estudios No. NAY-EST7:88-115. 1969. Plan Nayari t, S. R. H. Resultados finales de hidrología, plancton y fauna ictiológica en el sistema Teacapán-Agua Brava. 1971 b. 177-199. CARVAJAL, J., Bol. Inst. Oceanogr. Univ. Oriente Contribución al conocimiento de la biología de los robalos Centropomus undecimalis y C. poeyi en la Laguna de Términos, Campeche, México. 1975, 51-70. (1) : 14 CASTELLANOS L. Informe Final 2da. Etapa Programa Uso de la Zona Costera de Michoacán y Guerrero. Convenio Comisión del Río Balsas, S. R. H. y Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México. Contrato de Estudios No. OC-E-03-74, Subprograma de Hidrología. 1975. 44 p., 66 tabl., 46 figs. CASTRO, J. L. An. Inst. Nal. Inv. Biol. Pesq. Peces sierra, rayas, mantas y especies afines de México. 1965. 170-256. 1: CASTRO, J. L. Contribución al estudio de los tiburones de México. Tesis profesiona Esc. Nal. Ciencias Biológicas, IPN. México, 1967. 256 p. Mem. VI Congr. Latinoam. Zool. México, (presentación y resumen) Aspectos zoogeográficos de los peces marinos que penetran aguas continentales en México. 1974. CASTRO, J. L., J. ARVIZU y J. PÁEZ, Revta. Soc. mex. Hist. Nat. Contribución al conocimiento de los peces del Golfo de California. 1970. 107-181. 31: CASTRO, J. L., MA. DE J. PARRA y F. DE LA CHICA, Mem. V Congr. Oceanogr. México, (presentación y resumen), Los peces de las lagunas oriental y occidental, Oaxaca, y sus relaciones con la temperatura, y salinidad. 1974. CERVIGON, F. Ecología Marina. Los Peces Margalef, R. (Ed.) Fundación La Salle de Ciencias Naturales Caracas, 1967. Cap. 10:308-355, 156 figs. CERVIGON, F. Los Peces Marinos de Venezuela. Monogr. Estación de Investigaciones Marinas de Margarita, Fundación La Salle de Ciencias Naturales Caracas, 1966. 1-951, 385 figs. 11 y 12: CHACKO, P. J., Proc. Indian Acad. Sci. Food and feeding habits of the fishes of the Gulf of Mannar. 1949. 83-97. (3): 29 CHÁVEZ, E. A., Mem. IV Congr. Nac. Ocean. (México), Nov. 17-19, 1969. Notas acerca de la ictiofauna del estuario del Río Tuxpan y sus relaciones con la temperatura y la salinidad. Carranza, J. (Ed.) 1972. 177-199. CHÁVEZ, M., Ciencia Méx., Contribución al conocimiento de la biología de los robalos, chucumite y constantino (Centropomus spp) del estado de Veracruz (Pisces; Centropomidae). 1963. 141-160. (5): 22 CHIMITS, P. FAO Fish. Bull. The tilapias and their culture. A preliminary bibliography. 1955. 1-33. (1) : 8 CHIMITS, P. FAO Fish. Bull. The tilipias and their culture A second review and bibliography. 1957. 1-24. (1) : 10 CHIRICHIGNO, N. Bol. Inst. Mar Perú-Callao, Nuevos registros para la ictiofauna marina del Perú. 1968. 377-504, 39 figs. (8): 1 CHIRICHIGNO, N. Conferencia sobre Explotación y Conservación de las Riquezas Marítimas del Pacífico Sur. Lista Sistemática de los Peces Marinos Comunes para Ecuador-Perú-Chile. Comisión Permanente del Pacífico Sur, 1969. 108 p., 160 figs, CHIRICHIGNO, N. Inf. Inst. Mar Perú-Callao Clave para identificar los peces marinos del Perú. 1974. 1-388, 643 figs 41: CLARK, E., Amer. Mus. Novitates, Notes on some Hawaiian Plectognath fishes, including a key to the species. 1949. 1-22. 1397: CLARO, R. y V. I. LAPIN, Academia Ciencias Cuba Serie Oceanológica Algunos datos sobre la alimentación y la dinámica de las grasas de la biajaiba, Lutjanus synagris (Linnaeus) en el Golfo de Batabano, plataforma sur de Cuba. 1971. 1-16. 10: CLARO, R. y V. I. LAIPIN, Academia Ciencias Cuba Serie Oceanológica Variabilidad de algunos parámetros bioquímicos en órganos y tejidos de la biajaiba (Lutianus synagris L.) durante el proceso de maduración gonadal. 1973. 1-18. 17: COMAS-VIÑAS, L., Algunos aspectos biológico-pesqueros de la sardina crinuda Ophisthonema libertate Günther 1868 en la región de Guaymas, Sonora, México 1974/75. Tesis profesional Fac. Ciencias Univ. Nal. Autón. México 1976. 85 p., 16 figs., 16 tablas. COPELAND, B. J. y W. S. BIRKHEAD, First Annual Report lo Carolina Power and Light Co., Raleigh, N. C. Some ecological studies of the lower Cape Fear River estuary, ocean out fall and Dutchman Greek, 1971. 1972. 1-105. 71: CROKER, R. A., Trans. Amer. Fish. Soc. Growth and food of the gray snapper, Lutianus griseus in Everglades National Park 1962. 379-383, (4): 91 CRONIN, L. E. y A. J. MANSUETI, A Symposium on the Biological Significance of Estuaries. Sport Fishing Institute, The biology of the estuary. In; Douglas, P. H. y R. H. Strout (Eds.). Washington, D. C.; 1971. 14-39. CURRAN, H. W., A systematics revision of the gerrid fishes referred to the genus Eucinostomus, with a discussion of their distribution and speciation. Ph. D. dissertation Univ. of Michigan 1942. 183 p. CUVIER, G. y A. VALENCIENES, Histoire Naturelle des Poissons 1-22 texto, 1-4 atlas 650 láms. Paris. 1828-1849. DAHL, G., Los Peces del Norte de Colombia. INDERENA, Bogotá, 1972. 391 p. DAHLBERG, M. D. y E. P. ODUM, Amer. Midl. Natur. Annual cycle of species occurrence, and diversity in Georgia estuarine fish populations. 1970. 382-392. 83: DALL, W., Proc. World Sci. Conf. Biol, and Culture of Shrimps and Prawns, FAO Fish. Rep. Food and feeding of some Australian penacid shrimps, 1968. 251-258. (2): 57 DARNELL, R. M., Publ. Inst. Mar. Sci. Univ. Texas Food habits of fishes and larger invertebrates of Lake Pontchartrain, Louisiana, and estuarine community. 1958. 353-416. 5: DARNELL, R. M. Ecology Tropic spectrum of an estuarine community based on studies of Lake Pontchartrain, La. 1961 553-568. (3) : 42 DARNELL, R. M. Publ. Inst. Mar. Sci. Univ. Texas, Fishes of the Río Tamesi and related coastal lagocins, in East-Central México. 1962. 299-365. 8: DAY, J. H., Estuaries. Publ. Amer. Ass. Adv. Sci. The biology of Knysna estuary, South Africa. In: Lauff, G. H. (Ed.) 1967. 397-407. 83: DAY, J. W., W. G., SMITH Y C. S. HOPKINSON, Proceeding of the Second Coastal Marsh and Estuary Management Symposium. Louisiana State University, Baton Rouge, La., jul. 1972: Some tropic relationships of marsh and estuarine arcas. Chabreck, R. H. (Ed.) 1973a. 115-135. DAY, J. W., W. G. SMITII, P. WAGNER Y W. STOWE, Publ. No. LSU-56-72-04 Center for Wetland Resources Louisiana State University Community structure and carbon budget of a salt marsh and shallow bay estuarine system in Louisiana Baton Rouge, La. 1973b. 79 p. DE BUEN, F. Trab. Est. Limnol. Patz. Lista de peces de agua dulce de México. En preparación de su catálogo. 1940 1-66 2: DE BUEN, F. An. Inst. Biol. Univ. Nal. Autón México, Poeciliopsis en las cuencas de los ríos Lerma y Marqués, con descripción de dos nuevas especies (Pisces: Poeciliidae). 1943. 262-283. (1) : 14 DE BUEN, F. Revta. Soc. mex. Hist. Nat. Ictiogeografía continental mexicana, (I, II, III) . 1947. 87-138. (1-4): 7 DE BUEN, F. Rev. Biol. Mar. Univ. Chile Lampreas, tiburones, rayas y peces en la Estación de Biología Marina de Montemar, Chile 1959. 3-200. (1, 2 y 3): 9 DE BUEN, F. Rev. Biol. Mar. Univ. Chile Tiburones, rayas y quimeras en la Estación de Biología Marina de Montemar, Chile. 1960. 150, 16 figs. (1, 2 y 3) : 10 DE SYLVA, D. P. Estuarine Research, Nektonic food webs in estuaries. Cronin, L. E. (Ed.) Academic Press New York 1975. 420-447. 1: DE SYLVA, D. P. Biscayne Bay: Past/Present/Future. Symposium University of Miami, April 2-3, 1976: Fishes of Biscayne Bay, Florida. Thoraug, A. y A. Volker (Eds.) 1976. 181-202. DE SYLVA, D. P., F. A. KALBER y C. N. SCHUSTER, Inf. Ser. Univ. Mar. Labs. Delaware Fishes and ecological conditions in the gone of the Delaware River Estuary, with notes on the other species collected in deeper waters. 1962. 1-164. 5: DÍAZ, E. L. FAO Fish. Tech. Pap. Roma Bibliographic material on the fishes of Colombia and Northern South America. 1965. 172. 53: DILL, W. A. y C. WOODHULL, Elops affinis. Calif. Fish. and Game A game fish for the Salton Sea, the tenpounder 1942. 171-174. (4): 28 DULLMAN, W. E., Univ. Kansas Publ. Mus. Nat. Hist. A biographic account of the herpetofauna of Michoacán, México. 1965. 639-650. (14): 15 EBELING, A. M., Copeia The dentition of Eastern Pacific mullets, with special reference to adaptation and taxonomy. 1957. 173-185. 3: EGUZA, S. Bull. Jap. Soc. Sci. Fish. Some notes on the feeding habits of the young Mugil cephalus Linnaeus. 1950. 715-720. (11): 15 EIGENMANN, R. S., Amer. Natur. New California fishes. 1891. 153-156. (291): 25 EIGENMANN, C. H. y R. S. EIGENMANN Occ. Pap. Cal. Ac. Sci. A revision of the South America Nematognathi; or catfishes. 1890. 1-508, 57 figs. 1: EKMAN, S. Zoogeography of the Sea. Sidwick and Jackson London 1953. 419 p., figs.-texto. ESTÉVEZ, J., Aspectos generales de la biología y ecología del mejillón Mytella strigata (Hanley, 1843) en dos lagunas costeras del estado de Guerrero. Tesis profesional Fac. Ciencias, Univ. Nal. Autón. México. 1975. 63 p., 11 tablas, 11 figs., 3 mapas, 10 láms. EVERMANN, B. W. y H. W. CLARK, Proc. Cal. Ac. Sci., Ser. 4 Description of two new species of fishes from off Cape San Lucas, Lower California. 1928. 685-688, láms. 27-28. (2): 26 EVERMANN, B. W. y S. E. JENKINS, Proc. U. S. Nat. Mus. Report upon a collection of fishes made at Guaymas, Sonora, México, with descriptions of new species. 1891. 121-165. 14: EVERMANN, B. W. y S. E. MEEK, Proc. Ac. Nat. Sci. Phila.: A review of the species of Gerres found in American waters. 1883. 116-124. EVERMANN , B. W. y S. E. MEEK, Proc. Ac. Nat. Sci, Phila.: A revision of the American species of the genus Gerres. 1886. 256-272. EVERMANN, B. W. y L. RADCLIFFE, Bull. U. S. Nat. Mus. The fishes of the west coast of Perú and the Titicaca Basin. 1917. 1466, 14 láms. 95: FERGUSON-WOOD, E. J., W. E. ODUM Y. J. C. ZIEMAN, Lagunas Costeras, un Simposio, Mem. Simp. Intern. Lagunas Costeras. UNAM-UNESCO; México, Nov. 28-30, 1967: Influence of sea grasser on the productivity of coastal lagoons. Ayala-Castañares, A. y F. B. Phleger (Eds.) 1969. 495-502. FITCH, J. E. Fish. Bull. Cal. Fish. and Game, Distributional notes on some Pacific coast marine fishes. 1952. 557-564. (4): 38 FITCH, J. E. Fish. Bull. Cal. Fish. and Game Extensions to known geographical distributions of some marine fishes on the Pacific coast. 1953. 539-552. (4): 39 FOWLER, H. W., Proc. Ac. Nat. Sci. Phila. A second collection of fishes from the Panama Canal Zone. 1916-1917. 127-136, 2 figs. 69: FOWLER, H. W. Bol. Mus. Hist. Nat. "Javier Prado", Los peces del Perú. 1941a. 218-236, 8 figs. (17): 5 FOWLER, H. W. Bol. Mus. Hist, Nat. "Javier Prado" Los peces del Perú. 1941b. 363-391, 22 figs. (18): 5 FOWLER, H. W. Bol. Mus. Hist. Nat. "Javier Prado", Los peces del Perú. 1943. 275-293. (26-27): 7 FOWLER, H. W. Bol. Mus. Hist. Nat. "Javier Prado", Los peces del Perú. Catálogo sistemático de los peces que habitan en aguas peruanas. 1945 1. 1-298, 92 figs. GARCÍA E. Modificaciones al Sistema de Clasificación Climática de Koppen (para adaptarlo a las condiciones de la República Mexicana). Instituto de Geografía Univ. Nal. Autón. México, 1973. 246 p. GARMAN, S., Mem. Mus. Comp. Zool. Harv. Reports on an exploration off the west coast of México, Central and South America, and off the Galapagos Islands, in charge of Alexander Agassiz by the U. S. Fish Comission steamer Albatross during 1891. 1899. 1-431, 1-431, 97 láms. 24: GILBERT, Ch. H. Description of twenty-two new species of fishes collected by the steamer Albatross, of the United States Fish Comission. Proc. U. S. Nat. Mus. 1897. 437-457, láms. 49-55. 19: GILBERT, Ch, H. y E. Ch. STARKS, Mem. Cal. Ac. Sci. The fishes of Panama Bay. 1904. 1-304, 33 láms. 4: GILL, T. N., Proc. Ac. Nat. Sci. Phila., 1862; Catalogue of the fishes of Lower California in, the Smithsonian Institution, collected by Mr. J. Xantus. 1862. 140-151; 242-246; 249-262. 1:, 2:, 3: GILL, T. N. Proc. Ac. Nat. Sci. Phila., 1863, Catalogue of the fishes of Lower Calitornia in the Smithsonian Institution, collected by Mr. J. Xantus. 1863. 80-88. 4: GILL, T. N. Proc. Ac. Nat. Sci. Phila., 1863 Descriptive enumeration of a collection of fishes from the western coast of Central America, presented to the Smithsonian Institution by Capt. John M. Dow. 1864. 162-180. GINSBURG, I. Bull. Bingham Oceanogr. Coll. A revision of the genus Gobionellus (Family Gobiidae) 1933. 1-50. (2): 4 GINSBURG, I. Fish. Bull. Fish and Wildl. Service Flounders of the genus Paralichthys and related genera in American waters. 1952. 267-351, 15 láms. (71): 52 GIRARD, Ch. F. House of Rep. Ex. Doc. Fishes. Part 4 of reports of explorations and surveys to ascertain the most practicable and economical route for a railroad from the Mississippi River to the Pacific Ocean 1858. 1-400, láms. 1-76. (91): 10 GONZÁLEZ-VILLASEÑOR, L. I. Aspectos biológicos y distribución de algunas especies de peces de la familia Ariidae de las lagunas litorales del noroeste de México. Tesis profesional Fac. Ciencias, Univ. Nal. Autón. México 1972. 88 p., 33 figs., 30 tablas. GONZÁLEZ-VILLASEÑOR, L. I. An. Centro Cienc. del Mar y Limnol. Univ, Nal. Autón. México Estudio preliminar sobre contenido de ácidos orgánicos coloridos en el agua de lagunas costeras de Guerrero, México 1977. 243-248. (1) : 4 GOPALAKRISHNAM, V. Coastal Aquaculture in the Indo-Pacific Region. Mem. Indopacific Fisheries Council Symposium on Coastal Aquaculture, Bangkok, Thailand, Nov. 18-21, 1970: Taxonomy and biology of tropical fin-fish for coastal aquaculture in the IndoPacific region. Pillay, T. V. R. (Ed.). 1972. 120-149. GNERI, F. S. y V. ANGELESCU, Rev. Inst. Nac. Invest. Cienc. Nal. Museo Arg. Cienc. Zool. La nutrición de los peces iliófagos en relación con el metabolismo general del ambiente acuático. 1951. 1-144. (1): 2 GREEN, J. The Biology of Estuarine Animals. University of Washington Press Seatle 1968. 401 p. GREENWOOD, P. H., D. E. ROSEN, S. H. WEITZMAN y G. S. MYERS, Bull. Am. Mus. Nat. Hist. Phyletic studies of teleosteans fishes, with a provissional classification on living forms. 1966. 341-455. (4): 131 GREENWOOD, P. H., G. S. MYERS, D. E. ROSEN y S. H.WEITZMAN, Proc. Biol. Soc. Wash. Named main division of Teleostean fishes. 1967. 227-228. 80: GREY, M. Fieldiana Zoology Catalogue of type specimens of fishes in Chicago Natural History Museum 1947. 109:205. (3); 32 GUDGER, W., Zoologica The gaff-topsail, Felichthys felis, a sea catfish that carries its eggs in its mouth. 1916. 123-158 (5): 2 GUERRA-CAMPOS, A. y A. K. M. BASHIRULLAH, Bol. Inst. Oceanogr. Univ. Oriente Biología del pargo Lutianus griseus (L.) de la Isla de Cubagua, Venezuela. II. Maduración sexual y fecundidad. 1975. 109-116. (1): 14 GÜNTER, G., Ecol. Monogr. Seasonal variations in abundance of certain estuarine and marine fishes in Louisiana, with reference to life history, 1938. 313-346. 8: GÜNTER, G. Publ. .Inst. Mar. Sci. Univ. Texas, Studies on marine fishes of Texas. 1945. 1-190. (1): 1 GÜNTER, G. Amer. Midl. Natur. A revised list of euryhalin fishes of north and middle America. 1956. 345-354. (2): 56 GÜNTHER, A. C.,. Catalogue of the Fishes in the Collection of the British Museum 1859. 1-524, 21 láms. 1: GÜNTHER, A. C. Proc. Zool. Soc. London, 1861 On a collection of fishes sent by Cap. John M. Dow from the Pacific coast of Central America, 1861a. 370-376. GÜNTHER, A. C. Catalogue of the Fishes in the Collection of the British Museum. 1861b. 1-586, 21 láms. 3: GÜNTHER, A. C. Catalogue of the Fishes in the Collection of the British Museum. 1864. 1-534, 22 láms. 5: GÜNTHER, A. C. Catalogue of the Fishes in the Collection of the British Museum 1866. 1-500, 20 láms. 6: GÜNTHER, A. C. Catalogue of the Fishes in the Collection of the British Museum. 1868. 1-512, 20 láms. 7: GÜNTHER, A. C. Trans. Zool. Soc. London, An account of the fishes of the s tates of Central America, based on collection made, by Capt. J. M. Daw, F. Goodman y O. Salvin. 1869. 377-494, láms. 64-87. 6: GUZMÁN-ARROYO, M. Informe Final 3ra. Etapa Programa Uso de la Zona Costera de Michoacán y Guerrero. Convenio Comisión del Río Balsas, S. R. H. y Centro Cienc. del Mar y Limnol, Univ. Nal. Autón. México. Contrato de Estudios No. OC-E 03-75. Biología, ecología y pesca del "langostino de laguna" Macrobrachium tenellum (Smith, 1871) (Decapoda, Palaemonidae) en la Laguna de Mitla, Gro., México. 1975. HAEDRICH, L. R. y S. O. HAEDRICH, Estuar. Coast. mar. Sci. A seasonal survey of the fishes in the Mystic River, a polluted estuary in downtown Boston, Massachusetts. 1974. 59-73. 2: HARDER, W. Bull. Inter. Am. trop. Tuna Comm. The intestine as a diagnostic character in identifying certain clupeids (Engraulidae, Clupeidae, Dussermieriidae) and a morfometric character for comparing anchoveta population. 1958. 373-387. (8): 2 HARIMA, H. y P. R. MUNDY, Trans. Amer. Fish. Soc. Diversity indices applied to the fish biofacies of a small stream. 1974. 457-461. 103: HARRINGTON, R. W. y E. S. HARRINGTON, Ecology Food selection among fishes invading a high subtropical salt marsh; from onset of flooding throught the progress of a mosquito brood. 1961. 646-660. (4): 42 HARRIS, A. H. y C. D. ROSE, Trans. Amer. Fish. Soc. Shrimps predation by the sea catfish Galeichthys felis 1968. 503-504. (4): 97 HART, J. L.,J. Fish. Res. Board Can. Bull. Pacific fishes of Canada Ottawa, 1973. 1-740. 180: HEALD, E. J., University of Miami. Sea Grant Technical Bulletin The production of organic detritus in a South Florida Estuary, 1971. 1-110. 6: HEALD, E. J., W. E. ODUM y D. C. TABB, Miami Geol, Soc. Mem. Mangroves in the estuarine food chain. Environment of South Florida: Past and Present. Gleason, P. J. (Ed.) 1974. 182-189. 2: HEDGPETH, J. W. Treatise on Marine Ecology and Paleoecology. Geol. Soc. America, Mem.67 Estuaries and Lagoons. Il. Biological Aspects, Hedgpeth, J. W. (Ed.) 1957a. 673-750. 1: HEDGPETH, J. W. Treatise on Marine Ecology and Paleoecology, Geol. Soc. America Mem. 67 Obtaining ecological data in the sea. Hedgpeth, J. W. (Ed.) 1957b. 359-382. 1: HEDGPETH, J. W. Treatise on Marine Ecology and Paleoecology. Geol, Soc. America, Mem. 67 Marine biogeography Hedgpeth, J. W. (Ed.) 1957c. 359-382. 1: HELLIER, T. R., Publ. Inst. Mar. Sci. Univ. Texas Fish production and biomass studies in relatión to photosynthesis in the Laguna Madre of Texas. 1962. 212-215. 8: HESTER, J. W. y B. J. COPELAND, University of North Carolina. Sea Grant Program Publ. UNC-SG-75-02, Nekton population dynamics in the Albermal Sound and Neuse River estuaries. 1975. 129 p. HIATT, R. W. Trans. Amer. Fish. Soc., 1944, Food chains and food cycle in Hawaiian fish ponds. Part 1. The food and feeding habits of mullet (Mugil cephalus) milk fish (Chanos chanos) and the ten-pounder (Elops machnata) . 1947a. 250-261. 74: HIATT, R. W. Trans. Amer. Fish. Soc., 1944 Food-chains and food cycle in the Hawaiian fish ponds. Part II. Biotic Interaction. 1947b. 262-280. 74: HILDEBRAND, H. H., Ciencia Mex. Estudios biológicos preliminares sobre la Laguna Madre de Tamaulipas. 1958. 151-173, (7-9): 17 HILDEBRAND, H. H., Lagunas Costeras, un Simposio. Mem. Simp, Intern. Lagunas Costeras. UNAM-UNESCO, Nov. 28-30, 1967 Laguna Madre, Tamaulipas; Observations in the hydrography and fisheries, Ayala-Castañares, A. y F. B. Phleger (Eds.) 1969. 679-686. HILDEBRAND, S. F. Bull. Bingham Oceanogr. Coll. A review of the American anchovies (Family Engraulidae). 1943. 1-165, 72 figs. (2): 8 HILDEBRAND, S. F. Bull. U. S. Nat. Mus. A descriptive catalog of the shore Fishes of Perú. 1946. 1-530, 95 figs. 189: HILDEBRAND, S. F. y W. C. SCHROEDER, Bull. U. S. Bureau Fish. Comm. Fishes of Chesapeake Bay 1928. 1-366. (1): 43 HILLMAN, R. E., N. W. DAVIS Y J. WENNEMER, Stuar. Coast. mar. Sci. Abundance, diversity, and stability in shore zone fish communities in an arca of Long Island Sound affected by the thermal discharge of Nuclear Power Station. 1977. 355-381. 5: HIYAMA, T., T. KUMADA, S. ARITA, K. TOMITA y S. MURAMAM, Peces Marinos de la Costa Mexicana del Pacifico. Kumada, T. (Ed.) Hansiti Printing Co., Japón y Talls. Gráfs. de la Nación, México, 1940. 78 p. 102 láms. HODGKIN, E. P., Symposium on the Impact of Human Activities on Coastal Zones. University of Sidney Australia UNESCO Committee for Man and Biosphere. Publ. Biological aspects of coastal zone development in Western Australia: 1. General Aspects. 1973. 93-111, 6 figs. 1: HOESE, H. D. y R. S. JONES, Publ. Inst. Mar. Sci. Univ. Texas Seasonality of larger animals in a Texas turtle grass community. 1963. 37-47. 9: HOESE, H. D., B. J. COPELAND, F. N. MOSELEY y E. D. LANE, Tex. J. Sci. Fauna of the Aransas Pass inlet, Texas. III Diel and seasonal variations in trawlable organisms of the adjacent area. 1968 33-60 20 HOFF, G. J. y R. M. IBARRA, Estuar. Coast. mar. Sci. Factors affecting the seasonal abundance, composition and diversity of fish in a Southeastern New England estuary. 1977 665-678 5 HOLCIK, J., Vestnik, Cs. spol. Zool. (Acta Zoc. Zool. Bohemoslov.) Standing crop, abundance, production, and some ecological aspects of fish population in some inland waters of Cuba. 1970 184-201 34 HORN, M. H. y L. G. ALLEN, Bull. South. Cal. Acad. Sci. Number of species and faunal resemblance of marine fishes in California bays and estuaries. 1976 159-170 (2) 75 HOLGUÍN-QUIÑONES, 0. E., Catálogo de especies marinas de importancia comercial en Baja California Sur. Inst. Nal. de Pesca, México 1976 117 HUBBS, C. L., Misc. Publ. Mus. Zool. Univ. Mich. Studies of the fishes of the order Cyprinodontes. VI. Material for a revision of the American genera and species. 1926 1-87 16 HUBBS, C. L. The Biogeography of Baja California and Adjacent Seas. The marine vertebrate of the outer coast. Part II. 1960 134-147 (3-4) 9 HUBBS, C. L. y R. ISHIYAMA, Copeia Methods for the taxonoinic study and description of skates (Rajidac) 1968 483-491 3 HUNT, B. P. Trans. Amer. Fish. Suc. Focid relationship between Florida spotted gar and other organisms in the Tamiami Canal, Dade Country. Florida 1953 13-33 82 IDYLL, C, P., D. C. TABB y B, YOKEL, Proc. First Marsh and Estuary Management Symposium The value of estuaries to shrimps. Baton Rouge, Louisiana 1967 83-90 JACOT, A. P., Trans. Amer. Micr. Soc. Age, growth and scale characters of the mullet Mugil cephalus and M. curema 1920 199-229 39 JANSSON, A-M, Helgolander wiss Meeres-unters. The food-web of the Cladophorabelt fauna. 1967 578-588 15 JENKINS, 0. P. y B. W. EVERMANN, Proc. U. S. Nat. Mus. Description of eighteen new species of fishes from the Gulf of California, 1889 137-158 11 JHINGRAN V. G., Bull. Centr. Inl. Fish. Res. Inst. Report on the fisheries of the Chilka lake 1957-60. 1963 1-113 1 JHINGRAN, V, G, y A. V. NATARAJAN, Bull. Centr. Inl. Fish Res, Inst., 8 . Final report on the fisheries of the Chilka lake (1957-65), 1966 JOB, T. J., Rec. Indian Mus. An investigation on the nutrition of the perches of the Madras coast. 1940 289-364 42 JORDAN, D. S., Stanford Publ. Biol. Sci. A classification of fishes. 1923 79-243 3 JORDAN, D. S. y CH, H. BOLLMAN, Proc. U. S. Nat. Mus. Scientific results of explorations by the U. S. Fish Commission steamer Albatross. IV. Description of new species of fishes collected at the Galapagos Island and along the coast of the United States-Colombia in 1877-88. 1890 149-183 12 JORDAN, D. S. y C. H. EIGENMANN, Rept. U. S. Comm. Fish. for 1886. A review of the Sciaenidae of America and Europe. 1889 343-451,12 figs., 4 láms. JORDAN, D. S. y B. W. EVERMANN, Bull U. S. Nat. Mus. The fishes of North and Middle America. 1896-1900 1-3313, 398 láms., 958 figs. (47) 1-4 JORDAN, D. S, y CH. H. GILBERT, Proc. U. S. Nat. Mus. List of the fishes collected by Lieut. Henry E. Nichols, U. S, N., in the Gulf of California and on the west coast of Lower California, with description of four new species. 1882 a. 273-279 4 JORDAN, D. S. y CH. H. GILBERT, Proc. U. S. Nat. Mus. Description of thirty-three new species of fishes from Mazatlán, México. 1882b. 338-365 4 JORDAN, D, S. y CH. H. GILBERT, Bull. U. S. Fish Comm. for 1881 Description of ninetccn new species of fishes from the Bay of Panama. 1882c. 306-318 1 JORDAN, D. S. y CH. H. GILBERT Proc. U. S. Nat. Mus. Description of four new species of sharks, from Mazatlán, México. 1882d. 102-110 5 JORDAN, D, S. y CH. H. GILBERT, Proc. U.S. Nat. Mus. Catalogue of the fishes collectcd by Mr. John Xantus at Cape San Lucas, which are now in the United States National Museum, with description of eight new species. 1882e. 353-371 5 JORDAN, D. S. y CH. H. GILBERT, Bull. U.S. Nat. Mus. Synopsis of the fishes of North America. 1883a. 1-1018 16 JORDAN, D. S. y CH. H. GILBERT, Proc. U.S. Nat. Mus. List of the fishes now in the Museum of Vale College, collected by Prof. Frank H. Bradley, at Panamá with description of three new species. 1883b. 620-632 5 JORDAN, D. S. y CH. H. GILBERT, Proc. U.S. Nat. Mus. Description of two new species of fishes (Myrophis vafer and Chloroscombrus orqueta) from Panama. 1883c. 645-647 5 JORDAN, D. S. y CH, H. GILBERT, Bull. U. S. Fish. Comm. for 1882, List of the fishes collected at Mazatlán, México, by Charles H. Gilbert. 1883d. 105-108 2 JORDAN, D. S. y CH. H. GILBERT, Bull. U. S. Fish. Comm. for 1882, List of the fishes collected at Panama by Charles H. Gilbert. 1883e. 109-111 2 JORDAN, D, S. y D. K. Goss, Rep. U. S. Comm. Fish and Fisheries for 1886, A review of the flounders and soles (Pleuronectidae) of Arnerica and Europe. 1889 225-342, 9 láms., 23 figs, JORDAN, D. S. y C. L. HUBBS, Leland Stanford Jr. Univ. Publ. Univ. Ser. Studies in Ichthyology A monographic review of the family of Atherinidae or silversides, 1919 1-87, 12 láms., 42 figs. JORDAN, D. S., B. W. EVERMANN y H. W, CLARK, Bull. U. S. Bureau of Fisheries Comm. Check list of the fishes and fish-like vertebrates of North and Middle America north of the boundaries of Venezuela and Colombia. 1930 1-670 2 JORDAN, D. S., E. CH. STARKS, G. B. CULVER y T. M. WILLIAMS, Proc. Cal. Ac. Sci., Ser. 2 The fishes of Sinaloa. 1895 377-614, láms. 27-55. 5 JORDAN, E,, M. ANGOT y R. DE LA TORRE, An. Centro Cienc. del Mar y Limnol. Univ. Nal, Autón. México. Prospección biológica de la Laguna de Nichupté, Cancún, Q. Roo: Nota Científica. 1978 179-188 (1) 5 KATO S., S. PRINGER Y M. H. WAGNER, U. S. Fish Wild. Serv. Bureau of Comm. Fisheries, Field guide to Eastern Pacific and Hawaiian Sharks. 1967 1-47 271 KAWANABE, H A. DE LA CRUZ y E. P. ODUM, Energy flow in a Spartina marsh tide pool. University of Georgia (mimeografiado). 1965 KENDALL, W. C. y L. RADCLIFFE, Mem. Mus. Comp. Zool. Harvard Report of the scientific rcsults of the exploration to the eastern tropical Pacific by the Albatross. The shore fishes. 1912 77-171, 8 láms. (3) 35 KEJLSON, M. A,, G. N. JOHNSON y R. L. WATSON, Annual Report tu the Atomic Energy Commission. Biomass and densities of the fish and macrovertebrates of a New Port estuary, North Carolina. In: Rice T. R. U. S. Dept. Commerce National Marine Fisheries Service, Beaufort, N. C. 1973 169-182 KNAPP, F. T., 1949. Trans. Amer. Fish. Soc. Menhaden utilization in relation to the conservation of food and game fishes of the Texas Gulf coast. 1949 137-144 79 KNER, R. y F. STEINDACHNER, Abh. Akad. Wiss. Munchen Neue Gattungen und Arten von Fischen aus Central-Amerika, gesammelt von Prof. Moritz Wagner. 1864-1865 1-61, 5 láms. 10 KNER, R. y F. STEINDACHNER, Sitzb. Akad. Wiss. Wien. Neue Fishe aus dem Museum der Herren Joh C. Godeffrog und Sohn in Hamburg. 1866 356-395, láms. 1-5, 18 figs. 54 KOBELKOWSKY, A. y A. RESÉNDEZ, An. Inst. Biol. Univ. Nal. Autón, México, Ser. Cienc. del Mar y Limnol. Estudio comparativo del endosqueleto de Mugil cephalus y Mugil curema (Pisces: Perciformes) 1972 33-84, 31 láms. (1) 43 KOEPCKE, H. W., Biata, Lista de los peces marinos conocidos del Perú, con datos de su distribución geográfica. Primera parte. 1962a. 1-17 (29) 4 KOEPCKE, H. W. Biota Lista de los peces marinos conocidos del Perú, con datos de su distribución geográfica. Segunda parte. 1962b. 193-204 (32) 4 KOEPCKE, H. W. Biota Lista de los peces marinos conocidos del Perú, con datos de su distribución geográfica. Tercera parte. 1962c. 193-204 (33) 4 KOEPCKE, H. W. Biota Lista de los peces inarinos conocidos del Perú, con datos de su distribución geográfica. Cuarta parte. 1963a. 237-258 (34) 4 KOEPCKE, H. W. Biota Lista de los peces marinos del Perú, con datos de su distribución geográfica, Quinta parte. 1963b. 325-352 (36) 4 KOEPCKE, H. W. Biota Lista de los peces marinos conocidos del Perú con datos de su distribución geográfica. Sexta parte. 1964 141-181 (40) 5 LAGLER, K. F., J. M. KAPETSKY y D. J. STEWART, Univ. Michigan Tech. Rept. FAO, Rome, No. FI:SF/ZAM II Tech, Rept. The fisheries of the Kafue flats, Zambia, in relations to the Kafue Gorge dam' 1971 1-161 1 LANKFORD, R. R. Informe Ira, Etapa Programa Uso de la Zona Costera de Michoacán y Guerrero. Convenio Comisión del Río Balsas, S. R. H., y Centro Cienc. del Mar 1, Limnol. Univ, Nal. Autón. México, Contrato de Estudios No. OCE-03-73, Descripción general de la zona costera de Michoacán y Guerrero. 1974 42 p. LANKFORD, R. R. Estuarine Processes. Estuarine Research Federation Conference, Galveston, Texas, Oct. 6-9, 1975. Coastal lagoons of México. Their origin and clasification. In: Wiley, M. (Ed.) Academic Press Inc. New York 1977 182-215 2 LANKFORD, R. R., M. GUTIÉRREZ-ESTRADA y A. CARRANZA-EDWARDS, Informe Final 2da. Etapa Programa Uso de la Zona Costera de Michoacán y Guerrero. Convenio Comisión del Ría Balsas, S. R. H., y Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México. Contrato de Estudios No. OC-E-03-74 Subprograma de geología. 1975 6 p. LENANTON, R C. J Symposium on the Impact of Human Activities on Coastal Zones. Biological aspects of coastal development in Western Australia: II. Fish, crustacean and birds. University of Sidney Australia UNESCO Committee for Man and Biospliere. Publ. 1973 112-126, 6 figs 1 LEON, E. P., Rev. Biol. Trop. Ecología de la ictiofauna del Golfo de Nicoya, Costa Rica, un estuario tropical. 1973 5-30 (1) 21 LICEA-DURÁN, S., M. E. GÓMEZ y E. GÓMEZ Informe Final 2da. Etapa Programa Uso de la Zona Costera de Michoacán y Guerrero. Convenio Comisión del Río Balsas, S. R. H., y Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México. Contrato de Estudios No. OC-E-03-74, Informe de avance del estudio del fitoplancton en 5 lagunas del estado de Guerrero, México (Resultados preliminares), noviembre 1974. 1975 750 p. LICEA-DURÁN, S., M. E, GÓMEZ y E. GÓMEZ Informe Final 3ra. Etapa Programa Uso de la Zona Costera de Michoacán y Guerrero. Informe final de estudio del fitoplancton en 5 lagunas costeras del Estado de Guerrero (1974-1975). Convenio Comisión del Río Balsas, S. R. H., y Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México. Contrato de Estudios No. OC-E-03-75, 1976 750 p. LINDEMAN, R. L., Ecology The trophic-dynamie aspect of ecology. 1942. 399-418. (4): 23 LINDNER, M. J., Trans. Amer. Fish. Soc. The commercial marine fisbes, crustaceans and molluscs of the West coast of México. 1947. 71-80 71: LINNAEUS, C., Systema Naturae ... . Pisces. Holmiae Ed. 10 1758. 239-338. 1: LINNAEUS, C. Systema Naturae ... Pisces. Holmiae. Ed. 12, 1766. 419-532. 1: LINTON, E. Parasites of fish of Beaufort. Bull. U. S. Bureau of Fisheries Comm. 1904. 321-428. 24: LINTON, T. L. y W. L. RICKARDS, Quart. J. Fla. Acad. Sci. Young caminan snook on the coast of Georgia. 1965. 185-189. (2): 28 LIVINGSTON, J. R. Estuar. Coast mar. Sci. Diurnal and seasonal fluctuations of organismos in a North Florida estilarse. 1976. 373-400 1: LONGLEY, W. H. y S. F. HILDEBRAND, Pap. Tortugas Lab. Systematic catalogue of the fishes of Tortugas Florida. 1941. 1-331. (535): 34 LÓPEZ, R. B., Rev. Mus. Argentino Cienc. Nat. Bernardino Rivadavia, Hidrobiología Problemas sobre la distribución geográfica de los peces marinos surarnericanos. 1963. 111-135. (3): 1 LOWE-MC CONNELL, R. H., Fish Communities in Tropical Freshwaters. Longman Inc. New York 1975. 337 p. LUJÁN, .J. L., Estudio bromatológico de una población de Ruppia maritima L. de la Laguna de Nuxco, Gro., México, con generalidades sobre su Ecología e importancia alimenticia. Tesis profesional Fac. Ciencias Químicas, Univ. Nal. Autón. México, gs. 1975. 38 p., 3 mapas, 11 tablas, 9 figs. LUKEN, CH. F., Vid. Meddel. Natarh. Foren. Kjobenhavn, 1873: Nogle nye eller mindre fuldstaendigt kjendte Pandsermaller, isaer fra det nordlige Sydamerika. 1874 202-220 MAC GINITIE., G, E., Science The role of bacteria as food for bottorD animals. 1932. 490. (1978): 76 MAGO, F. M. L., Acta Venez., Estudios preliminares sobre la ecología de los peces de los llanos de Venezuela. 1970. 71-102. 7: MANN, G. Vida de los Peces en Aguas Chilenas. Inst. Invest. Bacteria. Santiago Chile 1954a. 342 p. MANN, G. Inv. Zool. Chilenas El mar chileno y sus regiones biogeográficas. 1954b. 75-86, 2 figs. (5): 2 MARGALEF, R., Perspectives in Ecological Theory. The University of Chicago Press. Chicago 1969. 111 p. MARSHALL ADAMS, S., J. exp. mar. Biol. Ecol. The ecology of ee1grass, Zostera marina (L.) fish communities I. Structural analysis. 1976. 269-291. 23: MARTÍNEZ-GUERRERO, A. Informe Final 3ra. Etapa Programa Uso de la Zona Costera de Michoacán y Guerrero, Convenio Comisión del Río Balsas, S. R. H., y Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. Contrato de Estudios No. OC-E-03-75 Informe final del estudio del Zooplancton en 5 lagunas del sistema lagunar costero de Guerrero, México. México. 1975. 750 p. MARTÍNEZ-GUERRERO, A. Distribución y variación estacional del zooplancton en cinco lagunas costeras del Estado de Guerrero, México. An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México 1978. 201-214. (1): 5 MASSAY-CAMPOZANO, SH., Estudio sistemático de la familia Carangidae en aguas ecuatorianas. Tesis profesional Fac. Ciencias Químicas y Naturales Univ. Guayaquil. 1967. 115 p., 28 figs. Mc ERLEAN, A. J., S. C. O'CONNOR, J. A. MIHURSKY y C. I. GIBSON, Estuar. Coast. mar. Sci. Abundance, diversity, and seasonal patterns of estuarine fisli population 1973. 19-36. (1): 1 MC HUGH, J. L., A Symposium on Estuarine Fisheries. Amer. Fish. Soc. Spec. Publ. Management of estuarine fisheries. 1966. 133-154. 3: MC HUGH, J. L. Estuaries. Publ. Amer. Ass. Adv. Sci. Estuatine nekton. Lauff, G. H. (Ed.) 1967. 581-619 83: MC HUGH, J. L. Estuarine fisheries ave they doomed? Estuarine Research Federation, Galveston, Texas, 6-9 Oct., 1975. (presentation and abstract) 1975. MC HUGH, J. L. y J. E. FITCH, Fish. Bull. Calif. Dept. Fish. Game. An annoted list of the clupeoid fishes of the Pacific coast, from Alaska to Cape. San Lucas, Baja California. 1951. 491-495 (4): 37 MC PHAIL, J. D., Trab. de Divulgación Dir. Gral. Pes. Ind. Con. México, 1-28 (mimeografiado). Clave para los sciaenidos (Sciaenidae) del Pacífico Oriental. Trad. Rodolfo Ramírez Granados 1960. MEAD, G. W., Scientific Exploration of the South Parific. A history of South Pacific fishes. Standar Book 1970. 236-251. (309-01755-6): MEEK, E. S. Field colum. Mus. Zool. Ser. The fresh-water fishes of Mexico north of the Isthmus of Tehuantepec. 1902-1904. 51-252, 17 láms 72 figs. MEEK, E. S. y S. F. HILDEBRAND, Field Mus. Nat. Hist. Publ., Zool. Ser. The marine fishes of Panama 1923. 1-330, 24 láms. (215): 15 MEEK, E. S. y S. F. HILDEBRAND, Field Mus. Nat. Hist. Publ., Zool. Ser. The marine fishes of Panama. 1925. 330-707, 47 láms. (226): 15 MEEK, E. S. y S. F. HILDEBRAND, Field Mus. Nat. Hist. Publ., Zool. Ser. The marine fishes of Panama. 1928. 707-1045, 47 láms (249): 15 MILLER, D. J. y R. N. LEA, Fish Bull. Cal. Dept. Fish. Game Guide to the coastal marine fishes of California. 1972. 1-235. 157: MILLER, R. R., Proc. U. S. Nat. Mus. Hyporhamphus patris a new species of hemiramphidae fish from Sinaloa, México, with and analysis of the generic characters of Hyporhamphus and Hemirhamphus. 1945. 185-192. 96: MILLER, R. R. Occ. Pap. Mus. Zool. Univ. Michigan Four new species of viviparous fishes, genus Poeciliopsis, from Northwestern México. 1960. 1-11, 2 láms 619: MILLER, R. R. Copeia Geographical distribution of Central American freshwater fishes. 1966. 773-802 4: MILLER, R. R. Fieldiana Zoology An evaluation of Seth E. Meek's contributions to Mexican Ichthyology. 1976. 1-31. (1): 69 MILLER, R. R. y A. CARR, Copeia Systematics and distribution of some freshwater fishes from Honduras and Nicaragua, 1974. 120-125 1: MILLER, J. M. A trawi survey of the shallow Gulf fishes near Port Aransas, Texas. Publ. Ins. Mar. Sci. Univ. Texas 1965. 80-107. 10: MORPOW J. E., Bull. Bingham Oceanogr. Coll. Shore and pelagic fishes from Perú, with new records and the description of a new species of Sphoeroides. 1957. 5-55. 16: MOSELEY, F. N. y B. J. COFELAND, Publ. Inst. Mar. Sei. Univ. Texas A portable drop-net for representative sampling of nekton. 1969 37-45. 11: MUSS, B. J. The Fauna of Danish Estuaries and Lagoons. Kobenhavn. Andr. Fred, Host and Spn Bianco, Lunos Bogtrykkeri A/S., 316 p. 1967. NYELSEN, I. G., Vidensk. Meddr. densk naturh. Foren., bd. Notes on some Heterosomata (Pisces) from NW South Anierica with the description of a new genus and species and a new subespecies of Paralichthinae 1963. 337-400, 3 lám 125: NIXON, S. W. y C. A. OVIATT, Zostera marina, Ecology Preliminary measurement of midsummer metabolism in beds of eelgrass, 1972. 150-153. 53: NIXON, S, W, y C. A. OVIATT, Ecol. Monogr. Ecology of a New England salt marsh, 1973 463-498. 13: NORMAN, J. R., A Systematic Monography of the Flatfishes (Heterosomata), Psettodidae, Bothidae, Pleuronectidae. The Trustees of the British Museum (Natural History). London 1934. 1-459, 317 figs. 1: NORMAN, J. R. A Draft Synopsis of the Orders, Families and Genera of Recent Fishes and Fish-like Vertebrates. The Trustees of the British Museum (Natural History), London 1966. 649 p. ODUM, E. P. y A. DE LA CRUZ, A. I. B. S. Bull. Detritus as a major component of ecosystems. 1963. 39-40. (3): 13 ODUM, E. P. y A. DE LA CRUZ, Estuaries. Publ. Amer. Ass. Adv. Sci. Particulate organic detritus in a Georgia salt marsh-estuarine ecosystem. Lauff, G. H. (Ed.) 1967. 383-389 83: ODUM, H. T. y B. J. COPELAND, Coastal Ecological Systems of the United States A functional classification of the coastal ecological systems. In: Odum, H. T., B. J. Copeland y E. A. McMaban (Eds.) The Conservation Foundation Wash. D. C., National Oceanic Adminstration, 1974. 5-84. 1: ODUM, W. E. The food and feeding of the striped mullet, Mugil cephalus, in relation to the environment., , M. S. Thesis Institute of Marine Sciences, University of Miami Miami, Florida. 1966. 118 p. ODUM, W. E. Limnol. Oceanogr. The ecological significance of fine particle selection by the striped mullet Mugil cephalus. 1968a. 92-98. (1): 13 ODUM, W. E. Chesapeake Sci. Mullet grazing a Dinoflagellate bloom. 1968b. 202-204. (3): 9 ODUM, W. E. Proc. Symposium on Marine Food Chains, Edimburgo. Oliver and Boyd. Utilization of the direct grazing and plant detritus food chains by the striped mullet Mugil cephalus Steek, J. (Ed.). London: 1970. 222-240. ODUM, W. E. Sea Grant Program Tech. Bull. Pathways of energy flow in a South Florida estuary. 1971. 1-162. 7: ODUM, W. E. y E, J. HEALD, Bull. Mar. Sci. Trophic analyses of an estuarine mangrove community. 1972. 671-738 (3): 22 ODUM, W, E. y E. J. HEALD, Estuarine Research. The detritus-based food web of an estuarine mangrove community. In: Cronin, L. E. (Ed.) Academic Press. New York 1975. 265-286 1: ODUM, W. E., J. C. ZlEMAN y E. J. HEALD, Proceeding of the Second Coastal Marsh and Estuary Management Symposium. Louisiana State University, Baton Rouge, La., Jul. 1972: The importance of vascular plant detritus to estuaries Chabreck, R. H. (Ed.). 1973. 91-114. OLIVIER, S. R., R. BASTIDA y M. R. TORTI, Ser. Hidr. Naval, Argentina, H. 1025 Sobre el ecosistema de las aguas litorales del Mar de Plata. Niveles tróficos y cadenas alimentarias pelágico-demersales y bentónico-demersales. 1968. 45 p. OLIVIER, S. R., A. ESCOFET, P. PENCHAZZADEH y J. M. ORENSANZ An. Soc. Cient. Argentina Estudio ecológico de la región estuarial de Mar Chiquita (Buenos Aires, Argentina). II. Relaciones tróficas interespecíficas. 1972. 89-104. 194: OVIATT A. C. y S. W. NIXON, Estuar. Coast mar. Sci. The demersal fish of Narragansett Bay: An analysis of conimunity structure, distribution and abundance. 1973. 361-378. 1: PARR, A. E., Heterosomata, Pleuronectidae. Bull. Bingham Oceanogr. Coll. 1931. 13-16 (1): 4 PARKER, R. H. y W. G. BLANTON, Environmental factors affecting bay and estuarine ecosystems of the Texas coast. Coastal Ecosystems Management, Inc. Fort Worth, Texas No. PB. 1970-42, 182 p. 1970. PATNAIK, D. A., Proc. All-India Congr. Zool. On the biology of Mugil cephalus Linnaeus of the Chilka Lake. 1966. 457-464. (2): 2 PEARL, H. W. Limnol. Oceanogr. Bacterial uptake of dissolved organic matter in relation to detrital aggregations in marine and freshwater systems, 1974 966-972 (6): 19 PEARCY, W. G. y S. W. RICHARDS, Ecology Distribution and ecology of fishes of the Mystic River estuary, Connecticut. 1962 248-259. 43: PEARSE, A. S. Pap. Tortugas Lab. Animals in brackish waters ponds and pools at Dry Tortugas. 1932 125-142. 27: PENNAK, R. W., Fresh-water Invertebrates of the United States. The Ronald Press Co. New York 1953. 769 p. PETERSON, C. L., Bull. Inter. Am. trop. Tuna Comm. Observations on the taxonomy, biology and ecology oí the Engraulid and Clupcid fishes in the Gulf of Nicoya, Costa Rica. 1956. 138-280. (5): 1 PlANKA, E. R., Amer. Natur. Latitudinal gradients in species diversity: a review of concepts. 1966. 33-46. (910): 100 PILLAY, T. V. R., In the food and feeding adaptations of the gray inullet Mugil lade Forskal. Sci. and Cult. 1953. 261-262 (6): 16 PILLAY, T. V. R. (Ed.) Mem. Indo-Pacific Fisheries Council Symposium on Coastal Aquaculture, Bangkok, Thailand, Nov. 18-21, 1970. Coastal Aquaculture in the Indo-Pacific Region. FAO Fishing New (Books) Ltd. 1972. 497 p. POEY Y ALOY, F., Memorias Sobre la Historia Natural de la Isla de Cuba. La Habana, 1860-1861. 1-463, 34 láms: 1-442, 19 láms. 1-2: 2: POOLE, R. W., An Introduction to Quantitative Ecology. McGraw-Hill New York 1974. 532 p. PRABHAKARO RAO, A, V., J. Mar. Biol. Ass. India Observations en the food and feeding habits of Gerres oyena (Forskal) and Gerres filamentosus Cuvier from the Pulical lake with notes en the food of allied species. 1968. 332-346. (2): 10 QASIM, S. Z., Proc. Symposium Marine Food Chains. Edimburgo, Oliver and Boyd Some problems related to the food chain in a tropical estuary. Steele, J, H. (Ed.) London: 1970. 46-51. RAMÍREZ-HERNÁNDEZ, E., An. Inst. Nal. Inv. Biol. Pesq. Estudio preliminar sobre los peces marinos de México. México, 1965. 258-292. 1: RAMÍREZ-HERNÁNDEZ, E. Peces marinos de importancia comercial en el noroeste de México. Tesis profesional Ese. Nal. Ciencias Biológicas, I. P. N. 1968 172 p. RAMÍREZ-HERNÁNDEZ, F. y M. L. SEVILLA, . Lista preliminar de los recursos pesqueros de México, marinos y de agua dulce. Secretaría de Industria y Comercio, Dir. Gral, Pes. Ind. Conn., México (mimeografiado: 1-42). 1963 RAMÍREZ-HERNÁNDEZ, E. y J. ARVIZU, An, Inst. Nal. Inv, Biol-Pesq., Investigaciones ictiológicas en las costas de Baja California. I. México 1965. 293-324. 1: RAMÍREZ-HERNÁNDEZ, E. y J. PÁEZ, An. Inst. Nal. Inv. Biol.-Pesq. Investigaciones ictiológicas en las costas de Guerrero. I. México, 1965, 327-358. 1: RAMÍREZ-HERNÁNDEZ, E., G. CARRILLO y D. LLUCH, Investigaciones ictiológicas en las costas de Chiapas. Lista de peces colectados en las capturas camaroneras (agosto-septiembre, 1959 y abril-mayo-junio, 1960). Secretaría de Industria y Comercio., Dir. Gral. Pes. Ind. Conn. México, Publ. Inst. Nal. Inv. Biol.-Pesq. 1964. 1-17. 5: RAMÍREZ-HERNÁNDEZ, E., N. VÁZQUEZ, R. MÁRQUEZ Y C. GUERRA, Publ. Inst. Nal. Inv. Biol.-Pesq. Investigaciones ictiológicas en las costas de Sinaloa. 1. Lista de peces colectados en las capturas camaroneras (agosto 1961; abril-octubre, 1962 mayo-septiembre, 1963). Secretaría de Industria y Comercio, Dir. Gral. Pes. Ind, Conn. México. 1965. 1-36 12: RAMÍREZ-GRANADOS, R., Revta. Soc. mex. Hist. Nat. Estudio ecológico preliminar de las lagunas costeras cercarias a Acapulco, 1952. 199-218 13: RANDALL, J. E. Grazing effect on sea-grasses by hervivorous reef fishes in the West Indies. Ecology 1965. 255-260. (2): 46 RANDALL, J. E. Stud. trop. Oceanogr. Food habits of reef fishes of the West Indies. Miami 1967 665-847. 5: REID, G. K., Bull. Mar. Sci. Golf Caribb.. An ecological study of the Golf of México fishes in the vecinity of Cedar Key, Florida. 1954. 1-94. (1): 4 REID, G. K. The Texas Journal of Science A summer study of the biology and ecology of Eeast Bay, Texas. Part 1: Introduction, description of area, methods, some aspects of the fish community, the invertebrate fauna. 1955a 316-343. (3): 7 REID, G. K. The Texas Journal of Science A summer study of the biology and ecology of East Bay, Texas. Part II: The fish fauna of east bay, the gulf beach and summary. 1955b. 430-453 (4): 7 REID, G. K,; A, INGLIS y H. D. HOESE, Southwestern Nat. Summer foods of some fish species in East Bay, Texas. 1956. 100-104. (3): 1 REGAN, Ch. T. Biologia-Centrali-Americana Pisces, Porter and Dulau Co. London 1906-1909. 1-203, 26 láms. 33: REGAN, Ch. T. Ann. Mag. Nat. Hist. Ser. 8 A revision of the fishes of the genus Elops. 1909. 37-40. 3: REGAN, Ch. T. Ann. Mag. Nal, Hist. Ser. 8 Fishes from Peru, collected by Dr. H. O. Forbes. 1913. 278-280. 12: RESÉNDEZ, A. An. Inst. Biol. Univ. Nal. Autón México. Estudio de los peces de la laguna de Tamiahua, Veracruz, México Ser. Cienc. del Mar y Limnol. 1970 79-146, 58 figs., 1 tabla. (1): 41 RESÉNDEZ, A. Revta Soc. mex. Hist. Nal. Estudio de los peces de la laguna de Alvarado, Veracruz, México. 1973. 183-281, 62 figs. 31: RESÉNDEZ, A. An. Inst. Biol. Univ. Nal. Autón. Lista preliminar de peces colectados en las lagunas de Nichupté y Bojórquez, Cancún, Q. Roo, México. Ser. Zoología México 1975. 87-100. (1): 46 RICHARD, S. W., Bull. Bingham Oceanogr. Coll. The demersal fish populations of Long Island Sound. 1963. 1-101. 18: RICKER, K. E., Mus. Contr. Inst. Fish. Univ. Brit. Columbia Mexican shore and pelagic fishes collected from Acapulco to Cape San Lucas during the 1957 cruise of the "Marijean". 1959a. 1-18. 3: RICKER, K. E. Mus. Contr. Inst. Fish. Univ. Brit. Columbia. Fishes collected from the Revillagigedo Islands during J9541958 cruises of the "Marijean" 1959b. 1-10. 4: ROLDEL, P. M., Fish. Bull. Calif. Dept. Fish and Game Common ocean Fishes of the California coast. 1953. 1-184. 91: ROMÁN, R., Contribución al conocimiento de la biología del "langostino" Macrobrachium tenellum (Smith, 1871) en algunas lagunas costeras de Guerrero México. Tesis profesional Fac. Ciencias, Univ. Nal. Autón. México. 1976 71 p., 15 figs 9 tablas, 5 láms. ROSEN, D. E. y R. M. BAILEY, Bull. Am. Mus. Nal. Hist. The poeciliid fishes (Cyprinodontiformes) their structure, zoogeography and systematics. 1963 1-176 (1): 126 ROSEMBLATT R. H., Stud. trop, Oceanogr. The zoogeography relationship of the marine shore fishes of tropical America. Miami 1967. 579-592. 5: ROSEMBLATT, R. H. y B. W. WALKER, Occ. Pap. Cal. Ac. Sci. The marine shore fishes of the Galapagos Islands. 1963. 97-106. 44: ROSEMBLATT, R. H., J. E. MC COSKER y I. RUBINOFF, Coritribution in Science Indo-West Pacific fishes from the Gulf of Chiriqui, Panama. 1972. 1-18. 231: ROSEN, D. E., Systematic Zoology A vicariance niodel of Caribbean biogeography. 1975. 431-464 (4): 21 RZEDOWSKI, J. y R. Mc VAUGH, Contr. Univ. Mich. Herb. La vegetación de Nueva Galicia. 1966. 1-123, 28 figs. (1): 9 SAILA, S. B., Estuarine Research Some aspects of fish production and cropping in estuarine systems. In: Cronin, L. E. (Ed.) Academic Press, New York 1975. 473-493. 1: SÁNCHEZ, C., Ministerio Agricultura y Ganadería, El Salvador, C. A., Inf. Téc. Desarrollo de juveniles del camarón de río Macrobrachium tenellum (Simth) en estanques de arcilla y concreto. 1975. 1-15. (2): 2 SCHAEFER, M. B., Rept. Inter. Am. trop. Tunna Comm. for 1953: Report on the investigations of the Inter-American Tropical Tuna Commission for the year 1953. 1954. 18-87. SCHESKE, C. L. y E. P. ODUM, Proc. Gulf Caribb. Fish. Inst. Mechanisms maintaining high productivity in Georgia estuaries. 1961. 75-80. 11: SCHROEDER, W. C., Rep. U. S. Comm. Fish. (1923) Fishes of Key West and the clam industry of Southern Florida. 1924 1-74. 12: SCHULTZ, L. P. Proc. U. S. Nal. Mus. A revision of subfamilies of atherine fishes with description of new genera and species. 1948 1-48. 98: ***SCHUSTER, W. H., FAO Fish. Synops. Synopsis of biological data on milkfish Chanos chanos (Forkal). 1960. var. pág. 4: SEALE, A., Allan Hancock Pacific Exp. Report on fishes from Allan Hancock Expeditions iti the California Academy of Sciences. 1940. 1-46. 9: SHANNON, C. E. y W. WEAVER, The Mathematical Theory of Communication. University of Illinois Press Urbana. 1963. 117 p. S. I. C. Catálogo de Peces Marinos Mexicanos , Secretaría de Industria y Comercio Subsecretaría de Pesca, Instituto Nacional de Pesca. México 1976. 462 p., 504 figs. SIGNORET, M. Rev. Lat-amer. Microbiol. Microorganismos presentes en el contenido digestivo de Tilapia sp (Pisces: Cichlidae). 1974. 153-154. 16: SMITH, R. F ; A. H. SWARTZ y W. G. MASS MANN (Eds.), Amer. Fish. Soc. Spec. Publ. A Symposium on Estuarine Fisheries. 1966. 1-154. 3: SMITH H. M Raleigh, N. C., Geol. Econ. Surv. II The fishes of North Carolina. 1907. 1-453. 11: SNEDAKER, S, C. y J. M. BROOK, Biscayne Bay: Past/Present/Future. Symposium University of Miami, April 2-3, 1976: Ecology and tlie food web of Biscayne Bay Thorhaug, A. y A. Voker (Eds.) 1976. 227-233. R, E. y E. HELLER, Proc. Wash. Ac. Sci. Shore fishes of the Revillagigedo, Clipperton, Cocos and Galapagos Islands. 1905. 333-427. 6: SPRINGER, V. G. y K. D. WOODBURN, Prof. Pap. Ser. Mar. Lab. Fla. An ecological studies of the fishes of the Tanipa Bay area. 1960. 1-104. 1: STARKS, E. Ch. Proc. U. S. Nat. Mus. A collection of fishes niade by P. O. Simons in Ecuador and Peru. 1906. 761-800, láms. 65-66, 8 figs. 30: STARKS, E. CH. y E. L MORRI.S, Univ. Cal. Publ. Zool. The marine fishes of Southern California. 1907. 159-251. (11): 3 STEINDACHNER, F., Ichth. Notizen (Sitzb. Akad. Wiss. Wien.) Über einige neue oder seltine Arten von Mazatlán, Lagos und Santos. 1869 16-26, láms. 5-8. (9): 60 STEINDACHNER, F. Ichth. Beitrage (Sitzb. Akad. Wiss Wien.), Zur Fischfauna von Panama 1875, 1-65, 13 láms. (4): 72 STEINDACHNER, F. Ichthologishe Beitrage 4 (Sitzb. Akad, Wiss. Wien.) 1876. 551-616. (1): 72 STEINDACHNER, F. Ichth. Beitrage (Sitzb. Akad Wiss. Wien.) Zur Fischfauna von Panama, Acapulco und Mazatlán. Über einige neue Fishcharten, insbesonder Characinen und Siluroiden aus dem Amazonenstrome. 1876. 1-192, 15 láms. (5): 75 STEINDACHNER, F. Ichthologische Beitrage 8 (Sitzb. Akad. Wiss. Wien.) 1879a. 1-73, 3 láms 80: STEINDACHNER, F. Denkschar. Akad. Wiss. Wien. Über einige Neue und Seltene Fisch-Arten k. k. Zoologischen Museen ru Wien, Stuttgart und Waeschau. 1879b 1-52, 9 láms. 41: STEINDACHNER, F. Denkschar. Akad. Wiss. Wien. Fisch-Fauna des Cauca und der Flusse bei Guayaquil. 1880. 55-104 (52 p. en anexo), 9 láms. 12: STUARDO, J. y A. MARTÍNEZ-GUERRERO, Acta Politécnica Mexicana Resultados generales de una prospección de los recursos biológicos y pesqueros del sistema lagunar costero de Guerrero, México. 1975. 99-115. (72): 16 STUARDO, J. y M. VILLARROEL, An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México Aspectos ecológicos y distribución de los moluscos en las lagunas costeras de Guerrero, México. 1976. 70-90 (1): 3 STUARDO, J., A. MARTÍNEZ, A. YÁÑEZ-ARANCIBIA, J. A. WEINBORN y J. RUIZ, Informe Final 1ra. Etapa Programa Uso de la Zona, Costera de Michoacán y Guerrero. Prospección de los recursos biológicos y pesqueros del sistema lagunar costero de Guerrero y, en parte, del litoral rocoso de Michoacán, México. Convenio Comisión del Río Balsas, S. R. H. y Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México. Contrato de Estudios No. OCE-03-73, 1974. 500 p. SUBRAHAMANYAM, C. B. y S. H. DRAKE, Bull. Mar. Sci. Studies on the animal communities in two north Florida salt marshes. Part I. Fish communities. 1975. 445-465 (4): 25 SUBRAHAMANYAM, C. B., W. L. KRUCZINSKI y S. H. DRAKE, Bull Mar. Sci. Studies on the animal communities in two north Florida salt marshes. Part II. Macroinvertebrate communities 1976. 172-195. (2): 26 SUSUKI K., Rep. Fac. Fish. Univ. Mie. Biology of striped mullet, Mugil cephalus Linnaeus. I. Food contents of youngs. 1965. 295-305. (2): 5 SYKES, J. E. y J. H, FINUCANE, Occurrence in Tampa Bay, Florida, of immature species domitat in Gulf of Mexico commercial fisheries U. S. Fish Wildl. Serv. Fish. Bull. 1966 369-379. (2): 65 TABB, D. C., D. L, DUBROW Y R. B. MANNING, The ecology of northern Florida Bay and adjacent estuaries. Florida State Board of Conservation. 1962. 1-80 39: TAGATZ, M. E., U. S. Fish Wildl. Serv. Fish. Bull. Biology of tlie blue crab, Callinectes sapidus Rathbun, in the St. Johns River, Florida. 1968a. 17-33. (1): 67 TAGATZ, M. E. Q. J. Fla. Ac. Sci. Fishes of the St. johns River, Florida. 1968b 25-50. 30: TEAL, J. M. Ecology Energy flow in the salt marsh ecosystem of Georgia. 1962. 614-624. (4): 43 THAYER, G. W., S, MARSHALL ADAMS y M. W. LACROIX, Estuarine Research. Chemistry, Biology and the Estuarine System. Structural and functional aspects of a recently stablished Zostera marina communities Cronin, L. E. (Ed.) Academic Press Inc. New York: 1976. 1. THIENEMANN, A., Chironornus. Binnengewasser 1954. 1-834. 20: THOMAS, J., II. WAGNER y H. LOESCH, Coastal Studies Bull. Studies on the fishes of Barataria Bay, Louisiana, an estuarine community, 1971 56-66. 6: THOMPSON, D. A. y W. H. EGER, The University of Arizona, Field Guide Series. Guide to the families of the comon fishes of the Gulf of California. 1966. 21-53. THOMPSON, J. M. Aust. J. Mar. Freshw. Res. Growth and habitats of the sea mullet Mugil dobula Günther, in Western Australia. 1951. 193-225. 2: THOMPSON, J. M. Aust. J. Mar. Freshw. Res. The organs of feeding and food oí some australian mullets. 1954. 469-485. (3): 5 THOMPSON, J. M. Bull. West. Aust. Fish. Dept. The food of Western Autralian estuarine fishes. 1957. 1-13. 7: TORAL, S, Estudio de los Cichlidae (Pisces: Perciformes) de la Laguna de Términos y sus afluentes. Tesis profesional Fac. Ciencias, Univ. Nal. Autón México. 1971. 32 p. TORAL, S. y A. RESENDEZ, Rev. Biol. Trop. Los ciclidos (Pisces: Perciformes) de la Laguna de Términos y sus afluentes. 1973 259-279 (2): 21 TORTONESE, F. Boll. Mus. Zool. Anat. Comp. Univ. Torino Si alcuni Plagiostomi c Teleostei raccolti dal dott. E. Feste nell'America centrale c meridionale Ser. 3 , . 1939a. 45-56, lám. 1. (89): 47 TORTONESE, F. Boll. Mus. Zool. Anal. Comp. Univ. Torino Risultati ittiologici del viaggio di circumnavigazione del globo della R. N. "Magenta" (1865-1868). Ser. 3 1939b. 177-421, 17 figs., 9 láms. (100): 47. TRENT, W. L., U. S. Bureau Comm. Fish. Abstract in of Water Resources Research Catalog. TS Ecology of Western Gulf estuaries. 1970 Vol. 6, part I TSCHUDI, I, J. von, Ichthyologie Untersuchungen über der Fauna Peruana: 1845. 1-35, 6 láms TURNER, W. R. y G. N. JOHNSON, NOAA Technical Report NMFS-666 Distribution and relative abundance of fishes in Newport River, North Carolina. 1973. 23 p. ULREY, A. B. y P. 0. GREELLY, Bull. Soc. Cal. Ac. Sci. A list of the marine fishes (Telcostei) of Southern California with their distribution. 1928. 1-53. (1): 28 VAAS, K. F. y A. E. HOFSTEDE, Contr. Inl. Fish. Res. Stat. Bogor. Studies on Tilapia mossambica Peters (ikan mudjair) in Indonesia. 1952 1-68. 1: VANNUCCI, M. Lagunas Costeras un Simposio. Mem. Strip. Intern. Lagunas Costeras. UNAM-UNESCO, Nov. 28-30, 1967: What is known about production potential of coastal lagoons. Ayala-Castañares, A. y F: B. Phleger (Eds.). 1969. 457-478. VILLARROEL, M., Informe Final 2da. Etapa Programa Uso de la Zona Costera do Michoacán y Guerrero. Relaciones entre macroinvertebrados bentónicos (especialmente moluscos) y sedimentos en 3 lagunas del Estado de Guerrero, México. I. Convenio Comisión del Rio Balsas, S. R. H., y Centro Cienc. del Mar y Limnol. Univ. Nal. Autón Mexico. Contrato de Estudios No. OC-E-03-74, 750 p. 1975. VILLARROEL, M. Informe Final 3ra. Etapa Programa Uso de la Zona Costera de Michoacán y Guerrero. Relaciones entre macroinvertebrados hentónicos (especialmente moluscos) y sedimentos en las lagunas costeras Salinas de Apozahualco, Chautengo y Nuxco, Gro., M6xico, II. Relaciones entre sedimentos de Areas centrales de manglar y la distribución de los macroinvertebrados bentónicos. Convenio Comisión del Rio Balsas, S. R. H., y Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México. Contrato de Estudios No. OC-E-03-75, WAGNER, P. R., 1976. 750 p. WAGNER, P.R. Seasonal biomass abundance, and distribution of estuarine dependant fishes in the Caminada Bay System of Louisiana. Ph. D. Dissertation Lousiana University Press. 1973 WALFORD, L. A. Occ. Pap. Santa Barbara Mus. Nat. Hist. Contribution from the Fleischmann expedition along the west coast of Mexico. 1936. 1-10. 4: WALFORD, L. A. Marine game fishes of the Pacific coast from Alaska to the Equator: 1937. 1-205, 69 Láms. WALSHE, B. M. Nature London Feeding mechanisms of Chironomus larvae. 1947. 474. 160: WALSHE, B. M. Proc. Ziil. Soc. London. The feeding habits of certain chironomid larvae (subfamily Tendipedinae) 1951. 63-79. 121: WARBURTON, K., Estuar. Coast. mar Sci. Community structure, abundance, and diversity of fish in a Mexican coastal lagoon system. 1978. 497-519. 7: WARME, J. E. y L. A. SANCHEZ, Estuarine Research Federation, Galveston, Texas, 6-9 Oct., 1975 (presentation and abstract). Sedimentary patterns in west coast lagoons, 1975. WEINBORN, J. A., Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México. Problema de Investigación Prospección preliminar de la fauna carcinológica en cl sistema lagunar costero del estado de Guerrero y litoral sur del Estado de Michoacan, con referencia especial a las especies de importancia económica. 1974. 180 p., 32 figs., 10 láms., 8 tablas. WILEY. M. L., T. S. Y. Koo y L. E. CRONIN Proceeding of the Second Coastal Mash and Estuary Management Symposium. Louisiana State University, Baton Rouge, La., Jul. 1972: Finfish productivity in coastal marshes and estuaries. Chabreck, R. H. (Ed.) 1973. 139-150. WILSON, C. Ann. Carn. Mus. Some marine fishes from Colombia and Ecuador. 1976. 57-70, lám. 10. (1-2): 10 YÁÑEZ-ARANCIBIA, A., Centro Cienc. del Mar y Limnol Univ. Nal. Autón. México. Problema de Investigación. Prospección preliminar de la fauna ictiológica del sistema lagunar costero del Estado de Guerrero (Pacífico Central de México). 1974. 199 p., 31 figs., 14 láms., 2 tablas. YÁÑEZ-ARANCIBIA, A. An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México Sobre los estudios de peces en las lagunas costeras: Nota científica. 1975a. 53-60. (1): 2 YÁÑEZ-ARANCIBIA, A. Informe Final 2da. Etapa Programa Uso de la Zona Costera de Michoacán y Guerrero. Convenio Comisión del Río Balsas, S. R. H., y Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México. Contrato de Estudios No. OC-E-03-74, 750 p. Relaciones tróficas de la fauna ictiológica del sistema lagunar costero de Guerrero y aspectos parciales de dinámica de poblaciones de los peces de importancia comercial, 1975b. 230 p., 71 figs. YÁÑEZ-ARANCIBIA, A. An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México. Zoogeografía de la fauna ictiológica de la Isla de Pascua (Easter Island). 1975c. 29-52. (1): 2 YÁÑEZ-ARANCIBIA, A. An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México. Observaciones sobre Mugil curema alenciennes en áreas naturales de crianza, México. Alimentación, crecimiento, madurez y relaciones ecológicas. 1976a. 92-124. (1): 3 YÁÑEZ-ARANCIBIA, A. CICAR-II Symposiurn, Caracas, Venezuela, FAO July 12-16, 1976. Fish. Rep. Fish culture in coastal lagocins: Perspectives in México. Progress in Marine Research in the Caribbean and Adjacent Regions. Stewart, H. B. (Ed.) 1976b. 529-547 (1977). 200: YÁÑEZ-ARANCIBIA, A. I Reunión Latinoamericana sobre Ciencia y Tecnología de los Océanos, Secretaría de Marina, Veracruz, México, 26 mayo - 1 junio, 1976: Medioambiente y fauna ictiológica con perspectivas de piscicultura lagunar en México. 1976c 445-476. YÁÑEZ-ARANCIBIA, A. World Mariculture Society, Eight Annual Meeting. San José, Costa Rica, Jan. 9-13, 1977 (in press). Biological and ecological studies and perspectives of culture of sea cat-fish Galeichthys caerulescens (Günther) in coastal lagocins on the Pacific coast of Mexico J. W. Avault (Ed.). 1977. YÁÑEZ-ARANCIBIA, A. Seminar on Present and Future Research in Coastal Lagoons. Duke University Marine Laboratory, JABO and UNESCO, Beafort N. C. Aug. 28-Sep, 2, 1978 (in press) . Fishes ocurrence, diversity, and abundance in two tropical coastal lagoons with ephermeral inlets on the Pacific coast of México. 1978a. YÁÑEZ-ARANCIBIA, A. An. Centro Cienc. del Mar y Limnal. Univ. Nal. Autón. México. Patrones ecológicos y variación cíclica de la estructura trófica de las comunidades nectónicas en lagunas costeras del Pacífico de México. 1978b. 285-306. (1): 5 YÁÑEZ-ARANCIBIA, A. y R. S. NUGENT, Síntesis de antecedentes bióticos y abióticos de los ecosistemas estuarinos de Nayarit, México. Publ. Ciencias Biológicas Univ, Autón. Nuevo León, México. Vol. in memoriam Dr. E. Caballero (en prensa). 1975. YAÑEZ-ARANCIBIA, A. y R. S. NUGENT, 39th Annual Meeting American Society of Limnology and Oceanography. Savannah, Georgia, 21-24 Jun. 1976 (abstract and presentation). Some ecological relationships of nektonie communities in nine coastal lagoons on the Pacific coast of Mexico. 1976. YÁÑEZ-ARANCIBIA A, y R. S. NUGENT, An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. Mexico. El papel ecológico de los peces en estuarios y lagunas costeras. 1977. 107-113. (1): 4 YAÑEZ-ARANCIBIA, A, y G. DIAZ, An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón México. Ecología trodinámica de Dormitator lalifrons (Richardson) en nueve lagunas costeras del Pacifico de México. (Pisces: Elcotridae). 1977. 125-140. (1). 4 YAÑEZ-ARANCIBIA, A. y V, LEYTON, An. Centro Cienc. del Mar y Limnol. Univ. Nal. Antón. Desarrollo del otolito embrionario, patron de su crecinliento y morfológica con otolitos juveniles y adultos del bagre marino Galeichthys merulescens (Günther) Mexico 1977. 115-124. (1) 4 YAÑEZ-ARANCIBIA, A., J. CURIEL y V. LEYTON, An. Centro Cienc, del Mar y Limnol. Univ. Nal. Autón México. Prospección biológica y ecológica del bagre marino Galeichthys caerulescens (Günther) en cl sistema lagunar costero de Guerrero, México. (Pisces: Ariidae). 1976. 125-180. (1): 3 YASUDA, E, Bull. Japanese Soc. Sci. Fish. The types of food habits of fishes assured by stomach contents examination. 1960. 653-662. (7): 26 YOKOTA, T., In Japanese Materials. The construction of fish community at Nankai Regional Area from the view point of their food habits. 1956. ZARET, TH. M. y R- T. PAINE, Science Species introduction in a tropical lake. 1973. 449-455 182: ZARUR, A. Estudio ecológico preliminar de la laguna de Términos (Campeche). Tesis profesional, Fac. Ciencias, Univ. Nal Autón. México. 1961. 69 p. ZARUR, A. Revta. Soc. Mex. Hist. Nat. Algunas consideraciones geobiológicas de la laguna de Términos Campeche. 1962. 51-70 23: LÁMINAS
 Lám. 1. Especies típicas y de importancia comercial de la laguna Salinas de Apozahualco, Gro. Según Stuardo, Martínez-Guerrero, Yáñez-Arancibia, Weinborn y Ruiz (1974). 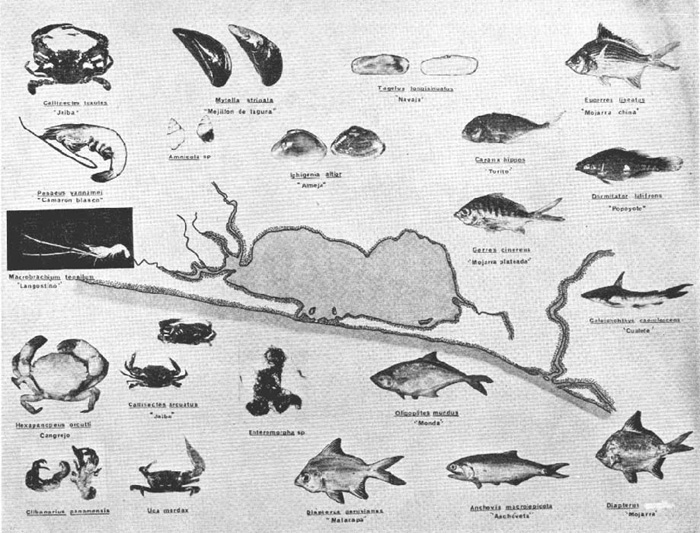 Lám. 2. Especies típicas y de importancia comercial de la laguna de Chautengo, Gro. Según Stuardo, Martínez-Guerrero, Yáñez-Arancibia, Weinborn y Ruiz (1974) 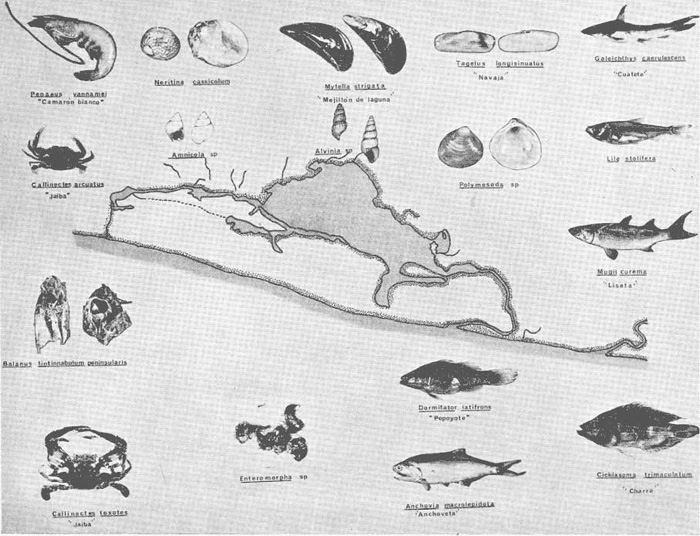 Lám. 3. Especies típicas y de importancia comercial de la laguna de Tecomate, Gro. Según Stuardo, Martínez-Guerrero, Yáñez-Arancibia, Weinborn y Ruiz (1974). 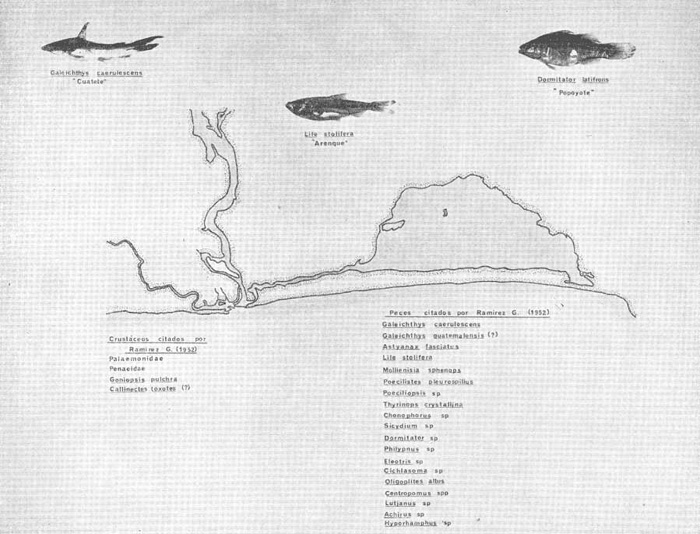 Lám. 4. Especies tópicas y de importancia comercial de la laguna de Coyuca, Gro. Según Stuardo, Martínez-Guerrero, Yáñez-Arancibia, Weinborn y Ruiz (1974). 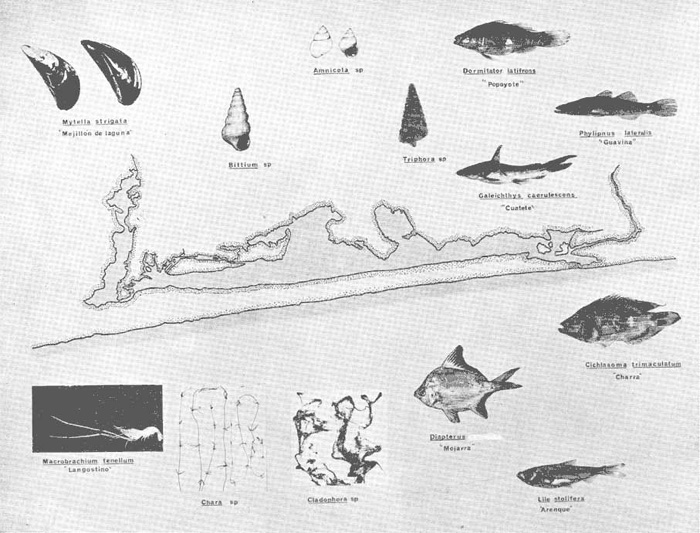 Lám. 5. Especies típicas y de importancia comercial de la laguna de Mitla, Gro. Según Stuardo, Martínez-Guerrero, Yáñez-Arancibia, Weinborn y Ruiz (1974). 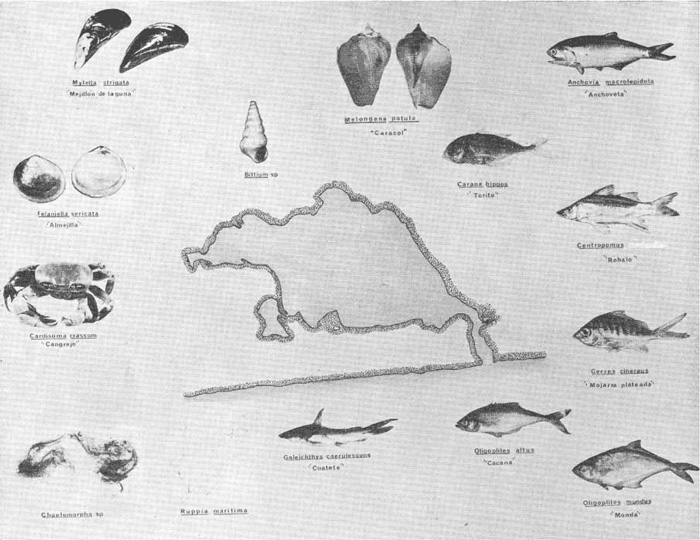 Lám. 6. Especies típicas y de importancia comercial de la laguna de Nuxco, Gro. Según Stuardo, Martínez-Guerrero, Yáñez-Arancibia, Weinborn y Ruiz (1974). 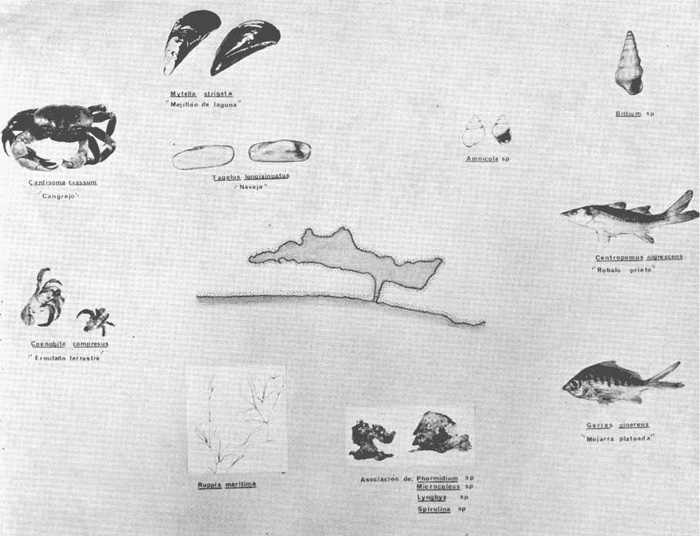 Lám. 7. Especies típicas y de importancia comercial de la laguna Salinas del Cuajo, Gro. Según Stuardo, Martínez-Guerrero, Yáñez-Arancibia, Weinborn y Ruiz (1974). 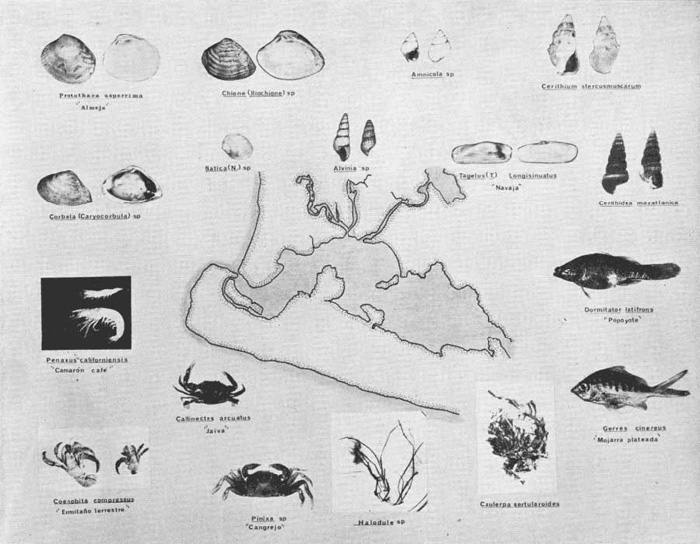 Lám. 8. Especies típicas y de importancia comercial de la laguna de Potosí, Gro. Según Stuardo, Martínez-Guerrero, Yáñez-Arancibia, Weinborn y Ruiz (1974).  Lám. 9. Fig. 1: Heterodontus francisci (girard, 1854). Fig. 2: Ginglymostoma cirratum (Bonnaterre, 1788). Fig. 3: Pristis zephyreus Jordan y Starks, 1895.  Lám. 10. Fig. 1: Urotrygon asterias (Jordan y Gilbert, 1882). Fig. 2: Urotrygon nebulosus Garman, 1885. Fig. 3: Urotrygon aspidurus (Jordan y Gilbert, 1881). 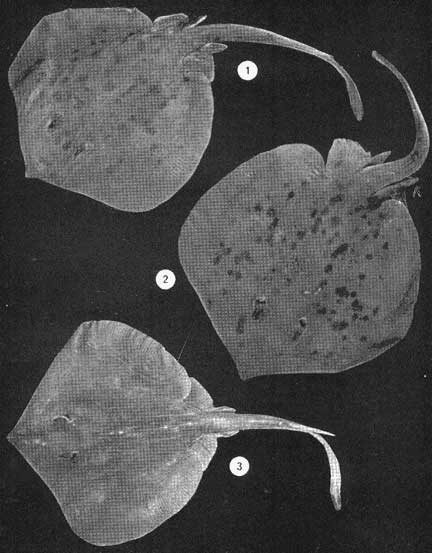 Lám. 11. Fig. 1: Urotrygon goodei (Jordan y Bollman, 1889). Fig. 2: Urotrygonchilensisi (Gunther, 1859). Fig. 3: Urotrygon sp A.  Lám. 12. Fig. 1: Elops afffinis Regan, 1909. Fig. 2: Albula vulpes (Linnaeus, 1758). Fig. 3: Myrophhis vafer Jordan y Gilbert, 1882. Fig. 4: Lile stolifera (Jordan y Gilbert, 1896).  Lám. 13. Fig. 1: Opisthonema libertate (Gunther, 1866). Fig. 2: Opisthopterus dovii (Günther, 1868). Fig. 3: Pliosteostoma lutipinnis (Jordan y Gilbert, 1881). Fig. 4: Anchovia macrolepidota (Kner y Steindachner, 1865).  Lám. 14. Fig. 1: Anchoa panamensisi (Steindachner, 1875). Fig. 2: Anchoa mundeoloides (Breder, 1928). Fig. 3: Anchoa curta (Jordan y Gilbert, 1882). Fig. 4: Anchoa scofieldi (Jordan y Culver, 1895). Fig. 5: Chanos chanos (Förskal, 1775). 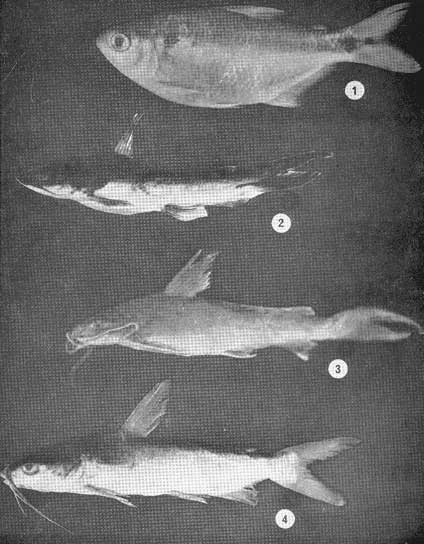 Lám. 15. Fig. 1: Astyanax fasciatus (Cuvier, 1854). Fig. 2: Galeichthys careulescens (Günther, 1864). Fig. 3: Galeichthys gilberti Jordan y Williams, 1895. Fig. 4: Arius liporus (Bristol, 1896).  Lám. 16. Fig. 1: Hyporhamphus unifasciatus (Razzani, 1842). Fig. 2: Poecilia sphenops Cuvier y Valenciennes, 1846 (hembra y macho). Fig. 3: Poeciliopsis lucida Miller, 1960. Fig. 4: Poeciliopsis porosus De Buen, 1943 (hembra y macho).  Lám. 17. Fig. 1: Poeciliopsis balsas Hubbs, 1926 (hembra y macho). Fig. 2: Thyrinops crystallina (Jordan y Culver, 1985). Fig. 3: Centropomus nigrescens Gunther, 1864. Fig. 4: Prionotus ruscarius Gilbert y Straks, 1904.  Lám. 18. Fig. 1: Centropomus robalito Jordan y Gilbert, 1881. Fig. 2: Diptectrum pacificum Meek y Hildebrand, 1925. Fig. 3:Caranx hippos (Linnaeus, 1766). Fig. 4: Caranx marginatus (Gill, 1863).  Lám. 19. Fig. 1: Caranx medusicola Jordan y Straks, 1895. Fig. 2: Caranx latus Agassiz, 1831. Fig. 3: Caranx caballus Gunther, 1869. Fig. 4: Selene brevoorti (Gill, 1863).  Lám. 20. Fig. 1: Oligoplites mundus Jordan y Straks, 1896. Fig. 2: Oligoplites altus (Günther, 1869). Fig. 3: Oligoplites saurus (Blonch y Schneider, 1801). Fig. 4: Oligoplites refulgens Gilbert y Straks, 1904. Fig. 5: Trachinotus rhodopus Gill, 1863.  Lám. 21. Fig. 1: Lutjanus novemfasciatus Gill, 1862. Fig. 2: Lutjanus argentiventris (Peters, 1869). Fig. 3: Lutjanus guttatus (Steindachner, 1869). Fig. 4: Diapterus peruvianus (Cuvier y Valenciennes, 1830).  Lám. 22. Fig. 1: Gerres cinereus (Walbaum, 1972). Fig. 2: Eugerres lineatus (Humboldt y Valenciennes, 1821). Fig. 3: Eugerres axillaris (Günther, 1864). Fig. 4: Eucinostomus currani Zahuranec, 1967.  Lám. 23. Fig.1:Eucinostomus entomelas Zahuranec, 1967. Fig. 2: Eucinostomus dowii (Gill, 1863). Fig. 3: Pomadasys sp. Fig. 4: Pomadasys macracanthus (Günther, 1864).  Lám. 24. Fig. 1: Pomadasys branickii (Steindachner, 1879). Fig. 2: Umbrina xanti Gill, 1862. Fig. 3: Micropogon ectenes Jordan y Gilbert, 1881. Fig. 4: Cynoscion stolzmanni (Steindachner, 1879).  Lám. 25. Fig. 1: Cynoscion xanthulus Jordan y Gilbert, 1881. Fig. 2: Cynoscion reticulatus (Gunther, 1869). Fig. 3: Menticirrhus elongatus (Gunther, 1864). Fig. 4: Menticirrhus nasus (Gunther, 1869).  Lám. 26. Fig. 1: Kyphosus elegans (Peters, 1869). Fig. 2: Cichlasoma trimaculatum (Gunther, 1868). Fig. 3: Tilapia mossambica Peters, 1852. Fig. 4: Abudefduf saxatilis (Linnaeus, 1758).  Lám. 27. Fig. 1: Mugil curema Valenciennes, 1836. Fig. 2: Polydactilus approximans Lay y Bennet, 1839. Fig. 3: Sphyraena ensis Jordan y Gilbert, 1882. Fig. 4: Eleotris pictus Kner y Steindachner, 1864. Fig. 5: Gobiomorus maculatus (Gunther, 1859). 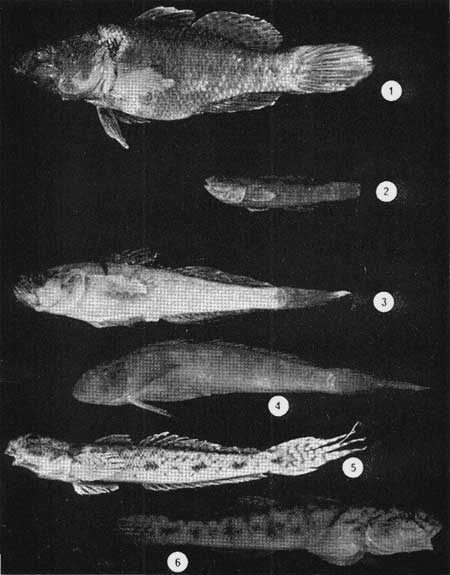 Lám. 28. Fig. 1: Dorminator latinfrons (Richardson, 1837). Fig. 2: Bathygobius soporator (Cuvier y Valenciennes, 1837). Fig. 3: Microgobius miraflorensis Gilbert y Straks, 1904. Fig. 4: Gobionellus microdon (Gilbert, 1891). Fig. 5: Gobionellus sagittula (Gunther, 1861). Fig. 6: Awaous nelsoni Evermann, 1868.  Lám. 29. Fig. 1: Microdesmus dipus Günther, 1864. Fig. 2: Scomberomorus maculatus (Mitchill, 1815). Fig. 3: Citharichthys gilberti Jenkins y Evermann, 1889. 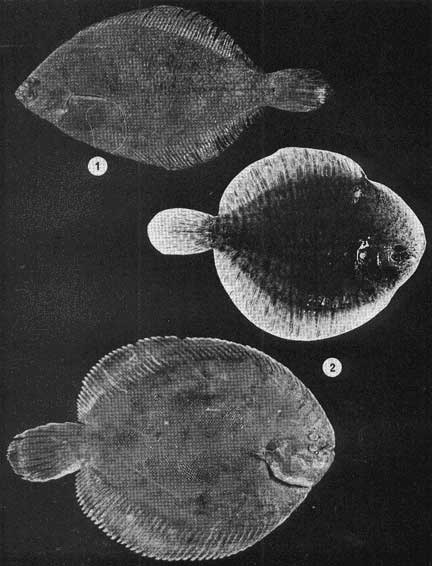 Lám. 30. Fig. 1: Etropus crossotus Jordan y Gilbert, 1882. Fig. 2: Achirus mazatlanus (Steindachner, 1869) (juvenil y adulto). 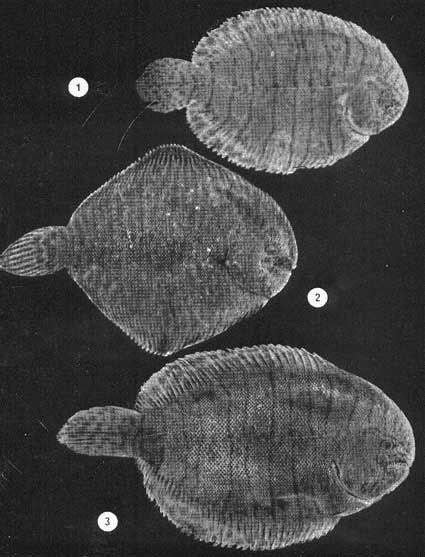 Lám. 31. Fig. 1: Achirus panamensis (Steindachner, 1875). Fig. 2: Achirus klunzingeri (Steindachner, 1879). Fig. 3: Trinectes fonsecensis (Gunther, 1862). 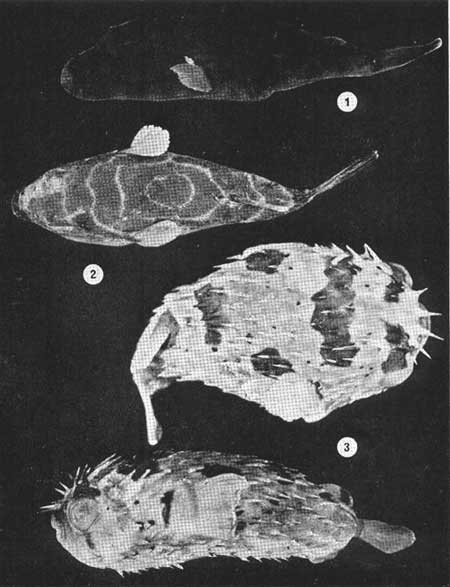 Lám. 32. Fig. 1: Sphoeroides lobatus (Steindachner, 1870). Fig. 2: Sphoeroides annulatus (Jennyns, 1842). Fig. 3: Diodon hystrix Linnaeus, 1758.
|

