|
OBSERVACIONES AL MICROSCOPIO ELECTRÓNICO DE BARRIDO DE LA
ACCIÓN DEL EXTRACTO ACUOSO DE LA ESPONJA HALICLONA SP. SOBRE
STAPHYLOCOCCUS AUREUS
Trabajo presentado en parte en el VI Congreso
Nacional de Oceanografía, Ensenada B. California, México, 10 al
13 de abril, 1978. Recibido el 26 de septiembre de 1979 y aceptado para su
publicación el 21 de febrero de 1980.
FERNANDO GONZALEZ-FARÍAS
GERARDO GREEN
FRANCISCO FLORES-VERDUGO
Universidad Nacional Autónoma de
México, Centro de Ciencias del Mar y Limnologia. Contribución 129
del Centro de Ciencias del Mar y Limnologia, UNAM.
Se probó la acción antibiótica de un extracto
acuoso de la esponjaHaliclona
sp.sobreStaphylocotcus aureus.Se determinó
la concentración mínima inhibitoria de dicho extracto sobre los
estafilococos. Se obtuvieron varias fracciones por separación
cromatográfica y se determinó su actividad antibiótica. Se
observaron en el microscopio electrónico de barrido los efectos causados
sobre la pared celular de los estafilococos por el extracto, dos de las
fracciones y ampicilina. Se discuten los posibles sitios de acción de
las fracciones antibióticas.
Antibiosis againstStaphylococcus aureuswas tested
for an aqueous crude extract from the sponge Haliclona
sp.Several chromatographic fractions were obtained and tested against
the staphylococci. The efects caused by the crude extract, two chromatographic
fractions and ampicillin on the cellular wall of the staphylococci were
observed on the scanning electron microscope. The posible sites of action of
the fractions are discussed.
La antibiosis producida por exudados de esponjas sobre bacterias fue observada por vez primera por Nigrelli y colaboradores (1959). A partir de entonces se han reportado esponjas con propiedades antibióticas, aislándose y purificándose los compuestos responsables de dicha acción (Andersen y Faulkner, 1973; Burkholder y Ruetzler, 1969; Jakowska y Nigrelli, 1960; Nigrelli et al.,1967 y 1961; Sharma, 1970; Sharma y Burkholder, 1967; Sharmaet al., 1968; Stempien, 1966; Stempien et al.,1973 y 1970). Hasta hace poco tiempo era difícil el observar la acción de los antibióticos sobre la morfología bacteriana. Ahora con la ayuda del microscopio electrónico de barrido (MEB), se pueden observar claramente los efectos producidos por las sustancias antibióticas, así como determinar la secuencia de estos. A la fecha existen varios trabajos sobre los efectos producidos por antibióticos comerciales sobre la morfología de las bacterias (Greenwood y O'Grady, 1972, 1969a y 1969b; Klainer y Perkins, 1971 y 1970). En general se ha trabajado con antibióticos del grupo de las penicilinas, los cuales interfieren en la síntesis de la pared celular de las bacterias (Donachie y Begg, 1970; Schwarz et al., 1969 y 1975; Tipper y Strominger, 1968; Tzagoloff y Novick, 1977; Westling-Häggström et al.1977). El objetivo de este trabajo es el conocer los efectos causados sobre pared celular de Staphylococcus aureus, por el, extracto crudo acuoso de la esponjaHaliclona sp. y por dos fracciones cromatográficas obtenidas a partir del extracto. Además comparar los efectos causados por las fracciones cromatográficas sobre la morfología bacteriana con los efectos causados por la ampicilina. MATERIAL Y MÉTODOS
COLECTA DE LA ESPONJALa colecta se llevó a cabo por buceo libre y buceo autónomo, a profundidades entre 1 y 20 m, en el área de Zihuatanejo, Gro. (17º37'N, 101º 34'W). Las esponjas colectadas fueron inmediatamente congeladas en hielo seco y transportadas al laboratorio. EXTRACTO CRUDO ACUOSOSe tomaron 10 g (peso húmedo) de la esponja y se homogeneizaron en 100 ml de agua destilada. El homogeneizado se centrifugó a 2 500 rpm durante 10 min., desechándose el precipitado y utilizando, el sobrenadante para las pruebas de antibiosis y para la purificación cromatográfica (Green, 1977). CROMATOGRAFÍA DEL EXTRACTO ACUOSOSe preparó una columna cromatográfica (1.3 x 45.0 cm) con Sephadex G-25 Pharmacia Fine Chemicals) en agua destilada. Se colocó en la columna una alícuota de 5 ml del extracto crudo acuoso y se corrió con un flujo constante de 0.5 ml,/hr, colectándose fracciones de 2 ml. CEPA Y CONDICIONES DEL CULTIVOSe utilizó una cepa deStaphylococcus aureus proveniente del Departamento de Bacteriología de la Facultad de Química, UNAM Se mantuvo el cultivo en caldo nutritivo (BIOXON) a 37ºC. DETERMINACIÓN DE LA CONCENTRACIÓN MÍNIMA INHIBITORIA DEL EXTRACTO ACUOSOTubos de ensaye con caldo nutritivo estéril fueron inoculados con 0.1 ml. de un cultivo ya crecido de S. aureus, se agregaron alícuotas del extracto para obtener diluciones en serie de 0.1: 10, 0.3:10, 0.5: 10. 0.8: 10 y 1.0: 10. Esta serie de diluciones se efectuó también para una solución de ampicilina (Beechman Research Laboratories) de 50 µg/ml. La concentración mínima inhibitoria (CMI) se determinó observando el crecimiento en los distintos cultivos después de incubarlos 15 horas a 37ºC. PRUEBAS DE ANTIBIOSISi) En placa: Se prepararon sensidiscos con papel filtro estéril de 6 mm de diámetro, sobre los cuales fueron impregnadas alícuotas de 0.5 ml del extracto y de cada una de las fracciones cromatográficas. Se prepararon también sensidiscos con 0.5 mg de ampicilina para comparación. Los sensidiscos secos se colocaron en cajas de Petri con agar nutritivo (DIFCO), previamente inoculadas con los estafilococos. Se incubaron las cajas 24 horas a 37ºC. ii) En caldo: Se prepararon cinco matraces conteniendo 45 ml de caldo nutritivo estéril, y se inocularon con 0.1 ml de un cultivo ya crecido de S. aureus. A las 3.5 horas de incubación a 37ºC (fase logarítmica del crecimiento) se les agregó a cada uno de los matraces lo siguiente: 5 ml del extracto crudo, 5 ml de la fracción cromatográfica P, 5 ml de la fracción cromatográfica Q, 5 ml de una solución de ampicilina de una concentración de 50 µg/ml. El quinto matraz se dejá como control. Todas las soluciones adicionadas a los cultivos fueron previamente estrilizadas por filtración en Millipore. De cada uno, de estos matraces se tomaron alicuotas de 1 ml a los 60, 120 y 180 min después de haber adicionado las sustancias antibióticas (Greenwood y O'Grady, 1972, 1969a y 1969b; Klainer y Perkins, 1971 y 1970). PREPARACIÓN DE LAS MUESTRAS PARA SU OBSERVACIÓN EN EL MEBLas alícuotas tomadas de los cultivos, en los distintos tiempos, se centrifugaron a 2 500 rpm durante 15 min, desechándose el sobrenadante y utilizando el precipitado con las bacterias. Estas fueron fijadas directamente en una solución de Glutaraldehido al 2.5% en solución de buffer fosfatos (SBF) , pH 7.2, durante 12 horas a 4ºC. Posteriormente se lavaron tres veces con SBF, postfijándolas con una solución de Tetraóxido de Osmio al 2% en SBF durante 30 min. Se lavaron con agua destilada tres veces y se resuspendieron en el volumen original (1 ml). Se tomaron 2-3 gotas de cada una de las suspensiones y se colocaron sobre cubreobjetos adheridos a portamuestras de aluminio. Las muestras se dejaron secar a la temperatura ambiente. A las muestras ya secas se les adicionaron unas gotas de una solución de Cloruro Férrico al 5% durante 15 min. Se lavaron tres veces con agua bidestilada y se dejaron secar a la temperatura ambiente (Arnold et al., 1971; Boyde, 1972; Greenwood y O'Grady, 1969a y 1969b; Klainer y Perkins, 1971; Marszalek, 1969; Williams et al.,1973). Las muestras ya secas se cubrieron con una capa de carbón de 100-200 A, en una evaporadora Jeol (Mod. JEE-4B) , y posteriormente con una capa de oro de 250 A, en una cubridora fina Jeol (Mod. JFC-1100). Las preparaciones se observaron en un microscopio electrónico de barrido Jeol (Mod. SEM-35) con un voltaje de aceleración de 15 KV y una inclinación de 30º. RESULTADOSDe la purificación cromatográfica se obtuvieron varias fracciones, se determinó la absorbancia de éstas a 2 800 ,Å así como su actividad antibiótica (Fig. 1). 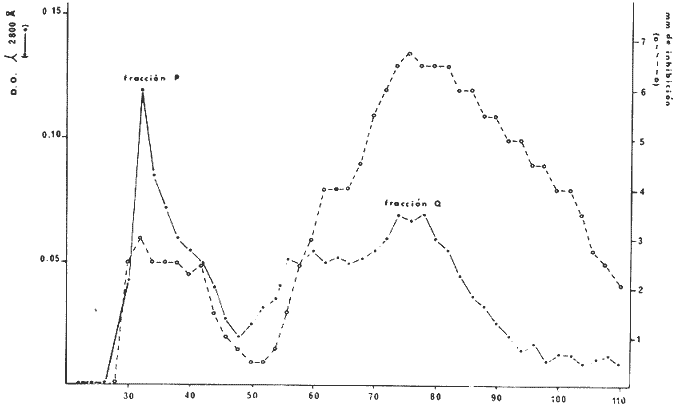 Fig. 1. Absorbancia a 2 800 Å de las fracciones cromatográficas obtenidas a partir del extracto crudo acuoso de la esponja Haliclona sp. e inhibición causada por estas sobre Staphylococcus aureus por medio de sensidiscos.  TABLA 1 CONCENTRACIÓN MÍNIMA INHIBITORIA DEL EXTRACTO ACUOSO Y DE LA AMPICILINA SOBRE STAPHYLOCOCCUS AUREUS Se determinó la concentración mínima inhibitoria del extracto acuoso y de la ampicilina sobre los estafilococos, los resultados se observan en la tabla 1. Se determinó la actividad antibiótica del extracto, de las fracciones cromatográficas P y Q y de la ampicilina (0.5 mg) comparándose entre sí (Tabla 2). Se determinó que la fracción cromatográifica P es de alto peso molecular, no es dializable, es termolábil (pierde 60% de su actividad a 100ºC durante 60 min) y se inactiva con cambios de pH. La fracción cromatográfica Q es de bajo peso molecular, es dializable, es termoestable (a 100ºC durante 60 min) y resiste cambios de pH.  TABLA 2 INHIBICIÓN DE STAPHYLOCOCCUS AUREUS EN PLACA CON SENSIDISCOS IMPREGNADOS CON 0.5 ml DE CADA UNA DE LAS SOLUCIONES DE SUSTANCIAS ANTIBIÓTICAS, LA AMPICILINA (0.5 mg), SE TIENE COMO REFERENCIA Los cambios producidos por el extracto, las dos fracciones cromatográficas y la ampicilina sobre la pared celular de los estafilococos a traves del tiempo, se observan en la serie de micrografías siguientes (Figs. 3-14): Los estafilococos control se observan homogéneos sin presentar cambios morfológicos aparentes a través del tiempo (Fig. 2). Se observa que los cambios morfológicos que se producen sobre las bacterias al ser tratadas con el extracto acuoso, son similares a los que se han reportado para antibióticos del grupo de las penicilinas (Klainer y Perkins, 1970 y 1971; Greenwood y O'Grady, 1969a, 1969b y 1972). Los cambios a través del tiempo, fueron los siguientes: 1) Aparición de superficies rugosas y un aumento considerable de tamaño (Figs. 3 y 4). 2) Formación de esferoplastos y aparición de perforaciones sobre las bacterias (Figs. 5 y 6). 3) Colapso de las bacterias que forman una malla de debris celular (Fig. 7). Los cambios morfológicos que produce la fracción cromatográfica P sobre los estafilococos a través del tiempo con los siguientes: 1) Aumento de tamaño y aparición de rugosidades en la superficie de las bacterias (Fig. 8). 2) Los estafilococos en bipartición aumentan su tamaño y parece ser que forman el septo y no logran separarse (Figs. 9 y 10). 3) Se presentan grandes deformaciones y aparecen perforaciones sobre las bacterias (Figs. 11 y 12). 4) Se presenta el colapso de las bacterias. Con la fracción cromatográfica Q, se observan los siguientes cambios morfológicos: 1) Aumento de tamaño (Fig. 13). 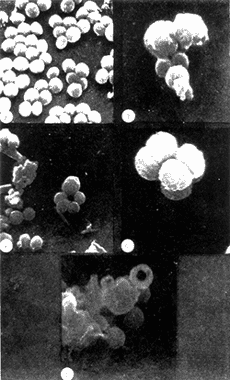 Fig. 2. Staphylococcus aureus control, muestra tomada a las 6.5 horas de incubación. Aumentos 13 000X. Fig. 3. Staphylococcus aureus tratado con el extracto acuoso durante 1 hora. Aumentos 20 000X. Fig. 4. Staphylococcus aureus tratado con el extracto acuoso durante 1 hora. Aumentos 11 000X. Fig. 5. Staphylococcus aureus tratado con el extracto acuoso durante 3 horas. Aumentos 20 000X. Fig. 6. Staphylococcus aureus tratado con el extracto acuoso durante 3 horas. Aumentos 15 000X. 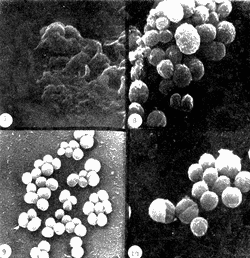 Fig. 7. Staphylococcus aureus tratado con el extracto acuoso más de 3 horas. Aumentos 15 OOOX. Fig. 8. Staphylococcus aureus tratado con la fracción cromatográfica P durante 1 hora. Aumentos 13 OOOX. Fig. 9. Staphylococcus aureus tratado con la fracción cromatográfica P durante 2 horas. Aumentos 7 200X. Fig. 10. Staphylococcus aurcus tratado con la fracción cromatográfica P durante 2 horas. Aumentos 13 OOOX. 2) Bacterias de mayor tamaño con deformaciones discretas. 3) No se llegó a observar colapso de las bacterias al ser tratadas con esta fracción cromatográfica a la concentración y tiempo de exposición indicados. A modo de comparación se observan las paredes colapsadas de las bacterias al ser tratadas con ampicilina (Fig. 14). La secuencia de aparición de los cambios morfológicos sobreS. areus,por efecto de penicilina ya se ha reportado (Klainer y Perkins, 1970 y 1971; Greenwood y O'Grady, 1969a, 1969b y 1972). 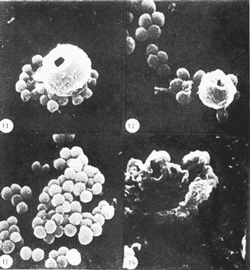 Fig. 11. Staphylococcus aureus tratado con la fracción cromatográfica P durante 3 horas. Aumentos 8 600X. Fig. 12. Staphylococcus aureus tratado con la fracción cromatográfica P durante 3 horas. Aumentos 11 000X. Fig. 13. Staphylococcus aureus tratado con la fracción cromatográfica Q durante 2 horas. Aumentos 8 600X. Fig. 14. Staphyloccocus aureus tratado con ampicilina durante 3 horas. Aumentos 15 OOOX. DISCUSIÓNSe sabe que la pared celular ayuda a mantener el tamaño y forma de las bacterias, y juega un papel crítico en la división celular, sobre todo en la formación de los mesosomas (Higgins y Shockman, 1970) y de los septos que dividen a dos bacterias hermanas. Y aún más importante es que es una de las estructuras anatómicas que contribuyen a mantener la integridad fisiológica y bioquímica de la célula (Klainer y Perkins, 1970). La pared celular se encuentra formada por varias capas, entre las cuales se encuentra el sáculo, que es una macromolécula rígida y cerrada formada por mureína (Lehninger, 1970; Schwarzet al. 1969). Esta macromolécula solo puede ser modificada si se abre, esta apertura se lleva a cabo por un sistema de hidrolasas (Schwarz et al.,1969). Por lo tanto la síntesis de pared celular se efectúa por medio de un sistema enzimático de síntesis e hidrólisis del sáculo (Higgins y Shockman, 1970; Schwarzet al., 1969; Tzagoloff y Novick, 1977). Es decir que las hidrolasas proveen de espacio y receptores a las subunidades de mureína (no polimerizada) que entran a formar parte del sáculo. Por lo tanto los sitios donde actúan las hidrolasas son sitios de síntesis del sáculo (Schwarz et al.,1969). A la fecha en Escherichia colise han encontrado dos tipos de zonas de crecimiento del sáculo, una zona central que funciona como un sistema de formación del septo y otra zona de crecimiento en cada uno de los polos de la bacteria que funciona como un sistema de elongación (Donachie y Begg, 1970; Schwarz et al., 1975). No se sabe si estos dos sistemas son distintos entre sí, o solo representan dos estados funcionales distintos del mismo sistema (Schwarzet al., 1975). Recientemente se ha observado en el microscopio electrónico de barrido que enStaphylococcus sp., se presentan dos tipos de superficie, una lisa correspondiendo a pared celular de reciente síntesis y otra rugosa correspondiendo a pared celular vieja (Amako y Umeda, 1977). Se puede pensar que los dos sistemas antes descritos son diferentes, pues la formación de los septos, en el proceso de bipartición se efectúa en la pared celular vieja, mientras que la elongación de las bacterias se efectúa en la pared celular nueva. Si se bloquea la polimerización de la mureína por medio de sustancias tales como la penicilina, que actúa acilando la transpeptidasa responsable de la polimerización de la mureína (Tipper y Strominger, 1968; Schwarz et al.,1969; Lehninger, 1970), se bloquea la síntesis del sáculo, permitiendo que el sistema de hidrolasas continúe su función. Es decir que al verse inhibida la síntesis de mureína, más uniones del sáculo son hidrolizadas, que las que pueden ser cerradas por el sistema de sintesis del sáculo (Schwarz et al.,1969). Parece ser que en las bacterias tratadas con la fracción cromatográfica P, se ve inhibida la síntesis de pared celular en el sistema de duplicación de los estafilococos, impidiendo la síntesis del septo así como la separación entre dos bacterias hermanas. Tomando en cuenta que la fracción cromatográfica P posee características de un polipéptido se puede pensar que exista una parte terminal que posea residuos similares a la penicilina (cisteína y valina), y que su modo de acción sea similar. Con estos resultados se sugiere que también en S. aureusexisten dos sistemas de síntesis de pared celular como los ya reportados para E. coli (Donachie y Begg, 1970; Schwarz et al., 1975) y que la fracción cromatográfica P actúa solo en el sistema de formación del septo, permitiendo el crecimiento del sáculo en el sistema de elongación, por lo que se observan estafilococos de gran tamaño (Figs. 8, 9 y 10) . Con la fracción cromatográfica Q no se observan cambios morfológicos severos sobre la pared celular de los estafilococos, por lo que se puede pensar que su modo de acción sea a nivel metabólico. Al no observarse lisis de las bacterias al ser tratadas con esta fracción sugiere que este compuesto es bacteriostático. Aunque se debe tomar en cuenta que la inhibición producida por esta fracción sobre S. aureuspor medio de sensidiscos, es mayor que la producida por la fracción cromatográfica P. Lo antes discutido es válido para las concentraciones usadas, pues dependiendo de las concentraciones serán los efectos que se observen sobre la morfología de las bacterias. Tenemos el ejemplo de E. coli, en el que con bajas concentraciones de penicilina se inhibe el sistema de formación del septo y con altas concentraciones se inhibe el sistema de elogación (Tzagoloff y Novick, 1977; Schwarz et al.,1969). Conclusiones1) La acción antibiótica del extracto acuoso es mayor que la de cada una de las fracciones por separado, existiendo probablemente entre estas una acción sinérgica. 2) La fracción cromatográfica P en la concentración usada, interfiere en el mecanismo de formación del septo de los estafilococos, siendo probablemente esta interferencia similar a la de la ampicilina. 3) La fracción cromatográfica P, a la concentración usada, tiene acción bactericida. 4) La fracción cromatográfica Q interviene probablemente en el metabolismo bacteriano, y no produce cambios severos a nivel morfológico. 5) La fracción cromatográfica Q es, a la concentración usada, un compuesto bacteriostático. 6) Los efectos producidos por ambas fracciones cromatográficas sobre las bacterias está en función de las concentraciones usadas y del tiempo de exposición a dichas sustancias. AgradecimientosLos autores desean hacer patente su agradecimiento al Centro de Ciencias del Mar y Limnología, por el apoyo brindado, sin el cual no hubiera sido posible el desarrollo de este trabajo. Se agradece también la valiosa ayuda de Sergio Licea, en lo que respecta a microscopia electrolnica, así como también a la señora Rosa Durán por la transcripción del trabajo. LITERATURAAMAKO, K. A. UMEDAScanning electron microscopy of Staphylococcus.Jour. Ultrastruc. Res.,1977.34-40.58: ANDERSEN, R. J. D. J. FAULKNER,Antibiotics from marine organisms of the Gulf of California. Food and Drugs from the Sea, Proceedings 1972, In: Worthen, L. R. (Ed.) Mar. Tech. Soc.:1973.111-115. ARNOLD, J. D., A. E. BERGER O. L. ALLISON,Proc. 4th Ann. S.E.M. Symposium, IITRI, Some problems of fixation of selected biological samples for S. E. M. examination. In: Johari, O. (Ed.).Chicago:1971.251-256. BOYDE, A., Biological specimen prepation for the S. E. M-An over view- In: Johari, O. and I. Korvin (Eds). Proc. of the Workshop on Biol. Spec. Prep. of the S.E.M., IITRI, Chicago:1972.257-264. BURKHOLDER, P. R. K. RUETZLER,Antimicrobial activity of some marine sponges.Nature,1969.983-984.222: DONACHIE, W K. BEGG. Growth of bacterial cell.Nature,1220-1224.227: GREEN, G., Antibiosis in marine sponges.Fish. Rep. FAO1977.199-205.(200): GREENWOOD, D. F. O'GRADY, Scanning electron microscopy of Staphylococcus aureus exposed to some common anti-staphylococcal, agents.Jour. Gen. Microbiol.,1972.263-270.70: GREENWOOD, D. F. O'GRADYAntibiotic-induced surface changes in microorganisms demostrated by scanning electron microscopy.Science1969a.1076-1078.163: GREENWOOD, D. F. O'GRADY A comparison of the effects of ampicillin on Escherichia coli and Proteus mirabilis.Jour. Med. Microbiol.,1969b.435-441.2: HIGGINS, M. G. SHOCKMAN Model for cell wall growth of Streptococcus faecalis. Jour. Bact.,1970.643-648.101: JAKOWSKA, S. R. F. NIGRELLI,Antimicrobial substances from sponges.Ann. N. Y. Acad. Sci.,1960.913-918.90: KLAINER, A. S. R. L. PERKINS, Proc. 4th Ann. S.E.M. Symposium, IITRI, Surface effects of cell wall active antimicrobial agents. In: Johari, O. (Ed.).Chicago:1971.329-336. KLAINER, A. S. R. L. PERKINS,Antibiotic-induced alterations in the surface morphology of bacterial cells: A scanning beam electron microscope study.Jour. Infect. Dis.,1970.323-343.122: LEHNINGER, A. L.,Biochemistry,Worth Pub. Inc. Nueva York,1970.833 p. MARSZLEK, D. S., Proc. 2d. Ann. S.E M. Symposium, IITRI, Preparation of soft biological materials for scanning electron microscopy. In: Johari, O. (Ed.).Chicago:1969.231-236. NIGRELLI, R. F M. F. STEMPIEN JR. G. D. RUGGIERI U. R. LIGUORI J. T. CECILSubstances of potiential biomedical importance from marine organisms. Fed. Proc.,1967.1197-1205.26: NIGRELLI, R. F, M. BASLOW S. JAKOWSKA First Interscience Conference on Antimicrobial Agents and Chemotherapy. Amer. Soc. Microbiol. Further characterization of antimicrobial substances from the Bahamian sponges Haliclona viridis and Tedania ignis. Ann Arbor. Mich.:196183-84. NIGRELLI, R. F, S. M. JAKOWSKA I. CALVENTI Ectyonin, Antimicrobial agent from the sponge Microciona prolifera Verrill.Zoologica,1959.173-176.44: SCHWARZ, U. A. ASMUS H. FRANK,Autolytic enzimes and cell division of Escherichia coli.Jour. Mol. Biol.,1969.419-429.41: SCHWARZ, U. A. RYTER A. RAMBACHR. HELLIO C Y. HIROTA Process of cellular division in Escherichia coli: differentiation of growth zones in the sacculus.Jour. Mol. Biol.,1975.98:749-759. SHARMA, G. M., Food and Drugs from the Sea, Proc. 1969,Antimicrobial substances of marine sponges. I. In: Youngken, H. W. (Ed.), Mar. Tech. Soc.:1970.307-310. SHARMA, G. M. P. R. BURKHOLDER, Studies on antimicrobial substances of sponges. I. Isolation, purification and properties of a new bromine containing antibacterial substances.Jour. Antibiot. Ser. A.,1967.200-203.20: SHARMA, G. M., B. VIG P. R. BURKHOLDERFood and Drugs from the Sea. Studies on the antimicrobial substances of sponges. III. Chemical properties of some compounds from marine sponges. In: Freudenthal, H. D. (Ed.), Mar. Tech. Soc.:1968.119-126. STEMPIEN, M. F, An antibiotic substance isolate from a sponge of the GenusAgelas. Amer. Zool.,1966.363.6: STEMPIEN, M.F. G. D. RUGGIERI R. F. NIGRELLI J. T. CECILFood and Drugs from the Sea, Physiologically active substances from marine sponges. II In: Youngken, H. W. (Ed). Proc. 1969, Mar. Tech. Soc.:1970.295-305. STEMPIEN, M. F. .J. S. CHIB R. F. NIGRELLI R. A. MIERZWAFood and Drugs from the Sea. Physiologically active substances from marine sponges. II. Antimicrobial substances present in extracts of the sponge Verongia archeri and others species of the Genus Verongia. In: Worthen, L. R. (Ed.). Proc. 1972, Mar. Tech. Soc.:1973.105-110. TIPPER, D. .J. J. L. STROMINGER Biosynthesis of the peptidoglycan of bacterial cell walls. Jour. Biol. Chem.,1968.3169-3179.243: TZAGOLOFF, H. R. NOVICK Geometry of cell division in Staphylococcus aureus. Jour. Bact.,1977.343-350.129: WESTLING-HÄGGSTRÖM, B., , T. ELMROSS. NORMARK B. WINDBLAD, Growth pattern and cell division in Neisseria gonorrhoeae. Jour. Bact.,1977.333-342.29: WILLIAMS, S. T., C. J. VELDKAMP C. S. ROBINSON Proc. of the Workshop on S E M. in Pathology, IITRI, Preparation of microbes for scanning electron microscopy. In: Johari, O. (Ed).Chicago:1973.735-742.
|

