|
VARIACIÓN DE
LA CONCENTRACIÓN DE ALGUNOS IONES EN EL AGUA DE LA LAGUNA APOZAHUALCO,
GUERRERO, MÉXICO
Trabajo presentado en el VI Congreso Nacional de
Oceanografía, Ensenada B. California, México. 10 al 13 de abril,
1978. Recibido el 15 de septiembre de 1978 y aceptado para su
publicación el 16 de octubre de 1978.
HUGO FERNÁNDEZ P.
Universidad Nacional
Autónoma de México Centro de Ciencias del Mar y
Limnología. Contribución 101 del Centro de Ciencias del Mar y
Limnología,
LAWRENCE D. MEE
Universidad Nacional
Autónoma de México Centro de Ciencias del Mar y
Limnología. Contribución 101 del Centro de Ciencias del Mar y
Limnología, UNAM.
En este estudio se determinó
la variación de la concentración de los iones Na+, K+, Mg2+,
Ca2+, S04 2-, HC03- y la clorinidad en muestras de agua de la Laguna de
Apozahualco, durante el periodo en que la Laguna se encuentra aislada de la
zona litoral y bajo un proceso de evaporación. Las variaciones
observadas fueron similares a las que se registran cuando se evapora agua de
mar estandard, sin embargo se observaron dos anomalías correspondientes
a los iones HCO3- y K+. La anomalía del HC03- se atribuyó a
procesos biológicos mientras que la del potasio se considera de tipo
geoquímico.
Changes in the concentration of Na+,
K+, Ca2+, Mg2+, SO4 2-, HC03- and the chlorinity of water samples from
Apozahualco Lagoon were studied when the Lagoon was isolated from the litoral
zone and under conditions of evaporation. The changes determined in the
concentration of Na+, Ca2+, Mg2+, SO4 2- and the chlorinity were very similar
to these calculated from evaporation of standard sea water. The anomalous
behavior of HC03- and K+ were aatributed to biological processes and of
geochemical origin, respectively.
En los últimos años se han hecho grandes avances en la interpretación de las interacciones iónicas de los diferentes componentes de disoluciones complejas de electrolitos (Fridman, 1960; Harned and Robinson, 1968; Scatcnard, 1968 y Millero, 1974), obteniéndose una serie de modelos químicos. Estos modelos han sido aplicados por Sillén (1961) ; Garrels y Thompson (1962) ; Kester y Pitckowicz (1969) y Leyendekkers 1972) ; Robinson y Wood (1972) ; Whitfield (1974), para entender el comportamiento que tienen los elementos más abundantes en el agua de mar y para ríos, estuarios y lagos por Millero, (1975) y Millero (1976). En la zona costera uno de los sistemas más interesantes para estudios de este tipo son las lagunas litorales. En México existen 125 lagunas litorales (Lankford, 1977), con salinidades que varían entre 3% y 200%, El agua de estos sistemas tiene salinidad y composición variable considerando que su origen es agua de mar y aguas de escurrimientos continentales. Los datos que aquí se presentan, son preliminares de un estudio más amplio cuyo objeto es diseñar un modelo químico para sistemas hipersalinos. ÁREA DE ESTUDIOLa Laguna Apozahualco, se localiza en la "costa chica" del Estado de Guerrero, es una laguna somera con una superficie de 2 km2. Esta laguna no recibe aportes de agua de ríos, únicamente de escurrimientos continentales durante la época de lluvias. Su comunicación con el mar es directa a través de una barra arenosa que se abre periódicamente durante el periodo de lluvias (Fig. l). 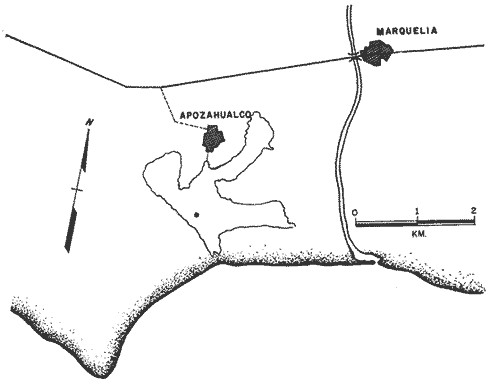 Fig. Esquema de la Laguna Apozahualco,Guerrero, México. MATERIAL Y MÉTODOSDado que la laguna se seca casi totalmente, durante parte del año, las muestras se tomaron únicamente, en la zona más profunda. Las muestras fueron filtradas para eliminar el material en suspensión y llevadas al laboratorio para su análisis, a excepción de la alcalinidad total que se determinó en el campo. Se hicieron las siguientes determinaciones: La clorinidad se determinó por titulación con nitrato de plata (Cox, et al. 1966). El sodio y el potasio se determinaron por absorción atómica (Riley, 1975) mientras que el calcio y el magnesio se cuantificaron volumétricamente con E.D.T.A. (Culkin y Cox, 1966). Para los sulfatos se utilizó un método colorimétrico, usando como disolvente dimetil sulfóxido, con ácido clorhídrico (Janger, 1970). La alcalinidad se obtuvo potenciométricamente (Edmond, 1970). Para la calibración de los métodos se utilizó agua estándar de Copenhague. La densidad de las muestras se determinó con un picnómetro a 25ºC. Una vez analizadas las muestras, se calculó para cada muestra la suma de equivalentes de los cationes y los aniones ajustándose la diferencia entre éstos con sodio. Se tomó como una aproximación, que la alcalinidad total es debida únicamente a los bicarbonatos. Con estos datos se trazaron gráficas de la variación de la concentración de cada ion, con respecto a la clorinidad (Fig. 2). En esta figura se incluyó, además las relaciones entre los diferentes iones y la clorinidad representativas del comportamiento teórico de la evaporación gradual de agua de mar en la que se perdería solamente agua. 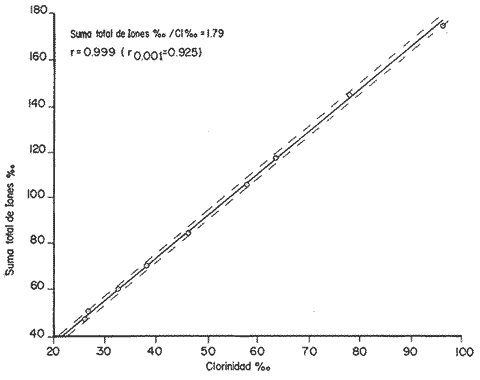 Fig.3 Diagrama de las relaciones entre la concentracion de los iones Na+,K+, Mg2+, Ca2+,So42- yHCO-3 y la clorinidad RESULTADO Y DISCUSIÓNDe la figura 2, se puede observar que las variaciones en la concentración del sodio y el magnesio son similares a las que se tendrían por evaporación gradual de agua de mar; la pendiente de la recta para el caso del sodio es 0.5582, este valor para el agua de mar es 0.55653 (Millero, 1974) lo mismo ocurre para el magnesio cuya pendiente es 0.0669 correspondiendo al agua de mar un valor de 0.0668 (Millero, 1974) . En el caso del potasio se observa que a pesar de la buena correlación, su pendiente (0.0140) es sensiblemente diferente a la del agua de mar 0.0206 (Millero, 1974). Desafortunadamente, no existen suficientes datos para explicar las causas de este comportamiento anómalo del potasio, que deberá ser motivo de un estudio especial considerando también, los métodos analíticos. El calcio y los sulfatos tienen un comportamiento lineal (r = 0.998; r = 0.999 respectivamente), si la clorinidad es menor de 65%o. La pendiente de la recta, para el caso del calcio, es 0.0210 y de 0.02127 para el agua de mar (Millero, 1974). Para clorinidades mayores de 65% los puntos se apartan del comportamiento lineal, esto coincide con observaciones de estudios anteriores de Copeland (1974) y Borchet (1965) en los que se comprobó que el sulfato de calcio se precipita como yeso (Ca S04 2 H2O) a clorinidades similares. Dado que se determinaron solo dos puntos después de que empieza a precipitar el calcio como sulfato no es posible determinar el valor de la clorinidad a la cual empezó a depositarse el yeso. El ion bicarbonato presenta un comportamiento irregular que no sigue el proceso propuesto por Copeland (1974) para este ion. Esta diferencia se debe a que Copeland trabajó con agua de mar en un experimento del laboratorio sin la influencia ocasionada por organismos que afectan al sistema CO20, CO3=, HCO3- como en el presente caso. En la figura 3 se presenta la gráfica de la suma total de los iones analizados y expresados en partes por mil (%o), que se puede considerar como una aproximación de la salinidad, contra la clorinidad. ConclusionesCONCLUSIONESDe los resultados obtenidos se puede concluir que los iones analizados se comportan en el agua de la laguna en forma similar a la que tienen en el agua de mar sometida a un proceso de evaporación, las únicas excepciones a este comportamiento, lo presentan los iones potasio y bicarbonato. Para el ion bicarbonato este comportamiento se debe principalmente a efectos causados por la base biológica y para el potasio probablemente se deben a efectos de tipo geográfico pero esto deberá ser comprobado. LITERATURABORCHET, H., Chemical Oceanography. Principles of oceanic salt depositation and metamophism. In: Riley, J. P. and G. Skirrow (Eds.) Academic Press London New York 1965. 205-276 2 COPELAND, B. J. S. W NIXON Coastal Ecological Sistemes of the United States. Hypersaline Lagoons. In: Odurn, H. T., B. J. Copland and E. A. McMahom (Eds.) Conserv. Found, Wash. 1974. 312-379. 1 COX, R. A. McCARTNEY F. CULKIN Deep-Sea Res. Pure water for reactive density standard 1966. 319-325. 15 CULKIN, F. R. A. Cox Deep-Sea Res. Sodium, potassium, magnesium, calcium and strontium in sea water. 1966. 789-804. 13 EDMOND, J. M., Deep-Sea Res. High precision determination of titration alkalinity and total carbon dioxide content of sea water by potentiometric tritation. 1970. 737-750. 17 FRIEDMAN, H. L., J. Chem. phys. Mayer's ionic solution theory applied to electrolyte mixtures. 1960. 1134-1144. 32 GAARRELS, R. M. M. E. THOMPSON A Chemical model for sea water at 25ºC and one atmosphere total presure. Amer. J. Sci. 1962. 57-66. 260 HARNED, H. S. R. A. ROBINSON Multicomponent Electrolyte Solutions Pergamon Press Oxford, England, 1968. 110 p. JANGER, D. The determination of sulphate in sea water by means of photometric tritation with hydrochloric acid in dimetil sulfoxide. Anal. Chim. Act. 1970. 483-490. 52 KESTER, D. R., Limnol. Oceanogr. Sodium, magnesium and calcium sulfate ion-pairs in seawater at 25ºC. 1969. 686-692. 14: LANKFORD, R. R., Estuarine Processes Coastal Lagoons of Mexico. Their origin and classification. In: Wiley, M. (Ed.) Est. Res. Fed. Galv Texas 1977. 182-215. 2: Oct. 5-9, 1975 LEYENDEKKERS, J. V., The chemical potencials of seawater components. Mar. Chem. 1972. 75-88. 1: MILLERO, F. J., The physical chemistry of seawater. Ann. Rev. Earth planet. Sci. 1974. 101-150. 2 Chemistry of the Coastal Environment The physical chemistry of estuaries. In: Church (Ed.) Adv. Chem. Ser. Am. Chem. Soc. Wash., D. C. 1975. MILLERO, F. J. D. LAWSON A. GONZÁLEZ The density of artificial river and estuarine waters. J. Geophys. Res. 1976. 1177-1179 81: RILEY, J. P., Chemical Oceanography. Analytical Chemistry of Sea Water. In: Riley J. P. and G. Skirrow (Eds.) Academic Press, London, New York, 1975. 193-547. 3: ROBINSON, R. A. R. H. WOOD Calculations of osmotic and activity coefficients of sea water at 25°C. J. Soln. Chem. 1972. 481-488. 1: SCATCHARD, G., The excess free energy and related properties of solutions containing electrolytes. J. Amer, Chem. Soc., 1968. 3124-3127 90 SILLEN, L. G., Oceanographic Amer. The physical chemistry of sea water. In: Sears, M. (Ed.) Asoc. Adv. Sci., Wash., D. C. 1961. 549-581
|

