|
ECOLOGÍA EN LA BOCA DE PUERTO REAL, LAGUNA DE
TÉRMINOS I. DESCRIPCIÓN DEL ÁREA Y ANÁLISIS
ESTRUCTURAL DE LAS COMUNIDADES DE PECES
Trabajo presentado en el VI
Congreso Nacional de Oceanografía, Ensenada B. Califronia,
México, 10 al 13 de abril, 1978. Proyecto Especial del Programa Regional
de Desarrollo Científico y Tecnológico de la Organización
de los Estados Americanos (OEA) . Recibido el 15 de febrero de 1978 y aceptado
para su publicación el 28 de febrero de 1978
ERNESTO BRAVO-NÚÑEZ
ALEJANDRO YÁÑEZ-ARANCIBIA
Universidad Nacional Autónoma de
México, Centro de Ciencias del Mar y Limnología, Laboratorio de
Ictiología y Ecología Estuarina. Contribución 121 del
Centro de Ciencias del Mar y Limnología, UNAM.
Se discute un ciclo anual (sep. 1976-ago-1977).
Analizados 978 ejemplares de 18 colectas diurnas se considera que la fauna
ictiológica de la Boca de Puerto Real está compuesta por 24
familias, 42 géneros y 53 especies. Las familias mejor representadas en
diversidad fueron Sciaenidae (8 especies), Pomadasyidae (7) y con 3 especies
Engraulidae, Syngnathidae, Sparidae, Balistidae y Tetraodontidae.
La dinámica ambiental del área determina
el establecimiento de dos tipos de comunidades nectónicas (BPR-1 y
BPR-3) separadas por una barrera hidrodinámica e influidas por los
siguientes patrones ecológicos: 1) corrientes, 2) sustrato, 3)
profundidad, 4) Macroepifauna bentónica, 5) vegetación sumergida,
6) disponibilidad de alimento, 7) transparencia, 8) oleaje.
BPR-1: Diversidad íctica total anual 31
especies; especies tipo Orthopristis chrysopterus Haemulon plumieri,
Archosargus unimaculatus, Corvula sanctae-luciae; H' numérico
de 1,4344 a 2,1867; H' biomasa de 1,0474 a 2,3119; densidad de 0.001 a 0.054
indiv/m2; biomasa de 0.97 a 2.23
g/m2; especies visitantes ocasionales 14 (28%) ;
especies en tránsito 12 (24%) ; especies residentes permanentes 4 (8%) ;
consumidores de primer orden 4 (13%); consumidores de segundo orden 17 (55%) ;
consumidores de tercer orden 10 (32%) salinidades de 29 a
380/00; temperaturas de 21 a
29°C, oxígeno de 2.6 a 6.4 ml 02/1; sustrato
lodoso de arena fina limo arcillosa con 50 a 60%, de
CaCO3 y alto contenido orgánico; profundidades
hasta de 4 m; macroepifauna variada y abundante; vegetación de praderas
de Thalassia testudinum, transparencia de 64%; alta
disponibilidad de alimento; oleaje moderado.
BPR-3: Diversidad íctica total anual 29
especies; especie tipo Sphoeroides testudineus; H'
numérico de "cero" a 1,6463; H' biomasa de "cero" a 1,7640; densidad de
"cero" a 0. 111 indiv./m2; biomasa de "cero" a 11
g/m2; especies visitantes ocasionales 16 (32%) ;
especies, en tránsito 12 (24%) ; especies residentes permanentes 1 2%) ;
consumidores de primer orden 9 (31 %) ; consumidores de segundo orden 12 (41
%,) ; consumidores de tercer orden 8 (28%) ; salinidades de 27 a
380/00; temperaturas de 22 a
29° C; oxígeno de 3.4 a 5.4 ml 02/l; sustrato
arenoso de arena limo arcillosa con 60 a 70% de CaCO3 y
bajo contenido orgánico; profundidades hasta de 5 m; macroepifauna poco
variada y poco abundante; vegetación de Rhodophyceae
y Phaeophyceae transparencia de 48%; relativa disponibilidad
de alimento; oleaje fuerte.
La afinidad establecida entre BPR-1 y BPR-3 fue de
6.6% para visitantes ocasionales (Urolophus jamaicensis y
Lutjanus synagris), 12.5% para especies en tránsito
(Arius felis, Bairdiella chrysura y Monacanthus
hispidus) y de "cero" para especies residentes permanentes, lo que
refuerza lo diferente de las dos comunidades.
Se demuestra una sucesión de especies en ambas
comunidades concluyéndose que la Boca de Puerto Real es un ecosistema
dinámico, de ictiofauna transicional y poco propicio para el
establecimiento de comunidades permanentes. Representa la puerta de entrada al
ecosistema lagunar estuarino del interior de la Laguna de
Términos.
An annual cycle
is considered (Sept. 1976 - Aug. 1977). From analysis of 978 samples
from 18 diurnal collections the ichthyological fauna of the entrance
of Puerto Real, appears to be composed of 24 families, 42 genera and
53 species. The families with most diverse representation were Sciaenidae
(8 species) . Pomadasydae (7) and, with 3 species each, Engraulidae,
Syngnathidae, Sparidae, Balistidae, and Tetraodontidae. The environmental
dynamics of the study arca determine the establishment of two types
of nektonic communities (BPR-1 and BPR-3), separated by a hydrodynamic
barrier and influenced by the following ecological factors: 1) currents,
2) substrate, 3) depth, 4) benthic macroepifauna, 5) submerged vegetation,
6) available food, 7) transparency, 8) waves. BPR-1: total
annual ichthyological diversity 31 species with typical species: Orthopristis
chrysopterus, Haemulon plumieri, Archosargus unimaculatus, Corvula sanctae-luciae;
H' number from 1,4344 to 2,1867; H' biomass from 1,0474 to 2,3119; density
from 0.001 to 0.054 indiv./m2; biomass from 0.97 to 2.23
g/m2; occasional visitant species 14 (28%) ; species in-transit
12 (24%) ; permanent residents 4 (8%) ; Ist order consumers 4 (13%)
; 2nd order consumers 17 (55%); 3rd order consumers 10 (32%); salinities
from 29 to 38 ppt; temperatures from 21 to 29° C; oxygen from 2.6
to 6.4 ml 02/1; substrate muddy with fine sand and clayey
silt with 50 to 60% CaC02 and a high organic content; depths
to 4 m; macroepifauna varied and abundant; vegetation including banks
of Thalassia testudinum; transparency 64%; high food availability;
moderate waves. BPR-3: total
annual ichthylogical diversity 29 species with typical specie Sphoeroides
testudineus; H' number from "zero" to, 1,6463; H' biomass from "zero"
to 1,7640; density from "zero" to 0.111 indiv./m2; biomass
from "zero" to 11 g/m2; occasional visitant species 16 (32%);
species in-transit 12 (26%) ; permanent residents 1 (2%) ; Ist order
consumers 9 (31%) ; 2nd order consumers 12 (41%) ; 3rd order consumers
8 (28%) ; salinities from 27 to 38 ppt; temperatures from 22 to 29°
C; oxygen from 3.4 to 5.4 m1 02/ 1; sandy substrate of sand
with clayed silts with 60 to 70%, CaC03 and low organic content;
depths to 5 m; macroepifauna little variation and low abundance; vegetation
of Rodophytes and Phaeophytes; transparency of 48%; relatively
abundant food; strong wave motion. The affinity
established between BPR-1 and PBR-3 was 6.6% for occasional visitors
(Urolophus jamaicensis and Lutjanus synagris) ; 12.5%
for species in-transit (Arius felis, Bairdiella chrysura, and
Monacanthus hispidus), and "zero" for permanent residents, reforcing
the difference, between the two communities. A sucession
of species is demonstrated in each community showing that the entrance
to Puerto Real is a dynamic ecosystem of transitional ichthyofauna and
not very propicious for the establishment of permanent communities.
The system represent the entrance to the estuarine lagoon ecosystem
of the interior of the Términos Lagoon. En septiembre de 1976 el Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México, inició diferentes actividades de investigación en la Estación de Investigaciones Marinas que se encuentra en Ciudad del Carmen, Camp. Estas investigaciones tienen un carácter multidisciplinario y forman parte de un basto programa de investigaciones financiado, en cierta medida, por la Organización de los Estados Americanos a través de su Programa Regional de Desarrollo Científico y Tecnológico. Este programa de investigaciones se denomina "Recursos Bióticos en Lagunas Costeras, Manglares y Áreas Adyacentes en América Latina (Proyectos Pilotos Comparativos en el Golfo de Nicoya, Costa Rica; Bahía de Puerto Viejo, Azua, República Dominicana, Laguna de Términos, Campeche, México) ". Entre los planteamientos iniciales del mencionado proyecto, se hizo énfasis que la Laguna de Términos y sus áreas adyacentes representan un complejo ecosistema aparentemente de alta productividad biológica, pero que la incidencia de esta productividad, tanto en la propia laguna como en la Sonda de Campeche adyacente, es desconocida. En otras palabras las hipótesis de trabajo planteaban la necesidad de establecer, en forma cuantitativa, si la Laguna de Términos es un área que debe ser explotada intensivamente desde el punto de vista pesquero, o sólo explotada parcial y racionalmente, por cuanto puede ser más importante como área natural de crianza. Asimismo la necesidad de establecer cuál es el significado de la laguna en la alta productividad pesquera de la Sonda de Campeche. Necesariamente un enfoque de esta naturaleza debe ser el reflejo, de estudios interdisciplinarios y con una proyección de varios años. Así se ha entendido en el Laboratorio de Ictiología y Ecología Estuarina del Centro de Ciencias del Mar y Limnología, por lo cual se precisaron diferentes áreas dentro de la Laguna de Términos, por ser consideradas ecológicamente estratégicas. La Boca de Puerto Real es una de esas áreas y los. resultados del primer ciclo anual son discutidos en este trabajo sobre la base de los siguientes objetivos propuestos inicialmente: 1. Conocer la dinámica ambiental del área sintetizando los aspectos climáticos, geológicos, hidrográficos y biológicos. 2. Determinar la flora y los grupos macrofaunísticos más comunes. 3. Determinar la composición de la fauna ictiológica. 4. Determinar aspectos ecológicos generales para cada una de las especies estudiadas. 5. Determinar la estructura de las comunidades de peces sobre la base de: las diferentes categorías ictiotróficas, diversidad, frecuencia, afinidad, abundancia y variación estacional dé las especies y poblaciones. 6. Establecer algunos valores de productividad pesquera en términos de diversidad y abundancia (densidad y biomasa) para discutir la relación: áreas de explotación v/s áreas de crianza. ANTECEDENTESRecientemente Lankford (1977) ha reportado que en México existen 123 a 125 lagunas costeras. Cárdenas (1969), y Yáñez-Arancibia (1975, 1976a y 1976b) han señalado, que estas áreas representan 12,555 km2 de superficie o bien 1.5 millones de Ha de zonas estuarinas, repartidas a lo largo de los 10,000 km de costa. Esta situación litoral excepcional representa un patrimonio cultural y económico transcendental en el futuro desarrollo socio-económico del sector pesquero (Yáñez-Arancibia, 1977a). Importantes renglones de la producción pesquera nacional se obtienen en estos cuerpos de agua cuya explotación, por otra parte, resulta más accesible debido a que no es necesario contar con equipo costoso para la extracción del recurso.. Por otra parte, se ha discutido que más del 80% de los peces litorales utilizan las lagunas costeras y estuarios en alguna etapa de su vida (Yáñez-Arancibia y Nugent, 1977). Dentro de estos sistemas, ecológicos costeros, la Laguna de Términos reviste interés particular, puesto que corresponde a una de las lagunas costeras más grande del país con un área aproximada, de 2,500 km2 y se encuentra ubicada frente a una de las zonas más productivas del Golfo de México, la Sonda de Campeche (Carranza, 1969; Sauskan y Olaechea, 1974; Klima, 1976). Presenta gran diversidad de habitats y es un enorme potencial como criadero de especies litorales que tienen importancia comercial bien establecida (i. e., ostión, caracol, camarón, jaibas y peces). El incipiente aprovechamiento de estos recursos costeros, hace necesario el conocimiento integral del ecosistema con el fin de llegar a efectuar una evaluación real y concreta del potencial pesquero del sistema, tanto para especies actualmente explotadas, como para aquellas que aún no sufren presión de pesca alguna y que representan un recurso económico potencial. Con anterioridad la Laguna de Términos ha sido objeto de muy diversos estudios con diferentes enfoques, tanto de su fauna y flora, como de su geología y condiciones físico-químicas. Entre los principales, se pueden citar el estudio biológico general de Zarur-Menez (1961 y 1962); de la microfauna, Ayala-Castañares (1963), García-Cubas (1963), Morales (1966); del plancton, Silva-Bárcenas (1963), Suárez-Caabro y Gómez-Aguirre (1965) y Gómez-Aguirre (1965 a, b y 1974), Loyo-Rebolledo (1965) de quetognatos, Laguarda-Figueras (1967) de protozoarios, Marrón-Aguilar y López-Ochoterena (1969) ; de vegetación sumergida, Sauer (1967) y Ortega (1969); de geología y procesos geológicos, Thom (1969), Phleger y Ayala-Castañares (1971), Yáñez-Correa (1963 y 1968) y Cruz-Orozco et al. (1977); de ictiología, Toral (1971), Toral y Reséndez (1974) y Carvajal (1975) ; de los recursos naturales generales, Coll de Hurtado (1972) ; de camarones, Signoret (1974) ; de productividad general, Carvajal (1973) ; de almejas comerciales, Ruiz (1975) ; de poliquetos, Marrón-Aguilar (1975) ; de fauna epizoica de manglar, Espinosa (1976), y aspectos físico-químicos generales, SRH (1976). De todos los estudios mencionados, sólo tres de ellos se refieren a estudios ictiológicos especializados y tratan específicamente sobre aspectos taxonómicos, excepto Carvajal (1975) que discute aspectos biológicos refiriéndose solamente a dos especies de robalos, un informe preliminar a estos estudios de Yáñez-Arancibia et al. (1977) y un trabajo recientemente terminado de Amezcua-Linares y Yáñez-Arancibia (1979). ÁREA DE ESTUDIOEl área de la Laguna de Términos (Fig. 1) ha sido parcialmente descrita. Desde el punto de vista geológico y/o geomorfológico por Ayala-Castañares (1963), Thom (1969), Phleger y Ayala-Castañares (1971), Coll de Hurtado (1975), Cruz-Orozco et al. (1977), e indirectamente por CarranzaEdwards et al. (1975) y Lankford (1977). Desde el punto de vista hidrográfico, por Yáñez-Correa (1963), Gómez-Aguirre (1965a, 1965b y 1974), Phleger y Ayala-Castañares (1971), Secretaría de Recursos Hidráulicos (SRH, 1976). Desde el punto de vista climatológico por García (1973), Coll de Hurtado (1975), Carvajal (1973). Desde el punto. de vista biológico se encuentran los estudios de plancton de Silva Bárcenas (1963), Gómez-Aguirre (1965 a, 1965 b y 1974), Suárez-Caabro, y Gómez-Aguirre (1965), Loyo Rebolledo (1965), Laguarda-Figueras (1967), Marrón Aguilar y López Ochoterena (1969) ; sobre bentos de Ayala-Castañares (1963), García-Cubas (1963), Morales (1966), Ortega (1969), Solís-Wolfwitz (1973), Signoret (1974), Marrón Aguilar (1975), Ruiz (1975), Espinosa (1976) ; sobre necton y otros recursos pesqueros Zarur-Menez (1961 y 1962), Carranza (1969), Toral (1971), Carvajal (1973 y 1975), Toral y Reséndez (1974), Amezcua-Linares y Yáñez-Arancibia (1979). Algunos de estos antecedentes parciales, más las observaciones de este estudio permiten establecer el siguiente panorama ambiental para la Boca de Puerto Real. CLIMALa Laguna de Términos y áreas adyacentes se encuentran en una zona tropical con temperaturas anuales superiores a los 26°C y precipitaciones anuales entre 1,100 y 1,900 mm (Tabla l). Las lluvias son frecuentes en verano y mucho menores en invierno. La figura 2 muestra la relación pluvial para Ciudad del Carmen con los datos de la tabla 1. La precipitación más baja se presenta a fines del invierno, y comienzos de la primavera y las máximas durante los meses de agosto, septiembre y octubre. Las lluvias de noviembre hasta enero son causadas principalmente por el fenómeno de los "nortes" que son vientos que azotan la costa de Campeche después de atravesar el Golfo. La figura 2 muestra que entre octubre y noviembre aumenta el número de días con "norte" (Tabla 2) . Hay una relación directa entre la precipitación y el número de días con nortes anticiclónicos. En los meses de verano pueden presentarse ocasionalmente ciclones y tormentas tropicales. Figura 1 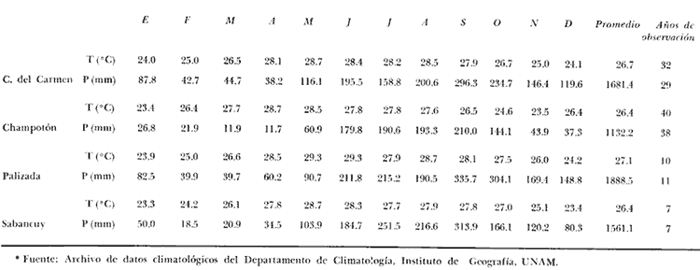 TABLA 1 DATOS CLIMATOLÓGICOS DEL ÁREA LAGUNA DE TÉRMINOS* 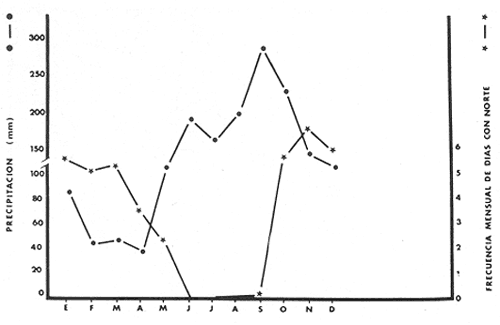 Fig. 2. Relación pluvio climática en el área de la Laguna de Términos (ver Tablas 1 y 2). De acuerdo a la clasificación de García (1973) el clima predominante en toda la Laguna de Términos sería del Tipo Amw, esto es: clima cálido subhúmedo, isotermal, con lluvias en verano, comprendiendo toda la porción sur y oriental con la excepción del río San Pedro. El clima determina el suelo y la vegetación, condiciona el drenaje y es un factor de importancia en la evolución geomorfológica del relieve. GEOMORFOLOGÍA Y RASGOS TOPOGRÁFICOSUn rasgo distintivo típico de la Boca de Puerto Real es el delta de marea que se presenta hacia el interior de la laguna (Fig. 3). Cruz-Orozco et al. (1977) señalan algunas importantes características de esta zona y por ser consideradas trascendentes es necesario mencionarlas. La punta sureste de Isla Aguada ha crecido en dirección sureste a una velocidad de 3 m/año. La tasa de crecimiento de los bajos en el sentido de su eje mayor se estima en aproximadamente 1 m/año y 0.4 m/año en el sentido transversal. El delta de flujo de mareas está formado por tres sistemas de bajos bien definidos de los cuales el mayor se sitúa al este, contiguo a Isla Aguada. Los bajos más largos son bisectados por corrientes que emigran lateralmente. La forma general de los bajos es alargada paralela a los canales de marea, con su extremo hacia la Boca de Puerto Real terminado en punta. La forma de los bajos en el extremo hacia la laguna es normalmente achatada, principalmente en los bajos de los Grupos A y B. La superficie para los tres sistemas de bajos es Grupo A: 6.5 Km2, Grupo B: 1 km2 y Grupo C: 2.3 km2. Yáñez-Correa (1963) ha mostrado en un perfil batimétrico que la Boca de Puerto Real presenta un canal principal de circulación desplazado hacia la orilla de Isla Aguada, allí la playa es inclinada en forma muy diferente a la planicie y longitud de la pendiente de la playa de Isla del Carmen. Recientemente Cruz-Orozco et al. (1977) establecen que la topografía ondulada de la porción noroeste de la Boca de Puerto Real es característica de un terreno cubierto por cordones de playa. Éstos funcionan como canales de flujo. y reflujo erosionando los sedimentos de esas depresiones. Las porciones positivas tienen el aspecto de afloramientos rocosos alargados y paralelos a los canales. Los canales de esa porción noroeste son angostos y pueden variar desde cotas de -3 hasta -6 m. SEDIMENTOSLa Boca de Puerto Real ha sido considerada por Yáñez-Correa (1963) como un "ambiente sedimentario" donde las corrientes litorales mueven los materiales principalmente de origen marino cerca de la costa en donde la acción de las corrientes de mareas y la geomorfología del área ayudan para que un gran volumen de ellos sea transportado hacia el interior de la laguna y otra parte sea depositado en la playa por la acción del oleaje. Los sedimentos depositados incluyen materiales gruesos y fragmentos finos, así como no-clásticos y materia orgánica. La mayoría de las fracciones gruesas contienen abundantes restos vegetales.  TABLA 2 FRECUENCIA MENSUAL DE LOS NORTES ANTICICLÓNICOS DEL GOLFO DE MÉXICO; TIPO: NORTES QUE YA PASARON POR VERACRUZ* 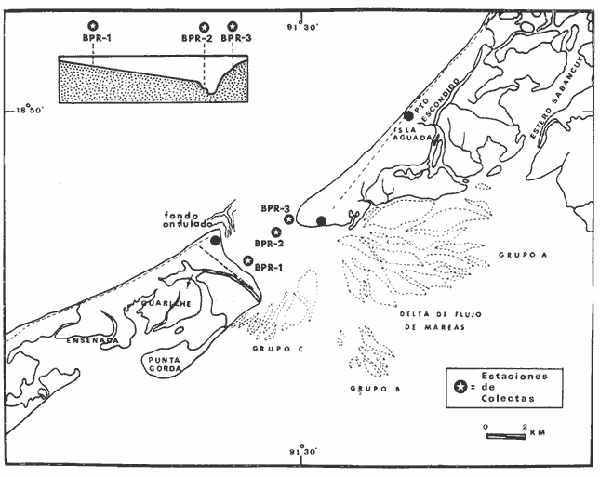 Fig. 3. Geomorfología y rasgos topográficos generales de la Boca de Puerto Real. Se señala la ubicación de las estaciones de colecta, un perfil batimétrico esquematizado y la ubicación de diferentes grupos de "bajos" del delta interior de mareas. Los contenidos de Ca C03 más altos se encuentran en los sedimentos de la Boca de Puerto Real, donde Yáñez-Correa (1963) reporta entre un 50 y 60% en el área denominada BPR-1 de este estudio y entre 60 y 70% en el área denominada BPR-3. Estas áreas de máximos porcentajes parecen ser el resultado del gran aporte de material carbonatado de origen marino acarreado por las corrientes de mareas al interior de la laguna. En la zona BPR1 el contenido de materia orgánica es muy alto como consecuencia del impacto ecológico de las praderas de Thalassia testudinum. HIDROLOGÍA Y CORRIENTESLa hidrología del área de la Laguna de Términos está influida por el sistema Grijalva-Usumacinta y por el drenaje típico de zona caliza, en seguida es importante la cuenca del río Candelaria, río Champotón y luego los conjuntos formados por el sistema Pom-Atasta, el río Chumpán y el río Mamantel (Fig. l). Todo esto es uno de los rasgos característicos de la Laguna de Términos y determina una ecología particular de los sistemas fluviolagunares existentes (Amezcua-Linares y Yáñez-Arancibia, 1979). En la Boca de Puerto Real la influencia de aguas dulces es muy poco manifiesta. Esto puede ser el reflejo de un flujo de transporte neto hacia dentro de la laguna, desde el mar. El delta de flujo de mareas así lo indica. Yáñez-Correa (1963) reporta valores de salinidad superficial y de fondo de 39%0, temperaturas entre 29 y 30°C para los meses, de marzo-abril. Cruz-Orozco et al. (1977) reporta para el sector noreste del Grupo. A de bajos del delta (Fig. 3) salinidades entre 27 y 31°/oo y temperaturas de 23°C para el mes de febrero; y para el sector central del mismo Grupo A, salinidades entre 37.3 y 37.6°/oo y temperaturas entre 26 y 27°C para el mes de julio. En estos estudios (Tablas 3, 4, 5 y 6) , en la zona BPR-1 las salinidades presentan un rango superficial y de fondo de 29 a 38°/oo, la temperatura superficial de 22 a 29°C y de fondo de 29 a 28°C el oxígeno superficial de 4.29 a 6.40 ml 02/1 y de fondo de 2.59 a 6.40 ml 02/1 la profundidad de 1.5 a 4 m, la transparencia es estimada en un 64%. En la zona BPR-2 las salinidades presentan un rango superficial de 21 a 38°/00, y de fondo de 30 a 38°/oo la temperatura superficial de 22 a 28°C y de fondo de 25 a 27.4°C, el oxígeno superficial de 3.2 a 5.5 ml02/1, la profundidad de 3.5 a 10 m, la transparencia es estimada en un 35%. En la zona BPR-3 las salinidades presentan un rango superficial de 28 a 38°/oo y de fondo de 9-7 a 38°/oo, la temperatura superficial de 22 a 29°C y de fondo de 26 a 28°C, el oxígeno superficial de 3.44 a 5.4 ml 02/1 y de fondo de 3.9 a 5.3 ml 02/1, la profundidad de 2 a 5 m, la transparencia es estimada en un 48%. Cruz-Orozco et al. (1977) establecen que la circulación principal se concentra sobre la zona del canal principal de Puerto Real, el mayor efecto de flujo se deja sentir hacia los bajos del Grupo A del delta de flujo de mareas En la figura 4 se esquematiza el patrón de circulación sobre la base de los resultados de esos autores. 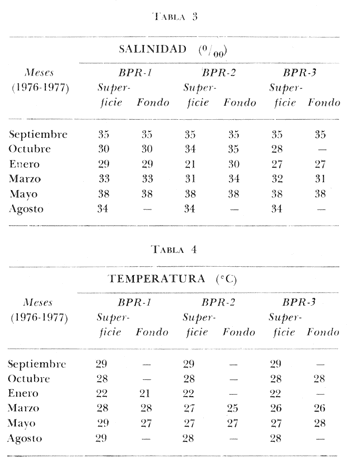 TABLA 3 Y TABLA 4 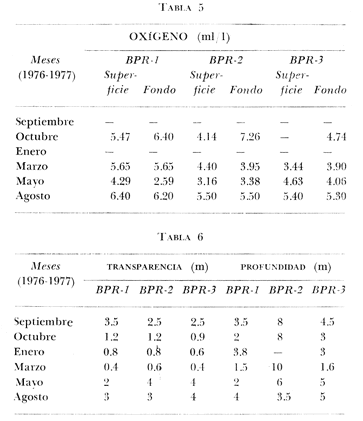 TABLA 5 Y TABLA 6 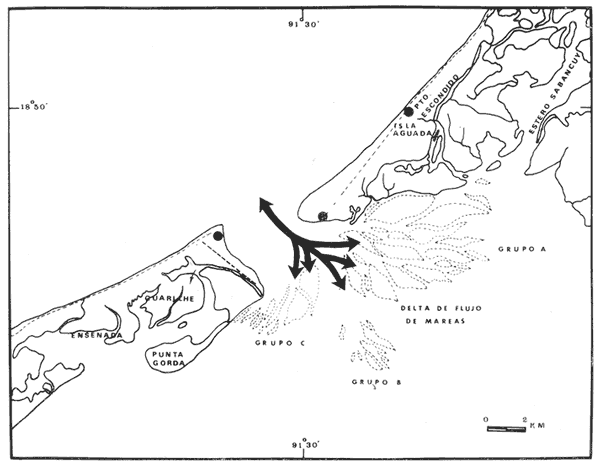 Fig. 4. Principal patrón de corrientes de la Boca de Puerto Real. Esquematizado de acuerdo a la información de Cruz Orozco et al. (1977). VEGETACIÓNEn la Boca de Puerto Real existe una vegetación exhuberante, reflejo del clima que impera. La vegetación costera emergente está compuesta por plantas que crecen en la playa y ayudan a la fijación de arena, en la parte más cercana al mar la vegetación puede ser dispersa y predominan Amaranthus gregii e Ipomea pes-coprae (Fig. 5) ; más adentro pueden encontrarse matorrales de Acacia sp, Randia acubate y también Coccoloba uvifera. Es común en la Boca de Puerto Real que la zona de manglar, Rhizophora mangle y otras, limite, y aun se mezcle, con plantaciones de cocos. Los manglares ubicados en el interior de las playas se encuentran en asociaciones de Rhizophora mangle, Avicenia germinans y Laguncularia racemosa.  Fig. 5. Vegetación costera emergente en el área de la Boca de Puerto Real. Pueden encontrarse Amaranthus gregii, Ipomea pes-coprae, Acacia sp, Randia acubate, Coccoloba uvifera, Rhizophora mangle, Avicenia germinans y Laguncularia racemosa. La vegetación sumergida está representada por praderas de Thalassia testudinum Halodule wrigtii, y Syringodium filiforme en las orillas de la Isla del Carmen (Fig. 6), y por Phaeophyceae y Rhodophyceae en las orillas de la Isla Aguada (Fig. 7). Algunas pocas de estas macroalgas se pueden presentar entre las praderas de Thalassia, pero están sueltas y son batidas por el movimiento de las aguas (Fig. 8).  Fig. 6. Vegetación sumergida en las orillas de la Isla del Carmen en la Boca de Puerto Real. Pueden encontrarse Thalassia testudinum, Halodule wrigtii y Syringodium filiforme. ESTACIONES DE COLETACon los antecedentes de la dinámica ambiental de la Boca de Puerto Real recién discutida en sus aspectos generales y más significativos, se dispuso una red de 3 estaciones (Fig. 3) : BPR-1: Ubicada sobre praderas de Thalassia testudinum en la planicie sumergida de la playa de Isla del Carmen frente a la Boca de Puerto Real.  Fig. 7. Vegetación sumergida en las orillas de la Isla Aguada en la Boca de Puerto Real. Pueden encontrarse macroalgas Rodophyceae y Phaeophyceae predominando Gracilaria confervoides y otras. BPR-2: Ubicada sobre el canal principal de circulación. BPR-3: Ubicada sobre la planicie sumergida de la playa de Isla Aguada, frente a la Boca de Puerto Real, predominando la vegetación sumergida de Rhodophyceae y Phaeophyceae.  Fig. 8. Parches de Thalassia testudinum con algunas macro algas Phaeophyceae y Rhodophyceae "sueltas", en las orillas de la Isla del Carmen en la Boca de Puerto Real. MATERIAL Y MÉTODOS
ACTIVIDADES DE CAMPOLas capturas de la ictiofauna fueron realizadas a bordo de una embarcación de fibra de vidrio de 7 m de eslora con el fondo casi plano y quilla marina, equipada con un motor de 40 H.P. El arte de pesca empleado, consistió de una red de prueba camaronera de 10 m de largo, boca de 9 m (5 m abertura de trabajo) con dos portalones 0.8 X 0.5 m cada uno y de pulgada de abertura de malla. Se efectuaron 6 cruceros generales: 1er. crucero: del 20 al 24 de septiembre de 1976 2o. crucero: del 18 al 27 de octubre de 1976 3er. crucero: del 18 al 22 de enero de 1977 4o. crucero: del 2 al 11 de marzo de 1977 5o. crucero: del 2 al 6 de mayo de 1977 6o. crucero: del 16 al 20 de agosto de 1977 Todas las capturas se realizaron durante el día en profundidades que no excedieron los 4 m planificados de manera que se cubriera de la mejor forma posible los diferentes ambientes del área. En la figura 3 se señalan las estaciones de colecta. En cada estación se efectuó un arrastre de pesca cuantificándose la densidad y biomasa ictiofaunística. El material recolectado era rápidamente llevado a la embarcación fijándose en formalina al 10% neutralizada previamente con Borato de Sodio. Los estómagos se inyectaron, ya que el retardar la fijación del contenido estomacal hace que se vuelva irreconocible después de 20 minutos. Posteriormente el material se etiquetó y envasó en bolsas de polietileno para su transporte al laboratorio. Para cada arrastre de pesca se tomaron muestras de agua con una botella Van-Dorn efectuándose mediciones de: temperatura con un termómetro Kalcico; salinidad con un refractómetro convencional; oxígeno por el método Winkler; profundidad y transparencia con un disco de Secchi graduado cada 20 cm. Posteriormente la transparencia fue estimada porcentualmente en relación a la profundidad de la siguiente manera: T = Σt/p /N X 100 (1) donde T = Porcentaje anual de la transparencia; t = transparencia en un muestreo; P = profundidad en el muestreo correspondiente y N = número total de eventos de t/p. Asimismo se realizaron observaciones respecto de: tipo de sustrato, vegetación sumergida y circundante, macrofauna bentónica, mareas y de aspectos climatológicos. MATERIAL DE ESTUDIODe los 6 cruceros generales en el área de estudio (que comprendieron 18 colectas), se obtuvo un total de 978 ejemplares, detallados como sigue: Estación BPR-1: 404 ejemplares Estación BPR-2: 14 ejemplares Estación BPR-3: 560 ejemplares La vegetación y la macrofauna bentónica colectada al mismo tiempo fue separada, fijada y etiquetada para estudios complementarios. ACTIVIDADES DE LABORATORIOEn el laboratorio los peces fueron reetiquetados, reenvasados en frascos de vidrio y preservados en alcohol metílico al 70% para el siguiente análisis: TAXONOMÍALa determinación de las especies fue hecha con métodos convencionales, empleando la literatura básica, principalmente los trabajos de: Jordan y Everman (1896-1900); Meek e Hildebrand (1923-1928) ; S. F. Hildebrand (1943) ; Cervigón (1966) y S. 1. C. (1976), y para su ordenación sistemática se siguieron los criterios de: Greenwood et al. (1966 y 1967) ; Cervigón (1966) y Yáñez-Arancibia (1977 b) . COMPOSICIÓN, DIVERSIDAD Y ABUNDANCIALas comunidades ictiofaunísticas están formadas por diversos componentes, los cuales se determinaron en relación a su origen y frecuencia de aparición, i. e., frecuencia entre 1 y 10% = visitantes ocasionales; entre 30 y 70% = especies en tránsito y entre 80 y 100% = especies permanentes. Estos valores se obtuvieron de la siguiente relación: F = NVA/NTC . (100) (2) donde F = porcentaje de frecuencia; NVA = número de veces de aparición de una especie en una estación de colecta y NTC = número total de colectas en la estación correspondiente. La composición propuesta en este estudio para la boca de Puerto Real, es discutida en relación a los trabajos de Yáñez-Arancibia (1975 a, 1976 y 1977 b), Yáñez-Arancibia y Nugent (1977) y Kikuchi (1966). La diversidad fue considerada como número de especies para cada estación de muestreo y su variación en relación al tiempo y a las características bióticas y abióticas predominantes, además de considerar un índice de diversidad en cada colecta de acuerdo a la fórmula de Shannon y Weaver (1963) cuya expresión matemática es: 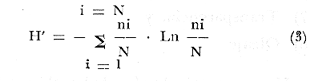 Fórmula (1) donde ni = número de individuos de una especie en una colecta y N = número total de individuos de todas las especies de la colecta. Éste fue un antecedente más para discutir la afinidad ecológica entre las estaciones de colecta. La abundancia fue determinada en términos de densidad (número de ejemplares) y biomasa (peso en fijador) considerando parcelas de muestreo de 2 500 m² que resultan de arrastrar el arte de pesca mencionada una distancia de 500 m de longitud con la boca a 5 m de abertura de trabajo y velocidad entre 1 y 3 nudos y un tiempo de arrastre de +- 30 minutos. Se consideró un índice de biomasa que se obtiene de utilizar la relación de Shannon y Weaver (1963) reemplazando el número de individuos de una especie en una colecta por gramos de los mismos y el número total de individuos de todas las especies de la colecta por los gramos totales de la misma. Este aspecto ha sido muy poco discutido (Wilhm, 1968). Aparentemente existe una relación directa de los dos índices, i. e., H' de Shannon y Weaver (196 3) y H' de Wilhm (1968); sin embargo el de diversidad otorga la misma importancia a especies de gran tamaño y a las de tamaño pequeño y el índice de biomasa destaca esta diferencia. En este trabajo se consideran complementarios. La fórmula modificada de Shannon y Weaver (1963) para el índice de biomasa sería: 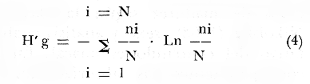 Fórmula (2) donde ni = gramos de una especie en una colecta y N = gramos totales de todas las especies de la colecta. RELACIONES TRÓFICASEl examen de los estómagos, el estado del pez y las fases de digestión del contenido estomacal se hizo. siguiendo el criterio de los métodos considerados por Yáñez-Arancibia (1975 b) y Yáñez-Arancibia et al. (1976). La categorización ictiotrófica fue ordenada de acuerdo a la clasificación en tres categorías ictiotróficas de peces de ambientes lagunares-estuarinos, propuesta por Yáñez-Arancibia (1977 b y 1978a). Las tres categorías ictiotróficas corresponden a: 1) Consumidores Primarios, categoría en la que se incluyen, a) Planctófagos (fito y/o zoo), b) Detritívoros (y otros restos vegetales), y c) Omnívoros (detritus, vegetales y fauna de pequeño tamaño). 2) Consumidores Secundarios, categoría en la que se incluyen los peces predominantemente carnívoros, aun cuando pueden incluir en su dieta algunos vegetales y detritus pero sin mucha significación cuantitativa. 3) Consumidores de Tercer Orden, categoría en la que se incluyen peces exclusivamente carnívoros, donde los vegetales y el detritus son un alimento accidental. Los porcentajes de las categorías ictiotróficas fueron obtenidos con el total de especies en la estación correspondiente (Tablas 10 y 11) . ASPECTOS BIOLÓGICOS GENERALESPara todas las especies fueron obtenidas medidas de peso y longitud. Además para las especies de importancia comercial se obtuvieron datos de madurez según la clasificación de Nikolsky (1963), sexo y análisis cuali y cuantitativo del contenido estomacal. En las tablas correspondientes las abreviaciones utilizadas son: Ejemplos: M 3) = Machos, 3 ejemplares ind 6) = Sexo indeterminado, 6 ejemplares II (10) = Fase de desarrollo gonádico, II, 10 ejemplares. Asimismo se conservó una submuestra de cada especie quedando depositada en la colección ictiológica del Centro de Ciencias del Mar y Limnología y un duplicado en la Estación de Investigaciones Marinas "El Carmen", ambas pertenecientes a la Universidad Nacional Autónoma de México, bajo la clave CCMLPF, Camp. La definición de esta clave se indicó anteriormente en el trabajo de Yáñez-Arancibia (1977 b) . CARACTERIZACIÓN ICTIOECOLÓGICA DE LAS ESTACIONES DE COLECTA Y AFINIDADCada estación fue caracterizada en relación a la ictiofauna típica que presenta (diversidad, componentes comunitarios y categorias ictiotróficas) y su variación en el tiempo. Además de este aspecto fueron comparadas en su afinidad ecológica para delimitar comunidades en relación a los siguientes factores bióticos y abióticos del sistema ecológico: 1) Corrientes 2) Sustrato 3) Profundidad 4) Macroepifauna bentónica 5) Vegetación sumergida 6) Disponibilidad de alimento 7) Transparencia, y 8) Oleaje Un porcentaje de afinidad ecológica fue calculado sobre la base del número de especies comunes. RESULTADOSCOMPOSICIÓN DE LA FAUNA ICTIOLÓGICA El estudio de 897 ejemplares determinó la existencia de 2 clases, 1 subclase, 2 divisiones, 5 superórdenes, 9 órdenes, 10 subórdenes, 24 familias, 41 géneros y 53 especies. El ordenamiento sistemático, a continuación, sigue parcialmente el criterio de Cervigón (1966) para categorías genéricas y específicas y el criterio de Greenwood et al. (1966 y 1967) y Yáñez-Arancibia (1977 b) para categorías supragenéricas. LISTA SISTEMÁTICA DE LOS PECES COLECTADOS Phylum Chordata Subphylum Vertebrata A. CLASE CHONDRICHTHYES Subclase Elasmobranchii Orden Batoidei Familia I Urolophidae Género 1 Urolophus Müller y Henle, 1838 Especie 1) Urolophus jamaicensis (Cuvier, 1817) B. CLASE OSTEICHTHYES División Taeniopaedia Superorden Clupeomerpha Orden Clupeiformes Suborden Clupeoidei Familia II Clupeidae Género 2 Opisthonema Gill, 1861 Especie 2) Opisthonema oglinum (Le Sueur, 1817) Género 3 Sardinella Vaalenciennes,1847 Especie 3) Sardinella macrophthalmus ( Ranzani, 1842) Familia III Engraulidae Género 4 Anchovia Jordan y Evermann, 1896 Especie 4) Anchovia sp. Género 5 Anchoa Jordan y Evermann 1927 Género 5 Anchoa hepsetus hepsetus Hildebrand, 1943 Género 6 Anchoviella Fowler, 1911 Especie 6) Anchoviella sp División Euteleostei Superorden Protacanthopterygii Orden Salmoniformes Suborden Myctophoidei Familia IV Synodontidae Género 7 Synodus Scopeli,1777 Especie 7) Synodus foetens (Lnnaeus, 1776) Superorden Ostariphysi Orden Siluriformes Familia V Ariidae Género 8 Arius Cuvier y Valenciennes, 1840 Especie 8) Arius felis (Linnaeus,1766) Superorden Paracanthoterygii Orden Gobiespciformes Familia VI Gobiesocidae Género 9 Gobiesox Lacépède, 1800 Especie 9) Gobiesox strumosus Cope, 1870 Superorden Aconthopterygii Orden Gastereosteiformes Suborden Syngnathoidei Familia VII Syngnatidae Género 10 Hippocampus Rafinesque, 1810 Especie 10) Hippocampus hudsonius punctulatus Guichenot, 1853 Género 11 Syngnathus Linneus, 1758 Especie 11) Syngnathus rousseau Kaup, 1856 12) Syngnatus mackayi (Swain y Meek, 1884) Orden Scorpaeniformes Suborden Scorpaenoidei Familia VIII Scorpaenidae Género 12 Scorpaena Linnaeus, 1758
Especie 13) Scorpaena plumieri
plumieri Bloch, 1789
Colectadas con métodos
diferentes
Orden Perciformes Suborden Percoidei Familia IX Serranidae Género 13 Epinephelus Bloch, 1793 Especie 14) Epinephelus guttatus (Linnaeus, 1758) Género 14 Diplectrum Holbrook, 1855 Especie 15) Diplectrum radiale (Quoy y Gaimard, 1824) Familia X Carangidae Género 15 Chloroscombrus Girard, 1859 Especie 16) Chloroscombrus chrysurus (Linnaeus, 1766) Género 16 Oligoplites Gill, 1863 Especie 17) Oligoplites saurus (Bloch y Schenider, 1801) Familia XI Lutjanidae Género 17 Lutjanus Bloch, 1970 Especie 18) Lutjanus synagris (Linnaeus, 1758) 19) Lutjanus griseus (Linnaeus, 1758) Familia XII Gerridae Género 18 Eucinostomus Baird y Girard, 1854 Especie 20) Eucinostomus gula (Cuvier, 1830) 21) Eucinostomus argenteus Baird y Girard, 1855 Familia XIII Pomadasyidae Género 19 Orthopristis Girard, 1859 Especie 22) Orthopristis Chrysopterus (Linnaeus, 1758) 23) Orthopristis poeyi Scudder, 1868 24) Orthopristis sp Género 20 Anisotremus Gill, 1861 Especie 25) Anisotremus virgicus (Linnaeus, 1758) 26) Anisotremus spleniatus (Poey, 1860) Género 21 Haemulon Cuvier, 1829 Especie 27) Haemulon plumieri (Lacépèdde, 1802) Género 22 Bathystoma Scudder, 1863 Especie 28) Bathystoma rimator (Jordan y Swain, 1884) Familia XIV Sparidae Género 23 Calamus Swainson, 1839 Especie 29) Calamus penna (Valenciennnes, 1830) Género 24 Archosargus Gill, 1865 Especie 30) Archosargus porbatocephalus (Walbaum, 1792) 31) Archosargus unimaculatus (Bloch, 1792) Familia XV Sciaenidae Género 25 Bairdiella Gill, 1861 Especie 32) Bairdiella chrysura (Lacépède, 1802) Género 26 Cynoscion Gill, 1861 Especie 33) Cynoscion nebulosus (Cuvier y Valenciennes, 1830) 34) Cynoscion sp Género 27 Menticirrchus Gill, 1861 Especie 35) Menticirrchus martiniencis (Cuvier y Valenciennes, 1830) 36) Menticirrchus saxatils ( Bloch y Schneider, 1801) Género 28 Equetus Rafinesque, 1815 Especie 37) Equetus acuminatus (Bloch y Schneider, 1801) Género 29 Odontoscion Gill, 1862 Especie 38) Odontoscion dentex Cuvier, 1830 Género 30 Corvula Jordan y Eigenmann, 1886 Especie 39) Corvula sanctae-luciae Jordan, 1890 Familia XVI Ephippidae Género Chaetodipterus Lacépède, 1803 Especie 40) Chaetodipterus faber (Broussonet, 1782) Familia XVII Chaetodontidae Género 32 Chaetodon Linnaeus, 1758 Especie 41) Chaetodon ocellatus Bloch, 1787 Suborden Labroidei Familia XVIII Labridae Género 33 Novaculichthys Bleeker, 1861 Especie 42) Novaculichthys cf. infirmus (Bean, 1888) Suborden Scombroidei Familia XIX Trichiuridae Género 34 Trichiurus Linnaeus, 1758 Especie 43) Trichiurus lepturus Linnaeus, 1758 Suborden Soleoidei Familia XX Soleidae Género 35 Achirus Lacépède, 1802 Especie 44) Achirus lineatus (Linnaeus, 1758) Orden Tetraodontiformes Suboorden Balistoidei Familia XXI Balistidae Género 36 Balistes Linnaeus, 1758 Especie 45) Balistes capriscus Gmelin, 1788 Género 37 Monacanthus Oken, 1817 Especie 46) Monacanthus hispidus (Linnaeus, 1766) 47) Monacanthus ciliatus (Mitchill, 1818) Familia XXII Ostraciontidae Género 38 Lactophrys Swainson, 1839 Especie 48) Lactophrys tricornis (Linnaeus, 1758) Subordden Tetraodontoidei Familia XXIII Tetraodontidae Género 39 Shoeroides Anonymous, 1798 Especie 49) Sphoeroides testudineus (Linnaeus, 1758) 50) Sphoeroides marmoratus (Ranzani, 1840) Género 40 Lagocephalus Swainson, 1839 Especie 51) Lagocephalus laevigatus (Linnaeus, 1766) Familia XXIV Diodontidae Género 41 Diodon Linnaeus, 1758
Especie 52) Diodon hystrix Linnaeus,
1758
Colectadas con métdos
diferentes
Género 42 Chilomycterus Bibron, 1846 Especie 53) Chilomycterus schoepfi (Walbaum, 1792) SINOPSIS ECOLÓGICA DE LAS ESPECIESUrolophus jamaicensis (Cuvier, 1817) N. v. "Raya" Urolophus jamaicensis (Cuvier) Regne Animal, 1817, 2: 137. Castro, An. Inst. Nal. Inv. Biol. Pesq., 1965; 1: 187. Es una especie rara muy poco conocida en ambientes lagunares estuarinos del Golfo, de México y Mar Caribe siendo el trabajo de Castro (1965) el único que después de revisar la literatura pertinente la reporta y tal vez estos estudios representan el primer registro para los ambientes estudiados. Con base en estos antecedentes y las observaciones del presente trabajo, Urolophus jamaicensis se considera como un componente comunitario ocasional (Tabla 7) y consumidor de tercer orden (Tablas 10 y 11) . En el área de estudio se colectó en septiembre de 1976 en la estación BPR-3 y en marzo de 1977 en la BPR-1 (Tabla 12), obteniéndose 3 ejemplares desde 146 hasta 384 mm LT. Los detalles de parámetros ambientales más sobresalientes durante su captura, en las tablas 3 a 6. Yáñez-Arancibia y Amezcua-Linares (1979) estudian la ecología de esta especie en Laguna de Términos en un trabajo posterior a este estudio. Opisthonema Oglinum (Le Sueur, 1817) N v. "Sardina" Megalops oglina Le Sueur, Journ, Ac. Nat. Sci. Phila., 1871; 1: 359. Aspectos generales sobre la ecología de esta especie en ambientes lagunares estuarinos y costeros del Golfo de México y Mar Caribe se han reportado en los trabajos de: Beebe y Tee-Van 1 (1928) ; Springer y Bullis (1956) ; Christmas et al. (1960) ; Springer y Woodburn (1960) ; Lowe (1962); Tabb et al. (1962); Cervigón (1966 y 1972) ; Randall (1967) ; Fuss et al. (1968) ; Carr y Adams (1973) y Hester y Copeland (1975). Con base en estos antecedentes y las observaciones de este estudio, Opisthonema oglinum se considera como un componente comunitario ocasional (Tabla 7) y consumidor de primer orden (Tabla 11). En el área de estudio se colectó en marzo de 1977 en la estación BPR-3 (Tabla 12), obteniéndose 33 ejemplares desde 70 hasta 102 mm I-T. Los detalles de parámetros ambientales más sobresalientes durante su captura, en las tablas 3 a 6. Sardinella macrophthalmus (Ranzani, 1842) N. v. "Sardina" Clupea macrophthalma Ranzani, Nov. Comm. Ac. Sci. Bonon., 1842; 5: 320. Aspectos generales sobre la ecología de esta especie en ambientes lagunares estuarinos del Golfo de México y Mar Caribe no. han sido estudiados; sin embargo, de especies muy afines del género se han reportado, en los trabajos de: Springer y Woodburn (1960) ; Cervigón (1966 y 1972) ; Swingle (1971) y Cerame-Vivas (1974). Con base en estos antecedentes y las observaciones de este estudio, Sardinella macrophthalmus se considera como un componente comunitario en tránsito (Tabla 8) y consumidor de primer orden (Tabla 11) . En el área de estudio se colectó en septiembre y octubre de 1976 y enero y marzo de 1977 en la estación BPR-3 (Tabla 12), obteniéndose 112 ejemplares desde 68 hasta 135 mm LT. Los detalles de parámetros ambientales más sobresalientes durante su captura en las tablas 3 a 6. Anchovia sp. N. v. "Anchoa" La determinación taxonómica a nivel específico, de esta especie no se logró, ya que los ejemplares capturados eran juveniles deteriorados; sin embargo, aspectos generales sobre la ecología de varias especies afines del género en ambientes lagunares estuarinos del Mar Caribe se han reportado en los trabajos de: Schultz (1949) y Cervigón (1966). Con base en estos antecedentes y las observaciones de este estudio, Anchovia sp. se considera como un componente comunitario ocasional (Tabla 7) y consumidor de primer orden (Tabla 11) . En el área de estudio se colectó en marzo de 1977 en la estación BPR-3 (Tabla 12), obteniéndose 2 ejemplares de 91 y 98 mm LT. Los detalles de parámetros ambientales más sobresalientes durante su captura, en las tablas 3 a 6. Anchoa hepsetus hepsetus Hildebrand, 1943 N. v. "Anchoa" Anchoa hepsetus hepsetus Hildebrand, Bull. Bing. Oceanogr. coll., 1943; 8: 2, fig. 21. Aspectos generales sobre la ecología de ésta y otras especies del género en ambientes lagunares estuarinos del Golfo de México y Mar Caribe se han reportado en los trabajos de: Hildebrand y Schroeder (1928) Hildebrand y Cable (1930) Hubbs (1936) Gunter (1945) ; Schultz (1949) Reid (1954 y 1955 b) ; Kilby (1955) ; McLane (1955) ; Wheatland (1956); Simmons (1957) ; Darnell (1958, 1961 y 1962) ; H. H. Hildebrand (1958); Hoese (1958 y 1965); Springer y Woodburn (1960); Tabb y Manning (1961) Tabb et al. (1962) ; Gunter y Hall (1963) Cervigón (1966) ; Roessler (1967) ; Detwyler y Houde (1970) ; Reséndez (1970 y 1973) ; W. E. Odum (1971) ; Swingle (1971) Chávez (1972) ; Day et al. (1972, 1973 a y b) Carr y Adams (1973) ; Turner y Johnson (1973) ; Ceramen-Vivas (1974) ; Hester y Copeland (1975) y Subrahmanyam y Drake (1975). Con base en estos antecedentes y las observaciones de este estudio, Anchoa hepsetus hepsetus se considera como un componente comunitario ocasional en la estación BPR-1 y en tránsito para la BPR-3 (Tablas 7 y 8) y consumidor de primer orden (Tablas 10 y 11). En el área de estudio, se colectó en enero de 1977 en la BPR-1, enero y marzo de 1977 en la BPR-3 (Tabla 12), obteniéndose 8 ejemplares desde 90 hasta 138 mm LT. Los detalles de parámetros ambientales más sobresalientes durante su captura, en las tablas 3 a 6. Anchoviella sp. N. v. "Anchoa" La determinación taxonómico a nivel específico de esta especie no se logró, ya que sólo se contó con ejemplares juveniles deteriorados; sin embargo, aspectos generales sobre la ecología de varias especies afines de este género en ambientes lagunares, estuarinos del Golfo de México y Mar Caribe se han reportado en los trabajos de: Springer y Bullis (1956) ; Cervigón (1966) y Swingle (1971). Con base en estos antecedentes y las observaciones de este estudio, Anchoviella sp. se considera como un componente comunitario en tránsito, (Tabla 8) y consumidor de primer orden (Tabla 11) . En el área de estudio se colectó en octubre de 1976 y marzo de 1977 en la estación BPR-3 (Tabla 12), obteniéndose 2 ejemplares de 60 y 79 mm LT. Los detalles de parámetros ambientales más sobresalientes durante su captura, en las tablas 3 a 6. Synodus foetens (Linnaeus, 1766) N. v. "Chile" Salmo foetens Linnaeus, Syst. Nat., 1766; Ed. 12: 513. Aspectos generales sobre la ecología de ésta y otras especies afines del género en ambientes lagunares estuarinos y costeros del Golfo de México y Mar Caribe se han reportado en los trabajos de: Linton (1905) ; Smith (1907).; Beebe y Tee-Van (1928); Hildebrand y Schroeder (1928) ; Storey (1937); Gunter (1945); Gunter e Hildebrand (1951); H. H. Hildebrand (1954); Reid (1954 y 1955 b) ; Simmons (1957) ; Springer y Woodburn (1960) ; Tabb et al. (1962) ; Hoese (1965); Cervigón (1966) ; Randall (1967); W. E. Odum (1971); Swingle (1971); Chávez (1972) ; Carr y Adams (1973) ; Day et al. (1973b) ; Cerame-Vivas (1974) ; Brook (1975 y 1977); Odum y Heald (1975); Subrahmanyam y Drake (1975) y Smith (1976). Con base en estos antecedentes y las observaciones de este estudio, Synodus foetens se considera como un componente comunitario ocasional (Tabla 7) y consumidor de tercer orden (Tabla 11) . En el área de estudio se colectó en septiembre de 1976 en la estación BPR-3 y en mayo de 1977 en la BPR-2 (Tabla 12), obteniéndose 2 ejemplares de 183 y 207 mm LT. Los detalles de parámetros ambientales más sobresalientes durante su captura, en las tablas 3 a 6. Arius felis (Linnaeus, 1766) N. v. "Bosh" Silurus felis Linnaeus, Syst. Nat., 1766, Ed. 12:503. Aspectos generales sobre la ecología de esta especie en ambientes lagunares estuarinos del Golfo de México y Mar Caribe se han reportado en los trabajos de: Smith (1907) ; Gudger (1912, 1916 y 1918); Lee (1937); Gunter (1945); Knapp (1949) ; Reid (1954) ; Darnell (1958 y 1961) ; Springer y Woodburn (1960); Gunter y Hall (1965); University of Alabama (1966); Mansueti y Hardy (1967) ; Harris y Rose (1968) ; W. E. Odum (1971); Swingle (1971); Chávez (1972); Odum y Heald (1972); Day et al. (1973 a y 1973 b) y Yáñez-Arancibia et al. (1976). Con base en estos antecedentes y las observaciones de este estudio, Arius felis se considera como un componente comunitario en tránsito para las estaciones BPR-1 y BPR-3 y ocasional para la BPR-2 (Tablas 7 y 8) y consumidor de segundo orden (Tablas 10 y 11). En el área de estudio se colectó en septiembre y octubre de 1976 y marzo de 1977 en la BPR-3, en octubre de 1976 y marzo de 1977 en la BPR-1 y en agosto de 1977 en la BPR-2 (Tabla 12), obteniéndose 207 ejemplares desde 36 hasta 346 mm LT. Se analizaron 42 especímenes de los cuales 6 fueron machos 2 en estadio II de madurez gonádica, 3 en estadio III y uno en estadio VII; 24 fueron hembras de las cuales 6 en estadio II, 14 en estadio III, una en estadio IV y 3 en estadio VI; y 12 fueron de sexo indeterminado, 11 en estadio I y uno en estadio II. En los estómagos se hallaron pastos marinos (Halodule wrightii y Thalassia testudinum), algas en general, algas rojas, restos vegetales, crustáceos decápodos, restos de cangrejos, Emerita sp, camarones del género Penaeus, isópodos, anfípodos, copépodos, nemátodos, restos de poliquetos, priapúlidos, restos de conchas, ascidas (algunas del orden Aplousobranchia) restos de peces, detritus y materia orgánica vegetal y animal no determinable. Los detalles de parámetros ambientales más sobresalientes durante su captura, en las tablas 3 a 6. Gobiesox strumosus Cope, 1870 N. v. "Pez adhesivo" Gobiesox strumosus Cope, Proc. Acad. Nat. Sci. Phila., 1870: 121. Aspectos generales sobre la ecología de esta especie en ambientes lagunares estuarinos y costeros del Golfo de México y Mar Caribe se han reportado en los trabajos de: Hildebrand y Schroeder (1928) ; Briggs (1958) ; Springer y Woodburn (1960); Runyan (1961); Hoese (1965) ; Cervigón (1966) ; W. E. Odum (197 1) ; Swingle (197 1) ; Odum y Heald (197 2) ; Powell et al. (1972) ; Reséndez (1973) y Smith (1976). Con base en estos antecedentes, Gobiesox strumosus se considera un consumidor de segundo orden (Tabla 10). En estos estudios se colectó a mano en octubre de 1976, un ejemplar en la orilla, dentro de una concha de molusco en la pradera de Thalassia testudinum correspondiente a la estación BPR-I. Por otro lado, como el especimen fue capturado con diferente método al utilizado para la obtención de las muestras del presente trabajo, únicamente aparece en la "lista sistemática", en la tabla de componentes ictiotróficos y en este capítulo. Hippocampus hudsonius punctulatus Guichenot, 1853 N. v. "Caballito de mar" Hippocampus punctulatus Guichenot, en Sagra. Historia Física, Política y Natural de la Isla de Cuba, 1853; 4: 239, lám. 5, fig. 2. Aspectos generales sobre la ecología de ésta y otras especies afines del género en ambientes lagunares estuarinos del Golfo de México y Mar Caribe se han reportado en los trabajos de: Reid (1954); H. H. Hildebrand (1958); Strawn (1958) ; Springer y Woodburn (1960) ; Tabb et al. (1962) ; Cervigón (1966 y 1973) ; Brook, (1975 y 1977), y Reséndez (1975). Con base en estos antecedentes y las observaciones de este estudio, Hippocampus hudsonius punctulatus se considera como un componente comunitario ocasional (Tabla 7) y consumidor de tercer orden (Tabla 10) . En el área de estudio se colectó en enero de 1977 en la estación BPR-1 (Tabla 12), obteniéndose un ejemplar de 120 mm LT. Los detalles de parámetros ambientales más sobresalientes durante su captura en las tablas 3 a 6. Syngnathus rousseau Kaup, 1856 N. v. "Pez pipa" Syngnathus rousseau Kaup, Cat. Lophobr. Fish., 1856: 40. Aspectos generales sobre la ecología de esta especie y de otras afines del género en ambientes lagunares estuarinos del Golfo de México y Mar Caribe se han reportado. en los trabajos de: Herald (1942); Gunter (1945); H. H. Hildebrand (1954, 1955 y 1958); Reid (1954 y 1955 b); Joseph y Yerger (1956); Simmons ( 1957); Darnell (1958 y 1961) ; Springer y Woodburn (1960) ; Tabb et al. (1962); Gunter y Hall- (1963); Reséndez (1965, 1970, 1973 y 1975) ; Cervigón (1966 y 1975); Kikuchi (1966); Swingle (1971); Cerame-Vivas (1974) ; Brook, (1975 y 1977) y Subrahmanyam y Drake (1975). Con base en estos antecedentes y las observaciones de este estudio, Syngnathus rousseau se, considera como un componente comunitario ocasional (Tabla 7) y consumidor de tercer orden (Tabla 10). En el área de estudio se colectó en enero de 1977 en la estación BPR-1 (Tabla 12) obteniéndose un ejemplar de 208 mm LT. Los detalles de parámetros ambientales más sobresalientes durante su captura, en las tablas 3 a 6. Otra especie de Syngnathus se reporta en la lista sistemática, i. e., S. mackayi (Swain y Meek, 1884) no tomándose en cuenta para este capítulo debido a que se colectó antes de iniciar el presente trabajo y con métodos diferentes. No obstante, es razonable suponer que su comportamiento ecológico general no debe de ser muy diferente de S. rousseau. Epinephelus guttatus (Linnaeus, 1758) N. v. "Cherna" Perca guttata Linnaeus, Syst. Nat., 1758; Ed. 10: 292. Aspectos generales sobre la ecología de ésta y otras especies afines del género en ambientes lagunares estuarinos y costeros del Golfo de México y Mar Caribe se han reportado en los trabajos de: Beebe y Tee-Van (1928) ; Gudger (1929) ; Longley e Hildebrand (1941); Erdman (1956) ; Bardach y Menzel (1957) ; Boschung (1957 b) ; Menzel (1960) ; Springer y Woodburn, (1960); C. L. Smith (1961); Tabb y Manning (196 1) ; Tabb et al. (1962) ; H. A. Randall (1964) ;Walker y Nelson (1964) ; Moe y Martin (1965) ; Randall (1965 y 1967); Cervigón (1966) ; Rees y Nelson (1966) ; Causey (1969) Struhsaker (1969) ; Reséndez (1970 y 1975) W. E. Odum (1971) ; F. G. W. Smith (1971); Chávez (1972); Hastings (1972); Odum y Heald (1972) ; Powell et al. (1972) ; Cashman (1973); Cerame-Vivas (1974) y G. B. Smith (1976). Con base en estos antecedentes y las observaciones de este estudio, Epinephelus guttatus se considera como un componente comunitario en tránsito (Tabla 8) y consumidor de tercer orden (Tabla 10) . En el área de estudio se colectó en marzo y mayo de 1977 en la estación BPR-1 (Tabla 12), obteniéndose 3 ejemplares desde 437 hasta 540 mm LT, de los cuales 2 fueron hembras una en estadio I y la otra en estadio II de madurez gonádica; el otro ejemplar fue de sexo indeterminado en estadio II. En los estómagos se hallaron peces (Arius felis) y un espécimen que contenía algo de Thalassia testudinum ingerida tal vez de manera ocasional al capturar su presa. Los detalles de parámetros ambientales más sobresalientes durante su captura, en las tablas 3 a 6. Diplectrum radiale (Quoy y Gaimard, 1824) N. v. "Aguavina, Serrano, Vulcai" Serranus radiale Quoy y Gaimard, Freycinet, Voyage Uranie et Physicienne, Zool., 1824: 316. Aspectos generales sobre la ecología de ésta y otras especies afines del género en ambientes lagunares estuarinos y costeros del Golfo de México y Mar Caribe, se han reportado en los trabajos de: Gunter (1945) ; Springer y Bullis (1956); Springer y Woodburn (1960) ; Tabb et al. (1962) ; Dawson (1965) ; Cervigón (1966); Swingle (1971) y Smith (1976). Con base en estos antecedentes y las observaciones de este estudio, Diplectrum radiale se considera como un componente comunitario ocasional (Tabla 7) y consumidor de tercer orden (Tabla 11) . En el área de estudio se colectó en septiembre de 1976 en la estación BPR-3 (Tabla 12), obteniéndose 3 ejemplares desde 117 hasta 130 mm LT, todos eran hembras en estadio 11 de madurez gonádica. En los estómagos se hallaron camarones del género Penaeus y restos de crustáceos decápodos. Los detalles de parámetros ambientales más sobresalientes durante su captura, en las tablas 3 a 6. Chloroscombrus chrysurus (Linnaeus, 1766)N. v. "Horqueta" Scomber chrysurus Linnaeus, Syst. Nat., 1766; Ed. 12: 494. Aspectos generales sobre la ecología de esta especie en ambientes lagunares estuarinos del Golfo de México y Mar Caribe se han reportado en los trabajos de: Reid (1955); Gunter (1956); Springer y Bullis (1956) ; Boschung (1957 a) ; Springer y Woodburn (1960); Tabb et al. (1962) ; Gunter y Hall (1963) ; Hoese (1965) ; Cervigón (1966); Swingle (1971) ; Chávez (1972) ; Day et al. (1973 b) y Cerame-Vivas (1974). Con base en estos antecedentes y las observaciones de este estudio, Chloroscombrus chrysurus se considera como un componente comunitario en tránsito (Tabla 8) y consumidor de segundo orden (Tabla 11) . En el área de estudio se colectó en octubre de 1976 y en enero y marzo de 1977 en la estación BPR-3 (Tabla 12), obteniéndose 22 ejemplares desde 44 hasta 110 mm LT. Los detalles de parámetros ambientales más sobresalientes durante su captura, en las tablas 3 a 6. Oligoplites saurus (Bloch y Schneider, 1801) N. v. "Xpip" Oligoplites saurus saurus Schultz, Proc. U. S. Nat. Mus., 1949, 99: 129. Aspectos generales sobre la ecología de ésta y otras especies afines del género en ambientes lagunares estuarinos del Golfo de México y Mar Caribe se han reportado en los trabajos de: Beebe y Tee-Van (1928) ; Hildebrand y Schroeder (1928) ; Breder (1948) ; Kilby (1955) ; Reid (1955 b) ; Springer y Woodburn (1960); Tabb y Manning (1961); Tabb et al. (1962); Gunter y Hall (1963) ; Hoese (1965) ; Cervigón (1966) ; Randall (1967) ; W. E. Odum (1971) Swingle (1971) ; Carr y Adams (1972 y 1973) Odum y Heald (1972) ; Cerame-Vivas (1974) y Subrahmanyam y Drake (1975). Con base en estos antecedentes y las observaciones de este estudio, Oligoplites saurus saurus se considera como un componente comunitario ocasional (Tabla 7) y consumidor de segundo orden (Tabla 11) . En el área de estudio se colectó en marzo de 1977 en la estación BPR-3 (Tabla 12), obteniéndose un ejemplar de 111 mm LT. Los detalles de parámetros ambientales más sobresalientes durante su captura, en las tablas 3 a 6. Lutjanus synagris (Linnaeus, 1758) N. v. "Pargo" Sparus synagris Linnaeus, Syst. Nat., 1758, Ed. 10: 280. Aspectos generales sobre la ecología de ésta y otras especies afines del género en ambientes lagunares estuarinos y costeros del Golfo de México y Mar Caribe se han reportado en los trabajos de: Jordan (1885); Lonnberg (1894); Evermann y Marsh (1900) ; Beebe y Tee-Van (1928) ; Hubbs (1936) ; Longley e Hildebrand (194 1) ; Gunter (1942 y 1945) ; Reid (1954); H. H. Hildebrand (1955 y 1958) Springer y Bullis (1956) ; Boschung (1957 a) Springer y Woodburn (1960) Tabb y Manning (1961) ; Croker (1962) Lowe (1962) ; Rodríguez (1962) ; Tabb et al. (1962) ; Gunter y Hall (1963) ; Moe y Martin (1965) ; Cervigón (1966) ; Moseley (1966) ; Randall (1967) ; Causey (1969); Reséndez (1970, 1973 y 1975); Claro y Lapin (1971); W. E. Odum (1971); Swingle (1971) ; Chávez (1972) ; Hastings (1972) ; Cerame-Vivas (1974) ; Brook (1975 y 1977), Smith (1976) Jordan et. al. (1978). Con base en estos antecedentes y las observaciones de este estudio, Lutjanus synagris se considera como un componente comunitario ocasional (Tabla 7) y consumidor de tercer orden (Tablas 10 y 11). En el área de estudio se colectó en septiembre de 1976 en la estación BPR-3 y en agosto de 1977 en las BPR-1 y BPR-2 (Tabla 19), obteniéndose 10 ejemplares desde 94 hasta 247 mm LT, de los cuales 3 fueron machos en estadios I, II y III de madurez gonádica, 4 fueron hembras, 3 en estadio II, una en estadio III; y 3 indeterminados en estadio I. En los estómagos se hallaron camarones del género Penaeus, restos de crustáceos decápodos, restos de peces, poliquetos, nemátodos y platelmintos de los órdenes Tricladida y Policladida. Los detalles de parámetros ambientales más sobresalientes durante su captura, en las tablas 3 a 6. Lutjanus griseus (Linnaeus, 1758) N. v. ''Pargo prieto, Pargo mulato" Labrus griseus Linnaeus, Syst. Nat., 1758, Ed. 10: 283. Aspectos generales sobre la ecología de ésta y otras especies afines del género en ambientes lagunares estuarinos y costeros del Golfo de México y Mar Caribe se han reportado en los trabajos de: Jordan (1885) Lonnberg (1894) ; Evermann y Marsh (1900) Beebe y Tee-Van (1928); Hubbs (1936); Longley e Hildebrand (1941) ; Gunter (1942 y 1945) ; Reid (1954) ; H. H. Hildebrand (1955 y 1958) ; Springer y Bullis (1956) ; Boschung (1957 a) ; Springer y Woodburn (1960) ; Tabb y Manning (196 1) ; Croker (1962); Lowe (1962); Rodríguez (1962); Tabb et al. (1962) Gunter y Hall (1963) ; Moe y Martin (1965) Cervigón (1966) ; Moseley (1966) Randall (1967) ; Causey (1969) ; Reséndez (1970, 1973 y 1975) Claro y Lapin (1971) W. E. Odum (1971) Swingle (1971) ; Chávez (1972) ; Hastings (1972) ; Cerame-Vivas (1974); Brook (1975 y 1977); Smith (1976) y Jordan et al. (1978). Con base en estos antecedentes y las observaciones de este estudio, Lutjanus griseus se considera como un componente comunitario en tránsito (Tabla 8) y consumidor de tercer orden (Tabla 10) . En el área de estudio se colocó en septiembre y octubre de 1976 y marzo de 1977 en la estación BPR-1 (Tabla 12), obteniéndose 5 ejemplares desde 217 hasta 278 mm LT, de los cuales 2 fueron machos en estadio III de madurez gonádica y 3 fueron hembras, una en estadio II, otra en estadio III y la última en estadio VII. En los estómagos se hallaron camarones del género Penaeus, crustáceos decápodos, entre ellos jaibas, un copépodo, restos de conchas, restos de peces y Thalassia testudinum en cantidades poco significativas. Los detalles de parámetros ambientales más sobresalientes durante su captura, en las tablas 3 a 6. Eucinostomus gula (Cuvier 1830) N. v. "Mojarrita" Gerres gula Cuvier, en Cuvier y Valenciennes, Hist. Nat. Poiss., 1830; 6: 464. Aspectos generales sobre la ecología de esta y otras especies afines del género en ambientes lagunares estuarinos y costeros del Golfo de México y Mar Caribe se han reportado en los trabajos de: Linton (1905) ; Smith (1907) ; Beebe y Tee-Van (1928); Curran (1942); Heald y Strickland (1949) ; H. H. Hildebrand (1954, 1955 y 1958) ; Reid (1954) ; Kilby (1955) Springer y Bullis (1956) ; Boschung (1957 a) Springer y Woodburn (1960); Darnell (1962); Walker y Nelson (1964); Cervigón (1966) ; Randall (1967); Reséndez (1970 y 1973); W. E. Odum (1971); Swingle (1971); Chávez (1972) ; Odum y Heald (1972 y 1975) ; Carr y Adams (1973) ; Day et al. (1973 b) ; Cerame-Vivas (1974) ; Heald et al. (1974) ; Brook (1975 y 1977) y Subrahmanyam y Drake (1975). Con base en estos antecedentes y las observaciones de este estudio, Eucinostomus gula se considera como un componente comunitario en tránsito para la estación BPR-1 y ocasional para las BPR-2 y BPR-3 (Tablas 7 y 8) y consumidor de primer orden (Tablas 10 y 11). En el área de estudio se colectó en septiembre y octubre de 1976 y en mayo, agosto de 1977 en la BPR-1, marzo de 1977 en la BPR-3 y agosto de 1977 en la BPR-2 (Tabla 12), obteniéndose 40 ejemplares desde 30 hasta 124 mm LT; se analizaron 23 especímenes, de los cuales 2 fueron machos en estadios II y III de madurez gonádica; 11 fueron hembras en estadio II; y 10 de sexo indeterminado en estadio, I. En los estómagos se hallaron isópodos, anfípodos, copépodos, crustáceos decápodos, poliquetos, oligoquetos, nemátodos, espículas de esponjas, foraminíferos, huevos no identificados, materia orgánica animal no determinable, restos de Thalassia testudinum, de algas y materia inorgánica. Los detalles de parámetros ambientales más sobresalientes durante su captura, en las tablas 3 a 6. Eucinostomus argenteus Baird y Girard, 1855 N. v. "Mojarra plateada, Mojarra cantileña" Eucinostomus argenteus Baird y Girard, en Baird. y Girard, Ann. Rep. Smithsonian Inst. para 1854; 1855: 335. Aspectos generales sobre la ecología de esta y otras especies afines del género en ambientes lagunares estuarinos y costeros del Golfo de México y Mar Caribe se han reportado en los trabajos de: Linton (1905) ; Smith (1907) ; Beebe y Tee-Van (1928); Curran (1942); Heald y Strickland (1949) ; H. H. Hildebrand (1954, 1955 y 1958); Reid (1954); Kilby (1955); Springer y Bullis (1956); Boschung (1957 a); Springer y Woodburn (1960) ; Darnell (1962) ; Walker y Nelson (1964); Cervigón (1966); Randall (1967); Reséndez (1970 y 1973); W. E. Odum (1971); Swingle (197 1) Chávez (1972) ; Odum y Heald (1972 y 1975) Carr y Adams (1973) ; Day et al. (1973 b) Cerame-Vivas (1974) ; Heald et al. (1974) ; Brook (1975 y 1977) y Subrahmanyam y Drake (1975). Con base en estos antecedentes y las observaciones de este estudio, Eucinostomus argenteus se considera como un componente comunitario en tránsito (Tabla 8) y consumidor de primer orden (Tabla 11) . En el área de estudio se colectó en septiembre y octubre de 1976 en la estación BPR-3 (Tabla 12), obteniéndose 54 ejemplares desde 55 hasta 88 mm LT. Se analizaron 36 especímenes, de los cuales 9 fueron machos y 12 hembras en estadio 11 de madurez gonádica.; y 15 de sexo indeterminado, 14 en estadio, I y uno indeterminado. En los estómagos se hallaron cephalocordados (Amphioxus), protocordados, poliquetos, nemátodos, copépodos, un huevo de crustáceo, fragmentos vegetales y materia orgánica no determinable. Los detalles de parámetros ambientales más sobresalientes durante su captura, en las tablas 3 a 6. Orthopristis chrysopterus Linnaeus, 1766 N. v. "Burro" Perca chrysoptera Linnaeus, Syst. Nat., 1766, Ed. 12: 485. Aspectos generales sobre la ecología de ésta y otras especies afines del género en ambientes lagunares estuarinos del Golfo de México y Mar Caribe se han reportado en los trabajos de: Linton (1905) ; Smith (1907) ; Hildebrand y Schroeder (1928) ; Hildebrand y Cable (1930) ; Gunter (1945) ; Reid (1954 y 1955 b) ; Springer y Bullis (1956) Simmons (1957) ; H. H. Hildebrand (1958) Springer y Woodburn (1960) ; Tabb et al. (1962); Gunter y Hall (1965); Hoese (1965); Cervigón (1966) ; Swingle (1971) ; Carr y Adams (1973) y Subrahmanyam y Drake (1975). Con base en estos antecedentes y las observaciones de este estudio, Orthopristis chrysopterus se considera como un componente comunitario permanente para la estación BPR-1 y en tránsito para la BPR-3 (Tablas 8 y 9) y consumidor de segundo orden (Tablas 10 y 11) . En el área de estudio se colectó en septiembre y octubre de 1976, enero, marzo y mayo de 1977 en la BPR-1 y septiembre de 1976 y agosto de 1977 en la BPR-3 (Tabla 12), obteniéndose 88 ejemplares desde 42 hasta 166 mm LT. Los detalles de parámetros ambientales más sobresalientes durante su captura, en las tablas 3 a 6. Orthopristis poeyi Scudder, 1868 N. v. "Burro" Orthopristis poeyi (Scudder Ms.) Poey, Sinopsis, 1868: 312. Aspectos generales sobre la ecología de especies afines a ésta y del mismo género en ambientes lagunares estuarinos del Golfo de México y Mar Caribe se han reportado en los trabajos de: Linton (1905) ; Smith (1907) ; Hildebrand y Schroeder (1928) ; Hildebrand y Cable (1930) ; Gunter (1945) ; Reid (1954 y 1955 b) ; Springer y Bullis (1956) Simmons (1957) ; H. H. Hildebrand (1958) Springer y Woodburn (1960) ; Tabb et al. (1962); Gunter y Hall (1965); Hoese (1965) ; Cervigón (1966); Swingle (1971) ; Carr y Adams (1973) y Subrahmanyam y Drake (1975). Con base en estos antecedentes y las observaciones de este estudio, Orthopristis poeyi se considera como un componente comunitario ocasional (Tabla 7) y consumidor de segundo orden (Tabla 10). En el área de estudio se colectó en septiembre de 1976 en la estación BPR-1 (Tabla 12), obteniéndose 2 ejemplares de 190 y 209 mm LT. Los detalles de parámetros ambientales más sobresalientes durante su captura, en las tablas 3 a 6. Orthopristis sp. N. v. "Burro" La determinación taxonómica a nivel específico de esta especie no se obtuvo, ya que se trataba de un ejemplar juvenil considerablemente deteriorado; sin embargo, al parecer no corresponde a ninguna de las dos especies anteriores del género, por lo cual se discute de manera independiente. Aspectos generales sobre la ecología de varias especies afines del género en ambientes lagunares estuarinos del Golfo de México y Mar Caribe, se han reportado en los trabajos de: Linton (1905) ; Smith (1907) ; Hildebrand y Schroeder (1928) ; Hildebrand y Cable (1930) ; Gunter (1945) ; Reid (1954 y 1955 b) ; Springer y Bullis (1956) Simmons (1957) ; H. H. Hildebrand (1958) Springer y Woodburn (1960) ; Tabb et al. (1962); Gunter y Hall (1965); Hoese (1965); Cervigón (1966); Swingle (197 1) ; Carr y Adams (1973) y Subrahmanyam y Drake (1975). Con base en estos antecedentes y las observaciones de este estudio, Ortropristis sp. se considera como un componente comunitario ocasional (Tabla 7) y consumidor de segundo orden (Tabla 11) . En el área de estudio se colectó en marzo de 1977 en la estación BPR-3 (Tabla 12), obteniéndose 2 ejemplares de 65 y 72 mm LT. Los detalles de parámetros ambientales más sobresalientes durante su captura, en las tablas 3 a 6. Bathystoma rimator (Jordan y Swain, 1884) N. v. "Burrito" Haemulon rimator Jordan y Swain, Proc. U.S. Nat. Mus., 1884,: 308. Aspectos generales sobre la ecología de otras especies afines del género en ambientes lagunares estuarinos y costeros del Golfo de México y Mar Caribe se han reportado en los trabajos de: Beebe y Tee-Van (1928) ; Longley e Hildebrand (1941); Springer y Woodburn (1960) ; Tabb et al. (1962) ; Cervigón- (1966) ; Pagan y Austin (1967) ; Randall (1967) y Cerame-Vivas (1974). Con base en estos antecedentes y las observaciones de este estudio, Bathystoma rimator se considera como un componente en tránsito (Tabla 8) y consumidor de segundo orden (Tabla 10) . En el área de estudio se colectó en septiembre de 1976 y agosto de 1977 en la estación BPR1 y en enero y agosto de 1977 en la BPR-2 (Tabla 12), obteniéndose 18 ejemplares desde 72 hasta 103 mm LT. Los detalles de parámetros ambientales más sobresalientes durante su captura, en las tablas 3 a 6. Anisotremus virginicus (Linnaeus, 1758) N. v. "Postá" Sparus virginicus Linnaeus, Syst. Nat., 1758, Ed. 10: 281. Aspectos generales sobre la ecología de ésta y otras especies afines del género en ambientes lagunares estuarinos y costeros del Golfo de México y Mar Caribe se han reportado en los trabajos de: Beebe y Tee-Van (1928) ; Longley e Hildebrand (1941); Springer y Woodburn (1960) ; Tabb et al. (1962) ; Cervigón (1966) ; Pagan y Austin (1967) ; Randall (1967) y Cerame-Vivas (1974). Con base en estos antecedentes y las observaciones de este estudio, Anisotremus virginicus se considera como un componente comunitario ocasional (Tabla 7) y consumidor de segundo orden (Tabla 10) . En el área de estudio se colectó en agosto de 1977 en la estación BPR-1 (Tabla 12), obteniéndose 6 ejemplares desde 75 hasta 281 mm LT. Los detalles de parámetros ambientales más sobresalientes durante su captura, en las tablas 3 a 6. Anisotremus spleniatus (Poey, 1861) Pristipoma spleniatum Poey, Memorias, 1860; 2: 187. Aspectos generales sobre la ecología de ésta y otras especies afines del género en ambientes lagunares estuarinos y costeros del Golfo de México y Mar Caribe se han reportado en los trabajos de: Beebe y Tee-Van (1928) ; Longley e Hildebrand (1941); Springer y Woodburn (1960) ; Tabb et al. (1962) ; Cervigón (1966) ; Pagan y Austin (1967) ; Randall (1967) y Cerame-Vivas (1974). Con base en estos antecedentes y las observaciones de este estudio, Anisotremus spleniatus se considera como un componente comunitario ocasional (Tabla 7) y consumidor de segundo orden (Tabla 10) . En el área de estudio se colectó en enero de 1977 en la estación BPR-2 y en agosto de 1977 en la BPR-1 (Tabla 12), obteniéndose 3 ejemplares desde 79 hasta 95 mm LT. Los detalles de parámetros ambientales más sobresalientes durante su captura, en las tablas 3 a 6. Haemulon plumieri (Lacépéde, 1802) N. v. "Boquilla" Labrus plumieri Lacépéde, Hist. Nat. Poiss., 1802; 3: 480, lám. 2, Fig. 2. Aspectos generales sobre la ecología de ésta y otras especies afines del género en ambientes lagunares estuarinos y costeros del Golfo de México y Mar Caribe se han reportado en los trabajos de: Goode y Bean (1880) ; Beebe y Tee-Van (1928) ; Storey (1937) ; Longley e Hildebrand (1941) ; Breder (1948) ; Gunter e Hildebrand (1951); Reid (1954) ; Boschung (1957 a) ; Springer y Woodburn (1960) ; Courtenay (1961) ; Cervigón (1966); Cummings et al. (1966) ; Randall (1967) ; Chávez (1972) Carr y Adams (1973) ; Cerame-Vivas (1974) Brook (1975 y 1977) ; Reséndez (1975) ; Smith (1976) y Jordan et al. (1978). Con base en estos antecedentes y las observaciones de este estudio, Haemulon plumieri se considera como un componente comunitario permanente (Tabla 9) y consumidor de segundo orden (Tabla 10). En el área de estudio se colectó en septiembre y octubre de 1976, enero, marzo. y mayo de 1977 en la estación BPR-1 (Tabla 12), obteniéndose 24 ejemplares desde 75 hasta 199 mm LT. Los detalles de parámetros ambientales más sobresalientes durante su captura, en las tablas 3 a 6. Calamus penna (Valenciennes, 1830) N. v. "Pez pluma" Pagellus penna Valenciennes, en Cuvier y Valenciennes, Hist. Nat. Poiss., 1830; 6: 154. Aspectos generales sobre la ecología de esta y otras especies del género en ambientes lagunares estuarinos y costeros del Golfo de México y Mar Caribe se han reportado en los trabajos de: Springer y Woodburn (1960) ; Cervigón (1966); Randall (1967); Randall y Caldwell (1968); Wang y Raney (1971), Smith (1976) y Jordan et al. (1978). Con base en estos antecedentes y las observaciones de este estudio, Calamus penna se considera como un componente comunitario ocasional (Tabla 7) y consumidor de segundo orden. En el área de estudio se colectó en agosto de 1977 en la estación BPR-2 (Tabla 12), obteniéndose un ejemplar de 84 mm LT, el cual fue una hembra en estadio II de madurez gonádica. El alimento consistió de restos de poliquetos y de anfípodos. Los detalles de parámetros ambientales más sobresalientes durante su captura, en las tablas 3 a 6. Archosargus probatocephalus (Walbaum, 1792) N. v. "Sargo" Sparus probatocephalus Walbaum, Artedi Pisc., 1792: 295. Aspectos generales sobre la ecología de esta y otras especies afines del género en ambientes lagunares estuarinos y costeros del Golfo de México y Mar Caribe se han reportado en los trabajos de: Rathbun (1892) ; H. M. Smith (1907) ; Hildebrand y Schroeder (1928) ; Hildebrand y Cable (1938) ; Gunter (1942 y 1945) ; Herald y Strickland (1949) ; Viosca (1954); H. H. Hildebrand (1955 y 1958); Kilby (1955) ; Simmons (1957) ; Darnell (1958, 1961, 1962) ; Springer y Pirson (1959) ; Springer y Woodburn (1960); Cervigón (1966) ; Swingle et al. (1966) ; Randall (1967) ; Reséndez (1970, 1973 y 1975); W. E. Odum (1971); Swingle (1971); Chávez (1972) ; Odum y Heald (1972) Day et al. (1973 a y b) ; Cerame-Vivas (1974) Brook (1975 y 1977) ; G. B. Smith (1976) y Jordan et al. (1978). Con base en estos antecedentes y las observaciones de este estudio Archosargus probatocephalus se considera como un componente comunitario en tránsito (Tabla 8) y consumidor de segundo orden (Tabla 10). En el área de estudio se colectó en octubre de 1976 y agosto de 1977 en la estación BPR1 (Tabla 12), obteniéndose 2 ejemplares de 207 y 480 mm LT, siendo una hembra en estadio II de madurez gonádica y un macho en estadio VII respectivamente. En los estómagos se hallaron restos de moluscos gasterópodos y bivalvos, restos de crustáceos y materia orgánica no, determinable. Los detalles de parámetros ambientales más sobresalientes, durante su captura, en las tablas 3 a 6. Archosargus unimaculatus (Bloch, 1792) N. v. "Sargo" Perca unimaculata Bloch, Ichthyologia, 1792: Lám. 308. Aspectos generales sobre la ecología de ésta y otras especies afines del género en ambientes lagunares estuarinos y costeros del Golfo de México y Mar Caribe se han reportado en los trabajos de: Rathbun (1892); H. M. Smith (1907); Hildebrand y Schroeder (1928); Hildebrand y Cable (1938); Gunter (1942 y 1945) ; Herald y Strickland (1949) ; Viosca (1954) ; H. H. Hildebrand (1955 y 1958); Kilby (1955) Simmons (1957); Darnell (1958, 1961 y 1962) Springer y Pirson (1959) ; Springer y Woodburn (1960); Cervigón (1966) ; Swingle et al. (1966); Randall (1967) ; Reséndez (1970, 1973 y 1975) ; W. E. Odum (1971); Swingle (1971); Chávez (1972) ; Odum y Heald (1972) ; Day et al. (1973 a y b) ; Cerame-Vivas (1974) ; Brook (1975 y 1977); G. B. Smith (1976 y Jordan et al. (1978). Con base en estos antecedentes y las observaciones de este estudio, Archosargus unimaculatus se considera como un componente comunitario permanente para la estación BPR-1 y en tránsito para la BPR-3 (Tablas 8 y 9) y consumidor de segundo orden (Tablas 10 y 11) En el área de estudio se colectó en septiembre, octubre de 1976, enero, marzo y mayo. de 1977 en la BPR-1 y en octubre de 1976 y agosto de 1977 en la BPR-3 (Tabla 12), obteniéndose 79 ejemplares desde 32 hasta 247 mm LT; se analizaron 65 especímenes, de los cuales 8 fueron machos, uno en estadio I de madurez gonádica, 4 en estadio II y 3 en estadio III; 17 fueron hembras, 15 en estadio II y 2 en estadio III; y 40 sexualmente indeterminados, 35 en estadio I y 5 indeterminados. En los estómagos se hallaron, algas calcáreas, cyanofitas y chlorophytas entre las últimas Euteromorpha sp y Chaetomorpha sp; pastos marinos (Thalassia testudinum), diatomeas pennadas, epifitas de Th. testudinum, crustáceos entre ellos, camarones Penaeus, anfípodos, copépodos, tanaidaceos, anostracos, cladoceros, moluscos bivalvos, gastrópodos (Odostomia sp entre otros) larvas de gastrópodos, restos de conchas, anélidos poliquetos, nemátodos, Cnidarios de la familia Campanulariidae, ascidias coloniales (Perophora viridis y otras) , restos de peces, huevecillos no identificados, restos calcáreos, materia orgánica no determinable y materia inorgánica. Los detalles de parámetros ambientales más sobresalientes durante su captura, en las tablas 3 y 6. Bairdiella chrysura (Lacépéde, 1802)N. v. "Corvina" Caranx chrysurus Lacépéde, Hist. Nat. Poiss., 1802, 3: 64. Aspectos generales sobre la ecología de ésta y otras especies afines del género en ambientes lagunares estuarinos del Golfo de México y Mar Caribe se han reportado en los trabajos de: Linton (1905); Kuntz (1916); Welsh y Breder (1923); Hildebrand y Schroeder (1928); Hildebrand y Cable (1930); Gunter (1938, 1945 y 1956); Reid (1954 y 1955b); McLane (1955); Reid et al. (1956); Darnell (1958, 1961 y 1962) ; H. H. Hildebrand (1958); Springer y Woodburn (1960); Tabb et al. (1962) ; Gunter y Hall (1963); Moe y Martin (1965); Cervigón (1966); Reséndez (1970 y 1973); W. E. Odum (1971) ; Swingle (1971) ; Chávez (1972) ; Carr y Adams (1973) ; Day et al. (1973b); Cerame-Vivas (1974) y Subrahmanyam y Drake (1975). Con base en estos antecedentes y las observaciones de este estudio, Bairdiella chrysura se considera como un componente comunitario en tránsito (Tabla 8) y consumidor de segundo orden (Tablas 10 y 11). En el área de estudio se colectó en octubre de 1976, enero y mayo de 1977 en la estación BPR-1 y en octubre de 1976 y marzo de 1977 en la BPR-3 (Tabla 12), obteniéndose 43 ejemplares desde 53 hasta 190 mm LT. Los detalles de parámetros ambientales más sobresalientes durante su captura, en las tablas 3 a 6. Cynoscion nebulosus (Cuvier y Valenciennes, 1830) N. v. "Corvina" Otolithus nebulosus Cuvier y Valenciennes, Hist. Nat. Poiss., 1830; 5: 186. Aspectos generales sobre la ecología de ésta y otras especies afines del género en ambientes lagunares estuarinos del Golfo de México, y Mar Caribe se han reportado en los trabajos de: Linton (1905); Hildebrand y Schroeder (1928) Pearson (1929) ; Hildebrand y Cable (1934) Storey (1937) ; Gunter (1938 y 1945) ; Knapp (1949); Moody (1950) ; Gunter e Hildebrand (1951); H. H. Hildebrand (1954 y 1958); Reid (1954, 1955 a y b) ; Kilbv (1955) ; McLane (1955) ; Joseph y Yerger (1956) ; Reid et al. (1956); Springer y Bullis (1956) ; Breuer (1957); Simmons (1957) ; Darnell (1958, 1961 y 1962); Guest y Gunter (1958) ; Klima y Tabb (1959) Springer y Woodburn (1960) ; Stewart (1961) Tabb (196 1) ; Tabb et al. (1962) ; Cervigón (1966) ; Lorio y Schafer (1966) ; Swingle et al. (1966) ; Tabb (1966) ; Reséndez (1970 y 1973); W. E. Odum (1971); Swingle (1971); Chávez (1972) ; Carr y Adanis (1973) ; Day et al. (1973 b) ; Cerame-Vivas (1974) ; Hester y Copeland (1975) y Subrahmanyam y Drake (1975). Con base en estos antecedentes y las observaciones de este estudio, Cynoscion nebulosus se considera como un componente comunitario en tránsito (Tabla 8) y consumidor de tercer orden (Tabla 10) . En el área de estudio se colectó en septiembre y octubre de 1976 en la estación BPR-1 (Tabla 12), obteniéndose 3 ejemplares desde 170 hasta 318 mm LT. Los detalles desde 170 hasta 318 mm LT. Los detalles de de parámetros ambientales más sobresalientes durante su captura en las tablas 3 a 6. Cynoscion sp. N. v. "Corvina" La determinación taxonómica a nivel específico de esta especie no se obtuvo, ya que se trataba de un ejemplar juvenil considerablemente deteriorado; sin embargo, al parecer no corresponde a la especie anterior por lo cual se discute de manera independiente. Aspectos generales sobre la ecología de varias especies afines de este género en ambientes lagunares estuarinos del Golfo de México y Mar Caribe se han reportado en los trabajos de: Linton (1905); Hildebrand y Schroeder (1928) Pearson (1929) ; Hildebrand y Cable (1934) Storey (1937) ; Gunter (1938 y 1945) ; Knapp (1949) ; Moody (1950); Gunter e Hildebrand (1951); H. H. Hildebrand (1954 y 1958) ; Reid (1954, 1955 a y b); Kilby (1955); McLane (1955) ; Joseph y Yerger (1956) ; Reid et al. (1956) ; Springer y Bullis (1956) ; Breuer 1 (1957) ; Sinimons (1957) ; Darnell (1958, 1961y 1962) Guest y Gunter (1958) ; Klima y Tabb (1959) Springer y Woodburn (1960) ; Stewart (1961) Tabb (1961); Tabb et al. (1962) ; Cervigón (1966) Lorio y Schafer (1966) ; Swingle et al. (1966) Tabb (1966) ; Reséndez (1970 y 1973) ; W. E. Odum (1971); Swingle (1971) ; Chávez (1972) ; Carr y Adams (1973) ; Day et al. (1973 b) ; Cerame-Vivas (1974) ; Hester y Copeland (1975) y Subrahmanyam y Drake (1975). Con base en estos antecedentes y las observaciones de este estudio, Cynoscion sp se considera como un componente comunitario ocasional (Tabla 7) y consumidor de tercer orden (Tabla 11) . En el área de estudio se colectó en octubre de 1976 en la estación BPR-3 (Tabla 12), obteniéndose un ejemplar de 75 mm LT. Los detalles de parámetros ambientales más sobresalientes durante su captura, en las tablas 3 a 6. Menticirrhus martinicensis (Cuvier y Valencienrnes, 1830) N. v. "Tambor" Umbrina martinicensis Cuvier y Valenciennes, Hist. Nat. Poiss., 1830; 5: 186. Aspectos generales sobre la ecología de ésta y otras especies afines del género en ambientes lagunares estuarinos del Golfo de México y Mar Caribe se han reportado en los trabajos de: Smith (1907) ; Hildebrand y Schroeder (1928) ; Hildebrand y Cable (1934) ; Gunter (1938 y 1945); Miles (1949); Reid (1954) ; Joseph y Yerger (1956); Boschung (1957 a); H. H. Hildebrand (1958) ; Springer y Woodburn (1960) ; Gunter y Hall (1965); Hoese (1965); Moe y Martin (1965); Cervigón (1966); Swingle (1971); Chávez (1972) y Day et al. (1973 b). Con base en estos antecedentes y las observaciones de este estudio, Menticirrhus martinicensis se considera como un componente comunitario ocasional (Tabla 7) y consumidor de segundo orden (Tabla 11) . En el área de estudio se colectó en marzo de 1977 en la estación BPR-3 (Tabla 12), obteniéndose un ejemplar de 163 mm LT. Los detalles de parámetros ambientales más sobresalientes durante su captura, en las tablas 3 a 6. Menticirrhus saxatilis (Bloch y Schneider, 1801) N. v. "Zorra" Johnius saxatilis Bloch y Schneider, Syst. Ichth., 1801: 75. Aspectos generales sobre la ecología de ésta y otras especies afines del género en ambientes lagunares estuarinos del Golfo de México y Mar Caribe se han reportado en los trabajos de: Smith (1907) ; Hildebrand y Schroeder (1928) ; Hildebrand y Cable (1934) ; Gunter (1938 y 1945) ; Miles (1949) ; Reid (1954) ; Joseph y Yerger (1956); Boschung (1957 a); H. H. Hildebrand (1958) ; Springer y Woodburn (1960) ; Gunter y Hall (1965) ; Hoese (1965); Moe y Martin (1965); Cervigón (1966); Swingle (1971); Chávez (1972) y Day et al. (1973 b). Con base en estos antecedentes y las observaciones de este estudio, Menticirrhus saxatilis se considera como un componente comunitario en tránsito (Tabla 8) y consumidor de segundo orden (Tabla 11) . En el área de estudio se colectó en octubre de 1976 y enero de 1977 en la estación BPR-3 (Tabla 12), obteniéndose 2 ejemplares de 100 y 140 mm LT. Los detalles de parámetros ambientales más sobresalientes durante su captura, en las tablas 3 a 6. Equetus acuminatus (Bloch y Sclineider, 1801) N. v. "Obispo" Gramistes acuminatus Bloch y Schnaider, Syst. Ichth., 1801: 184. Aspectos generales sobre la ecología de ésta y otras especies afines del género en ambientes lagunares estuarinos y costeros del Golfo de México y Mar Caribe se han reportado en los trabajos de: Springer y Bullis (1956) ; Springer y Woodburn (1960); Lowe (1962); Cervigón (1966) ; Randall (1967) y Smith (1976). Con base en estos antecedentes y las observaciones de este estudio, Equetus acuminatus se considera como un componente comunitario ocasional (Tabla 7) y consumidor de segundo orden (Tabla 10). En el área de estudio se colectó en septiembre de 1976 en la estación BPR-1 (Tabla 12), obteniéndose un ejemplar de 120 mm LT. Los detalles de parámetros ambientales más sobresalientes durante su captura, en las tablas 3 a 6. Odontoscion dentex (Cuvier y Valenciennes, 1830) N. v. "Corvina" Corvina dentex Cuvier y Valenciennes, Hist. Nat. Poiss., 1830; 5: 139, lám. 109. Aspectos generales sobre la ecología de esta especie en ambientes lagunares estuarinos y costeros del Golfo de México y Mar Caribe se han reportado en los trabajos de: Springer y Woodburn (1960) ; Cervigón (1966) ; Randall (1967) y Smith (1976). Con base en estos antecedentes y las observaciones de este estudio, Odontoscion dentex se considera como un componente comunitario en tránsito para la estación BPR-1 y ocasional en las BPR-2 y BPR-3 (Tablas 7 y 8) y consumidor de segundo orden (Tablas 10 y 11). En el área de estudio se colectó en septiembre y octubre de 1976, enero y mayo de 1977 en la estación BPR-1, septiembre de 1976 en la BPR2 y agosto de 1977 en la BPR-3 (Tabla 12), obteniéndose 45 ejemplares desde 60 hasta 166 mm LT. Los detalles de parámetros ambientales más sobresalientes durante su captura, en las tablas 3 a 6. Corvula sanctae-luciae Jordan, 1889 N. v. "Corvina" Corvula sanctae-luciae Jordan, Proc. U. S. Nat. Mus., 1889; 12: 649. Aspectos generales sobre la ecología de esta especie en ambientes lagunares estuarinos del Golfo de México y Mar Caribe se han reportado en los trabajos de: Cervigón (1966) y Cerame-Vivas (1974). Con base en estos antecedentes y las observaciones de este estudio, Corvula sanctae-luciae se considera como un componente comunitario permanente (Tabla 9) y consumidor de segundo orden (Tabla 10) . En el área de estudio se colectó en septiembre y octubre de 1976, enero, marzo y mayo de 1977 en la estación BPR-1 (Tabla 12), obteniéndose 30 ejemplares desde 59 hasta 144 mm LT. Los detalles de parámetros ambientales más sobresalientes durante su captura, en las tablas 3 a 6. Chaetodipterus faber (Broussonet, 1782) N. v. "Chomba" Chaetodon faber Broussonet, Iclth. Syst. Pisc., 1782: 9, lám. 6. Aspectos generales sobre la ecología de esta especie en ambientes lagunares estuarinos y costeros del Golfo de México. y Mar Caribe se han reportado en los trabajos de: Ryder (1887) ; Linton (1905) ; Hildebrand y Schroeder (1928) ; Townsend (1929) ; Hildebrand y Cable (1938) ; Gunter (1945) ; Breder (1946) ; Reid (1954 y 1955 b) ; Springer y Bullis (1956); Hoese (1958 y 1965) ; Springer y Woodburn (1960) ; Darnell (1962) ; Tabb et al. (1962) ; Cervigón (1966) ; Randall (1967) ; Reséndez (1970) ; Swingle (1971) ; Chávez (1972) ; Day et al. (1973 b) ; Cerame-Vivas (1974) y Smith (1976). Con base en estos antecedentes y las observaciones de este estudio, Chaetodipterus faber se considera como un componente comunitario ocasional (Tabla 7) y consumidor de primer orden (Tabla 11) . En el área de estudio se colectó en septiembre de 1976 en la estación BPR-3 (Tabla 12), obteniéndose 8 ejemplares desde 190 hasta 380 mm LT, 7 fueron hembras, 5 en estadio III de madurez gonádica y 2 en estadio VI; y un macho, en estadio III. En los estómagos se hallaron pastos marinos (Thalassia testudinum) restos de algas rodophytas (Codium sp y otras); materia orgánica vegetal no determminable; celenterados (Cnidaria, Anthozoarios y Plumatela sp); anfípodos gammáridos; moluscoa bivalvos, almejas, microgastrópodos (Triphora nigrocincta y Mitrella lunata entre otros) restos de conchas; restos de esponjas; ascidias coloniales; nemátodos; huevos no identificados y eventualmente material inorgánico. Los detalles de parámetros ambientales más sobresalientes durante su captura, en las tablas 3 a 6. Chaetodon ocellatus Bloch, 1787 N. v. "Muñeca" Chaetodon ocellatus Bloch, Naturg. Ausl. Físche, 1787; 3: 105, lám. 221, fig. 2. Aspectos generales sobre la ecología de ésta y otras especies afines del género en ambientes lagunares estuarinos y costeros del Golfo de México y Mar Caribe se han reportado en los trabajos de: Beebe y Tee-Van (1928) ; Longley e Hildebrand (1940 y 1941) ; Caldwell y Briggs (1957) ; Springer y Woodburn (1960) ; Cervigón (1966) ; Randall (1967); Bohlke y Chaplin (1968) ; Chávez (1972) ; Hastings (1972) ; Cerame-Vivas (1974) y Smith (1976). Con base en estos antecedentes y las observaciones de este estudio, Chaetodon ocellatus se considera un componente comunitario ocasional (Tabla 7) y consumidor de primer orden (Tabla 10) . En el área de estudio se colectó en agosto de 1977 en la estación BPR-1 (Tabla 12), obteniéndose un ejemplar de 68 mm LT. Los detalles de parámetros ambientales más sobresalientes durante su captura, en las tablas 3 a 6. Novaculichthys cf. infirmus (Bean, 1888) Xyrichthys infirrnus Bean, Bull. U. S. Fish. Comm., 1888: 199, lám. 29, fig. 2. La presente especie quedó conferida a Novaculichthys infirmus debido a que sólo se contó con un ejemplar juvenil considerablemente deteriorado, lo cual impidió su ubicación taxonómico-específica precisa; sin embargo, por sus características merísticas tal parece que se trata de la especie mencionada. Por otro lado, después de revisar la literatura pertinente no se encontró registro alguno para ambientes lagunares estuarinos del Golfo de México y Mar Caribe, por lo que éste pudiera ser el primer reporte para ese tipo de ambientes. Con base en las observaciones de este estudio, Novaculichthys cf. infirmus se considera como un componente comunitario ocasional (Tabla 7) y se le ubica entre los consumidores de primer orden (Tabla 10) . En el área de estudio se colectó en octubre de 1976 en la estación BPR-1 (Tabla 12), obteniéndose un ejemplar de 97 mm LT. Los detalles de parámetros ambientales más sobresalientes durante su captura, en las tablas 3 a 6. Trichiurus lepturus Linnaeus, 1758 N. v. "Pez cinta" Trichiurus lepturus Linnaeus, Syst. Nat., 1758, Ed. 10: 246. Aspectos generales sobre la ecología de esta especie en ambientes lagunares estuarinos del Golfo de México y Mar Caribe se han reportado en los trabajos de: Gunter (1938 y 1945) ; Reid (1955 b) Springer y Woodburn (1960) ; Hoese (1965) Cervigón (1966) ; Swingle (1971) ; Chávez (1972) ; Day et al. (1973 b) Reséndez (1973) y Cerame-Vivas (1974). Con base en estos antecedentes y las observaciones de este estudio, Trichiurus lepturus se considera como un componente comunitario ocasional (Tabla 7) y consumidor de tercer orden (Tabla 11) . En el área de estudio se colectó en enero de 1977 en la estación BPR-3 (Tabla 12), obteniéndose un ejemplar de 467 mm LT. Los detalles de parámetros ambientales más sobresalientes durante su captura, en las tablas 3 a 6. Achirus lineatus (Linnaeus, 1758) N. v. "Sol" Pleuronectes lineatus Linnaeus, Syst. Nat., 1758, Ed. 10: 268. Aspectos generales sobre la ecología de ésta y otras especies afines del género en ambientes lagunares estuarinos y costeros del Golfo de México y Mar Caribe se han reportado en los trabajos de: Gunter (1945 ); Reid (1954) ; Kilby (1955); H. H. Hildebrand (1958) ; Springer y Woodburn (1960) ; Tabb et al. (1962) ; Cervigón (1966) ; Pagan y Austin (1967) ; Reséndez (1970 y 1973); W. E. Odum (1971);Swingle (1971) Chávez (1972) ; Odum y Heald (1972 y 1975) Day et al. (1973 b) ; Cerame Vivas (1974) y Subrahmanyam. y Drake (1975). Con base en estos antecedentes y las observaciones de este estudio, Achirus lineatus se considera como un componente comunitario ocasional (Tabla 7) y consumidor de segundo orden (Tabla 11) . En el área de estudio se colectó en septiembre de 1976 en la estación BPR-3 (Tabla 12), obteniéndose un ejemplar de 146 mm LT. Los detalles de parámetros ambientales más sobresalientes durante su captura, en las tablas 3 a 6. Balistes capriscus Gmelin, 1788 N. v. "Pez puerco" Balistes capriscus Gmelin, Syst. Nat., 1788; 1: 1471. Aspectos generales sobre la ecología de ésta y otras especies afines del género en ambientes lagunares estuarinos y costeros del Golfo de México y Mar Caribe se han reportado en los trabajos de : Beebe y Tee-Van (1928) ; Springer y Bullis (1956) ; Springer y Woodburn (1960) ; Randall (1963, 1964 y 1967) ; Randall et al. (1964) ; Dawson (1965) ; Cervigón (1966) ; Ress y Nelson (1966) ; Cerame-Vivas (1974) y Smith (1976). Con base en estos antecedentes y las observaciones de este estudio, Balistes capriscus se considera como un componente comunitario ocasional (Tabla 7) y consumidor de segundo orden. En el área de estudio se colectó en agosto de 1977 en la estación BPR-2 (Tabla 12), obteniéndose un ejemplar de 287 mm LT. Los detalles de parámetros ambientales más sobresalientes durante su captura, en las tablas 3 a 6. Monacanthus hipidus (Linnaeus, 1766) N. v. "Lija" Balistes hispidus Linnaeus, Syst. Nat., 1766, Ed. 12,: 405. Aspectos generales sobre la ecología de ésta y otras especies afines del género en ambientes lagunares estuarinos y costeros del Golfo de México y Mar Caribe se han reportado en los trabajos de: Beebe y Tee-Van (1928) ; Reid (1954 y 1955 b) ; Springer y Woodburn (1960) ; Tabb y Manning (1961); Tabb et al. (1962); Cervigón (1966) ; Randall (1967) y Smith (1976). Con base en estos antecedentes y las observaciones de este estudio, Monacanthus hispidus se considera como un componente comunitario en tránsito (Tabla 8) y un consumidor de segundo orden (Tablas 10 y 11) . En el área de estudio se colectó en septiembre de 1976 y mayo de 1977 en la estación BPR-1 y en septiembre de 1976 y agosto de 1977 en la BPR-3 (Tabla 12), obteniéndose 6 ejemplares desde 55 hasta 128 mm LT. Los detalles de parámetros ambientales más sobresalientes durante su captura, en las tablas 3 a 6. Monacanthus ciliatus (Mitchill, 1818) N. v. "Lija" Balistes ciliatus Mitchill, Amer. Monthly Mag., 1818; 2: 326. Aspectos generales sobre la ecología de ésta y otras especies afines del género en ambientes lagunares estuarinos y costeros del Golfo de México y Mar Caribe se han reportado en los trabajos de: Beebe y Tee-Van (1928) ; Reid (1954 y 1955 b); Springer y Woodburn (1960) ; Tabb y Manning (1961) ; Tabb et al. (1962) ; Cervigón (1966) ; Randall (1967) y Smith (1976). Con base en estos antecedentes y las observaciones de este estudio, Monacanthus ciliatus se considera como un componente comunitario ocasional (Tabla 7) y un consumidor de segundo orden (Tabla 10) . En el área de estudio se colectó en octubre de 1976 en la estación BPR-1 (Tabla 12), obteniéndose un ejemplar de 97 mm LT. Los detalles de parámetros ambientales más sobresalientes durante su captura, en las tablas 3 a 6. Lactophrys tricornis (Linnaeus, 1758)N. v. "Torito, Pez cofre" Ostracion tricornis Linnaeus, Syst. Nat., 1758, Ed. 10; 1: 331. Aspectos generales sobre la ecología de ésta y otras especies afines del género en ambientes lagunares estuarinos y costeros del Golfo de México y Mar Caribe se han reportado en los trabajos de: Beebe y Tee-Van (1928) ; Longley y Hildebrand (1941) ; Springer y Woodburn (1960) ; Cervigón (1966) ; Randall (1967) ; Swingle (1971) ; Cerame-Vivas (1974) y Brook (1975 y 1977). Con base en estos antecedentes y las observaciones de este estudio, Lactophrys tricornis se considera como un componente comunitario ocasional (Tabla 7) y consumidor de segundo orden (Tabla 10). En el área de estudio se colectó en mayo de 1977 en la estación BPR-1 (Tabla 12), obteniéndose un ejemplar de 98 mm LT. Los detalles de parámetros ambientales más sobresalientes durante su captura, en las tablas 3 a 6. Sphoeroides testudineus (Linnaeus, 1758) N. v. "Xpú" Tetraodon testudineus Linnaeus, Syst. Nat., 1758, Ed. 10: 332. Aspectos generales sobre la ecología de ésta y otras especies afines del género en ambientes lagunares estuarinos y costeros del Golfo de México y Mar Caribe se han reportado en los trabajos de: Linton (1905) ; Hildebrand y Schroeder (1928) ; Reid (1954 y 1955 b) ; Springer y Bullis (1956) ; Springer y Woodburn (1960) ; Tabb et al. (1962) ; Cervigón (1966) ; Randall (1967) ; Shipp y Yerger (1969) ; Swingle (1971) ; Carr y Adams (1973) ; Day et al. (1973 b); Cerame-Vivas (1974) ; Reséndez (1975) ; Smith (1976) y Jordan et al. (1978). Con base en estos antecedentes y las observaciones de este estudio, Sphoeroides testudineus se considera como un componente comunitario en tránsito para la estación BPR-1 y permanente para la BPR-3 (Tablas 7 y 9) y consumidor de tercer orden (Tablas 10 y 11) . En el área de estudio se colectó en septiembre, octubre de 1976, enero, marzo y agosto de 1977 en la BPR-3 y en octubre de 1976, enero y marzo de 1977 en la BPR-1 (Tabla 12), obteniéndose 49 ejemplares desde 126 hasta 227 mm LT; se analizaron 36 especímenes de los cuales 10 fueron machos, 3 en estadio I de madurez gonádica, 2 en estadio II y 5 en estadio III; 26 fueron hembras, 2 en estadio I, 20 en estadio II, 3 en estadio III y una en estadio VII. En los estómagos se hallaron crustáceos (camarones Penaeus cangrejos Paguridae y Porcelanidae jaibas de la familia Portunidae, cirripedeos del orden Thoracica, ostrácodos, anfípodos del orden Gamanaridae, huevos de crustáceos y restos de decápodos), moluscos (gastrópodos, Littorina sp, bivalbos, almejas, micromoluscos, pulpos y restos de conchas), esponjas, ascidias coloniales, poliquetos, restos de peces, restos de Penatulaceae, foraminíferos fragmentos de Thalassia testudinum, de algas y restos vegetales, materia orgánica no determinable y materia inorgánica. Los detalles de parámetros ambientales más sobresalientes durante su captura, en las tablas 3 a 6. Sphoeroides marmoratus (Ranzani, 1840) N. v. "Xpú" Tetrodon marmoratus Ranzani, Novi. Comment. Ac. Sci. Inst. Bonon., 1840; 4: 73, lám. 10, fig. 1. Aspectos generales sobre la ecología de ésta y otras especies afines del género en ambientes lagunares estuarinos y costeros del Golfo de México y Mar Caribe se han reportado en los trabajos de: Linton (1905) ; Hildebrand y Schroeder (1928) ; Reid (1954 y 1955 b) ; Springer y Bullis (1956) ; Springer y Woodburn (1960) ; Tabb et al. (1962) ; Cervigón (1966) ; Randall (1967) ; Shipp y Yerger (1969) ; Swingle (1971); Carr y Adams (1973) ; Day et al. (1973 b) ; Cerame-Vivas (1974) ; Reséndez (1975) ; Smith (1976) y Jordan et al. (1978). Con base en estos antecedentes y las observaciones de este estudio, Sphoeroides marmoratus se considera como un componente comunitario ocasional (Tabla 7) y consumidor de tercer orden (Tabla 10) . En el área de estudio se colectó en mayo de 1977 en las estaciones BPR-1 y BPR-2 (Tabla 12), obteniéndose 3 ejemplares desde 55 hasta 99 mm LT, un macho en estadio. 11 de madurez gonádica y 2 de sexo indeterminado en estadio I. En los estómagos se hallaron, restos de crustáceos, anfípodos, foraminíferos y materia orgánica no determinable. Los detalles de parámetros ambientales sobresalientes durante su captura, en las tablas 3 a 6. Lagocephalus laevigatus (Linnaeus, 1766) N. v. "Xpú" Tetraodon laevigatus Linnaeus, Syst. Nat., 1766, Ed. 12: 411. Aspectos generales sobre la ecología de esta especie en ambientes lagunares estuarinos del Golfo de México y Mar Caribe se han reportado en los trabajos de: Boschung (1957 a) ; Springer y Woodburn (1960) ; Walker y Nelson (1964) ; Cervigón (1966) y Swingle (1971). Con base en estos antecedentes y las observaciones de este estudio, Lagocephalus laevigatus se considera como un componente comunitario ocasional (Tabla 7) y consumidor de tercer orden (Tabla 11) . En el área de estudio se colectó en marzo de 1977 en la estación BPR-3 (Tabla 12), obteniéndose un ejemplar de 91 mm LT, macho en estadio II de madurez gonádica y en cuyo estómago se halló materia animal no determinable. Los detalles de parámetros ambientales más sobresalientes durante su captura, en las tablas 3 a 6. Chilomycterus schoepfi (Walbaum, 1792) N. v. "Pez erizo" Diodon schoepfi Walbaum, Artedi Pisc., 1792: 601. Aspectos generales sobre la ecología de ésta ,y otras especies afines del género en ambientes lagunares estuarinos y costeros del Golfo de México y Mar Caribe se han reportado en los trabajos de: Beebe y Tee-Van (1928) ; Gunter (1945) ; Reid (1954) ; Springer y Bullis (1956) ; H. H. Hildebrand (1958) ; Springer y Woodburn (1960) ; Tabb et al. (1962) Gunter y Hall (1963 y 1965) ; Hoese (1965) Cervigón (1966) ; Randall (1967) ; Swingle (1971); Brook (1975 y 1977) ; Reséndez (1975) y Smith (1976). Con base en estos antecedentes y las observaciones de este estudio, Chilomycterus schoepfi se considera como un componente comunitario en tránsito (Tabla 8) y consumidor de tercer orden (Tabla 10). En el área de estudio se colectó en octubre de 1976 y enero de 1977 en la estación BPR1 (Tabla 12), obteniéndose 4 ejemplares desde 65 hasta 218 mm LT. Los detalles de parámetros ambientales más sobresalientes durante su captura, en las tablas 3 a 6. ESTRUCTURA DE LAS COMUNIDADES
COMPONENTES COMUNITARIOSLa dinámica de la Boca de Puerto Real determina que las especies que allí ocurren puedan ser reunidas en tres grupos comunitarios. Especies con frecuencia entre 1 y 20% son consideradas como especies visitantes ocasionales (tablas 7 y 12) ; corresponden a 31 (62% sobre 50 especies) . Especies con frecuencia entre 30 y 70% son consideradas como especies en tránsito (tablas 8 y 12) ; corresponden a 21 (42% sobre 50 especies) . Especies con frecuencia entre 80 y 100% son consideradas como especies habitantes permanentes (tablas 9 y 12) ; corresponden a 5 (10% sobre 50 especies) . En la estación BPR-1 se presentan 14 especies (28%) visitantes ocasionales, 12 especies (24%) en tránsito y 4 especies (8%) residentes permanentes. En la estación BPR-2 se presentan 9 especies (18%) visitantes ocasionales, y una especie (2%) en tránsito. No se presentan residentes permanentes. En la estación BPR-3 se presentan 16 especies (32%) visitantes ocasionales, 12 especies (24%) en tránsito, y una especie (2%) residente permanente. La cuantificación de las tablas 7 a 9 se basa en el registro total anual. Por lo tanto el panorama refleja valores máximos. Desde luego para cada una de las estaciones estudiadas los componentes comunitarios varían en el tiempo de acuerdo a los patrones ecológicos en juego. Este cambio sucesional comunitario puede apreciarse en la tabla 12 y en las figuras 9 y 10. Lo significativo para las poblaciones de las estaciones BPR-1, BPR-2 y BPR-3 es que las especies en tránsito son las que sustentan cuantitativamente a las comunidades respectivas en la Boca de Puerto Real (Figs. 9 y 10) . CATEGORÍAS ICTIOTRÒFICASConsiderando las tres categorías propuestas por Yáñez-Arancibia (1977 b y 1978 a) se consideradera que la ictiofauna queda agrupada de la siguiente manera. De las especies presentes en la estación BPR-1 se presentan 4 especies (13%) consumidores de primer orden, 17 especies (55%) consumidores de segundo orden, y 10 especies (32%) consumidores de tercer orden (Tabla 10) . De las especies presentes en la estación BPR-3 se presentan 9 especies (32%) consumidores de primer orden, 12 (41%) consumidores de segundo orden, y 8 (28%) consumidores de tercer orden (Tabla 11). La cuantificación de las tablas 10 y 11 se basa en el registro total de especies de la estación correspondiente. Por lo tanto el panorama refleja valores máximos para la estación. Desde luego para cada una de las estaciones estudiadas los componentes comunitarios ictiotróficos varían en el tiempo de acuerdo a los patrones ecológicos en juego. Este cambio puede apreciarse en las figuras 11 y 12. Lo significativo para las poblaciones de las estaciones BPR-1 y BPR-3 es que las especies consumidoras de segundo orden son las que sustentan cuantitativamente a las comunidades respectivas en la Boca de Puerto Real (Figs. 11 y 12) y guardan una relación directa con las especies en tránsito de las comunidades (Figs. 9 y 10) . FRECUENCIAEl análisis de la tabla 12 ha permitido establecer los rangos de frecuencia para determinar las especies visitantes ocasionales (Tabla 7), las especies en tránsito (Tabla 8), y las especies habitantes permanentes (Tabla 9) (ver Componentes comunitarios) . En la estación BPR-1 las especies más importantes han sido: Orthopristis chrysopterus, Haemulon plumieri, Archosargus unimaculatus y Corvula sanctae-luciae. En la estación BPR-3 la especie Sphoeroides testudineus ha sido la más importante. Estas 5 especies son consideradas, por frecuencia, residentes permanentes de las comunidades (Tabla 9).  TABLA 7 ESPECIES VISITANTES OCASIONALES DE LAS COMUNIDADES.  TABLA 8 ESPECIES EN TRÁNSITO DE LAS COMUNIDADES. 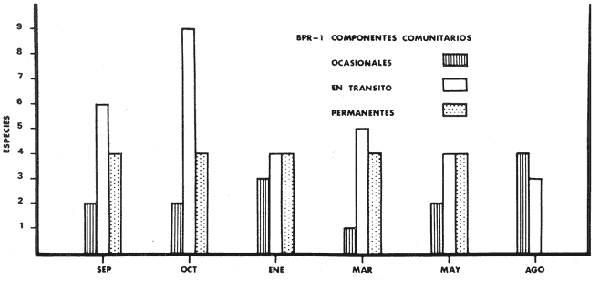 Fig. 9. Variación temporal y proporciones entre los tres tipos de componentes dentro de la estructura de las comunidades de peces en la Boca de Puerto Real (BPR-1). 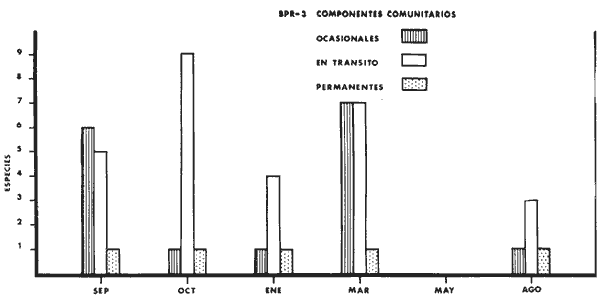 Fig. 10. Variación temporal y proporciones entre los tres tipos de componentes dentro de la estructura de las comunidades de peces en la Boca de Puerto Real (BPR-3).  TABLA 9 ECIES HABITANTES PERMANENTES DE LAS COMUNIDADES.  TABLA 10 CATEGORÍAS ICTIOTRÓFICAS DE LA ESTACIÓN BPR-1 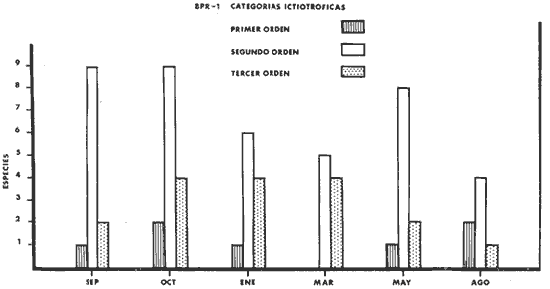 Fig. 11. Variación temporal y proporciones entre las tres categorías ictiotróficas dentro de la estructura de las comunidades de peces en la Boca de Puerto Real (BPR-1) . 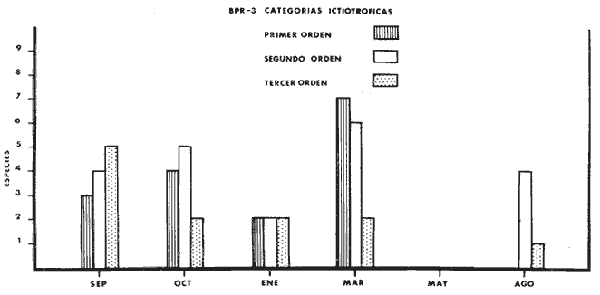 Fig. 12. Variación temporal y proporciones entre las tres categorías ictiotróficas dentro de la estructura de las comunidades de peces en la Boca de Puerto Real (BPR-3).  TABLA 11 CATEGORÍAS ICTIOTRÓFICAS DE LA ESTACIÓN BPR-3. Especies de importancia secundaria en la estación BPR-1 han sido Lutjanus griseus, Eucinostomus gula, Bairdiella chrysura, Odontoscion dentex y Sphoeroides testudineus. Tabla 12 Especies de importancia secundaria en la estación BPR-3 han sido Sardinella macrophtalmus, Arius felis y Chloroscombrus chrysurus.Del total de 50 especies consideradas en la tabla 12, en la estación BPR-1 se encuentran 30 (60%). en la estación BPR-2 se presentan 10 (20%) y en la estación BPR-3 se presentan 29 (58%). DIVERSIDAD Y DISTRIBUCIÓNLa diversidad calculada como índice numérico (H'n) muestra una variación temporal (Figs. 13 y 14). Estos índices permiten resumir información concerniente a la estructura numérica de las poblaciones. Su valor empírico aislado es vago y debe considerarse como información adicional dentro de un contexto ecológico muy amplio. Los índices encontrados son bajos y concuerdan con otros rangos encontrados en otra área de pastos marinos y manglares (ver Discusión). Es evidente que el estudio de la diversidad por medio de índices es tremendamente problemático y complejo para comunidades nectónicas de activo desplazamiento y por lo general difícil de interpretar. Shannon y Weaver (1963) establecen un rango de valores para la diversidad referida a un probable grado de contaminación, estableciendo que valores entre 0 y 2 reflejarían una situación de alta contaminación. Esto es discutible por cuanto los valores encontrados no rebasan por mucho este rango y sin embargo el área no se encuentra contaminada (Botello, 1978). ABUNDANCIALa distribución del standing crop total de las comunidades (g peso húmedo X m-2) y densidad (No. indiv. X m-2) se aprecia en las figuras 15 y 16. En la estación BPR-1 se aprecia un rango anual de biomasa de 0.97 g x m-2 (enero) hasta2.2 3 g x m-2 (marzo) con un promedio de 1.33 g x m-2. En la estación BPR-3 se aprecia un rango anual de biomasa de "cero" g x m-2 (mayo) a 10.92 g x m-2 (septiembre) con un promedio de 2.02 g x m-2. Esta biomasa no necesariamente sigue una relación directa con la densidad como se aprecia en las figuras 15 y 17. Esto puede explicarse porque los organismos son jóvenes, inmaduros sexualmente y por consiguiente de pequeño tamaño. A su vez, la relación entre la biomasa y el índice de biomasa (H'g) es directa y relativamente uniforme pudiendo presentar alguna relación inversa eventual cuando aparecen ejemplares aislados de tamaño considerable (Figs. 16 y 18). AFINIDADLa afinidad establecida entre las tres estaciones estudiadas se basa en las tablas 7, 8 y 9, de la siguiente manera: Para visitantes ocasionales. Entre las estaciones BPR-1 y BPR-2 con un total de 23 especies sólo 3 (13.04%) son comunes, i. e., Lutjanus synagris, Anisotremus spleniatus y Sphoeroides marmoratus. Entre las estaciones BPR-1 y BPR-3 con un total de 30 especies sólo 2 (6.66%) son comunes, i. e., Urolophus Jamaicensis y Lutjanus synagris. Entre las estaciones BPR-2 y BPR-3 con un total de 25 especies sólo 4 (16%) son comunes, i. e., Synodus foetens, Lutjanus synagris, Eucinostomus gula y Odontoscion dentex. Para especies en tránsito. Entre las estaciones BPR-1 y BPR-2 con un total de 13 especies sólo 1 (7.7%) es común, i. e., Anisotremus surinamensis. Entre las estaciones BPR1 y BPR-3 con un total de 24 especies sólo 3 (12.5%) son comunes, i. e., Arius felis, Bairdiella chrysura y Monacanthus hispidus. Entre las estaciones BPR-2 y BPR3 la afinidad es "cero". Para residentes permanentes. Entre las tres estaciones consideradas, la afinidad es "cero". DISCUSIÒNLo más significativo de los resultados presentados es el contraste evidente entre las estaciones consideradas siendo claramente notorio entre la BPR-1 ubicada sobre parches de Thalassia testudinum y la BPR-3 ubicada sobre parches de macroalgas. Este contraste y/o diferencias a nivel estructural de las comunidades nectónicas aparentemente obedece al marco ambiental en el cual se sitúan, dentro del cual resalta como barrera física entre ambas ictiocomunidades la corriente que penetra por el canal de la Boca de Puerto Real (ver Figs. 3 y 4, Conclusiones y Resumen). Para ambas ictiocominidades se encontraron 3 niveles tróficos siendo: 1) consumidores de primer orden, 2) consumidores de segundo orden, y 3) consumidores de tercer orden, de los cuales los consumidores de segundo orden son dominantes, al menos numéricamente; la figura 19 resume y compara el hecho establecido en las figuras 11 y 12 y las tablas 10 y 11. Asimismo los consumidores de segundo orden se identifican en gran medida con los componentes comunitarios en tránsito (más del 50%) por lo cual es razonable suponer que esos componentes tanto estructural como funcionalmente son los que en forma más significativa regularían y condicionarían en tiempo y espacio a las comunidades en cuestión. Por otra parte, los índices de diversidad, tanto de número de especies como de biomasa, no son altos y concuerdan con valores de otras áreas similares, al menos para la comunidad ubicada sobre pastos marinos siendo comparativamente menores y de relación inversa para con la comunidad ubicada sobre parches de macroalgas (Tabla 13, Figs. 20 y 21). Los valores bajos de estos índices no reflejan necesariamente áreas contaminadas por cuanto el área aquí estudiada se encuentra, en términos generales limpia de contaminación (Botello, 1978). A su vez en la tabla 14 puede compararse la biomasa de las comunidades de peces de diferentes sistemas ecológicos de pastos marinos de Norte América, de donde resulta interesante hacer hincapié en dos aspectos: 1) aparente mente las praderas de pastos marinos son sistemas ecológicos eficientes para convertir la energía de la radiación solar en tal cantidad de materia que es capaz de sustentar importantes poblaciones de peces (Yáñez-Arancibia 1978 b), y 2) la biomasa de la comunidad ubicada sobre parches de macroalgas es comparativamente menor (Fig. 22) y paradójicamente el promedio es mayor determinado por una gran densidad en el mes de septiembre. 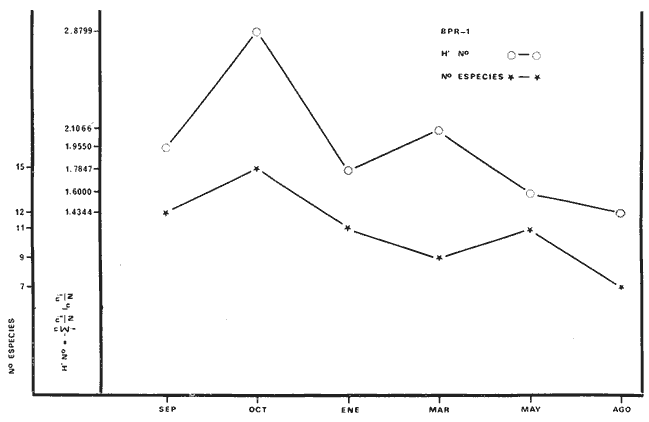 Fig. 13. Variación temporal y comparación entre el índice de diversidad (H`n) y el número de especies (N°) en las comunidades de peces en la Boca de Puerto Real (BPR-1). 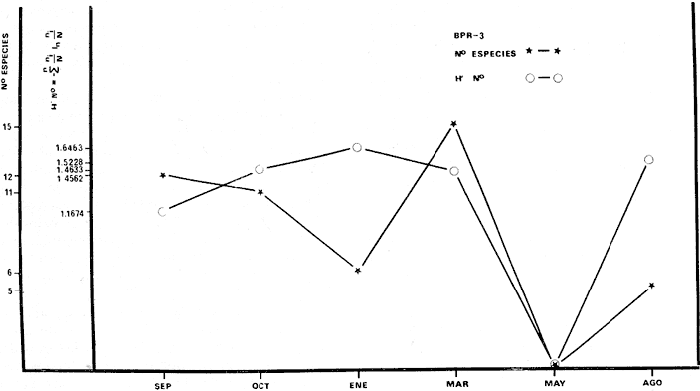 Fig. 14. Variación temporal y comparación entre el índice de diversidad (H`n) y el número de especies (N°) en las comunidades de peces en la Boca de Puerto Real (BPR-3). 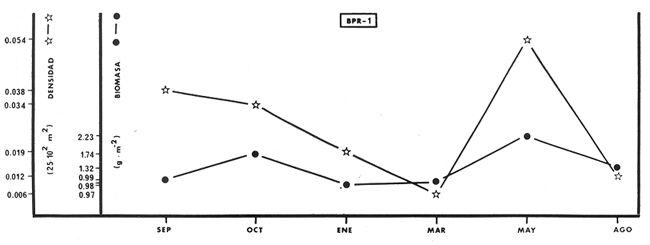 Fig. 15. Variación temporal y comparación entre la biomasa y la densidad en las comunidades de peces en la Boca de Puerto Real (BPR-1). 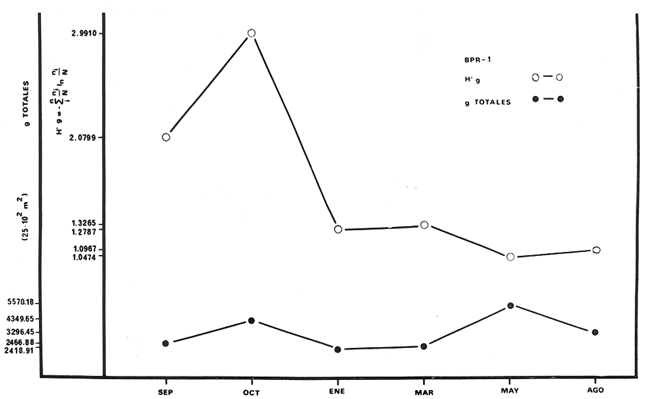 Fig. 16. Variación temporal y comparación entre la biomasa y el índice de la biomasa (H`g) en las comunidades de peces en la Boca de Puerto Real (BPR-1). 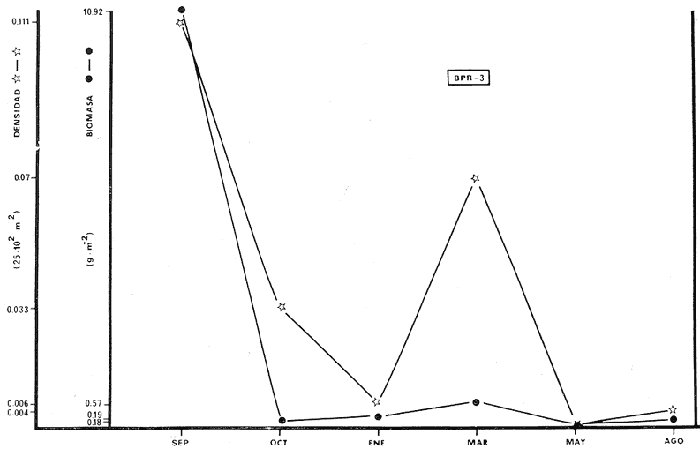 Fig. 17. Variación temporal y comparación entre la biomasa y la densidad en las comunidades de peces en la Boca de Puerto Real (BPR-3). 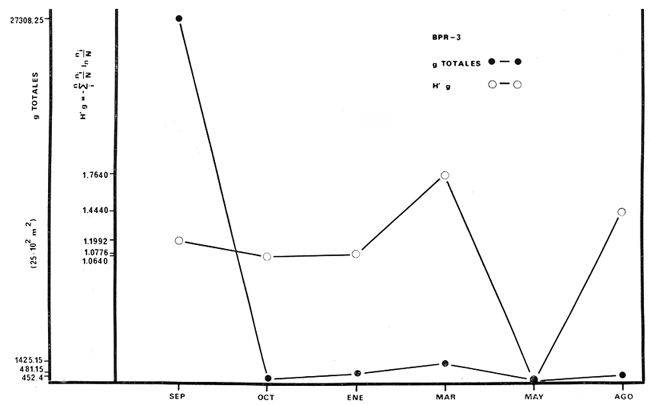 Fig. 18. Variación temporal y comparación entre la biomasa y el índice de la biomasa (H`g) en las comunidades de peces en la Boca de Puerto Real (BPR-3). 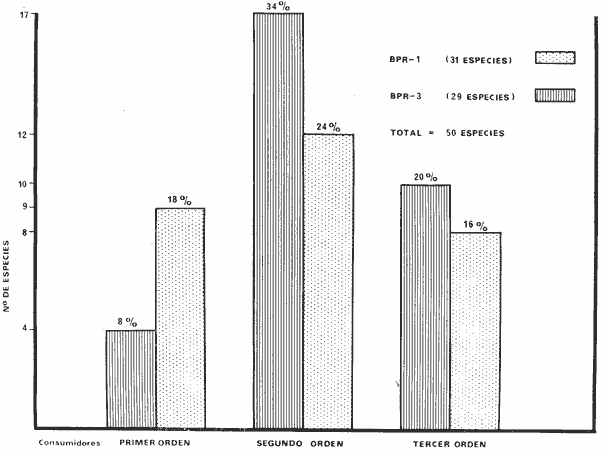 Fig. 19. Variación temporal y comparación de los 3 niveles tróficos en las comunidades de peces en la Boca de Puerto Real, ubicadas sobre Thalassia testudinum (BPR- 1), y bancos de macroalgas (BPR-3) . Una característica que se observó en ambas comunidades a lo largo de este estudio es que se componían prácticamente en su totalidad de individuos jóvenes, lo cual se evidenció debido a que el promedio del rango de tallas no sobrepasó los 200 mm y a que sexualmente eran inmaduros. Dichas especies presumiblemente utilizan el sistema lagunar-estuarino de Laguna de Términos como área natural de crianza; sin embargo, la Boca de Puerto Real representa únicamente la puerta de entrada a dicho sistema lo que hace difícil corroborar esta determinación. El análisis de frecuencia de las especies permitió agruparlas en las 3 categorías de componentes comunitarios ya mencionados (Figs. 9 y 10) , i. e., 1) componentes ocasionales, 2) especies en tránsito, y 3) residentes permanentes (Tablas 7, 8 y 9). Esta categorización es similar a la propuesta por Kikuchi (1966) en la cual reconoce para comunidades de pastos marinos: 1) residentes permanentes, 2) residentes estacionales, 3) visitantes temporales, los cuales se alimentan en un área más amplia que la solamente ocupada por pastos marinos, y 4) especies migratorias ocasionales, y a la propuesta por Subrahmayam y Drake (1975) en la cual reconoce para comunidades de peces, sobre la base de su presencia como juveniles y/o adultos en marea alta y/o baja, cuatro categorías: 1) especies residentes permanentes, 2) especies que utilizan los pantanos salobres como áreas naturales de crianza, 3) especies que utilizan los pantanos salobres para alimentarse, y 4) especies esporádicas que presentan movimientos erráticos. 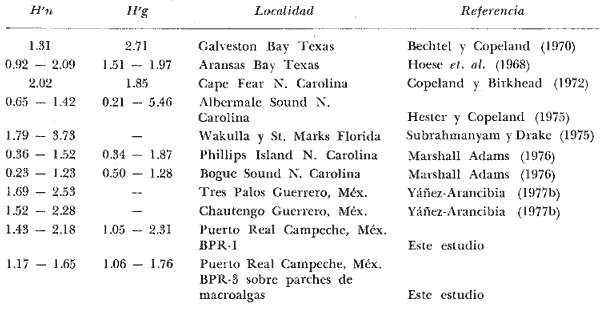 TABLA 13 RANGOS DE VALORES DE DIVERSIDAD DE COMUNIDADES DE PECES EN SISTEMAS ESTUARINOS CON PASTOS MARINOS O MANGLARES DE NORTEAMÉRICA 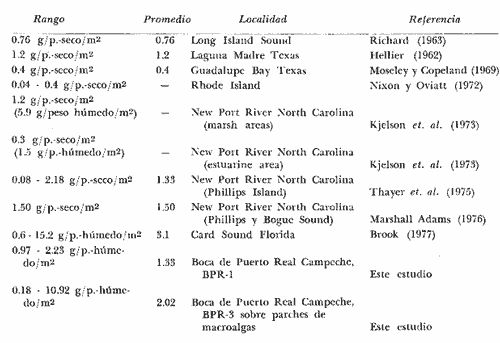 TABLA 14 RANGOS DE VALORES DE BIOMASA DE COMUNIDADES DE PECES EN DIFERENTES SISTEMAS ESTUARINOS DE PASTOS MARINOS DE NORTEAMÉRICA 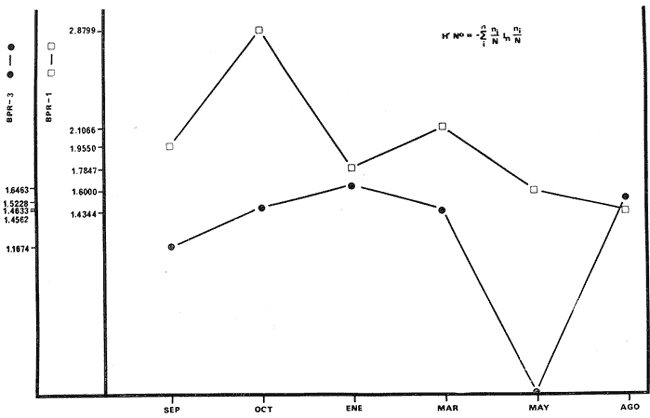 Fig. 20. Variación temporal y comparación del índice de diversidad (H`n) en las comunidades de peces en la Boca de Puerto Real, ubicada sobre praderas de Thalassia testudinum (BPR-1) , y en bancos de macroalgas (BPR-3) . 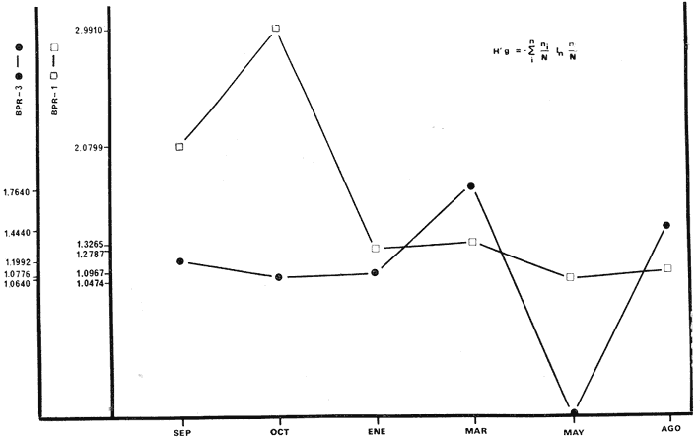 Fig. 21. Variación temporal, y comparación del índice de diversidad (H`g) en las comunidades de peces en la Boca de Puerto Real, ubicadas sobre Thalassia testudinum (BPR-1), y bancos de macroalgas (BPR-3).  Fig. 22. Variación temporal y comparación de biomasa en las ictiocomunidades en la Boca de Puerto Real, ubicadas sobre Thalassia testudinum (BPR-1), y bancos de macroalgas (BPR-3). Estas categorizaciones no se contraponen con la propuesta por Yáñez-Arancibia (1977 b, 1978 a) en la cual considera que en algunos sistemas lagunares estuarinos de México se presenta un máximo de seis componentes comunitarios, i. e., 1) peces dulceacuícolas que ocasíonalmente penetran en aguas salobres, 2) peces anadromos y catadromos, en tránsito, 3) peces verdaderamente estuarinos, los cuales permanecen toda su vida en el estuario pudiendo penetrar ocasionalmente al mar o al agua dulce, 4) peces marinos que utilizan el estuario como áreas naturales de crianza o para desovar, pero pasan la mayor parte de su vida en el mar regresando al estuario estacionalmente, 5) peces marinos que efectúan visitas al estuario generalmente como adultos y para alimentarse, y 6) visitantes marinos ocasionales que irregularmente penetran al estuario por diferentes razones y su frecuencia es baja. La categorización propuesta en este estudio puede ser válida para un sistema estuarino poco marcado, de ictiofauna transicional y, en términos generales, queda junto con la de Kikuchi (1966) y la de Subrahmanyam y Drake (1975) englobadas en la de Yáñez-Arancibia (1977 b, 1978 a). Lo significativo de estas situaciones es lo particular de los sistemas lagunares estuarinos en donde se estudiaron; sin embargo, en un plano general su estructura y en parte su funcionamiento son razonablemente similares. Por último es importante señalar que la diversidad y abundancia faunística en la estación BPR-1 (considerando no sólo a los peces) es alta, determinando una gran disponibilidad del alimento como lo han demostrado Yáñez-Arancibia (1978 b) siendo por el contrario bajas para la estación BPR-3, determinando una relativa disponibilidad del alimento lo que se evidenció por la poca diversidad y abundancia de la fauna de acompañamiento de las capturas realizadas durante el presente estudio. Por los resultados presentados y la discusión general planteada se pueden puntualizar diferentes conclusiones. ConclusionesCONCLUSIONESLa dinámica ambiental del área determina el establecimiento de dos tipos de comunidades, una en la estación BPR-1 sobre praderas de Thalassia testudinum y la otra en la estación BPR-3 sobre bancos de macroalgas Rhodophyceae y Phaeophyceae, separadas por una barrera hidrodinámica e influidas por los siguientes patrones ecológicos: 1) corrientes, 2) sustrato, 3) profundidad, 4) macroepifauna bentónica, 5) vegetación sumergida, 6) disponibilidad de alimento, 7) transparencia, 8) oleaje. Las comunidades mencionadas se caracterizan por: ESTACIÒN BPR- 1 1. Las temperaturas superficiales varían entre 22 °C (enero) y 29 °C (septiembre). Las de fondo entre 21°C (enero) y 28 °C (marzo). 2. Las salinidades superficiales y de fondo varían entre 29 o/oo (enero) y 38 o/oo (mayo). 3. El oxígeno superficial varía entre 4.29 ml/l (mayo) y 6.40 ml/l (agosto) . El de fondo varía entre 2.59 ml/l (mayo) y 6.40 ml/l (octubre). 4. La transparencia promedio, estimada en función de la profundidad (hasta 4 m) fue de 64%. 5. Sustrato lodoso de arena fina limo arcilloso con 50 a 60% de CaC03 y alto contenido orgánico; vegetación de Thalassia testudinum, oleaje moderado. 6. La diversidad de grupos faunísticos (considerando no sólo a los peces) es alta (Yáñez-Arancibia 1978b). 7. Esto determina una gran disponibilidad de alimento para sostener comunidades de peces formadas por 31 especies. 8. Estas comunidades ictiofaunísticas presentan un rango de biomasa total de 0.97 g/M2 (enero) a 2.23 g/m2 (mayo) (Fig. 23) con un promedio de 1.33 g/m2 y una biomasa total de 8 g/m2 /año. Con un rango de densidad total de 0.001 indiv. /m2 (marzo) a 0.054 indiv./m2 (mayo) (Fig. 23) con un promedio de 0.027 indiv./m2 y una densidad total de 0.16 indiv./m2. 9. Estas 31 especies de peces se componen desde el punto de vista de su permanencia en la comunidad en: ESTACIÒN BPR-3 Las temperaturas superficiales varían entre 22°C (enero) y 29°C (septiembre). Las de fondo entre 26°C (marzo) y 28°C (octubre y mayo). Las salidades superficiales y de fondo varían entre 27 o/oo (enero) y 38 o/oo (mayo). El oxígeno superficial varía entre 3.44 ml/l (marzo) y 5.40 ml/l (agosto). El de fondo varía entre 3.9 ml/l (marzo) y 5.3 ml/l (agosto). La transparencia promedio, estimada en función de la profundidad (hasta de 5m) fue de 48% Sustrato arenoso de arena limo arcillosa con 60 a 70% de CacO3 y bajo contenido orgánico; vegetación de Rhodophyceae y Phacophyceae, y oleaje fuerte. La diversidad de los grupos faunísticos (considerando no sólo a los peces) es baja. Esto determina una relativa disponibilidad de alimento el cual es capaz de sostener comunidades de peces formadas por 29 especies. Estas comunidades ictiofaunísticas presentan un rango de bíomasa total de 0.00 g/m² (mayo) a 11 g/m² (septiembre) (Fig. 24) con un promedio de 2.0 g/m² y una biomasa total de 12.04 g/m² /año. Con un rango de densidad total de 0.00 indiv./m2 (mayo) a 0.11 indiv./m² (septiembre) (Fig. 24) con un promedio de 0.04 indiv./m² y una densidad total de 0.02 indiv./m² Estas 29 especies de peces se componen desde el punto de vista de su permanencia en la comunidad en: especies visitantes ocasionales 14 (28%) ; especies visitantes en tránsito 12 (24%) y especies residentes permanentes 4 (8%) . Y desde el punto de vista de categorías ictiotróficas en: consumidores de primer orden 4 (13%), con un rango de biomasa de 0.00 g/m² (marzo) a 0.04 g/m² (septiembre) (i.e., 0.06 g/m² /año) y un rango de densidad de 0.00 indiv./m² a 0.013 indiv./m² (septiembre) (i.e. 0.016 indiv./m²/año/. Consumidores de segundo orden 17 (55%) ; con un rango de biomasa de 0.14 g/m² (marzo) a 1.20 g/m² (octubre y agosto) (i.e., 4.71 g/m²/año) y un rango de densidad de 0.003 indiv./m² (marzo) a 0.05 indiv./m² (mayo) (i.e., 0.13 indiv./m²/ año) . Consumidores de tercer orden 10 (32%) ; con un rango de biomasa de 0.12 g/m² (agosto) a 1.63 g/m² (mayo) (i.e., 2.65 g/m²/año) y un rango de densidad de 0.OO/indiv./m² (septiembre, mayo y agosto) a 0.003 indiv./m² (enero) (i.e., 0.010 indiv./m²/año). 10. La diversidad ictiofaunística numérica (H'n) presenta un rango de 1.43 (agosto) a 2.18 (octubre); y la diversidad de biomasa (H'g) presenta un rango de 1.05 (mayo) a 2.31 (octubre) (Fig. 23). 1l. Las especies tipo son 4: Orthopristis chrysopterus Haemulon plumieri Archosargus unimaculatus Corvula sanctae-luciae 12. Se establece también que la afinidad entre las estaciones BPR-1 y BPR-3 desde el punto de vista de sus componentes comunitarios fue de: Para especies visitantes ocasionales de 6.6% las cuales son: Urolophus jamaicensis y Lutjanus synagris. Para especies visitantes en tránsito de 12.5% las cuales son: Arius felis, Bairdiella chrysura y Monacanthus hispidus. Y para especies residentes permanentes de "cero". especies visitantes ocasionales 16 (32%). especies visitantes en tránsito 12 (24%) y especies residentes permanentes 1 (2%). Y desde el punto de vista de categorías ictiotróficas en: consumidores de primer orden 9 (32%); con un rango de biomasa de 0.00 g/m2 (mayo y agosto) a 4.42 g/m2 (septiembre) (i.e., 4.75 g/m2 (mayo y agosto) a 0.06 indiv./m2 (marzo) (i.e., 0.11 indiv. /m2 (septiembre) (i.e., 0.1 indiv. m2/ año). Consumidores de segundo orden 12(41%); con un rango de biomasa de 0.00 g/m² (mayo) a 4.72 g/m² (septiembre) (i.e., 5.0 g./m2/año) y un rango de densidad de 0.00 indiv./m² (mayo) a 0.08 indiv./m² (septiembre) (i.e., 0.1 indiv./m² /año). Consumidores de tercer orden 8(28%); con un rango de biomasa de 0.00 g/m2 (mayo) a 1.8 g/m² (septiembre) (i.e., 2.4 g/m²/año) y un rango de densidad de 0.00 indiv./m² (mayo) a 0.018 indiv.1 m² (septiembre) (i.e., 0.023 indiv./m²/año). La diversidad ictiofaunística numérica (H'n) presenta un rango de 0.00 (mayo) a 1.65 (enero) ; y la diversidad en biomasa (H'g) presenta un rango de 0.00 (mayo) a 1.76 (marzo) (Fig. 24). Únicamente hubo una especie tipo: Sphoeroides testudineus 13. Se demuestra una sucesión de especies en ambas comunidades, lo que junto con los valores relativamente bajos de biomasa y diversidad, permiten concluir que la Boca de Puerto Real es un ecosistema dinámico, de ictiofauna transicional y poco propicio para el establecimiento de comunidades permanentes. 14. El sistema representa la puerta de entrada al ecosistema lagunar estuarino del interior de la Laguna de Términos. 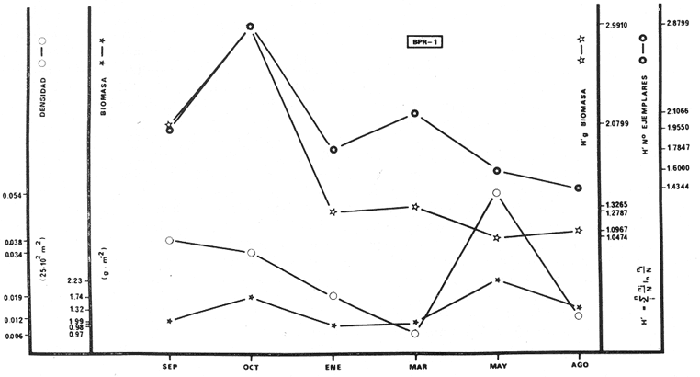 Fig. 23. Variación temporal y relaciones entre la densidad (indv./m2), biomasa (g/m2) índice de diversidad (H'Nº) e índice de biomasa (H'g) en las comunidades de peces de la estación BPR-1.  Fig. 24. Variación temporal y relaciones entre la densidad (indv.-m2), biomasa (g/m2) indice de diversidad (H'Nº) e índice de biomasa (H'g) en las comunidades de peces de la estación BPR-3. AgradecimientosAGRADECIMIENTOSA Rodolfo Cruz-Orozco Jefe de la Estación de Investigaciones Marinas "El Carmen" y su personal técnico, las facilidades proporcionadas en el área y su ayuda en las colectas. A los compañeros del Laboratorio de Ictiología y Ecología Estuarina: Felipe Amezcua-Linares su ayuda en las colectas y discusiones taxonómicas, Violeta Leyton Vargas su ayuda en las colectas y confección de mapas, Irma Vargas su ayuda en la confección de las gráficas. A Alma Rosa González Esquinca por su colaboración en el procesamiento del material y confección de tablas. Francisco Contreras Espinoza, Enrique Boschi (experto de UNESCO en Biología Marina) y a Leonardo Luján por su ayuda en algunas colectas. A Alfredo Laguarda Figueras, Director del Centro de Ciencias del Mar y Limnología y a José Luis Rojas Galaviz, Secretario Académico de dicho Centro, las facilidades otorgadas para la ejecución de estos estudios y la lectura del manuscrito. A Antonio García-Cubas y Gerardo Green Macías la lectura del manuscrito. A John W. Day sus comentarios. Este estudio fue financiado por el Programa Regional de Desarrollo Científico y Tecnológico de la Organización de Estados Americanos (OEA) a través de su Oficina de Proyectos Especiales, y forma parte de un programa de estudios denominado "Recursos Bióticos en Lagunas Costeras, Manglares y Áreas Adyacentes de América Latina" (proyectos piloto comparativos en el Golfo de Nicoya, Costa Rica; Bahía de Puerto Viejo Azua, República Dominicana; Laguna de Términos, Campeche, México). LITERATURAAMEZCUA-LINARES, F. A. YÁÑEZ-ARANCIBA, Ecología de los sistemas fluvio-lagunares asociados a Laguna de Términos. I. El habitat y estructura de las comunidades de peces.(en prensa). An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México 1979. 3 6 AYALA-CASTAÑARES, A. Sistemática y distribución de los foraminíferos recientes de la Laguna de Términos, Campeche, México Bol. Inst. Geol. Univ. Nal. Autón. México. 1963. 1-130. 3 67 BARDACH, J. E. y D. W. MENZEL Field and laboratory observations on the growth of some Bermuda reef fishes Proc. Gulf Caribb. Fisher. Inst., Ninth Ann. Sess. 1957. 106-112. BECHTEL, T. J. B. J. COPELAND Fish species diversity indices as indicators of pollution in Galveston Bay, Texas. Pub1s. Inst. Mar. Sci. Univ. Texas , 1970. 103-132. 15 BEEBE, W. J. TEEN-VAN, Zoologica The fishes of Port-auPrince, with a summary of the known species of marine fish of the island of Haiti and Santo Domingo. 1928 1-279. 1 10 BOHLKE, J. E. C. G. CHAPLIN, Fishes of the Bahamas and Adjacent Waters. Livingston Publishing, 1968. 771 p. BOSCHUNG, H. T., The fishes of the Mobile Bay and the Gulf coast of Alabama. Ph. D. Dissertation. Univ. Alabama, 1957a. 626 p. ---, Some interesting records of marine fishies of Alabama. J. Alabama Acad. Sci., 1957b. 33-34 29 BOTELLO, A. V. Variación de los parámetros hidrológicos en las épocas de sequía y lluvias (Mayo, y Noviembre de 1974) en la Laguna de Términos, Campeche, México. An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, 1978. 159-178. 1 5 BREDER, C. M. Field Book of Marine Fishes of the Atlantic Coast from Labrador to Texas. G. P. Putnam's Sons Nueva York 1948. 332 p. ---, Bull. Bingham Oceanogr. Coll. An analysis of the deceptive resemblances of fishes to plant part, with critical remarks on protective coloration, mimicry and adaptation. 1946. 1-49. 2 10 BREUER, J. P., Ecological survey of Baffin and Alazan Bays, Texas. Publ. Inst. Mar. Sci. Univ. Texas, 1957 134-155. 2 4 BRIGGS, J. C. A list of Florida fishes and their distribution Bull. Fla. St. Mus. Biol. Sci., 1958 223-318. 8 2 BROOK, J. M. Some aspects of the trophic relationships among the higher consumers in a seagrass community (Thalassia testudinum Koning) in Card, Sound, Florida. Ph. D. Dissertation, University of Miami, 1975. 133 p. ---, Trophic relationships in a seagrass community (Thalassia testudinum), in Card Sound, Florida. Fish diets in relation to macrobenthic and cryptic faunal abundance. Trans. Amer. Fish. Soc. 1977. 219-229. 3 106 CALDWELL, D. K. J. C. BRIGGS, Range extensions of western north Atlantic fishes with notes on some soles of the genus Gymnachirus. Bull. Fla. St. Mus. Biol. Sci. 1957. 1-11. 1 2 CÁRDENAS, F. M. Lagunas Costeras un Simposio. Mem. Simp. Intern. Lagunas Costeras. Pesquerías en las lagunas litorales de México. In: Ayala--Castañares, A. y F. B. Phleger (Eds.) UNAM-UNESCO México 1969. 645-652. Nov. 28-30, 1967 CARRANZA, J. Los recursos naturales del sureste y su aprovechamiento. Inst. Mex. Rec. Nat. Renov., 1969. 1-151. 2 3 CARR, W. E. S. C. A. ADAMS Food habits of juvenile marine fishes: Evidence of cleaning habit in the leather jacket Oligoplites saurus, and the spot tail pinfish, Diplodus holbrooki, Nat. Mar. fish. Serv. Fish. Bull., 1972. 1111-1120 4 70 CARR, W. E. S. C. A. ADAMS Food habits of Juvenile marine fishes occupying seagrass beds in the estuarine zone near Crystal river. Florida. Trans. Amer. Fisher. Soc. 1973 511-540. 3 102 CARVAJAL, R. J. Condiciones ambientales y productividad de la Laguna de Términos, Lagena, Campeche, México. 1973. 35-38. 31 -----, Contribución al conocimiento de los robalos Centropomus undecimalis y C. poeyi en la Laguna de Términos, Bol. Inst. Oceanogr. Univ. Oriente, Campeche, México. 1975. 51-70. 1 14 CASAMAN, C. W Contributions to the ichthyofaunas of the west Flower Garden Reef and other sites in the Gulf of Mexico and western caribbean. Ph. D. Dissertation, Texas A and M University, 1973. 248 p. CASTRO, A. J. L. Peces sierra, rayas, mantas y especies afines de México, An Inst. Nal. Inv. Biol Pesq., 1965. 170-256. 1 CAUSEY, B. D. The fish fauna of seven and onehalf Fathom Reef, northwestern Gulf of Mexico. M. S. Thesis, Texas A and M University, 1969 110 p. CERAME-VIVAS, M. J. Inc. Mangroves of Puerto Rico. P. F. Z. Properties,. Inc., y M. J. Cerame-Vivas, Inc., 1974. 64 p CERVIGON, M. F. Los Peces Marinos de Venezuela. Estación de Investigaciones Marinas de Margarita, Fundación La Salle de Ciencias Naturales, Caracas, Monogr. 1966. 1-951. 11 y 12: -----, Ecología Marina. Fundación La Salle de Ciencias Naturales, Caracas, Monogr. Los Peces In: Margalef R. (Ed.) 1972. 308-355. Cap. 10 14 -----, Complemento IV. Contribución Científica, 5 Los Peces Marinos de Venezuela. Universidad de Oriente Nueva Esparta 1975. 45 p. CHÁVEZ, E. A., Notas acerca de la ictiofauna del estuario del río Tuxpan y sus relaciones con la temperatura y la salinidad. In: Carranza, J. (Ed.) Mem. IV Congr. Nal. Ocean. México 1972. 177-199. CHRISTMAS, J. Y., G. GUNTER E. L. WHATLEY Fishes Taken in the menhaden fishery of Alabama, Mississippi, and eastern Louisiana. U. S. Fish Wildl. Serv., Spec. Sci. Rep. Fish., 1960. 1-10. 339 CLARO, R. V. I. LAPIN Algunos datos sobre la alimentación y la dinámica de las grasas en la biajaiba, Lutjanus synagris (Linnaeus) en el Golfo de Batabano, Plataforma sur de Cuba. Acad. Cienc. Cuba, Inst. Oceanogr. Ser. Oceanol., 1971 1-16. 10 COLL DE HURTADO, A. El sureste de Campeche y sus recursos naturales. Serie Cuadernos Inst. Geogr. Univ. Nal. Autón. Méxic 1975. 85 p. COPELAND, B. J. W. S. BIRKHEAD First Annual Report to Carolina Power and hight Co., Some ecological studies of the lower Cape Fear River estuary, ocean out fall and Dutchman Greek, 1971. Raleigh, N. C., 1972. 1-105. 71 COURTENAY, W. R. Western atlantic fishes of the genus Haemulon (Pomadasyidae) : Systematic status and juvenile pigmentation. Bull. Mar. Sci. Gulf Caribb., 1961. 66-149. 1 11 CROKER, R. A. Growth and food of the gray snapper, Lutjanus griseus, in Everglades National Park. Trans. Amer. Fish. Soc., 1962. 379-383. 4 91 CRUZ-OROZCO y F. ROSALES-LOPEZ R., F. LEY Lou R. LECUANDA Programa de Estudios: Recursos Bióticos en Lagunas Costeras, Manglares y Áreas Adyacentes de América Latina. Mimeografeado Informe preliminar sobre los estudios de geología, Laguna de Términos, Campeche, México. Centro Cienc. del Mar y Limnol., UNAM-OEA. 1977. 21 p. CUMMINGS, W. C., Y B. D. BRAH J. Y. SPIRES Haemulon album Cuvier, off north Bimini, Bahamas. Sound production, schooling and feeding habits of the margate, 1966 626-640. 3 16 CURRAN, H. W. A systematic revistion of the gerrid fishes referred to the genus Eucinostomus, with a discussion of their distribution and speciation. Ph. D. Thesis, University of Michigan , 1942. 183 p. DARNELL, R. M. Food habits of fishes and larger invertebrates of Lake Pontchartrain, Louisiana, an estuarine community. Publ. Inst. Mar. Sci. Univ. Texas 1958. 353-416. 5 -----, Ecology Trophic spectrum of an estuarine community based on studies of Lake Pontchartrain, Louisiana. 1961. 552-568. 3 42 ----, Fishes of the Río Tamesí and related coastal lagoons in east central Mexico. Publ. Inst. Mar. Sci. Univ. , Texas 1962. 299-365. 8 DAWSON, C. E. Museum Report. Gulf Coast Res. Mimeografiado Lab., Ocean Springs, Miss. 1965. 57 p. DAY, J. W., W. G. SMITH CH. S. HOPKINSON Coastal Marsh and Estuary Management Symposium. Some trophic relationships of marsh and estuarine areas. In: Chabreck, R. H. (Ed.) Louisiana State University Press: 1973a. 115-135. DAY, J. W., W. G. SMITH, P. R. WAGNER W. C. STOWE Community structure and energy flow in a salt marsh and shallow hay estuarine system in Louisiana. Dept. Mar. Sci., Louisiana St. Univ., Baton Rouge, La 70803: 1972. 1-170. DAY, J. W., W. G. SMITH, P. R. MAGNER W. C. STOWE Community structure and carbon budget of a salt marsh and shallow hay estuarine system in Louisiana. Publ. No. LSU-5672-01 Center of Wetland Resources Louisiana State University, Baton Rouge, La. 1973b. 79 p. DETWYLER, R. E. D. HOUDE Food selection by laboratory-reared larvae of the scaled sardine Harengula pensacolae (Pisces: Clupeidae) and the hay anchovy Anchoa mitchilli (Pisces: Engraulidae). Mar. Biol., 1970. 214-222. (3): 7 ERDMAN, D. S., Recent fish records from Puerto Rico. Bull. Mar. Sci. Gulf. Caribb., 1956. 315-340. (4): 6 ESPINOSA, M. E., La fauna sésil intermareal del manglar relacionada con algunos parámetros ambientales de la Laguna de Términos. Tesis Profesional Fac. Ciencias Univ. Nal. Autón. México. 1976. 48 p EVERMANN, B. W. M. C. MARSH, The fishes of Puerto Rico. U. S. Fish Comm. Bull. 1900. 49-350. 20: FUSS, C. M., J. A. KELLY K. W. PREST, Gulf thread herring: Aspects of the developing fishery and biological research. Proc. Gulf Caribb. Fish. Inst., 1968. 111-125. 21: GARCÍA, F. Modificaciones al Sistema de Clasificación Climática de Koppen (Para Adaptarlo a las Condiciones de la República Mexicana). Instituto de Geografía, Univ. Nal. Autón. México, 1973 246 p. GARCÌA-CUBAS, A. J., Sistemática y distribución de los micromoluscos de la Laguna de Términos, Bol. Inst. Geol. Univ. Nal. Autón. México Campeche, México. 1963. 1-55 67: GÒMEZ-AGUIRRE, S., Comportamiento estacional del plancton de la Laguna de Términos, Campeche, México Tesis Profesional Fac. Ciencias Univ. Nal. Autón. México. 1965a. 106 p. ------, Algunas consideraciones acerca del fitoplancton primaveral en la boca de Paso Real, Campeche. An. Inst. Biol. Univ. Nal. Autón. México, 1965b. 65-69. (1-2): 36 ----------, Reconocimientos estacionales de hidrología y plancton en la Laguna de Términos, Campeche, México. An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, 1974. 61-82. (1): 1 GOODE, G. B. T. H. BEAN, Catalogue of a collection of fishes obtained in the Gulf of Mexico by Dr. J. W. Velre with descriptions of seven new species. Proc. U. S. Nat. Mus., 1880. 333-345. 2: GREENWOOD, P. H., D. E. ROSEN, S. H. WEITZMANN G. S. MYERS, Phyletic studies of teleostean fishes, with a provisional classification of living forms Bull. Amer. Mus. Nat. Hist. 1966. 339-456. (4): 131 GREENWOOD, P. H., G. S. MYERS, D. E. ROSEN S. H. WEITZMANN, Named main divisions of teleostean fishes. Proc. Biol. Soc. Wash., 1967. 227-228 80: GUDGER, E. W., Science, Oral gestation in the graff-topsail catfish, Felichthys felis. 1912. 192. (892): 35: ---, Zoologica, The graff-topsail, Felichthy felis, a sea catfish that carries its eggs in its mouth. 1916. 123-158. (5): 2 ------, Felichthys felis. Oral gestation in the graff-topsail catfish, Carnegie Inst. Wash. Publ., 1918. 25-52. 252: --------, Pap. Tortugas Lab., On the morphology, coloration and behavior of seventy teleostean fishes of tortugas, Florida. Carnegie Inst. Wash. Publ., 1929. 149-204. 26: GUNTER, G., Seasonal variations in abundance of certain estuarine and marine fishes in Lousiana, with particular reference to life histories. Ecol. Monogr., 1938. 313-346. 8: ------, A list of the fishes of the manland of North and Middle America recorded from both freshwater and sea water. Amer. Midl. Nat., 1942. 305-326. (2): 28 ------, Studies on marina fishes of Texas. Publ. Inst. Mar. Sci. Univ. Texas, 1945. 1-94. (1) : 1 ---------, A revised list of eurihaline fishes of north and middle America. Amer. Midl. Nat., 1956. 345-354. (2): 56 GUNTER, G. H. H. HILDEBRAND Ecology, Destruction of fishes and other organisms on the south Texas cost by the cold wave of jan. 28-Feb. 3, 1951. 1951. 731-736. (4): 32 GUNTER, G. G. H. HALL, Biological investigations of the St. Lucie estuary (Florida) in conection with Lake Okeechobee discharges trough the St. Lucie. Canal. Gulf Res. Rep., 1963. 189-307. (5): 1 GUNTER, G. G. H. HALL, A biological investigation of the Caloosahatchee estuary of Florida. Gulf Res. Rep., 1965. 1-72. (1) : 2 HARRIS, A. H. C. D. ROSE, Galeichthys felis. Shrimps predation by the sea catfish Trans Amer. Fish. Soc., 1968. 503-504. (4) : 97 HASTINGS, R. W. The origin and seasonality of the fish fauna on a new Setty in the northeastern Gulf of Mexico. Ph. D. disertation, Florida St. University, 1972. 555 p. HEALD, E. J., W. S. ODUM D. C. TABB, Environment of South Florida: Present and Past. Mangroves in the estuarine food chain. In: Gleason, J. (Ed.) Miami Geol. Soc. Mem. 1974 182-189. 2: HERALD, E. S., Three new Pipe fishes from the Atlantic coast of north and south America, with a Key to the Atlantic American species. Stanford Ichth. Bull., 1942. 125-134. (4): 2 HERALD, E. S. R. S. STRICKLAND, An annoted list of fishes of Homosassa Springs, Florida. Quart. Journ. Fla. Aca. Sci., 1949. 99-109 (4) : 11 HESTER, J. W. B. J. COPELAND, Nekton population dynamics in the Albermarle Sound and Neuse River Estuaries. University of North Carolina. Sea Grant Program Publ. UNC-SG75-02, 1975. 129 p. HELLIER, T. R., Fish production and biomass studies in relation to photosynthesis in the Laguna Madre of Texas. Publs. Inst. Mar. Sci. Univ. Texas, 1962. 212-215. 8 HILDEBRAND, H. H., A study of the fauna of the Brown shrimu (Penaeus aztecus Ives grounds in the western Gulf of Mexico. Publ. Inst. Mar. Sci. Univ. Texas, 1954. 233-366. (2): 3 -------, A study of the fauna of the pink shrimp (Penaeus duorarum Burkenroad) grounds in the Gulf of Campeche. Publ. Inst. Mar. Sci. Univ. Texas, 1955. 169-232. (1): 4 -----, Ciencia (Mex.), Estudios biológicos preliminares sobre la Laguna Madre de Tamaulipas. 1958. 151-173. (7-9): 17 HILDEBRAND, S. F., A review of the American anchovies (Family Engraulidae). Bull. Binghman Oceanogr. Coll., 1943. 1-165. (2): 8 HILDEBRAND, S. F. W. C. SCHROEDER, The Fishes of Chesapeake Bay. Bull. U. S. Bur. Fish., 1928. 1-366. (1): 43 HILDEBRAND, S. F., L. E. CABLE, Development and life history of fourteen Teleostean fishes of Beaufort. Bull. U. S. Bur. Fish., 1930. 383-499. 46: HILDEBRAND, S. F., L. E. CABLE, Reproduction and development of whitings or kingfishes, drums, spot, croaker, and weak fishes or sea trouts. Family Scianidae, of the Atlantic coast of the United States. Bull. U. S. Bur. Fish., 1934. 41-117. 48: HILDEBRAND, S. F. L. E. CABLE, Futher notes on the development and life history of some teleosts at Beaufort. Bull. U. S. Bur. Fish. 1938. 505-642. (24): 48 HOESE, H. D., A partially annotated cheklist of the marine fishes of Texas. Publ. Inst. Mar. Sci. Univ. Texas, 1958. 312-352. 5: -----------, Spawning of marine fishes in the Port Aransas Texas arca a.s determined by distribution of young and larvae. Ph. D. Dissertation, University Texas, 1965. 144 p. HOESE, H. D., B. J. COPELAND, F. N. MOSELEY E. D. LANE, Fauna of the Aransas Pass Inlet, Texas. 111. Diel and seasonal variations in trawlable organisms of the adjacent arca Tex. J. Sci., 1968. 33-60 20: HUBBS, C. L., Fishes of the Yucatán península. Carnegie Inst. Wash. Publ., 1936. 157-287 175: JORDAN, D. S., List of fishes from Egmant key, Florida, in the Museum of Yale College, with description of two new species. Proc. Acad. Nat. Sci. Philad., 1885. 42-46. 12: JORDAN, D. S. B. W. EVERMANN, The fishes of North and Middle America. Bull. U. S. Nat. Mus. 1896-1900. 13-313. (47) : 1-4 JORDAN, E., M. ANGOT R. DE LA TORRE, Prospección biológica de la Laguna de Nichupté, Cancún, Quintana Roo: Nota Científica. An. Centro Cienc. del Mar y Limnol. Univ. Sutd., 1978. 179-188. (1): 5 JOSEPH, E. B. R. W. YERGER, The fishes of Alfigator Harbor Florida with notes on their natural history. Fla. St. Univ. Sutd., 1956. 111-156. 22: KIKUCHI, T., An ecological study on animal communities of the Zostera marine belt in Tomioka Bay, Amakusa, Kyshu. Publ. Amakusa Mar. Biol. Lab., 1966. 1-106. 1: KILBY, J. D., The fishes of two Gulf coastal marsh areas of Florida. Tul. Stud. Zool., 1955. 176-247. (8): 2 KJELSON, M. A., N. JOHNSON, R. L. GARNER J. D. WATSON Annual Report to the Atomic Energy Commission. Biomass and densities of the fish and macrovertebrates of the New Port Estuary, North Carolina. In: Rice, T. R., (Ed.) U. S. Dept. Commerce, National Marine Fisheries Service, Beaufort, N. C.,: 1973. 169-182. KLIMA, E. F., CICAR-II Symposium Progress in Marine Research in the Caribbean and Adjacent Regions Stud. An assessment of the fish stoks and fisheries of the Campeche Bank. UNESCO-FAO. WECAF 1976. 1-24. 5: KLIMA, E. F. D. C. TABB, A contribution to the biology of the spotted weakfish, Cynoscion nebulosus (Cuvier) from northwest, Florida, with a description of the fishery. Fla. St. Bd. Conserv. Mar. Lab. Tech. Ser., 1959. 1-25. 30: KNAPP, F. T., Menhaden utilization in relation to the conservation of the food and game fishes of Texas Gulf coast. Trans. Amer. Fish. Soc., 1949. 137-144. 79: KUNTZ, A., Notes on the embriology and larval development of five species of teleostean fishes Bull. U. S. Bur. Fish. 1916. 409-429. 34: LAGUARDA-TIGUERAS, A., Estudio sistemático y distribución de Sagitta friederici en la Laguna de Términos, Campeche, México. An Inst. Biol. Univ. Nal. Autón. México. Ser. Cienc. del Mar y Limnol., 1967. 47-57. (1): 38 LANKFORD, R. R., Estuarine Processes. Circulation, Sediments, and Transfer of Material in the Estuary. Coastal lagoons of Mexico: Their origin and classification. In: Cronin, L. E. (Ed.) Academic Press Inc. Nueva York, 1977 182-215. 2: LEE, G. , Galelchthys felis., Oral gestation in the marine Catfish, Copeia 1937. 44-56. 1: LINTON, E., Parasites of fishes of Beufort, North Carolina. Bull. U. S. Bur. Fish. (1904) 1905. 321-428. 24: LONGLEY, W. H. S. F. HILDEBRAND, New genera and specíes of fishes from Tortugas, Florida. Pap. Tortugas Lab., Carnegie Inst. Wash. Publ., 1940. 223-285. 32: LONGLEY, W. H. S. F. HILDEBRAND, Systematic catalogue of the fishes of tortugas, Florida with observations on color, habits, and local distribution. Pap. Tortugas Lab., Carnegie Inst. Wash. Publ., 1941. 1-331. 34: LONNENBERG, A. J. E., List of fishes observed and collected in south Florida. Ofvers. Kongl. Akad. Forh., 1894. 109-131. 3: LORIO, W. J. H. E. SCHAFER, A food habit study of the spotted seatrout, Cynoscion nebulosus, in the Biloxi marsh area, Louisíana. Proc. 19th Ann. Conf. Southeast. Ass. Game Fish Comm.: 1966. 289-296. LOWE, R. H., The fishes of the British Guiana continental shelf, Atlantic coast of south America, with notes on their natural history. Journ. Linn. Soc. London, Zool., 1962. 669-700. (301): 44 LOYO-REBOLLEDO, M. E., Notas acerca de la flora de diatomeas de la Laguna de Términos, Campeche, México. An. Inst. Biol. Univ. Nal. Autón. México, 1965. 61-64. (1-2): 36 MANSUETI, A. J. J. D. HARDY, Development of Fishes of the Chesapeake Bay Region. Natur. Resources Inst., Univ. Maryland, 1967. 199 p. MARRÒN-AGUILAR, M. A., Estudio cuantitativo y sistemático de los poliquetos (Annelida, Polychaeta) bentónicos de la Laguna de Términos, Campeche, México. Tesis Doctoral Fac. Ciencias Univ. Nal. Autón. México, 1975. 143 p. MARRÒN-AGUILAR, M. A. E. LÒPEZ-OCHOTERENA, Protozoarios ciliados de México. XVI. Sistemática de algunas Especies del orden y Tintinnida Kofoid y Campbell, de la Laguna de Términos, Campeche, México. Revta. Soc. Méx. Hist. Nat., 1969. 43-64. 30: MARSHALL ADAMS, S., The ecology of eelgrass, Zostera marina (L.), fish communities I. Structural analysis. J. exp. mar. Biol. Ecol., 1976. 269-291. 22: McLANE, W. M., The fishes of the St. Johns River system. Ph. D. Dissertation, University of Florida., L. 1955. 361 p. MEEK, E. S. S. F. HILDEBRAND, The marine fishes of Panama. Field Mus. Nat. Hist. Publ., Zool. Ser., 1923-1928. 1-1045. (215,226 y 249): 15 MENZEL, D. W., Utilization of food by a Bermuda reef fishes Epinephelus guttatus. Jour. Conseil Internatl. Eplor. Mer., 1960. 216-222. (2): 25 MILES D. W., A study of the food habits of the fishes of the Aransas Bay area Ann. Mimeografeado. Rept. Mar. Lab., Tex. Game, Fish., Oyst. Comm., 1949. 129-169. 1948-1949: MOE, M. A., G. T. MARTIN, Fishes taken, in monthly traw1 samples offshore of Pinellas Country, Florida, with new additions to the fish fauna of Tampa Bay area. Tul. stud. Zool., 1965. 129-151. (4): 12 MOODY, W. D., A study of the natural history of the spotted trout, Cinoscion nebulosus, in Cedar key, Florida area. Quart. J. Fla. Acad. Sci., 1950. 147-171. (3): 12 MORALES, G. A., Ecology, distribution and taxonomy of recent Ostracoda of the Laguna de Términos, Campeche, Mexico. Bol. Inst. Geol. Univ. Nal. Autón. México, 1966. 1-103. 81: MOSELEY, F. N., Biology of the red snapper, Lutjanus aya Bloch, of the northwestern Gulf of Mexico. Publ. Inst. Mar. Sci. Univ. Texas, 1966. 91-101. 11: MOSELEY, F. N. B. J. COPELAND, A. portable dropnet for representative sampling of nekton. Publ. Inst. Mar. Sci. Univ. Texas, 1969. 37-45. 14: NIKOLSKY, G. V., The Ecology of Fishes. Academic Press. Nueva York, 1963. 352 p. NIXON, S. W. C. A. OVIATT, Ecology, Preliminary measurement of midsummer metabolism in beds of eelgrass, Zostera marina. 1972. 150-153. 53: ODUM, W. E., Pathways of energy flow in a South Florida estuary. Sea Grant Program Each. Bull. Univ. Misma, 1971. 1-162. 7: ODUM, W. E. E. J. HEALD, Trophic analysis of an estuarine mangrove community Bull. Mar. Sci., 1972. 671-738. (3): 22 ODUM, W. E. E. J. HEALD, Estuarine Research. Chemistry, Biology, and the Estuarine System. The detritus-based food web of an estuarine mangrove community. In. Cronin, E. L. (Ed.), Academic Press Inc. Nueva York, 1975. 265-286. 1: ORTEGA, M. M., Contribution a I 'étude de la vegetation de la Laguna de Términos (Campeche, Mexique). Tesis doctoral Fac. Ciencias Univ. París, Francia, 1969. 60 P. PAGAN, F. A. H. M. AUSTIN, Report an a fish kill at Laguna Joyuda, western Puerto Rico in the summer, 1967. Caribb. Jour. Sci., 1967. 177-193. (3-4). 10 PEARSON, J. C., Natural history and conservation of the redfish and other commercial scianids on the Texas coast. Bull. U. S. Bur. Fish. 1929. 129-214. 44: PHLEGER, F. B. A. AYALA-CASTAÑARES, Processes and history of Terminos Lagoon, Mexico. Bull. Am. Ass. Petrol. Geol., 1971. 2130-2140. (2): 55 POWELL, D. L. DWINELL S. DWINELL, An annotated listing of the fish reference collection at the Florida Department of Natural Resources MarinE Research Laboratory. Fla. Dept. Nat. Res. Mar. Res. Lab., Spec. Sci. Rep., 1972. 1-179. 36: RANDALL, H. A., A study of the growth and other aspects of the biology of the west Indian. Topshell, Cittariumm pica (Linnaeus) Bull. Mar. Sci. Gulf Caribb. 1964. 424-443. (3): 14 RANDALL, J. E., An analysis of the fish populations of artificial and natural reefs in Virgin Island. Caribb. Jour. Sci., 1963. 31-47. (1): 3 ---------, Contributions to the biology of the Queen conch, Strombus gigas Bull. Mar. Sci. Gulf Caribb. 1964. 246-295. (2): 14 -------, Food habits of the nassau grouper (Epinephelus striatus). Assoc. Is. Mar. Labs. Caribb. Sixth Meeting: 1965. 13-16. --- Food habits of reef fishes of the West Indies. Stud. Trop. Oceanogr., Univ. Miami, 1967. 665-847. 5: RANDALL, J. E. D. K. CALDWELL, A review of the sparid fish genus Calamus with descriptions of four new species. Bull. Los Ang. Cty. Mus. Nat. Hist. Sci., 1968. 1-47. 2: RANDALL, J. E., R. E. SCHROEDER W. A. STARCH Notes on the biology of the echinoid Diadema antillarum. Caribb. Jour. Sci., 1964. 421-433. (2-3): 4 RATHBUN, R., Succesful bratching of sheepshead eggs on Fish Hawk. Rept. U. S. Fish. Comm., . 1892. 188-889: lix REID, G. K., An ecological study of the Gulf of Mexico fishes in the vicinity of Cedar Key, Florida. Bull. Mar. Sci. Gulf Caribb., 1954. 1-94. (1): 4 -----------------, A summer study of the biology and eco logy of East Bay Texas. Texas J. Sci., 1955a. 316-343 (3) : 7 ---------, A summer study of the biology and ecology of east Bay Texas. Part 11: The fish fauna, and summary. Texas J. Sci., 1955b. 429-453. (4): 7 REID, G. K., A. INGLIS H. D. HOESE, Summer foods of some fish species in East Bay, Texas. Southwest. Natur., 1956. 100-104. (3): 1 RESÈNDEZ, M. A., Contribución al conocimiento de los Syngnathidae (Pisces, Gas tereos tei formes) de Bahía Florida, Miami, Fla., EE.UU. Tesis Profesional Fac. Ciencias Univ. Nal. Autón. México, 1965. 30 p. ----------, Estudio de los peces de la Laguna de Tamiahua, Veracruz, México. An. Inst. Biol. Univ. Nal. Autón. México, Ser. Cienc. del Mar y Limnol., 1970. 79-146. (1): 41 -----------, Estudio de los peces de la Laguna de Alvarado, Veracruz, México. Revta. Soc. mex. Hist. Nat., 1973. 183-281. 34: ---------, Lista preliminar de peces colectados en las Lagunas de Nichupté y Bojórquez, Cancún, Quintana Roo, México. An. Inst. Biol. Univ. Nal. Autón. México. Ser. Zoología, 1975. 87-100. (1): 46 REES, F. W. R. NELSON, A study of artificial reefs of the Alabama coast. In: Annual Report of Marine Research Conducted by University of Alabama for the Seafoods Division. Alabama Department of Conservation 1966. 1-27. October 1965-September 1966: RICHARDS, S. W., The demersal fish population of Long Island Sound Bull. Bingham Oceanogr. Coll., 1963. 1-101. 18: RODRÌGUEZ, P. Z., Estudios estadísticos y biológicos sobre la biajaiba (Lutjanus synagris). Centro Invest. Pesqueras, La Habana, Notas Invest., 1962. 1-89. 4: ROESSLER, M., Observations on the seasonal ocurrence and life histories of fishes in Button Wood Canal, Everglades National Park, Florida. Ph. D. Dissertation University of Miami, 1967. 155 p. RUIZ, M. E., Estudio ecológico preliminar de las almejas comerciales del sistema lagunar de Términos, Campeche, Rangia cuneata (Gray, 1831). Tesis Profesional, Fac. Ciencias Univ. Nal. Autón. México, 1975. 80 p. RUNYAN, S., Early development of clingfish, Gobiesox strumosos Cope. Chesapeake. Sci., 1961. 113-141. (3) 2 RYDER, J. A., On the development of osseaus fishes, including marine and freshwater forms. Rept. U. S. Fish. Comm., 1887. 489-604. 1885: SAUER, J., Geographic. reconnaissance of seashore vegetation along the Mexican Gulf Coast. Loulsiana State. Univ. Press. Coastal Studies Series, 1967. 1-59. 21: SAUSKAN, V. I. A. OLACHEA, Ictiofauna bentónica del Banco de Campeche. Resum. Invest. Inst. Nac. Pesca Cent. Invest. Pesq., Cuba, 1974. 102-106. 1: SCHULTZ, L. P., A further contribution to the ichthyology of Venezuela. Proc. U. S. Nat. Mus., 1949. 1-209. 99: SHANNON, C. E. W. WEAVER, The Mathematical Theory of Communication. University of Illinois Press. Urbairia. 1963. 117 p. SHIPP, E. L. R. W. YERGER, Status, characters, and distribution of the northern and southern puffers of the genus Sphoeroides. Copeia, 1969. 425-433. 3: S. I. C., Catálogo de Peces Marinos Mexicanos. Secretaría de Industria y Comercio, Subsecretaría de Pesca, Instituto Nacional de Pesca, México, 1976. 462 p. SIGNORET, M., Abundancia, tamaño y distribución de camarones (Crustacea, Pencidae) de la Laguna de Términos, Campeche, México y su relación con algunos factores hidrológicos. An. Inst. Biol. Univ. Nal. Autón. México. Ser. Zoología, 1974. 119-140. (1): 45 SILVA-BÁRCENAS, A.; Sistemática y distribución de los géneros de diatorneas de la Laguna de Términos, Campeche, México. Bol. Inst. Geol. Univ. Nal. Autón. México, 1963. 1-131. (2): 67 SIMMONS, E. G., Ecological survey of the upper Laguna Madre of Texas. Publ. Inst. Mar. Sci. Univ. Texas, 1957. 156-200. (2): 4 SMITH, C. L., Synopsis of biological data on groupers (Epinephelus and allies genera) of the western north Atlantic. F. A. O. Fish. Biol. Synopsis, 1961. 1-61. 23: SMITH, F. G. W., Atlantic Reef Corals. University of Miami Press, Florida, 1971. 111 p. SMITH, G. B., Ecology and distribution of eastern Gulf of Mexico reef fishes. Dept. Nat. Res., Mar. Res. Lab., Publ., 1976. 1-78. 19: SMITH, H. M., North Carolina, Geology and Economics, Survey, The fishes of North Carolina Raleigh. 1907. 1-453. 2: SOLÌS-WOLFOWITZ, V., Contribución al conocimiento de las ascidias de la Laguna de Términos. Problema de Investigación. Mimeografeado Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México. 1973. 62 p. SPRINGER, S. H. R. BULLIS, Collections by the "Oregonin the Gulf of Mexico. U. S. Fish Wildl. Serv., Spec. Sci. Rept., 1956. 1-134. 196 SPRINGER, V. G. J. PIRSON, Fluctuations in the relative abundance of sport fishes as indicated by the catch at Port Aransas Texas, Publ. Inst. Mar. Sci. Univ. Texas, 1959. 169-185. 5: 1952-1956. SPRINGER, V. G. K. D. WOODBURN, An ecological study of the fishes of the Tampa Bay area. Fla. St. Bd. Conserv. Mar. Lab., Prof. Pap., 1960. 1-104. 1: S. R. H., Estudio de la calidad del agua en la Laguna de Términos, Campeche. Secretaría de Recursos Hidráulicos, Subsecretaría de Planeación, Dirección de Control de la Contaminación del Agua. Contrato ATECMAR, S. A., Núm. SP-75-C-I. 1976. STEWART, K. W., Contributions to the Biology of the spotted seatrout (Cynoscion nebulosus) in the civerglades National Park, Florida. M. S. Thesis University of Miami, 1961. 103 p. STOREY, M., Ecology, The relation between normal range and mortality of fishes due to cold at Sanibel Island, Florida. 1973. 10-26. (1): 18 STRAWN, K., Life history of the pigmy seahorse, Hippocampus zosterae Jordan y Gilbert, at Cedar Key, Florida. Copeia 1958. 16-22. (1): STRUHSAKER, P., Demersal fish resources: composition, distribution, and commercial potential of the continental shelf stocks off the south eastern United States. U. S. Fish Wildl. Serv. Fish. Ind. Res., 1969. 261-300. (7): 4 SUÁREZ-CAABRO, J. A . S. GÒMEZ-AGUIRRE, Observaciones sobre el plancton de la Laguna de Términos, Campeche, México. Bull. Mar. Sci., 1965. 1072-1120. (4): 15 SUBRAHMANYAM, C. B. S. H. DRAKE Studies on the animal communities in two north Florida salt marshes. Part. 1: Fish communities. Bull. Mar. Sci., 1975. 445-465. (4): 25 SWINGLE, W. E., S. L. SPENCER Th. M. SCOTT, Statistics on the sport fishery of the Mobile Delta during Proc. SE. Assoc. Game and Fish. Comm 1966. 439-446. 19: the period of July 1, 1963 to june 30, 1964. SWINGLE, H. A. Biology of Alabama stuarine areas: Cooperative Gulf of Mexico estuarine inventory. Alabama Mar. Res. Bull. 1971. 1-128. 5: TABB, D. C., A contribution to the biology of the spotted seatrout, Cynoscion nebulosus (Cuvier) of east central Florida. Fla. St. Bd. Conserv. Mar. Lab. Tech. Ser., 1961. 1-22. 35: TABB, D. C. R. B. MANNING, A check list of the flora and fauna of northern Florida Bay and adjacent brackish waters of the Florida mainland collected during period July 1957 through September 1960. Bull. Mar. Sci. 1961. 552-649. (4): 11 TABB, D. C., . D. L. DUBROW R. B. MANNING The ecology of northern Florida Bay and adjacent estuaries. Tech. Ser. Fla. St. Bd. Conserv., 1962. 1-79. 39: THAYER, G. W., S. MARSHALL ADAMS M. W. LA CROIX Estuarine Research. Chemistry, Biology and the Estuarine System. Structural and functional aspects of a recently stablished Zostera marina communities In: Cronin, L. E. (Ed.) Academic Press. Inc. Nueva York, 1975. 517-540. 1: THOM, B. G., Problems of the development of Isla del Carmen, Campeche, Mexico. Zutschr, Geomorphologie, N. F. Bd., 1969. 406-413. (4): 13 TORAL, S., Estudio de los Cichlidae (Pisces, Perciformes) de la Laguna de Términos y sus afluentes. Tesis profesional Fac. Ciencias Univ. Nal. Autón. México, 1971. 32 p. TORAL, S. A. RESÉNDEZ, Los cíclidos (Pisces, Perciformes) de la Laguna de Términos y sus afluentes. Rev. Biol. Trop., 1974. 254-274. (2): 21 TOWNSEND, C. H., Records of changes in color among fishes. New York Aquarium, Nat. Ser., N. Y. Zool. Soc.: 1929. 1-60. TURNER, W. R. G. N. JOHNSON, Distribution and relative abundance of fishes in Newport River, North Carolina. NOAA Tech. Rept. NMFS-666: 1973. 1-23. UNIVERSITY OF ALABAMA, Annual report of marine research conducted by University of Alabama for the Seafoods Division, Alabama Department of 1966. Typed File Rep.: 1966. 1-82. VIOSCA, P., La Conserv. The bait stealin'Sheepshead. 1954. 5-8. (7): 6 WALKER, T. H. W. R. NELSON, In: Preliminary Marine Ecological Study of Mobile Bay. Ocurrence of vertebrates in the 1963-64 estuarine survey Alabama Dep. Conserv., Seafoods Div. Typed. File. Rep.: 1964. 138-184. WANG, J. C. E. C. RANEY, Distributions and fluctuations in the fish fauna of the Charlotte Harbor estuary, Florida. Charlotte Harbor Estuarine Stud., Mote. Mar. Lab., Sarasota, Florida: 1971. 1-56. WELSH, W. W., C. M. BREDER, Contributions of the life histories of the Sciaenidae of the eastern United States coast. Bull. U. S. Bur. Fish., 1923. 141-201. 39: WHEATLAND, S. B., Oceanography of Long Island sound. VII. Pelagic fish eggs and larvae. Bull. Bingham Oceanogr. Coll., 1956. 234-314. 15: WILHM, J. L., Ecology, Use of biomass units in Shannon's formula. 1968. 153-156. (1): 49 YÁÑEZ-ARANCIBIA, A. Sobre los estudios de peces en las lagunas costeras: Nota científica. An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, 1975a. 53-60. (1) : 2 -----------, In: Informe Final 2a. Etapa Programa Uso de la Zona Costera de Michoacán y Guerrero Relaciones tróficas de la fauna ictiológica del sistema lagunar costero de Guerrero y aspectos parciales de dinámica de poblaciones de los peces de importancia comercial. 230 p., . Convenio Comisión del Río Balsas, S. R. H. y Centro de Ciencias del Mar y Limnología Univ. Nal. Autón. México. Contrato de Estudios N9 OC-E-03-74, 1975b. 750 p. ----------, Piscicultura en lagunas costeras: Perspectivas en México. Mem. I Reun. Lat. Cienc. Tecnol. Ocean. (México) 1976. 445-476. ----------------- Proceeding World Mariculture Society Eight Annual Meeting.in press) . Biological and ecological studies and perspectives of culture of sea catfish Galeicthys caerulescens (Gunther) in coastal lagoons on the Pacific coast of Mexico. In: Avault, J. W. (Ed.). San José Costa Rica, 1977a. jan. 9-13, 1977 ( ------- Taxonomía, ecología y estructura de las comunidades ictiofaunísticas en nueve lagunas costeras del Estado de Guerrero (Pacífico Central de México). Tesis doctoral, Ciencias del Mar, Univ. Nal. Autón. México, 1977b. 716 p. ---- Patrones ecológicos y variación cíclica de las estructura trófica de las comunidades nectónicas en lagunas costeras del Pacífico de México. An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, 1978a. 285-306. (1) : 5 YÁÑEZ-ARANCIBIA, A., Seminar on Present and Future Research in Coastal Lagoon. Ecology in the entrance of Puerto Real, Términos Lagoon, II. Discusison on trophic structure of fish communities in banks of Thalassia testidinum. Duke University Marine Laboratory, IABO, and UNESCO, Beaufort NC. 1978b. 1978 (in press) Aug. 28-Sept 2 YÁÑEZ-ARANCIBIA, A. R. S. NUGENT, El papel ecológico de los peces en estuarios y lagunas costeras. An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, 1977 107-114. (1): 4 YÁÑEZ -ARANCIBIA, A. F. AMEZCUA-LINARES, Ecología de la raza Urolophus jamaicensis (Cuvier) en Laguna de Términos, un sistema estuarino del Sur del Golfo de México. An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México,(en prensa). 1979. (2): 6 YÁÑEZ-ARANCIBIA, A., J. CURIEL-GÒMEZ V. LEYTON YÁÑEZ, An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, Prospección biológica y ecológica del bagre marino Galelchthys caerulescens (Gunther) en el sistema lagunar costero de Guerrero, México. Pisces: Ariidae). 1976. 125-180. (1): 3 YÁÑEZ-ARANCIBIA, A., F. AMEZCUA-LINARES, E. BRAVO-NÙÑEZ V. LEYTON YÁÑEZ, Programa de Estudios: Recursos Bióticos en Lagunas Costeras, Manglares y Áreas Adyacentes de América Latina" Centro de Ciencias del Mar y Limnología, Mimeografeado Informe preliminar sobre los estudios de ecología y comunidades de peces en la Laguna de Términos, Campeche, México. UNAM-OEA: 1977. 49 p. YÁÑEZ-CORREA, A., Batimetría, salinidad, temperatura y distribución de los sedimentos recientes en la Laguna de Términos, Campeche, México. Bol. Inst. Geol. Univ. Nal. Autón, México, 1963. 1-47. (1): 67 -----, Littoral processes and sediments of the inner continental shelf of the southern Bay of Campeche, M. S. Thesis, Texas A and M University, 1968. 80 p. ZARUR-MENEZ, A., Estudio biológico preliminar de la Laguna de Términos, Campeche, México. Tesis profesional Fac. Ciencias Univ. Nal. Autón. México 1961. 64 p -------, Algunas consideraciones geobiológicas de la Laguna de Términos, Campeche, México. Revta. Soc. Mex. Hist. Nat., 1962. 51-70. 23:
|

