|
PATRONES ECOLÓGICOS Y VARIACIÓN
CÍCLICA DE LA ESTRUCTURA TRÓFICA DE LAS COMUNIDADES
NECTÓNICAS EN LAGUNAS COSTERAS DEL PACÍFICO DE MÉXICO
Trabajo presentado en el Simposio "Marine Sciences in the Americas"
Interciencia Association, en Panel II "Ecology and Environmental Protection",
San José, Costa Rica, 2 al 7 de julio, 1977. Recibido el 4 de agosto de
1977 y aceptado para su publicación el 30 de agosto de 1977.
ALEJANDRO YÁÑEZ-ARANCIBIA
Universidad Nacional Autónoma de
México, Centro de Ciencias del Mar y Limnología, Laboratorio de
Ictiología y Ecología Estuarina. Contribución 82 del
Centro de Ciencias del Mar y Limnología, UNAM.
Las lagunas costeras del estado de Guerrero
(Pacífico central de México), presentan un ciclo de
fisiología ambiental con tres periodos ecológicos anuales:
Periodo 1 (salinidades de 15 a 34 ppm), de agosto a
noviembre, las lagunas se encuentran en contacto con el mar a través de
una boca en la barrera arenosa ocurriendo un intercambio biológico,
físico y químico. Periodo 2 (salinidades
mayores que 35 ppm), de noviembre a mayo, las lagunas se encuentran aisladas
del mar y la evaporación excede a los aportes de aguas dulces,
mínimo volumen de agua dentro de las lagunas. Periodo 3
(salinidades menores que 15 ppm), de mayo a agosto, las lagunas se
encuentran aisladas del mar y la evaporación es mucho menor que los
aportes de aguas dulces, máximo volumen de agua dentro de las
lagunas.
Por afinidad ecológica las lagunas pueden
reunirse en dos grupos. Grupo A donde el ciclo de
fisiología ambiental afecta a toda la laguna, profundidades medias de 1
m, temperaturas de 29 a 35°C, salinidades de 2 a 125 ppin, alta biomasa
fitoplanctónica, con un máximo de 43.106 cel./l, biomasa
zooplanctónica máxima de 105 indiv./m³ y 1.0 g/m³,
variables cantidades de detritus por frecuente exportación, pocos
manglares, variable biomasa macrobentónica, y estructura trófica
y comunidades nectónicas complejas en diversidad durante el
Periodo 1 simplificándose durante los periodos 2 y 3
(H' máxima de 2,1588), sólo un 15% de peces presentes durante
todo el año demuestra lo inestable del sistema ecológico.
Grupo B donde el ciclo afecta sólo una parte limitada
de las lagunas, profundidades medias de 2 m, temperaturas de 29 a 33°C,
salinidades de cero a 4 ppm, muy alta biomasa fitoplanctónica, con un
máximo de HP a 109 a 1010 cel./1, biomasa zooplanctónica
máxima de 10³ indiv./m³ y 3.0 g/m³, grandes cantidades de
detritus, numerosos manglares, ausencia de biomasa macrobentónica, y
estructura trófica y comunidades nectónicas de complejidad
relativa durante el periodo 1 en la zona de influencia
marina y simple en el resto de las lagunas durante ese periodo como
también en toda la superficie lagunar durante los periodos
2 y 3 (H' máxima de 1,9898); un 55% de peces presentes durante
todo el año demuestra lo estable del medio ambiente.
The coastal lagoons of the state of Guerrero (central
Pacific coast of Mexico), present an environmental physiology cycle with three
ecological annual periods: Period 1 (Salinities from 15 to
34 ppt), from August to November, the lagoons are in contact with the sea
through an open pass in the barrier bar permitting a biological, physical and
chemical exchange. Period 2 (salinities higher than 35 ppt),
from. November to May, the lagoons are isolated from the sea and evaporation
exceeds freshwater input, there is a minimum volume of water inside the
lagoons. Period 3 (salinities lower than 15 ppt), from May
to August, the lagoons are isolated from the sea and freshwater input exceeds
the rate of evaporation, there is a maximum volume of water inside the
lagoons.
Based on ecological affinities the lagoons can he
arranged in two groups. Group A where the cycle of
environmental physiology affects the entire lagoon: mean depth of 1 m,
temperatures from 29 to 35°C, salinities from. 2 to 125 ppt, high
phytoplanktonic biomass with a maximum of 43.106 cel./l, zooplanktonic biomass
with a maximum of 105 indiv./m³ and 1.0 g/m³, variable amount of
detritus, few mangroves, variable macrobenthic biomass, and complex nektonic
communities in diversity and trophic structure during period
1 becoming less complex during the periods 2 and 3
(H' maximum of 2,1588) ; only 15% of the fishes present during the entire year
shom the inestability of the ecological system.
Group B where the cycle affects
only a limited part of the lagoons: mean depth of 2 m, temperatures from 29 to
33°C, salinities from zero to 4 ppt, very high phytoplanktonic biomass with
a maximum of 109 to 1010 cel./I, zooplanktonic biomass with a maximum of
10³ indiv./m³ and 3.0 g/m³, large quantities of detritus,
numerous mangroves, macrobenthic biomass almost absent, trophic structure and
nektonic communities of relative complexity during period 1
in the zone of marine influence and simple in the rest of the lagoon during
this period as well as in the entire lagoon surface during periods
2 and 3 (H'maximum of 1,9898); a 55% of the filhes present during the
entire year indicate the stability of the environment.
Plantear una discusión ecológica detallada para la fauna ictiológica de las lagunas costeras de Guerrero hace necesario disponer de un buen conocimiento biológico, y abiótico del área, que permita integrar ecológicamente a las comunidades de peces dentro del sistema lagunar estuarino en cuestión. En ese aspecto existe mucha información de diversos trabajos, la mayoría de los cuales han sido parte de informes científicos elaborados por el Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México, para la Comisión del Río Balsas de la ex Secretaría de Recursos Hidráulicos, que representan una información valiosa para lograr los objetivos del estudio ictio-ecológico aquí propuesto. Es un hecho reconocido desde mucho tiempo y en diferentes países, que las lagunas costeras y/o estuarios representan en su mayoría un potencial de recursos pesqueros de considerable magnitud. Los peces de esos ecosistemas desarrollan uno de los papeles más importantes en el balance energético de esos sistemas biológicos y en la progresión natural del ambiente (YáñezArancibia y Nugent, 1977). Esto determina que la ictiología lagunar-estuarina sea uno de los aspectos más importantes y tal vez uno de los de mayor proyección dentro de los estudios ecológicos y biológico-pesqueros que pretendan evaluar y proponer una correcta administración de los recursos bióticos de un área que presenta características ambientales, en gran medida, predominantemente estuarinas. La complejidad ambiental de estos ecosistemas hacen de su ecología un tópico multidisciplinario que no es fácil de entender en términos ordinarios. Los ejemplos en los cuales se apoyan algunos de, los principios generales de interacciones entre la fauna, la flora y el medio ambiente, son a menudo difíciles de describir cuantitativamente y con frecuencia son sólo locales en su aplicación. De manera que el problema ictiológico en las lagunas costeras debe ser abordado a, un nivel de ecosistema como problema integral más que como aspecto parcial de investigación. Se sabe que México posee 1.5 millones de hectáreas de ambientes estuarinos, o bien 12,555 kilómetros cuadrados de superficie de lagunas costeras, real y/o potencialmente productivas, muchas de ellas en estados precarios de explotación, otras irracionalmente explotadas, pero todas en un estado latente de contaminación futura por los impactos del hombre en el ambiente natural. Estudios recientes han detallado que los 10 mil kilómetros de litoral mexicano se encuentran caracterizados por 125 lagunas costeras que representan 1/3 de la zona costera de México. Esto determina que las lagunas costeras y estuarios representen un patrimonio cultural y económico de lo más trascendente en el futuro del desarrollo socio-económico del sector pesquero en México. Considerando estos antecedentes y entendiéndose que la explotación y/o cultivos de organismos marinos, así como también que la comprensión de la dinámica de un ambiente natural implica un conocimiento biológico y ecológico acabado de las especies a explotarse, se propone este estudio ictio-ecológico como un esfuerzo que se indentifica con: 1) la necesidad de resolver problemas biológicos de los peces de ambientes lagunares, 2) los intereses del país de prospección y evaluación de recursos acuáticos renovables, y 3) las perspectivas particulares dc desarrollo socio-económico de la zona costera del estado de Guerrero. ÁREA DE ESTUDIODiversos estudios se han referido al área, describiéndola de diferentes puntos de vista. Geología, Geografía y Geomorfología: Lankford (1974 y 1977), Lankford et al. (1975), Warme y Sánchez (1975), Carranza-Edwards et al. (1975). Climatología: García (1973). Hidrografía: Arpi et al. (1974), Castellanos (1975) . Biología., Ecología e Hidrografía general: Ramírez-Granados (1952), Stuardo et al. (1974), Stuardo. y Martínez-Guerrero (1975), Stuardo y Villarroel (1976), Guznián (1975), Weinborn (1974), Villarroel (1975 y 1976), Estévez (1975), Luján (1975), Román (1976), Licea et al. (1975 y 1976), Martínez-Guerrero (1978); YáñezArancibia (1974, 1975a, 1975b, 1976a, 1976b, 1977 a y b), Yáfiez-Arancibia y Nugent (1976 y 1977), Yáñez-Arancibia y Díaz (1977), YáfiezArancibia et al. (1976). La mayoría de los trabajos mencionados discuten los rasgos generales de las diferentes lagunas y coinciden en definir el área como un sistema lagunar costero. Esto debido a numerosas características generales de la zona litoral, además de otras particulares para cada laguna. El origen geológico es común para todas ellas; el clima es el mismo a lo largo de la costa de Guerrero tropical subhúmedo con lluvias en verano y sequías en invierno, temperaturas con límites no mayores de 5° C, evaporación media anual entre 1,900 y 2,000 mm, precipitación media casi cero en la época de sequía y más de 300 mm mensuales durante la época de lluvias; se encuentran separadas del mar por una barrera arenosa de amplitud y altura variables; la macrofauna es muy escasa y poco abundante. En general, las lagunas presentan cuerpos de aguas someras de volúmenes variables, dependiendo de la "lluvia" y del "estío", con temperaturas elevadas que descienden en los meses de diciembre-enero-febrero, salinidades muy variables, fondos predominantemente fangosos, y características de topografía y superficies muy irregulares. En condiciones naturales las 9 lagunas consideradas (Fig. 1) presentan un ciclo regular anual de entrada periódica de agua de mar (excepto Mitla por influencia del hombre), que se define y se describe en este trabajo como un ciclo de fisiología ambiental. La zona costera del estado de Guerrero se extiende en una longitud de alrededor de 490 km. La mayor parte de la costa se caracteriza por el litoral lagunar pero también presenta algunas zonas rocosas y algunas llanuras de bajo relieve. Las epi e infaunas bentónicas se encuentran escasamente representadas en todas las lagunas, al igual que la vegetación sumergida, exceptuando manglares y otra vegetación semiacuática. Sin embargo, los peces y el fitoplancton son particularmente abundantes en algunas lagunas. En general, todas las lagunas presentan valores de oxígeno disuelto lejos de ser valores letales para las comunidades de peces; esto es, menos de 2 ml 02/1. La acción del viento, lo somero de las aguas, y la existencia de una biomasa considerable de productores primarios (i.e., matrofitas, microfitas y fitoplancton) aseguran una buena oxigenación de las aguas de las lagunas, el cual eventualmente puede descender durante la noche en la laguna de Mitla por fenómeno local de eutroficación. 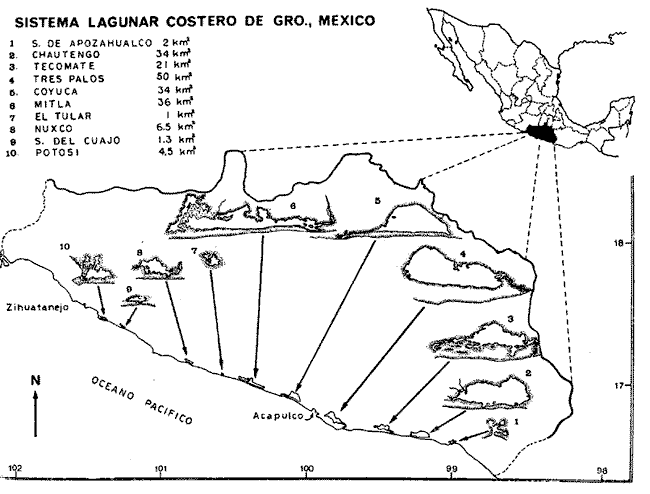 Fig. 1. Zona costera del estado de Guerrero, México. Se indica en detalle el sistema lagunar, su ubicación geográfica y la relación de superficies entre la lagunas. MATERIAL Y MÉTODOSLas capturas de los peces fueron realizadas empleando como artes de pesca: "chinchorro" (malla 1/4"), "atarraya" (malla 1/2" y 5 m de diámetro), "agallera" (100 m de longitud y malla 2"). Se efectuaron 12 colectas generales: 1a colecta del 10 al 18 de septiembre de 1973, 2a colecta del 20 al 25 de septiembre de 1973, 3a colecta del 23 al 26 de octubre de 1973, 4a colecta del 20 al 25 de noviembre de 19731 5a colecta del 10 al 14 de enero de 1974, 6a colecta del 5 al 10 de marzo de 1974, 7a colecta del 14 al 24 de mayo de 1974, 8a colecta del 15 al 23 de agosto de 1974, 9a colecta del 18 al 30 de octubre de 1974, 10a colecta del 7 al 13 de enero de 1975, 11a colecta del 17 al 26 de marzo de 1975, 12a colecta del 6 al 20 de julio de 1975. Se dispusieron numerosas estaciones de colectas para cada laguna y se efectuaron 10 lances de pesca en cada estación, cuantificándose la densidad y standing crop ictiofaunístico. Estos valores de abundancia son discutidos sobre la base de 19.5 m² que es la superficie de colecta del "atarraya" obteniendo promedios sobre la base de los 10 lances de pesca de cada estación de colecta. De las 12 colectas generales en el área de estudio se consideraron las más representativas para cada uno de los 3 periodos ecológicos que caracterizan al sistema lagunar costero de Guerrero. Eso determinó que fueran examinados 15 905 peces, detallados de la siguiente manera: Laguna Salinas de Apozahualco (1 013 ejemplares), Chautengo (4 325), Tecomate o San Marcos (1 353), Tres Palos (3 930), Coyuca (1 064), Mitla (1 240), Nuxco (1 447), Salinas del Cuajo (451), Potosí (1 055). De esta colección total fueron determinadas 105 especies. La diversidad ictiofauníatica fue considerada como el número o variabilidad de especies para cada laguna y su variación en relación al tiempo y a las características bióticas y abióticas predominantes. Además, fue discutido un índice de diversidad para cada colecta en cada laguna, de acuerdo a la fórmula de Shanon y Weaver (1963). Fue utilizado H' porque su cálculo depende tanto de la riqueza de especies como de la distribución equitativa de los individuos de todas las especies en cada muestra. Poole (1974) y Subralimanyam y Drake (1975) han discutido detalladamente este aspecto. El índice de Margalef (1969) a menudo refleja los cambios en el número de especies en relación al tamaño de la muestra sin asignar el mismo valor a dos colectas que tienen diferente número de especies (Dalilberg y Odum, 1970; Harima y Mundy, 1974). El examen de los estómagos de los peces se hizo de acuerdo a todos los métodos discutidos por Yáñez-Arancibia et al. (1976). Cada laguna fue caracterizada en relación a la ictiofauna típica que presenta y su variación en el tiempo, y reunidas en dos grupos en relación a afinidad ecológica determinado por: 1) efectos del ciclo de fisiología ambiental, 2) profundidades medias, 3) rangos de salinidades, 4) rangos de temperaturas, 5) biomasa fitoplanctónica, 6) biomasa zooplanctónica, 7) cantidad de detritus en sedimentación, 8) cantidad de manglares presentes, 9) biomasa macrobentónica, y 10) complejidad de la estructura trófica de las comunidades nectónicas. Los valores cuantitativos sobre el fitoplacton se encuentran en los trabajos de Licea et al. (197,95 y 1976) y los del zooplancton en el trabajo de Martínez-Guerrero (1978). RESULTADOS Y DISCUSIÓN
DINÁMICA AMBIENTAL DE LAS LAGUNASEste sistema lagunar presenta una dinámica ambiental con 3 situaciones ecológicas marcadas que determinan cambios en la estructura ictiofaunística de las lagunas y que puede ser definido como un ciclo de fisiología ambiental (Yáñez-Arancibia, 1976a, 1977b). 1. El periodo de barra abierta al mar. Se considera un periodo normal donde se manifiesta la mayor influencia marina en el ecosistema y mezclas de aguas dulces o salobres y marinas con un gran intercambio biológico, físico y químico. El nivel medio de las lagunas oscila con las mareas pero en un rango limitado. Las salinidades máximas son de 34 ppm oscilando desde, más o menos, 15 ppm. Las temperaturas oscilan entre 29 y 31° C. La precipitación es alta al igual que el escurrimiento y la evaporación. (Agosto, septiembre, octubre, noviembre). 2. El periodo de secas. Es un periodo que seva haciendo hipersalino. No hay contacto con el mar y por lo tanto se carece de intercambio biológico, físico y químico. Hay un marcado descenso del volumen de agua interno y grandes presiones ambientales, principalmente por aumento de la salinidad y la temperatura. Las salinidades máximas registradas han sido de 125 ppm oscilando desde, más o menos, 35 ppm. Las temperaturas oscilan entre 28 y 40° C. No existe precipitación como tampoco escurrimiento, pero la evaporación es muy alta. (Noviembre, diciembre, enero, febrero, marzo, abril, mayo). 3. El periodo de lluvias. Es un periodo hiposalino. No hay contacto con el mar y por lo tanto se carece de intercambio biológico, físico y químico. Hay un marcado aumento de volumen de agua interno y un nuevo estres por la disminución brusca de la salinidad. Existe intercambio biológico con alguna fauna dulceacuícola continental. Con la subida del nivel del agua se forma una cabeza hidrostática y en un efecto combinado con la erosión de la barrera arenosa desde el mar, se fuerza la abertura de la misma para reiniciar el ciclo. Las salinidades van de cero hasta 14 ppm. Las temperaturas oscilan entre 29° y 35° C. La precipitación es muy alta al igual que el escurrimiento y la evaporación. (Mayo, junio, julio, agosto). Este ciclo de fisiología ambiental, es válido para las lagunas Salinas de Apozahualco, Chautengo, Tecomate, Nuxco, Salinas del Cuajo y Potosí. Las lagunas de Tres Palos, Coyuca y Mitla son grandes cuerpos de aguas casi dulce, con salinidades que no exceden las 4 ppm, que no manifiestan cambios marcados durante el aflo; Mitla por permanecer cerrada artificialmente al mar durante 9 o 10 años, y Coyuca y Tres Palos por efectos físicos del canal meándrico que las separa del mar. Los factores que intervienen en este ciclo son: 1) la precipitación, 2) el escurrimiento, 3) la evaporación, 4) la filtración a través de la barrera arenosa, y 5) las mareas (Yáñez-Arancibia, 1977b). FAUNA Y FLORA TÍPICASLa vegetación de las lagunas se compone de los siguientes elementos: 1) palmar, 2) lignetum peremnifolio de manglar, 3) semiacuática, y 4) acuática. Los principales productores primarios son los manglares y el fitoplancton. Los grupos zooplanctónicos más comunes han sido: Copepoda, Chaetognata, larvas de Gasteropoda, larvas de Bivalvia, larvas de Cirripedia, larvas de Polychaeta, larvas de Decapoda, y algunos huevos y larvas de peces. La macrofauna bentónica incluye: Porifera, Cnidaria, Annelida, Mollusca (Bivalvia y Gasteropoda) en fondos blandos y duros, Arthropoda (Scalpellidae, Balanidae, Penaeidae, Paleomonidae, Callianasidae, Diogenidae, Coenobitidae, Portunidae, Xanthidae, Pinnotheridae, Grapsidae, Gecarcinidae, Ocypodidae, Isopoda y Tanaidacea) distribuídos sobre: 1) facie de playa, 2) facie de manglar, 3) facie bentónico pelágico, y 4) facie bentónica de fondos arenosos y fangosos. En general el bentos -se encuentra pobremente representado y no caracteriza a las lagunas en particular. COMPOSICIÓN DE LAS COMUNIDADES ICTIOFAUNÍSTICASLa dinámica ecológica del ambiente se refleja en la composición cualitativa y cuantitativa de las comunidades ictiofaunísticas las que pueden estar formadas por todos o solamente algunos de los siguientes grupos: 1) peces dulceacuícolas que ocasionalmente penetran en las aguas salubres, 2) peces anadromos y catadromos, en tránsito a través del estuario, 3) peces verdaderamente estuarinos, los cuales permanecen toda su vida en el estuario, pudiendo penetrar ocasionalmente al mar o al agua dulce, 4) peces marinos que utilizan el estuario como áreas naturales de crianza, o para desovar pero pasan la mayor parte de su vida en el mar, regresando al estuario estacionalmente, 5) peces marinos que efectúan visitas al estuario, generalmente como adultos y para alimentarse, 6). visitantes marinos ocasionales que irregularmente penetran al estuario por diferentes razones (marejadas, tormentas, etcétera). Las comunidades varían en su composicion y abundancia relativa de especies de acuerdo a: 1) las condiciones hidrológicas del sistema, consecuencia de 2) la estación del año, 3) la localidad dentro del estuario y sus gradientes de safinidad, y eventualmente puede existir un 4) factor, la disponibilidad del alimento. Yáñez-Arancibia (1977b) discute en detalle la diversidad de los seis componentes ictiofaunísticos considerados. Los porcentajes encontrados, esto es, 14% de peces dulceacuícolas, 6% de peces propiamente estuarinos, 28% de peces marinos que utilizan el estuario como áreas de crianza o para desovar, 31% de peces marinos que utilizan el estuario como adultos y para alimentarse, y 21% de visitantes marinos ocasionales, son cifras relativas. No obstante, dan un panorama general de la composición de las comunidades las cuales, sin embargo, están estructuradas con diferente composición de acuerdo a las diferentes lagunas. El estoc de peces dulceacuícolas (por su limitada tolerancia a variaciones de salinidades) proporcionan un buen patrón de comparación ecológica entre las diferentes lagunas y es conveniente considerar dos grupos principales de peces, i.e. dulceacuícolas y marinos, para apreciar las variaciones mayores en la estructura de las comunidades. Las especies de cada uno de esos componentes son las siguientes: PECES DULCEACUÍCOLAS: Astyanax fasciatus, Poecilia sphenops, Poeciliopsis lucida, Poeciliopsis porosus, Poeciliopsis balsas, Poecilistes pleurospilus, Thyrinops crystallina, Cichlasoma trimaculatum, Tilapia mossambica, Eleotris pictus, Gobiomorus maculatus, Dormitator latifrons, Microgobius miraflorensis, Awaous nelsoni, Chonophorus sp, Sicydium sp. PECES PROPIAMENTE ESTUARINOS: Lile stolifera, Galeichthys caerulescens, Galeichthys gilberti, Arius liropus, Gobionellus microdon, Gobionellus sagittula. PECES MARINOS QUE UTILIZAN EL ESTUARIO COMO ÁREAS DE CRIANZA: Albula vulpes, Chanos chanos, Centropomus nigrescens, Centropomus robalito, Caranx hippos, Caranx marginatus Caranx laftís, Caranx caballus, Oligoplites mundus, Oligoplites saurus, Oligoplites altus, Diapterus peruvianus, Gerres cinereus, Eugerres lineatus, Eugerres axillaris, Eucinostomus currani, Eucinostomus entomelas, Eucinostomus dowil, Mugil cephalus, Mugil curema, Polydactilus aproximans, Cyc1opsetta querna, Citarichthys gilberti, Etropus crossotus, Achirus mazatlanus, Achirus panamensis, Achirus klunsingeri, Trinectes fonsecensis, Sphoeroides lobatus, Sphoeroides annulatus. PECES MARINOS QUE UTILIZAN EL ESTUARIO COMO ADULTOS Y PARA ALIMENTARSE: Elops affinis, Albula vulpes, Dixonina nemoptera, Ophistonema libertate, Opisthopterus dowii, Pliosteostoma lutipinnis, Anchovia macrolepidota, Anchoa panamensis, Anchoa mundeoloides, Anchoa curta Anchoa, scofieldi, Hyporhamphus unifasciatus, Hyporhamphus patris, Strongylura stolzmanni, Tylosurus fodiator, Centropomus pectinatus, Selene brevoorti, Trachinotus rhodopus, Lutjanus noveinfasciatus, Lutjanus argentiventris, Lutianus guttatus, Pomadasys leuciscus, Pomadasys macracanthus., Pomadasys branickii, Umbrina xanti, Micropogon altipinis, Micropogon ectenes, Cynoscion stolzmanni, Cynoscion xanthulus, Menticirrhus elongatus, Menticirrhus nasus, Scomberomorus maculatus, Diodon hystrix. PECES MARINOS VISITANTES OCASIONALES: Heterodontus francisci, Ginglymostoma cirratum, Pristis zephyreus, Urotrygon nebulosus, Urotrygon asterias, Urotrygon aspidurus, Urotrygon goodei, Urotrygon chilensis, Urotrygon sp A, Myrophis vafer, Prionotus ruscarius, Diplectrum pacificum, Caranx medusicola, Oligoplites refulgens, Trachinotus rhodopus, Pomadasys branickii, Menticirrhus elongatus, Menticirrhus nasus, Kyphosus elegans, Abudefduf saxatilis, Sp,hyraena ensis, Bathygobius soporator, Microdesmus dipus. CATEGORÍAS ICTIOTRÓFICASYáñez-Arancibia (1977b) ha propuesto tres categorías ictiotróficas para las lagunas costeras, discutiendo los trabajos de Hiatt (1947), Gneri y Angelescu (1951), Yokota (1956), Reid et al. (1956), Darnell (1958 y 1961), Springer y Woodburn (1960), Gunter (1956), Hedgpeth (1957), Thompson (1957), Yasuda (1960), Teal (1962), Mc Hugh (1967), J. H. Day (1967), Olivier et al. (1968 y 1972), Qasim (1970), Odum (1971), Odum y Heald (1972 y 1975), Carr y Adams (1973),J.W.Dayetal. (1973ay 1973b),ZaretyPaine (1973),Hodgkin (1973), Lenanton (1973), Mc Erlean et al. (1973), Heald et al. (1974), De Sylva (1975), Snedaker y Brook (1976). 1) Consumidores Primarios, categoría en la que se incluyen, a) Planctófagos (fito y/o zoo), b) Detritívoros (y otros restos vegetales), y c) Omnívoros (detritus, vegetales y fauna de pequeño, tamaño). 2) Consumidores Secundarios, categoría en la que se incluyen los peces predominantemente carnívoros, aun cuando pueden incluir en su dieta algunos vegetales y detritus pero sin mucha significación cuantitativa. 3) Consumidores de Tercer Orden, categoría en la que se incluyen peces exclusivamente carnívoros, donde los vegetales y el detritus son un alimento accidental. La ictiofauna general de las lagunas costeras de Guerrero puede quedar agrupada de la siguiente manera en relación a las tres categorías o niveles ictiotróficos definidos en el punto anterior. 1) Consumidores primariosa) Planctófagos: Lile stolifera, Ophistonema libertate, Opisthopterus dovii, pliosteostoma lutipinnis, Anchovia macrolepidota, Anchoa panamensis, Anchoa mundeoloides, Anchoa curta, Anchoa scofieldi, Hyporhamphus unifasciatus, Thyrinops crystallina. b) Detritívoros: Mugil cephalus Mugil curema, Eleotris pictus, Gobiomorus maculatus, Dormitator latifrons, Bathygobius soporator, Microgobius miraflorensis, Gobionellus microdon., Gobionellus sagittula, Awaous nelsoni, Microdesmus dipus. c) Omnívoros: Chanos chanos, Asyanax fasciatus, Poecilia sphenops, Peociliopsis lucida, Poeciliopsis porosus, Peociliopsis balsas, Poecilistes pleurospilus, Kyphosus elegans, Gerres cinereus, Eugerres lineatus Eugerres axillaris, Eucinostomus currani, Eucinostomus entomelas, Eucinostomus dowii, Cich1asoma trimaculatum, Tilapia mossambica, 2) Consumidores secundariosAlbula vulpes, Myrophis vafer, Galeichthys caerulescens, Galeichthys gilberti, Diapterus peruvianus, Elops affinis, Pomadasys sp, Pomadasys leuciscus, Pomadasys macracanthus, Pomadasys branickii, Caranx hippos, Caranx marginatus, Caranx medusicola, Caranx latus, Caranx caballus, Selene brevoorti, Oligoplites mundus, Oligoplites saurus, OligoPlites altus, Oligoplites refulgens, Umbrina xanti, Menticirrhus elongatus, Menticirrhus nasus, Abudefduf saxatilis, Polydactilus ap, proximans, Achirus mazatlanus, Achirus panamensis, Achirus klunsingeri, Trinectes fonsecensis, Sphoeroides lobatus, Sphoeroides annulatus, Diodon hystrix, 3) Consumidores de tercer ordenHeterodontus francisci, Ginglymostoma cirratum, Pristis zephyreus, Urotrygon nebulosus, Urotrygon astertas, Urotrygon aspidurus, Urotrygon goodei, Urotrygon chilensis, Urotrygon sp A, Arius liropus, Strongylura stolzmanni, Ty1osurus fodiator, Prionotus ruscarius, Centropomus nigrescens, Centropomus robalito, Centropomus pectinatus, Diplectrum pacificum, Trachinotus rodophus, Lutjanus novemfasciatus, Lutianus argentiventris, Lutianus guttatus, Micropogon altipinnis, Micropogon ectenes, Cynoscion stolzmanni, Cynoscion xanthulus, Cynoscion reticulatus, Sphyraena ensis, Cyclopsetta querna, Citarichthys gilberti, Etropus crossotus. Esta categorización determina que en el sistema lagunar costero de Guerrero, el 38% de la ictiofauna son consumidores primarios (11% planctófagos, 11 % de detritívoros y 16% de omnívoros), cifras que pueden variar cuando algunos peces señalados como detritívoros, circunstancialmente pueden comportarse como omnívoros. Los consumidores secundarios alcanzan un 32% y un 30% los consumidores de tercer orden. Estas última cifras también pueden varias ligeramente cuando circunstancialmente algunos consumidores secundarios pueden comportarse como consumidores de tercer orden, todo ello determinado, por algunos factores discutidos más adelante. Por otra parte el porcentaje individual de consumidores varía en cada laguna dependiendo de sus características ecológicas. En las lagunas más dulceacuícolas (i.e., Tres Palos, Coyuca y Mitla) prácticamente desaparecen los consumidores de tercer orden y son cuantitativamente importantes los consumidores primarios. En realidad, los consumidores de tercer orden se encuentran mejor representados en aquellas lagunas que reciben marcada influencia marina durante el periodo 1. AFINIDAD ECOLÓGICA Y GRUPOS DE LAGUNASEl análisis detallado de las diagnosis ecológicas (Tabla 1) permite apreciar que varias lagunas responden a un esquema general (i. e., Salinas de Apozahualco, Chautengo, Tecomate, Nuxco, Salinas del Cuajo y Potosí), por una parte, y (i.e., Tres Palos, Coyuca y Mitla) por otra. El ciclo de fisiología ambiental de los tres periodos ecológicos por el cual pasan anualmente las lagunas, tiene mayor o menor influencia en cada una de las áreas y es lo que básicamente determina un patrón de comportamiento general de las lagunas. La afinidad ecológica entre ellas respondería al siguiente esquema: Lagunas del Grupo A (Laguna tipo: Chautengo)Pertenecen Salinas de Apozahualco, Chautengo, Tecomate, Nuxco, Salinas del Cuajo y Potosí. En este grupo el ciclo afecta a toda la laguna (Fig. 2). Profundidades medias anuales: 1 m. Temperaturas de 29 a 35° C. Salinidades de 2 a 125 %o. Alta biomasa fitoplanctónica con un máximo de 43-106 cel./l. Biomasa zooplantónica máxima de 105 indiv./m³ y 1.0 g/m³. Variable cantidad de detritus puesto que en el periodo 1 hay una manifiesta exportación hacia el mar. Pocos manglares y de distribución irregular. Variable biomasa macrobentónica. Estructura trófica y comunidades nectónicas complejas en diversidad durante el periodo 1, simplificándose durante los periodos 2 y 3 (H' máxima de 2,1588) (Fig. 3 y 5). El bajo porcentaje de peces que se encuentran presentes todo el año es el reflejo de la inestabilidad del ambiente (i.e., 15%) En la figura 5 se utiliza la simbología surgida por H. T. Odum y Copeland (1974). Lagunas del Grupo B (Laguna tipo: Tres Palos)Pertenecen Tres Palos, Coyuca y Mitla. En este grupo el ciclo afecta sólo el área del canal (Fig. 2). Profundidades medias anuales: 2 m. Temperaturas de 29 a 33° C. Salinidades de 0 a 4 %o. Biomasa fitoplanctónica muy alta. con un máximo de 109 a 1010 cel. /l. Biomasa zooplanctónica máxima de 10³ indiv. /m³ y 3.0 g/m³. Gran cantidad de detritus acumulado en sedimentación por su limitada exportación hacia el mar; esto porque el ciclo es de efecto restringido además de la barrera que representa el canal meándrico que las comunica con el mar; Mitla no posee canal pero se encuentra cerrada y el efecto ecológico es similar. Gran superficie de manglares presentes en la periferia de las lagunas y de distribución continua. Muy baja biomasa macrobentónica (casi ausente). Estructura trófica y comunidades nectónicas relativamente complejas en diversidad durante el Periodo 1 en la zona del canal, simplificándose mucho durante este mismo periodo en el resto de la laguna, y a través de toda la laguna durante los periodos 2 y 3 (H' máxima de 1,9898) (Figs. 4 y 6). El alto porcentaje de peces que se encuentran presentes todo el año es el reflejo de la estabilidad del ambiente (i.e., 55%). En la figura 6 se utiliza la simbología sugerida por H. T. Odum y Copeland (1974). 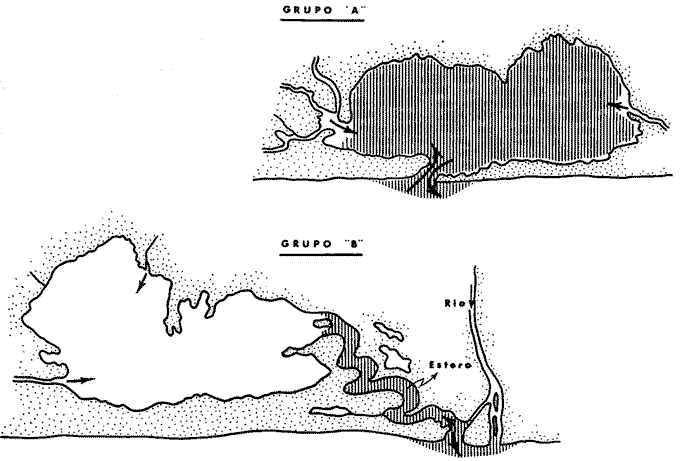 Fig. 2. Esquema geomorfológico de las lagunas de los Grupos A y B en el sistema lagunar costero de Guerrero, señalándose el área de influencia marina durante el periodo 1 de su dinámica ecológica. En la tabla 1 se presentan los valores globales de peces dulceacuícolas, peces marinos, diversidad, densidad y biomasa, y su variación estacional, en las lagunas ecológicamente similares. 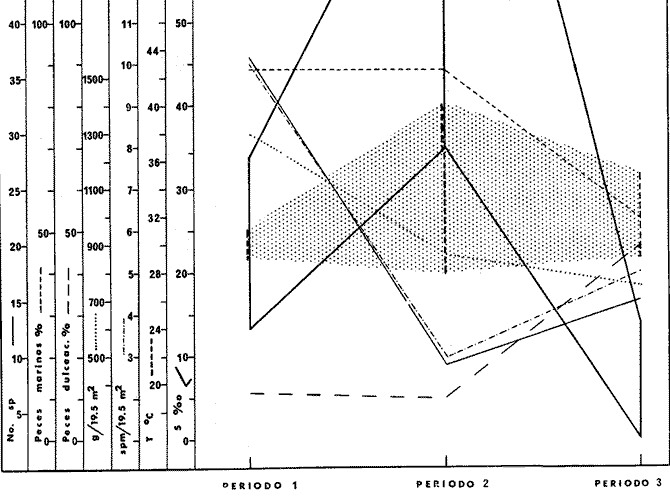 Fig. 3. Relaciones entre la diversidad, densidad, standing crop, peces marinos, peces dulceauícolas, temperatura y salinidad, en los tres periodos ecológicos de las lagunas del Grupo A. Los valores son promedios para las seis lagunas de este grupo y están tomados de la Tabla 1. En estas lagunas el 15% de su ictiofauna total se encuentra presente todo el año siendo un reflejo de la inestabilidad del sistema ecológico. 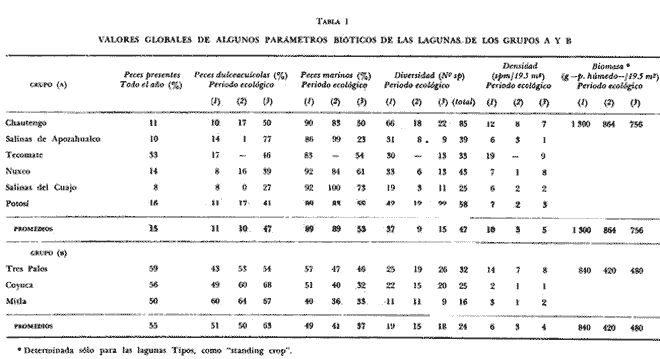 TABLA 1 VALORES GLOBALES DE ALGUNOS PARÁMETROS BIÁTICOS DE LAS LAGUNAS DE LOS GRUPOS A Y B 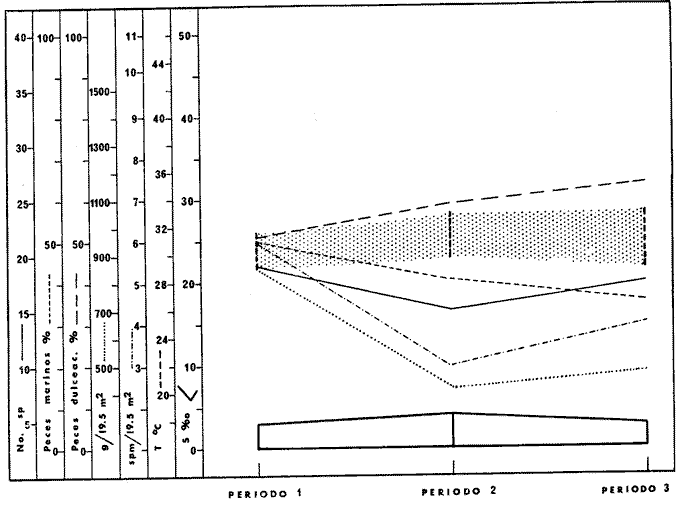 Fig. 4. Relaciones entre la diversidad, densidad, standing crop, peces marinos, peces dulceacuícolas, temperatura y salinidad, en los tres periodos ecológicos de las lagunas del Grupo B. Los valores son promedios para las tres lagunas de este grupo y están tomados de la Tabla 1. En estas lagunas el 55% de su ictiofauna total se encuentra presente todo el año, siendo un reflejo de la estabilidad del sistema ecológico. ESTRUCTURA TRÓFICA DE LOS GRUPOS "A" Y "B" Y MODELOS DE SUS ECOSISTEMASLos aspectos trofodinámicos de la ecología no han sido abordados en los estudios de comunidades lagunares y/o estuarinas en México (excepto algunos de los trabajos del autor de este estudio), aún considerando que estos conceptos fueron destacados en un trabajo pionero de Lindeman (1942). Las tramas tróficas que caracterizan a los dos grupos de lagunas son similares en el número de niveles tróficos, pero difieren en diversidad de especies de cada uno de esos niveles y en las relaciones tróficas de esos niveles (Figs. 5 y 6). GRUPO ALa estructura trófica de estas lagunas está compuesta por cuatro niveles tróficos (Fig. 5). En el 1er nivel se ubican los productores primarios: microfitobentos, pastos pantanosos, manglares y fitoplancton. Se incluye además al detritus por su origen y resultado. En el 2do. nivel se ubican todos los consumidores primarios en complejas relaciones tróficas. Desde la microfauna asociada al proceso de formación de detritus: bacterias, hongos y nemátodos; además de macro y meio bentos incluyendo gastrópodos, bivalvos, jaibas y camarones (Mytella strigata, Callinectes toxotes, C. arcuatus, Penaeus sty1irostris, P. vannamei, P. californiensis) , además, zooplancton, insectos y los peces consumidores primarios. 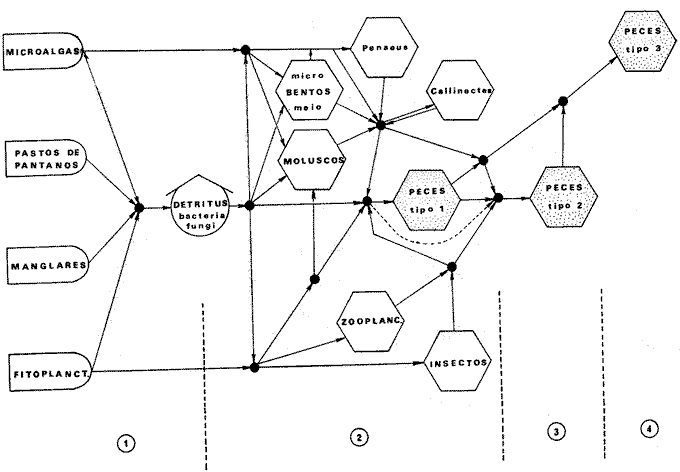 Fig. 5. Trama trófica (food web) en las lagunas del Grupo A, que reciben marcada influencia marina durante el periodo 1 del ciclo de fisiología ambiental del sistema lagunar costero de Guerrero. Las variaciones cualitativas y cuantitativas de los 4 niveles tróficos en el tiempo, son discutidas en el texto. Las flechas señalan las principales vías del flujo energético a través de las relaciones tróficas comunes. En el 3er. nivel se ubican los peces consumidores secundarios, y en el 4to. nivel los peces consumidores de tercer orden y/o los carnívoros superiores. Esta trama trófica (Fig. 5) se presenta durante el periodo 1 de todas las lagunas del Grupo A. Sin embargo, se manifiestan variaciones cuali y cuantitativas en los otros periodos. Durante el periodo 2 en el 1er nivel disminuye la biomasa del microfitobentos y del fitoplancton. En el 2do. nivel desaparecen los camarones y los insectos de la trama trófica y si se encuentran son en realidad excepcionales; el zooplancton, los macromoluscos, las jaibas y los peces consumidores primarios disminuyen en un 50% la diversidad, la densidad y la biomasa. En el 3er. nivel los peces consumidores secundarios disminuyen en un 750% la diversidad y la densidad, un 50%, la biomasa. En el 4to. nivel desaparecen completamente los peces consumidores de tercer orden, quedando solamente como carnívoros superiores algunas aves acuáticas. Durante el periodo 3 en el ler. nivel se recupera la biomasa de microfitobentos y de fitoplancton por la proliferación de especies dulceacuícolas. La cantidad de detritus aumenta significativamente a un máximo de materia orgánica descompuesta acumulada en sedimentación; posteriormente gran parte de ella será exportada hacia el mar. En el 2do. nivel se recupera en un 100%, la diversidad y biomasa de insectos; también se recupera en un 100% la biomasa de peces consumidores primarios pero sólo aumenta en un 25%, la diversidad por presencia de especies dulceacuícolas; y se mantiene y/o disminuye ligeramente la diversidad, densidad y biomasa de macromoluscos y jaibas; los camarones no se pueden recuperar puesto que no hay contacto con el mar; aumenta en un 100%, la biomasa y densidad del zooplancton pero la diversidad aumenta sólo en un 25% por presencia de especies dulceacuícolas. En el 3er. nivel se recupera en un 100% la biomasa de peces consumidores secundarios, pero la densidad y diversidad sólo se recupera en un 25% por la presencia de especies dulceacuícolas. En el 4to. nivel no existen peces consumidores de tercer orden cuantitativamente importantes porque la mayoría de ellos son marinos y los carnívoros superiores sólo están representados por aves. 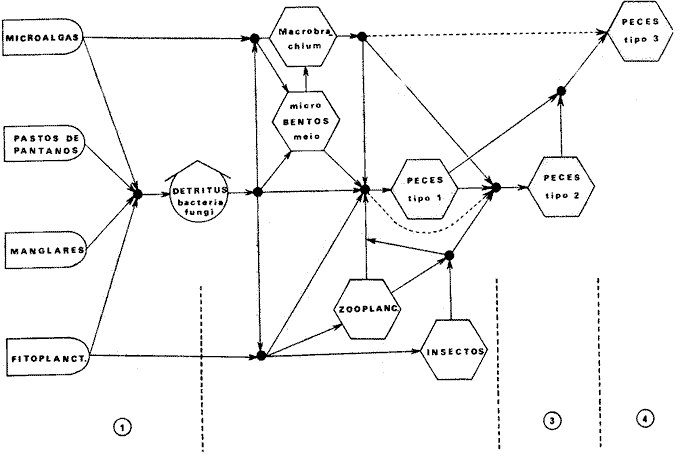 Fig. 6. Trama trófica (food web) en las lagunas del Grupo B, oligohalinas, que reciben poca influencia marina durante el periodo 1 del ciclo de fisiología ambiental del sistema lagunar costero de Guerrero. Las variaciones cualitativas y cuantitativas de los 4 niveles trofócos en el tiempo, son discutidas en el texto. Las flechas señalan las principales vías del flujo energético través de las relaciones tróficas comunes. Componentes IctiotróficosLos componentes ictiotróficos varían en el tiempo según el periodo ecológico de las lagunas. La máxima diversidad se alcanza durante el periodo 1 y en ese momento el modelo tiene su máxima complejidad. Consumidores PrimariosLos planctófagos se encuentran representados por Anchovia, Anchoa, Hyporhamphus, Ophistonema, Opisthopterus y Pliosteostoma en las zonas más salobres, y por Lile y Thyrinops en las áreas más dulceacuícolas. Eventualmente Ophistonema, Opisthopterus, Pliostoestoma y Lile pueden comportarse como carnívoros primarios puesto que la disponibilidad del alimento los hace ser a veces exclusivamente zooplanctófagos. En otros momentos todas las especies mencionadas se alimentan tanto de fito como de zooplancton. La más abundante de estas especies es Anchovia macrolepidota tanto en número como en biomasa y son particularmente importantes ya que miden hasta 130 mm de longitud patrón y formando compactos cardúmenes que se desplazan constantemente dentro de lo reducido de su ambiente ecológico, alimentándose de fitoplancton, algas filamentosas, zooplancton y en menor proporción detritus. Las Anchovia y Anchoa en general presentan un ciclo vital rápido y una fecundidad elevada, y por su gran adaptabilidad a las lagunas son muy importantes en las cadenas tróficas puesto que sirven de alimento a otros peces, a algunas aves costeras y aún al hombre. Los detritívoros se encuentran representados por Mugil y Gobionelus durante todo el año y por Eleotris, Gobiomorus, Dormitator, Microgobius durante la época del periodo 3. En el ambiente pelágico lagunar es muy importante Mugil curema por sus grandes cardúrnenes de juveniles durante el periodo 1 y cardúrnenes de ejemplares mayores durante el resto del año; así como también es importante Gobionellus microdon en el ambiente bentónico de fondos fangosos. En comparación con los planctófagos, los detritívoros son menos abundantes en términos de diversidad pero sus poblaciones son muy densas en número de individuos, a pesar de sufrir uno de los mayores índices de predación por los niveles tróficos superiores. En el balance energético del ecosistema los detritívoros forman uno de los grupos ictiotróficos de mayor importancia ecológica por su papel de convertir energía potencial del detritus en energía utilizable por los niveles tróficos superiores además de aportar con una gran biomasa. Además algunos de ellos revisten importancia comercial para el hombre como Mugil curema (Yáñez-Arancibia, 1976a) y Dormitator latifrons (Yáñez-Arancibia y Díaz, 1977). Los omnívoros se encuentran representados por Chanos, Kyphosus, Gerres, Eugerres, Eucinostomus y Diapterus en las zonas más salobres, y por Astyanax, Cichlasoma y algunos Poecílidos en las áreas más dulceacuícolas. En este grupo las especies claves son las mojarras que se distribuyen indistintamente por todos los ambientes de las lagunas, predominando en diversidad, densidad y biomasa. Las relaciones interespecíficas dentro de estos peces son complejas y en su dieta carnívora predan sobre detritívoros y sobre otros omnívoros. Gerres, Diapterus y Eugerres son muy importantes por servir de alimento a otros peces de niveles tróficos superiores, además de aves acuáticas y al hombre. Los peces consumidbres secundarios se encuentran representados fundamentalmente por Albula, Galeichthys, Diapterus (que con frecuencia cambia a este nivel). Elops, Pomadasys, Caranx, Oligoplites, Menticirrhus, Achirus, Trinectes, Sphoeroides y Diodon. En las cercanías de las bocas y asociados a sustrato arenoso se encuentran Achirus y Trinectes. En las zonas más salobres dominan Elops affinis, Caranx spp y Oligoplites spp distribuidos por toda la laguna. Todas estas especies tienen gran importancia comercial, pero exceptuando a Galeichthys, las restantes son visitantes cíclicos del estuario que invaden las lagunas durante el periodo 1. Su aporte en biomasa disminuye considerablemente en periodos posteriores. Las relaciones interespecíficas en este grupo son complejas puesto que además de predar sobre niveles tróficos inferiores existe predación entre ellos. Los peces consumidores de tercer orden no siempre son fáciles de determinar por cuanto muchos peces consumidores secundarios pueden cambiar a este nivel de acuerdo a la disponibilidad del alimento y aún estacionalmente. Las especies más importantes han sido Arius y Galeichthys (que en algunas épocas son exclusivamente carnívoros), Strongylura, Centropomus, Trachinotus, Lutianus, Micropogon, Cynoscion, Cyclopsetta, Citarichthys y Etropus con mayor frecuencia; y esporádicamente Tylosurus, Prionotus, Deplectrum y Sphyraena. En las áreas de mayor salinidad y con sustrato predominantemente fangoso se encuentran más abundantes los Centropomus, Lutianus Cynoscion y Micropogon, pero cerca de las bocas donde predomina el sustrato arenoso se encuentran mejor representados los lenguados. Los bagres, robalos, pargos y curvinas revisten gran importancia comercial en las lagunas y son especies muy importantes en el balance energético de las lagunas especialmente durante el periodo 1 donde son predados por aves acuáticas y por el hombre. Los tiburones y rayas (i.e., Ginglymostoma, Heterodontus, Carcharhinus y Urotrygon) no son abundantes, pero cuando excepcionalmente penetran a las lagunas se incorporan en este nivel trófico. GRUPO BLa estructura trófica de estas lagunas está compuesta por cuatro niveles tróficos (Fig. 6) de relaciones más simples que la trama trófica del Grupo A. En el ler. nivel se ubican los productores primarios: microfitobentos, pastos pantanosos, manglares (los más abundantes), y fitoplancton (muy abundante en biomasa). Se incluye además al detritus (muy abundante) por su origen y resultado. En el 2do. nivel se ubican todos los consumidores primarios que por la baja diversidad tienen relaciones tróficas simples. Se incluye la microfauna asociada a los procesos de formación del detritus: bacterias, hongos y otros: macro y meio fauna considerando gastrópodos, bivalvos y el langostino Macrobrachium tenellum; además zooplancton, insectos y los peces consumidores primarios. En el 3er. nivel se ubican los peces consumidores secundarios y en el 4to. nivel los peces consumidores de tercer orden y/o los carnívoros superiores. Esta trama trófica (Fig. 6) se presenta durante el periodo 1 de todas las lagunas del Grupo B, pero con Macrobrachium disminuido en términos de densidad y biomasa. Sin embargo se manifiestan variaciones cualitativas y cuantitativas en los otros periodos. Durante los periodos 2 y 3 en el 2do nivel se recupera la densidad y biomasa de Macrobrachium en la trama trófica. En el 3er. nivel disminuye en un 50% la diversidad, densidad y biomasa de los peces consumidores secundarios. En el 4to. nivel desaparece en un 100% la diversidad, densidad y biomasa de los peces consumidores de tercer orden. Los carnívoros superiores sólo se encuentran representados por aves acuáticas. Lo significativo de esta trama trófica es que los productores primarios permanecen con igual significación cuantitativa durante todo el año. Por otra parte, los camarones y las jaibas no juegan un papel trascendente en el balance energético del ecosistema; su ocurrencia es fugaz y poco significativa, presentándose solamente en la zona de la boca de las lagunas y durante el periodo 1. Asimismo Macrobrachium tenellum es una especie interesante en esta trama trófica; durante el periodo 1 es poco abundante y se distribuye en las áreas más dulceacuícolas de estas lagunas por lo que es poco frecuente que sea predada por peces consumidores de tercer orden que generalmente son marinos; durante el periodo 2 y 3 esta especie aumenta considerablemente pero ya no puede sufrir presiones de predación por parte de los peces consumidores de tercer orden ya que han desaparecido del ecosistema por estres de salinidad. También es interesante apreciar en esta trama trófica, y a diferencia de la trama trófica el Grupo A, que los 3 primeros niveles permanecen prácticamente inalterables durante todo el año, siendo otro aspecto que refuerza la validez de la estabilidad de esos ecosistemas. Componentes IctiotráficosLos componentes ictiotróficos varían en el tiempo pero sólo en la zona del canal de este grupo de lagunas. La mayor parte de los peces se mantiene presentes todo el año, con baja diversidad y en un ambiente estable. Consumidores Primarios Los planctófagos se encuentran representados por las especies de Lile y Thyrinops muy abundantes en toda la laguna. En la zona del canal se encuentran Anchovia y Anchoa. Los detritívoros forman un grupo de peces consumidores primarios extraordinariamente abundantes predominando Mugil, Eleotris, Gobiomorus, Dormitator, Microgobius, Gobionellus, Awaous. Los más importantes cuantitativamente han sido Mugil curema (Yáñez-Arancibia, 1976a) y Dormitator latifrons (Yáñez-Arancibia y Díaz, 1977). Todas estas especies se encuentran todo el año y en abundantes poblaciones que aprovechan las grandes cantidades de detritus que existe acumulado en estas lagunas. La mayoría de ellas no tienen importancia comercial pero su importancia ecológica es significativa y ya se ha discutido anteriormente. Los omnívoros se encuentran representados por Gerres, Eugerres, Eucinostomus, Diapterus y Chanos que son poco abundantes, y particularmente por Asyanax, Poecilia, Poeciliopsis y Cichlasoma que son extraordinariamente abundantes y forman grandes cardúnienes de pequeños ejemplares, aprovechando la gran disponibilidad de alimento de detritus, algas filamentosas, larvas y adultos de insectos copépodos dulceacuícolas, etcétera. Las mojarras tienen importancia comercial sólo estacionalmente y Cichlasoma prácticamente todo el año. Los peces consumidores secundarios se encuentran representados por algunos lenguados como Achirus y Trinectes en la zona arenosa del canal adyacente a la boca y especialmente durante el periodo 1. El resto de la laguna, además de la zona del canal, presenta ejemplares de Elops, Caranx, Galeichthys, Oligoplites y Diapterus. De los cuales Diapterus peruvianus y en especial Galeichthys caerulescens son los únicos verdaderamente trascendentes en estas lagunas, por su gran adaptación a ellas, su distribución y su abundancia (Yáñez-Arancibia et al., 1976). Las relaciones interespecíficas en este nivel son simples y la única especie que preda dentro de este mismo nivel es Galeichthys caerulescens. Los consumidores de tercer orden desaparecen de estas lagunas durante la mayor parte del año. Durante el periodo 1 pueden encontrarse algunos Centropomus, Lutianus, Strongylura y algunos Sciaénidos y Bótidos, pero en los otros periodos ecológicos de las lagunas desaparecen. No son abundantes ni aún en el periodo 1. En ese momento Galeichthys caerulescens puede trasladarse a este nivel trófico. AgradecimientosEste estudio fue financiado por Contrato de Estudios N° OC-E-03-73 y N° OC-E-03-74 celebrados entre la Comisión del Río Balsas de la ex Secretaría de Recursos Hidráulicos y el Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. Se agradece especialmente la discusión de los resultados preliminares de este estudio por parte de Richard S. Nugent de NUS Corporation Ecological Science Division, Pittsburgh, y de John W. Day de Louisiana State University. Un reconocimiento muy especial a los comentarios realizados por W. H. L. Allsopp (International Development Research Center, Canada), E. L. Goldberg (Scripps Institution of Oceanography, California), Manuel M. Murillo (Universidad de Costa Rica), y Th. R. Tosteson (University of Puerto Rico, Mayaguez), durante la presentación de este trabajo en "Symposium Marine Sciences in the Americas", july 2 - 7, 1977, San José Costa Rica. LITERATURAARPI, B., L. I. GONZÁLEZ-VILLASEÑOR, A. VÁZQUEZ-BOTELLO, A. ORTEGA Y V. MARTÍNEZ, In: Informe Final Ira. Etapa Programa Uso de la Zona Costera de Michoacán y Guerrero. Convenio Comisión del Río Balsas, S. R. H., y Centro de Ciencias del Mar y Limnología Univ. Nal. Autón. México. Contrato de Estudios No. OCE - 03 - 73, Informe sobre la pre-investigación hidrográfica en las lagunas costeras del estado de Guerrero. 1974 43, 15 tabl, 48 maps. CARR, W. E. S. y C. A. ADAMS, Food habits of juvenile marine fishes occupying seagrass beds in the estuarine zone near Crystal River, Florida. Trans. Amer. Fish. Soc., 1973 511-540 102 CARRANZA-EDWARDS, A., M. GUTIÉRREZ-ESTRADA y R. RODRÍGUEZ-TORRES, An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, Unidades morfo-tectánicas continentales de las costas mexicanas. 1975 81-88 2 1 CASTELLANOS, L., In: Informe Final 2da. Etapa Programa Uso de la Zona Costera de Michoacán y Guerrero. Convenio Comisión del Río Balsas, S. R. H., y Centro de Ciencias del Mar V Limnología Univ. Nal. Autón. México. Contrato de Estudios No. OC-E-03-74, Subprograma de hidrología. 1975 44, 66 tab. , 46 figs. DE SYLVA, D. P., Estuarine Research. Nektonic food web in estuaries. Academic Press New York. 1975 420-447 1 DAHLBERG, M. D. y E. P. ODUM, Amer. Midl. Natur., Annual cycle of species ocurrence and diversity in Georgia estuarine fish populations. 1970 382-392 83 DARNELL, R. M., Publ. Inst. Mar. Sci. Univ. Texas Food habits of fishes and larger invertebrates of Lake Pontchartrain, Louisiana, an estuarine commnunit 1958 353-416 5 DARNELL, R. M., Ecology, Trophic spectrum of an estuarine community based on studies of Lake Pontchartrain, La. 1961 553-568 42 3 DAY, J. H., Estuaries. Am. Ass. Adv. Sci. Publ. The biology of Knysna estuary, South Africa. In: Lauff, G. H. 1967 397-407 83 DAY, J. W., W. G. SMITH Y C. S. HOMINSON Proceeding of the Coastal Marsh and Estuary Managernent Symposium. Some trophic relationships of marsh and estuarine areas. In: Chabreck, R. H. Louisiana State University, Baton Rouge, La. 1973 115-135 July 1972 DAY, J. W., W. G. SMITH, P. WAGNER Y W. STOWE Publ. No. LSU-56-72-04 Center for Wetland Resources Community structure and carbon budget of a salt marsh and shallow bay estuarine system. in Louisiana. Louisiana State University, Baton Rouge, La. 1973b 79 ESTÉVEZ, J., Tesis profesional Aspectos generales de la biología y ecología del mejillón Mytella strigata (Hanley, 1843) en dos lagunas costeras del estado de Guerrero. Fac. Ciencias Univ. Nal. Autón. México. 1975 63, 11 tabl. 11 figs. 3 maps. 10 láms. GARCÍA, E., Modificaciones al Sistema de Clasificación Climática de Köppen (para adaptarlo a las condiciones de la República de México). Inst. Geogr. Univ. Nal. Autón. México. 1973 246 GNERI, F. S. y V. ANGELESCU Rev. Inst. Nac. Invest. Cienc. Nat. Museo Arg. Cienc. Zool., . La nutrición de los peces iliófagos en relación con el metabolismo general del ambiente acuático. 1951 1-44 2 1 GUNTER, G. . A revised list of euryhalin fishes of north and middle America. Amer. Midl. Natur., 1956 345-354 56 2 GUZMÁN-ARROYO, M., In: Informe Final 3ra. Etapa Programa Uso de la Zona Costera de Michoacán y Guerrero. Convenio Comisión del Río Balsas, S. R. H. y Centro de Ciencias del Mar y Limnología Univ. Nal. Autón. México. Contrato de Estudios No. OC-E-03-75. Biología, ecología y pesca del langostino de laguna Macrobrachium tenellum (Smith, 1871) (Decapoda: Palaemonídae) en la laguna de Mitla, Gro., México. 1975 HARIMA, H. y P. R. MUNDY, Diversity indices applied to the fish biofacies of a small strem. Trans. Amer. Fish. Soc., 1974 457-461 103 HEALD, E. J., W. E. ODUM y D. C. TABB., Environment of South Florida: Past and Present. Mangroves in the estuarine food chain. In: Gleason, P. J. (Ed.) Miami Geol. Soc. Mem., 1974 182-189 2 HEDGPETH, J. W., Treatise on Marine Ecology and Paleoecology. Estuaries and Lagoons. II. Biological Aspects. Geol. Soc. America, Mem. 1957 673-750 67 1 HIATT, R. W., Food-chains and food cycle in the Hawaiian fisli ponds. Part II. Biotic Interaction Trans. Amer. Fish. Soc., 1944 1947 262-280 74 HODGKIN, E. P., In: Symposium on the Impact of Human Activities on Coastal Zones. Biological aspects of coastal zone development in Western Australia. I. General Aspects. University of Sidney Australia UNESCO Committee for Man and Biosphere. Publ. 1 93-111, 6 figs. LANKFORD, R. R., In: Informe 1ra. Etapa Programa Uso de la Zona Costera de Michoacán y Guerrero. Convenio Comisión del Río Balsas, S. R. H., y Centro de Ciencias del Mar y Limnología Univ. Nal. Autón. México. Cantrato de Estudios No. OC - E - 03 - 73, 1974 42 LANKFORD, R. R. Estuarine Processes. Coastal lagoons of Mexico. Their origin and classification. In: Wiley, M. (Ed.) Estuarine Research Federation Conference Galveston, Texas, 1977 182-215 2 Oct. 6-9, 1975. LANKFORD, R. R., M. GUTIÉMMZ-ESTRADA y A. CAMANZA-EDWMWS, In: Informe Final 2da. Etapa Programa Uso de la Zona Costera de Michoacán y Guerrero. Convenio Comisión del Río Balsas, S. R. H., y Centro de Ciencias del Mar y Limnología Univ. Nal. Autón. México. Contrato de Estudios No. OC-E-03-741- Subprograma de geología. 1975 63 LENANTON, R. C. J., In: Symposium on the Impact of Human Activities on Coastal Zone Biological aspects of coastal development in Western Australia. II. Fish, crusta ceans and birds. University of Sidney Australia UNESCO Committee for Man and Biosphere. Publ. 1 112-126, 6 figs 1973 LICEA-DURÁN, S., M. E. GÓMEZ y E. GÓMEZ, In: Informe Final 2da. Etapa Programa Uso de la Zona Costera de Michoacán y Guerrero. Convenio Comisión del Río Balsas, S. R. H., y Centro de Ciencias del Mar y Limnología Univ. Nal Autón. México. Contrato de Estudios No. OC-E-03-74, Informe de avanve del estudio del fitoplancton en 5 lagunas del estado de Guerrero, México (Resultados preliminares), noviembre 1974. 1975 LICEA-DURÁN, S., M. E. GÓMEZ y E. GÓMEZ, In: Informe Final 3ra. Etapa Programa Uso de la Zona Costera de Michoacán y Guerrero. Convenio Comisión del Río Balsas, S. R. H., y Centro de Ciencias del Mar y Limnología Univ. Nal. Autón. México. Contrato de Estudios No. OC-E-03-75, Informe final del estudio del fitoplancton en 5 lagunas costeras del estado de Guerrero (1974-1975). 1976 750 LINDEMAN, R. L., Ecology, The trophic-dynamic aspect of ecology. 1942 399-418 23 4 LUJÁN, J. L., Tesis profesional . Estudio bromatológico de una población de Ruppia marítima L. de la laguna de Nuxco, Gro., México, con generalidades sobre su ecología e importancia alimenticia. Fac. Ciencias Químicas Univ. Nal- Autón. México. 1975 38, 3 maps. 11 tabls. 9 figs. MAGALEF, R. Perspectives in Ecological Theory. The University of Chicago Press. Chicago, 1969 111 MARTÍNEZ-GUERRERO, A., An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, Distribución y variación estacional del zooplancton en cinco lagunas costeras del estado de Guerrero, México. 1978 201-214 5 1 Mc ERLEAN, A. J., S. G. O'CONNOR, J. A. MIHURSKY y C. I. GIBSON, Abundance, diversity and seasonal patterns of estuarine fish population. Estuar, Coast, mar. Sci., 1973 19-36 1 1 Mc HUGH, J. L., Estuarines. Am. Ass. Adv. Sci. Estuarine nekton. In: Lauff, G. H. (Ed.) Publ. 1967 581-619 83 ODUM, H. T. y B. J. COPELAND, Coastal Ecological Systems of the United States. A functional classification of the coastal ecological systems. In: Odum, H. T., B. J. Copeland y E. A. Mc Mahan (Eds.) The Conservation Foundation Washington, D. C., National Oceanic and Administration 1974 5-84 1 ODUM, W. E., Sea Grand Program Tech Bull. Univ. Miami, Pathways of energy flow in a south Florida estuary. 1971 1-162 7 ODUM, W. E. y E. J. HEALD, Bull Mar. Sci., Trophic analyses of an estuarine mangrove community. 1972 671-738 22 2 ODUM, W. E. y E. J. HEALD, Estuarine Research. The detritus-based food web of an estuarine mangrove community. In: Cronin. L. E. (Ed.) Academic Press New York 1975 265-286 1 OLIVER, S. R., R. BASTIDA Y M. R. TORTI Ser. Hidrogr. Naval, Argentina, H. Sobre el ecosistema de las aguas litorales de Mar del Plata. Niveles tróficos y cadenas alimentarias pelágico-demersales y bentónico-demersales. 1968 45 1025 OLIVER, S. R., A. ESCOFET, P. HAMADEH Y J. M. ORENSANZ, An. Soc. Cient. Argentina, Estudio ecológico de la región estuarial de Mar Chiquita (Buenos Aires, Argentina). II. Relaciones tróficas interespecíficas. 1972 89-104 194 POOLE, R. W., An Introduction to Quantitative Ecology. Mc. Graw Hill, New York, 1974 532 QASIM, S. Z., Marine Food Chains. Some problems related to the food chain in a tropical estuary. In: Steele, J. H. (Ed.) Oliver and Bovd, Edinburgo, 1970 46-51 RAMÍREZ-GRANADOS, R., Revta. Soc. mex. Hist. Nat., Estudio ecológico preliminar de las lagunas costeras cercanas a Acapulco. 1952 199-218 13 REID, G. K., A. INGLIS y H. D. HOESE, Texas Southwestern, Nat., Summer Foods of some fish species East Bay, 1956 100-104 1 3 ROMÁN, R., Tesis profesional Contribución al conocimiento de la biología del langostino Macrobrachium tenellum (Smith, 1871) en algunas lagunas costeras de Guerrero, México. Fac. Ciencias Univ. Nal. Autón. México. 1975 71, 15 figs. 9 tabl. 5 láms. SHANNON, C. E. y W. WEAVER, The Mathematical Theory of Communictition. University of Illinois Press, Urbana. 1963 SNEDAKER, S. C. y I. M. BROOK, Biscayne Bay: Past / Present / Future. Ecology arid the food web of Biscayne Bay. In: Thorhang, A. y A. Volker (Eds.) Symposium University of Miami, 1976 227-233 Apr. 2-3, 1976 SPRINGER, V. G. y K. D. WOODBURN, Prof. Pap. Ser. Mar. Lab. Fla., An ecological studies of the fishes of the Tampa Bay Area. 1960 1-104 1 STUARDO, J. y A. MARTÍNEZ-GUERRERO, Acta Politécnica Mexicana, Resultados generales de una prospección de los recursos biológicos y pesqueros del sistema lagunar costero de Guerrero, México. 1975 99-115 16 72 STUARDO, J. y M. VILLARROEL, An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, Aspectos ecológicos y distribución de los moluscos en las lagunas Costeras de Guerrero, México. 1976 70-90 3 1 STUARDO, J., A. MARTÍNEZ-GUERRERO, A. YÁREZ-ARANCIBIA, J. A. WEINBORN y J. RUIZ, Informe Final 1a. Etapa Programa Uso de la Zona Costera de Michoacán y Guerrero. Convenio Comisión del Río Balsas, S. R. H., y Centro de Ciencias del Mar y Limnología Univ. Nal. Autón. México. Contrato de Estudios N9 OC-E-03-73, . Prospección de los recursos biológicos y pesqueros del sistema lagunar costero de Guerrero y, en parte, del litoral rocoso de Michoacán, México. 1974 500 SUBRAHMANYAM, C. B. y S. H. DRAKE, Bull. Mar. Sci., Studies on the animal communities in two north Florida salt marshes. Part 1. Fish communities. 1975 445-465 25 4 TEAL, J. M., Ecology Energy flow in the salt marsh ecosystem of Georgia. 1962 614-624 43 4 THOMPSON, J. M., Bull. West. Aust. Fish. Dept., The food of Western Australian estuarine fishes. 1957 1-13 7 VILLARROEL, M., In: Informe Final 2° Etapa Programa Uso de la Zona Costera de Michoacán y Guerrero. Convenio Comisión del Río Balsas, S. R. H., y Centro de Ciencias del Mar y Limnología Univ. Nal. Autón. México. Contrato de Estudios N9 OC-E-03-74, Relaciones entre macroinvertebrados bentónicos (molusco&) y sedimentos en 3 lagunas del estado de Guerrero, México. I. 1975 750 VILLARROEL, M., In: Informe Final 3q Etapa Programa Uso de la Zona Costera de Michoacán y Guerrero. Convenio Comisión del Río Balsas, S. R. H., y Centro de Ciencias del Mar y Limnología Univ. Nal. Autón. México. Contrato de Estudios N9 OC-E-03-75, Relaciones entre macroinvertebrados bentónicos (especialmente moluscos) y sedimentos en las lagunas costeras Salinas de Apozahualco, Chautengo y Nuxco, Gro., México. II. Relaciones entre sedimentos de áreas centrales de manglar y la distribución de los macroinvertebrados bentónicos. 1976 750 WARME, J. E. y L. A. SÁNCHEZ, Estuarine Research Federation Conference Sedimentary patterns in west coast lagoons. Galveston, Texas, 1975 Oct. 6-9, 1975. WEINBORN, J. A., Problema de Investigación, Prospección preliminar de la fauna carcinológica en el sistema lagunar costero del estado de Guerrero y litoral sur del estado de Michoacán, con referencia especial a las especies de importancia económica. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México. 1974 180, 32 figs. 10 láms. 8 tabl. YÁÑEZ-ARANCIBIA, A., Problema de Investigación, Prospección preliminar de la fauna ictiológica del sistema lagunar costero del estado de Guerrero (Pacífico Central de México). Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México. 1974 199. 31 figs. 14 láms. 2 tabl. An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, Sobre los estudios de peces en las lagunas costeras: Nota científica. 1975a. 53-60 2 1 In: Informe Final 2,9 Etapa Programa Uso de la Zona Costera de Michoacán y Guerrero. Convenio Comisión del Río Balsas, S. R. H., y Centro de Ciencias del Mar y Limnología Univ. Nal. Autón. México. Contrato de Estudios N9 OC-E-03-74, Relaciones tróficas de la fauna ictiológica del sistema lagunar costero de Guerrero y aspectos parciales de dinámica de poblaciones de los peces de importancia comercial. 230 p., 71 figs. 1975b 750 An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, Observaciones sobre Mugil curema Valenciennes en áreas naturales de crianza, México: Alimentación, crecimiento, madurez y relaciones ecológicas. 1976a. 92-124 3 1 Progress in Marine Research in the Caribbean and Adiacent Regions. Fish culture in coastal lagoons: Perspectives in Mexico. CICAR - II Symposium, FAO Fish. Rep. Caracas, Venezuela, 1976b 200 July, 12-16, 1976 Proceeding World Mariculture Society Eight Annual Meeting. Biological and ecological studies and perspectives of culture of sea catfish Galeichthys caerulescens (Gunther) in coastal lagoons on the Pacific coast of Mexico. . San José, Costa Rica, Jan. 9-13, 1977 (in press). Tesis doctoral Taxonomía, ecología y estructura de las comunidades ictiofaunísticas en nueve lagunas costeras del estado de Guerrero (Pacífico Central de México). Ciencias del Mar, Univ. Nal. Autón. México, 1977b 800 p., 66 figs., 32 láms. YÁÑEZ-ARANCIBIA, A. y R. S. NUGENT, 39th Annual Meeting American Society of Limnology and Oceanography. Some ecological relationships of nektonic communities in nine coastal lagoons on the Pacific coast of Mexico. Savannah, Georgia, 1976 Jun. 21-24, 1976. YÁÑEZ-ARANCIBIA, A. y R. S. NUGENT, An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, El papel ecológico, de los peces en estuarios y lagunas costeras. 1977 107-114 4 1 YÁÑEZ-ARNCIBIA, A. y G. DÍAZ, An Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, Ecología trofodinámica de Dormitator latifrons (Richardson) en nueve lagunas costeras del Pacífico de México (Pisces: Eleotridae). 1977 125-140 4 1 YAÑEZ-ARANCIBIA, A., J. CURIEL-GÓMEZ Y V. LEYTON DE YÁÑEZ, An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, Prospección biológica y ecológica del bagre marino Galeichthys caerulescens (Gunther) en el sistema lagunar costero de Guerrero, México (Pisces: Arfidae). 1976 125-180 3 1 YASUDA, F., Bull. Japanese Soc. Sci. Fish., The types, of food habíts of fishes assured by stomach contents examination. 1960 653-662 26 7 YOKOTA, T., In: japanese Materials. The construction of fish community at Nankai Regional Area from, the view point of their food habits. 1956 ZARET, TH. M. y R. T. PAINE, Science, Species introduction in a tropical lake. 1973 449-455 182
|

