|
PROSPECCIÓN BIOLÓGICA Y ECOLÓGICA DEL BAGRE MARINO GALEICHTHYS CAERULESCENS (GUNTHER) EN EL SISTEMA LAGUNAR COSTERO DE GUERRERO, MÉXICO (PISCES: ARIIDAE)
A. YÁÑEZ-ARANCIBIA
J. CURIEL-GÓMEZ
V. L. DE YÁÑEZ
Universidad Nacional Autónoma de
México. Centro de Ciencias del Mar y Limnología,
Laboratorio de
Ictiología.
Se discute la alimentación, hábitos
alimenticios, relaciones tróficas, crecimiento, madurez,
reproducción y relaciones ecológicas de
Ga1eichthys
caerulescens (Gunther) en el sistema lagunar costero de
Guerrero,
Pacífico central de México.
Los resultados indican que es una especie
predominantemente carnívora, consumidor de Segundo y Tercer Orden
que se
alimenta de peces, crustáceos decápodos, insectos,
moluscos,
anélidos, isópodos, nemátodos, copépodos,
ostrácodos, detritus y materia orgánica, vegetales y
sedimentos
inorgánicos. El espectro trófico varía cuali y
cuantitativamente de acuerdo a: 1) la disponibilidad del alimento, 2) la
estación del año, 3) la localidad y sus
características
físico-químicas, y 4) la edad del pez. Para estos estudios
se
eligieron los métodos volumétricos, gravimétricos,
de
frecuencia y el índice de importancia relativa de cada grupo
trófico. En el método volumétrico se propone la
siguiente
relación matemática para mayor exactitud
cuantitativa
Vcr = Vt - Vp
donde Vcr representa el volumen de capacidad real que
significa el 100% de un estómago lleno, Vt representa el volumen
total
que desplaza un estómago y donde Vp representa solamente el
volumen
desplazado por el estómago vacío (pared estomacal) . Se
propone
además la siguiente relación matemática que
determina el
índice de importancia relativa de cada grupo trófico
relacionando
porcentualmente el volumen y la frecuencia del alimento
I I R = F * V / 100
donde IIR representa el índice de importancia
relativa, F la frecuencia y V el volumen de cada grupo trófico. La
relación de estos tres parámetros permite cuantificar el
patrón de alimentación de la especie en un gráfico
definido como "diagrama trófico combinado".
Los estudios poblacionales muestran que el crecimiento
es muy rápido hasta los 180 mm de L. T. pero sin incremento en
peso
pronunciado. Posteriormente la curva sufre una notoria inflección
siendo
el incremento en peso muy marcado en relación a la talla que crece
con
menos velocidad. Las poblaciones alcanzan la madurez gonádica de
fase
III a los 200 mm de L. T. promedio y las hembras maduran antes que los
machos
en talla.
Los estudios de reproducción indican un marcado
dimorfismo sexual en relación a esa actividad fisiológica.
Existe
una gran proporción de hembras en las poblaciones, se reproducen
por
grandes huevos de abundante vitelo, fertilizados externamente e incubados
en la
cavidad oral de los machos. El desarrollo ontogénico es descrito
sobre
la base de 5 etapas embrionarias definidas por primera vez. El periodo de
reproducción es muy amplio presentándose la mayor cantidad
de
huevos y larvas en incubación durante los meses de mayo y octubre.
Se
reproducen a salinidades menores de 15%. La especie no sufre presiones de
predación por otros peces pero es un exportador de energía
del
ecosistema al ser predada por: 1) el hombre, y 2) cierta aves. Tolera
rangos de
temperatura de 19 a 35ºC y rangos de salinidad de 0 a 45 %.
The paper discusses the food, feeding habits, trophic
relationships, growth, sexual maturity, reproduction and ecological
relationships of the sea catfish, Galeichthys
caerulescens
(Gunther) in the coastal lagoon system of the state of Guerrero on the
Pacific
coast of Mexico.
The investigation shows the sea catfish to be
predominantly a second or third level carnivor which consumes: fish,
decapod
crustaceans, insects, molluscs, annelids, isopods, nematods, copepods,
ostracods, detritus and organic material, plants and inorganic sediments.
These
trofic relationships vary both qualitatively and quantitatively according
to:
1) the food available, 2) season of the year, 3) the location within the
lagoon
and its physical and chemical characteristics, and 4) the age of the
fish.
Stomach contents were studied using volumetric and gravimetric methods,
frequency of occurrance and also by calculating an index of relative
importance
for each trophic group. In order to better quantify the data developed
from the
volumetric analysis, the following mathematical relation is
proposed:
Vcr = Vt - Vp
where: Vcr represents the real volumetric capacity of
the stomach, Vt represents the total volume displaced by the full stomach
(when
actually measured volumetrically), Vp represents the volume displaced by
the
stomach tissue (wall) only (when actually measured volumetrically after
removing food). An index of Relative Importance of each trophic group is
proposed. The index is calculated from the relation between the volume
and
frequency of the specific food ingested as follows:
I I R=F * V / 100
where: IIR represents the index of Relative
Importance, F represents the frequency with which a food is found in the
stomachs, V represents the volume each food occupies in the stomachs. The
relationship of the three parameters (HR, F and V) permit the
quantification of
the feeding habits of the species in a graph as "combined trophic
diagram".
The population studies reveal that length increases
very rapidly up to 180 mm T. L. but with little increase in weight.
Thereafter,
the lenght-weight curve shows a marked inflection caused by sharp
increase in
weight with the relatively slow increase in length. The population
reaches
sexual maturity (gonadal phase III) at an average 200 mm T. L. with the
females
maturing at a length. (180-190 mm T. L.) smaller that of the male (210 mm
T.
L.).
The investigations indicate that there is a marked
sexual dimorphism associated with reproductive activities. There are many
more
females than males in the populations studied. The eggs are large with a
high
proportion of yolk, they are fertilized externally and incubated in the
oral
cavity of the male. The embriological developments is described on the
basis of
5 distinct embryonic stages. The reproductive period of the population is
long
with the greater number of eggs and larvae being incubated during the
months of
May and October. Reproduction occurs in waters with salinities of less
than
15%.
There are no other fish that prey on the sea catfish
in the lagoons; however, the species does contribute to the exportation
of
energy from the lagoon system due to predation by: man, and certain
birds.
Tolerance ranges of temperature are from 19 to 35ºC and of salinity
from 0
to 45 %.
De los estudios de Berdegué (1956), Ramírez H. y Páez (1965), Álvarez (1970), González (1972), Amezcua-Linares (1972), Stuardo et al. (1974), Stuardo y Martínez-Guerrero (1975), Castro (1974), Yáñez-Arancibia (1974 y 1975 a), se desprende que la familia ARIIDAE posee 4 especies de Galeichthys en la costa del Pacífico de México: esto es: G. caerulescens, seemani, guatemalensis y gilberti. De estas especies, G. caerulescens corresponde a la mejor representada en los sistemas estuarinos del Pacífico mexicano, tanto por su abundancia como por su distribución. En años recientes ha sido objeto de estudios pero en trabajos aislados, parciales, y con diferentes objetivos (Álvarez, 1970; Carranza, 1969 y 1970; Carranza y Amezcua-Linares, 1971 a y 1971 b; Amezcua-Linares, 1972; González, 1972; Stuardo et al. 1974; Yáñez-Arancibia, 1974 y 1975 a; Yáñez-Arancibia y Nugent, 1975). El trabajo de González (1972) corresponde al estudio más amplio sobre la familia Ariidae realizado a la fecha. Desde 1973 se han venido desarrollando diferentes estudios biológicos dentro de un Programa de Convenio de Colaboración entre la Comisión del Río Balsas, SRH, y el Centro de Ciencias del Mar y Limnología, UNAM. En estas investigaciones los estudios ictiológicos han representado uno de los objetivos más importantes en la evaluación de los recursos pesqueros del sistema lagunar de Guerrero, señalándose por Yáñez-Arancibia (1974 y 1975 a) y por Stuardo et al. (1974) que el bagre o "cuatete" G. caerulescens corresponde a una de las especies más significativas en la economía de las lagunas y como potencial pesquero del sistema lagunar de Guerrero. La especie se distribuye en el Pacífico, desde el noroeste de México hasta Guatemala. La Secretaría de Recursos Hidráulicos (SRH, 1975) ha señalado que G. caerulescens corresponde a la tercera especie de importancia comercial en la laguna de Chautengo, después de las "lisas" (Mugilidae) y las "mojarras" (Gerridae). Estos antecedentes, además de la abundancia de la especie, la calidad de su carne, su aceptación en el mercado, y su amplia distribución por todo el Pacífico mexicano, justifican el interés de la Comisión del Río Balsas y del Centro de Ciencias del Mar y Limnología, de discutir aspectos biológicos y ecológicos de la especie, conducentes a un óptimo aprovechamiento de la misma, a una administración racional del recurso, y a determinar las perspectivas de su cultivo. ÁREA DE ESTUDIOEl área de estudio ha sido descrita en detalle por Yáñez-Arancibia (1975 b) sintetizando aspectos geográficos, climáticos, hidrográficos y ecológicos, referidos a la ictioecología del sistema lagunar de Guerrero (Figs. 1 y 2). Para detalles geológicos y geomorfológicos del área ver Lankford (1974 y 1975), Gutiérrez y Carranza-Edwards (1975), y Warme y Sánchez (1975). Para detalles hidrográficos ver Arpi et al. (1974) y Castellanos (1975). Para aspectos biológicos y ecológicos ver Ramírez G. (1952), Stuardo et al. (1974), Stuardo y Martínez-Guerrero (1975) , Stuardo y Villarroel (1976) , Stuardo y Estévez (1975), Villarroel (1975), Weinborn (1974), Yáfiez-Arancibia (1974 y 1975 b), y Licea-Duran et al.(1975). El área cubre una extensión costera de aproximadamente 490 km de litoral. Los estudios ictiológicos se han efectuado en todas las lagunas importantes; esto es: 1. Salinas de Apozahualco (2 km2 sup. aproxi mada). 2. Chautengo (34 km2 sup. aproximada) . 3. Tecomate o San Marcos (21 km2 sup. apro ximada) . 4. Tres Palos (50 km2 sup. aproximada) . 5. Coyuca (34 km2 sup. aproximada) . 6. Mitla (36 km2 sup. aproximada) . 7. NUXCO GEl 20 (6.5 km2 sup. aproximada) . 8. Salinas del Cuajo (1.3 km2 sup. aproximada). 9. Potosí (4.5 km2 sup. aproximada) . 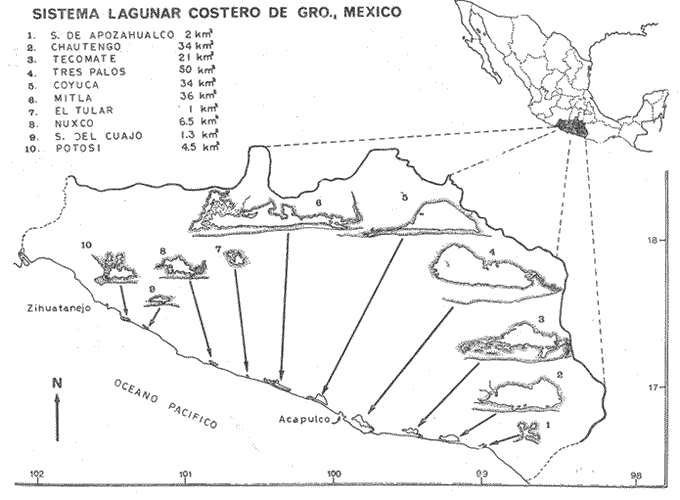 Fig. 1. Zona costera del Estado de Guerrero, México. Se indica en detalle el Sistema Lagunar y la relación de superficies entre las diferentes lagunas. Las epi-e infaunas bentónicas se encuentran escasamente representadas en todas las lagunas (Stuardo y Villarroel, 1976; Villarroel, 1975), al igual que la vegetación sumergida, exceptuando manglares y otra vegetación semi-acuática. Sin embargo los peces y el fitoplancton son particularmente abundantes en algunas lagunas Yáñez-Arancibia 1974 y 1975 a; Licea-Duran et al., 1975) . Los 9 cuerpos a aguas estudiadas son lagunas costeras típicas. Son de aguas someras, de volúmenes variables dependiendo de la "seca" y del "estío", con temperaturas elevadas que descienden en los meses de diciembre-enero-febrero, fondos predominantemente fangosos, y características de topografía y superficies muy irregulares. Algunas de ellas presentan un ciclo regular anual de entrada periódica de agua de mar (Fig. 2) y otras permanecen cerradas durante algunos años. MATERIALES Y MÉTODOS
Material de estudioPara el análisis de la alimentación y hábitos alimenticios fueron examinados 605 ejemplares. De éstos, fueron estudiados 390 por los métodos volumétricos y de frecuencia, y 215 por los métodos gravimétricos. Para la discusión del crecimiento y madurez gonádica fueron examinados 265 ejemplares diferentes de la colección anterior. 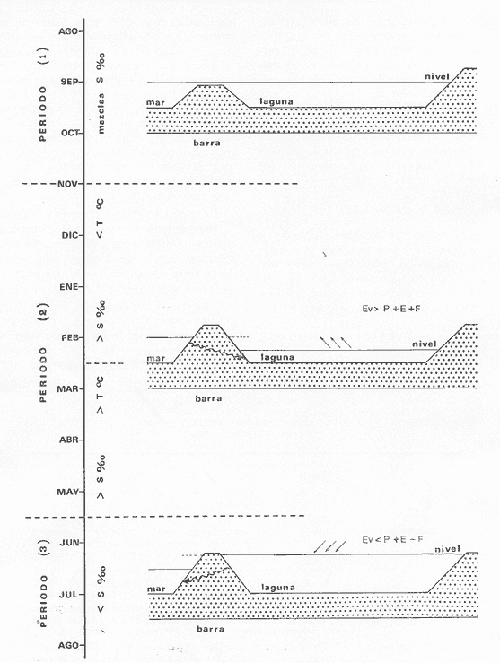 Fig. 2. Ciclo de fisiología, ambiental del Sistema Lagunar costero de Guerrero, México. (Según Yáñez-Arancibia 1975a y 1975b) , Periodo (1) barra abierta al mar y mezclas de aguas dulces, salobres y marinas. Periodo (2)=, descenso del volúmen de agua interno y presiones ambientales por aumento considerable de las salinidades y variaciones de las temperaturas. Periodo (3) = salinidades marinas aumento del volumen de agua interno. Efecto combinado de cabeza hidrostática y erosión del mar para abrir la barra y reiniciar el ciclo, Ev= evaporación; P = precipitación; E= escurrimiento; F= filtración desde el nivel superior. Esta colección de 870 ejemplares de G. caerulescens se distribuyó entre 66.0 y 400.0 mm de longitud total, y entre 4.9 y 927. 4 g de peso total. Fueron colectados 72 ejemplares en septiembre de 1973, 340 ejemplares en mayo de 1974, y 458 ejemplares en octubre de 1974. Para la discusión de reproducción fueron examinados numerosos machos y hembras grávidas en periodos de reproducción, además de 200 huevecillos y 167 larvas. Actividades en el área de estudioPara cada una de las lagunas estudiadas se dispuso un número determinado de estaciones de colectas, tratando de cubrir de la mejor manera la superficie de las mismas. En cada estación se realizó un número determinado de lances de pesca para determinar una cierta unidad de esfuerzo de pesca. El arte de pesca empleada fue el "atarraya", que es particularmente eficiente en las aguas turbias y someras de las lagunas costeras. Es una red circular de 5 m de diámetro, malla de trama 0.5 y 1.0 pulgadas, y con numerosos lastres de plomo en la periferia. Las muestras eran rápidamente llevadas a bordo (una lancha de aluminio de fondo plano, 3.4 m de eslora, y con motor fuera de borda de 9 HP) y fijadas en formalina al 10%, neutralizada previamente con Borato de Sosio, inyectando además la región estomacal de los peces para detener los procesos digestivos. El retardar esta operación hace que después de algunos minutos sea irreconocible el contenido estomacal de los peces (Yáfiez-Arancibia, 1975 a). La productividad pesquera de la especie puede ser estimada en relación al número de ejemplares capturados en cada lance de pesca, y la biomasa en relación al peso total promedio para cada lance. Conociéndose la superficie del arte de pesca y la superficie de la laguna puede ser estimada una biomasa total. Sólo recientemente se han estado desarrollando métodos para estudios cuantitativos de las comunidades ictiológicas en lagunas costeras y sistemas estuarinos (J. W. Day et al., 1973; Nixon y Oviatt, 1973; Hester y Copeland, 1975; Kjelson y Colby, 1975; ,Yáñez-Arancibia, 1975 c) .  TABLA 1 EXAMEN DE LAS GÓNADAS TAMAÑO, COLOR Y FORMA, DE ACUERDO CON NIKOLSKY (1963) Actividades de laboratorioEn el laboratorio las muestras eran lavadas y mantenidas en alcohol metílico al 70%. Las mediciones de longitud fueron hechas con un ictiómetro convencional y las de peso, sobre material fijado, en una balanza Ohaus Tripel Beam de 0.1 g de precisión y 2,610 g de capacidad. El examen de los estómagos y el estado del pez se hizo siguiendo el criterio de Laevastu (1971) ; las fases de digestión del contenido estomacal fueron determinadas de acuerdo a Carranza (1969) y Yáñez-Arancibia (1975 a) , y el examen de las gónadas se hizo considerando las fases de desarrollo sexual recomendadas por NikoIsky (1963), tabla 1. Yáñez-Arancibia (1975 a) ha discutido varios métodos para analizar el contenido estomacal de los peces: método volumétrico, método numérico, método gravimétrico, método de frecuencia, cronología alimenticia, índice de importancia relativa, coeficiente de vacuidad, etcétera. De acuerdo al tamaño de los estómagos, al tipo y tamaño del alimento y al grado de digestión, es necesario combinar entre sí diferentes métodos para obtener una información más clara sobre la preferencia alimenticia de las especies en determinadas áreas. Para G. caerulescens se eligieron los métodos volumétricos, de frecuencia, gravimétricos, y el índice de importancia relativa de cada grupo trófico. Método volumétrico: De acuerdo al método volumétrico, cada grupo trófico fue separado y medido su volumen por desplazamiento de agua en una probeta graduada de 0.1 m1 de precisión. El volumen de cada grupo trófico fue referido al volumen de capacidad real (Vcr) que representa el 100% de un estómago lleno. Este Vcr se calcula con la siguiente fórmula discutida por Yáñez-Arancibia (1975 a): Vcr = Vt - Vp (1) donde Vt representa el volumen total que desplaza un estómago inmediatamente después de disectado, ligado en sus extremos y sumergido en la probeta graduada, y donde Vp representa solamente el volumen desplazado por el estómago vacío (pared estomacal) . Para efectuar esta última medición se abre el estómago vaciando el contenido en una caja de Petri. W. E. Odum (1971) y W. E. Odum y Heald (1972) determinan la composición porcentual del contenido estomacal de dos maneras: 1) Para grandes partículas alimenticias calculan el volumen de los distintos alimentos en una probeta graduada, -de manera similar a la metódica empleada en este estudio y discutida inicialmente; 2) Los estómagos con partículas pequeñas (menos de 1 mm) requieren una segunda aproximación. Calculan el volumen de una partícula patrón y luego estiman por comparación el resto. de las partículas alimenticias en un porta objetos graduado micrométricamente. En la Unión Soviética se emplea una relación entre el volumen total del alimento y el volumen del pez, multiplicado por una constante. La fórmula es: Ic = Va / Vp * 100 (2) donde Ic representa el índice de llenado del estómago, Va representa el volumen total del alimento y Vp representa el volumen del pez. Esta información aparentemente contribuye a una mejor interpretación en el análisis volumétrico pero ha sido tan poco discutida (Yáñez Arancibia) 1975 a), que no ha sido empleada en estos estudios. Método de frecuencia: De acuerdo al método de frecuencia la expresión de los resultados fue hecha con dos expresiones matemáticas que señalan la periodicidad y/o la preferencia con que son ingeridos ciertos alimentos, pero no señala la cantidad o número. Sin embargo el método ayuda a la interpretación final del pa trón alimenticio de la especie. Yáñez- Arancibia (1975 a) discute este método en detalle. Una de las expresiones matemáticas es: F = n / NE * 100 (3) donde F representa la frecuencia o periodicidad de aparición de algún alimento, n representa el número de estómagos que contienen dicho alimento, y NE es el total de estómagos analizados. Esto determina que F sea una expresión porcentual (%). Yasuda (1960) también ha usado con efectividad esta expresión. Una simplificación de la fórmula (3) ha usado exitosamente Albertine (1973) y Yáñez-Arancibia (1975 b) f = n / NE (4) donde f representa un índice de frecuencia; ya que no es una expresión porcentual como en (3), los resultados son interpretados de la siguiente manera: si f es menor que 0.10 (alimento accidental), si f es mayor que 0.10 pero menor que 0.50 (alimento secundario), y si f es mayor que 0.50 (alimento preferencial). Método gravimétrico: Referente al método gravimétrico, tiene un principio similar al método volumétrico y por lo tanto presenta las mismas ventajas e inconvenientes. La masa de los organismos, una vez separados, es medida por medio de una balanza en lugar de una probeta. En este estudio se determinó el peso total del contenido estomacal (Pce) por la siguiente fórmula discutida por Yáfiez-Arancibia (1975 a): Pce = Pte - Ppe (5) donde Pte representa al peso total del estómago y Ppe el peso de la pared estomacal. Estudios de Albertine (1973) demuestran que este método complementa a otros y sugieren calcular un índice de repleción (Ir) de la siguiente manera: Ir = p / P * 100 (6) donde p representa el peso del contenido estomacal (g) y P representa el peso total del pez. De esta manera la expresión es porcentual (%). Aoyama (1953), Yokota (1956) , Yasuda (1960) y Yáñez-Arancibia (1975 a) expresan porcentualmente (%) el peso de cada alimento determinado en el estómago del pez con la fórmula: Ica = PCE / PT * 100 (7) donde Ica es el índice de cantidad de alimento ingerido, PCE -representa el peso del contenido estomacal y PT representa el peso total del pez. En este trabajo también se estudia esta relación y puede discutirse su variación en los peces carnívoros detritívoros, u otros; y la necesidad gravimétrica de los alimentos en relación a su crecimiento. Método del índice de importancia relativa:Este método sugerido por Pinkas et al. (1971) y usado recientemente por Yáñez-Arancibia (1975 a), es muy útil para interpretar de mejor manera la importancia de algún alimento específico. Puede ocurrir que un pez dado consuma una jaiba o camarón que en volumen ocupe casi toda la capacidad estomacal; sin embargo, el número (la unidad) es bajo y más aún la frecuencia es mínima. Entonces se considera como un alimento ocasional. La combinación de los diferentes métodos mencionados sirve para interpretar el índice de importancia relativa (IRI), calculado de la siguiente fórmula: IRI = F (N - V) (8) donde N representa el porcentaje numérico, V representa el porcentaje volumétrico y F representa la frecuencia o porcentaje de ocurrencia. Esta relación es muy útil, pero aparentemente poco práctica para peces que se alimentan de organismos y partículas de muy diferentes tamaños. El método numérico (N) en sí representa más inconvenientes que ventajas, además que por tratarse de un método que cuantifica unidades, le otorga el mismo valor a un foraminífero, que a una jaiba o un pez. Este aspecto lo hace necesariamente poco preciso y requiere de complementos volumétricos y de frecuencia con mayor urgencia que los otros métodos, para la interpretación de la alimentación de los diferentes peces. Consideraciones de este tipo nos ha llevado a idear una relación matemática para cuantificar la importancia relativa de determinado grupo trófico dentro de- la alimentación (espectro trófico) de cada especie, que relacione la frecuencia y el volumen del alimento por ser considerados los parámetros más importantes en el estudio de la alimentación de los peces. La fórmula propuesta es la siguiente: I I R = F *V / 100 (9) donde IIR representa el índice de importancia relativa que tiene cada grupo trófico en particular, F representa frecuencia o porcentaje de ocurrencia, y V representa el porcentaje volumétrico del alimento ingerido o grupo trófico. Esto determina que la expresión sea porcentual con un rango natural de 0 a 100. La combinación de HR, de F y V en un cuadro graduado como el de la figura 3 permite graficar el espectro trófico el cual queda delimitado por el porcentaje volumétrico y por el porcentaje de frecuencia, y evaluado por el índice de importancia relativa en relación a 3 cuadrantes (i.e., I, II, III). Para volumen y frecuencia se define el siguiente rango evaluativo combinado: 0-10% = grupos tróficos de importancia baja, 10-40% = grupos tróficos de importancia secundaria, y de 40-100% = grupos tróficos de importancia alta. Para el índice de importancia relativa se define el siguiente rango evaluativo: 0-10% grupos tróficos de importancia relativa baja, de 10-40% = grupos tróficos de importancia relativa secundaria, y de 40-100% grupos tróficos de importancia relativa alta. Los 3 cuadrantes quedan definidos de la siguiente manera: Cuadrante 1 = (ABCD), zona de los grupos tróficos accidentales, ocasionales o circunstanciales. Cuadrante II = (DEFG), zona de los grupos tróficos secundarios. Cuadrante III = (HIJK), zona de los grupos tróficos preferenciales. En las figuras 19 a 24 se han graficado los"diagramas tróficos combinados" para todas las lagunas estudiadas. 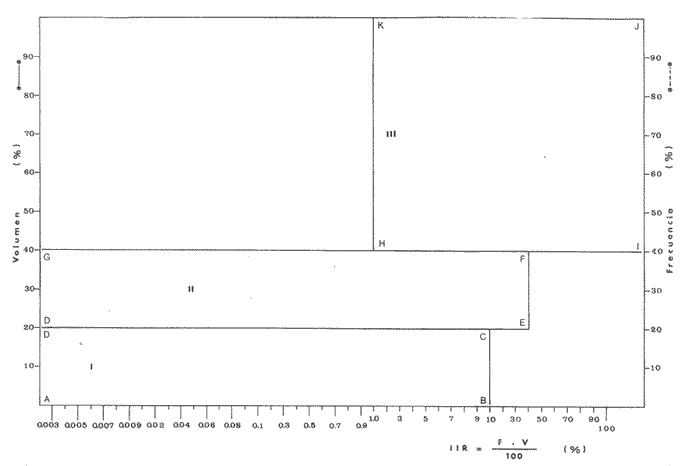 Fig. 3. Cuadro de relación de volumen, frecuencia, e índice de importancia relativa, para representar y evaluar espectros tróficos cuantitativos. Diagrama Trófico Combinado Identificación y terminologíaDespués de separar el contenido estomacal, éste fue clasificado en 2 categorías: Organismos. Fueron determinados a nivel específico, genérico, de familia o grupo, según las dificultades taxonómicas que representaban y principalmente de acuerdo al grado de digestión. Esto se vio facilitado por la existencia de los trabajos de Weinborn (1974), Yáñez-Arancibia (1974) , Stuardo y Villarroel (1976) , Stuardo et al. (1974), donde se estudian crustáceos, peces, moluscos, plancton y vegetación sumergida del área de estudio. Otros materiales. Dentro de esta categoría fueron determinados los sedimentos inorgánicos, materia orgánica animal no determinable (M. O. N. D.), restos vegetales, y detritus. Este último término fue usado de acuerdo al concepto definido por E. P. Odum y De la Cruz (1963) y ampliado por Darnell (1967 a y 1967 b) ... "Todo tipo de material biogénico en diferentes estados de descomposición microbiana, representando potencialmente una fuente de energía para consumo de las especies" ... Cuando fue posible la identificación de las partículas de detritus se hizo de acuerdo a su color (W. E. Odum y Heald, 1972; Yáñez-Arancibia 1975 a) . Las expresiones volumétricas, gravimétricas, de frecuencia, y el índice de importancia relativa de los diferentes grupos tróficos (diagrama trófico combinado), así como también las relaciones de peso-longitud, conjuntamente con el sexo y las diferentes fases del desarrollo gonádico de los peces, fueron graficadas. La terminología abreviada en las tablas y gráficas es la siguiente: S = sexo. ES = estado sexual (fase gonádica) IND = indeterminado. PT = peso total del pez. LT = longitud total del pez. LP = longitud patrón (estándar) del pez. LC = longitud de la cabeza. PE = peso del estómago. VE = volumen del estómago. VEV = volumen del estómago vacío. PCE = peso del contenido estomacal. MOND = materia orgánica no determinable. M = macho. H = hembra. RESULTADOS Y DISCUSIÓN
OBSERVACIONES SOBRE ALIMENTACIÓN Y HÁBITOS ALIMENTICIOSLa especie hemóloga de G. caerulescens, en la costa del golfo, corresponde a G. (= Arius) felis y ha sido objeto de numerosos y completos estudios. Darnell (1958) encontró que dicha especie pasa por tres etapas alimenticias durante su vida. Los ejemplares menores de 100 mm de longitud se alimentan de pequeños crustáceos, principalmente copépodos; al aumentar de tamaño son más importantes en su dieta los pequeños invertebrados del fondo; y finalmente después de los 200 mm los cangrejos y peces predominan en su régimen alimenticio. Knapp (1949) y Harris y Rose (1968) han señalado que G. (=A.) felis es un activo depredador de camarones penéidos consumiendo más del 80% en su dieta. W. E. Odum (1971) y W. E. Odum y Heald (1972) no encontraron en sus estudios la isucesión alimenticia descrita por Darnell (1958). Estos dos últimos autores, en el análisis de 62 estómagos de G. ( = A.) felis de la localidad de North River, Florida, encontraron 11 tipos de alimento en ejemplares midiendo entre 205 y 331 mm de longitud. Entre estos tipos los que representaron volumétricamente menos del 5% de la dieta fueron: nemátados, cangrejos, larvas, algunos peces (tarpon), insectos adultos, Brachidontes exustus, isópodos, restos de algas, Penaeus duorarum, Palaemonetes spp., Alpheus heterochaelis. El principal alimento fueron los anfípodos con un 28%, la jaiba Rhithropanopeus harrisi con un 47%, y misidáceos con un 7%. Al mismo tiempo en el análisis del alimento de 14 ejemplares juveniles de la localidad de Whitewater Bay, encontraron dominancia de anfípodos, y en menor grado misidáceos, larvas de Chironomus, isópodos, y pequeños cangrejos. Darnell (1958 y 1961), Reid (1954), Gunther (1945), Smith (1907) y Gudger (1916), han coincidido en destacar la importancia de los camarones y peces en la alimentación de G. (= A.) felis. Carranza (1969 y 1970) encontró que G. gilberti (una especie que convive con G. caerulescens) ingiere en su dieta volumétricamente un 43% de crustáceos de los cuales 37% es camarón, pero la frecuencia es sólo de 8%; los peces representan el 22% del volumen de alimento ingerido, con una frecuencia de 44%; por otra parte anélidos poliquetos aparecieron con una frecuencia de 12% pero fueron volumétricamente bajos. En el Pacífico de México, G. caerulescens ha sido parcialmente estudiada por Carranza (1969 y 1970), Carranza y Amezcua-Linares (1971 a y 1971 b), Amezcua-Linares (1972), y en forma poco más amplia por González (1972), Stuardo et al. (1974) , Yáñez-Arancibia (1974 y 1975 a). Exceptuando el último trabajo mencionado los otros consideran a G. caerulescens como una especie de hábitos preferentemente carnívoros predando sobre anélidos, crustáceos, insectos y peces pequeños. Según González (1972), G. caerulescens es una especie típicamente carnívora que ingiere peces. El alimento principal en la etapa juvenil son pequeños crustáceos, insectos, moluscos, pequeños peces, anélidos y algas (estas últimas posiblemente ingeridas accidentalmente cuando capturan el alimento, puesto que su frecuencia es muy baja); entre los crustáceos, los copépodos se encuentran en mayor número y frecuencia, luego les siguen los anfípodos. Yáñez-Arancibia (1975 a) ha señalado que G. caerulescens es una especie predominantemente carnívora, consumidor de Segundo y Tercero Orden, predando sobre peces, detritus, crustáceos, insectos, moluscos, anélidos y en menor grado hidrozoarios (?) y algunos vegetales. Agrega ese autor que el factor alimenticio más importante fueron los peces y restos de materia orgánica no determinable; en menor proporción, crustáceos, moluscos, insectos, anélidos y restos vegetales. Para nuestros estudios se hicieron observaciones en septiembre de 1973, mayo de 1974 y octubre de 1974. Las lagunas de Chautengo, Mitla y Nuxco fueron visitadas en esas tres fechas. Apozahualco sólo aportó ejemplares en septiembre de 1973, Tecomate sólo en mayo de 1974 y Tres Palos sólo en octubre de 1974. Salinas de ApozahualcoEl espectro trófico en esta laguna (Figs. 4, 16, 19; tabla 2) señala que el principal alimento lo constituyen los peces predominando Gobionellus microdon, Mugil curema y Anchovia sp; luego materia orgánica no determinable y algo de detritus; luego insectos dípteros Chironomus sp., tanto larvas como algunos adultos y finalmente; anélidos y restos de vegetales en mucho menor proporción. La cuantificación de estos grupos tróficos se indica en las figuras y tabla mencionadas. 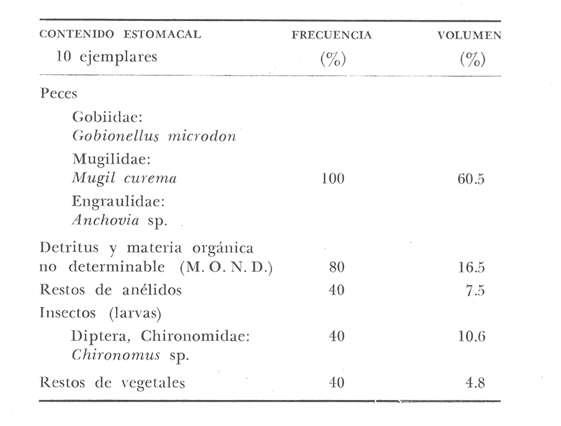 TABLA 2 (Figuras 4, 16, 19) RELACIÓN DEL CONTENIDO ESTOMACAL DE GALEICHTHYS CAERULESCENS EN SALINAS DE APOZAHUALCO, GRO. (SEP., 1973) ChautengoEl espectro trófico en esta laguna (Figs. 5, 8, 12, 16, 17, 18, 20; tablas 3, 6, 10) señala que en septiembre de 1973 el principal alimento lo constituyen los peces predominando Gobionellus microdon, Cichlasoma trimaculatum, y Anchovia macrolepidota; luego materia orgánica no determinable y algo de detritus; luego crustáceos predominando Callinectes sp.; moluscos predominando Mytella strigata; luego vegetales como Enteromorpha sp. y finalmente; nemátodos y restos de insectos acuáticos. En mayo de 1974 el principal alimento lo constituyeron los peces predominando Gobionellus sp. y Cich1asoma trimaculatum; luego decápodos predominando Callinectes sp. y Penaeus sp.; luego materia orgánica no determinable y algo de detritus; isópodos; y finalmente moluscos, Mytella strigata y Tagelus sp. y en mucho menor proporción vegetales como Enteromorpha sp. e insectos acuáticos Chironomus sp. En octubre de 1974 el principal alimento lo constituyeron los peces y materia orgánica no determinable en mayor proporción; entre los peces predominaron Gobionellus sp., Anchovia sp., Diapterus sp., Mugil curema y Gerres cinereus; los crustáceos decápodos y los moluscos también significaron grupos tróficos importantes predominando Penaeus sp., Mytella strigata y Polymesoda sp.; finalmente en menor proporción nemátodos y algas filamentosas Enteromorpha sp. y Chaetomorpha sp. La cuantificación de estos grupos tróficos para las tres épocas de colectas se indica en las figuras y tablas mencionadas. 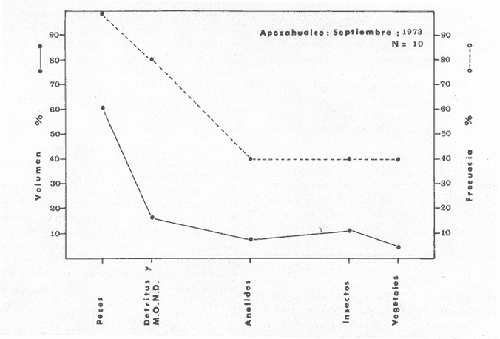 Fig. 4. Espectro trófico de volumen y frecuencia del alimento de G. caerulescens en Apozahualco, Gro., México. Septiembre, 1973 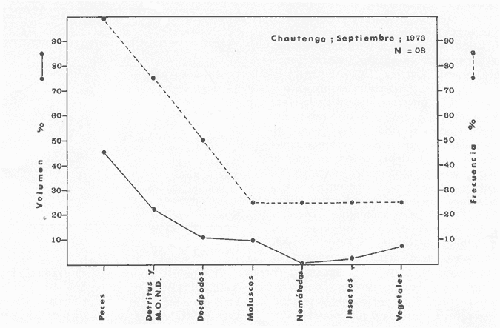 Fig. 5. Espectro trófico de volumen y frecuencia del alimento de G. caerulescens en Chautengo, Gro., Mé xico, septiembre, 1973 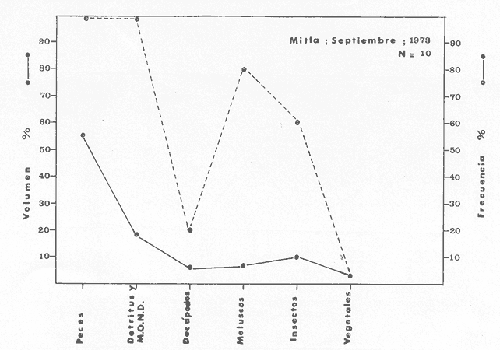 Fig. 6. Espectro trófico de volumen y frecuencia del alimento de G. caerulescens en Mitla, Gro., México. Septiembre, 1973. 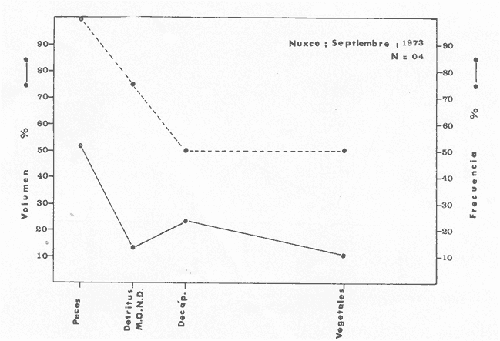 Fig. 7. Espectro trófico de volumen y frecuencia del alimento de G. caerulescens en Nuxco. Gro., México. Septiembre, 1973. 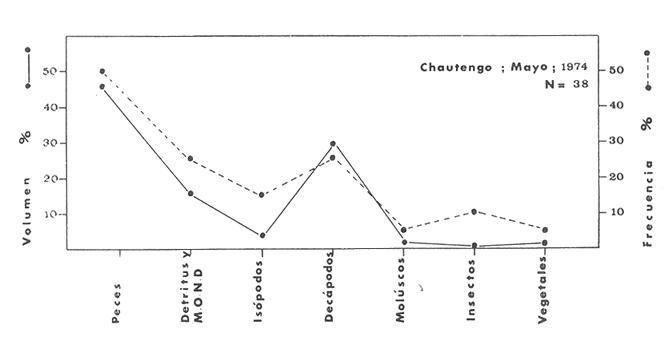 Fig. 8. Espectro trófico de volumen y frecuencia del alimento de G. caerulescens en Chautengo, Gro., México. Mayo, 1974. 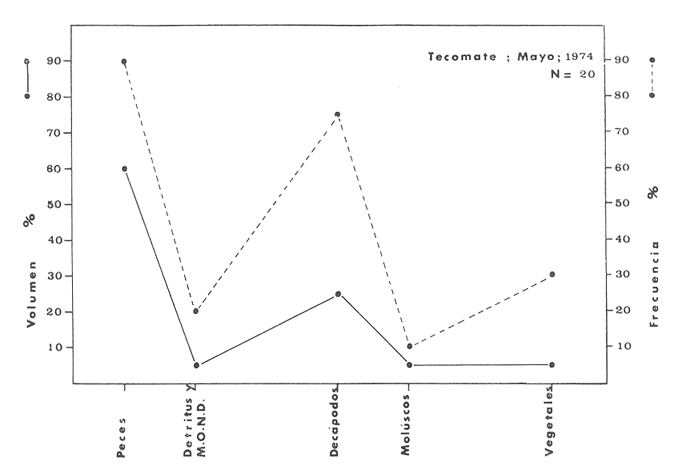 Fig. 9. Espectro trófico de volumen y frecuencia del alimento de G. caerulescens en Tecomate, Gro., Mé xico. Mavo, 1974. 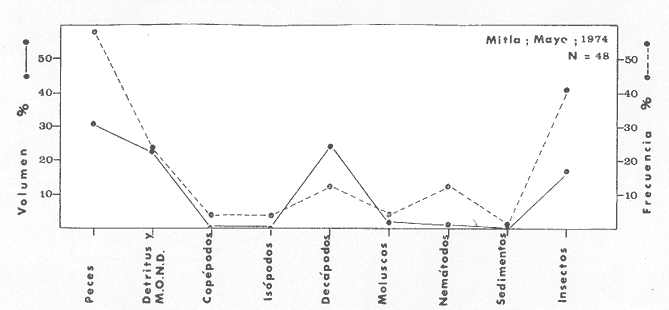 Fig. 10. Espectro trófico de volumen y frecuencia del alimento de G. caerulescens en Mitla, Gro., México, Mayo, 1974. 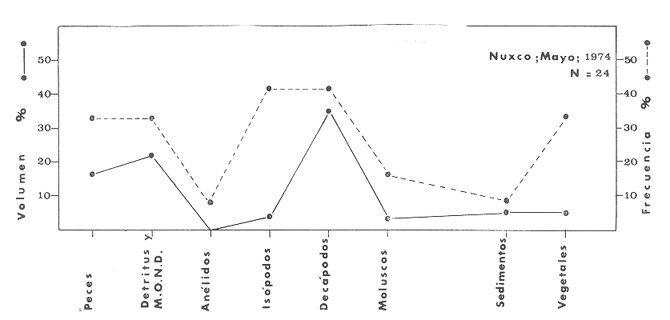 Fig. 11. Espectro trófico de volumen y frecuencia del alimento de G. caerulescens en Nuxco, Gro., México. Mayo, 1974. 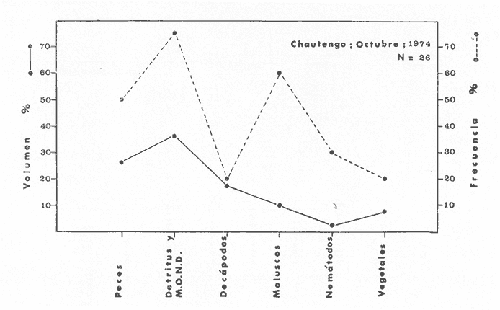 Fig. 12. Espectro tró fico de volumen y frecuencia del alimento de G. caerulescens en Chautengo, Gro., México. Octubre, 1974. 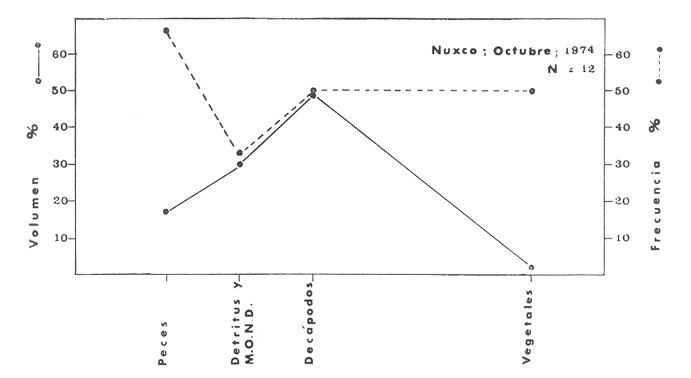 Fig. 13. Espectro trófico de volumen y frecuencia del alimento de G. caerulescens en Nuxco, Gro., México. Octubre, 1974. 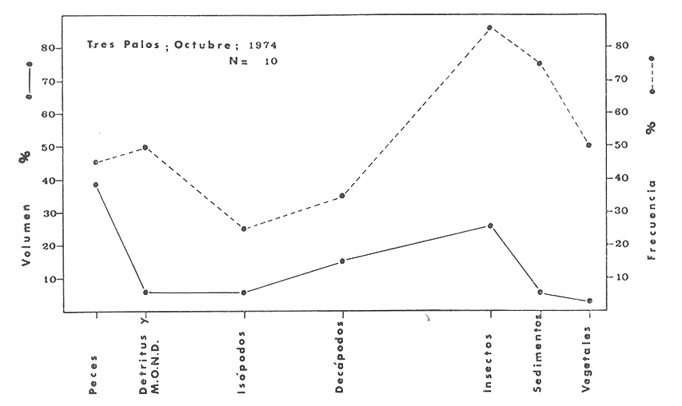 Fig.14. Espectro trófico de volumen y frecuencia del alimento de G. caerulescens en Tres Palos, Gro., México. Octubre, 1974. 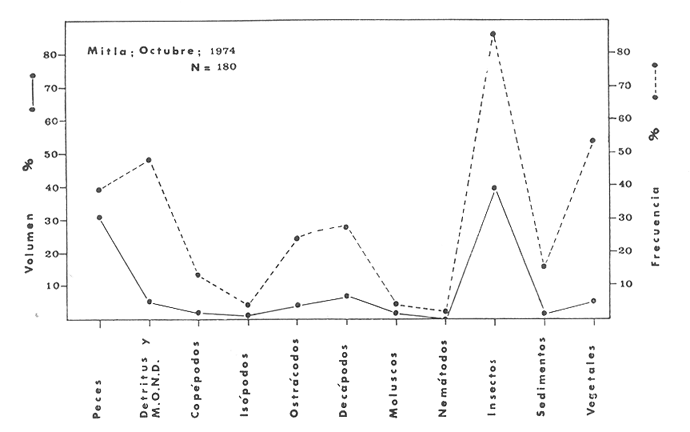 Fig. 15. Espectro trófico de volumen y frecuencia del alimento de G. caerulescens en Mitla, Gro., México. Octubre, 1974. TecomateEl espectro trófico en esta laguna (Figs. 9, 17, 21, tabla 7) señala que en mayo de 1974 el principal alimento lo constituyeron los peces predominando Anchovia macrolepidota, Diapterus peruvianus y Mugil curema; luego crustáceos decápodos predominando Cardisoma crassum y Callinectes sp. y finalmente; moluscos Mytella strigata; restos vegetales; y materia orgánica no determinable con algo de detritus. La cuantificación de estos grupos tróficos se indica en las figuras y tabla mencionadas. Tres PalosEl espectro trófico en esta laguna (Figs. 14, 18, 22, tabla 11) señala que el principal alimento en octubre de 1974 lo constituyeron los peces predominando Dormitator latifrons, Cichlasoma trimaculatum, Diapterus peruvianus y Mugil curema; luego insectos acuáticos Chironomus sp.; luego crustáceos decápodos predominando Macrobrachium tenellum; materia orgánica no determinable y algo de detritus y finalmente; isópodos; restos vegetales y sedimentos inorgánicos. La cuantificación de estos grupos tróficos se indica en las figuras y tabla mencionadas.  TABLA 3 (Figuras 5, 16) RELACIÓN DEL CONTENIDO ESTOMACAL DE GALEICHTHYS CAERULESCENS EN CHAUTENGO, GRO. (SEP., 1973) MitlaEl espectro trófico en esta laguna (Figs. 6, 10, 15, 16, 17, 18, 23, tablas 4, 8, 12) señala que en septiembre de 1973 el principal alimento lo constituyeron los peces predominando Dormitator latifrons, Cich1asoma trimaculatum y Mugil curema; luego materia orgánica no determinable y algo de detritus; luego insectos acuáticos Chironomus sp.; crustáceos decápodos predominando Macrobrachium tenellum; moluscos microgasterópodos Amnicola sp., y finalmente algunos vegetales. En mayo de 1974 el principal alimento lo constituyeron los peces predominando Dormitator latifróns y Cichlasoma trimaculatum; luego materia orgánica no determinable y algo de detritus; crustáceos decápodos predominando Macrobrachium tenellum; moluscos microgasterópodos Amnicola sp.; insectos acuáticos Chironomus sp. y algunos coleópteros; copépodos Cyc1ops sp.; isópodos; nemátodos y sedimentos inorgánicos. En octubre de 1974 el espectro trófico es tan diversificado como en mayo y cuantitativamente muy similar; el principal alimento lo constituyeron los insectos Chironomus sp. y algunos coleópteros; luego los peces predominando Dormitator latifrons, Cichlasoma trimaculatum, algunos Poecílidos y Astyanax fasciatus en menor proporción; luego materia orgánica no determinable y algo de detritus; crustáceos decápodos con la especie Macrobrachium tenellum; vegetales como Enteromorpha sp. y Chaetomorpha sp. y en forma menos significativa; copépodos Cyc1ops sp.; ostrácodos; isópodos; moluscos microgasterópodos Amnicola sp.; nemátodos y sedimentos inorgánicos. La cuantificación de estos grupos tróficos para las tres épocas de colectas se indica en las figuras y tablas mencionadas. 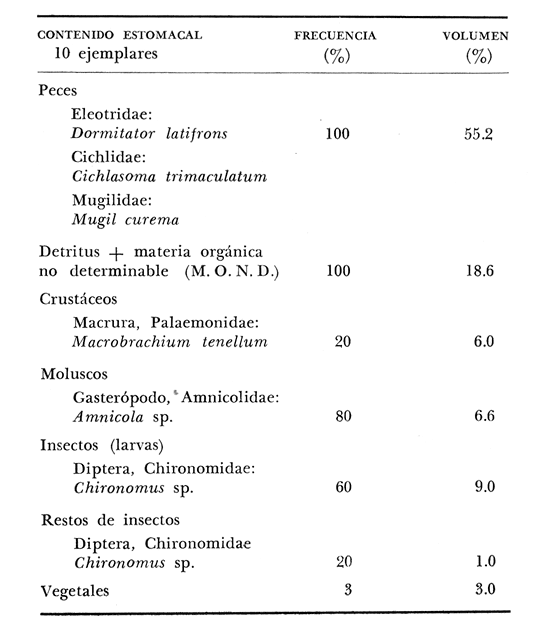 TABLA 4 (Figuras 6, 16) RELACIÓN DEL CONTENIDO ESTOMACAL DE GALEICHTHYS CAERULESCENS EN MITLA, GRO. (SEP., 1973) 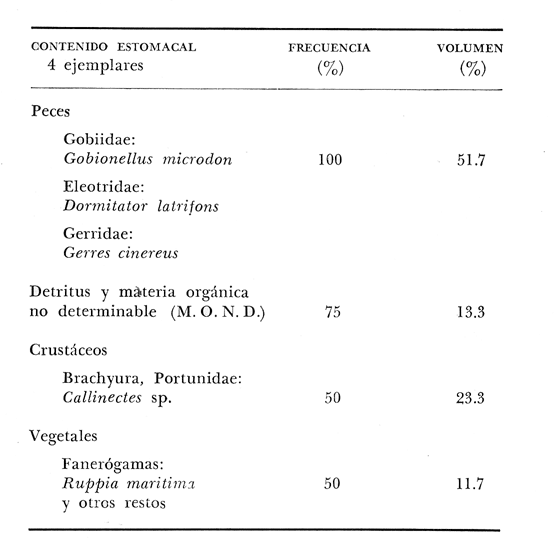 TABLA 5 (Figuras 7, 16) RELACIÓN DEL CONTENIDO ESTOMACAL DE GALEICHTHYS CAERULESCENS EN NUXCO, GRO. (SEP., 1973) NuxcoEl espectro trófico en esta laguna (Figs. 7, 11, 13, 16, 17, 18, 24, tablas 5, 9, 13) señala que en septiembre de 1973 el principal alimento lo constituyeron los peces predominando Gobionellus microdon, Dormitator latifrons y Gerres cinereus; luego crustáceos decápodos predominando Callinectes sp.; y finalmente materia orgánica no determinable y algo de detritus y restos de la fanerógama Ruppia maritima. En mayo de 1974 el espectro se ve muy diversificado constituyendo el principal alimento los crustáceos decápodos predominando Callinectes sp., Penaeus sp. y Cardisoma crassum; luego materia orgánica no determinable y algo de detritus; peces predominando Mugil curema, Dormitator latifrons, Gerres cinereus y Gobionellus sp.; vegetales como Enteromorpha sp., Chaetomorpha sp. y Ruppia maritima ; moluscos Amnicola sp., Polymesoda sp., Mytella strigata y finalmente en mucho menor proporción; anélidos; isópodos y sedimentos inorgánicos. En octubre de 1974 nuevamente los crustáceos de cápodos fueron el principal alimento predominando Callinectes sp. y Penaeus sp.; luego materia orgánica no determinable y algo de detritus; peces; y en mucho menor proporción algunos restos vegetales. La cuantificación de estos grupos tróficos para las tres épocas de colectas se indica en las figuras y tablas mencionadas. 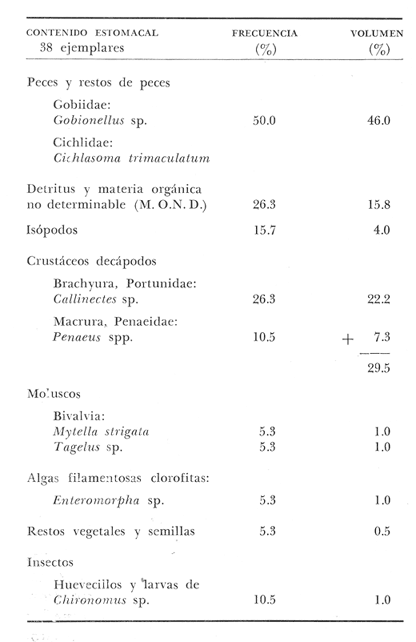 TABLA 6 (Figuras 8, 17, 20) RELACIÓN DEL CONTENIDO ESTOMACAL DE GALEICHTHYS CAERULESCENS EN CHAUTENGO, GRO. (MAYO, 1974) Estos resultados permiten precisar que G. caerulescens es una especie predominantemente carnivora, consumidor de Segundo y eventualmente de Tercer Orden. Su alimento lo constituyen peces, crustáceos, decápodos, insectos, moluscos, anélidos, isópodos, nemátodos, copépodos, ostrácodos, detritus y materia orgánica. vegetales y sedimentos inorgánicos. El predominio de estos grupos tróficos depende de a) la disponibilidad del alimento, b) la estación del año, c) la localidad, y d) la edad del pez.  TABLA 7 (Figuras 9, 17, 21) RELACIÓN DEL CONTENIDO ESTOMACAL DE GALEICHTHYS CAERULESCENS EN TECOMATE, GRO. (MAYO, 1974) Esto se aprecia al examinar los espectro tróficos interpretados en los diagramas tróficos combinados de las figuras 19 a 24. Se observa que en las lagunas de Tres Palos y Mitla los insectos constituyen el grupo trófico más importante determinado por la gran disponibilidad de ese alimento en aquellas localidades predominantemente dulceacuícolas donde las salinidades máximas no exceden las 3.5% allí además aparecen en el espectro trófico algunos copépodos, isópodos y ostrácodos dulceacuícolas. En las otras lagunas los insectos no son un grupo trófico tan significativo, pero sí lo son los peces, crustáceos decápodos y moluscos, entre otros, los cuales dependiendo de la época del año y las características propias de cada localidad, predominan unos u otros, como ocurre en Nuxco en octubre donde son más importantes los crustáceos sobre los peces en la alimentación de la especie. 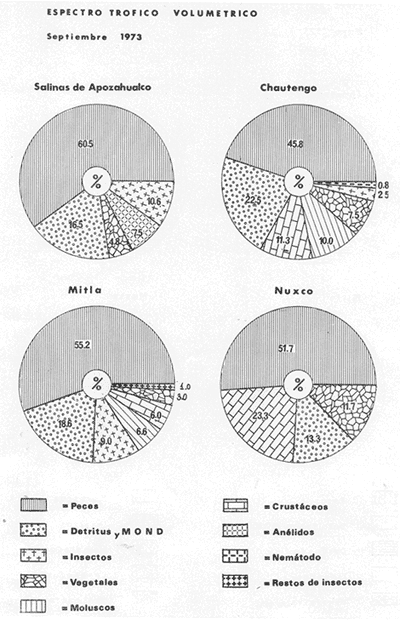 Fig. 16. Espectro trófico volumétrico del alimento de G. caerulescens en Apozahualco, Chautengo, Mitla y Nuxco, Gro., México. Septiembre, 1973. 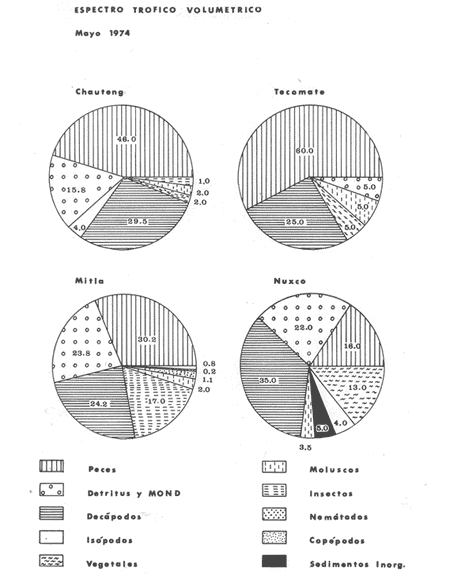 Fig. 17. Espectro trófico volumétrico del alimento de G. caerulescens en Chautengo, Tecomate, Mitla y Nuxco, Gro., México, Mayo, 1974. 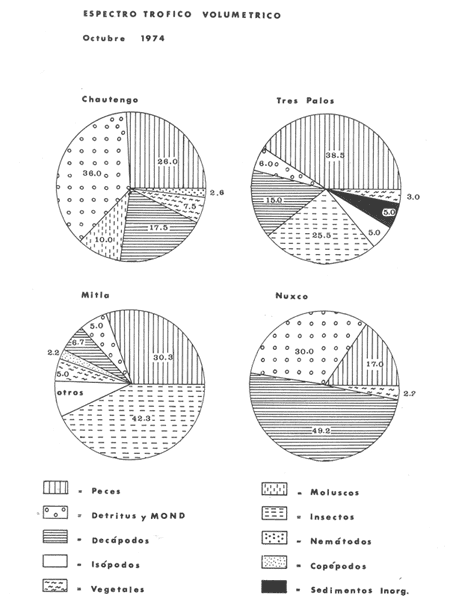 Fig. 18. Espectro Trófico volumétrico del alimento de G. caerulescens en Chautengo, Tres Palos, Mitla y Nuxc, Gro., México. Octubre, 1974 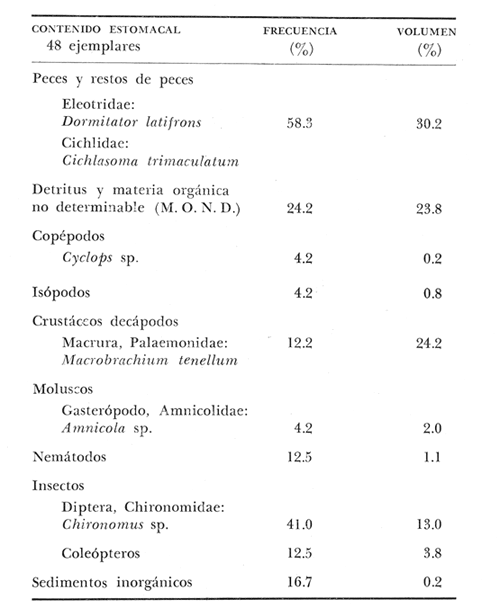 TABLA 8 (Figuras 10. 17) RELACIÓN DEL CONTENIDO ESTOMACAL DE GALEICHTHYS CAERULESCENS EN MITLA, GRO. (MAYO, 1974) Los peces que le sirven de alimento a G. caerulescens en el sistema lagunar costero de Guerrero son: Gobionellus microdon Mugil curema Anchovia macrolepidota Anchovia sp. Cichlasoma trimaculatum Dormitator latifrons Gerres cinereus Diapterus peruvianus Astyanax fasciatus Poecílidos 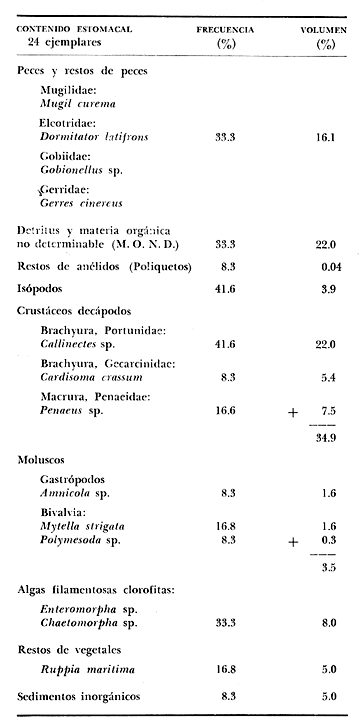 TABLA 9 (Figuras 11, 17, 24) RELACIÓN DEL CONTENIDO ESTOMACAL DE GALEICHTHYS CAERULESCENS EN NUXCO, GRO. (MAYO, 1974) Predominan Gobionellus, Cich1asoma, Dormitator, Astyanax y algunos Poecílidos en las zonas de bajas salinidades y definitivamente en las lagunas casi dulceacuícolas como Tres Palos y Mitla (probablemente también Coyuca) , y con una frecuencia variable las otras especies enlistadas más arriba.  TABLA 10 (Figuras 12. 18) RELACIÓN DEL CONTENIDO ESTOMACAL DE GALEICHTHYS CAERULESCENS EN CHAUTENGO, GRO. (OCTUBRE, 1974) Los vegetales corresponden definitivamente a un grupo trófico de poca importancia (Figs. 19 a 24) considerado como alimento accidental. Es conveniente hacer ver que el detritus (mezclado con M. O. N. D.) aparece con una frecuencia de cierta significación, lo que combinado con un espectro volumétrico ligeramente inferior lo constituyen en un grupo trófico secundario el cual además puede ser ingerido accidentalmente al predar sobre organismos macrobentónicos (Callinectes, Macrobrachium, Penaeus, Polymesoda, Mytella, u otros) o sobre algunos peces que viven casi enterrados en los fondos lagunares (Dormitator, Gobionellus, u otros) . Al respecto Darnell (1958) indicó queG. (= A.) felis come algo de detritus y también Springer y Woodburn (1960) han encontrado detritus en G. (= A.) felis además de peces, anélidos, insectos, anfípodos gamáridos, isópodos, copépodos y cangrejos. 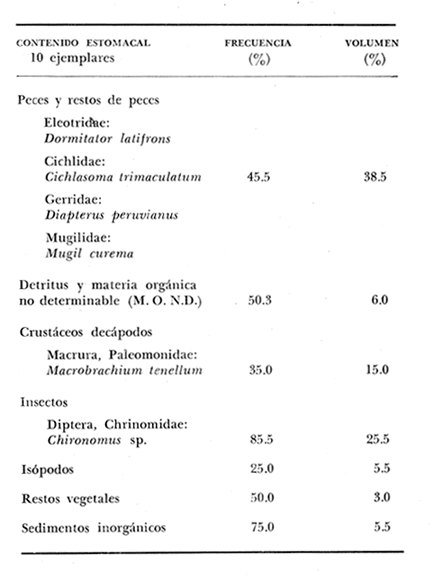 TABLA 11 (Figuras 14, 18, 25) RELACIÓN DEL CONTENIDO ESTOMACAL DE GALEICHTHYS CAERULESCENS EN TRES PALOS, GRO. (OCTUBRE, 1974) Además de la localidad, la estación del año, y la disponibilidad del alimento, el espectro trófico de G. caerulescens varía ligeramente con la edad del pez, predominando el zooplancton y pequeños organismos bentónicos en los ejemplares de menos de 100 mm de LT. Posteriormente la variación del espectro trófico se basa fundamentalmente en los otros tres factores ya discutidos. Sin embargo, es básicamente carnívoro teniendo una posición ecológica discutida más adelante. 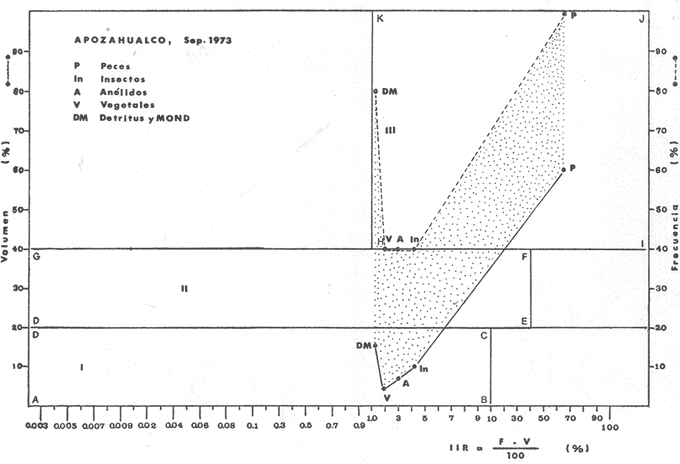 Fig. 19. Diagrama Trófico Combinado de Galeichthys caerulescens en Apozahualco, Septiembre 1973. Alimento preferencial = peces. Alimento secundario = detritus y MOND. Alimento ocasional o circunstancial = insectos y anélidos. Alimento accidental = vegetales. 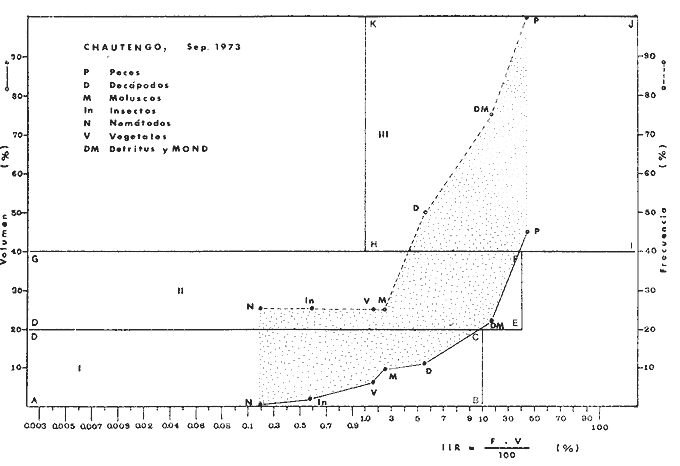 Fig. 20 A. Diagrama Tró fico Combinado de Galeichthys caerulescens en Chautengo, Septiembre 1973. Alimento preferencial = peces. Alimento secundario = detritus y MOND, y en parte decápodos. Alimento ocasional o circunstancial -- moluscos, insectos, nemátodos y vegetales. 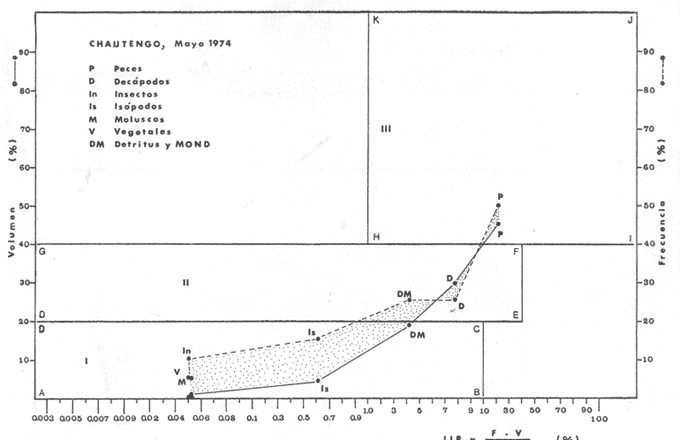 Fig. 20 B. Diagrama Trófico Combinado de Galeichthys caerulescens en Chautengo, Mayo 1974. Alimento preferencial = peces. Alimento secundario = de cápodos. Alimento circunstancial u ocasional = detritus y MOND, isópodos, insectos, moluscos. Alimento accidental = vegetales. 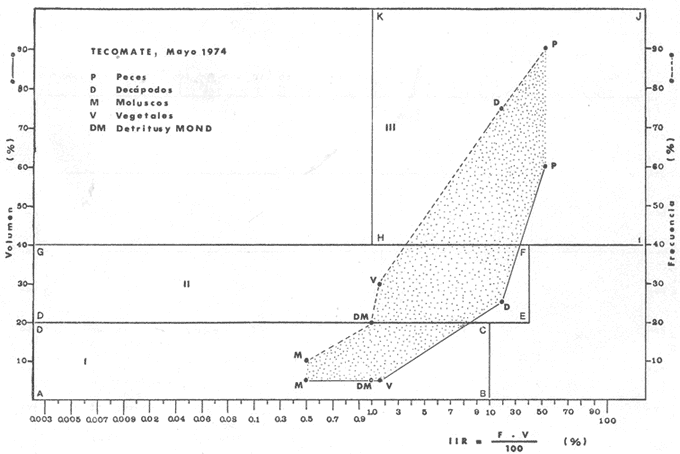 Fig. 21. Diagrama Tró fico Combinado de Galeichthys caerulescens en Tecomate, Mayo 1974. Alimento preferencial = peces. Alimento secundario = decápodos. Alimento circunstancial u ocasional = moluscos, detritus y MOND, vegetales. 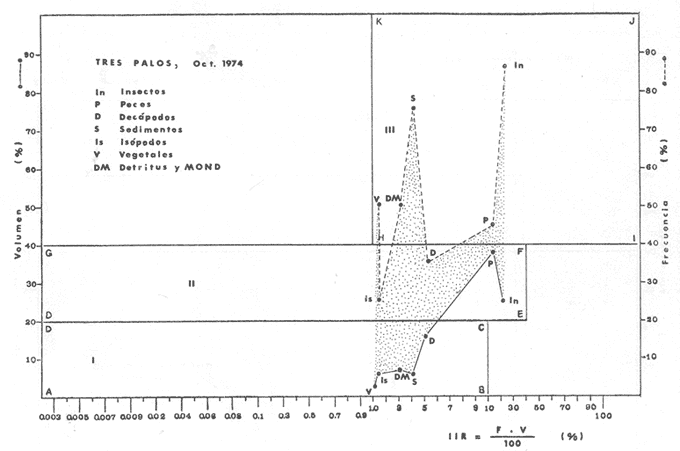 Fig. 22. Díagrama Trófico Combinado de Galeichthys caerulesens en Tres Palos, Octubre 1974. Alimento preferencial = insectos. alimento secundario = peces , Alimento circunstancial u ocasionel = decapodados, detritus y MOND, sedimientos. Alimento accidental = is{opodos, vegetales. 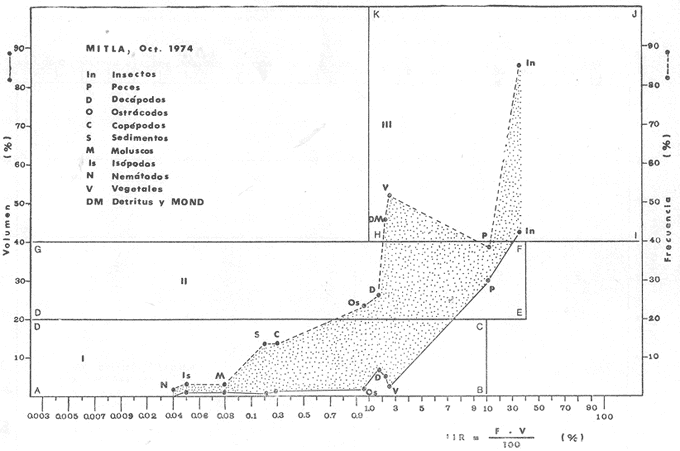 Fig. 23. Diagrama Trófico Combinado de Galeichthys caerulescens en Mitla, octubre 1974. Alimento preferencial = insectos. Alimento secundario = peces. Alimento circunstancial u ocasional = decápodos, detritus y MOND, vegetales. Alimento accidental = ostrácodos, copépodos, sedimentos, moluscos, isópodos, nemátodos. 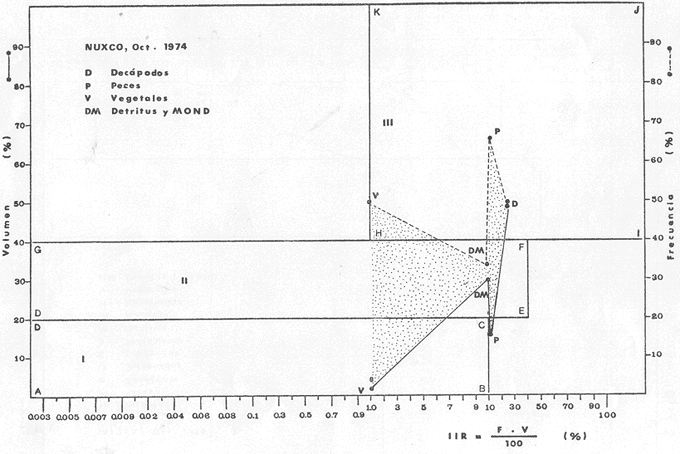 Fig. 24. Diagrama Trófico Combinado de Galeichthys caerulescens en Nuxco, Octubre 1974. Alimento preferencial = decápodos. Alimento secundario = peces, detritus y MOND. Alimento accidental = vegetales. 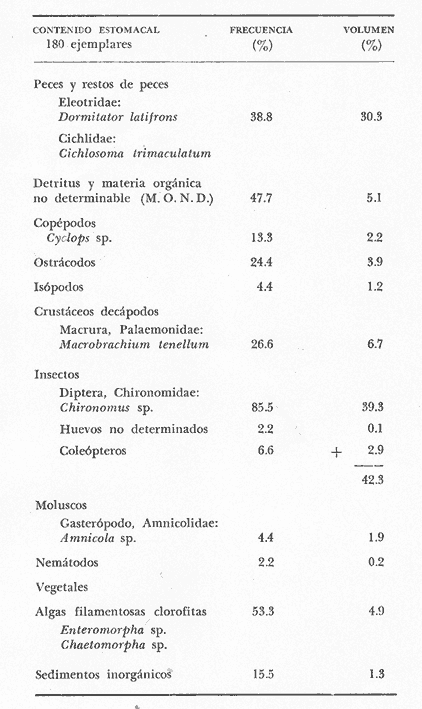 TABLA 12 (Figuras 15, 18, 23) RELACIÓN DEL CONTENIDO ESTOMACAL DE GALEICHTHYS CAERULESCENS EN MITLA, GRO. (OCTUBRE, 1974) Interesantes resultados ha mostrado el estudio de la relación gravimétrica del alimento ingerido por G. caerulescens (Figs. 25 a 27) . Se aprecia que en los primeros estados de desarrollo, siendo el pez pequeño, consume mayor cantidad de alimento en relación a su peso total. Conforme crece la especie y se incrementa en peso total, la necesidad gravimétrica de alimento es mucho menor. Éste es un aspecto económico interesante cuando se piensa en especies suceptibles de ser cultivadas y deben conocerse las necesidades económicas de alimento de la especie en cuestión conforme avanza su desarrollo y crecimiento. Los hábitos alimenticios de las diferentes especies determinan su rango gravimétrico del alimento lo que es muy diferente en una especie de alimentación y hábitos alimenticios preferentemente detritívora como Dormitator latifrons que convive ampliamente con G. caerulescens. En la figura 28 se muestra la dispersión gravimétrica del alimento para ambas especies siendo notoria su diferencia. D. latifrons requiere de bastante cantidad de alimento en sus estados juveniles, pero sus necesidades no son mucho menores conforme crece el pez. La disponibilidad del alimento para D. latifrons es muy grande y su capacidad estomacal voluminosa. Aparentemente D. latifrons necesita alimentarse con gran intensidad además de un alto requerimiento gravimétrico, en relación a G. caerulescens que es un pez carnívoro. 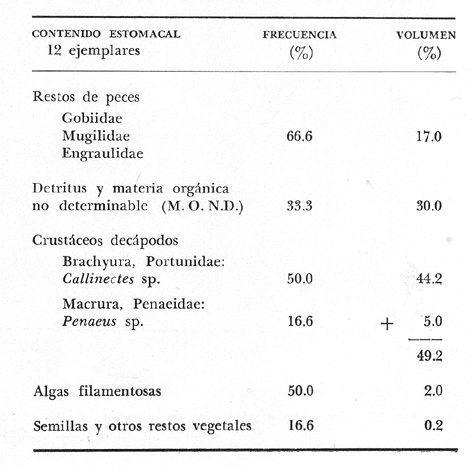 TABLA 13 (Figuras 13, 18) RELACIÓN DEL CONTENIDO ESTOMACAL DE GALEICHTHYS CAERULESCENS EN NUXCO, GRO. (OCTUBRE, 1974) 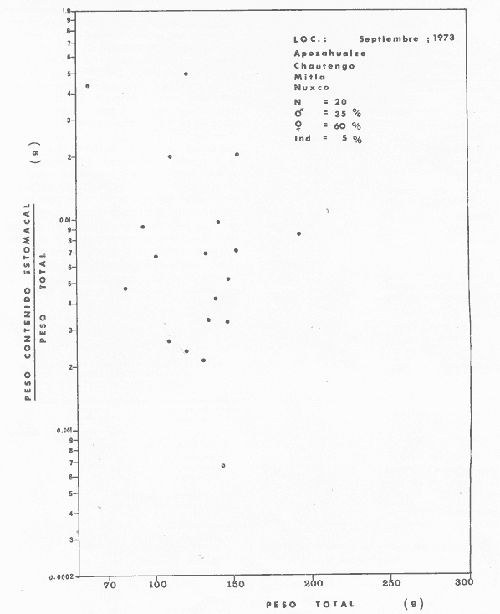 Fig. 25. Dispersión gravimétrica del alimento de G. caerulescens en relación a . su tamaño en peso. Apozahualco, Chautengo, Mitla y Nuxco, Gro., México. Septiembre, 1973. 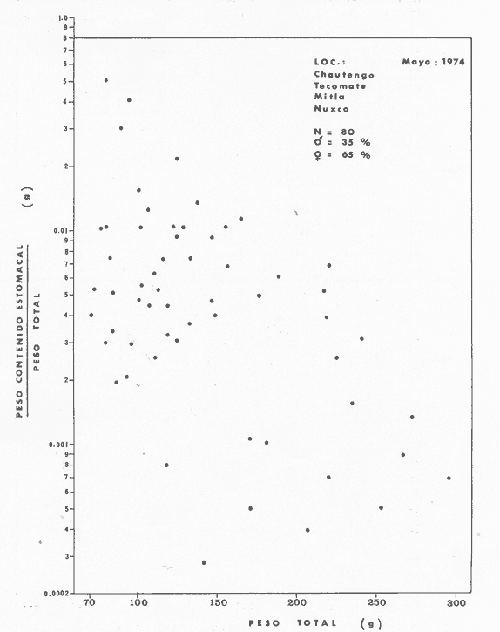 Fig. 26. Dispersión gravimétrica del alimento de G. caerulescens en relación a su tamaño en peso. Chautengo, Tecomate, Mitla. y Nuxco, Gro., México. Mayo, 1974. 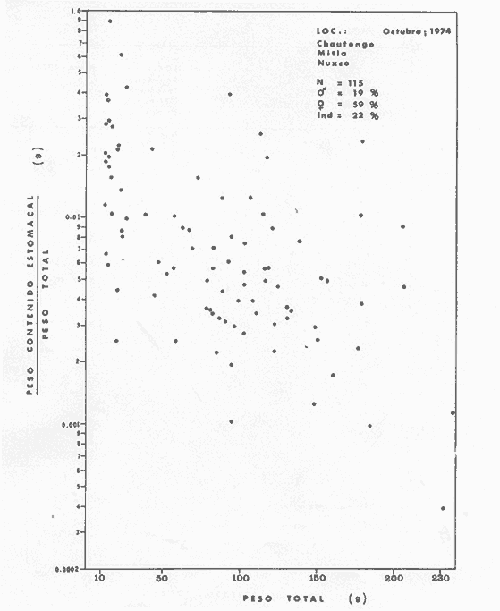 Fig. 27. Dispersión gravimétrica del alimento de G. caerulescens en relación a su tamaño en peso. Chautengo, Mitla y Nuxco, Gro., México. Octubre, 1974. 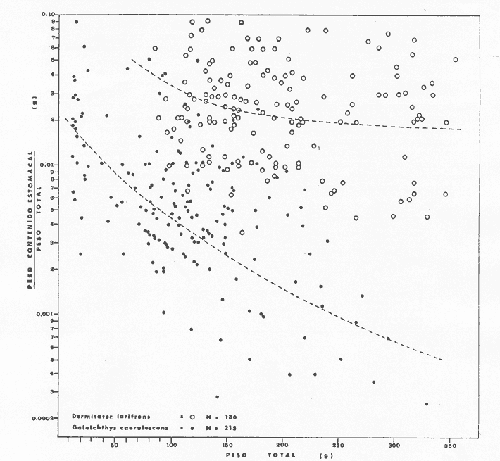 Fig. 28. Dispersión gravimétrica del alimento en relación al tamaño en peso del pez. G. caerulescens (puntos negros) D. latifrons (puntos blancos). Sistema lagunar costero de Guerrero, México. OBSERVACIONES SOBRE CRECIMIENTOFueron examinados 265 ejemplares que variaron entre 66.0 y 400.0 mm. de LT, y entre 4.9 y 927.4 g de PT respectivamente. 20 ejemplares colectados en septiembre de 1973 (Apozahualco, Chautengo, Mitla y Nuxco, figura 29) ; 130 ejemplares colectados en mayo de 1974 (Chautengo, Tecomate, Mitla y Nuxco, figura 30) y 115 ejemplares colectados en octubre de 1974 (Chautengo, Mitla y Nuxco, figura 3l). En las tres figuras citadas- se aprecia un marcado incremento en peso en relación al tamaño del pez y conforme se desarrolla gonádicamente. Sin embargo, el crecimiento en longitud es más rápido hasta los 160 180 mm, pero sin incremento en peso pronunciado. Posteriormente la curva sufre una inflección con lo cual el crecimiento en longitud es menos pronuncia do en relación al rápido incremento en peso a medida que avanza el periodo de desarrollo gonádico para la reproducción. Esta relación es común para muchas poblaciones de peces, puesto que el peso, es proporcional al cubo de la longitud (Beckman, 1945). Numeroso s individuos, no obstante, en fase gonádica VI, manifiestan un descenso en peso por un reciente desove. OBSERVACIONES SOBRE MADUREZEn las colectas de septiembre de 1973 (Fig. 29) se observa que después de los 200 mm de LT y 60 g de PT se inicia la aparición de ejemplares de fases gonádicas mayores de III. Esta fase gonádica se considera como adulta. En las colectas de mayo de 1974 (Fig. 30) se observan algunas hembras entre 180 y 200 mm de LT y de aproximadamente 50 g de peso total que ya iniciaron su desarrollo gonádico III. Al mismo tiempo se observan numerosos machos en fases gonádicas II que pueden alcanzar hasta 220 mm o más de LT y más de 70 g de PT que todavía no alcanzan la fase sexual adulta. 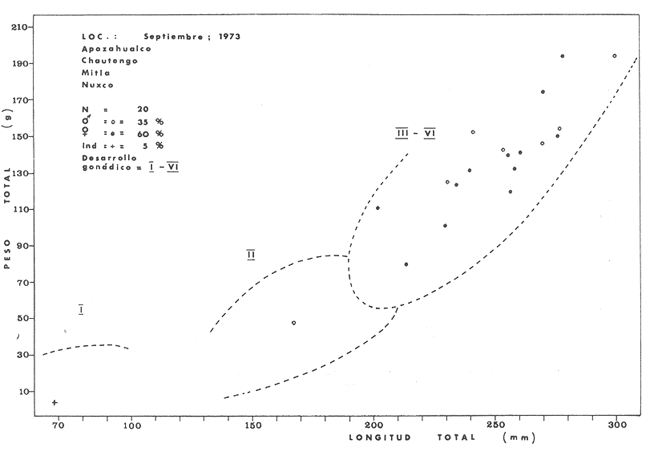 Fig. 29. Relación peso/longitud/ desarrollo gonádico, en G. caerulescens de Apozahualco, Chautengo, Mitla y Nuxco, Gro, México. 35% de machos y 60% de hembras. Septiembre, 1973. 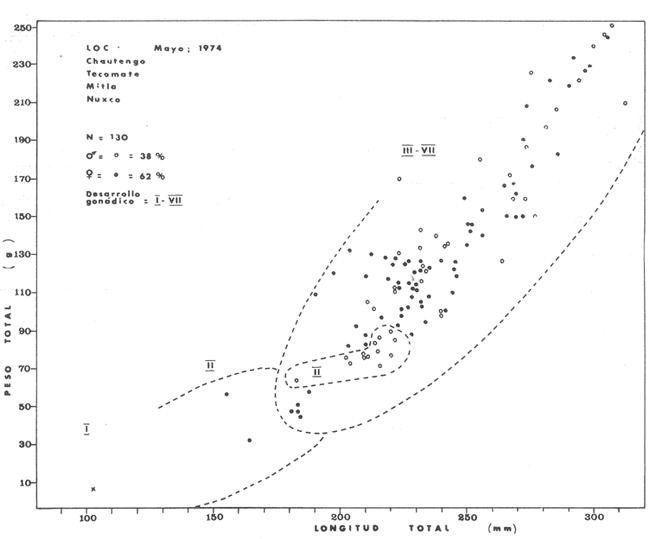 Fig. 30. Relación peso/longitud/ desarrollo gonádico, en G. caerulescens de Chautengo, Tecomate, Mitla y Nuxco. Gro., México. 38% de machos y 62% de hembras. Mayo, 1974. En las colectas de octubre de 1974 (Fig. 3 1) se observa la misma relación de la figura anterior, e incluso algunos machos pueden tener 90 g o más de PT sin alcanzar la madurez gonádica del estado III. Estas apreciaciones permiten decir en forma preliminar que la talla regular a la cual G. caerulescens alcanza el estado adulto, es de, aproximadamente, 200 mm de LT, donde aparentemente las hembras pueden madurar entre 180 y 200 mm de LT, pero los machos lo hacen entre 200 y 220 mm de LT. Después de los 220 mm de LT existe una mezcla de fases sexuales que van de IIIa VII lo que dificulta enormemente precisar la edad de los peces, su crecimiento, o si se trata de su primera, segunda o tercera etapa de reproducción. Se hace necesario estudios de los otolitos en el futuro. En las tablas 14 a 24 se señalan las relaciones morfométricas, gravimétricas, y volumétricas, el sexo y su fase gonádica, para los ejemplares considerados en las discusiones de crecimiento y madurez. OBSERVACIONES SOBRE REPRODUCCIÓN
Dimorfismo sexual1) En la parte dorsal de las aletas pélvicas, las hembras presentan una carnosidad, sostenida por un rayo cartilaginoso, que se torna de un fuerte color negro en la época del desove (Fig. 32 A) . En las hembras jóvenes esta modificación no es tan conspicua, así como tampoco en los machos en los cuales prácticamente desaparece. 2) En machos y hembras sexualmente maduros, de la misma talla, las hembras son más robustas del tronco. 3) Durante el periodo de incubación los machos modifican la morfología de la cavidad bucal para ampliarla. Esto se manifiesta por una depresión de la región hioídea que prácticamente se desarticula para volver a su posición normal después de la incubación (Fig. 32B y C). El pliegue carnoso de la parte dorsal de las aletas pélvicas es ligeramente triangular y se reduce un tanto después del desove intensificándose nuevamente durante un nuevo periodo de reproducción. González (1972) señaló observaciones a este respecto para G. caerulescens del noroeste de México. 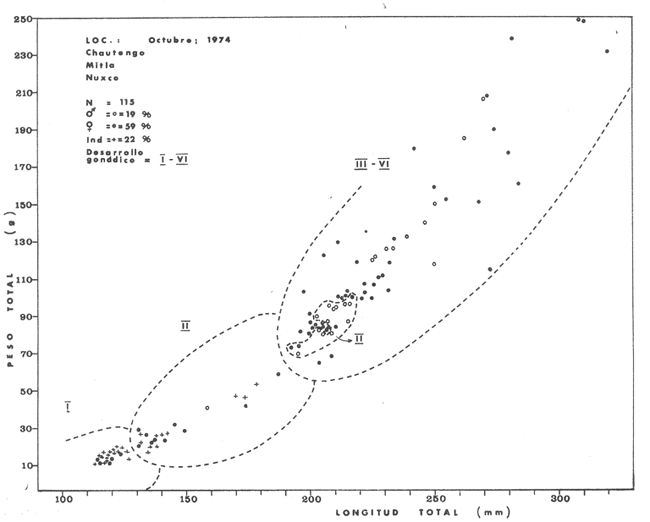 Fig. 31. Relación de peso/ longitud/ desarrollo gonádico, en G. caerulescens de Chautengo, Mitla y Nuxco, Gro., México. 19% de machos y 59% de hembras. Octubre, 1974.  Fig. 32. Dimorfismo sexual en G. caerulescens. A. Aleta pélvica derecha de una hembra de 430 mm de LT. Modificación de la superficie dorsal en las hembras sexualmente maduras durante el desove. 1 = cuerpo del pez, 2 = modificación carnosa de color negro y con un fuerte sostén cartilaginoso, 3 = rayos pélvicos. B. Cabeza de un macho de 280 mm de LT normal, en estado de descanso reproductivo. C. Cabeza de un macho de 285 mm de LT incubando 21 huevos en la cavidad bucal. Región hioí dea deprimida, ampliándose la cavidad bucal. Gudger (1916 y 1918) y Lee (1937) han señalado para Bagre marinus y para G. (= A.) felis respectivamente, unas modificaciones de la región hioídea de los machos que les permite ampliar la cavidad bucal. En nuestras observaciones sobre G. caerulescens se aprecia que los machos que se encuentran incubando presentan una conspicua depresión de la región hioídea, similar a esas otras especies de la familia. Tipo de reproducciónPodemos definirlos como peces ovíparos de gestación oral. Se reproducen sexualmente y después de la ovoposición los huevos son fertilizados por el macho en un proceso de fecundación externa. Nada se conoce del mecanismo por el cual el macho llevaría los huevos a su boca después de la fertilización de los mismos. Algunos autores piensan que los huevos no caerían al suelo puesto que su peso los hundiría fácilmente en el lodo y serían difícilmente recuperados por el macho y aun predados por otros organismos (Gudger, 1916 y 1918; Lee, 1931 y 1937; González, 1972). Sin embargo, Gunther (1947) aparentemente acepta la idea que para G. ( = A.) felis los huevos necesitan de un corto periodo en el agua para cementarse con una sustancia que los cubre inmediatamente después de ser expulsados por la hembra. Esta apreciación es muy interesante puesto que en nuestras observaciones, fueron colectados 42 huevos (Laguna de Nuxco) aglutinados, cementados fuertemente, y adheridos al pasto marino Ruppia maritima, frescos y recién desovados. Es probable que G. caerulescens necesite de un corto periodo (muy breve) de los huevos en el agua antes de ser llavados a la boca del macho. junto con esos huevos fue colectado un macho en estado de desarrollo gonádico V de 290 mm de LT y una hembra de 300 mm de LT con el orificio genital inflamado, sanguinolento y ligeramente evertido señalándose su reciente desove (octubre, 1974). Forma de reproducciónLee (1937) ha observado en G. (= A.) felis unas modificaciones peculiares en las aletas pélvicas de las hembras durante su desove aceptando que allí se sostienen los huevos mientras son fertilizados por el macho. Similares observaciones señala González (1972) para G. caerulescens. Yáñez-Arancibia (1975a) y observaciones de este estudio permiten precisar que las hembras de G. caerulescens acentúan mucho la carnosidad y el color negro de la parte dorsal de las aletas pélvicas para desempeñar, aparentemente, la misma función de su especie homóloga del Golfo de México. 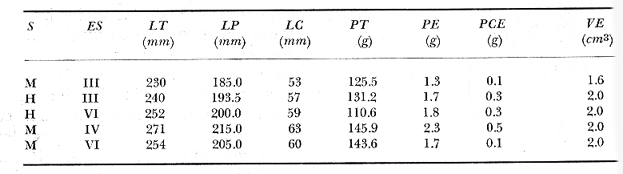 TABLA 14 RELACIONES, MORFOMÉTRICAS, GRAVIMÉTRICAS Y VOLUMÉTRICAS DE GALEICHTHYS CAERULESCENS (GUNTHER) EN APOZAHUALCO, (SEP. 1973) 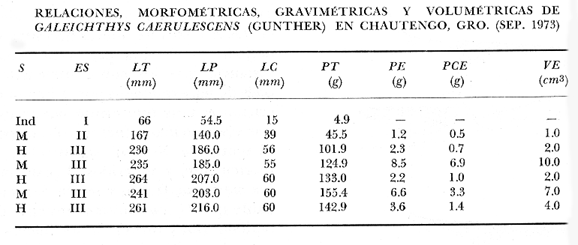 TABLA 15 RELACIONES, MORFOMÉTRICAS, GRAVIMÉTRICAS Y VOLUMÉTRICAS DE GALEICHTHYS CAERULESCENS (GUNTHER) EN CHAUTENGO, GRO. (SEP. 1973)  TABLA 16 RELACIONES, MORFOMÉTRICAS, GRAVIMÉTRICAS Y VOLUMÉTR.ICAS DE GALEICHTHYS CAERULESCENS (GUNTHER) EN MITLA, GRO. (SEP. 1973)  TABLA 17 RELACIONES, MORFOMÉTRICAS, GRAVIMÉTRICAS Y VOLUMÉTRICAS DE GALEICHTHYS CAERULESECENS (GUNTHER) EN NUXCO, GRO. (SEPT. 1973) Como todas las especies de la familia, el macho incuba los huevos en la cavidad bucal. Gudger (1912, 1916 y 1918) señala el número de huevos que G. (= A.) felis puede mantener en su boca, reportando un máximo de 55. González (1972) ha reportado entre 7 y 21 peces pequeños en la boca de los machos de G. caerulescens de las lagunas litorales del noroeste de México. En nuestros estudios se han encontrado entre 8 y 25 huevecillos y pequeñas larvas en la boca de algunos machos, permaneciendo allí hasta que los pequeños juveniles han absorvido completamente la bolsa del vitelo. Un macho de 230 mm de LT colectado en mayo de 1974 en Mitla presentaba 18 larvas en su boca, de 45 mm de longitud promedio cada una y que en total ocupaban un volumen de 18 cm3 dentro de la cavidad oral del macho. Época de reproducciónLee (1937) y Gunther (1947) han señalado que G. (= A.) felis del Golfo desova en junio y González (1972) indica que G. caerulescens aparentemente se reproduce en diferentes meses del año, intensificándose entre enero y abril. En nuestros estudios se han encontrado machos incubando huevos y protegiendo larvas en sus bocas, preferentemente en los meses de septiembre, octubre y mayo. Es probable que G. caerulescens se reproduzca con una intensidad bianual, pero no está claro su ciclo de reproducción. Las gónadas que presentan huevos maduros a instantes de desovar presentan también una gran cantidad de huevos en formación de 1.0 mm de diámetro, en un cantidad aproximadamente el doble de los huevos maduros. Es probable que ellos correspondan al estoc de reserva para el supuesto segundo desove anual. Como hemos encontrado larvas con la bolsa del vitelo casi absorvida, tanto en mayo como en octubre, y consideran-do que el desarrollo embrionario puede tardar un mes, es probable que el principal desove y fertilización de los huevos ocurra en marzo y en agosto. 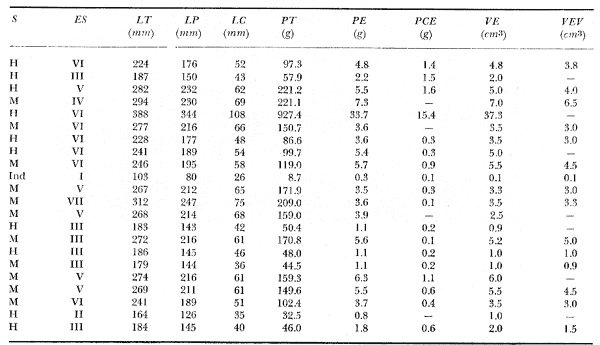 TABLA 18 RELACIONES MORFOMÉTRICAS, GRAVIMÉTRICAS Y VOLUMÉTRICAS DE GALEICHTHYS CAERULES-CENS (GUNTHER) EN CHAUTENGO, GRO. (MAYO, 1974) 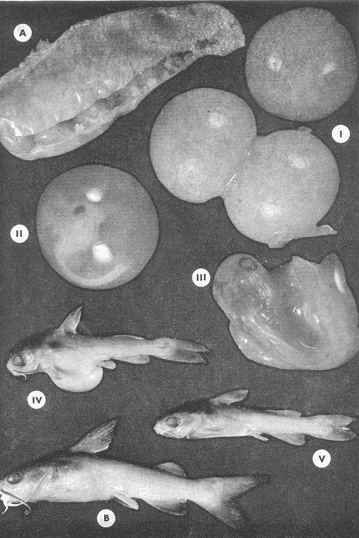 Fig. 33. Desarrollo embrionario de G. caerulescens en el sistema lagunar costero de Guerrero, México. A. Gónadas grávidas de una hembra de 300 mm. de LT en fase gonádica V. Se muestra la gónada derecha de 66 mm de longitud con un corte de su pared para indicar numerosos huevos en su interior; 16 huevos por desovar la gónada derecha y 14 la izquierda. I. Etapa de desarrollo ontogénico 1; huevos de 9 mm de diámetro. II. Etapa de desarro ontogénico II; embrión de 14 mm de LT. III. Etapa de desarrollo ontogénico III; larva de 25 mm de LT. IV. Etapa de desarrollo ontogénico IV; larva de 37 mm de LT. V. Etapa de desarrollo ontogénico V; larva de 42 mm de LT. B. Primer juvenil libre nadador. 55 mm de LT. Explicación detallada en el texto y resumen en la tabla 25. 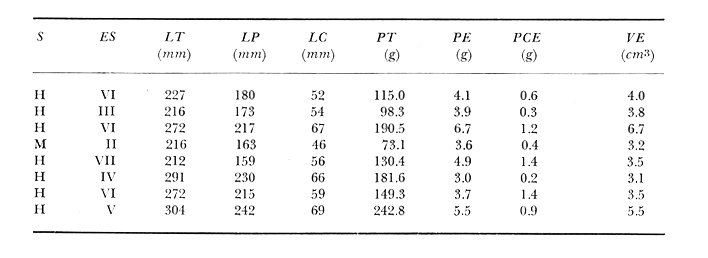 TABLA 19 RELACIONES, MORFOMÉTRICAS, GRAVIMÉTRICAS Y VOLUMÉTRICAS DE GALEICHTHYS CAERULESCENS (GUNTHER) EN TECOMATE, GRO. (MAYO, 1974) FecundidadEl análisis de gónadas maduras ha mostrado entre 20 y 35 huevos a punto de ser desovados (entre 10 y 17 huevos en cada gónada). Examen de 200 huevos indica un volumen promedio de 0.66 cm3, un peso promedio de 0.62 g, y un diámetro promedio de 0.9 mm, para cada huevo. En sentido estricto la fecundidad es aparentemente baja, pero biológicamente existen mecanismos que aseguran una alta supervivencia de los huevos y larvas constituyéndola en la especie más abundante en número y biomasa del sistema lagunar de Guerrero, como son: a) una gran proporción de hembras en las poblaciones, b) un amplio periodo de reproducción, c) huevos con gran cantidad de vitelo y de gran tamaño, d) una efectiva protección de huevos y larvas durante la gestación oral por parte de los machos, y e) un probable doble desove anual. Desarrollo de los huevos y larvasColectas de los meses de septiembre, octubre y mayo han permitido reunir una buena colección de huevos y estados larvarios de G. caerulescens. Esta colección de 367 unidades (huevos y larvas) ha mostrado que desde el estado de gónada grávida en estado V hasta el juvenil libre nadador, se distinguen V Etapasde desarrollo que caracterizan su ontogenia (Fig. 33). Estas etapas han sido consideradas en forma preliminar encontrándose actualmente en ejecución estudios osteológicos e histológicos de las etapas larvarias. La Etapa I se caracteriza por los huevos recientemente desovados; los más avanzados en su desarrollo se encuentran en el estado de mórula y puede observarse un pequeño grado de segmentación del vitelo. La segmentación es más nítida cerca del polo animal y difusa hacia el lado contrario. Los huevos se encuentran aglutinados en una masa ligeramente compacta adheridos unos a otros por estructuras similares a "ventosas" que presenta la membrana capsular. La membrana capsular es transparente y fueron contadas hasta 7 ventosas en un huevo. La Etapa II se caracteriza por los huevos libres unos de otros e incorporados definitivamente a la cavidad oral de los machos. Se observa el avance del blastodermo hacia el polo animal, dando lugar a la formación del embrión y cerrándose el blastoporo se esbozan las cápsulas ópticas (de rápido desarrollo) y las primeras pigmentaciones de los ojos. El embrión mide 14 mm de LT presentando una torción semi-circular con la cabeza muy deprimida y la zona caudal se encuentra recostada sobre uno de sus flancos. La cabeza mide 3.5 mm de ancho, 4.0 mm de longitud; la órbita ocular 1.5 mm en el sentido antero posterior. Se distingue claramente el cuerpo y la formación de las aletas y sus rayos. Se observan numerosos miotomos. Exceptuando los ojos, todo el cuerpo carece de pigmentación. La Etapa III puede definirse como el inicio de los estados larvarios. El embrión se encuentra completamente formado y los de desarrollo más avanzado pueden desprender la cabeza y la cola del huevo, pero conservando la torción semi-circular. Se distinguen muy claramente todos los rayos y espinas de las aletas. Cápsulas ópticas bien desarrolladas. Los tres pares de barbillas bien desarrollados. La cabeza sigue siendo deprimida y mide 4.5 mm de ancho y 6.0 de longitud; la órbita ocular 2.7 mm en el sentido antero posterior. El embrión mide 25 mm de LT como máximo. Las barbillas maxilares miden 4.0 mm y se extienden hasta la base de la espina pectoral o poco más; las barbillas mandibulares miden 3.1 mm de longitud y 2.3 las mentonianas. La boca no es funcional y mide 3.5 mm de ancho. La aleta dorsal 3.5 mm de altura, y la misma longitud las pectorales. Se pueden contar hasta 50 miotomos. Se presenta pigmentación de melanóforos dispersos en la región de la fontanela y parte anterior dorsal del cuerpo. Las aletas carecen absolutamente de pigmentaciones. Vasos sanguíneos muy marcados sobre el vitelo. La Etapa IV muestra a la larva con la bolsa del vitelo esférica y reabsorviéndose rápidamente. La larva mide 37 mm de LT. La cabeza es menos deprimida midiendo 7.8 mm de ancho y 9.5 de longitud; la órbita ocular 3.0 mm en el sentido antero posterior. Las barbillas maxilares miden 8.0 mm y se extienden hasta la mitad de la base de las aletas pectorales; las barbillas mandibulares miden 4.5 min de longitud y 3.5 las mentonianas. La boca es ligeramente funcional y mide 5.0 mm de ancho. La aleta dorsal 6.0 mm de altura y la misma longitud las pectorales. Aleta adiposa proporcionalmente grande. Se pueden contar hasta 55 miotomos. El cuerpo de la larva es rectilíneo desprendiéndose claramente la cabeza y la cola. La pigmentación es intensa en las fontanelas y parte dorsal de la cabeza' así como también en los mioseptos. Todas las aletas y el dorso de las barbillas maxilares con puntuaciones dispersas de melanóforos. La Etapa V muestra a la larva con la bolsa del vitelo prácticamente absorvida. La larva mide 42 min de LT. La cabeza definitivamente menos deprimida que en las etapas anteriores y mide 9.0 mm de ancho y 9.5 mm de longitud; la órbita ocular 3.0 mm en el sentido antero posterior. Las barbillas maxilares miden 8.5 mm de longitud y se extienden hasta la mitad de la base de las aletas pectorales; las barbillas mandibulares 6.5 mm de longitud y 5.0 mm las mentonianas. La boca es funcional y mide 5.8 mm de ancho. La aleta dorsal mide 7.0 mm de altura y 6.9 la longitud de las pectorales. Se pueden contar hasta 59 miotomos. La pigmentación es muy definida con melanóforos dispersos en la parte dorsal de las barbillas maxilares, en los ojos, en el dorso de la cabeza, en las aletas; aparecen las primeras pigmentaciones en la parte dorsal de las aletas pélvicas. La aleta dorsal adiposa se reduce de tamaño proporcionalmente al cuerpo. Ningún estudio anterior de G. caerulescens refiere alguna descripción de huevos y larvas, de manera que es imposible tener un patrón de comparación. Esto determina que la definición de nuestras etapas sea considerada preliminar y sujeta a estudios posteriores, actualmente en ejecución. Con anterioridad Gudger (1912, 1916 y 1918) ha descrito parcialmente algunos huevos y larvas de G. (= A.) felis señalando que los huevos miden un diámetro promedio de 19 mm y la larva presenta una longitud total de 57 mm. Esto determina que los huevos de felis tengan el doble del tamaño de los de caerulescens y la larva de felis tenga 14 mm más que la larva Etapa V de caerulescens; agrega el mismo autor que el volumen promedio de los huevos de felis es de más de 3 cm3 y que los juveniles al final del periodo de incubación miden entre 85 y 100 mm de LT. Ambos desarrollos coinciden en la profusa irrigación sanguínea del huevo y vitelo, dándole un conspícuo color rojizo al enmalle que cubre al vitelo. Al estado actual de nuestros estudios nada podemos decir del periodo total de gestación (duración), pero Gudger (op. cit.) ha señalado que G. (= A.) felis dura alrededor de 70 días en su periodo de gestación oral. En la tabla 25 se presentan rasgos comparativos en el desarrollo de huevos y larvas de G. (= A.) felis y G. caerulescens. OBSERVACIONES SOBRE RELACIONES ECOLÓGICASEsta especie es la más abundante en número y biomasa y una de las mejor adaptadas fisiológica y morfológicamente al sistema lagunar costero de Guerrero. De la misma manera es una de las especies más abundantes en las lagunas costeras del noroeste de México. 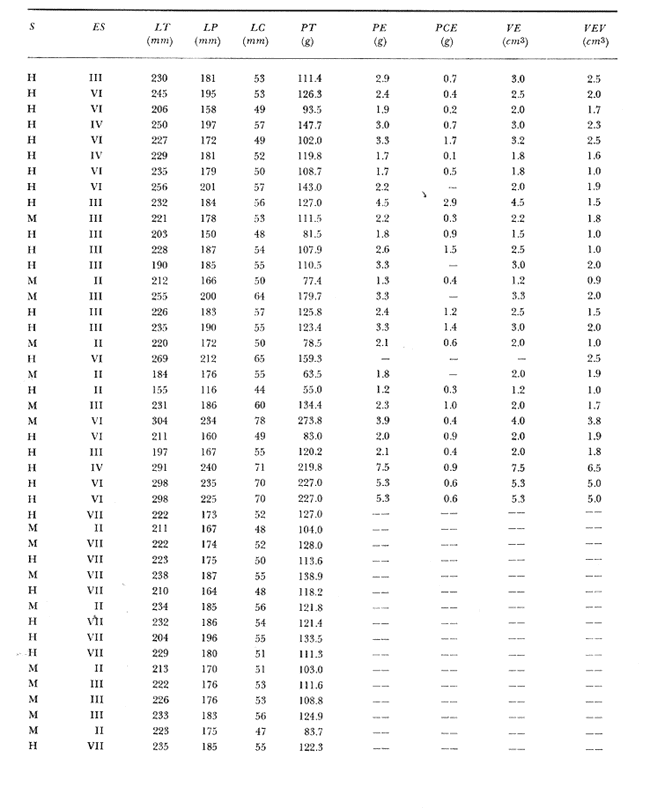 TABLA 20 RELACIONES MORFOMÉTRICAS, GRAVIMÉTRICAS Y VOLUMÉTRICAS DE GALEICHTHYS CAERULES CENS (GUNTHER) EN Mitla, GRO. (MAYO, 1974) 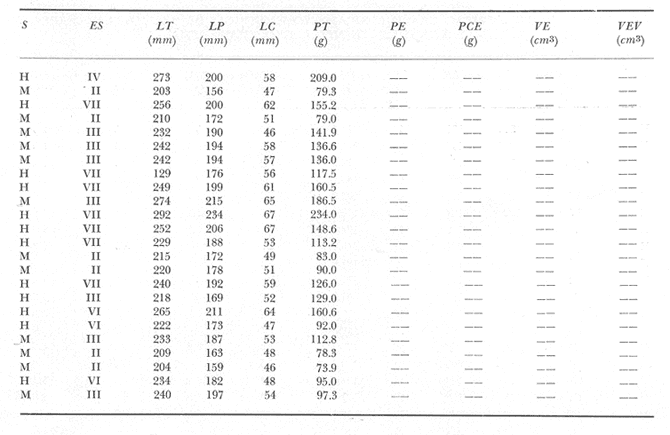 TABLA 20 (Continuación) 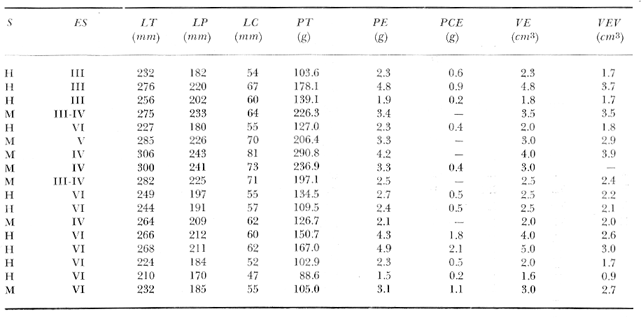 TABLA 21 RELACIONES MORFÓMETRICAS Y VOLUMÉTRICAS DE GALEICHTHYS CAERULESCENS (GUNTHER) EN NUXCO, GRO.. (MAYO 1974) 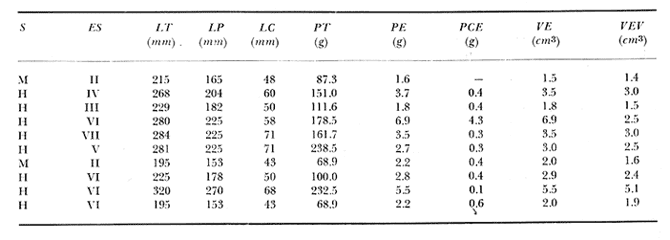 TABLA 22 RELACIONES MORFOMÉTRICAS, GRAVIMÉTRICAS Y VOLUMÉTRICAS DE GALEICHTHYS CAERULES CENS (GUNTHER) EN CHAUTENGO, GRO. (OCT. 1974) 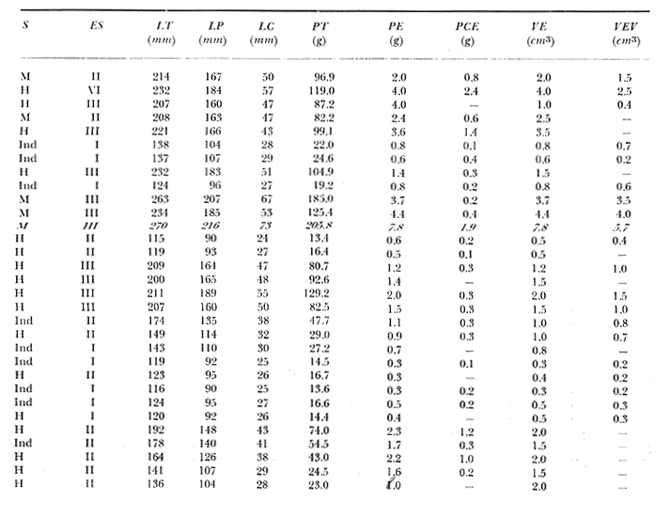 TABLA 23 RELACIONES MORFOMÉTRICAS, GRAVIMÉTRICAS Y VOLUMETRICAS DE GALEICHTHYS CAERULESCENS (GUNTHER) EN MITLA, GRO. (OCT. 1974) 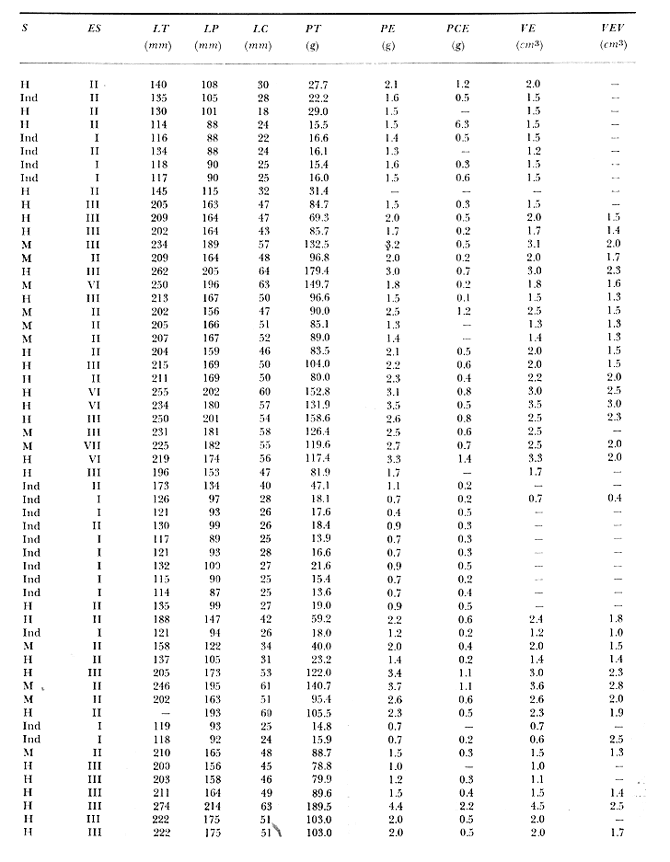 TABLA 23 (Continuación) 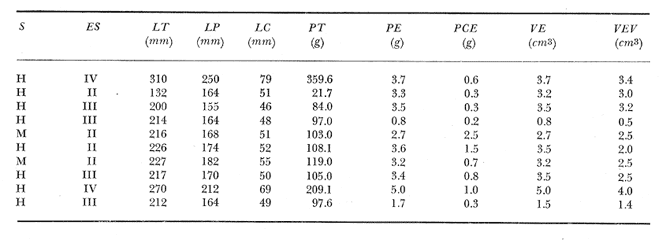 TABLA 23 (Continuació n) 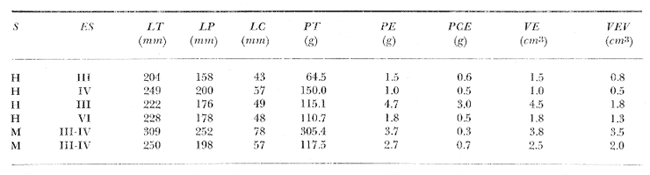 TABLA 24 RELACIONES MORFOMÉTRICAS, GRAVIMÉTRICAS Y VOLUMÉTRICAS DE GALEICHTHYS CAERULES CENS (GUNTHER) EN NUXCO, GRO. (OCT. 1974) De acuerdo a Yáñez-Arancibia (1975 a y 1975 c) correspondería a una especie típicamente estuarina, de origen dulceacuícola, que pudiendo o no realizar migraciones, completa todo su ciclo de vida en el interior de las lagunas y estuarios del Pacífico. De las observaciones de González (1972), Stuardo et al., (1974) y Yáñez-Arancibia, (1974 y 1975 a) podemos establecer que G. caerulescens vive sin dificultad entre rangos de temperatura que van de 19 a 35º C, y entre rangos de salinidades que van de 0 a 45% y aún más. Sin embargo, son muy pocos los ejemplares que se colectan a salinidades mayores de 35% En la figura 34 se observan algunos bagres o "cuatetes" en altas salinidades durante el periodo de secas del sistema lagunar de Guerrero y definido como periodo ecológico (2) por Yáñez-Arancibia (1975 a y 1975 b) . Las presiones ambientales por el aumento -de la salinidad y la temperatura durante ese periodo son intensas y sólo algunas especies logran subsistir hasta que se inicia el periodo de lluvias. Sin embargo, considerando su alta capacidad euritérmica y euribalina, muchos ejemplares de "cuatetes" mueren durante el periodo (2) (Fig. 2), por presiones de osmorregulación en salinidades extremas de 76% (Fig. 34). Darnell (1958), Springer y Woodburn (1960), W. E. Odum y Heald (1972), J. W. Day et al. (1973 a y 1973 b) han señalado que G. (= A.) felis es una especie carnívora de Segundo y Tercer Orden. Por consiguiente de acuerdo a nuestros estudios y a Yáfiez-Arancibia (1975 a) G. caerulencens juega ecológicamente un papel similar en los ecosistemas estuarinos y lagunares del Pacífico de México.  Fig. 34. Estado agónico de grandes poblaciones de G. caerulescens por aumento considerable de la temperatura y salinidades hasta de 76°/oo durante la época de secas en el sistema lagunar de Guerrero. (Fotografía gentileza del Dr. J. Stuardo.)  TABLA 25 RASGOS COMPARATIVOS EN EL DESARROLLO DE HUEVOS Y LARVAS Un hecho notable es que esta especie en el sistema lagunar costero de Guerrero no sufre presiones de predación por parte de otros peces; pero sí se transforma en un "exportador de energía" del sistema al ser predado por: a) el hombre, y b) ciertas aves. Sus hábitos son bentónicos, es un activo nadador y escudriñador del fondo, se agrupa en densos cardúmenes, es un gran predador y está provisto de 3 fuertes espinas aserradas (aleta dorsal y pectorales) con un alto poder tóxico al causar una herida. Es la especie mejor adaptada para vivir en el sistema lagunar de Guerrero. Se distribuye indistintamente en el interior de las lagunas, o cerca de las desembocaduras de distributarios, o en las orillas de manglares, o cerca de la boca. Es muy abundante en las lagunas de Chautengo, Tecomate, Tres Palos, Mitla y Nuxco, en comparación con las otras lagunas estudiadas. Se reproduce a salinidades bajas (menos de 15%) y como la especie también habita la costa marina de Guerrero, muchos ejemplares penetran a los estuarios buscando salinidades menores para reproducirse. Conclusiones1. Galeichthys caerulescens es una especie carnívora, consumidor de Segundo y Tercer Orden. 2. Su espectro trófico se compone de peces, decápodos, insectos, moluscos, anélidos, isópodos, nemátodos, copépodos, ostrácodos, detritus y materia orgánica, vegetales y sedimentos inorgánicos. 3. Existe variación cuali- y cuantitativa del espectro trófico y dependiendo de: a) la disponibilidad del alimento, b) la estación del año, c) la localidad y sus características físico químicas, y d) la edad del pez. 4. La especie crece rápidamente hasta los 180 mm de LT pero sin incremento en peso pronunciado. Posteriormente el incremento en peso es muy marcado en relación a la talla que crece con menos velocidad. 5. Las poblaciones alcanzan la madurez gonádica de fase III a los 200 mm LT promedio; pero las hembras maduran antes que los machos (180 a 200 y 200 a 220 mm de LT respectivamente). 6. Existe un marcado dimorfismo sexual en relación a la actividad fisiológica de la reproducción. Es mayor la proporción de hembras que de machos en las poblaciones. Se reproducen por grandes huevos de abundante vitelo, fertilizados externamente e incubados en la cavidad oral de los machos. El desarrollo ontogénico pasa por 5 etapas embrionarias bien definidas morfológicamente. El periodo de reproducción es muy amplio y se presentan la mayor cantidad de huevos y larvas en incubación durante los meses de mayo y octubre. Se reproducen a salinidades menores de 15 %. 7. La especie no sufre presiones de predación por otros peces; pero es un exportador de energía del ecosistema lagunar al ser predada por: a) el hombre, y b) ciertas aves acuáticas. 8. Tolera rangos de temperatura de 19 a 35º C y rangos de salinidades de 0 a 45% 9. Estas características biológicas y ecológicas la convierten en una importante especie del sistema lagunar costero de Guerrero, con grandes perspectivas de ser cultivada. Estudios ya iniciados se abocan a este problema en forma particular. AgradecimientosLos autores desean agradecer sinceramente a José Stuardo y Richard Nugent, expertos en biología marina de OEA y UNESCO respectivamente, por la revisión cuidadosa del manuscrito y sus valiosas sugerencias y comentarios. A Gerardo Green su estímulo, valiosas críticas y acertadas sugerencias. A José L. Rojas las fací lidades y apoyo otorgados en el Laboratorio de Ictiología de la UNAM. Este estudio fue financiado en gran medida por los contratos de estudios Nº OC-E-03-74 y Nº OC-E-03-75 celebrados entre la Comisión del Río Balsas de la Secretaría de Recursos Hidráulicos y el Centro de Ciencias del Mar y Limnología de la UNAM. LITERATURAALBERTINE-B, J. Biologie des stades juveniles de téleostésne Mugilidae Mugil auratus Risso 1810, Mugil capito Cuvier 1829 et Mugil saliens Risso 1810. I. Régime alimentaire. Aquaculture 1973 251-266 2 ÁLVAREZ DEL V., J. Peces Mexicanos (Claves) Inst. Nal. Invest. Biol. Pesq., Com. Nal. Consult. Pec. 1970 166 p., 62 figs. AMEZCUA-LINARES, F. Tesis Profesional. Aportación al conocimiento de los peces del sistema de Agua Brava, Nayarit. Fac. Ciencias, Univ. Nal. Autón. México 1972 209 p., 12 tablas, 14 láms. AOYAMA, T. Concerning the survey of food habits, specially the survey of food habits of benthos fishes wich were caught at Yellow Sea and East China Sea. Japanese Materials. 1956 BECKMAN, W C. The lenght-weight relationship, factor for conversion between standar and total lenght, and coefficients of condition for seven Michigan fishes. Trans. Amer. Fish. Soc. 1945 237-256 75 BERDEGUE, J. Peces de importancia comercial en la costa noroccidental de México. Secr. Marina Direc. Gral. Pesc. Ind. Con., México 1956 345 p., 206 figs., 2 map. CARRANZA, J. 3er. Informe de Contrato de Estudios No. EI-69-51 Informe preliminar sobre la alimentación y hábitos alimenticios de las principales especies de peces de las zonas de los Planes Piloto Yavaros y Escuinapa. Univ. Nal. Autón. México, Inst. Biol. y SRH 1969 28 p., 5 figs. 1 ---, Informe final del Contrato de Estudios Nº EI-69-51 Informes final sobre la primera etapa del estudio de la fauna ictiológica y depredadores del camarón en las lagunas y esteros de los Planes Piloto Escuinapa, Sin., y Yavaros, Son. Univ. Nal. Autón. México, Inst. Biol. y SRH 1970 28 p., 5 figs. CARRANZA, J. F. AMEZCUA-LINARES 2da. Parte del 2do. Informe del Contrato de Estudios Nº NAY-EST-7 Plan Nayarit, SRH Informe de avance de trabajo, incluyendo información ecológica básica, datos de distribución de postlarvas e informe preliminar sobre fauna ictiológica. Univ. Nal. Autón. México, Inst. Biol. y SRH 1971a 58-80, 1 fig., 1 tabla. CARRANZA, J. F. AMEZCUA-LINARES 2da. Parte del Informe final del Contrato de Estudios Nº NAY-EST-7 Plan Nayarit, SRH. Resultados finales de hidrología, plancton y fauna ictiológica en el sistema Teacapán-Agua Brava (octubre 1970-junio 1971). Univ. Nal. Autón. México. Inst. Biol., y SRH 1971b 88-115, 13 tablas. CASTRO, J. L. Aspectos zoogeográficos de los peces marinos que penetran aguas continentales de México. Mem. VI Congr. Latinoam. Zool. México (en prensa). 1974 CASTRO, J. L. MA. DE J. PARRA F. DE LACHICA Los peces de las lagunas oriental y occidental, Oaxaca, y sus relaciones con la temperatura y salinidad. Mem. V Congr. Nac. Oceanogr., México (en prensa). 1974 DARNELL, R. M. Food habits of fishes and larger invertebrates of Lake Pontchartrain, Louisiana, an estuarine community. Publ. Inst. Mar. Sci., Univ. Texas 1958 353-416 5 ---, Trophic spectrum of an estuarine community based on studies of Lake Pontchartrain, La. Ecology 1961 553-568 12 (3) ---, The organic detritus problem. Estuaries G. M. Lauff. Publ. Am. Ass. Adv. Sci. 1967a 374-375 83 ---, Organic detritus in relation to the estuarine ecosystem. Estuaries G. M. Lauff Publ. Am. Ass. Adv. Sci. 1967b 397-407 83 DAY, J. W. W. G. SMITH C. S. HOPKINSON Proc. Coastal Marsh añd Estuary Symposium. Some trophic relationships of rnarsh and estuarine areas. Louisiana State University Baton Rouge, La. 1973a 115-135 jul. 1972 DAY, J. W. W. G. SMITH P. WAGNER W. STOWE Community structure and carbon budget of a salt marsh and shallow bay estuarine system in Louisiana. Center for Wetland Resources. Louisiana State University, Baton Rouge, La. 1973b 79 p. Publ. No. LSU-56-7204 GONZÁLEZ, L. I. Tesis profesional. Aspectos biológicos y distribución de algunas especies de peces de la familia Ariidae de las lagunas litorales del noroeste de México. Fac. Ciencias, Univ. Nal. Autón. México 1972 88 p., 33 figs., 30 tablas. GUDGER, E. W. Oral gestation in the graff-topsail Catfish, Felichthys felis. Science 1912 192 35 (892) ---, The graff-topsail, Felichthys felis, a sea catfish that carries its eggs in its mouth. Zoologica 1916 123-158 2 (5) ---, Oral gestation in the gaff-topsail catfish Felichthys felis. Carn. Inst. Wash. Publ. 1918 25-52 252 GUNTHER, G. Studies on marine fishes of Texas. Pub1s. Inst. mar. Sci., Univ. Tex. 1945 1-190 1 (1) GUTIERREZ, M. A. CARRANZA Convenio Comisión del Río Balsas Subprograma de Geología. Informe Final de la 2da. Etapa del Programa de Uso de la Zona Costera de los Estados de Michoacán y Guerrero. SRH y Centro de Ciencias del Mar y Limnología, UNAM México 1975 43 p. figs. texto. HARRIS A. H. C. D. ROSE Shrimps predation by the sea catfish Galeichthys felis. Trans. Am. Fish. Soc. 1968 503-504 97 (4) HESTER, J. M. B. J. COPELAND Nekton population dynamics in the Albermarle Sound and Neuse River Estuaries. A University of North Carolina Sea Grant Program Publication UNC-SG-75-02 1975 129 p. KJELSON, M. D. R. COLBY Estimating the absolute abundance of estuarine fish population. Estuarine Research Federation Galveston, Texas, 6-9 Oct. 1975 (en prensa). 1975 KNAPP, F. T. Menhaden utilization in relation to the conservation of food and game fishes of the Texas Gulf coast. Trans. Am. Fish. Soc. 1949 137-144 79 LAEVASTU, T. Manual de métodos de biología pesquera. Acribia España Publicación FAO. 1971 243 p. LANKFORD, R. R. Informe del estudio de reconocimiento de la región costera de los Estados de Michoacán y Guerrero. Subprograma de Geología. Descripción general de la zona costera de Guerrero y Michoacán. Informe Centro de Ciencias del Mar y Limnología, UNAM 1974. 42 p. ---, Coastal lagoons of México. Their origin and classification. Estuarine Research Federation. Galveston, Texas (en prensa). 1975 LEE, G. Oral gestation in the marine six-whiskered catfish, Galeichthys felis. Anat. Rec. 1931 60 51 (1) ---, Oral gestation in the marine Catfish, Galeichthys felis Copeia 1937 44-56 1 LICEA-DURÁN S. E. GÓMEZ M. E. GÓMEZ Informe Final de la 2da. Etapa del Programa de Uso de la Zona Costera de Michoacán y Guerrero. Contrato No. OC-E-03-74 Informe de avance del estudio del fitoplancton en 5 lagunas del Estado de Guerrero (Resultados Preliminares), noviembre 1974 Comisión del Río Balsas, SRH y Centro de Ciencias del Mar y Limnología, UNAM, México 1975 27 p., 7 tablas, 3 figs., 3 láms. NIKOLSKY, G. V. The Ecology of Fishes. Academic Press, London New York 1963 352 p. NIXON, S. W. C.A. OVIATT Ecology of a New England salt Marsh. Ecol. Monogr. 1973 463-498 43 (4) ODUM, E. P. A. DE LA CRUZ Detritus as a major components of ecosystems. A. I. B. S. Bull. 1963 39-40 13 (3) ODUM, W. E. Pathways. of energy flow in a South Florida estuary. Ph. D. Dissertation Univ. of Miami. Sea Grant Program Tech. Bull. 1971 162 p. 7 ODUM, W. E. E. J. HEALD Trophic analyses of an estuarine mangrove community. Bull. mar. Sci. 1972 671-738 22 (3) PINKAS, L. M. S. OLIPHANT I. L. K. IVERSON Food habits of albacore, blue fin tuna and bonito in California waters. Department of fish and Game, California, Fish. Bull. 1971 1-105 152 RAMÍREZ G., R. Estudio ecológico preliminar de las lagunas costeras cercanas a Acapulco. Revta. Soc. mex. Hist. Nat. 1952 199-218 13 RAMÍREZ H., E. J. PÁEZ Investigaciones ictiológicas en las costas de Guerrero. I. An. Inst. Nal. Invest. Biol. Pesq., México 1965 327-353 1 REID, G. K. An ecological study of the Gulf of México fishes in the vecinity of Cedar Key, Florida. Bull. mar. Sci. Gulf Caribb. 1954 1-94 41 (1) SMITH, H. M. The fishes of North Carolina. Geol. and Econ., Surv. 2 Raleigh, N. C. 1907 453 p. SIC. Situación actual y posibilidades de la pesca en Guerrero. Secretaría de Industria y Comercio, Comisión Nacional Consultiva de Pesca México 1970 36 p. SPRINGER, V. G. K. D. WOODBORN An ecological studies of the fishes of the Tampa Bay Area. Prof. Pap. Ser. Mar. Lab. Fla. 1960 104 p. (1) SRH. Informe de la Comisión Interdisciplinaria a la laguna de Chautengo, Gro. Secretaría de Recursos Hidráulicos, Dirección de Acuacultura. 1975 STUARDO, J. A. MARTÍNEZ-GUERRERO Resultados generales de una prospección de los recursos biológicos y pesqueros del sistema lagunar costero de Guerrero, México. Acta Politécnica Mexicana 1975 99-115 16 (72) STUARDO, J. M. VILLARROEL Aspectos ecológicos y distribución de los moluscos en las lagunas costeras de Guerrero, México. An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México 1976 65-90 3 (1) STUARDO, J. J. ESTÉVEZ Informe Final de la 2da. Etapa del Programa Uso de la Zona Costera de los Estados de Michoacán y Guerrero. Aspectos generales de la biología y ecología del "mejillón de laguna" Mytella strigata (Hanley) en dos lagunas costeras de Guerrero, México. Convenio Comisión del Río Balsas, SRH y Centro de Ciencias del Mar y Limnología, UNAM, México. Contrato No. OC-E03-74. 1975 750 p. STUARDO, J. A. MARTINEZ L. A. YÁÑEZ J. A. WEINBORN J. RUIZ Prospección de los recursos biológicos y pesqueros del sistema lagunar de Guerrero y, en parte, del litoral rocoso de Michoacán. An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México (en prensa). 1974 VILLARROEL, M. Informe Final de la 2da. Etapa del Programa de Uso de la Zona Costera de Michoacán y Guerrero. Relación entre macroinvertebrados bentónicos (especialmente moluscos) y sedimentos en tres lagunas del Estado de Guerrero, México. Convenio Comisión del Río Balsas, SRH y Centro de Ciencias del Mar y Limnología, UNAM, México. Contrato Nº OC-03-74. 1975 750 p. WARME, J. E. L. A. SÁNCHEZ Sedimentary patterns in west coast lagoons. Estuarine Research Federation. Galveston, Texas (en prensa) 1975 WEINBORN, J. A. Prospección preliminar de la fauna carcinológica en el sistema lagunar costero del Estado de Guerrero y litoral sur del Estado de Michoacán, con referencia especial a las especies de importancia económica. Centro Cienc. del Mar y Limnol., Univ. Nal. Autón. México. Problema de Investigación 1974 180 p., 8 tablas, 32 figs., 10 láms. YÁÑEZ-ARANCIBIA, L. A. Prospección preliminar de la fauna ictiológica en el sistema lagunar costero del Estado de Guerrero (Pacífico Central de México). Centro Cien. del Mar y Limnol. Univ. Nal. Autón. México. Problema de Investigación 1974 199 p., 2 tablas, 31 figs., 14 láms. ---, Informe Final de 2da. Etapa del Programa de Uso de la Zona Costera de Michoacán y Guerrero. Relaciones tróficas de la fauna ictiológica del sistema lagunar costero de Guerrero y aspectos parciales de dinámica de poblaciones de los peces de importancia comercial. 230 p., 104 tablas, 71 figs. Convenio Comisión del Río Balsas, SRH y Centro de Ciencias del -Mar y Limnología, UNAM, México, Contrato No. OC-E-03-74. 1795a 750 p. ---, Observaciones sobre Mugil curema en áreas naturales de crianza, México. Alimentación, Crecimiento, Madurez y Relaciones Ecológicas. An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México 1975b 92-124 3 (1) ---, Sobre los estudios de peces en lagunas costeras: Nota científica. An. Centro Cienc. del Mar 1975c ---, Sobre los estudios de peces en lagunas costeras: Nota científica. An. Centro Cienc. del Mar Limnol. Univ. Nal. Autón. México 1975c 52-57 2 (1) YÁÑEZ-ARANCIBIA, L. A. R. S. NUGENT Síntesis de antecedentes bióticos y abióticos de los ecosistemas estuarinos de Nayarit, México. Publ. Ciencias Biológicas, Univ. Autón. Nuevo León, México. Vol. in memoriam Dr. E. Caballero (en prensa). 1975 YASUDA, F. The types of food habits of fishes assured by stomach contetnts examination. Bull. Japanese Soc. Sci. Fish. 1960 653-662 26 (7) YOKOTA, T The construction of fish community at Nankai Regional Area from the view point of their food habits. Japanese Materials. 1956
|

