|
OBSERVACIONES SOBRE MUGIL CUREMA VALENCIENNES EN
ÁREAS NATURALES DE CRIANZA, MÉXICO. ALIMENTACIÓN,
CRECIMIENTO, MADUREZ Y RELACIONES ECOLÓGICAS
Trabajo
presentado en el II Simposio Latinoamericano sobre Oceanografía
Biológica. Cumaná, Venezuela, 24-28 de noviembre de
1975.
A. YÁÑEZ-ARANCIBIA
Universidad Nacional Autónoma de
México. Centro de Ciencias del Mar y Limnología,
Laboratorio de
Ictiología.
Se estudia la alimentación, hábitos
alimenticios, relaciones tróficas, crecimiento, madurez y
relaciones
ecológicas de la "lisa" Mugil curema
Valenciennes en
el sistema lagunar costero de Guerrero, Pacífico central de
México.
Los resultados indican que esta especie se alimenta
preferentemente de detritus, sedimentos finos inorgánicos (a cuyas
partículas vive asociada micro fauna y flora) y algas
filamentosas. Como
alimento variable circunstancial puede aprovechar además,
ostrácodos, nemátodos, foraminíferos,
microgastrópodos, anélidos, isópodos, fragmentos de
vegetales y diatomeas bentónicas. En consecuencia su espectro
trófico señala que es una especie Detritívora
vegetal
correspondiendo a un Consumidor Primario. Este tipo de
alimentación
representa un patrón relativamente definido y constante que, sin
embargo, puede sufrir ligeras variaciones de acuerdo a: (1) la zona o
lugar,
(2) la estación del año, y (3) la disponibilidad del
alimento.
La mayoría de las lagunas costeras estudiadas
presentan 3 situaciones ecológicas generales marcadas, que
determinan
cambios en la estructura de las comunidades ictiofaunísticas y que
son
definidas como partes de un ciclo de fisiología ambiental: (1)
El periodo de barra abierta al mar que determina la
mayor
influencia marina en el ecosistema y mezclas de aguas dulces o salobres y
marinas (agosto-septiembre-octubre) , (2) El periodo de
secas que determina un marcado descenso del volumen de agua
interno y
grandes presiones ambientales principalmente por el aumento de la
salinidad y
la temperatura (marzo-abril-mayo), y (3) El periodo de
lluvias que determina salinidades mínimas y un
considerable
aumento del volumen de agua interno que junto con la erosión
marina
fuerza la abertura de las barras para reiniciar el ciclo
(junio-julio-agosto).
Este ciclo fisiológico ambiental es válido, en mayor o
menor
grado, para las lagunas Salinas de Apozahualco, Chautengo, Tecomate,
Nuxco,
Salinas del Cuajo y Potosí. Las lagunas de Tres Palos, Coyuca y
Mitla
son grandes cuerpos de aguas casi dulces que no manifiestan cambios
marcados
durante el año.
Las "lisas" penetran a las lagunas al abrirse las
barras, en grandes cardúmenes de alrededor de 7.0 cm de L. T.
promedio.
Al cerrarse las barras quedan en su interior alimentándose y
creciendo
hasta alcanzar tallas de 23.0 cm o más de L. T. y un desarrollo
gonádico de avanzado estado de maduración. Al abrirse
nuevamente
las barras estos adultos abandonan el sistema lagunar adentrándose
en el
mar para desovar en los próximos meses. Nuevamente el sistema
lagunar es
invadido por grandes cardúmenes de pequeños ejemplares que
corresponden probablemente al producto del desove del año
anterior.
Durante el periodo (1) y aún noviembre, el incremento en peso y el
crecimiento de los peces es muy marcado; disminuye durante el periodo (2)
y
nuevamente se intensifica durante el periodo (3).
Se observa que donde abundan las "lisas" es escaso el
"camarón" (Peneidos) y viceversa, probablemente por una
relación
ecológica de competencia por alimento y espacio. Las "lisas"
sirven de
alimento . a: 1) otros peces, 2) aves acuáticas, y 3) el hombre;
teniendo un importante papel ecológico por la conversión de
la
energía potencial del detritus, en energía aprovechable por
otros
niveles tróficos.
Se sugiere que el periodo más apropiado para
las capturas de las "lisas" son los meses de la época de lluvias,
pero
el recurso debe ser racionalmente administrado para asegurar la
posibilidad de
migración de la especie y el subsecuente desove,
restableciéndose
el equilibrio natural de las poblaciones.
Food, feeding habits, trophic relathionships, growth,
maturity and ecological relationships of the mullet Mugil
curema Valenciennes in the coastal lagoon system of Guerrero,
central
Pacific, Mexico, are studied.
The results indicate that this species feeds
preferably on detritus, fine inorganic sediment (with the particles of
which
micro fauna and flora live associated) and filamentous algae. As a
variable
circumstantial food it may also use ostracods, nematods, foraminifera,
microgastropods, annelids, isopods, fragments of plant material and
benthic
diatomes. Consequently, its trophic spectrum indicates that it is a plant
Detritivorous species corresponding to a Primary Consumer. This type of
feeding
represents a relatively defined and constant pattern which, nevertheless,
can
suffer slight variations according to: (1) the zone or place, (2) the
season of
the year, and (3) the availability of the food.
The majority of the coastal lagoons studied present
three marked general ecological situations which cause changes in the
structure
of the ichthyofaunistic communities and which are defined as parts of a
cicle
of environmental physiology: (1) The bar open to the sea
period which brings about the greatest marine influence in the
acosystem and the mixture of fresh or brackish waters and marine waters
(August-September-October), (2) The dry period which
brings
about a marked decrease in the volume of water within the lagoons and
great
environmental pressures primarily due to the increase in salinity and
temperature (March-April-May), and (3) The rainy period
which causes minimum salinities and a considerable increase in the volume
of
water inside which forces the opening of the bars to begin the cycle
again
(June-July-August) . This physiological environmental cycles is valid, to
a
greater or lesser degree, for the Salinas de Apozahualco, Chautengo,
Tecomate,
Nuxco, Salinas del Cuajo and Potosí lagoons. The Tres Palos,
Coyuca and
Mitla lagoons are large bodies of almost entirely fresh water which do
not
manifest marked changes during the year.
The mullets enter the lagoons when the bars open, in
large schools of fish of an average length of approximately 7.0 cm. When
the
bars close they remain inside feeding and growing until they reach 23.0
cm or
more in length and a gonadic development of an advanced state of
maturity. When
the bars open again these adults leave the lagoon system, entering the
sea to
spawn in the following months. Once again the lagoon system is invaded by
large
schools of small examples which probably correspond to the product of the
spawning of the previous year. During period (1) and even in November,
the
increase in weight and the growth of the fish is very marked; it
diminishes
during period (2) and again intensifies during period (3).
The observation is made that where mullets abound
shrimp (Peneidos) are scarce and viceversa, probably because of an
ecological
relationship of competition for food and space. Mullets serve as food
for: 1)
other fishes, 2) aquatic birds, and 3) man, having a very important
ecological
role because of the conversion of the potential energy of the detritus
into
energy which is usable by other trophic levels.
It is suggested that the most appropriate period for
the capture of mullets is that of the months of the rainy season, but the
resource should be rationally administered in order to insure the
possibility
of the migration of the species and the subsequent spawning,
reestablishing the
natural equilibrium of the populations.
En México, las especies Mugil curema Valenciennes y M. cephalus Linnaeus son las "lisas" más abundantes y de fundamental importancia comercial, de entre todas las otras lisas conocidas para las costas mexícanas (i.e., M. tricodon Poey, M. setosus Gilbert, M. hospes Jordan y Culvert). M. setosus y hospes se distribuyen en la costa noroccidental del país, y M. tricodon en el suroeste. A su vez M. curema y M. cephalus se distribuyen en ambas costas de México. M. curema se encuentra en ambas costas de América; en el Atlántico desde Cabo Cod hasta Brasil y en el Pacífico desde el Golfo de California hasta Chile. También hay registros del África Occidental. Stuardo et al. (1974) , Stuardo y Martínez (1975), Yáñez-Arancibia (1974) in Stuardo et al., (1974), y Yáñez-Arancibia (1975b) han señalado que M. curema es una especie particularmente abundante, que tiene gran importancia comercial, y que caracteriza en gran medida al sistema lagunar costero del estado de Guerrero, en la costa central del Pacífico de México. Corresponde a una de las especies del género menos estudiada y por consiguiente esta investigación parece representar a una de las pocas contribuciones sobre aspectos biológicos generales de la especie. Su diferenciación taxonómica ha sido estudiada por Jacot (1920), Trewards (1950), Ebeling (1957), Cervigón (1966), Kobelkowsky y Reséndez (1974). La importancia económica y ecológica que presenta en forma muy significativa en el sistema lagunar costero de Guerrero, México, justifica la necesidad de discutir observaciones biológicas conducentes a recomendar una correcta administración de este importante recurso biológico-pesquero, y/o con perspectivas de cultivos de la especie. AntecedentesLa Secretaría de Industria y Comercio (SIC, 1970) ha señalado que las "lisas" representan uno de los más importantes recursos pesqueros de la costa de Guerrero, tanto por su volumen de captura como por su valor comercial. El boletín editado por ese Organismo Estatal resume estadísticas pesqueras desde 1959 hasta 1970, en relación a: otras especies de peces, tortugas, camarones y ostiones. De acuerdo a ello, las "lisas" ocupan un renglón muy seguido detrás de esos otros importantes recursos pesqueros. En el año 1968 se capturaron en las costas de Guerrero 101 toneladas de "lisas" que significaron 568 mil pesos ($ 1 U. S. = $ 12.50); en el año 1969 se capturaron 39 toneladas que significaron 199 mil pesos y en el año 1970 se capturaron 124 toneladas que significaron 684 mil pesos. Desgraciadamente no se conoce la información estadística para los últimos años; pero sin embargo, se sabe que las "lisas" siguen representando uno de los recursos más importantes en las pesquerías costeras y lagunares de Guerrero y su explotación se ha incrementado mucho en los últimos años. Recientes actividades de investigación en el sistema lagunar costero de Guerrero, han señalado la importancia de efectuar estudios biológicos y pesqueros sobre las lisas por la magnitud económica que representan en esos ecosistemas (Stuardo et al. 1974; Stuardo y Martínez, 1975, Yáñez-Arancibia, 1975b, y un Informe editado por la Secretaría de Recursos Hidráulicos-SRH, 1975). Estudios actualmente en ejecución en el Centro de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México, enfatízan en forma particular problemas bio-ecológicos de las lisas del sistema lagunar costero de Guerrero, como parte de estudios multidisciplinarios integrativos llevados a cabo en un convenio de colaboración entre la Comisión del Río Balsas de la Secretaría de Recursos Hidráulicos y el Centro de Ciencias del Mar y Limnología de la UNAM. ÁREA DE ESTUDIOLa zona ha sido descrita en algún detalle; desde el punto de vista geológico por Lankford (1974 y 1975), Gutiérrez y Carranza (1975) y Warme y Sánchez (1975) ; desde el punto de vista hidrográfico por Arpi et al. (1974), y Castellanos (1975); y desde el punto de vista biológico y ecológico por Stuardo et al. (1974). Stuardo y Martínez (1975), Stuardo y Villarroel (1976), Villarroel (1975), Weinborn (1974), Yáñez-Arancibia (1974 y 1975), en parte Ramírez G. (1952), Stuardo y Estevez (1975), Licea et al. (1975), Yáñez-Arancibia et al. (1975). GEOGRAFÍALa zona costera del estado de Guerrero, México se extiende en una longitud de alrededor de 490 km, desde la desembocadura del Río Balsas, en el límite con Michoacán, hasta la punta Maldonado por el sur, en el límite con Oaxaca (Fig. 1). La mayor parte de la costa se caracteriza por el litoral lagunar pero también presenta algunas zonas rocosas y algunas llanuras de bajo relieve. Los estudios se han estado desarrollando en las siguientes lagunas litorales señaladas en la figura 1: Salinas de ApozahualcoSuperficie aproximada 2 km2; se ubica entre Pta. Acamama y el Río Marquelia; 98º 50' y 98º 51' W de longitud; profundidad media de 0.50 m; distancia aproximada de la costa 20 m; se orienta de sur a norte; la barra se encuentra al sur de la laguna y se abre directamente a la Bahía Dulce. 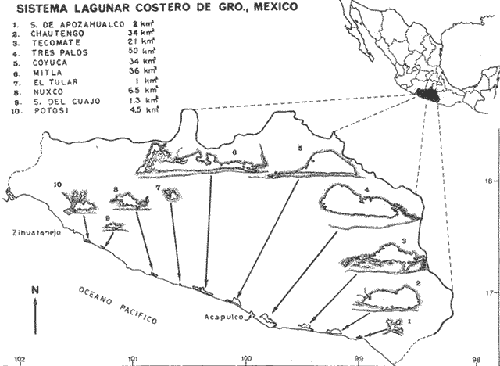 Fig. 1. Zona costera del Estado de Guerrero, México. Se indica en detalle el sistema lagunar, su ubicación geográfica y la relación de superficies entre las lagunas. Chautengo o NexpaSuperficie aproximada 34 km2; se ubica entre el Río Copala y el Río Nexpa; 99º 02´ y 99º 09' W de longitud; profundidad media de 1.08 m; distancia aproximada de la costa 600 m; se orienta de oeste a este; la barra se encuentra al sur de la laguna y se abre directamente al mar. Tecomate o San MarcosSuperficie aproximada 21 km2; se ubica entre el Río Nexpa y el Río Papagayo; 99º 17´ y 99º 27´ W de longitud; profundidad media de 0.75 m; distancia aproximada de la costa 2,000 m; se orienta de oeste a este; la laguna se abre al mar a través de un largo y profundo canal meándrico. Tres PalosSuperficie aproximada 50 km2; se ubica entre el Río Papagayo y el Río Sabana, al sur oeste de Acapulco; profundidad media de 2.50 m; distancia aproximada de la costa 2,000 m; se orienta de oeste a este; la laguna se abre al mar a través de un largo y profundo canal meándrico. CoyucaSuperficie aproximada 34 km2; se ubica al noroeste de Acapulco; 99º 58´ y 100º 08' W de longitud; profundidad media 2.50 m; distancia aproximada de la costa 500 m; se orienta de oeste a este; la laguna se abre al mar a través de un largo canal meándrico ubicado en su parte norte. MitlaSuperficie aproximada 36 km2 se ubica al noroeste de Acapulco; 100º 14´ y 100º 26´ W de longitud; profundidad media 2.94 m; distancia aproximada de la costa 1,000 m; se orienta paralela a la costa; la laguna se ha abierto al mar a través de una boca situada al este de ella y donde la barra tiene unos 300 m de ancho. TularEn esta laguna no se han efectuado estudios ictiológicos. Superficie aproximada 1 km2 ; se ubica 20 km antes de la ciudad de Tecpan de Galeana; 100º 33´ y 100° 34´ W de longitud; profundidad media de 0.40 m; distancia aproximada de la costa 1,000 m; se orienta paralela a la costa; la laguna se encuentra totalmente aislada del mar. Nuxco o El 20Superficie aproximada 6.5 km2; se ubica 20 km al norte del pueblo de Nuxco y frente al pueblito El 20; 100º 47´ y 100º 49´ W de longitud; profundidad media de 1.96 m; distancia aproximada de la costa 1,000 m; se orienta de noroeste a sureste; la laguna se abre al mar a través de un corto canal ubicado en el sector este de ella. Salinas del CuajoSuperficie aproximada 1.3 km2; se ubica al noroeste de Papanoa; 101º 11' y 101º 13' W de longitud; profundidad media de 0.50 m; distancia aproximada de la costa 1,000 m; se orienta paralela a la costa; la laguna es somera y se seca al final del periodo de secas. PotosíSuperficie aproximada 4.5 km2; se ubica detrás del Morro de Potosí; 101º 24´ y 101º 27´ W de longitud; profundidad media de 1.50 m; distancia aproximada de la costa 1,000 m; se orienta de oeste a este; la barra situada al noroeste de la laguna se abre directamente a la Bahía Potosí. CLIMAToda el área de estudio presenta un clima tropical subhúmedo del tipo AW, con lluvias en verano y sequías en invierno. El rango anual de la temperatura no excede los 5º C. En la época de las lluvias los vientos predominantes son del SE; y durante la época de secas dominan los vientos del NE. En general los vientos son importantes agentes de la evaporación local así como también la fuerte insolación. La precipitación pluvial más importante ocurre entre mayo y octubre durante la persistencia de los vientos marinos del SE. Por otra parte la evaporación media anual es superior a los valores medios de la precipitación anual. Los valores de evaporación medios anuales para las zonas estudiadas varían entre 1,900 y 2,200 mm; determinando un factor considerable en la variación de los valores de la salinidad de las aguas de las lagunas costeras. 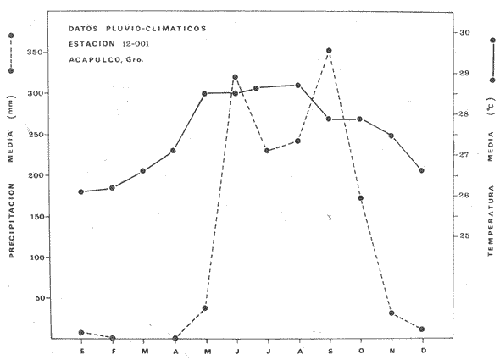 Fig. 2. Relación pluvio-climática, temperatura ambiente y precipitación, en la costa de Guerrero. Datos de la Estación 12-001 de Acapulco, Gro., México. La estación climatológica de Acapulco (núm. 12-001) detalla los siguientes datos para la zona costera de Guerrero (tabla 1) . En la figura 2 se han graficado los valores promedios mensuales de la temperatura y la precipitación, dada su importancia y relación con el ciclo de fisología ambiental (ecología) que presentan las lagunas costeras. 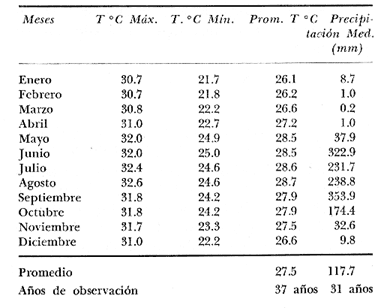 TABLA 1 (Figura 2) DATOS CLIMATOLÓGICOS PARA LA COSTA DE GUERRERO, MÉXICO HIDROGRAFíALa descarga fluvial afecta directamente los ecosistemas en cuestión. Castellanos (1975) ha señalado que el volumen anual de descarga está en función de varios factores como: a) área de la cuenca de drenaje. b) precipitación dentro de la cuenca, c) pérdida por evaporación, y d) cantidad de agua consumida por las actividades humanas. Los sedimentos acarreados por los ríos contribuyen al asolvamiento paulatino que están sufriendo las lagunas. De todos los ríos del área, sólo unos pocos descargan directamente en el mar (i.e., Papagayo, Balsas, Ometepec, entre otros). La mayor parte de los ríos presentan un ciclo anual de descarga en la época de las lluvias y secándose en los meses de intensa sequía. Esto ocurre marcadamente con los ríos que descargan en Apozahualco, Tecomate, Mitla, Nuxco, Salinas del Cuajo y Potosí. Otros como Chautengo, Tres Palos y Coyuca reciben un reducido caudal durante la época de sequía. En las figuras 3 y 4 se representan los valores mensuales de temperatura y salinidad del agua (Chautengo y Nuxco respectivamente) que corresponden a dos de las más importantes lagunas en donde se pesca la "lisa". Los datos han sido extractados de Castellanos (1975) y el gráfico modificado de ese mismo autor. En la figura 5 se representan valores medios del oxígeno disuelto en tres importantes lagunas del sistema lagunar, en un gráfico modificado de Castellanos (1975). 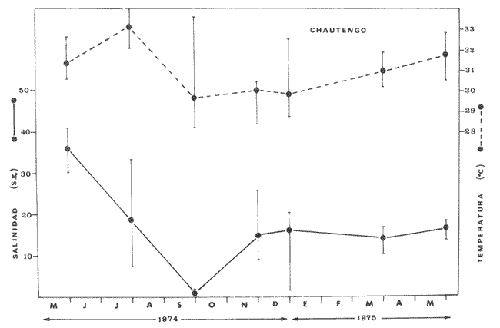 Fig. 3, Promedios mensuales de salinidad y temperatura de las aguas en la laguna de Chautengo, Gro., México. Extractado y modificado de Castellanos (1975). 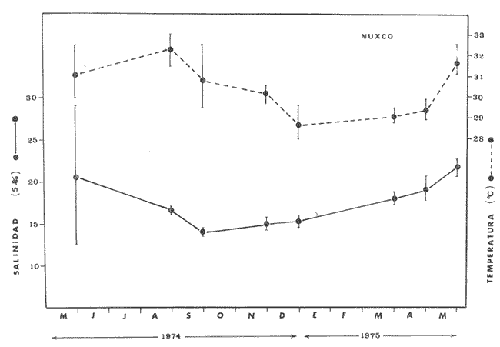 Fig. 4. Promedios mensuales de salinidad y temperatura de las aguas en la laguna de Nuxco, Gro., México. Extractado y modificado de Castellanos (1975). ECOLOGÍALas epi- e infaunas bentónicas se encuentran escasamente representadas en todas las lagunas (Stuardo y Villarroel, 1976; Villarroel, 1975), al igual que la vegetación sumergida, exceptuando manglares y otra vegetación semi-acuática. Sin embargo los peces y el fitoplancton son particularmente abundantes en algunas lagunas (Yáñez-Arancibia 1974 in Stuardo et al., 1974; Yáñez-Arancibia, 1975b; Licea et al., 1975). En general las lagunas son cuerpos de aguas someras, de volúmenes variables dependiendo de la "seca" y del "estío", con temperaturas elevadas que descienden en los meses de diciembre-enero-febrero, salinidades variables, niveles de oxígeno variables, fondos predominantemente fangosos, y características de topografía y superficies muy irregulares. Algunas de ellas presentan un ciclo regular anual de entrada periódica de agua de mar y otras permanecen cerradas durante algunos años. Se considera que por las características geológicas, geomorfológicas, hidrodinámicas y biológicas (autores op. cit.) las lagunas costeras de Guerrero corresponden a un sistema lagunar. Yáfiez-Arancibia 1975b ha señalado, que por las características de la dinámica ambiental del sistema lagunar, se consideran 3 situaciones ecológicas marcadas que, determinan cambios en la estructura ictiofaunística de las lagunas, a saber (Fig. 6): 1). El periodo de barra abierta al mar que determina la mayor influencia marina en el ecosistema y mezclas de aguas dulces o salobres y marinas (agosto-septiembre-octubre). 2). El periodo de secas que determina un marcado descenso del volumen de agua interno y grandes presiones ambientales principalmente por el aumento de la salinidad y la temperatura (marzo-abril-mayo). En este mismo periodo las temperaturas más bajas se registran en los meses de diciembre-enero-febrero. 3). El periodo de lluvias que determina salinidades mínimas y un considerable aumento del volumen de agua interno que en un efecto combinado con erosión desde el mar fuerza la abertura de las barras para reiniciar el ciclo (junio-julio-agosto). Este ciclo de fisiología ambiental (Fig. 6), es válido en mayor o menor medida, para las lagunas Salinas de Apozahualco, Chautengo, Tecomate, Nuxco, Salinas del Cuajo y Potosí. Las lagunas de Tres Palos, Coyuca y Mitla son grandes cuerpos de aguas casi dulce que no manifiestan cambios marcados durante el año. Mitla, por permanecer cerrada artificialmente al mar durante 8 años, y Coyuca y Tres Palos por efectos físicos del canal que las separa del mar. Los factores que intervienen son: precipitación, escurrimiento, evaporación y según Lankford (com. personal) la filtración a través de la barra desde el nivel superior. 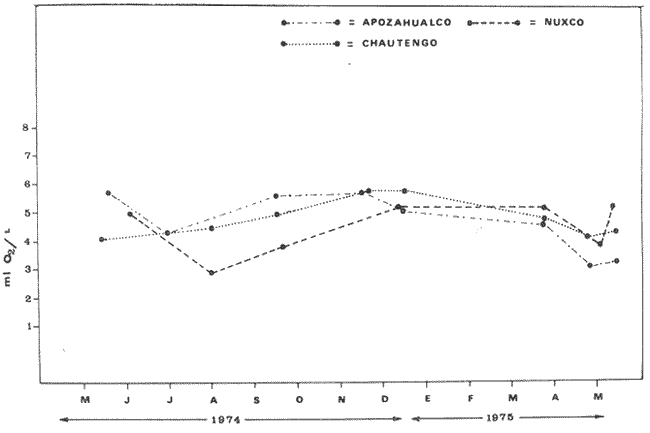 Fig. 5. Promedios mensuales de oxígeno disuelto en tres importantes lagunas de Guerrero, México. Modificado de Castellanos (1975).  Fig. 6. Ciclo de fisiología ambiental que presentan las lagunas de Apozahualco, Chautengo, Tecomate, Nuxco, Cuajo y Potosí; y en mucho menor proporción (en efectos biológicos) las lagunas de Tres Palos y Coyuca, Gro., México. La laguna de Chautengo puede ampliar su periodo (1) hasta diciembre, así como la laguna de Nuxco lo reduce a un máximo de 15 días. Ev = evaporación, P=precipitación, E=escurrimiento, F=filtración a través de la barra y desde el nivel superior. MATERIALES Y MÉTODOS
Material de estudioPara el análisis de la alimentación y hábitos alimenticios fueron examinados 501 estómagos de ejemplares que variaron entre 75 y 276 mm de longitud total (L. T.). Esta colección se distribuyó de la siguiente manera: 111 ejemplares de septiembre de 1973; 20 ejemplares de enero de 1974; 23 ejemplares de marzo de 1974; 18 ejemplares de abril de 1974; 136 ejemplares de mayo de 1974; 22 ejemplares de julio de 1974; 18 ejemplares de agosto de 1974; 138 ejemplares de octubre de 1974 y 15 ejemplares de noviembre de 1974. Para la discusión de crecimiento y madurez fueron examinados 784 ejemplares que variaron entre 60 y 276 mm de L. T. y entre 10 y 350 g de peso. Esta colección se distribuyó de la siguiente manera: 268 ejemplares de septiembre de 1973 con un promedio de peso de 16. 7 g y de 117 mm de longitud; 203 ejemplares de octubre de 1973 con un promedio de peso de 44.7 g y de 155 mm de longitud; 64 ejemplares de enero de 1974 con un promedio de peso de 49 g y de 175 mm de longitud; 50 ejemplares de marzo de 1974 con un promedio de peso de 49.2 y de 181 mm de longitud; 144 ejemplares de abril de 1974 con un promedio de peso de 59.4 g y de 182 mm de longitud; 25 ejemplares de mayo de 1974 con un promedio de peso de 74 g y de 186 mm de longitud; 30 ejemplares de julio de 1974 con un promedio de 121.7 g y de 239 mm de longitud. Actividades de campoLas colectas fueron hechas empleando como arte de pesca un "atarraya" que si bien es cierto es una red selectiva, es al mismo tiempo particularmente eficiente en las aguas turbias y someras de las lagunas. Es una red circular de 5 m de diámetro con malla de trama de 1.0 y 0.5 pulgadas y numerosos lastres de plomo en la periferia. Para cada una de las lagunas se dispuso un número determinado de estaciones de colectas tratando de cubrir de la mejor manera la superficie de las mismas. En cada estación de colectas se realizó un determinado número de lances de pesca y se cuantificaron los organismos capturados en cada lance. De esa manera se determina una cierta unidad de esfuerzo de pesca. No existen métodos desarrollados para estudios cuantitativos de comunidades naturales de peces de las lagunas costeras y sólo es posible "estimar" un potencial ictiofaunístico con visitas y colectas sistemáticas en el área de estudio. La biomasa es determinada de acuerdo al peso por unidad de área. J. W. Day et al. (1973), Nixon y Oviatt (1973), Hester y Copeland (1975) y Kjelson y Colby (1975), discuten consideraciones para estimar poblaciones de peces y biomasa en ecosistemas estuarinos, con mayor exactitud. El material recolectado era rápidamente llevado a la embarcación usada (una lancha de aluminio de fondo plano con motor fuera de borda de 9.5 H. P.) para impedir la regurgitación, fijándose en formalina al 10% neutralizada previamente con Borato de Sodio. A continuación los estómagos eran inyectados, lo que es muy importante porque el retardar la fijación del alimento hace que el contenido estomacal sea irreconocible después de 20 minutos. Ball (1948) y Yáñez-Arancibia (1975b) también han hecho incapié en esta observación. Posteriormente el material se etiquetaba y envasaba en bolsas de polietileno para su transporte al laboratorio. Actividades de laboratorioEn el laboratorio los peces fueron lavados y mantenidos en alcohol metílico al 70 % . Existen diversos métodos para el estudio del contenido estomacal de los peces y han sido discutidos en extenso por Yáñez-Arancibia, (1975b). Para el caso particular de Mugil curema se empleó el método volumétrico empleado por Odum (1971), Odum y Heald (1972) y Yáñez-Arancibia (1975b); el método de frecuencia empleado por Albertine (1973) y Yáfiez-Arancibia (1975b); gravimétrico, en términos generales. El grado de llenado de los estómagos fue determinado de acuerdo a si éste se encontraba: lleno, medio lleno, casi vacío, o vacío. El grado de digestión de acuerdo a si el alimento se encontraba: fresco, medio digerido, o digerido. El estado del pez fue determinado de acuerdo a: delgado (sin rastros de grasa en el tracto digestivo), no muy gordo (un hilillo de grasa a lo largo del tracto digestivo), y muy gordo (tracto digestivo completamente envuelto en grasa). Después de separar el contenido estomacal, éste fue clasificado en 2 categorías preliminares: Organismos. Fueron determinados a nivel específico, genérico, de familia o grupo, según las dificultades taxonómicas que representaban y principalmente de acuerdo al grado de digestión. Otros materiales. Dentro de esta categoría fueron determinados los sedimentos inorgánicos, materia orgánica animal o vegetal no determinable (M. O. N. D.), restos vegetales, y detritus. Este último término fue usado de acuerdo al concepto definido por Odum y De la Cruz (1963) y ampliado por Darnell (1967, a y b) ... "Todo tipo de material biogénico en diferentes estados de descomposición microbiana, representando potencialmente una fuente de energía para consumo de las especies..." Cuando fue posible la identificación de las partículas de detritus se hizo de acuerdo a su color (Odum y Heald, 1972; Yáñez-Arancibia 1975b). El crecimiento de la especie fue determinado de acuerdo a la relación (longitud - peso - tiempo) y en parte al examen de las escamas. La longitud fue medida como longitud total (L. T.) con un ictiómetro convencional. El peso fue medido como peso total sobre los especímenes previamente fijados, en una balanza Ohaus Triple Beam de 0.1 g de precisión y 2,610 g de capacidad. La madurez de los especímenes fue determinada en relación al examen de las gónadas, su tamaño, color y forma, de acuerdo con Nikolsky (1963). Fase I. Inmaduros: Individuos jóvenes que aún no han alcanzado la madurez sexual. Gónadas de tamaño muy pequeño. Fase II. En descanso: Los productos sexuales no han alcanzado a desarrollarse. Gónadas de tamaño muy pequeño. Ovarios con los huevecillos no distinguibles a simple vista. Fase III. En maduración: Las gónadas, de mayor tamaño, están sufriendo un incremento muy rápido en peso. Los testículos cambian de transparentes a un color rosado pálido. Fase IV. Maduros: Productos sexuales maduros. Las gónadas han alcanzado su máximo peso, pero los productos sexuales no salen al exterior cuando se aplica presión al vientre. Fase V. En reproducción: Los productos sexuales se expulsan en respuesta a una presión ligera de la región abdominal. El peso de las gónadas decrece rápidamente desde el principio del desove a su terminación. Fase VI. Desovados: Los productos sexuales han sido expulsados. Las aberturas genitales están inflamadas. Las gónadas tienen la apariencia de sacos desinflados. Los ovarios generalmente contienen unos cuantos huevecillos residuales y los testículos algo de esperma. Fase VII. En descanso: Los productos sexuales han sido expulsados. La inflamación alrededor de la abertura genital ha disminuído hasta desaparecer. Las gónadas han vuelto a tener un tamaño muy pequeño y no se distinguen huevecillos a simple vista. RESULTADOS Y DISCUSIÓN
ALIMENTACIÓN Y HÁBITOS ALIMENTICIOSEn particular. la alimentación y hábitos alimenticios de una especie muy afin, M. cephalus, ha sido estudiada por Hiatt (1947), Eguza (1950), Darnell (1958, 1961 y 1962), Suzuki (1965), W. E. Odum (1966, 1968 a, 1968 b, 1970, 1971), W. E. Odum y Heald (1972). De acuerdo con los trabajos citados, esta especie se alimenta fundamentalmente de la capa superficial del fondo seleccionando partículas finas incluyendo diatomeas bentónicas, algas filamentosas, detritus vegetal, y sedimentos inorgánicos. El contenido incluiría aproximadamente un 46% de sedimentos inorgánicos, 40% de partículas finas de detritus provenientes de hojas de mangle, y 14% de microalgas vivientes (W. E. Odum y Heald, 1972). Thompson (1951) ha estudiado la alimentación de M. dobula encontrando detritus, diatomeas, algas filamentosas y microfauna de moluscos. Pillay (1953) ha estudiado la alimentación de M. tade con resultados relativamente similares a los obtenidos por Albertine (1973) sobre la alimentación de M. auratus, M. capito y M. saliens. Albertine (1973) ha encontrado que los juveniles de 15 a 50 mm de LP son micrófagos carnívoros comiendo principalmente crustáceos, mientras que los de tallas entre 50 y 65 mm de LP son micrófagos herbívoros comiendo diatomeas bentónicas y otras microalgas. Bardach et al. (1972) señala que M. corsula de India, Pakistan y Burma prefiere copépodos y pequeños insectos y que los adultos de todas las especies del género son comedoras del fondo. Jacot (1920) ha señalado que M. curema tiene hábitos similares a M. cephalus, y los pequeños juveniles no comen crustáceos como en otras especies del género, sino que sus estómagos se encuentran llenos de fango obscuro y materia orgánica. Ebeling (1957) ha indicado que estas especies consumen diatomeas y algas filamentosas. Carranza (1969 y 1970) encontró que en los estómagos de Mugil en general se encuentra lodo con materia orgánica y detritus revueltos, y a veces restos vegetales. Yáñez-Arancibia (1974 in Stuardo et al.1974) señala que M. cephalus y M. curema se alimentan de la capa superficial del fondo y posteriormente Yáñez-Arancibia (1975b) discute en extenso la alimentación de M. curema en muestras colectadas durante 1973 en el sistema lagunar de Guerrero. Otras observaciones sobre la alimentación de M. curema han sido hechas por Schroeder (1924) indicando que remueve el fango buscando su alimento, Hildebrand y Schroeder (1928) indicando que comen pequeños organismos, y Pearse (1932) indicando que se alimentan del fango del fondo. Salinas de ApozahualcoLas observaciones en esta laguna fueron hechas sobre 111 ejemplares recolectados en septiembre de 1973, 16 ejemplares recolectados en mayo de 1974 y 90 ejemplares recolectados en octubre de 1974. En septiembre, el espectro trófico en esta laguna (tabla 2, Figs. 7, 8 y 9) indica una extraordinaria constancia en el patrón de alimentación, no presentando variación entre juveniles y los pocos adultos examinados. El principal alimento de la población está formado por detritus, materia orgánica, microflora (diatomeas bentónicas) y resto de algas filamentosas, con un 58.2% en volumen y 100% de frecuencia; luego les siguen en importancia sedimentos inorgánicos con 40% en volumen y 100% de frecuencia; y finalmente la microfauna con 1.8% de volumen y una frecuencia variable. En el mes de mayo, el espectro trófico (tabla 2, Fig. 9) es menos diversificado, además que disminuye marcadamente el consumo de sedimentos inorgánicos finos y se nota un considerable aumento del porcentaje volumétrico de algas filamentosas especialmente Chaetomorpha antenina. En este mes se presentan en Apozahualco los mayores "stress" ambientales por aumento considerable de la temperatura y salinidad del agua, lo que parece ser determinante en la desaparición de los grupos de la meio- y microfauna bentónicas que en otras condiciones les sirven como un alimento secundario o accidental. En el mes de octubre, las condiciones son relativamente similares al mes anterior, y por lo tanto el espectro trófico (tabla 2, Fig. 9) nuevamente se hace más diversificado y algunos grupos de la medio y microfauna bentónicas pueden ser incorporados en la dicta, aun cuando con poca significación volumétrica y una frecuencia muy variable. ChautengoLas observaciones en esta laguna fueron hechas sobre 8 ejemplares recolectados en abril de 1974, 114 ejemplares recolectados en mayo de 1974, 4 ejemplares recolectados en julio de 1974, 74 ejemplares recolectados en octubre de 1974, y 3 ejemplares recolectados en marzo de 1974. En los meses de marzo y abril, el espectro trófico (tabla 3, Fig. 9), indica que el principal alimento lo constituye el detritus, materia orgánica, microflora y restos vegetales, con un 57% de volumen y 100% de frecuencia; luego les siguen sedimentos finos inorgánicos con un 40% de volumen y 100% de frecuencia; luego vegetales del tipo Enteromorpha sólo un 2% de volumen; y micromoluscos, Amnicola con 1 % de volumen. 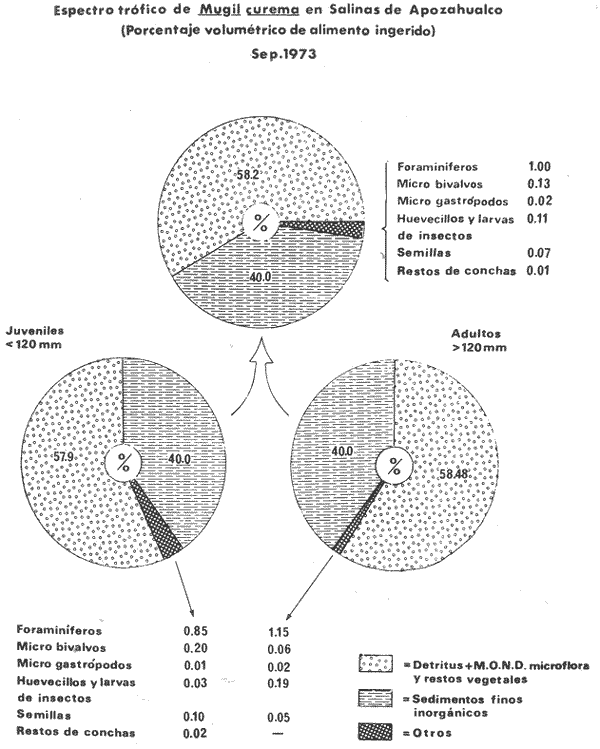 Fig. 7. Espectro trófico volumétrico de Mugil curema en el mes de septiembre de 1973. Salinas de Apozahualco, Gro., México.  TABLA 2 (Figuras 7, 8 y 9) RELACIÓN DEL CONTENIDO ESTOMACAL DE MUGIL CUREMA EN SALINAS DE APOZAHUALCO, GRO., MÉXICO En los meses de mayo, el espectro trófico (tabla 3, Fig. 9) es muy similar al del mes de octubre y aún julio. El principal alimento lo constituye el detritus, materia orgánica, microflora y restos vegetales con un 51% de volumen y 100% de frecuencia; luego sedimentos finos inorgánicos, con un 27.5% de volumen y 100% de frecuencia; algas filamentosas Enteromorpha con 11% de volumen y 75% de frecuencia; nemátodos con 5% de volumen y 60% de frecuencia; anélidos con 2% de volumen y frecuencia variable; huevecillos y larvas de insectos con 2% de volumen y frecuencia variable; y ostrácodos con 1% de volumen y frecuencia variable. Al igual que para la laguna S. de Apozahualco, en los meses de intensa sequía, disminuye la ingestión de sedimentos inorgánicos finos. Tecomate o San MarcosLas observaciones en esta laguna fueron hechas sobre 20 ejemplares recolectados en el mes de enero, y 4 ejemplares recolectados en el mes de marzo de 1974. El espectro trófico para ambos meses es muy similar y se ha resumido en la tabla 4, figura 9. El principal alimento lo constituye el detritus, materia orgánica, microflora y restos vegetales con un 59% de volumen y 100% de frecuencia; luego sedimentos finos inorgánicos con 40% de volumen y 100% de frecuencia, y finalmente otros restos y ostrácodos con 1% de volumen y 75% de frecuencia. 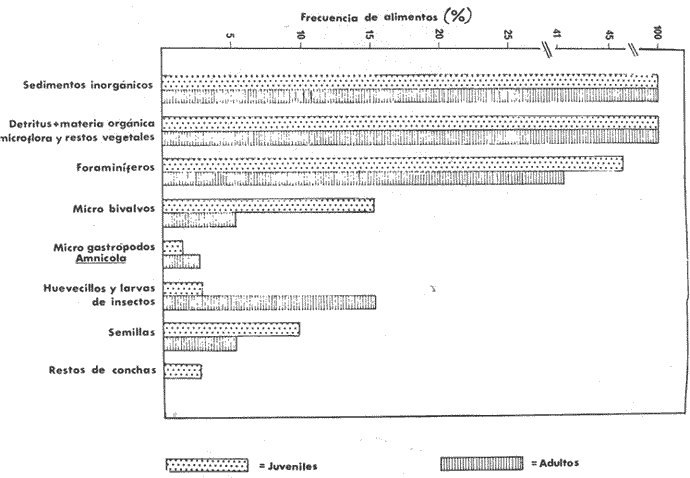 Fig. 8. Espectro trófico de frecuencia de Mugil curema en el mes de septiembre de 1973. Salinas de Apozahualco, Gro. 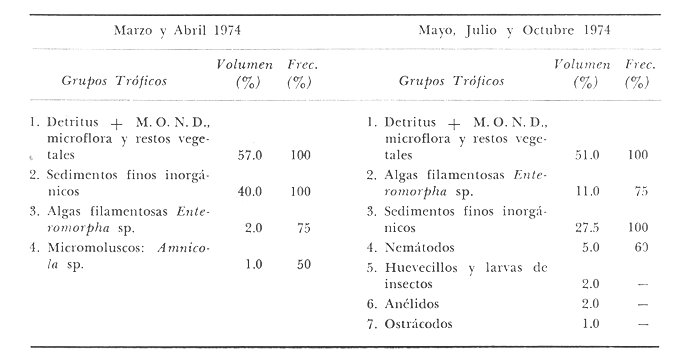 TABLA 3 (Figura 9) RELACIÓN DEL CONTENIDO ESTOMACAL DE MUGIL CUREMA EN CHAUTENGO, GRO., MÉXICO En esta laguna el patrón de alimentación es similar a las anteriores pero aparecen pocos organismos animales de la meio- y microfauna bentónicas.  TABLA 4 (Figura 9) RELACIÓN DEL CONTENIDO ESTOMACAL DE MUGIL CUREMA EN TECOMATE, GRO., MÉXICO Tres PalosLas observaciones en esta laguna fueron hechas sobre 8 ejemplares recolectados en el mes de julio de 1974 y 8 ejemplares recolectados en el mes de agosto de 1974. El espectro trófico es similar en ambos meses, (tabla 5, Fig. 9) constituyendo el principal alimento el detritus, materia orgánica, microflora y restos vegetales con 50% de volumen y 100% de frecuencia; luego sedimentos finos inorgánicos con un 30% de volumen y 100% de frecuencia; algas filamentosas con 13% de volumen y 75% de frecuencia; nemátodos con 4% de volumen y frecuencia variable; ostrácodos con 1 % de volumen y frecuencia variable; otros restos con 2% de volumen.  TABLA 5 (Figura 9) RELACIÓN DEL CONTENIDO ESTOMACAL DE MUGIL CUREMA EN TRES PALOS, GRO., MÉXICO CoyucaLas observaciones en esta laguna fueron hechas sobre 10 ejemplares recolectados en julio de 1974; 10 ejemplares recolectados en agosto de 1974; 15 ejemplares recolectados en noviembre de 1974. El espectro trófico es similar a Tres Palos (tabla 6, Fig. 9). El principal alimento lo constituye el detritus, materia orgánica, microflora y restos de vegetales con 52%, de volumen y 100% de frecuencia; luego sedimentos inorgánicos finos con 28% de volumen y 100% de frecuencia; algas filamentosas 13% de volumen y 80% de frecuencia; huevecillos de insectos 4% de volumen y frecuencia variable; ostrácodos 1% de volumen y frecuencia variable; nemátodos 1% de volumen y frecuencia variable; isópodos 1% de volumen y frecuencia variable.  TABLA 6 (Figura 9) RELACIÓN DEL CONTENIDO ESTOMACAL DE MUGIL CUREMA EN COYUYA, GRO., MÉXICO Las condiciones hidrográficas de Tres Palos y Coyuca son en extremo similares y su dinámica de fisiología ambiental es casi idéntica y ha sido discutida parcialmente por Yáñez-Arancibia (1975 b). Esto puede determinar la similitud en la alimentación de las lisas en ambas lagunas. NuxcoLas observaciones para esta laguna fueron hechas sobre 10 ejemplares recolectados en abril de 1974, 6 ejemplares recolectados en mayo de 1974, y 24 ejemplares recolectados en octubre de 1974. 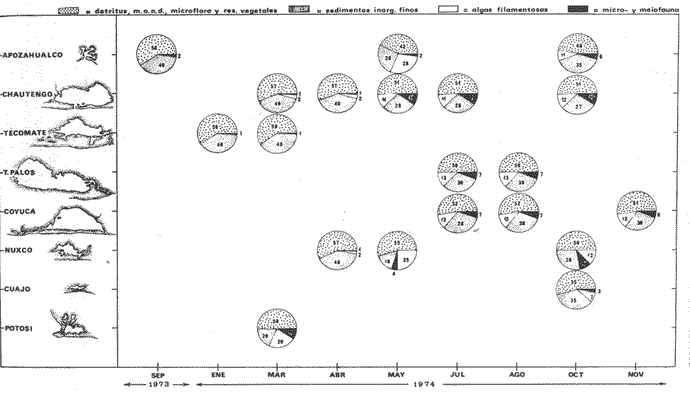 Fig. 9. Espectro trófico volumétrico de Mugil curema en el sistema lagunar costero de Guerrero, México. N = 501. En abril, el espectro trófico (tabla 7, Fig. 9) indica que el principal alimento lo constituye el detritus, materia orgánica, microflora y restos vegetales con 57% de volumen y 100% de frecuencia; luego sedimentos finos inorgánicos con 40% de volumen y 100% de frecuencia; vegetales Chaetomorpha y Ruppia maritima(fragmentos) con 2.1% de volumen y 75% de frecuencia; y otros restos con 0.90% de volumen y 15% de frecuencia.  TABLA 7 (Figura 9) RELACIÓN DEL CONTENIDO ESTOMACAL DE MUGIL CUREMA EN NUXCO, GRO., MÉXICO En mayo, el espectro trófico (tabla 7, Fig. 9) indica que el principal alimento lo constituye el detritus, materia orgánica, microflora y restos vegetales con 55% de volumen y 100% de frecuencia; luego sedimentos inorgánicos finos con 16% de volumen y 100% de frecuencia; algas filamentosas Chaetomorpha con 25% de volumen y 80% de frecuencia; ostrácodos con 2% de volumen y frecuencia variable; foraminíferos y micromoluscos con 2% de volumen y frecuencia variable. En octubre, el espectro trófico (tabla 7, Fig. 9), indica que el principal alimento lo constituye el detritus, materia orgánica, microflora y restos vegetales con un 50% de volumen y 100% de frecuencia; luego sedimentos finos inorgánicos, con un 28% de volumen y 100% de frecuencia; algas filamentosas Enteromorpha y Chaetomorpha un 12% de volumen y 80% de frecuencia y restos no determinados con 10% de volumen y de frecuencia variable (nemátodos, anélidos, insectos, ostrácodos). Salinas del CuajoLas observaciones para esta laguna fueron hechas sobre 24 ejemplares recolectados en octubre de 1974. El espectro trófico (tabla 8, Fig. 9) indica que el principal alimento lo constituye el detritus, materia orgánica, microflora y restos vegetales con 55% de volumen y 100% de frecuencia; luego sedimentos inorgánicos 35% de volumen y 100% de frecuencia y finalmente; algas filamentosas con 7% de volumen y 80% de frecuencia y foraminíferos con 1% de volumen y de frecuencia variable. Otros restos no determinados constituyen el 2% de volumen restante. PotosíLas observaciones para esta laguna fueron hechas sobre 16 ejemplares recolectados en marzo de 1974.  TABLA 8 (Figura 9) RELACIÓN DEL CONTENIDO ESTOMACAL DE MUGIL CUREMA EN SALINAS DE CUAJO, GRO., MÉXICO El espectro trófico (tabla 9, Fig. 9) indica que el principal alimento lo constituye el detritus, materia organica, microflora y restos vegetales con 50% de volumen y 100% de frecuencia; luego algas filamentosas con 20% de volumen y 75% de frecuencia; sedimentos inorgánicos con 20% de volumen y 100% de frecuencia; anélidos con 4.5% de volumen y 50% de frecuencia; nemátodos con 4.5% de volumen y 65% de frecuencia, foraminíferos 1% de volumen y de frecuencia variable.  TABLA 9 (Figura 9) RELACIÓN DEL CONTENIDO ESTOMACAL DE MUGIL CUREMA EN POTOSÍ, GRO., MÉXICO Por el análisis de la alimentación para cada laguna, podemos decir que tanto M. cephalus (discutida por otros autores) como M. curema aquí discutida, se alimentan de la capa superficial del fondo empleando un mecanismo de filtrado que se encuentra en la faringe y que fue estudiado inicialmente por Pillay (1953) y Thompson (1954). Este sistema les permite separar las partículas más finas las cuales son mezcladas con material mucoso proveniente del esófago y la masa es triturada por la acción de la parte pilórica del estómago que es muy musculosa y actúa como molleja (Fig. 10). El patrón de alimentación de M. curema está relacionado estrechamente con las adaptaciones morfológicas de su tracto intestinal (Fig. 10). La faringe presenta dos fuertes masas musculares que regulan tanto la entrada de la misma como el diámetro del canal faríngeo. Estos músculos presentan respectivos surcos de posición ventral y bordes como pliegues de posición anterior. Todo esto determina que la faringe cumpla un papel de seleccionador de finas partículas de alimento. El alimento es remojado con mucus proveniente del esófago, que de acuerdo a Al-Hussaini (1949) se produce por una activa función fisiológica del epitelio estratificado del esófago, que posee además células mucosas saculares. El esófago se conecta al estómago, más o menos por su porción media, y se separa de él por una válvula formada por pliegues epiteliales, estos pliegues varían en las diferentes especies (Thompson, 1954). En M. curema se distinguen claramente 9 pliegues en los ejemplares adultos. El estómago se diferencia en 2 secciones y externamente tiene aspecto globular. La parte posterior tiene el aspecto y forma de un saco, con paredes delgadas y presentando un apéndice gástrico de gran tamaño. El alimento es primeramente almacenado y parcialmente digerido en esta porción. De acuerdo a Babak (1903) y Thompson (1954) los ciegos pilóricos se encuentran relacionados con la secreción fisiológica de enzimas del tipo diastasa y tripsina. La parte anterior del estómago se encuentra rodeada de fuertes músculos y gruesas paredes, lo que determina que la cavidad estomacal se reduzca y se facilite la trituración del alimento por acción mecánica. Una válvula pilórica regula la entrada del alimento al intestino. El intestino se encuentra reunido en un masa intestinal. Es de paredes delgadas y de considerable longitud. Normalmente se reviste de tejido lipídico el cual aumenta o disminuye en relación al estado del pez. 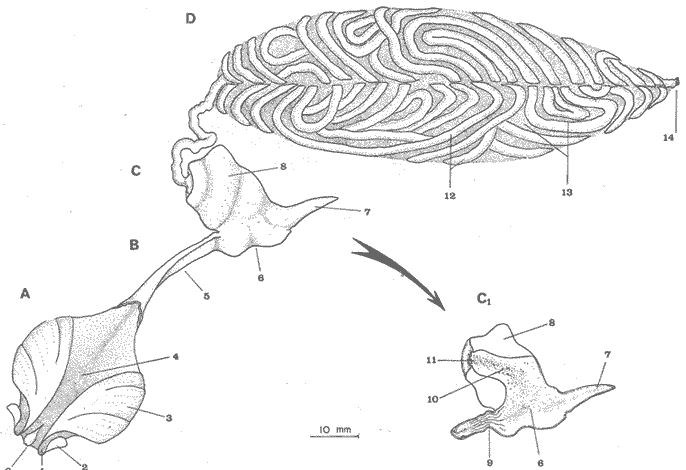 Fig. 10. Morfología del sistema digestivo de Mugil curema. A. Faringe. 0 = entrada de la faringe, 1 = surcos faríngeos externos, 2 = pliegues faríngeos, 3 = músculos faríngeos, 4 = canal faríngeo. B. Esófago. 5 = tubo esofágico. C. Estómago. 6 = cámara cardiaca, 7 = apéndice estomacal, 8 = cámara piló rica musculosa, 9 = pliegues epiteliales (válvula) , 10 = cavidad pilórica, 11 = válvula pilórica. D. Intestinos. 12 = tubo intestinal, 13 = tejido graso, 14 = hacia el ano. Ebeling (1957) ha estudiado las adaptaciones de los dientes de las "lisas" a varios tipos de alimentación, observando que a pesar de las ligeras diferencias en hábitos alimenticios, las piezas dentarias están adaptadas sutilmente para ello. La selección de finas partículas de alimento tiene significado ecológico por su mayor valor nutritivo en comparación con las partículas mayores (E. P. Odum y De la Cruz, 1967; W. E. Odum, 1968a). Estudios en ejecución en el sistema lagunar costero de Guerrero enfatizan aspectos cuali y cuantitativos del detritus orgánico (origen, proceso y resultado) por su importancia como alimento en varios organismos. Por el espectro trófico encontrado en estos estudios se constata que las "lisas" aprovechan, además del detritus y materia orgánica, ostrácodos, nemátodos, foraminíferos, microgastrópodos, anélidos, isópodos, fragmentos de vegetales, algas filamentosas y diatomeas bentónicas. En consecuencia puede concluirse que M. curema es una especie DETRITÍVORA vegetal siendo por lo tanto un Consumidor de Primer Orden de acuerdo a Yáñez-Arancibia (1975 b) . El alimento preferencial es el detritus; luego sedimentos inorgánicos finos sobre cuyas partículas vive asociada microfauna y flora; luego algas filamentosas y finalmente como alimento variable circunstancial micro- y meio- fauna enlistada más arriba. Este tipo de alimentación representa un patrón relativamente definido y constante, que sin embargo, puede sufrir ligeras variaciones de acuerdo a: a) la zona o lugar, b) la estación del año, y c) la disponibilidad del alimento (Fig. 9) El examen del estado del pez indicó que en septiembre, más del 80% de los peces se encontraban delgados; en octubre más del 80% presentaba algo más de un hilillo de grasa en el tracto digestivo; en diciembre, se encontraban ejemplares predominantemente en el estado de no muy gordos; en enero, marzo y abril los ejemplares eran predominantemente delgados; y los ejemplares gordos se encontraban con mayor frecuencia en los meses de junio a agosto (Fig. 11). Cada punto del gráfico representa el 80 o más porciento de los peces en dicho estado. Existe una aparente relación directa entre el estado del pez y el grado de llenado en que se encuentran los estómagos analizados, y éstos a su vez con el crecimiento de la especie en las lagunas (Fig. 12). Al abrirse las barras durante el periodo (1) , los pequeños ejemplares que penetran se alimentan activamente y crecen rápidamente utilizando, probablemente, toda la energía para el crecimiento y por lo tanto no existe almacenamiento de grasa. Durante el periodo (2) el crecimiento es más lento y los peces pueden presentar algo de grasa en el tracto digestivo que les sirve como energía de reserva cuando la disponibilidad y/o calidad del alimento es menor además de las presiones ambientales intensas. Finalmente durante el periodo (3) predominan los ejemplares gordos con bastante grasa envolviendo el intestino que probablemente constituirá el material de reserva durante el periodo de la reproducción y el desove de los meses futuros. 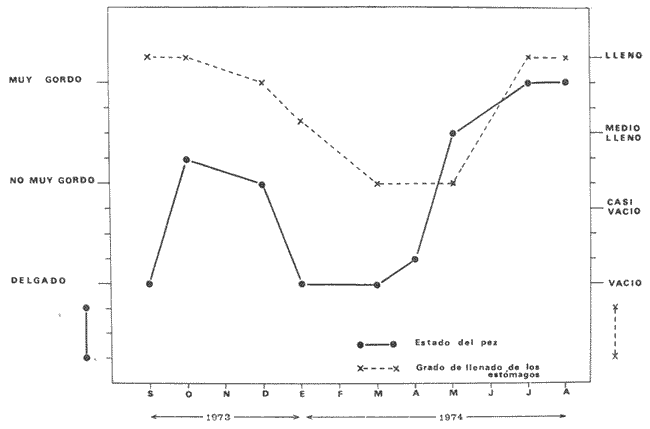 Fig.11. Relación entre el estado del pez y el grado de llenado de los estómagos, en Mugil curema. Cada punto del gráfico representa más del 80% de los peces en dicho estado, en el mes referido. Sistema lagunar costero de Guerrero, México. 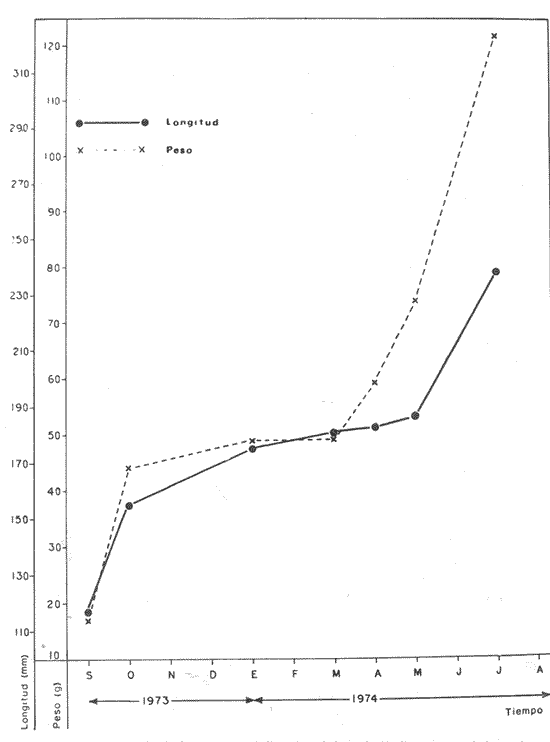 Fig. 12. Relación de peso/ longitud/ tiempo, para indicar el crecimiento de Mugil curema en el sistema lagunar costero de Guerrero, México. N = 784. CRECIMIENTOLas observaciones han señalado que al abrirse las barras durante el periodo (1) penetran grandes cardúmenes de pequeños ejemplares. Observaciones de líneas y áreas de crecimiento de las escamas de los costados indican que son ejemplares que tienen menos de 1 año de edad entre 6 y 8 meses (?) . El arte de pesca empleado captura los ejemplares más grandes de estos cardúmenes indicando predominio de individuos entre 100 y 120 mm de L. T. (Fig. 12), pero evidentemente son mucho más abundantes los ejemplares entre 60 y 90 mm de L. T. pero difíciles de capturar. Entre septiembre y noviembre el crecimiento y el incremento en peso es muy marcado y los ejemplares presentan sus tractos digestivos sin acumulación de grasa (Fig. 11). Este crecimiento se detiene en cierta medida durante el periodo (2). Lasserre (1975 a, 1975 b, y com. personal) indica que el crecimiento de las "lisas" es más marcado en mar abierto y que fenómenos de "stress" hacen lento el crecimiento de algunos Mugílidos por "efectos ecofisiológícos de osmorregulación". En otras palabras el metabolismo de las "lisas" sólo se centra en fenómenos de osmorregulación y el crecimiento es menos marcado durante alguna etapa de permanencia en ambientes estuarínos. En nuestras observaciones el crecimiento es muy rápido durante los periodos (1 y 3) y concordando con las apreciaciones de Lasserre (op. cit.) es muy lento durante un periodo de "stress". Al comenzar la época de las lluvias -periodo (3) desciende la salinidad y aumenta la disponibilidad del alimento. El crecimiento y el incremento en peso nuevamente se intensifica (Fig. 12) y los ejemplares se robustecen, engordan (Fig. 11) y alcanzan un avanzado estado de maduración. Las "lisas" abandonan los estuarios con una talla promedio de 230 mm de L. T., y poco menos de 2- años de edad. El primer desove ocurre probablemente entre lo 2 y 3 años de edad. El producto de ese desove (marzo-junio) aparentemente penetra a los estuarios de Guerrero en septiembre próximo continuando el ciclo dinámico de la especie. El ritmo de crecimiento es aproximadamente de 130 mm para el primer año y 100 mm para el segundo año. En el sistema lagunar estudiado las "lisas" crecen aproximadamente un promedio de 140 mm. Si las "lisas" que penetran en octubre (periodo 1) tienen entre 6-8 meses de edad, aparentemente el desove ocurrió en el mar entre los meses de abril-mayo (?). DINÁMICA Y MADUREZLas observaciones sobre M. curema en Guerrero indican que esta especie desova en el mar y al abrirse las bocas de las lagunas (aproximadamente en agosto-septiembre) penetran masivamente grandes cardúmenes de juveniles de 70 mm de L. T. promedio, los cuales crecen rápidamente alimentándose en el interior de los estuarios. Al cerrarse las bocas (más o menos en octubre-noviembre) , las "lisas" que quedan atrapadas alcanzan tallas considerables hasta de 270 mm de L. T. con un promedio de las poblaciones de 230 mm. Si sobreviven a la sobrepesca y a las presiones ambientales del periodo (2), vuelven al mar en el nuevo periodo de apertura de las barras, para completar la última etapa de su desarrollo gonádico y desovar. En el Atlántico se desconoce en gran medida la dinámica de esta especie y los estudios no están más avanzados de lo que se encuentran en las costas del Pacífico. Gunther (1956) la señala como una especie que penetra en aguas dulces y Anderson (1957) ha discutido el desove de M. curema en el Atlántico frente a Florida. Caldwell y Anderson (1959) indicaron el hallazgo (mayo) de larvas de esta especie en el mar, lejos de la costa, desgraciadamente en una nota científica, sin profundizar en ningún aspecto de la dinámica de las poblaciones. Springer y Woodburn (1960) han discutido en extenso los trabajos de Kilby (1955), Gunther (1945) y Mefford (1955), concluyendo con ello, y sus propios estudios, que M. curema no frecuenta en el estado adulto los estuarios y lagunas costeras, aunque su ocurrencia sería significátiva en el estado juvenil. Estas observaciones también han sido señalados por Cervigón (1966 y 1967), Carranza (1969 a y 1969 b), Carranza y Amezcua (1971 a y 1971 b) y parcialmente Amezcua (1972). Álvarez (1970) agrega que esta especie puede remontar ríos y Dahl (1971) señala que ejemplares que remontan aguas dulces por decenas de kilómetros puedan alcanzar grandes tamaños. El sistema lagunar de Guerrero no es una excepción a estas apreciaciones, pero por la dinámica particular de las lagunas ocurre que el cierre de las barras impide el retorno de los juveniles que voluntaria e involuntariamente permanecen dentro del estuario y alcanzan grandes tallas hasta el estado sexual IV. Es probable que esta dinámica permita un crecimiento más rápido de la especie por la gran disponibilidad del alimento dentro de las lagunas, y que como albergue les permiten sufrir menores presiones de predación. Sin embargo, nada sabemos del crecimiento de M. curema en mar abierto como para comparar con mayor exactitud. El desove no se produce en el interior de las lagunas, pero como se discutió anteriormente los ejemplares de grandes tallas que las abandonan aproximadamente en julio o agosto, se encuentran muy próximos a completar su madurez y por consiguiente a desovar. Jacot (1920) ha indicado que M. curema desova en mayo y junio dentro de un rango de abril a agosto, y que los juveniles penetran a los estuarios y se desarrollan rápidamente. Springer y Woodburn (1960) han señalado, por otra parte, que existe una sucesión en el desove de las "lisas" cercanas a Tampa Bay, donde M. cephalus desova primero, seguida tres o cuatro meses más tarde por M. curema y finalmente un mes después por M. tricodon. Anderson (1958) discute en particular el desove y crecimiento de M. cephalus frente a Florida. 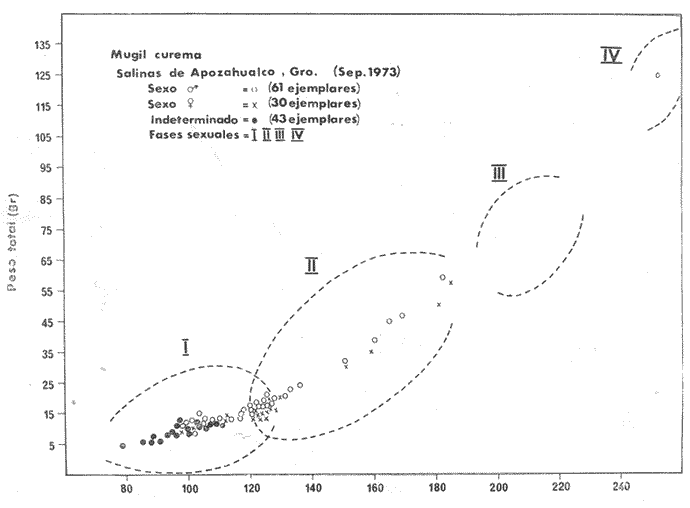 Fig. 13. Relación de peso/ longitud/ fases gonádicas, para indicar la relación de madurez de Mugil curema en el mes de septiembre (periodo 1), en Salinas de Apozahualco, Gro., México. En Guerrero, la frecuencia de tallas mayores dentro de las lagunas, ocurre en julio y desaparece rápidamente al abrirse las bocas siendo reemplazado por la ocurrencia masiva de los juveniles provenientes desde el mar en agosto-septiembre durante el periodo (1) prevalece el estadío de maduración gonádica I-II; (Figs. 13-14) durante el periodo (2) prevalecen los estadíos II-III; y durante el periodo (3) prevalecen los estadíos III-IV. 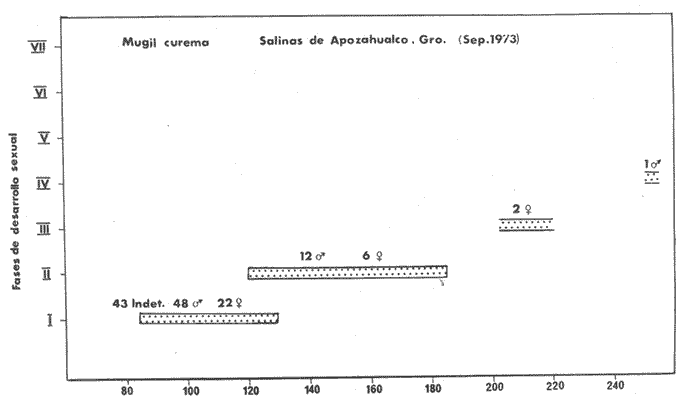 Fig. 14. Relación de la longitud total y las fases gonádicas de Mugil curema durante el mes de septiembre (periodo 1). Salinas de Apozahualco, Gro., México. De acuerdo a Mc Hugh (1967) y Yáñez- Arancibia (1975 a y 1975 b), y en parte a Gunther (1956) corresponde a una especie marina que penetra cíclicamente a los estuarios y lagunas al estado juvenil. Esto tiene por objeto protejerse, alimentarse y completar gran parte de su desarrollo. El desove, aparentemente se produce entre marzo y junio en ejemplares de 2 años y medio o más de edad. RELACIONES ECOLÓGICASLa alimentación, hábitos alimenticios y su posición trófica en la estructura de las comunidades ictiofaunísticas, determina que M. curema en el sistema lagunar costero de Guerrero, presente competencia interespectífica con otros peces Consumidores Primarios (detritívoros) como M. cephalus, Dormitator latifrons, Gobionellus microdon, Eleotris pictus, Gobiomorus maculatus (Yáñez-Arancibia, 1975 b). De estas especies, M. cephalus es la menos frecuente y abundante. Por el contrario D. latifrons es extraordinariamente abundante especialmente en las áreas más dulces de las lagunas de aguas salobres y particularmente en las lagunas dulceacuícolas (i. e., Tres Palos, Coyuca y Mitla) donde, a su vez, M. curema es muy escasa. Estos Mugílidos, Góbidos y Eléotridos constituyen un importante eslabón trófico para los peces Consumidores Secundarios y de Tercer Orden, y también para las aves acuáticas del área (Yáñez-Arancibia, 1975 b). M. curema presenta además una relación ecológica de competencia por alimento con otros peces Consumidores Primarios (omnívoros) pero el efecto es considerablemente menor que con los peces Consumidores Primarios (detritívoros) discutidos más arriba. Estas "lisas" sirven de alimento a a) otros peces, b) aves acuáticas, y c) el hombre, representando un papel ecológico muy importante por su efecto de conversión de la energía potencial del detritus en energía que es aprovechada por otros niveles tróficas, al ser predada la especie. Además, por su dinámica de penetrar desde el mar en grandes cardúmenes de juveniles es un importante "importador de energía" al ecosistema estuarino. A su vez, al ser predada por aves, por el hombre, y también por su dinámica de abandonar el estuario al estado adulto, es un importante "exportador de energía" del estuario. Interesantes observaciones permiten apreciar una aparente relación inversa entre la abundancia relativa de M. curema y de Penaeidos (i. e., Penaeus vannamei, P. sty1irostris, P. californiensis) . Esto se muestra en la figura 15 durante el periodo (1) de la laguna de Chautengo, para 13 estaciones de colectas, promediando el número de ejemplares capturados para 10 lances de pesca en cada estación. Es razonable suponer que esto se deba a una relación ecológica de competencia por espacio y alimento en un efecto combinado. Dall (1968) ha señalado que los "camarones" Penaeidos son oportunísticamente omnívoros alimentándose de la capa superficial del fondo. Odum y Heald. (1972) han señalado que Penaeus duorarum se alimenta en gran medida de partículas inorgánicas, detritus vegetal, algas filamentosas, microflora, y micro- y meio bentos. Esto constituye una alimentación muy similar a las "lisas". 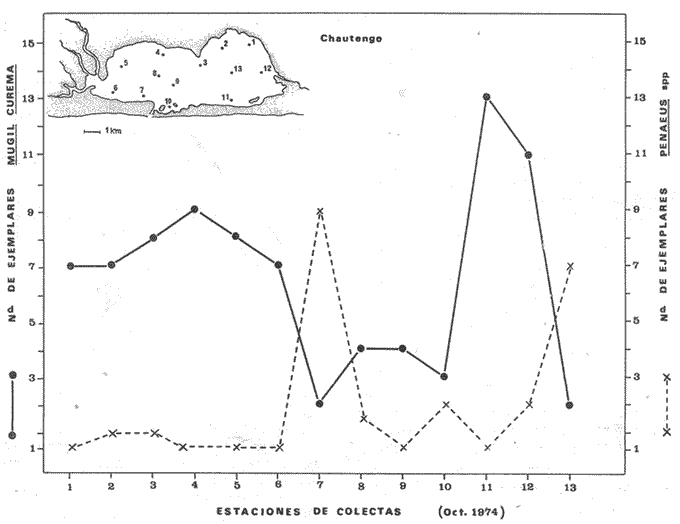 Fig.15. Relación de abundancia entre Mugil curema y Penacus spp. en la laguna de Chautengo, Gro., México, durante el periodo ecológico (1) de la laguna. Cada punto de las curvas representa el promedio de 10 lances de pesca en cada estación. Esta relación aparentemente inversa de la abundancia de "lisa" y "camarón" también ha sido observada en lagunas del noroeste de México, por Carranza (1970), tanto en volúmenes de captura (toneladas) para Caimanero como en pesca de atarraya en Etchoropo. Además P. Lasserre (com. personal) ha hecho la misma observación en Arcachón, Francia. En general, el rol ecológico de M. curema parece ser muy similar a M. cephalus, estudiada ampliamente en otras latitudes y discutida ecológicamente por Springer y Woodburn (1960), J. H. Day (1967), W. E. Odum y Heald (1972), J. W. Day et al. (1973 a y 1973 b), Heald et al. (1974). Sin embargo los estudios sobre M. curema no se han intensificado y merecen una atención especial desde el punto de vista bioecológico integral en las costas de México (Yáñez-Arancibia, 1975 a y 1975 b; Yáñez-Arancibia y Nugent, 1975). Conclusiones1. La alimentación de M. curema en el sistema lagunar costero de Guerrero, se basa fundamentalmente en el detritus vegetal, sedimentos inorgánicos y algas filamentosas. 2. El ritmo de crecimiento es aproximadamente de 130 mm para el primer año, y 100 mm para el segundo año, promedio. 3. En el sistema lagunar estudiado las "lisas" crecen aproximadamente 140 mm. 4. Los ejemplares juveniles que penetran durante el periodo (1) tienen menos de 1 año de edad (aprox. 68 meses). 5. Los ejemplares adultos que abandonan los estuarios a fines del periodo (3) tienen menos de 2 años de edad (aprox. 18-20 meses). 6. Algunos ejemplares de aproximadamente 3 años de edad penetran ocasionalmente a las lagunas durante el periodo (1) pero su frecuencia no es significativa en la estructura de las poblaciones. 7. En el sistema lagunar prevalecen los estadíos de maduración gonádica I-II durante el periodo (1); II-III durante el periodo (2) y III-IV durante el periodo (3). 8. El desove ocurre en el mar. El primer desove de la especie se produce alrededor de los 2 y medio años de edad, entre los meses de marzo a junio. 9. El periodo más apropiado para capturar este recurso en el sistema lagunar costero de Guerrero es en los meses de junio y julio cuando las "lisas" alcanzan las mayores tallas. Sin embargo la pesca debe ser racionalmente administrada para permitir la migración hacia el mar de un estoc básico de adultos que restablezcan el equilibrio natural de la especie. 10. Las perspectivas de cultivos de M. curema parecerían tener mejores resultados en las lagunas de Tres Palos, Coyuca y Mitla, considerando el amplio rango de tolerancia de las "lisas" a las bajas salinidades. Estas lagunas son grandes cuerpos de aguas casi dulces, con bastante disponibilidad de alimento y ausencia casi absoluta de peces predadores de segundo y tercer orden. Sus variaciones anuales no son marcadas. AgradecimientosA José Stuardo, experto de la OEA en biología marina, por sus críticas, sugerencias, comentarios y revisión cuidadosa del manuscrito. A Richard Nugent, experto de la UNESCO en biología marina, por sus comentarios y discusión de algunos aspectos ecológicos. P. Lasserre de Université de Bordeaux Arcachon (France), W. E. Odum de University of Virginia (USA) y J. W. Day de Louisiana State University (USA), por sus comentarios y valiosos cambios de impresiones. A mi esposa V. L. de Yáñez y al señor J. Curiel, estudiantes de biología, su inapreciable ayuda en algunas colectas y en el laborioso trabajo de procesar muestras. Este estudio fue financiado por contrato No. OC-E03-74 entre la Comisión del Río Balsas, SRH, y el Centro de Ciencias del Mar y Limnología, UNAM. LITERATURAALBERTINE-B. J., Biologie des stades juveniles de téleostéens Mugilidae Mugil auratus Risso 1810, Mugil capito Cuvier 1829 et Mugil saliens Risso 1810. 1. Régime alimentaire. Aquaculture 1973 251-266 2 AL-HUASSAINi, A. H. On the functional morphology of the alimentary tract of some fish in relation to their feeding habits. Quart. J. Micr. Sci. 1949 109-139 90 ÁLVAREZ, J. V. Peces Mexicanos (Claves). Inst. Nal. Invest. Biol. Pesq., Com. Nal. Consult. Pec. 1970 166 p., 62 figs. AMEZCUA, F. Aportación al conocimiento de los peces del sistema de Agua Brava, Nayarit. Tesis profesional Fac. Ciencias Univ. Nal. Autón. México 1972 209 p., 12 tablas, 14 láms. ANDERSON, W. W. Early development spawning, growth, and occurrence of the silver mullet (Mugil curema) along the South Atlantic coast of the United States. U. S. Fish. and Wildlife Serv., Fish. Bull. 1957 396-414 57 (119) ---, Larval development, growth, and spawning of striped mullet (Mugil cephalus) along the South Atlantic coast of the United States. U. S. Fish and Wildl. Serv., Fish. Bull. 1958 501-519 58 (144) ARPI, B., I. GONZÁLEZ, A. VÁSQUEZ, A. ORTEGA, V. MARTÍNEZ Informe sobre la pre-investigación hidrográfica en las lagunas costeras del Estado de Guerrero. Informe Centro de Ciencias del Mar y Limnología, Univ. Nal. Autón. México. 1974 43 p., 15 tablas, 48 mapas. BABAK, E. Ueber den Einfluss der Nahrung auf die Lange des Darmakanales. Biol. Zbl. 1903 477-483 23 BALL, R. C. Relationships between available fish food, feeding habits of fish and total fish production in a Michigan Lake. Tech. Bull. Michigan St. Call. Agr. Esp. Sta. 1948 1-59 206 BARDACH, J. E., J. H. RYTHER, W. O. McLARNEY Aquaculture. The Farming and Husbandry of Freshwater and Marine Organisms. Wiley-Interscience N. Y. 1972 868 p. CALDWELL, D. K., W. W. ANDERSON Offshore occurence of larval silver Mullet Mugil curema in the Western Gulf of Mexico. Copeia 1959 252-253 3 CARRANZA, J. Primer informe sobre el estudio taxonómico de la fauna de peces de los Planes Piloto Escuinapa y Yavaros. 2º Informe de Contrato de Estudios EI-69-51 Univ. Nal. Autón. México, Inst. Biol. y SRH 1969a 33 p., 14 figs., 3 mapas. ---, 3er. Informe de Contrato de Estudios EI-6951 Informe preliminar sobre la alimentación y hábitos alimenticios de las principales especies de peces de las zonas de los Planes Piloto Yavaros y Escuinapa. Univ. Nal. Autón. México, Inst. Biol., y SRH 1969b 50 p., 7 figs. ---, Informe final del Contrato de Estudios Nº EI-69-51 Informe final sobre la primera etapa del estudio de la fauna ictiológica y depredadores del camarón en las lagunas y esteros de los Planes Piloto Escuinapa, Sin. Y Yavaros, Son. Univ. Nal. Autón. México, Inst. Biol. y SRH 1970 28 p., 5 figs CARRANZA, J. F. AMEZCUA Parte del 2º Informe de Contrato de Estudios Nº NAYEST-7 Plan Nayarit, SRH, Informe de avance de trabajo, incluyendo información ecológica básica, datos de distribución de postlarvas e informe preliminar sobre fauna ictiológica. Inst. Biol., Univ. Nal. Autón. México 1971a 58-80, 1 fig., 1 tabla. CARRANZA, J., F. AMEZCUA 2° Parte del Informe Final de Contratos de Estudio Nº NAY-EST-7 Plan Nayarit, SRH, Resultados finales de hidrología, plancton y fauna ictiológica en el sistema Teacapán-Agua Brava (octubre 1970-junio 1971) Inst. Biol., Univ. Nal. Autón. México 1971b 88-115, 13 tablas. CASTELLANOS, L. Subprograma de Hidrología. Informe Final de la 2ª Etapa del Programa de Uso de la Zona Costera de Michoacán y Guerrero. Convenio Comisión del Río Balsas, SRH y Centro de Ciencias del Mar y Limnología, UNAM. México 1975 44 p., 63 tablas, 46 figs. CERVIGÓN, F. Los peces marinos de Venezuela. Estación de Investigaciones Marinas de Margarita Fundación La Salle de Ciencias Naturales Caracas 1966 951 p. 2 ---, Los Peces. Ecología Marina R. Margalef La Salle Caracas 1967 Cap. 10: 308-355, 156 figuras. DAHL, G. Los peces del norte de Colombia. INDERENA Bogotá 1971 391 p., figs.-texto. DALL, W. Proc. World Sci. Conf. Biol. and Culture of Shrimps and Prawns, Fish. Food and feeding of some Australian penaeid shrimp. Rep. FAO 1968 251-258 57 (2) DARNELL, R. M. Food habits of fishes and larger invertebrates of Lake Pontchartrain, Louisiana, an estuarine community. Publ. Inst. Mar. Sci., Univ. Texas 1958 353-416 5 ---, Trophic spectrum of an estuarine community based on studies of Lake Pontchartrain, La. Ecology 1961 553-568 42 (3) ---, Fishes of the Río Tamesí and Related Coastal Lagoons in East-Central Mexico. Ins. Mar Sci. 1962 299-365 8 ---, The organic detritus problem. Estuaries G. H. Lauff Publ. Am. Assoc. Adv. Sci. 1967 374-375 83 ---, Organic detritus in relation to the estuarine ecosystem. Estuaries G. H. Lauff Publ. Am. Assoc. Adv. Sci. 1967b 376-382 83 DAY, J. H. The biology of Knysna estuary, South Africa. Estuaries. G. H. Lauff Publ. Am. Assoc. Adv. Sci. 1967 397-407 83 DAY, J. W., W. G. SMITH, P. R. WAGNER, W. STOWE Community structure and Carbon budget of a salt marsh and shallow bay estuarine system in Loui siana., Publ. Nº LSU-SG-72-04 Center for wetland Resources. Louisiana State University, Baton Rouge, La. 1973a. 79 p. DAY, J. W., W. G. SMITH, C. S. HOPKINSON Proc. Coastal Marsh and Estuary Symposium. Some trophic relationships of marsh and estuarine areas. Louisiana State University, Baton Rouge, La. Jul. 1972 1973b 115-135 EBELING, A. M. The dentition of Eastern Pacific mullets, with special reference to adaptation and taxonomy. Copeia 1957 173-185, 7 figs., 2 láms., 2 tablas. 3 EGUSA, S. Some notes on the Feeding habits of the Young Mugil cephalus Linnaeus. Bull. Jap. Soc. Sci. Fish. 1950 715-720 15 (11) GUNTHER, G. Studies on marine fishes of Texas. Publ. Inst. Mar. Sci., Univ. Texas 1945 1-190 1 (1) ---, A revised list of euryhalin fishes of north and middle America. Am. Midl. Nat. 1956 345-354 56 (2) GUTIÉRREZ, M., A. CARRANZA Subprograma de Geología. Informe Final de la 2ª Etapa del Programa de Uso de la Zona Costera de Michoacán y Guerrero. Convenio Comisión del Río Balsas, SRH y Centro de Ciencias del Mar y Limnología, UNAM, México. 1975 63 p. figs.-texto. HESTER, J. M., B. J. COPELAND Nekton population dynamics in the Albemarle Sound and Neuse River Estuaries. Sea Grant Program Publication UNC-SG-75-02 A University of North Carolina. 1975 129 p. HIATT, R. W. Food chains and the food cycle in Hawaiin fish ponds. Part I. The food and feeding habits of mullet (Mugil cephalus), milkfish (Chanos chanos) and the tenpounder (Elops machnata). Res. Paper Trans. Amer. Fish. Soc. 1944, 1947 250-261., 250-261 2: 74 HILDEBRAN, S. F., W. C. SCHROEDER Fishes of Chesapeake Bay. Bull. U. S. Bur. Fish. 1928 1-366 43 (1) JACOT, A. P. Age, growth and scale characters of the mullet Mugil cephalus and M. curema. Trans. Amer. Micr. Soc. 1920 199-229 39 KILBY, J. D. The fishes of two Gulf coastal marsh areas of Florida. Tul. Stud. Zool. 1955 176-247 2 (8) KJELSON, M., D. R. COLBY Estimating the absolute abundance of estuarine fish population. Estuarine Research Federation Galveston, Texas 6-9 Oct. 1975 (en prensa). 1975 KOBELKOWSKY, A. y A. RESÉNDEZ Estudio comparativo del endoesqueleto de Mugil cep,halus y Mugil curema (Pisces, Perciformes). An. Inst. Biol. Univ. Nal. Autón. México, Ser. Cienc. del Mar y Limnol. 1974 33-84, 31 láms. 43 (1) LANKFORD, R. R. Informe Centro de Ciencias del Mar y Limnología, UNAM. Informe del estudio de reconocimiento de la región costera de los estados de Michoacán y Guerrero. Subprograma de Geología. Descripción general de la zona costera de Guerrero y Michoacán. 1974 42 p. ---, Coastal lagoons of Mexico- Their origin and classification. Estuarine Research Federation. Galveston, Texas Oct. 6-9, 1975 (en prensa). 1975 LASSERRE, P. Osmoregulation and differential penetration of two grey mullets, Chelon labrosus (Risso) and Liza ramada (Risso) in estuarine fish ponds. Aquaculture 1975a. 323-344 5 ---, Osmoregulation. Estuarine Research Federation Galveston, Texas, 6-9 Oct. 1975 (en prensa). 1975b. LICEA, S., E. GÓMEZ, M. E. GÓMEZ Informe de avance del estudio del fitoplancton en 5 lagunas del Estado de Guerrero (Resultados Preliminares), Noviembre 1974. 27 p., 7 tablas, 3 figs., 3 láms. Informe Final de la 29 Etapa del Programa de Uso de la Zona Costera de Michoacán y Guerrero. Convenio Comisión del Río Balsas, SRH y Centro de Ciencias del Mar y Limnología, UNAM, México 1975 750 p. Contrato N9 OC-E-03-74. McHUGH, J. L. Management of estuarine fisheries. A Symposium on Estuarine Fisheries. Am. Fish. Soc. Spec. Publ. 1966 133-151 3 ---, Estuarine Nekton. Estuaries G. H. Lauff Publ. Am. Assoc. Adv. Sci. 1967 581-619 83 MEFFORD, H. P. The silver mullet fishery in South Florida. Univ. Miami Mar. Lab. Rept. 1955 iii, 15 p. 5534 NIKOLSKY, G. V. The ecology of fishes. Academic Press, London, New York 1963. 352 p. NIXON, S. W. y C. A. OVIATT Ecology of a New England satl Marsh. Ecol. Monographs 1973 463-498 43 (4) ODUM, E. P. y A. A. DE LA CRUZ Detritus as a major component of ecosystems. A. I. B. S. Bull. 1963 39-40 13 (3) ODUM, E. P. y A. DE LA CRUZ Particulate organic detritus in a Georgia salt marsh-estuarine ecosystem Estuaries G. H. Lauff Publ. Am. Assoc. Adv. Sci. 1967 383-389 83 ODUM, W. E. The food and feeding of the striped mullet, Mugil cephalus, in relation to the environment. M. S. Thesis, Institute of Marine Sciences, University of Miami Miami, Florida 1966 118 p. ---, The ecological significance of fine particle selection by the striped mullet Mugil cephalus. Limnol. Oceanogr. 1968a. 92-98, 2 figs. 13 (1) ---, Mullet grazing on a Dinoflagellate bloom Chesapeake Science 1968b. 202-204, 2 figs. 9 (3) ---, Utilization of the direct grazing and plant detritus food chains by the striped mullet Mugil cephalus. Proc. Symposium on Marine Food Chains J. Steele 1970 222-240. ---, Pathways of energy flow in a South Florida estuary. Ph. D. Dissertation Univ. of Miami. Sea Grant Program Tech. Bull. 1971 162 p. 7 ODUM, W. E. y E. J. HEALD Trophic analyses of an estuarine mangrove community. Bull. Mar. Sci. 1972 671-738 22 (3) PEARSE, A. S. Animals in brackish waters ponds and pools at Dry Tortugas. Pap. Tortugas Lab. 1932 125-142 27 PILLAY, T. V. R. In the food and feeding adaptations of the Gray mullet Mugil tade Forks. Sci. and Cult. 1953 261-262 16 (6) RAMÍREZ, G. R. Estudio ecológico preliminar de las lagunas costeras cercanas a Acapulco. Revta. Soc. mex. Hist. Nat. 1952 199-218 13 SCHROEDER, W. C. Fishes of Key West and the clam industry of Southern Florida. Rep. U. S. Comm. Fish (1923) 1924 1-74 12 S. I. C. Situación actual y posibilidades de la pesca en Guerrero. Secretaría de Industria y Comercio Comisión Nacional Consultiva de Pesca, México. 1970 36 p. SPRINGER, V. G. y K. D. WOODBURN An ecological studies of the fishes of the Tampa Bay Area. Prof. Pap. Ser. Mar. Lab. Fla. 1960 104 p. 1 S. R. H. Informe de la Comisión Interdísciplinaria a la Laguna de Chautengo, Gro. Secretaría de Recursos Hidráulicos Dirección de Acuacultura (mimeografeado). 1975 STUARDO, J. y A. MARTÍNEZ Resultados generales de una prospección de los recursos biológicos y pesqueros del sistema lagunar costero de Guerrero, México. Mem. VI Congreso Latinoamericano de Zoología, México (en prensa). 1975 STUARDO, J. y M. VILLARROEL Aspectos ecológicos y distribución de los moluscos en las lagunas costeras de Guerrero, México. An. Centro Cienc. del Mar y Limnol., Univ. Nal. Autón. México 1976 65-92 3 (1) STUARDO, J. y J. ESTÉVEZ Aspectos generales de la biología y ecología del "mejillón de laguna" Mytella strigata (Hanley) en dos lagunas costeras de Guerrero, México. Informe Final de la 2,9 Etapa del Programa Uso de la Zona Costera de Michoacán y Guerrero. Convenio Comisión del Río Balsas, SRH y Centro de Ciencias del Mar y Limnología, UNAM. México. 1975 750 p. Contrato Nº OC-E-03-74. STUARDO, J., A. MARTÍNEZ, L. A. YÁÑEZ, J. A. WEINBORN y J. RUIZ Prospección de los recursos biológicos y pesqueros del sistema lagunar de Guerrero, y en parte, del litoral rocoso de Michoacán. An. Centro Cienc. del Mar y Limnol., Univ. Nal Autón. México (en prensa) . 1974 SUZUKI K. Biology of striped mullet, Mugil cephalus Linnaeus. 1. Food contents of yougs. Report Fac. Fish. Univ. Mie 1965 295-305 5 (2) THOMPSON, J. M. Growth and habits of the sea mullet Mugil dobula Gunther, in western Australia. Aust. J. Mar. Freshw. Res. 1951 193-225, 13 figs. 2 ---, The organs of feeding and food of some australian mullets. Aust. J. Mar. Freshw Res. 1954 469-485, 6 figs., 2 láms. TREWAVAS, E. The status of the American mullets, Mugil brasillensis and M. curema. Copeia 1950 149 2 VILLARROEL, M. Relación entre macroinvertebrados bentónicos (especialmente moluscos) y sedimentos en tres lagunas del Estado de Guerrero, México. 64 p., 13 tablas, 12 figs. In: Informe Final de la 2da. Etapa del Programa de Uso de la Zona Costera de Michoacán y Guerrero. Convenio Comisión del Río Balsas, SRH. y Centro de Ciencias del Mar y Limnología, UNAM., México 1975 750 p. Contrato Núm. OC-E-03-74. WARME, J. E. y L. A. SÁNCHEZ Sedimentary patterns in west coast lagoons. Estuarine Research Federation. Galveston, Texas, Oct. 6-9, 1975 (en prensa). 1975 YÁÑEZ-ARANCIBIA, L. A. Prospección preliminar de la fauna ictiológica en el sistema lagunar costero del Estado de Guerrero (Pacífico Central de México). Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México. Problema de Investigación 1974 199 págs., 2 tablas, 31 figs., 14 láms. YÁÑEZ-ARANCIBIA, L. A. Sobre los estudios de los peces en las lagunas costeras: Nota científica. An. Centro Cienc. del Mar y Limnol., Univ. Nal. Autón. México 1975a. 52-57 2 (1) YÁÑEZ-ARANCIBIA, L. A. Relaciones tróficas de la fauna ictiológica del sistema lagunar costero de Guerrero y aspectos parciales de la dinámica de poblaciones de los peces de importancia comercial. 230 p., 104 tablas, 71 figs., In: Informe Final de la 2da. Etapa del Programa de Uso de la Zona Costera de Michoacán y Guerrero. Convenio Comisión del Río Balsas, SRH y Centro de Ciencias del Mar y Limnología, UNAM., México 1975b. 750 p. Contrato Núm. OC-E03-74. YÁÑEZ-ARANCIBIA, L. A. y R. S. NUGENT Síntesis de antecedentes bióticos y abióticos de los ecosistemas estuarinos de Nayarit, México. Publ. Ciencias Biológicas. Univ. Autón. Nuevo León, México. Vol. in memoriam Dr. E. Caballero (en prensa). 1975 YÁÑEZ-ARANCIBIA, L. A., J. CURIEL, V. L. DE YÁÑEZ Prospección biológica y ecológica de Galeichthys caerulescens (Gunther) en el sistema lagunar costero de Guerrero, México. (Pisces: Ariidae). An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México 1975 125-180 3 (1)
|

