|
TOXICIDAD EN ESPONJAS Y HOLOTURIAS
GERARDO GREEN
Universidad Nacional Autónoma de
México, Centro de Ciencias del Mar y Limnología.
GERALD J. BAKUS
Allan Hancock Foundation. University of Southern
California. Los Ángeles, California 90007, USA.
La toxicidad en esponjas y holoturias está
relacionada en forma inversa con la latitud y puede alcanzar 100 por ciento
para las holoturias en arrecifes coralinos con una alta diversidad de especies.
La evidencia obtenida en aproximadamente 700 experimentos y observaciones bajo
el agua sugiere que la predación de peces ha resultado en la
selección natural para compuestos químicos nocivos y
tóxicos en especies de esponjas y holoturias.
Toxicity in sponges and holothurians is inversely
related to latitude and may reach 100 percent for liolothurians in
high-diversity coral reefs. Evidence from approximately 700 experiments and
from underwater observations suggests that predation by fishes has resulted in
natural selection for noxious and toxic chemical compounds in species within
these taxa.
Hace una década se sugirió que la toxicidad es uno de los varios mecanismos de defensa que los invertebrados marinos han evolucionado. en respuesta a la predación (Bakus, 1964). Más información sobre toxicidad de invertebrados bénticos de arrecifes coralinos ha sido reportada por Bakus (1966, 1967, 1968, 1969, 1973), Halstead (1965), Glynn (1965), Russell (1965), Jespersen y Lützen (1971) y Bryan (1973). McAllister (1968) reportó que sólo 12 de 770 especies de peces canadienses marinos y de aguas dulces son tóxicos al hombre y la mayoría de éstos son poco comunes. Siete de estas 12 especies tóxicas son venenosas. En contraste, información de Halstead (1967) sugiere que los peces venenosos y ponzoñosos son considerablemente más comunes en los trópicos que fuera de ellos (Bakus, 1969). No existe suficiente información en cuanto a otros taxa marinos para poder hacer este tipo de comparación. Puesto que no hay información adecuada sobre toxicidad, para sitios geográficos específicos, ahora se reporta el grado con el cual la toxicidad en esponjas y holoturias cambia con la latitud y con la temperatura del agua y el habitat correspondientes. Estudios anteriores (Yamanouchi, 1955) indicaron que varios peces marinos son sensibles a saponinas esteroides (Holoturinas) de ciertas holoturias y que no obstante que los peces de agua dulce son ligeramente más resistentes a la Holoturina, estos últimos son apropiados como organismos experimentales. Esto ha sido confirmado en este trabajo. MATERIAL Y MÉTODOSEl propósito de este método experimental fue el de determinar si una esponja u holoturia era tóxica a peces y obtener una aproximación de su grado de toxicidad. Las técnicas para la determinación de toxicidad en holoturias y esponjas son las siguientes: Pequeños peces marinos Apogon retrosella (Gill) , Clinocottus analis (Girard), Eupomacentrus sp., Gibbonsia elegans (Cooper), Harengula sp., Lythrypnus dalli (Gilbert) y el pez de agua dulce Carassius auratus (Linnaeus) fueron usados como organismos experimentales. Los peces marinos pesaron aproximadamente 4 g y los de agua dulce de 1.5 a 2 g. Se usaron peces marinos en muchos, de los estudios para poder asegurarse de que las especies locales de peces están respondiendo a toxinas de esponjas y holoturias con las cuales están asociadas. Un pedazo de la pared del cuerpo de una holoturia pesando 2 g (peso húmedo) es cortado en pedazos más pequeños y puesto en etanol de 95 por ciento a hervir por 20 minutos. El extracto es secado, pesado y añadido a un recipiente conteniendo 100 ml de agua de mar o agua dulce a temperatura ambiente. Un pez experimental es colocado en el recipiente y el comportamiento del pez es observado durante un periodo determinado. Experimentos control son llevados a cabo simultáneamente. Cinco gramos (peso húmedo) de esponja son homogeneizados con 20 ml de cada uno de los siguientes solventes por separado: agua, metanol, etanol, acetona y cloroformo. El homogeneizado de la esponja es centrifugado y el sobrenadante es evaporado. El extracto crudo evaporado es disuelto en 300 ml. de agua dulce en un recipiente en el cual un pez experimental es colocado. El comportamiento del pez es observado durante un periodo determinado. Los experimentos control son llevados a cabo simultáneamente. La prueba de toxicidad en holoturias fue determinada para la pared del cuerpo, víceras y túbulos de Cuvier separadamente. La información presentada aquí está basada únicamente en extractos de la pared del cuerpo ya que esta parece ser la estructura protectora en la mayoría de las holoturias. RESULTADOS Y DISCUSIÓNEn la tabla 1, en donde estos resultados son comparados con los de Yamanouchi (1955), sólo aproximadamente 25 por ciento de las holoturias estudiadas en las Islas de San Juan, Washington, son tóxicas a peces, y esta toxicidad es ligera en relación a la de holoturias tropicales. La incidencia de toxicidad se incrementa hacia los trópicos y alcanza un máximo (100 por ciento de las especies estudiadas en las Islas Palau) en donde los arrecifes coralinos y los peces asociados exhiben un alto grado, de heterogeneidad ambiental y diversidad de especies, respectivamente. La relativamente alta incidencia de toxicidad en holoturias de Japón puede estar relacionada en parte con el hecho de que la corriente nor-ecuatorial transporta agua cálida a la parte sur de Japón. La tabla 2 muestra la misma tendencia de toxicidad en que sólo 9 por ciento de las esponjas estudiadas en las Islas San Juan, Washington, son tóxicas a peces mientras que el 75 por ciento de las esponjas estudiadas en un arrecife coralino cerca de la ciudad de Veracruz, México, son tóxicas. Las tres especies de esponjas que son tóxicas en Washington tienen una muy amplia distribución. El número de especies de holoturias estudiadas en la Isla San Juan, Washington, es mayor que aquél de las Islas Palau ya que en la primera región las holoturias son mejores conocidas y fueron colectadas a profundidades mayores. Las esponjas fueron colectadas a mayor profundidad y sobre una área considerablemente mayor en las Islas San Juan, Washington, que en Veracruz, México. Veintiuna de veintisiete especies de esponjas tóxicas en Veracruz viven expuestas a peces predadores potenciales y las restantes 6 especies tóxicas viven igualmente expuestas y no expuestas a peces (por ejemplo, bajo corales). De 9 especies de esponjas no tóxicas a peces, 6 viven no expuestas a peces, 1 crece expuesta y no expuesta, y 2 viven expuestas (una de las cuales produce un exudado púrpura que es nocivo para peces) . Si hubiera información disponible sobre arrecifes coralinos bien desarrollados en el Pacífico ecuatorial occidental, se esperaría que casi todas las esponjas creciendo expuestas a peces predadores fueran tóxicas y/o químicamente nocivas a dichos peces. Esta conclusión está basada en la tendencia. aquí demostrada y en evidencia de experimentos en las Islas Vírgenes y el Atolón Eniwetok. Se encontró que de las 5 especies de Porífera expuestas en la Bahía Lameshur, San Juan, Islas Vírgenes, 2 son tóxicas a peces locales, y las otras 3 son nocivas (Bakus, 1969). La más intensa actividad predadora de peces observada en este estudio ha sido en los atolones de Eniwetok y Fanning. En estos lugares existe una mayor actividad alimenticia de peces sobre algas bénticas e invertebrados que en nigún otro lugar visitado. Solamente una especie de esponja fue observada creciendo expuesta a peces en el Atolón Eniwetok y resultó ser altamente tóxica para dichos peces (Bakus, 1967, 1968) . En forma similar, la tabla 1 muestra que casi todas las especies de haloturias viviendo expuestas allí son altamente tóxicas a peces (Bakus,1968). 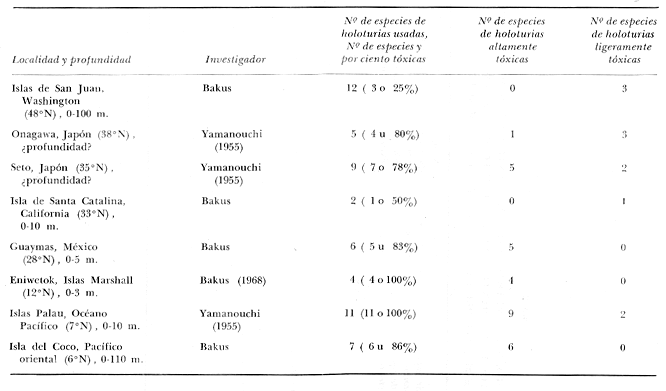 TABLA 1 TOXICIDAD DE HOLOTURIAS CON LATITUD. EXPERIMENTOS DE BAKUS: ALTAMENTE TÓXICA = MUERTE DEL PEZ DENTRO DE 15 MINUTOS (NORMALMENTE 10 MINUTOS). LIGERAMENTE TÒXICA = MUERTE DEL PEZ DENTRO DE 20 A 45 MINUTOS. EXPERIMENTOS DE YAMANOUCHI (1955): ALTAMENTE TÓXICA = TIEMPO PROMEDIO PARA 10 PECES (JUNTOS) DENTRO DE 60 MINUTOS. LIGERAMENTE TÓXICA = TIEMPO PROMEDIO PARA 10 PECES (JUNTOS) DE 116 A 173 MINUTOS Las observaciones bajo el agua sugieren que los peces amenazan sólo ligeramente a las esponjas y holoturias en Washington. En 14 inmersiones a profundidades de 15 a 20 m durante julio y agosto 1972, no se observaron más de 6 especies de peces predadores viviendo en el fondo marino en cualquier lugar, y rara vez se observaron algunos peces predadores en la columna de agua, aun cuando la visibilidad bajo el agua alcanzó 10 m. Además, los peces que fueron observados no mostraron interés cuando se intentó ofrecerles pedazos de cangrejos, erizos de mar o esponjas y holoturias tóxicas y no tóxicas. Se puede suponer que los peces estaban satisfechos en esas ocasiones. Se ha demostrado que los asteroides son los mayores predadores de muchos invertebrados en fondos duros en latitudes frío-templadas y altas latitudes en general (Mauzey et al., 1968; Dearborn y Allen, 1972 y Dayton et al., 1974). En notable contraste, no hay habitat marino qué soporte tan alta diversidad y biomasa de peces que aquel de los arrecifes coralinos y es bien conocido que la actividad predadora de peces sobre invertebrados bénticos es frecuentemente muy intensa en dicho habitat particularmente en el Pacífico ecuatorial (Bakus, 1964, 1966, 1967, 1968, 1969, 1974). Nuestros experimentos en el campo y en el laboratorio con holoturias cortadas en pedazos muy pequeños demostraron que los peces hambrientos raramente consumen las formas tropicales tóxicas, pero rápidamente consumen las especies ligeramente tóxicas no tropicales (Bakus, 1969, 1973, y 1974). En forma similar, estos experimentos indican que todos los peces estudiados rechazaron esponjas altamente tóxicas y mueren si son forzados a ingerir pequeños pedazos, de dichas esponjas (Bakus, 1969 y Green, 1974). Se sabe que sólo ciertas especies de peces tropicales altamente evolucionadas consumen esponjas tóxicas en la naturaleza (Randall y Hartman, 1968 y Green, 1974).  TABLA 2 TOXICIDAD DE ESPONJAS CON LATITUD. ALTAMENTE TÓXICA = MUERTE DEL PEZ DENTRO DE 60 MINUTOS. MODERADAMENTE TÓXICA =MUERTE DEL PEZ DENTRO DE 61 A 120 MINUTOS. LIGERAMENTE TÓXICA = MUERTE DEL PEZ DENTRO DE 121 A 720 MINUTOS. MUY LIGERAMENTE TÓXICA = MUERTE DEL PEZ DENTRO DE 720 A 960 MINUTOS Se puede argumentar que la toxicidad en holoturias se debe al efecto físico de la alta temperatura en la producción bioquímica de saponinas esteroides, ya que la Holoturina ha sido encontrada en concentraciones considerablemente mayores en estaciones calientes que en estaciones frías en Japón (Yasumoto et al., 1966). Esto tiende a apoyar la idea de que la Holoturina es un producto secundario del metabolismo, incrementándose directamente con la temperatura. Sin embargo, ciertas holoturias tropicales (Bakus, 1974) y muchas esponjas tropicales crípticas son no tóxicas a peces (Bakus, 1964 y Green, 1974) . Se sabe muy poco acerca de la química de las toxinas de esponjas y de los efectos de la temperatura sobre dichas toxinas (Sharma et al., 1970). Se reconoce que existen varias clases y causas de toxicidad en organismos marinos. El impacto biológico de los peces marinos sobre los invertebrados bénticos está bien documentado (Bakus, 1964, 1966, 1967, 1968, 1969; Dearborn y Allen, 1972; Hiatt y Strasburg, 1960; Randall, 1965, y Zaret y Paine, 1973). Nosotros creemos que los peces predadores han de jugar un papel selectivo muy importante, conduciendo a la producción y mantenimiento de mecanismos de defensa químicos en ciertos invertebrados de aguas tropicales, especialmente en aquellos asociados con arrecifes coralinos. Se asume por el momento que las defensas químicas nocivas y tóxicas son a menudo productos secundarios del metabolismo que han sido alterados y concentrados por selección natural durante diversos periodos. No obstante que ciertas de estas toxinas pudieron haber aparecido hace mucho tiempo, es probable que la selección natural continúa favoreciendo a "noxinas" (o sea, productos químico nocivos), que en, algunos casos ha conducido a la producción de toxinas, y que estos dos productos proveen un mecanismo, de defensa efectivo en contra de peces predadores. AgradecimientosLas investigaciones recibieron apoyo económico de The National Institutes of Health Biomedical Sciences Support Grants FR-07012-02 y FR-07012-03 y la Fundación Janss. Se agradece a lassiguientes personas e instituciones por su ayuda y apoyo: Agustín Ayala-Castañares, Universidad Nacional Autónoma de México, México, D. F.; a Henry Shafer y a Fernando Manrique, Escuela de Ciencias Marítimas y Tecnológicas de Alimentos, Guaymas, Sonora, México; a Roberto Bravo Samudio, Instituto de Investigaciones Médico-Biológicas de la Universidad Veracruzana, Veracruz, México; a Bernard C. Abbott, Allan Hancock Foundation, University of Southern California, Los Angeles, California, USA; a Russel Zimmer, Santa Catalina Marine Biological Laboratory, University of Southern California; y a Robert L. Fernald, Friday Harbor, Laboratories, University of Washington, Friday Harbor, Washington, USA. También a Kristian Fauchald y Bernard C. Abbott, University of Southern California; a Bruce W. Halstead, World Life Research Institute; a Willard D. Hartman, Yale University; a Ross E. Nigrelli, Osborn Laboratories of Marine Science; y a Admund Hobson, National Oceanic and Atmospheric Administration por haber leído el manuscrito. LITERATURABAKUS, G. J., . The effects of fish-grazing on invertebrate evolution in shallow tropical waters. Allan Hancock Fdn. Occ. Pap., 1964 1-29. 27: Nature, Some relationships of fishes to benthic organisms on coral reefs. 1966. 280-284. 210: Micronesica, The feeding habits of fishes and primary production at Eniwetok, Marshall Islands. 1967. 135-149. 3: Mar. Biol. Defensive mechanisms and ecology of some tropical holothurians. 1968. 23-32. 2: Int. Rev. Gen. Exper. Zool., Energetics and feeding in shallow marine waters. 1969. 275-369. 1: Biology and geology of coral reefs, The biology and ecology of tropical holothurians. Biology 1: In: Jones, O. A. y R. Endean (Eds.) 1973. 325-367. Vol. 2 Toxicity in holothurians: A geographical pattern. Biotropica, 1974. 229-236. 6 (4): BRYAN, P. G., Growth rate, toxicity, and distribution of the encrusting sponge Terpios sp. (Hadromerida: Suberitidae) in Guam, Mariana Islands. Micronesica, 1973. 237-242. 9 (2): DAYTON, P. K., G. A. ROBILLIARD, R. T. PAINE, y L. B. DAYTON, Ecol. Monogr., Biological accommodation in the benthic community at McMurdo Sound, Antarctica. 1974. 1-32. 44: DEARBORN, J. H., y K. W. ALLEN, Oxygen consumption and habits of some Antarctic echinoderms. Echinoderm Conference, Smithsonian Institution, Washington, D. C., 1972. September 6-8. GLYNN, P. W., Active movements and other aspects of the biology of Astichopus and Leptosynopta (Holothuroidea). Biol. Bull., 1965. 106-124. 129: GREEN, G., Ecology of toxicity and antibiosis in marine sponges. Disertación de Ph. D., University of Southern California. Los Ángeles, 1974. 137 p. HALSTEAD, B. W., Poisonous and venomous marine animals of the world. I. Invertebrates. U. S. Govt. Printing Office. Washington, D. C., 1965. 994 p. Poisonous and venomous marine animals of the world. II. Vertebrates. U. S. Govt. Printing Office. Washington, D. C., 1967. 821 p HIATT, R. W. y D. W. STRASBURG, Ecol. Monogr., Ecological relationships of the fish fauna on coral reefs of the Marshall Islands. 1960. 65-127. 30: JESPERSEN, A. y J. LÜTZEN, On the ecology of the aspidochirote sea cucumber Stichopus tremulus (Gunnerus). Norweg. J. Zool., 1971. 117-132. 19 (2): MAUZEY, K. P. y C. BIRKELAND y P. K. DAYTON, Ecology, Feeding behavior of asteroids and escape responses of their prey in the Puget Sound region. 1968. 603-618. 19: McALLISTER, D. E., Natl Museum Can. Nat Hist. Paper, Poisonus and venomous fishes of Canada. 1968. 1-11. 42: RANDALL, J. E., Proc. Internat. Conf. Trop. Ocean., Food habits of reef fishes of the West Indies. 1965. p. 665-847. RANDALL, J. E. y W. HARTMAN, Mar. Biol., Sponge-feeding fishest of the West Indies. 1968. 216-225. 1 (3): RUSSELL, F. E., Marine toxins and venomous and poisonous marine animals. Adv. Mar. Biol., 1965. 256-384. 3: SHARMA, G. M., B. VIG y P. R. BURKHOLDER, Food-drugs from the sea, Proceedings 1969. Antimicrobial substances of marine sponges. IV. In: Youngken, H. W. (Ed.) Mar. Tech. Soc. Washington, D. C., 1970: 307-310. YAMANOUCHI, T Publ. Seto Mar. Biol. Lab., . On the poisonous substances contaned in holotrurians. 1955. 183-202. 4: YASUMOTO, T., M. TANAKA y Y. HASHIMOTO, Distribution of saponin in echinoderms. Bull. Jap. Soc. Sci. Fish., 1966. 673-682. 32: ZARET, T. M. y R. T. PAINE, Science, Species introduction in a tropical lake. 1973. 449-451. 182:
|

