|
SISTEMÁTICA Y DISTRIBUCIÓN DE DIATOMEAS DE LA LAGUNA DE AGIABAMPO, SON./SIN., MÉXICO
SERGIO LICEA-DURAN
Centro de
Ciencias del Mar y Limnología, Universidad Nacional Autónoma de
México. El trabajo fue auspiciado por el contrato de estudios N9
El-68-115, entre la UNAM y la SRH.
Se presentan los resultados
del análisis de 21 muestras colectadas con red en superficie en tres
épocas del año, entre el periodo comprendido de septiembre de
1969 a mayo de 1970, en una laguna costera hiperhalina que comunica con el
Golfo de California.
Los análisis de las muestras
revelaron la existencia de 250 especies de diatomeas, correspondiendo el 61%, a
diatomeas pennales. En cada especie se indican referencias
bibliográficas en las que se confrontó la identificación
sistemática y los datos recabados de su distribución general;
asimismo su distribución local y abundancia relativa. Se incluyen, una
tabla con los datos hidrológicos, una tabla con la lista de especies
conteniendo su distribución y abundancia relativa, y 16 láminas
que ilustran el total de las especies identificadas.
Se
discuten las deficiencias del uso de redes en la colecta de diatomeas para
estudios de sistemática, recomendándose que es necesario incluir
muestreos con botellas "VanDorn". Se discuten las deficiencias en las
estimaciones de la abundancia relativa. Se analiza la posibilidad de la
existencia de formas o variedades en algunas especies. Se discuten
también algunas de las características ecológicas de las
diatomeas encontradas.
Se encontró que la mayor parte
de las especies son de características neríticas, especialmente
en la boca de la laguna y sitios aledaños, aunque también se
localizaron especies características de aguas salobres y dulces, las
cuales de una manera general fueron mas abundantes en los sitios mas alejados
de la boca, especialmente hacia el interior del Estero de Bacorehuis, lo que
hace pensar que se han adaptado a vivir en las condiciones hiperhalinas de la
laguna.
Se vio que la distribución de las especies
está determinada fundamentalmente por la marea y la salinidad,
pudiéndose diferenciar 4 facies ecológicas; 1) en la boca y
área circunvecina; 2) interior del Estero de Bacorehuis; 3) Ensenada de
Bamocha y 4) estación 12.
Results are given of the analyses of 21 surface samples which were
collected with plankton nets. The samples were collected during three periods
between September 1969 and May 1970 from a hypersaline lagoon in the coast of
the Gulf of California. There were 250 diatom species encountered in the
samples of which 61%, were pennal forms. A bibliography is given for each
species regarding systematic identification, general distribution, and the
local area of collection and relative abundance. Illustrations of all the
species identified are also included.
The problems of using
plankton net collections for sistematic studies are discussed, and it was
recommended that water samples, be collected with "Van-Dorn" bottles. The
problems of making accurate estimations of the relative abundance are
discussed.
The possibility is examined that some haves
varieties or forms. Also some ecologic characteristics of the diatoms
encountered are discussed.
It was found that most species
are characteristic of the marine neritic environment, especially those from the
lagoon inlet and adjacent areas. Species characteristic of brackish and fresh
water generally were most abundant in areas far from the lagoon inlet,
especially in the interior of the Estero Bacorehuis, and it is concluded that
they have become adapted to live in hypersaline conditions elsewhere in the
lagoon. It is concluded that species distribution is controlled mainly by tides
and salinity. Four ecologic environments are proposed: 1) the inlet and
adjacent areas; 2) the interior of Estero Bacorehuis; 3) the Ensenada Bamocha
and 4) station 12.
El Instituto de Biología por medio del Departamento de Ciencias del Mar y Limnología, emprendió en el año de 1968 un programa en las Lagunas Costeras y Estuarios del Noroeste de México, conocido como "Planes Piloto de Escuinapa y Yavaros", cuya finalidad primordial se enfocó a la planificación del desarrollo regional pesquero. En dichos estudios se escogió a la Laguna de Agiabampo como área de comparación entre las Lagunas del Huizache y Caimanero en el Estado de Sinaloa, y la Laguna de Yavaros en el Estado de Sonora. Los programas y detalles sobre este particular pueden encontrarse en Ayala-Castañareset al. (1968). El interés primordial que presenta esta área, parte del principio de tratarse de una región libre de los efectos de las obras de irrigación de distritos agrícolas, que en ocasiones vierten a las lagunas costeras contaminantes de diversos tipos que pueden producir efectos muy drásticos, todavía no bien conocidos. El objetivo principal de haber llevado al cabo esta monografía, es, además de contribuir al conocimiento de la flora diatomo1ógica mexicana, despertar y promover el interés por estos estudios, que en nuestro país, a pesar de las importantes contribuciones de ciertos. autores se encuentra en la etapa de iniciación, no obstante la importancia del grupo como integrante del plancton y por ser los productores primarios en el ecosistema acuático. ANTECEDENTESSegún la recopilación bibliográfica a la que se tuvo acceso, que de ninguna manera debe considerarse exhaustiva, se sabe que el estudio de las diatomeas de México se inició con las observaciones del doctor C. G. Ehrenberg (1838, 1841, 1854, 1869), quien hizo importantes contribuciones en el campo de la diatomologia mexicana. Dichos trabajos se refirieron a observaciones sobre diatomeas fósiles, recientes, de aguas dulces y marinas. Hizo descripciones de varios géneros y especies nuevas, asignándoles a algunas de ellas el nombre especifico de mexicana. Sus observaciones se realizaron principalmente en los Estados de México y Veracruz en diferentes localidades. Por comunicación personal de M. Ortega (1974), se sabe de la existencia relativamente copiosa acerca de las diatomeas fósiles mexicanas realizados por el mismo Ehrenberg; Schmidt (1873-1904), en su Atlas der Diatomaceen-kunde registra varias especies para las costas de México, algunas de las cuales llevan los nombres de las localidades mexicanas en donde fueron colectadas; Allen (1921, 1924, 1927, 1928a, 1928b, 1937, 1945a, 1945b) , realizó numerosos trabajos sobre las diatomeas del fitoplancton de la costa sur de California y Golfo de California; Mann (1925), discutió la similaridad de las diatomeas de las Islas Filipinas con la de la Bahía de Campeche; Cupp y Allen (1938), estudiaron las diatomeas del Golfo de California; Cupp (1943), hizo la descripción de la flora de diatomeas marinas de la costa occidental de Norteamérica; Osorio-Taffal (1944), registró el hallazgo de la diatomea Biddulphia sinensisGrev, en las aguas del Golfo de México. Más recientemente Bradbury (1971), realizó un estudio paleolimnológico del Lago de Texcoco en que describe la estratigrafía diatomológica del Valle de México reportando 204 especies de diatomeas. En cuanto a las contribuciones por científicos nacionales los estudios son escasos y las observaciones han sido ocasionales y sin continuidad. Se tiene noticia que Pane y Molteni (1858), mencionaron por primera vez al grupo de las diatomeas en un análisis geológico en un pozo abierto en el Valle de México; más tarde Díaz-Lozano (1917, 1937), realizó observaciones sobre algunas diatomeas fósiles en depósitos diatomíferos del Estado de México; Hernández-Velasco (1955), estudió la composición química de las frústulas de algunas diatomeas mexicanas; Silva-Bárcenas (1963), trató sobre las diatomeas de la Laguna de Términos; Gómez-Aguirre (1965, 1972), Gómez-Aguirre et al.(1970) y Santoyo-Reyes (1974a, 1974b) , en sus investigaciones sobre fitoplancton marino y de lagunas costeras, han discutido en varias ocasiones al grupo de las diatomeas principalmente en sus aspectos de ecología y distribución; Ortega (en elaboración) , está integrando un catálogo de las algas continentales recientes de México, que incluye entre otras algas, la recopilación e ilustración de todas las diatomeas que han sido reportadas para México. Se cuenta también con algunas aportaciones en forma de tesis profesionales de biólogo; entre ellas Quintana-González (1961), realizó observaciones al microscopio electrónico de diatomeas fósiles de algunos depósitos diatomíferos; Loyo-Rebolledo (1966), trató sobre la sistemática y distribución de diatomeas de la Laguna de Términos; Cruz (1970), se refirió a las diatomeas de la Laguna de Pueblo Viejo, y Avendaño (1972) , hizo un estudio somero de la flora diatomológica de la Laguna de Tamiahua. ÁREA DE ESTUDIOLa Laguna de Agiabampo ha sido descrita por varios autores desde diferentes puntos de vista en informes inéditos. Arenas-Fuentes (1969), en la distribución y variación de los factores ambientales; Gómez-Aguirre (1969, 1970), en planctología; Ayala-Castañares et al. (1970), en diferentes aspectos geológicos; Ortega (1970), sobre la vegetación sumergida, y Licea (1971), trata en forma breve el aspecto hidrológico. Aquí sólo se presenta una síntesis. La región de Agiabampo forma parte del Complejo Deltaico del Río Fuerte; se encuentra localizada en la costa sur del Estado de Sonora y norte del Estado de Sinaloa; se extiende aproximadamente entre los 26º05' y 26º30' de latitud norte y 109º20' de longitud oeste (Fig. 1) La laguna está formada por el Estero de Bacorehuis orientado al SE, que comunica con el Estero de Tebecán y dos cuerpos secundarios, orientados, el primero hacia el SW, que comunica con el Estero del Remolino; el segundo dirigido al norte, que corresponde a la Ensenada de Bamocha. La laguna se comunica ampliamente con el Golfo de California a través de una boca y dos barras arenosas. Las riberas de la laguna presentan una serie de irregularidades denominadas "ensenadas", que constituyen en ciertas ocasiones cuerpos de agua con características propias. La laguna se encuentra circundada por sistemas de esteros con la presencia de mangle rojo (Rhizophora mangle) y negro(Avicennia nítida); en ella no desemboca ningún río y el único aporte de agua dulce lo constituyen en la actualidad dos drenes del Sistema de Riego del Río Fuerte. La batimetría registra una irregularidad somera con profundidad promedio de 3 m, sin embargo, alcanza profundidades hasta de 13 m en las áreas cercanas a la boca. Los sitios más someros se encuentran cerca de los Esteros de Tebecán, Los Nidos y la Ensenada Bamocha con profundidades entre 40 y 60 cm. Aproximadamente la totalidad del fondo de la laguna muestra predominancia de sedimentos arenosos. La temperatura del agua presenta sus máximos en abril y mayo con cifras hasta de 32.6ºC, y los mínimos en febrero entre 20º y 23ºC, aunque en las ensenadas las aguas son más cálidas que en las zonas del centro de los brazos de la laguna, las oscilaciones diarias no son críticas. La salinidad manifiesta valores hiperhalinos con amplias variaciones a través del año, que van desde típicamente marinas en la boca hasta cifras de 54 % en la Ensenada de Bamocha y Estero de Tebecán en los meses cálidos. 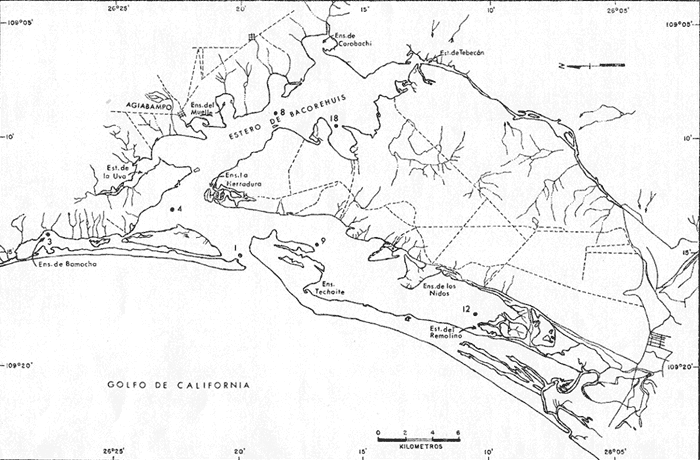 Fig. 1. Mapa de la Laguna de Agiabampo, con la situación de las estaciones de muestreo. MATERIAL Y MÉTODOSSe analizaron 21 muestras colectadas en 7 estaciones (Fig. 1) , en 3 épocas del año: otoño (7 octubre 1969) , invierno (23 febrero 1970) y primavera (27 mayo 1970) . En cada estación se estimaron los diversos parámetros del ambiente acuático, los cuales están referidos al final. en la tabla 1. En el texto las épocas de muestreo están referidas por las estaciones del año, pensando en la comodidad y por la cercanía con la estación del calendario. Colecta de diatomeasLas muestras se colectaron en la superficie con una red cónica de nylon con mallas de 60 micras de luz, 30 cm de boca y 1 m de longitud, a una velocidad de 1.5 a 2 nudos. La red se remolcaba durante 4 minutos en recorrido horizontal con una lancha tipo trimarán. Preparación y conservación de las muestrasLas muestras de fitoplancton se filtraron a través de una red de malla de 190 micras de abertura, con el fin de eliminar la parte zooplanctónica y pequeñas basuras. De cada muestra filtrada se hicieron dos submuestras: una se conservó para servir de testigo o bien ser utilizada según las exigencias futuras de su estudio; la otra submuestra se fraccionó en dos con el objeto de realizar 2 técnicas, una para el estudio de las diatomeas frágiles y otra para las formas robustas. Una observación previa permitió elegir la técnica adecuada. Para eliminar el material orgánico de las frústulas se eligió la técnica de Müller-Melchers y Ferrando (1956) , la cual consiste en oxidaciones lentas a base de permanganato de potasio para las especies delicadas, y oxidaciones rápidas con ácidos fuertes para ejemplares más resistentes. De cada muestra se hicieron cuatro preparaciones permanentes que fueron montadas en hyrax, cuyo índice de refracción aproximado es de 1.7, lo cual facilita la observación al microscopio. Análisis de las preparacionesLas preparaciones permanentes se observaron en líneas paralelas ascendentes cubriendo siempre el total de la preparación, y para la identificación taxonómica se recurrió a monografías, claves y descripciones existentes en las obras que más adelante se indican para cada especie. Las especies identificadas quedaron situadas para su localización por medio de una laminilla reticular denominada "England Finder", cuya descripción se muestra en Silva-Bárcenas (1963). Del material estudiado se elaboraron fotomicrografías de preferencia las vistas valvar y cingular; en algunos ejemplares que aparecen con dos vistas, las valvas corresponden a diferentes individuos de la misma especie. A los organismos de un mismo género que no se lograron identificar a nivel específico se les denominó con letras sucesivas del alfabeto. Con el fin de tener una visión general de la distribución y abundancia relativa de las especies se hizo un análisis cuantitativo porcentual, para lo cual se contaron los primeros 300 individuos aparecidos al azar en cada muestra (Tabla l). Este método ha sido empleado por diversos autores como Moreira (1962), Silva-Bárcenas (1963), y Gómez-Aguirre (1965) entre otros, el cual sin ser exacto, da idea de la abundancia relativa de las especies. De este modo se estableció arbitrariamente la siguiente escala de estimaciones de abundancia que se mencionan en el texto.  En la cuantificación se tomaron en cuenta los ejemplares incompletos que se pudieron identificar, considerando que algunos de ellos difícilmente se les encuentra íntegros. LISTA DE ESPECIESSe identificaron 250 especies incluidas en 46 géneros, de los cuales, 98 corresponden al grupo de las diatomeas centrales y 154 al grupo de las pennales, sin embargo conviene aclarar que en varios casos no fue posible determinar la especie debido a la carencia de literatura especializada. Para cada especie se indican las referencias bibliográficas de las que el autor dispuso y confrontó la identificación. Los nombres de las especies que aparecen con interrogación se consideran especies dudosas; sin embargo se estima que su morfología y dimensiones observadas justifican la identificación. A continuación se presenta una relación en orden alfabético del material identificado, así como datos recabados acerca de su distribución general referida por varios autores, y su abundancia y distribución local en la laguna, resaltando sólo los aspectos más sobresalientes. La lista de especies figura también al final en la tabla 2. Género Actinocyclus Ehrenberg, 1837 Actinocyclus octonarius Ehrenberg? (=Actinocyclus ehrenbergii Ralfs) (Lám. 1, fig. 1) . Van Heurck, 1896: 523, lám. 23, fig. 659. Boyer, 1926: 84. Cleve-Euler, 1951: 81, fig. 44. Curl, 1959: 287, fig. 16. Wood, 1963: 240, lám. 1, fig. 21a. Hendey, 1964: 83, lám. 24, fig. 3. Distribución general. Se ha registrado en las costas del Pacífico y Atlántico; es planctónica nerítica y ticopelágica, euríterma, polihalobia. Ha sido considerada cosmopolita. Distribución local. Estación 4 como excepcional en otoño. Género ActinoptychusEhrenberg, 1891 Actinoptychus aster Brun? (Lám. 1, figs. 2a-b). Schmldt, 1873-1904, lám. 173, fig. 2. Distribución local. Estación 4 como excepcional en otoño. Actinoptychus campanuliferSchmidt (Lám. 1, fig. 3) Moreira, 1960:9, lám. 2, fig. 12. Wood, 1963: 241, lám. 1, fig. 13. Distribución general. Se ha encontrado en las costas de Brasil; en México se ha registrado en las Lagunas de Términos (Loyo Rebolledo, 1966) y Yavaros (SantoyoReyes, 1972). Es nerítica y de aguas salobres. Distribución local. Prácticamente en toda la laguna en las tres épocas estudiadas, aunque con mayor abundancia en la boca (estación 1) en primavera. Actinoptychus splendens (Shadbot) Ralfs (Lám. 1, figs. 4a-b). Schmidt, 1873-1904, lám. 153, fig. 16. Van Heurck, 1896: 497, lám. 22, fig. 649. Boyer, 1926: 66. Cupp, 1943: 67, lám. 5, fig. 2. Cleve-Euler 1951: 791 fig. 36. Curl, 1959: 287, fig. 18. Distribución general. Se ha reportado para las costas del Pacífico y Atlántico; es nerítica y pelágica, especialmente de aguas templadas. En México se ha localizado en la costa NW del Pacífico (Gómez-Aguirre, 1972) y Lagunas de Yavaros y Términos(op. cit.). Distribución local. En los sitios cercanos a la boca en otoño e invierno. Actinoptychus vulgaris Schuman (Lám. 1, fig. 5). Schinidt, 1873-1904, lám. 153, fig. 1 Lefébure, 1947, lám. 9, fig. 3. Moreia, 1971: 6, lám. 1, fig. 6. Distribución general. Especie bentónica, nerítica, eurihalina; también se ha considerado cosmopolita. Distribución local. Estación 1 como excepcional durante el invierno. Actinoptychus vulgaris forma octonaria Ehrenberg (Lám. 1, fig. 6) . Moreira, 1966: 35, fig. 12. Distribución general. Es bentónica de medio marino. Distribución local. En la boca como excepcional en otoño. Actinoptychus sp A (Lám. 1, figs. 7a-b). Distribución local. Extensa en el área en las 3 épocas. Actinoptychus sp B (Lám. 2, fig. 1). Distribución local. Extensa en el área en otoño, y en la boca como excepcional en primavera. Actinoptychus sp C (Lám. 2, fig. 2). Distribución local. En la boca en forma rara durante la primavera. Actinoptychus sp D (Lám. 2, fig. 3). Distribución local. En la boca como excepción en invierno. Actinoptychus sp E (Lám. 2, fig. 4). Distribución local. En la boca como excepcional en invierno y primavera. Actinoptychus sp F (Lám. 2, figs. 5a-b). Distribución local. Extensa en el área como excepcional en otoño, y estaciones 4 y 9 en invierno. Actinoptychus sp G (Lám. 2, fig. 6). Distribución local. En la boca como rara durante el otoño. GéneroAmphiprora(Ehrenberg) Cleve, 1843, 1894 Amphiprora gigantea var. sulcata (O'Meara) Cleve (Lám. 3, fig. 1) . Allen y Cupp, 1935: 159, fior. 113. Cupp. 1943: 198, fig. 151. Distribución general. Se ha registrado ocasionalmente en el sur de California, es planctónica nerítica. Distribución local. Estación 9 como excepcional en otoño. Amphiprora paludosa Smith (Lám. 3, fig. 2). Van Heurck, 1896: 262, lám. 5, fig. 290. Boyer, 1927: 484. Cleve-Euler, 1952: 31, fig. 10400. Brunel, 1962: 147, lám. 45, fig. 1. Distribución general. Se ha registrado en la costa atlántica y en aguas salobres. Distribución local. Estación 8 durante la pri- como rara en las 3 épocas. Amphiprora sp (Lám. 3, fig. 3). Distribución local. Estación 8 durante la primavera. GéneroAmphora Ehrenberg, 1840 Amphora angusta (Gregory) Cleve (Lám. 3, fig. 4). Van Heurck, 1896: 130, lám. 24, fig. 674. Boyer, 1927: 271. Moreira 1962: 17 lám. 3, fig. 20. Wood, 1963: 243, lám. 2, fig. 23. Distribución general. Se ha encontrado como epífita marina de mares templados y fríos; se ha considerado cosmopolita. Distribución local. Estaciones 1, 8 y 18, con mayor abundancia en esta última en invierno. Apyhora capensis (Schmidt) Cleve (Lám. 3, fig. 5). Wood, 1963: 243, lám. 2, fig. 23. Distribución local. Estación 8 como excepción en otoño. Amphora egregia Schimidt (Lám. 3, fig. 6). Boyer, 1927: 257. Wood, 1963: 244, lám. 2, figs. 28a-b. Distribución general. Ha sido registrada para la Sonda de Campeche en el Golfo de México. Distribución local. Estación 8 como rara en primavera. Amphora laevis Gregory(Lám. 3, fig. 7). Van Heurck, 1896: 139, lám. 24, fig. 693. Boyer, 1927: 268. Wood, 1963: 244, lám. 2, figs. 33a-b. Distribución general. Ha sido registrada sólo como marina; en México se ha localizado en la Laguna de Yavaros. Distribución local. Estación 18 como rara en invierno. Amphora lineolata(Ehrenberg) Kützing (Lám. 3, fig. 8). Schinidt, 1873-1904, lám. 26, fig. 51. Van Heurck, 1896: 1381 lám. 1, fig. 10. Boyer, 1927: 264. Distribución general. Se ha registrado en aguas dulces y salobres. Distribución local. Amplia en invierno; y estaciones 4 y 18 en primavera. Amphora marina? (Smith) Cleve (Lám. 3, fig. 9). Cleve-Euler, 1953b: 92, fig. 671. Distribución local. Estación 8 como excepcional en otoño. Amphora obtusa Gregory (Lám. 3, fig. 10). Schmidt, 1873-1904, lám. 40, fig. 4. Van Heurck, 1896: 137, lám. 24, fig. 688. Boyer, 1927: 268. Wood, 1963: 245, lám. 2, figs. 35a-b. Distribución general. Ha sido registrada para las costas del Atlántico de Norteamérica. Distribución local. Estación 8 como excepcional en invierno. Amphora proteus Gregory (Lám. 3, fig. 11) . Schinidt, 1873-1904, lám. 27, figs. 2-3. Van Heurck, 1896: 129, lám. 24, fig. 671. Wood, 1963: 245, lám. 2, figs. 36a-c. Boyer, 1927: 254. Distribución general. Registrada para la costa atlántica; en México se ha encontrado en la Laguna de Yavaros. Distribución local. Estaciones 1 y 9 como excepcional en invierno. Amphora spectabilis? Gregory (Lám. 3, fig. 12) Van Heurck, 1896: 137, lám. 24, fig. 687. Boyer, 1927: 269. Cleve-Euler, 1953b: 102, fig. 701. Wood, 1963: 245, fig. 38. Distribución general. Anotada para el Golfo de California y en medios salobres. Distribución local. Estación 12 como excepcional durante el otoño. Amphora terroris Ehrenberg (Lám. 3, figs. 13a-b). Boyer, 1927: 262. Cleve-Euler, 1953b: 99, fig. 689. Wood, 1963: 246, lám. 3, figs. 40a-b. Distribución general. Ha sido registrada para la Sonda de Campeche y la Laguna de Yavaros. Distribución local. Prácticamente en toda el área, aunque mejor representada en invierno y primavera, donde fue abundante, especialmente en la estación 3. Amphora sp A (Lám. 3, fig. 14). Distribución local. Estación 8 en otoño y primavera Amphora sp B (Lám. 3, fig. 15). Distribución local. Estaciones 3, 8 y 9 en otoño Amphora sp B (Lám. 3, fig. 15). Distribución local. Estaciones 3, 8 y 9 en otoño Amphora sp C (Lám. 3, fig. 16) Distribución local. Estaciones 3 y 18 en otoño e invierno respectivamente. Amphora sp D (Lám. 3, fig. 17) Distribución local. Estaciones 1, 3, 8 y 9 en las 3 épocas del año, aunque estuvo mejor representada en la boca en invierno. Amphora sp E (Lám. 3, fig. 18). Distribución local. Estaciones 3 y 8, como escasa y rara respectivamente en primavera. Amphora spF (Lám. 3, fig. 19) Distribución local. Estación 3 como rara en invierno. Amphora sp G (Lám. 3, fig. 20) Amphora sp G (Lám. 3, fig. 20) Distribución local. Estación 18 como rara en primavera. GéneroAulacodiscusEhrenberg, 1845 Aulacodiscus margaritaceus Ralfs (Lám. 4, fig. 1) . Schmidt 1873-1904, lám. 37, fig. 4. Boyer, 1926: 77. Distribución general. Anotada para las costas de California y Banco de Campeche. Distribución local. Se registró en las 3 épocas estudiadas. Aulacodiscus sparsus Greville (Lám. 4, fig. 2). Schmidt, 1873-1904, lám. 36, fig. 12. Distribución local. Estaciones 1 y 8 en otoño; 9 en invierno; 1 y 4 en primavera. Aulacodiscus sp (Lám. 4, fig. 3). Distribución local. Estaciones 9 en invierno; 1 y 8 en primavera. Género AuliscusEhrenberg, 1843 Auliscus caelatus Bailey (Lám. 4, fig. 4). Schmidt, 1873-1904, lám. 32, figs. 12-13. Boyer, 1926: 93. Frenguelli, 1938, lám. 7, fig. 4. Cleve-Euler, 1951: 84, fig. 151. Curl, 1959: 288 fig. 21. Moreira, 1960: 10, láms. 1 y 4, figs. 3 y 25. Distribución general. Se ha registrado en el Golfo de México; es nerítica y ticopelágica de aguas tropicales y templadas. Distribución local. Estación 12 como excepcional en invierno. Auliscus sp A (Lám. 4, fig. 5). Distribución local. Estación 9 como excepcional en invierno. Auliscus sp B (Lám. 4, fig. 6). Distribución local En la boca como excepcional en otoño, GéneroBacteriastrumShadbolt, 1854 Bacteriastrum delicatulumCleve (Lám. 4, figs. 7a-b). Boyer, 1927: 560. Allen y Cupp, 1935: 131, fig. 46. Cupp, 1943: 96, fig. 55. Cleve-Euler, 1951: 94, fig. 174. Curl, 1959: 296, fig. 65. Distribución general. Registrada en el Atlántico Norte; es planctónica, pelágica, euriterma; en México se ha encontrado en la costa NW del Pacífico y en las Lagunas de Yavaros y Términos. Distribución local. Estaciones 1, 4 y 9 en otoño; y 9 en primavera. Bacteriastrum elegans Pavillard (Lám. 4, fig. 8) . Margalef, 1950: 98, fig. 255. Distribución local. Estación 9 en primavera como excepcional. Bacteriastrum hyalinumLauder (Lám. 5, fig. 1) . Cupp, 1953: 96, fig. 56a. Distribución general. Se ha reportado como nerítica en las costas de California; en México se ha registrado en la costa NW del Pacífico, y en las Lagunas de Yavaros y Términos. Distribución local. Estaciones 1 y 9 en otoño y primavera. Bacteríastrum sp A (Lám. 5, fig. 2). Distribución local. Excepcional en las estaciones 1 y 9 en otoño, y 1 en primavera. Bacteriastrum sp B (Lám. 5, figs. 3a-b). Distribución local. En la boca como excepcional en otoño. GéneroBiddulphia Gray, 1821 Biddulphia aurita (Lyngbye) Brébisson y Godey (Lám. 5, figs. 4a-d). Schmidt, 1873~1904, lám. 120, figs. 5-8. Van Heurck, 1896: 471, lám. 20, fig. 631. Boyer, 1926: 122. Cupp, 1943: 161, figs. 112 A (1-3). Cleve-Euler, 1951: 119, fig. 257. Curl, 1959: 189, fig. 26. Brunel, 1962: 144, lám. 7, fig. 3. Wood, 1963: 247, lám. 3, fig. 48. Moreira, 1967: 6, lám. 1, f ig. 5. Distribución general. Se ha registrado en las costas del Atlántico y Pacífico de Norteamérica. Es nerítica y ticopelágica y también de medio salobre; en México se ha localizado en las Lagunas de Yavaros y Términos. Distribución local. Estaciones 1, 4 y 12 en las 3 épocas del año; aunque estuvo mejor representada en invierno. Biddulphia aurita var. obtusa (Kützing) Husted (Lám. 5, fig. 5). Cupp, 1943: 162, fig. 112b. Cleve-Euler, 1951: 119, fig. 258. Curl, 1959: 289, fig. 29. Distribución general. Especie nerítica euriterma de aguas árticas. Distribución local. Estación 9 como excepcional en invierno. Biddulphia dubia (Brightwell) Cleve (Lám. 5, fig. 6). Boyer, 1926: 128. Allen y Cupp, 1935: 147, fig. 84. Cupp, 1943: 164, fig. 114. Distribución general. Se ha registrado en las costas del Pacífico y Atlántico como planctónica nerítica de aguas tropicales; en México se ha localizado en la costa NW del Pacífico y en Laguna de Términos. Distribución local. Estación 12 como rara en otoño. Biddulphia mobliensis(Bailey) Grunow (Lám. 5, figs. 7a-d). Boyer, 1926: 122. Allen y Cupp, 1935: 145, fig. 80. Lefébure, 1947, lám. 17, fig. 7. Cleve-Euler, 1951: 117, fig. 250. Curl, 1959: 289, fig. 28. Wood, 1963: 248, lám. 3, fig. 51. Distribución general. Anotada para las costas del Atlántico y Pacífico en aguas tropicales y templadas como planctónica nerítica, también es de medio salobre. En México se ha localizado en la costa NW del Pacífico y en las Lagunas de Yavaros y Términos. Distribución local. Se registró en las 3 épocas, siendo frecuente en las estaciones 4 y 8 durante el otoño. Biddulphia rhombus (Ehrenberg) Smith (Lám. 5, fig. 8). Schmidt, 1873-1904, lám. 120, figs. 11-13. Van Heurck, 1896: 472, lám. 20, fig. 634. Boyer, 1926: 126. Cupp, 1943: 163, fig. 113. Cleve-Euler, 1951: 118, fig. 254. Curl, 1959: 289, fig. 31. Moreira, 1960: 12, lám. 4, fig. 19. Distribución general. Se ha encontrado en aguas templadas del Norte; es nerítica, euriterma y eurihalina, sin embargo, en México se ha localizado en aguas salobres en las Lagunas de Yavaros y Términos. Distribución local. Amplia en otoño, siendo escasa en la boca; estaciones 1 y 9 como excepcional en invierno y primavera. Biddulphia tuomeyi(Bailey) Roper (Lám. 6, figs. 1a-b). Schmidt, 1873-1904, lám. 118 ' figs. 1-5. Van Heurck. 1896: 471, lám. 34, figs. 895-6. Boyer, 1926: 121. Lefébure, 1947, lám. 17, fig. 8. Distribución general. Se ha registrado en México en la Sonda de Campeche y Lagunas de Yavaros y Términos; es nerítica y de aguas salobres. Distribución local. Estación 4 en otoño y estaciones 1, 9 y 12 en invierno. Biddulphia sp A (Lám. 6, figs. 2a-b). Distribución local. En la boca como excepcional durante la primavera. Biddulphiasp B (Lám. 6, fig. 3). Distribución local. Estación 9 como excepcional en otoño. Biddulphia sp C (Lám. 6, fig. 4). Distribución local. Estaciones 9 y 12 en invierno. Biddulphia sp D (Lám. 6, fig. 5). Distribución local. Estación 12 como excepción en invierno. GéneroCaloneisCleve, 1894 Cáloneis powelli(Lewis) Cleve (Lám. 6, fig. 6). Boyer, 1927: 317. Loyo-Rebolledo, 1966: 118, lám. 2, fig. 16. Distribución general. Anotada para la costa atlántica de Norteamérica; es bentónica nerítica y de aguas salobres. En México se ha encontrado en la Laguna de Términos. Distribución local. Estación 12 como excepcional en invierno. Género CampylodiscusEhrenberg, 1841 Campylodiscussp (Lám. 6, fig. 7) Distribución local. Estación 18 como excepcional en primavera. Género CerataulusEhrenberg, 1861 Carataulus californicusSchmidt (Lám. 6, figs. 8a-b) . Schmidt, 1873-1904, lám. 115, fig. 4. Distribución local. Se registró en las 3 épocas del año, como presente estuvo en la boca en otoño y primavera. GéneroChaetocerosEhreriberg, 1845 Chaetoceros curvicentunCleve (Lám. 6, fig. 9). Sclimidt, 1873-1904, lám. 340, figs. 5-7. Boyer, 1926: 108. Cupp, 1943: 137, fig. 93. Cleve-Euler, 1951: 100, fig. 194. Curl, 1959: 296, fig. 62. Distribución general. Registrada para las aguas templadas del Sur como nerítica; en México se ha registrado en la Laguna de Yavaros. Distribución local. En la boca en otoño y estación 4 en primavera. Chaetoceros laevis Leud-Fortum (Lám. 6, fig. 10). Schmidt, 1873-1904, lám. 339, fig. 1. Cupp, 1943: 133, fig. 88. Distribución general. Se ha registrado como especie nerítica tropical; en México se ha encontrado en la Laguna de Yavaros. Distribución local. Estación 4 como excepcional en primavera. Caetoceros lorenzianus Grunow (Lám. 6, fig. 11) . Schmidt, 1873-1904, lám. 322, fig. 1. Allen y Cupp, 1935: 136, fig. 58. Cupp, 1943: 118, fig. 71. Cleve-Euler, 1951: 98, fig. 197. Curl, 1959: 295, fig. 54. Brunel, 1962: 105, láms. 18-19. Moreira, 1971: 8, figs. 7-8. Distribución general. Registrada como planctónica nerítica en aguas tropicales y templadas; otros la han encontrado en aguas salobres. En México se ha localizado en la costa NW del Pacífico y en la Laguna de Términos. Distribución local. Estaciones 1, 9 y 12 en otoño; y 1 y 9 en primavera. Chaetoceros sp A (Lám. 6, fig. 12). Distribución local. Amplia en otoño registrándose como abundante en la estación 9; en el mismo sitio fue excepcional en otoño. Chaetoceros sp B (Lám. 6, fig. 13) Distribución local. Estaciones 3 y 9 en otoño; y 9 en primavera. Chaetoceros sp C (Lám. 7, fig. 1) . Distribución local. En la estación 3 como abundante en otoño; y estación 9 como escasa en primavera. GéneroClimascospheniaEhrenberg, 1843 Climacosphenia moniligera Ehrenberg (Lám. 7, figs. 2a-b) . Schmidt, 1873-1904, lám. 307 , figs. 1-4. Cupp, 1943: 178, fig. 128. Lefébure, 1947, lám. 22, fig. 6. Moreira, 1962: 12, lám. 3, fig. 18. Distribución general. Es epífita nerítica, de aguas tropicales en regiones cerradas; se ha considerado cosmopolita. En México se ha localizado en la Laguna de Yavaros. Distribución local. Estación 8 como rara en primavera. GéneroCocconeisEhrenberg, 1838 Cocconeis diruptaGregory (Lám. 7, fig. 3). Schmidt, 1873- 1904, lám, 197, figs. 1 y 31. Van Heurck, 1896: 290, lám. 8, fig. 343. Boyer, 1927;: 246. Frenguelli, 1938, lám. 1, fig. 11. Moreira. 1966; 36, lám. 1, fig. 2 1. Distribución general. Registrada en las costas del Atlántico y Pacífico; es epífita de medios salobres. En México se ha localizado en la Laguna de Términos. Distribución local. Estaciones 1 y 3 como rara en invierno y primavera respectivamente. Cocconeis disculus(Schuman) Cleve (Lám. 7, figs. 4a-b). Frenguelli, 1938, lám. 1, fig. 10. Cleve-Euler, 1953 b; 10, fig. 495. Wood, 1963: 251, lám. 4, fig. 67. Patrick y Reimer, 1966: 239, lám. 15, figs. 1-2. Distribución general. Es característica de aguas dulces. Distribución local. Estaciones 1, 3 y 8 en invierno, aunque estuvo mejor representada en la boca. Cocconeis disculoides Hustedt (Lám. 7, fig. 5). Wood, 1963: 250, lám. 4, figs. 66a-b. Distribución local. En la boca en otoño; y estación 12 como escasa en primavera. Cocconeis distans Gregory (Lám. 7, figs. 6a-c). Schmidt, 1873-1904, lám. 193, fig. 36. Van Heurck, 1896: 287, lám. 29, fig. 817. Boyer, 1927: 246. Wood, 1963: 251, lám. fig. 68. Moreira, 1966: 36, lám. 1, fig. 20. Distribución general. Registrada en el Mar Ártico y costas del Atlántico y Pacífico; también se ha encontrado como epífita en aguas salobres. En México se ha localizado en la Laguna de Términos. Distribución local. Estaciones 1, 9 y 12 en invierno; y 3 en primavera. Cocconeis paniformis ? Brun (Lám. 7, fig. 7). Schmidt, 1873-1904, lám. 189, figs. 16-20. Distribución local. Prácticamente, en toda el área en las 3 épocas; se ubicó como presente en la estación 8 en otoño y 1 y 3 en invierno. Cocconeis placentula (Ehrenberg) Hustedt (Lám. 7, fig. 8). Schmidt,, 1873-1904, lám. 193 ' figs. 1-4. Van Heurck, 1896: 288, fig. 341. Boyer, 1927: 244. Cleve-Euler, 1953 b: 8, fig. 492. Wood, 1963: 251, lám. 4, fig. 72. Patrick y Reimer, 1966: 240, lám. 15, fig. 7. Skvortzow, 1971: 70, lám. 4, fig. 211. Distribución general. Se ha registrado en aguas dulces y salobres; en México se ha encontrado en la Laguna de Yavaros. Distribución local. Estaciones 8 y 12 en invierno. Cocconeis pseudomarginataGregory (Lám. 7, fig. 9) Schmidt, 1873-1904, lám. 194, fig. 8. Van Heurck, 1896: 291, lám. 29, fig. 824. Frenguelli, 1938, lám. 1, fig. 12. Distribución general. Registrada para Groenlandia, Honduras y Mar del Norte. Distribución local. En la boca como excepcional en otoño. Cocconeis spA (Lám. 7, fig. 10). Distribución local. Estaciones 1 y 4 en otoño; y 1 y 3 en invierno. Cocconeissp B (Lám. 7, fig. 11). Distribución local. Prácticamente en toda el área, destacando por su abundancia en las estaciones 3 y 4 en invierno y primavera. Cocconeis sp C (Lám. 7, fig. 12). Distribución local. En la boca durante el otoño. Cocconeissp D (Lám. 7, fig. 13). Distribución local. Estaciones 1 y 9 en otoño e invierno respectivamente. Cocconeis sp E (Lám. 7, fig. 14). Distribución local. Estaciones 1 en otoño; 8 y 12 como rara en primavera. Cocconeis sp F (Lám. 7, fig. 15) . Distribución local. Estaciones 9 en otoño; 8 y 18 en primavera. Género CoscinodiscusEhrenberg, 1840 Coscinodiscus conmutatusGrunow (Lám. 7, fig. 16) Cleve-Euler, 1951: 68, fig. 106. Distribución local. Estación 8 como excepcional en invierno. Coscínodiscus excentricus Ehr. =Thalassiosira eccentrica CL.) (Lám. 7, fig. 17) . Schmidt, 1873-1904 lám. 59, fig. 45. Van Heurck, 1896: 531, lám. 23, fig. 666. Boyer, 1926: 43. Allen y Cupp, 1935: 113, fig. 5. Cupp, 1943: 52, lám. 1, fig. 14. Lefébure, 1947, lám. 6, fig. 9. Curl, 1959: 286, fig. 11. Wood, 1963: 253, lám. 5, fig. 82. Moreira, 1966: 37, lám. 2, fig. 6. Distribución general. Anotada para las costas del Atlántico y Pacífico; es planctónica pelágica, frecuentemente nerítica, se ha considerado cosmopolita. En México se ha encontrado en la costa NW del Pacífico. Distribución local. Estaciones 1 y 9 en invierno. Coscinodiscus heteroporusEhrenberg (Lám. 7, fig. 18). Cleve-Euler, 1951: 651 fig. 94. Distribución local. Estaciones 4 en otoño; 1 y 9 en invierno. Coscinodiscus lineatusEhrenberg (Lám. 7, fig. 19). Van Heurck, 1896: 532, lám. 23, fig. 665. Boyer, 1926: 44. Allen y Cupp, 1935: 114, fig. 6. Cupp, 1943: 53, fig. 15. Lefébure, 1947, lám. 6, fig. 11. Cleve-Euler, 1951: 60, fig. 85. Wood, 1963: 251, lám. 5, fig. 84. Moreira, 1966: 38 lám. 2, fig. 13. Distribución general. Se ha registrado en la Sonda de Campeche, Veracruz y Florida; es epífita, pelágica ocasionalmente nerítica, se ha registrado como fósil del Mioceno. En México se ha localizado en la costa NW del Pacífico y Lagunas de Yavaros y Términos. Distribución local. Estaciones 1 y 3 en invierno; 1 y 9 en primavera. Coscinodiscus marginatus Ehrenberg (Lám. 7, fig. 20). Cupp, 1943: 55, lám. 1, fig. 3. Moreira, 1966: 38, lám. 2, fig. 10. Distribución general. Se ha encontrado esporádicamente en todos los océanos como nerítica, en México se ha localizado en aguas salobres en la Laguna de Términos. Distribución local. En la boca como excepcional en primavera. Coscinodiscus obscurus (Sclimidt) Cleve (Lám. 8, fig. 1 ). Schrnidt, 1873-1904, lám. 62, fig. 17. Cleve-Euler, 1951: 66, fig. 99. Distribución local. Estación 8 como rara en otoño. Coscinodiscus plicatus(Grunow) Cleve (Lám. 8, fig.2). Schmidt, 1873-1904, lám. 59, fig. 1. Cleve-Euler, 1951: 63. fig. 88. Distribución local. Estación 12 como excepcional en invierno. Coscinodiscus plicatulus(Grunow) Cleve (Lám. 8, fig. 3). Cleve-Euler, 1951: 63, fig. 89. Distribución local. En las 3 épocas, aunque mejor representada en la estación 8 en otoño. Coscinodiscus plicatulusGrunow forma ? (Lám. 8, fig. 4). Distribución local. Estaciones 8 en otoño; 9 y 12 en invierno. Coscinodiscus radiatus Ehrenberg (Lám. 8, fig. 5). Schmidt, 1873-1904, lám. 60, fig. 10, Van Heurck, 1896; 530, lám. 23, fig. 663. Boyer, 1926: 54. Allen y Cupp, 1935: 115, fig. 8. Cupp, 1943: 56, fig. 20. Lefébure, 1947, lám. 6, fig. 3. Cleve-Euler, 1951: 65, fig. 97. Curl, 1959: 287, fig. 15. Moreira, 1960: 7, lám. 2, fig. 9. Brunel, 1962: 55, lám. 3, fig. 1. Wood, 1963: 254, lám. 5, fig. 89. Moreira, 1966: 38, lám. 2, fig. 11. Distribución general. Ha sido registrada como especie estuarina, nerítica y pelágica de aguas árticas y templadas; en México se ha encontrado en la costa NW del Pacífico y Laguna de Yavaros. Distribución local. Estación 4 como rara en otoño y primavera. Coscinodiscus robustus Greville (Lám. 8, fig. 5). Schmidt 1873-1904, lám. 62, figs. 5-6. Distribuición local. En las 3 épocas, aunque con mayor abundancia en la estación 4 en otoño. Coscinodiscus subtilisEhrenberg (Lám. 8, figs. 7a-b). Schmidt, 1873-1904, lám. 57, fig. 11. Van Heurck, 1896: 533, lám. 34, fig. 901. Boyer, 1926: 50. Allen y Cupp, 1935: 120, fig. 18. Lefébure, 1947, lám. 6, fig. 13. Cleve-Euler, 1951: 59, fig. 8 1. Distribución general. Registrada como fósil de depósitos del Mioceno; es cosmopolita especialmente en lodo de estuarios y ocasionalmente en agua dulce y salobre. En México se ha encontrado en la costa NW del Pacífico y Laguna de Términos. Distribución local. Rara en otoño e invierno en las estaciones 1 y 4. Coscinodiscus sp A (Lám. 8, fig. 8). Distribución local. Estaciones 1 y 4 en otoño e invierno, respectivamente. Coscinodiscus sp B (Lám. 8, figs. 9a-b). Distribución local. En las 3 épocas, sin cambios notables en su abundancia., Coscinodiscus sp C (Lám. 8, fig. 10) . Distribución local. En la boca como rara en otoño. Coscinodiscus sp D (Lám. 8, fig. 11). Distribución local. Estación 4 como rara en primavera. Coscinodiscus sp E (Lám. 9, fig. 1) . Distribución local. Estación 4 como rara en invierno. Coscinodiscus sp F (Lám. 9, fig. 2). Distribución local. Estaciones 4 y 9 en invierno; 1, 4, 9 y 12 en primavera. Coscinodiscus sp G (Lám. 9, fig. 3). Distribución local. Estación 12 como excepcional en primavera. Coscinodiscussp H (Lám. 9, fig. 4). Distribución local. Estación 4 como rara en otoño. Coscinodiscus sp I (Lám. 9, fig. 5). Distribución local. En primavera en sitios cercanos a la boca. Coscinodiscus sp J (Lám. 9, fig. 6). Distribución local. En las 3 épocas, aunque estuvo mejor representada en otoño, especialmente en la boca. Coscinodiscus sp K (Lám. 10, fig. 1). Distribución local. Estación 3 como excepcional en otoño. Coscinodiscussp L (Lám. 10, fig. 2). Distribución local. Estación 9 como excepcional en otoño, Coseinodiscus sp M (Lám. 10, fig. 3). Distribución local. Estación 4 como excepcional en otoño. Coscinodiscus sp N (Lám. 10, fig. 4). Distribución local. Estación 9 como excepcional en invierno. Coscinodiscus sp O (Lám. 10, fig. 5). Distribución local. Estación 12 como excepcional en invierno. Coscinodiscus sp P (Lám. 10, fig. 6). Distribución local. Estación 4 como excepcional en otoño. Coscinodiscus sp ? (Lám. 10, fig. 7). Distribución local. En las 3 épocas registrándose como presente en la estación 12 en primavera. GéneroCyclotellaKützing, 1833 Cyclotella striata(Kützing) Grunow (Lám. 10, figs. 8a-d). Schmidt, 1873-1904, lám. 223, fig. 9. Van Heurck, 1896: 446, lám. 22, fig. 651. Boyer, 1926: 37. Frenguelli, 1938, lám. 5, fig. 47. Cleve-Euler, 1951: 42, lám. 4C. Wood, 1963: 256, lám. 6, fig. 98. Moreira, 1966: 38, lám. 2, fig. 19. Distribución general. Registrada en estuarios de la costa atlántica de Norteamérica; también es salobre, se ha considerado cosmopolita. En México se ha encontrado en la Laguna de Términos. Distribución local. Prácticamente en toda la laguna en las 3 épocas, aunque mejor representada en la estación 18 como especie predominante. GéneroDimerogramma Ralfs, 1861 Dimerogramma marinum (Gregory) Ralfs (Lám. 10, fig. 9). Van Heurck 1896: 336, lám. 30, fig. 849. Wood, 1963: 257, lám. 6, figs. 103a-b. Distribución general. Exclusivamente marina. Distribución local. En la boca como excepcional en otoño. Dimerogramma minor (Gregory) Ralfs (Lám. 10, fig. 10). Van Heurck, 1896: 336, lám. 10, fig. 392. Wood, 1963: 257, lám. 6, figs. 104a-d. Distribución general. Exclusivamente marina. Distribución local. Estación 4 como rara en invierno. GéneroDiploneisEhrenberg, 1840 Diploneis bombus Ehrenberg (Lám. 10, fig. 11) . Boyer, 1927: 353. Lefébure, 1947, lám. 25, fig. 11. Cleve-Euler, 1953b: 72, fig. 636. Wood, 1963: 257, lám. 6, fig. 105. Moreira, 1966: 39, lám. 3, fig. 3. Patrick y Reimer, 1966: 416, lám. 38, fig. 13. Distribución general. Anotada para las costas de Campeche y Florida; es epífita de medio marino y salobre, se ha considerado cosmopolita. Distribución local. En la boca como excepcional en otoño. Diploneis ovalis (Hilse) Cleve (Lám. 10, fig. 12). Cleve-Euler, 1953b: 75, fig. 643. Wood, 1963: 258, lám. 6, fig. 110. Moreira et al., 1968: 6, fig. 14. Distribución general. Registrada en aguas dulces y salobres. Distribución local. En la boca como excepcional en primavera. Diploneis splendida (Gregory) Cleve (Lám. 10, fig. 13). Boyer, 1927: 351. Wood, 1963: 259, lám. 6, fig. 113. Distribución general. Registrada en la costa del Atlántico de Norteamérica. Distribución local. Estación 9 como excepcional en primavera. Diploneis vacillans (Schmidth) Cleve (Lám. 10, fig. 14). Frenguelli, 1938, lám. 1, figs. 23-24. Boyer, 1927: 354. Moreira, 1966: 39, lám. 3, fig. 9. Distribución general. Registrada en el Golfo de California y Sonda de Campeche; es nerítica de aguas templadas. Distribución local. Rara en invierno en la estación 3. Diploneis sp (Lám. 10, fig. 15). Distribución local. Estación 3 como excepcional en otoño. Género DitylumBailey, 1862 Ditylum brightwelli (West) Grunow (Lám. 10, fig. 16). Van Heurck, 1896: 424, lám. 17, fig. 606. Frenguelli, 1938, lám. 6, figs. 9-10. Cupp, 1943: 148, figs. 107a-b. Lefébure, 1947, lám. 16, fig. 3. Distribución general. Se ha encontrado como nerítica en aguas templadas del Sur, también se ha registrado en aguas dulces. En México se ha localizado en la costa NW del Pacífico. Distribución local. En la boca como rara en otoño y estaciones 1, 4, 8 y 9 en primavera. GéneroEunotia Ehrenberg, 1837 Eunotia luna Ehrenberg (Lám. 10, figs. 17a-c). Schmidt, 1873-1904, lám. 286, figs. 31-40. Boyer, 1926: 225. Patrick y Reimer, 1966: 196, lám. 11, fig. 3. Distribución general. Registrada para aguas dulces. Distribución local. Estaciones 9 en otoño; 1 y 3 en invierno. GéneroGliphodesmisGreville, 1862 Gliphodesmis eximiaGreville (Lám. 10, fig. 18). Schmidt, 1873-1904, lám. 210, fig. 18. Boyer, 1926: 195. Distribución general. Registrada para las costas del Atlántico; en México se ha localizado en la Sonda de Campeche. Distribución local. En la estación 9 como excepcional en invierno. GéneroGrammatophora Ehrenberg, 1840 Grammatophora oceanica Ehrenberg (Lám. 10, fig. 19). Frenguelli, 1938, lám. 5, figs. 37-39. Wood, 1963: 262, lám. 7, fig. 33. Moreira 1966: 41, lám. 3, fig. 24. Distribución general. Es epífita, nerítica eurihalina, se ha considerado cosmopolita; en México se ha registrado en las Lagunas de Yavaros y Términos. Distribución local. Estación 3 como excepcional en otoño. Grammatophora marina(Lyngbye) Kützing (Lám. 10, fig. 20). Van Heurck, 1896: 354, lám. 11, fig. 479. Boyer, 1926: 156. Cupp, 1943: 174, fig. 125a. Lefébure, 1947, lám. 22, fig. 3. Cleve-Euler, 1953a: 12, fig. 305. Wood, 1963: 262, lám. 7, figs. 3a-b. Moreira, 1966: 41, lám. 3, fig. 29. Distribución general. Registrada en las costas del Atlántico y Pacífico; es epífita, nerítica, se ha considerado cosmopolita. En México se ha encontrado en las Lagunas de Yavaros y Términos. Distribución local. Estación 4 como rara en invierno. GéneroGyrosigma (Hassal) Cleve, 1845, 1894 Gyrosigma balticum (Ehrenberg) Cleve (Lám. 11, figs. 1a-b). Boyer, 1927: 456. Cleve-Euler, 1952: 11, fig. 1331. Curl, 1959: 301, fig. 96. Brunel, 1962: 152, lám. 42, figs. 1-2. Moreira, 1968: 9, figs. 13 y 19. Distribución general. Registrada en aguas salobres para las costas del Pacífico y Atlántico de Norteamérica; es bentónica, ocasional en plancton, nerítica y ticopelágica; se ha considerado cosmopolita. En México se ha encontrado en las Lagunas de Términos y Yavaros. Distribución local. Prácticamente en toda el área en las tres épocas, se registró con mayor abundancia en las estaciones 8, 12 y 18 en invierno. Gyrosigma distortum (Smith) Cleve var. brevirostris Brockm (Lám. 11, fig. 2) . Cleve-Euler, 1952: 13, lám. 7, fig. d. Distribución local. Estaciones 1 y 9 en invierno. Gyrosigma fasciola var. fasciola (Elirenberg) Cleve (Lám. 11, fig. 3). Boyer, 1927: 463. Frenguelli, 1938, lám. 3, fig. 11. Cleve-Euler, 1952: 13, fig. 1339. Wood, 1963: 277, lám. 11, fig. 219. Patrick y Reimer, 1966: 328, lám. 26, fig. 4. Distribución general. Registrada para las costas del Atlántico y Pacífico de Norteamérica; es bentónica. Distribución local. Estación 4 como excepcional en invierno. Gyrosigma fasciola var. sulcata (Grunow) Cleve (Lám. 11, fig. 4). Boyer, 1927: 463-4. Frenguelli, 1938, lám. 3, fig. 10. Hendey, 1964: 249. Distribución local. En la estación 18 como excepcional en primavera. Gyrosigma spenseri(Quekett) Cleve (Lám. 11, fig. 5) Boyer, 1927: 459. Allen y Cupp, 1935: 157, fig. 110. Cupp, 1943: 194, fig. 144. Frenguelli, 1942, lám. 1, fig. 33. Patrick y Reimer, 1966: 315, lám. 23, fig. 4. Moreira, 1966: 41, lám. 3, fig. 28. Distribución general. Registrada como nerítita y de medio dulce y salobre; en México se ha localizado en la Laguna de Términos. Distribución local. Estación 8 como rara en primavera. GéneroLampriscusGrunow, 1885 Lampriscus kittoni Schmidt (Lám. 11, fig. 6). Schmidt, 1873-1904, lám. 80,1 fig. 11. Distribución local. Apareció en invierno como excepcional. GéneroMastogloiaThwaites, 1856 Mastogloia apiculata Smith (Lám. 11, fig. 7). Schimidt, 1873-19041 lám. 185, fig. 43. Van Heurck, 1896: 154, lám. 25, fig. 700. Boyer, 1927: 333. Wood 1963: 264, lám. 7, fig. 140. Moreira, 1968: 6, fig. 18. Distribución general. Anotada para la costa atlántica tropical; Es bentónica de medio marino y salobre. En México se ha registrado en la Laguna de Términos. Distribución local. Estación 18 como excepcional en primavera. Mastogloia binotata (Grunow) Cleve (Lám. 11, fig. 8). Boyer, 1927: 330. Wood, 1963: 264, lám. 7, fig. 143. Moreira, 1966: 42, lám. 4, fig. 10. Distribución general. Se ha registrado como planctónica nerítica. Distribución local. Estaciones 4 y 9 en otoño y primavera respectivamente. Mastogloia braunii Grunow (Lám. 11, fig. 9). Moreira, 1962: 14, lám. 4, figs. 28-29. Wood, 1963: 265, lám. 8, fig. 144. Patrick y Reimer, 1966: 302, lám. 20, figs. 18-19. Distribución general. Registrada para aguas estuaricas y neríticas; se ha considerado cosmopolita. Distribución local. Estación 8 como excepcional en invierno. Mastogloia exiguaLewis (Lám. 11, figs. 10a-b). Schimidt, 1873-1904, lám. 185, fig. 33. Van Heurck, 1896: 155 lám. 2, fig. 63. Boyer, 1927: 332. Frenguelli, 1938, lám. 1, figs. 19-20. Cleve-Euler, 1953b: 62, fig. 611. Moreira, 1962: 14, lám. 4, figs. 2324. Distribución general. Registrada para la costa atlántica de Norteamérica; se ha encontrado en medios salobres, se ha considerado cosmopolita. Distribución local. Estación 18 como rara en invierno. Mastogloia exiguavar. gallica Petit (Lám. 11, figs. 11a-b). Schmidt, 1873-1904, lám. 185, fig. 37. Distribución local. Estación 12 como excepcional en invierno. Mastogloia exilis Hustedt (Lám. 11, fig. 12). Moreira, 1967: 9, lám. 2, fig. 5. Distribución general. Ha sido registrada como especie nerítica. Distribución local. Estación 18 como rara en otoño. Mastogloia grunowii ? Schmidt (Lám. 11, fig. 13). Schmidt, 1873-1904, lám. 186, figs. 1-7. Distribución local. Estación 18 como escasa en otoño. Mastogloia sp A (Lám. 11, fig. 14). Distribución local. Estación 12 como excepcional en invierno. Mastogloia sp B (Lám. 11, fig. 15). Distribución local. Estación 18 como rara en otoño. Mastogloia sp C (Lám. 11, figs. 16a-b). Distribución local. Estación 18 como rara en otoño e invierno. Mastogloia sp D (Lám. 11, figs. 17a-b). Distribución local. Estación 18 como excepcional en primavera. GéneroMelosiraAgardh, 1824 Melosira sulcata(Ehrenberg) Kützing (Lám. 12, figs. 1 a-d) . Van Heurck, 1896: 444, lám. 19, fig. 624. Boyer, 1926: 25. Cupp, 1943: 40, fig. 2. Lefébure, 1947, lám. 2, fig. 3. Cleve-Euler, 1951: 34, fig. 33. Curl, 1959: 285, fig. 1. Moreira, 1960: 5, lám. 2, fig. 8. Brunel, 1962: 34, lám. 8, fig. 4. Distribución general. Se ha registrado en las costas del Pacífico y Atlántico, es planctónica y bentónica, nerítica y ticopelágica; se ha considerado cosmopolita. En México se ha localizado en la costa NW del Pacífico y Lagunas de Yavaros y Términos. Distribución local. Ampliamente distribuida en la laguna en las 3 épocas, aunque con mayor abundancia en invierno. Melosira sulcatafirma hexagona Grunow (Lám. 12, figs. 2a-b) Schmidt, 1873-1904, lám. 176, figs. 17-18. Distribución local. Estación 9 como rara en primavera. Melosira sulcata forma poligona Grunow (Lám. 12, fig. 3). Schmidt 1873-1904, lám. 176, fig. 19. Distribución local. Estación 12 como excepcional en invierno. Melosira sulcata forma radiata Grunow (Lám. 12, fig. 4). Schmidt, 1873-1904, lám. 175, fig. 7. Distribución local. En las 3 épocas en prácticamente toda el área, sin cambios notables en la abundancia. Melosira sulcata forma ? A (Lám. 12, fig. 5). Distribución local. En las 3 épocas en prácticamente toda la laguna, sin cambios notables en la abundancia. Melosira sulcataforma ? B (Lám. 12, fig. 6) Distribución local. En las 3 épocas, aunque con mayor distribución en primavera. Melosira sulcataforma ? C (Lám. 12, fig. 7) Distribución local. Estación 8 como excepcional en primavera. Melosira sulcataforma ? D (Lám. 12, fig. 8). Distribución local. Estaciones 12 y 4 en invierno y primavera respectivamente. Melosira sulcata forma ? E (Lám. 12, fig. 9) Distribución local. Estación 9 como excepcional en primavera. Melosira sp A (Lám. 12, fig. 10) Distribución local. Estación 9 como excepcional en invierno. Melosira sp B (Lám. 12, fig. 11) Distribución local. Estación 9 como rara en primavera. Género NaviculaBordy, 1826 Navicula anpibolaCleve (Lám. 12, fig. 12). Boyer, 1927: 405. Patrick y Reimer, 1966: 445, lám. 39, figs. 78. Distribución general. Se ha registrado en aguas dulces de California. Distribución local. Estación 8 como excepcional en otoño. Navicula granulata (Bailey) Smith (Lám. 12, figs. 13a-b) Schmidt, 1873-1904, lám. 6, figs. 26-27. Van Heurck, 1896: 212, lám. 27, fig. 765. Boyer, 1927: 404. Cleve-Euler, 1953b: 109, fig. 717. Distribución general. Se ha registrado para la costa del atlántico de Norteamérica. Distribución local. En la boca como excepcional en invierno. Navicula brasillenses (Weissft) Grunow (Lám. 12, fig. 14). Cleve-Euler, 1953b: 110, fig. 718. Boyer, 1927: 404. Distribución general. Registrada en la costa atlántica de Norteamérica, es epífita nerítica; en México se ha encontrado en la Laguna de Términos en aguas salobres y marinas. Distribución local. Estación 8 como excepcional en invierno. Navicula directa(Smith) Ralfs (Lám. 12, figs. 15a-b). Schmidt, 1873-1904, lám. 47, fig. 5. Van Heurck, 1896: 189, lám. 25, fig. 722. Boyer, 1927: 395. Frenguelli, 1943, lám. 1, fig. 8. Wood, 1963: 269, lám. 9, fig. 167. Distribución general. Registrada en las costas del Atlántico, Groenlandia y California; es epífita. En México se ha encontrado en aguas salobres en la Laguna de Términos. Distribución local. En la boca en otoño y estaciones 8 y 18 en invierno. Navicula distans (Smith) Ralfs (Lám. 12, fig. 16). Schmidt, 1873-1904, lám. 45, fig. 14. Van Heurck, 1896: 185, lám. 3, fig. 133. Cupp, 1943: 193, fig. 143. Cleve-Euler, 1952: 70, fig. 1461. Cleve-Euler, 1953: 113, fig. 768. Wood, 1963: 269, lám. 9, fig. 168. Distribución general. Anotada como especie nerítica. Distribución local. Estación 4 como rara en primavera. Navicula forcipataGreville (Lám. 12, fig. 17). Boyer, 1927: 416. Frenguelli, 1938, lám. 1, figs. 31-32. Wood, 1963: 269, lám. 9, fig. 170. Moreira, 1966: 43, lám. 4, fig. 12. Distribución general. Ha sido encontrada en las costas del Atlántico; es nerítica euhalobia, se ha considerado cosmopolita. Distribución local. En la boca como excepcional en primavera. Navicula frequensHeurck (Lám. 12, fig. 18). Distribución local. En la boca como excepcional en otoño. Navicula longa (Gregory) Ralfs (Lám. 12, fig. 19). Van Heurck, 1896: 185, lám. 25, fig. 716. Boyer, 1927: 397. Wood, 1963: 270, lám. 9, fig. 175. Distribución general. Se ha localizado en la costa atlántica; en México se ha encontrado en la Sonda de Campeche y Lagunas de Términos y Yavaros. Distribución local. En la boca como excepcional en primavera. Navicula lyraEhrenberg (Lám. 12, fig. 20). Schmidt, 1873-1904, lám. 2, fig. 26. Van Heurck, 1896: 202, lám. 4, fig. 161. Boyer, 1927: 411. Lefébure, 1947, lám. 27, fig. 14. Patrick y Reimer, 1966: 443, lám. 39, figs. 5-6. Distribución general. Registrada en las costas del Pacífico y Atlántico de Norteamérica; es epífita de medio marino y salobre. En México se ha localizado en las Lagunas de Yavaros y Términos. Distribución local. Estaciones 8 y 12 en invierno; 4 y 12 en primavera. Navicula subcarinata Hendey (Lám. 12, fig. 21). Wood, 1963: 271, lám. 9, fig. 184. Distribución local. Estaciones 9 y 12 en invierno; 1 y 8 en primavera. Navicula weissflogii (Grunow) Cleve (Lám. 12, fig. 22). Van Heurck, 1896: 194, lám. 3, fig. 148. Boyer, 1927: 375. Allen y Cupp, 1935: 155, fig. 100. Wood, 1963: 272, lám. 9, fig. 187. Distribución general. Registrada para la Sonda de Campeche y costas de Florida. Distribución local. Estación 8 como rara en otoño. Navicula zostretti Grunow (Lám. 12, fig. 23). Boyer, 1927: 400. Frenguelli, 1938, lám. 1, fig. 38. Wood, 1963: 272, lám. 10, fig. 189. Moreira, 1966: 43, lám. 4, fig. 14. Distribución general. Anotada para el Mar Adriático y costas del Atlántico; es epífita marina se ha considerado cosmopolita. Distribución local. Estaciones 4 y 18 en otoño; y 8 en invierno. Navicula sp A (Lám. 12, fig. 24) Distribución local. En las 3 épocas en prácticamente toda el área, siendo más abundante en primavera. Navicula sp B (Lám. 12, fig. 25). Distribución local. Estaciones 1 y 4 en otoño e invierno respectivamente. Navicula sp C (Lám. 13, figs. 1a-d). Distribución local. En las 3 épocas con amplia distribución, siendo más abundante en las estaciones 4 y 8 en que se registró como presente en primavera. Navicula sp D (Lám. 13, fig. 2). Distribución local. En la boca como rara en invierno. Navicula sp E (Lám. 13, fig. 3). Distribución local. Estación 8 como excepcional en otoño. Navicula sp F (Lám. 13, fig. 4). Distribución local. En la estación 4 en otoño y 8 en primavera. Navicula sp G (Lám. 13, figs. 5a-b). Distribución local. Estaciones 8 18 y 9 en otoño, invierno y primavera respectivamente. Navicula sp H (Lám. 13, fig. 6). Distribución local. En la boca como excepcional en otoño. Navicula sp I (Lám. 13, fig. 7). Distribución local. En la estación 12 como rara en primavera. Naviculasp J (Lám. 13, fig. 8) . Distribución local. En la boca como excepcional en otoño. Navicula sp K (Lám. 13, fig. 9). Distribución local. Estación 18 como rara en invierno. Navicula sp L (Lám. 13, fig. 10). Distribución local. En la boca como excepcional en invierno y primavera. Navicula sp M (Lám. 13, fig. 11). Distribución local. En la boca como excepcional en primavera. Navicula sp N (Lám. 13, fig. 12) . Distribución local. En la boca en invierno y estaciones 1 y 9 en primavera. Navicula? sp O (Lám. 13, fig. 13) Distribución local. En la boca como excepcional durante el otoño. Navicula ? sp P (Lám. 13, fig. 14). Distribución local. En la boca como excepcional en otoño. Navicula? sp Q (Lám. 13, fig. 15). Distribución local. En las 3 épocas, siendo más abundante en primavera. GéneroNitzschiaHassel, 1845, em. Grunow,1880 Nitzschia angustata (Smith) Grunow (Lám. 13, fig. 16). Van Heurck, 1896: 385, lám. 15, fig. 498. Distribución general. Se ha encontrado en aguas dulces y salobres. Distribución local. Estaciones 3 y 9 como rara en primavera. Nitzschia granulataGrunow (Lám. 13, fig. 17). Boyer, 1926: 496. Wood, 1963: 273, lám. 10, fig. 195. Moreira, 1968: 10, fig. 16. Distribución general. Registrada en aguas salobres de las costas del Atlántico y Pacífico, es epífita planctónica. Distribución local. Estaciones 3, 8 y 12 en invierno y 12 en primavera. Nitzschia hungarica Grunow (Lám. 13, fig. 22). Van Heurck, 1896: 387, lám. 15, fig. 504. Cleve-Euler, 1952: 61, fig. 1435. Wood, 1963: 273, lám. 10, fig. 196. Distribución general. Se ha encontrado en aguas dulces y salobres. Distribución local. Estaciones 3 y 8 en otoño y primavera respectivamente. Nitzschia laevissima Grunow (Lám. 13, figs. 19a-b). Boyer, 1927: 516. Cleve-Euler, 1952: 75, fig. 1471. Distribución general. Registrada para la costa del Atlántico, también es salobre. Distribución local. En las 3 épocas, su representación la tuvo en la estación 12, en que se registró como abundante en otoño. Nitzschia longa Grunow (Lám. 13, figs. 20a-b). Boyer, 1927: 509. Frenguelli, 1938, lám. 4, fig. 7. Distribución general. Anotada para la Sonda de Campeche y Laguna de Términos. Distribución local. En las 3 épocas como rara, aunque con mayor distribución en primavera. Nitzschia longissima(Brébissan) Ralfs (Lám. 13, fig. 21). Van Heurck, 1896: 404, lám. 17, fig. 568. Boyer, 1927: 526. Allen y Cupp, 1935: 162, fig. 121. Frenguelli, 1938, lám. 4, fig. 22. Cupp, 1943: 200, fig. 154. Lefébure, 1947, Lám. 29, fig. 15. Cleve-Euler, 1952: 92, fig. 1508. Curl, 1959: 302, fig. 102. Wood, 1963: 273, lám. 10, fig. 197. Distribución general. Se ha encontrado en la costa del Pacífico y Atlántico; es nerítica y de aguas salobres; se ha considerado cosmopolita. En México se ha localizado en las Lagunas de Yavaros y Términos. Distribución local. Estación 8 como excepcional en otoño. Nitzschia longissima forma costata Schmidt (Lám. 13, fig. 22). Schmidt, 1873-1904, lám. 335, fig. 4. Distribución local. Rara en primavera en la estación 9. Nitzschia panduriformis Gregory (Lám. 13, fig. 23). Van Heurck, 1896: 386, lám. 15, fig. 500. Boyer, 1927: 497. Frenguelli, 1938, lám. 2, figs. 34-35. Cleve-Euler, 1952: 55, fig. 1426. Wood, 1963: 274, lám. 10, figs. 202a-b. Moreira, 1966: 44, lám. 4, fig. 19. Distribución general. Registrada en la costa del Atlántico. Es planctónica nerítica, eurihalina; se ha considerado cosmopolita. En México se ha encontrado en la Laguna de Términos en aguas salobres. Distribución local. Estaciones 9 y 1 en otoño e invierno respectivamente. Nitzschia paradoxa(Gmelin) Grunow Bacillaria paxillifer (O. F. Müller) Hendey (Lám. 13, fig. 24). Van Heurck, 1896: 392, lám. 15, fig. 518. Boyer, 1927: 509. Cupp, 1943: 206, fig. 159. Cleve-Euler, 1952: 69, fig. 1457. Curl, 1959: 302, fig. 103. Hendey, 1964: 274, lám. 21, fig. 5. Distribución general. Se ha encontrado en la costa del Atlántico y como ocasional en aguas dulces; abunda en aguas salobres y neríticas. En México se ha localizado en la Laguna de Yavaros. Distribución local. Estaciones 1 y 12 en otoño; 9 y 1.91 en primavera. Nitzschia punctata (Smith) Grunow (Lám. 14, fig. l). Van Heurck, 1896: 384, lám. 15, fig. 491. Boyer, 1927: 496. Wood, 1963: 274, lám. 10, fig. 204. Distribución general. Anotada para la costa atlántica de Norteamérica; es nerítica y de medios salobres cosmopolita. En México se ha localizado en la Laguna de Yavaros. Distribución local. En las estaciones 8; 3 y 12; 12 en otoño, invierno y primavera respectivamente. Nitzschia sigma(Kützing) Smith (Lám. 14, fig. 2). Schmidt, 1873-1904, lám. 336, figs. 1-4. Van Heurck, 1896: 396, lám. 16, fig. 531. Boyer, 1927: 514. Lefébure, 1947, lám. 29, fig. 14. Cleve-Euler, 1952: 74, fig. 1470. Wood, 1963: 274, lám. 10, fig. 205. Moreira, 1966: 44, lám. 4, fig. 2 1. Distribución general. Se ha encontrado en el Mar Báltico; es planctónica, eurihalina; también se ha registrado en aguas salobres. En México se ha localizado en las Lagunas de Términos y Yavaros. Distribución local. Estación 12 en las 3 épocas estudiadas. Nitzschia sigmoidea(Nitzschia) Smith (Lám. 14, figs. 3a-b). Schmidt, 1873-1904, lám. 332 figs. 1-4. Van Heurck, 1896: 395, lám. 16, fig. 528. Boyer, 1927: 513. Cleve-Euler, 1952: 72, fig. 1467. Distribución general. Registrada como planctónica de aguas dulces; en México se ha encontrado en la Laguna de Términos en aguas salobres. Distribución local. En las 3 épocas del año en forma rara, aunque con mayor distribución en primavera. Nitzschia spathulata Brébison (Lám. 14, fig. 4). Van Heurck, 1896: 393, lám. 16, fig. 523. Boyer, 1927: 511. Cleve-Euler, 1952: 71, fig. 1455. Distribución general. Exclusivamente marina. Distribución local. Estaciones 4 en invierno; 4 y 12 en primavera. Nitzschia silicula Hustedt (Lám. 14, fig. 5). Wood, 1963: 274, lám. 10, fig. 206. Distribución local. Estación 9 como excepcional en invierno. Nitzschia sp A (Lám. 14, fig. 6). Distribución local. Estaciones 1 y 9 como excepcional en invierno. Nitzschia sp B (Lám. 14, fig. 7). Distribución local. Estación 9 como excepcional en otoño. Nitzschia sp C (Lám. 14, fig. 8). Distribución local. Estación 12 como rara en otoño. Nitzschia sp D (Lám. 14, fig. 9). Distribución local. Estación 8 como rara en invierno. Nitzschia sp E (Lám. 14, fig. 10). Distribución local. Estación 4 como rara en invierno. Nitzschia sp F (Lám. 14, figs. 11a-b). Distribución local. En las 3 épocas como excepcional. Nitzschiasp G (Lám. 14, fig. 12). Distribución local. Estaciones 8 y 12; 12; y 9 en otoño invierno y primavera respectivamente. Nitzschia sp H (Lám. 14, fig. 13). Distribución local. Estaciones 9 y 12; 12 y 18 en invierno y primavera respectivamente. Género OpephoraPetit, 1888 Opephora marina (Gregory) Petit (Lám. 14, fig. 13). Frenguelli, 1938, lám. 5, fig. 22. Cleve-Euler, 1953a: 15, fig. 314. Mereira, 1966: 44, lám. 4, fig. 25. Distribución general. Es epífita pelágica, cosmopolita. Distribución local. En la boca como excepcional en otoño. Opephora pacifica (Grunow) Petit (Lám. 14, fig. 13). Van Heurck, 1896: 333, lám. 30, fig. 846. Frenguelli, 1938, lám. 5, fig. 21. Cleve-Euler, 1953b: 16, fig. 316. Wood, 1963: 275, lám. 10, fig. 209. Mereria. 1966: 44, lám. 4, fig. 24. Distribución general. Es epífita marina y cosmopolita; en México se ha localizado en la Laguna de Términos. Distribución local. En la boca como excepcional en invierno. GéneroPinnulariaEhrenberg, 1840 Pinnularia sp (Lám. 14, fig. 16). Distribución local. Estación 12 como rara vez en primavera. GéneroPlagiogrammaGreville, 1859. Plagiograrnma interruptumGrove (Lám. 14, fig. 17) Freguelli, 1938, lám. 5, figs. 30-31. Distribución local. En la boca y estación 8 en otoño y primavera respectivamente. Plaglogramma pulchellumGreville (Lám. 14, fig. 18). Schmidt, 1873-1904, lám. 209, fig. 32. Boyer, 1926: 179. Lefébure, 1947, lám. 22, fig. 10. Moreira, 1966: 45, lám. 4, fig. 26. Distribución general, Registrada en las Bahamas y costas de la India; es nerítica euhalobia. Distribución local. Estación 8 como excepcional en invierno. Plagiogramma vanheurckiiGrunow (Lám. 14, fig. 19). Van Heurck, 1896: 338, lám. 10, fig. 391. Frenguelli, 1938, lám. 5, fig. 32. Cupp, 1943: 180, fig. 129. Distribución general. Es nerítica. Distribución local. En la boca como excepcional en invierno. Plagiogramma sp A (Lám. 14, fig. 20). Distribución local. En la boca como excepcional en otoño. Plagiogrammasp B (Lám. 14, fig. 22). Distribución local. En la boca en otoño e invierno. Plagiogramma sp C (Lám. 14, fig. 22). Distribución local. Estación 1 como excepcional en otoño. GéneroPlanktoniella Schütt, 1893 Planktoniella sol (Wallich) Shütt (Lám. 14, fig. 23). Allen y Cupp, 1935: 120, fig. 19. Cupp, 1943: 63, fig. 27. Lefébure 1947, lám. 8, fig. 2. Moreira, 1971: 15, lám. 2, fig. 15. Distribución general. Es nerítica y pelágica, probablemente viviendo cerca del fondo en mares tropicales y subtropicales; en México se ha encontrado en la costa NW del Pacífico y Lagunas de Yavaros y Términos. Distribución local. Estaciones 9 y 12 como presente en invierno. GéneroPleurosigma (Smith) Cleve, 1852, em.1894 Pleurosigma famosum Smith (Lám. 14, fig. 24 ). Van Heurck, 1896: 254, lám. 6, fig. 268. Boyer, 1927: 467. Cleve-Euler, 1952: 20. fig. 1360. Distribución general. Registrada para las costas del Atlántico y Pacífico de Norteamérica. Distribución local. Estaciones 4 en invierno; 8, 9 y 12 en primavera. Pleurosigma normanii Ralfs (Lám. 14, fig. 25). Boyer, 1927: 471. Allen y Cupp, 1935: 156, fig. 106. Cupp, 1943: 196, fig. 148. Distribución general. Anotada para las costas del Atlántico de Norteamérica; es bentónica nerítica. En México se ha encontrado en la Laguna de Términos en aguas salobres. Distribución local. Estación 3 como rara en primavera. Pleurosigma sp A (Lám. 15, fig. 1) . Distribución local. Estación 12 como rara en primavera. Pleurosigma sp B (Lám. 15, fig. 2). Distribución local. Estación 12 como rara en primavera. Pleurosigma sp C (Lám. 15, fig. 3). Distribución local. Estación 4 como rara en primavera. Pleurosigma sp D (Lám. 15, fig. 4). Distribución local. Estaciones 1 y 4 en primavera. Pleurosigma sp E (Lám. 15, fig. 5). Distribución local. En la boca como excepcional en invierno. GéneroPseudaliscus(Leud-Fort) Rattray, 1879, 1888 Pseudaliscus peruvianus (Kitton) Rattray (Lám. 15, fig. 6). Boyer, 1926: 96. Distribución local. En la boca como excepcional en primavera. GéneroRaphoneisEhrenberg, 1844 Raphoneís surirella (Ehrenberg) Grunow (Lám. 15, fig. 7). Van Heurck, 1896: 330, lám. 10, fig. 397. Allen y Cupp, 1935: 152, fig. 94. Frenguelli, 1938, lám. 5, figs. 8-9. Cleve-Euler, 1953a: 28, fig. 341. Wood, 1963: 279, lám. 11, fig. 229a. Moreira, 1966: 45, lám. 5, fig. 2. Distribución general. Se ha registrado en el Golfo de California; es bentónica de medio marino y salobre; se ha considerado cosmopolita. Distribución local. En otoño y primavera en la boca y estación 4 respectivamente. GéneroRhizosolenia (Ehrenberg) Brightweil 1843, 1858 Rhizosolenia alata Brightiveell (Lám. 15, fig. 8). Schmidt, 1873-1904, lám. 317, fig. 1. Van Heurck, 1896: 416, lám. 33, fig. 837. Allen y Cupp, 1935: 130, fig. 43. Cupp, 1943: 90, fig. 52a. Cleve-Euler, 1951: 90, fig. 171. Curl 1959: 297, fig. 68. Distribución general. Se ha registrado en el Atlántico de Norteamérica; es nerítica y pelágica de aguas tropicales y templadas; se ha considerado cosmopolita. En México se ha registrado en la costa NW del Pacífico y Lagunas de Yavaros y Términos. Distribución local. Estación 3 como rara en primavera. Rhizosolenia alata forma gracillima (Cleve) Grunow (Lám. 15, fig. 9a-b) Allen y Cupp, 1935: 130, fig. 44. Cupp, 1943: 92, fig. 52 b. Distribución general. Es planctónica y nerítica, muy común en aguas del Norte; en México se ha encontrado en la Laguna de Términos en aguas salobres. Distribución local. Estaciones 8; 1 y 3; 8 en otoño invierno y primavera. Rhizosolenia calcaravis Schultze (Lam. 15, fig. 10) Van Heurck, 1896: 415, lám. 33, fig. 884. Allen y Cupp, 1935: 129, fig. 41. Cupp, 1943: 89, fig. 51. Cleve-Euler, 1951: 89, fig. 165. Curl, 1959: 297, fig. 70. Moreira, 1967: 11, lám. 1, fig. 13. Distribución general. Es nerítica y pelágica, de aguas tropicales y subtropicales. Distribución local. En toda la laguna en otoño destacando como presente en la estación 8; y estaciones 1 y 8 en primavera. Rhizosolenia imbricata var. shrubsolei (Cleve) Schrod (Lám. 15, figs. 11a-b). Van Heurck, 1896: 415, lám. 33, fig. 885. Allen y Cupp, 1935: 118, fig. 36. Cleve-Euler, 1951: 88, fig. 174. Distribución general. Es nerítica. Distribución local. En la boca y estación 8 en otoño, así como estación 8 en primavera. Rhizosolenla sendera Brightwell (Lám. 15, fig. 12). Van Heurck, 1896: 414, lám. 17, fig. 602. Boyer, 1926: 100. Cupp, 1943: 88, fig. 49. Cleve-Euler, 1951: 89, fig. 160. Cleve-Euler, 1953a: 128, fig. 37. Curl, 1959: 298, fig. 76. Brunel,, 1962: 67, lám. 4, figs. 3-4. Distribución general. Es pelágica de aguas templadas del Norte; en México se ha localizado en la costa NW del Pacífico y Lagunas de Yavaros y Términos. Distribución local. En las 3 épocas sin cambios notables en la abundancia. Rhizosolenia sp A (Lám. 15, fig. 13). Distribución local. Estaciones 8 y 18 en otoño y 8 en invierno. Rhizosolenlasp B (Lám. 15, figs. 14a-b). Distribución local. En la boca como excepcional en otoño. GéneroRhopalodia (Brébisson) Müller, 1885 Rhopalodia gibberula(Ehrenberg,) Müller (Lám. 15, figs. 15a-b). Schmidt, 1873-1904, lám. 254, figs. 13-21. Wood, 1963: 279, lám. 12, figs. 230a-d. Distribución local. En las 3 épocas, aunque con mayor distribución en otoño. Rhopalodia gimmerula var. producta (Grunow) Cleve-Euler (Lám. 15, fig. 16). Frenguelli, 1942, lám. 8, fig. 7. Cleve-Euler, 1952: 43, fig. 1415. Distribución local. En las 3 épocas, pero con mayor abundancia en primavera. Rhopalodiasp A (Lám. 15, fig. 170). Distribución local. Estación 4 como rara en primavera. Rhopalodia sp B (Lám. 15, fig. 18) . Distribución local. Estación 9 como excepcional en primavera. Rhopalodiasp C (Lám. 15, fig. 19). Distribución local. Estación 4 como rara en primavera. Género StauroneisEhrenberg, 1843 Stauroneis ancepsEhrenberg (Lám. 16, fig. 1) . Van Heurck, 1896: 160, lám. 1, fig. 55. Boyer, 1927: 422. Frenguelli, 1942, lám. 1, fig. 35. Cleve-Euler, 1953a: 163, fig. 125. Cleve-Euler, 1953b: 207, fig. 943. Patrick y Reimer, 1966: 361, lám. 30, fig. 1. Skvortzow, 1971: 73, lám. 7, fig. 11. Distribución general. Muy común en aguas dulces. Distribución local. Estación 4 en invierno y primavera. Stauroneis phoenicenteron(Nitzsch) Ehrenberg (Lám. 16, fig. 2). Van Heurck, 1896: 159, lám. 1, fig. 150. Boyer, 1927: 421. Lefébure, 1947, lám. 26, fig. 8. Wood, 1963: 280, lám. 12, fig. 233. Patrick y Reimer, 1966: 359, lám. 29, figs. 1-2. Skvortzow, 1971: 74, lám. 7, fig. 12. Distribución general. Muy común en aguas dulces; en México se ha registrado en la Laguna de Yavaros. Distribución local. En la boca como excepcional en primavera. GéneroSurirellaTurpin, 1828 Surirella fastuosavar. lata Ehrenberg (Lám. 16, fig. 3). Van Heurck, 1896: 372, lám. 13, fig. 584. Distribución local. Estación 8 en invierno como excepcional. Surirella fastuosa var. recedens (Smith) Cleve (Lám. 16, fig. 4). Cupp, 1943: 208, fig. 160. Distribución general. Registrada para la costa W de Norteamérica como poco común. Distribución local. Estaciones 1 y 12 como excepcional en otoño e invierno respectivamente. Surirella febigerú Lewis (Lám. 16, fig. 5) . Schimidt, 1873-19041 lám. 21, fig. 1. Boyer, 1927: 544. Moreira, 1962: 19, lám. 4, fig. 41. Distribución general. Registrada en la costa del Atlántico de Norteamérica y en aguas salobres; en México se ha encontrado en las Lagunas de Yavaros y Términos. Distribución local. En las 3 épocas, aunque con mayor distribución en invierno. Surirella gemmaElirenberg (Lám. 16, figs. 6a-b). Van Heurck, 1896: 372, lám. 13, fig. 582. Boyer, 1927: 540. Cleve-Euler, 1953a: 163 fig. 125. Moreira, 1962: 20, lám. 2, fig. 7. Distribución general. Registrada para la costa atlántica; es nerítica y de aguas salobres. En México se ha encontrado en las Lagunas de Yavaros y Términos. Distribución local. Estación 9 en las 3 épocas. Surirella ovataKützing (Lám. 16, fig. 7) Schinidt, 1873-1904, lám. 24, figs. 54-55. Boyer, 1927: 541. Frenguelli, 1942, lám. 9, fig. 5. Cleve-Euler, 1952: 122, fig. 1566. Wood, 1963: 281, lám. 12, fig. 239. Distribución general. Muy común en aguas dulces y salobres. Distribución local. Estación 12 como rara en primavera. Surirella sp (Lám. 16, fig. 8) . Distribución local. Estación 8 como rara en primavera. GéneroSynedraElirenberg, 1830 Synedra robusta Ralfs (Lám. 16, figs. 9a-b). Van Heurck, 1896: 371, lám. 12, fig. 577. Boyer, 1926: 209. Distribución general. Se ha registrado para las costas del Pacífico y también en aguas dulces. Distribución local. Estaciones 18 y 8 en otoño e invierno respectivamente. Synedra ulna(Nitzch) Ehrenberg (Lám. 16, fig. 10). Van Heurck, 1896: 330, lám. 10, fig. 409. Boyer, 1926: 198. Lefébure 1947, lám. 23, fig. 16. Cleve-Euler, 1953: 60, fig. 282. Moreira, 1962: 13, lám. 5, fig. 37. Brunel, 1962: 162, lám. 46, figs. 1-3. Wood, 1963: 282, lám. 12, fig. 246. Patrick y Reimer, 1966: 148, lám. 7, figs. 1-2. Skvortzow, 1971, lám. 3, figs. 14-16. Distribución general. Es epífita característica de agua dulce en lagos eutróficos; se ha registrado en la Laguna de Yavaros. Distribución local. Estación 18 como excepcional en primavera. Synedra sp A (Lám. 16, figs. 11a-b). Distribución local. Estaciones 3, 4 y 18 en otoño; así como 4 y 8 en invierno. Synedra sp B (Lám. 16, figs. 12a-b) Distribución local. Estaciones 3, como excepcional y 18 como presente en otoño. GéneroThalassionema Grunow, 1880 Thalassionema nitzschioides Grunow (Lám. 16, fig. 13). Cupp, 1943: 182, fig. 133. Lefébure, 1947, lám. 24, fig. 2. Cleve-Euler, 1953a: 75, fig. 400. Curl, 1959: 300, fig. 86. Moreira, 1971: 17, lám. 2, fig. 14. Distribución general. Es nerítica de aguas templadas del Norte; se ha considerado cosmopolita. En México se ha registrado para la Costa NW del Pacífico y Laguna de Yavaros. Distribución local. En las 3 épocas, aunque con mayor distribución en invierno. GéneroThalassiothrix Cleve y Grunow, 1880 Thalassiothrix delicatula Cupp (Lám. 16, fig. 14), Cupp, 1943: 188, fig. 137. Distribución general. Se presenta de aguas templadas a subtropicales del Sur. Distribución local. En las 3 épocas, aunque con mayor distribución en otoño. Género TrachyneisCleve, 1894 Trachyneis aspera (Ehrenberg) Cleve (Lám. 16, fig. 15). Boyer, 1927: 428. Wood, 1963: 283, lám. 12, fig. 249. Moreira, 1966: 47, lám. 5, fig. 17. Distribución general. Es ocasional en el plancton, nerítica, mesohalobia cosmopolita; en México se ha registrado en la Laguna de Términos en aguas salobres. Distribución local. En la boca, como excepcional en primavera; y en la estación 8 en otoño. GéneroTriceratium Ehrenberg, 1849 Triceratium favus Ehrenberg (Lám. 16, figs. 16a-b) . Schmidt, 1873-1904, lám. 82, figs. 1-3. Boyer, 1926: 133. Lefébure, 1947, lám. 16, fig. 6. Curl, 1959: 290, fig. 36. Moreira, 1966: 47, lám. 5, fig. 17. Distribución general. Registrada para el Golfo de México; es nerítica cosmopolita, euhalo- y eurihalina. En México se ha encontrado en la Laguna de Términos en aguas salobres. Distribución local. En las 3 épocas, pero con mayor abundancia en otoño, especialmente en la estación 4 en que se registró como presente. Triceratium scitulum Brightwell (Lám. 16, fig. 17). Schmidt, 1873-1904, lám. 83, figs. 11-13. Distribución general. Registrada en el Golfo de México y Sonda de Campeche. Distribución local. En las 3 épocas; aunque con mayor abundancia en primavera en las estaciones 1 y 9. GéneroTropidoneis Cleve, 1891 Tropidoneis lepidoptera (Gregory) Cleve (Lám. 16, fig. 18). Boyer, 1927: 480. Cupp, 1943: 197, fig. 149. Curl, 1959: 302, fig. 97. Wood, 1963: 284, lám. 12, fig. 251. Distribución general. Se ha encontrado en las costas del Atlántico; es nerítica y ticopelágica de aguas templadas. Distribución local. Estación 18 como rara en invierno. Tropidoneis seriata Cleve (Lám. 16, fig. 19). Boyer, 1927: 481. Moreira, 1962: 17, lám. 2, fig. 10. Distribución general. Se ha registrado en aguas salobres neríticas. Distribución local. Estación 18 como rara en otoño. DISCUSIÓN Y CONCLUSIONESEs un hecho bien conocido que durante la recolección de las muestras de diatomeas con red, escapan a través de sus mallas gran parte de las especies del nanoplancton, hecho que ha sido señalado en varias ocasiones por diversos autores, entre ellos Margalef (1964), quien menciona que aun las redes más finas sólo retienen del 5 al 8% del número de células contenidas en la columna de agua. Aunque esto depende más bien del tipo de las comunidades establecidas en los momentos de la captura, por lo que se debe considerar que cuando las proporciones del nanoplancton son grandes, las estimaciones serán más deficientes. En realidad el uso de redes está confinado para la captura de las especies raras y de tamaño grande, sin embargo, su uso no se ha podido sustituir en trabajos de sistemática, pero sí sería recomendable en investigaciones futuras analizar concentrados obtenidos por sedimentación de volúmenes grandes de muestras extraídas con botellas de tipo Van-dorn, a fin de lograr mayor precisión en los estudios de sistemática. A este respecto, Margalef (1972) y Gómez-Aguirre (1972), al comparar análisis cualitativos de fitoplancton de muestras recogidas por medio de red y con botellas, han encontrado resultados con una diferencia muy significativa en la composición cualitativa de los 2 tipos de muestras. En las estimaciones que se hicieron sobre la abundancia relativa de las especies identificadas (tabla 2), es necesario considerar además de las deficiencias antes señaladas por los métodos de colecta de las muestras, las introducidas por las técnicas corrosivas empleadas de Müller-Melchers (op. cit.) durante la limpieza del material diatomológico, ya que con este método gran parte de las frústulas frágiles y en menor grado las formas robustas se destruyen, por lo que resulta obvio que en las cuantificaciones que se hicieron sobre las preparaciones permanentes de acuerdo a la metodología adoptada, las especies robustas tienen comparativamente más probabilidades de registrarse en las estimaciones que las formas frágiles; sin embargo, se considera que la información que se obtuvo tiene la aceptación que cubre los objetivos de esta publicación. Existe la posibilidad de que en algunos de los nombres científicos referidos en el texto, hayan caído en desuso, en virtud de que en algunos casos la determinación sistemática se confrontó basándose exclusivamente en obras como la de Schrnidt (op. cit.) y Heurck (op. cit) entre otras, en cuyos casos varios de los nombres científicos referidos por estos autores cayeron primero en sinonimia, y posteriormente han sido desechados. En este caso se piensa que pudieran encontrarse Lampriscus kittoni, Cerataulus californicus y probablemente otros con los que el lector pudiera sorprenderse. Se piensa en la posible existencia de variedades o formas para algunas especies, determinadas por la acción del medio ambiente tan característico de los medios lagunares costeros, en este caso se pueden mencionar los ejemplares de las figuras 5 y 6 (Lám. 4), que se cree pertenecen a Auliscus caelatus y las figs. 5 a 9 (Lám. 12) a formas deMelosira sulcata; asimismo, se supone que las figuras 24 y 25 (Lám. 12), pudieran corresponder a la misma especie deNavicula que no pudo determinarse, al igual que los ejemplares de las figs.. 18 y 19 (Lám. 15) a Rhopalodia gibberula y las figs. 9a-9b (Lám. 8) a Coscinodiscus subtilis. Los hechos que nos llevan a pensar lo antes expuesto se basan en las diferencias que se observaron en las valvas, que aparentemente superan la variabilidad de la especie y no justifican una separación específica; sin embargo, la falta de estudios a nivel de géneros y especies que permitan determinar hasta qué punto los detalles de la valva son hereditarios, y a qué extensión pueden ser afectados por factores del medio ambiente, no permiten esclarecer muchos de estos problemas. Por otro lado, hay que considerar como lo ha señalado Geitler (In Lewin 1963), los aspectos tan peculiares en la estructura y crecimiento en las células de las diatomeas, que durante la división asexual como consecuencia de la deposición interna de nueva pared celular, las dimensiones celulares decrecen por una constante reducción en cada division vegetativa, como resultado, en varias diatomeas pennales las proporciones axiales cambian y las células pequeñas no tienen las mismas proporciones geométricas que las grandes de las que se originaron. Además de esto se debe considerar el polimorfismo tan característico de algunas especies que no es todavía bien conocido. Por lo anterior se recomienda para los trabajos futuros la utilización de cultivos monoespecíficos para ayudar a resolver en parte estos problemas. Otro de los aspectos que conviene señalar y está en relación con los antes expuesto, y basado en que el criterio morfológico de las valvas es el fundamento de la sistemática, es el hecho de insistir que las diatomeas deben observarse en sus planos valvar, cingular, así como las formas coloniales de las especies que las presentan, ya que algunas de ellas en sus distintas posiciones presentan aspectos morfológicos diferentes, además del polimorfismo propio de muchas especies que pueden crear confusiones que aumenten errores en la taxonomía. A este respecto cabe mencionar la afirmación de Helmcke (In Lewin, 1963), quien menciona que de 100,000 especies de diatomeas que han sido descritas, solamente 10,000 son actualmente reconocidas como válidas. Esto pone en evidencia que nuestro conocimiento actual no es satisfactorio, por lo que hay la necesidad de buscar más bases que den solidez a la taxonomía en este grupo. Es interesante señalar que a pesar de la hiperhalinidad del ambiente, se encontraron especies que han sido registradas como características de medios salobres o con alta frecuencia ocasional en estas aguas, sin embargo, estuvieron bien representadas numéricamente las especies: Amphora lineolata, Bacillaria paradoxa, Cocconeis Placentula, Coscinodiscus subtilis, Cyclotella striata, Diplones ovalis, D. bombus, Gyrosigma spencerii, Navicula lyra, Nitzschia angustata, N. hungarica, N. laevissima, N. sigma, N. granulata, Mastogloia apiculata, M. exigua, Raphoneis surirella, Surirella febigerii, S. gemma, S. ovata, y aun especies típicas de agua dulce comoCocconeis disculus, Eunotia luna, Nitzschia sigmoidea, Stauroneis anceps, S. phoenicenteron y Synedra ulna, siendo en general la mayoría de ellas más abundante en los sitios más distantes de la boca, especialmente en la estación 18. Su presencia y distribución tan localizada, hace suponer que dichas especies se han adoptado a vivir en este medio, y ayuda a apoyar la observación hecha por Ayala-Castañares et. al.(1970) , en el sentido de que, el cuerpo denominado Estero de Bacorehuis de la laguna, es remanente de un afluente del río Álamos que descargó sus aguas al océano en esa área y posteriormente hacia el SW (Fig. l). La distribución de las especies está determinada fundamentalmente por la marea y en parte por la salinidad. Las corrientes de marea tienen su mayor influencia hacia el ramal SW de la laguna y con menor intensidad hacia el fondo del Estero de Bacorehuis (estación 18) , lo cual se pudo constatar por la flora diatomológica nerítica identificada, además de observaciones directas. Las especies que más abundaron en estos sitios fueron: Biddulphia aurita, Nitzschia longissima, Chaetoceros curvicetum, Chlorenzianum, Rhizosolenia i.mbricata var. shrubsolei, Rh. setigera, Rh. alata, Thalassionema nitzschioi- Planhtoniella sol y Ditylum brightwelli. La mayor parte de estas especies han sido registradas en varias ocasiones por Allen (1927, 1927b, 1928 y 1937) Cupp y Allen (1938) y Round (1967), durante sus observaciones en el Golfo de California, por lo que resulta obvia su presencia en la laguna. Es interesante hacer resaltar que algunas de estas especies como Chaetoceros curvicetum, Thalassionema nitzschioides, Rhizosolenia setigera y Rh. alata, han sido registradas como muy abundantes por Allen (1927, 1927b) , en estudios que se hicieron frente a la costa de San Diego y Canal de Santa Bárbara en la costa occidental de California, por lo que su presencia en la laguna hace suponer que el centro de dispersión de estas especies viaja a través de la corriente de California y logran penetrar a la laguna por posibles corrientes litorales y efectos de marea. Esta suposición se basa también en las observaciones hechas por Allen (1937), quien en un estudio comparativo de las dos costas de California durante las expediciones de la Allan Hancock, encontró que no existen diferencias esenciales en la representación de géneros y especies para ambas costas. Relacionado en parte también al efecto de marea, se encontró que las especies: Amphora laevis, Amphora sp G, Campylosdiscus sp, Cocconeis placentula, Coscinodiscus obscurus, Cyclotella striata, Mastogloia spp, Synedra ulna, Tropidoneis lepidoptera, T. seriataentre otras, se encuentran limitadas a la estación 18, en donde imperan aguas tranquilas con escasa influencia de marca, por lo que pudieran considerarse especies características de la laguna. La salinidad es el otro factor que interviene en la distribución de las especies, pues se encontró queChaetoceros sp A y B, Coscinodiscus sp K,Diploneis vacillans, Diploneis sp, Grammatophora oceanica, Pleurosigna normanii, Rhizosolenia alata, se encuentran con mayor abundancia en la Ensenada de Bamocha, que el el sitio que presenta las salinidades más elevadas en la laguna. Es interesante resaltar, que aunque los muestreos fueron superficiales y predominaron las diatomeas planctónicas, también se capturaron gran variedad de especies bentónicas como Actinoptychus vulgaris, A. vulgaris forma octonaria, Caloneis powelli, Gyrosigma fascíola, Mastogloia apiculata, Melosira sucata, Pleurosigma normanii y Raphoneis surirella entre otras, sobre todo en las estaciones más someras (3, 12 y 18), lo que se puede deber a que la laguna se ve afectada directamente por la acción de los vientos y corrientes de marea como consecuencia de la poca profundidad, presentándose una mezcla vertical. Se encontró también la existencia de poblaciones como Actinoptychus campanulifer, Actinoptychussp A, Amphora terris, Cocconeis paniformis, Cocconeis sp B,Cyclotella striata, Gyrosígma balticum, Melosira sulcata f. radiata, M. sulcataf. B,Navicula sp A y C y Rhopalodia gibberulavar. producta, las cuales tuvieron una amplia distribución que se mantuvo a través de las tres épocas de estudio, por lo que también podrían considerarse como especies características. También cabe señalar a las especies que destacaron por su abundancia relativa en las tres épocas estudiadas, de esta forma se encontró que en el otoño dominaron Biddulphia mobiliensis, Cocconeis paniformis, Cocconeis sp B y Nitzschia laevíssima; en la temporada de invierno destacaron Amphora terroris, Cocconeis paniformis Cocconeis sp B, Cyclotella striatayNitzschialaevissima; por último en la época primaveral sobresalieron Amphora terroris, Cocconeis sp B,Cyclotella striata y Nitzschia laevissima. En cuanto a la diversidad de especies, tomando en consideración que no se utilizó la metodología más adecuada y conscientes de las limitaciones que eso implica, se pueden establecer de una- manera artificial y comparativa, tres categorías. La primera, que presenta la mayor diversidad, en que se identificaron de 40 a 68 especies y que se ubica en las estaciones 1 y 9; la segunda con una diversidad mediana, que se establece en las estaciones 4 y 8, en que se determinaron de 25 a 35 especies; y la tercera categoría que tiene la menor diversidad en donde se incluyen las estaciones 3 y 18 en que se identificaron entre 14 y 7 especies. Estas variaciones en la diversidad están determinadas fundamentalmente por la influencia marina, así como al aporte continental de agua dulce por parte de los drenes del sistema de riego del río Fuerte. A manera de conclusión podemos decir que la diversidad fue mayor en los sitios de mayor contacto con el mar. AgradecimientosEl autor desea expresar su reconocimiento a las instituciones ya mencionadas (SRH) , a través del Instituto de Biología (UNAM), por el patrocinio y las facilidades proporcionadas; a F. Mendoza Von Borstel y A. Cortés, por su decidida ayuda durante la realización de los Planes Escuinapa-Yavaros; y a los investigadores G. A. Fryxell (Universidad de Texas A & M), S. Gómez; A. Ayala-Castañares, A. Villalobos, y M. E. Caso por la revisión crítica en el mejoramiento de este trabajo. LITERATURAALLEN, W. E., Bull. Quantitative studies on inshore marine diatoms and dinoflagellates of Southern California. Scripps Inst. Oceanogr. tech. ser.,1921.9-29. 1(2): Bull. Quantitative studies on inshore marine diatonis and dinoflagellates collected in Southern California in 1924.Scripps Inst. Oceanogr. tech. ser.,1924.347-356.1(15): Bull. Quantitative studies on inshore marine diatoms and dinoflagellates of Southern California in 1922.Scripps Inst. Oceanogr. tech. ser1927a.31-38.1: Bull. Quantitative studies on inshore marine diatonis and dinoflagellates of Southern California in 1921.Scripps Inst. Oceanogr. tech. ser.,1927b.19-29.1 (2) Bull. Review of five years of study on phyto plankton at Southern California 1920-1924. Scripps Inst. Oceangr. tech. ser., 1928a.357-401.1: Bull. Catches of marine diatoms and dinofla gellates taken by boat in Southern California waters in 1926. Scripps Inst. Oceanogr. tech. ser.,1928b.201-246. 1: Plankton diatonis of the Gulf of California obtained by the Allan Hancock expedition of 1936. Univ. South. Calif. Press, Hancock Exped.,1937.47-59.3: Bull. Seasonal ocurrence of marine plankton diatonis of Southern California in 1938. Scripps Inst. Oceanogr., tech. Ser., 1945a.293-334.5: Bull. Vernal distribution of marine plankton diatonis offshore in Southern California in 1940. Scripps Inst. Oceanogr., tech. Ser.,1945b.335-370.5 (4): _____,ALLEN, W. E. y E. E. Ann. Jard. bot. Buitenzorg., Cupp, Plankton diatonis of the Java Sea.1935.101-174.44: ARENAS-FUENTES, V., Informe Depto. Cienc. del Mar y Limnol. Inst. Biol. Univ. Nal. Autón. México.:Estudios ambientales preliminares en la Bahía de Agiabampo. Son./Sin.1969.131. AYALA-CASTAÑARES, A., V. ARENAS, S. GÓMEZ, A. GARCÍA, M. E. CASO, M. BRAVO, R. LAMOTHE y J. A. CABRERA, Informe Depto. Cienc. del Mar y Limnol.Análisis de antecedentes y programa detallado de las investigaciones de la Universidad Nacional Autónoma de México, a través del Instituto de Biología, en los Planes Piloto Escuinapa y Yavaros. Inst. Biol. Univ. Nal. Autón. México.: 1968.1-54. AYALA-CASTAÑAREs, A., M. GUTIÉRREZ y V. M. MALPICA, Informe Depto. Cienc. del Mar y Limnol.Informe final de los estudios de Geología Marina en las regiones de Yavaros, Son., Huizache y Caimanero, Sin., y Agiabampo, Sin. durante la primera etapa. Inst. Biol. Univ. Nal. Autón. México.:1970.3-190. BRADBURY, J. P., Paleolimnology of Lake Texcoco México. Evidence from diatoms. Limnol. Oceanogr.,1971.180-200.16 (2): BRUNEL, J.,. Bol. Inst. Univ. Montreal, Le phytoplancton de la Baie des ChaleursCanadá,1962.9-365.77: BOYER, C. S., Synopsis of North American Diatomaceae. Proc. Acad. nat. Sci. Philad.,1926.1-128.78 (1): Synopsis of North American Diatomaceae.Proc. Acad. nat. Sci. Philad.,1927.229-583.79 (2): CLEVE-EULER, A., F. Svens. Vet. Akad. Handl., Die diatomeen von Schweden und Finland.1951.1-163.2(1): K. Svens. Vet. Akad. Handl.,Die diatomeen von Schweden und Finland.1952.1-153.3(3): K. Svens. Vet. Akad. Handl., Die diatomeen von Sclimeden und Finland. 1953a.1-158. 2 (1): K. Svens. Vet. Akad. Handl., Die diatomeen von Schweden und Finland. 1953b.1-255.4 (5): CUPP, E. E., Bull. Scripp. Inst. Oceanogr. tech. Ser., Marine plankton diatoms of the West of North America.1943.1-238.5 (1): CUPP, E. E. y W. E. ALLEN, Plankton diatonis of the Gulf of California obtained by Allan Hancock Pacific Expedition of 1937.Univ. South. Calif. Allan Hancock Pacific Exped.,1938.61-99.3: CURL, H., Publs. Inst. mar. Sci. Univ. Tex., The phytoplankton of Apalachee Bay and the Northeastern Gulf of México.1959.277-320. 6: CRUZ, M., Tesis profesional Esc. Nal. Cienc. Biol. IPN, Análisis parcial del microplancton de la Laguna de Pueblo Viejo, Ver.México.1970.52 p. DÍAZ-LOZANO, E., An. Inst. Geol. Univ. Nal. Autón. México,Diatomeas fósiles mexicanas.1917.1-27.1: An. Inst. Geol. Univ. Nal. Autón. México,Depósitos diatomíferos en el Valle de Toxi-Ixtlahuaca, Edo. de México. 1937.1-19.9: EHRENBERG, C. G., Die Infusionsthierchen aús vollkonimene organismen.Leipzing Press.1838. Verzreitung und Einflufs, des Inikroskopischen Lebens in Süd-und Nord-Amerika. Abh. Kúnigl. Akad. Wiss.Berlin,1841.291-445. Mikrogeologie Das Erde und Felsen Schaffende Wirken des unischtbar Kleinen selbststándinggen Laben auf der Erde. In: Voss L. (Ed). Leipzig Press.1954.374 p. Über maclitige Gebirg-Schicten vorherrs- aus mikroskopischen Bacillarien unter und bei der Stadt Mexiko. Abh. Kónigl. Akad. Wiss.Berlin.1869.1-68. FRENGUELLI, J., Revta. Mus. a Plata,Diatomeas de la Bahia de San Blas (Prov. de Buenos Aires). XII. Contribución al conocimiento de las diatomeas argentinas.1938.215-337.3: Revta. Mus. La Plata, Diatomeas del Neuguén (Patagonia). XVII. Contribución al conocimiento de las diatomeas argentinas.1942.73-219.5: Revt. Mus. La Plata, Diatomeas de las Órcadas del Sur. XVIII. Contribución al conocimiento de las diatomeas argentinas.1943.221-256.5: GILBERT, J. Y. y W. E. ALLEN,J. mar, Res., The phytoplankton of the Gulf of California obtained by the "E. W. Scripps" in 1939 and 1940.1943.89-110.5(2): GÓMEZ-AGUIRRE S.,Tesis profesional Fac. Ciencias, Univ. Nal. Autón. México. Comportamiento estacional del plancton de la Laguna de Términos, Campeche, México (Resultados preliminares) .1965. 112 p. Informe Depto. Cienc. del Mar y Limnol. Inst. Biol. Univ. Nal. Autón. México.:Resultados preliminares del estudio del plancton de la Bahia de Agiabampo, Son./Sin., México. 1969.32-48. Revta. Soc. mex. Hist. Nat.,Fitoplancton del Crucero Unitaka-Maru-30 (15-22 diciembre, 1965) en las costas del Pacífico mexicano.1972.31-44.33: GÓMEZ-AGUIRRE, S., S. LICEA-DURÁN y C. FLORES-COTO, . An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México, Ciclo anual del plancton en el Sistema HuizacheCaimanero (1969-1970).1974.83-981 (1): GÓMEZ-AGUIRRE, S., H. SANTOYO y A. MARTNEZ, An. Inst. Biol. Univ. Nal. Autón. México, Ser. Zool.(en prensa). Placton de Lagunas Costeras II. Ciclo anual en la Laguna de Yavaros (1969-1970).1975.93 GÓMEZ-AGUIRRE, S., C. FLORES, S. LICEA, H. SANTOYO Y A, MARTNEZ, Informe Depto. Cienc. del Mar y Limnol., Inst. Biol. Univ. Nat. Autón. México: Informe final de la 2da. Etapa de los estudios del Plancton en los Planes Piloto Escuinapa-Yavaros (Conclusión del primer ciclo anual).1970.234-286. HERNÁNDEZ-VELASCO, J., Boln. Soc. geol. mex., Las diatomitas mexicanas y su empleo industrial.1955.34-53.18 (1) LEFEBURE, P., Atlas pur la determination des diatomées Paul Lechevalier, Paris.1947.74 p. LEWIN, J. C., Ann. Rev. Microbiol.,Diatoms.1963.373-413.17: LICEA-DURÁN, S., Tesis profesional Fac. Ciencias, Univ. Nal. Autón. México.Sistemática, distribución y variación estacional de diatomeas de la Laguna de Agia- Son./Sin., México.1971.34 p. LOYO-REBOLLEDO, M. E., Tesis profesional Fac. Ciencias, Univ. Nal. Autón. México. Taxonomía y distribución de las diatomeas del plancton de la Laguna de Términos, Camp., México. 1966.169 p. MANN, A., Marine diatoms of the Phillipine Islands. Smith. Inst. U. S. Nat. Mus.,1925.1-182. 6 (1): MARGALEF, R., Inv. Pesq., Fitoplancton e hidrografía de las costas de Cádíz (Barbate) de junio de 1961 a agosto de 1962.1964.5-31.25: Inv. Pesq.,Regularidades en la distribución de la diversidad de fitoplacton en un área del mar Caribe.1972.241-264 36(2): MARGALEF, R. y M. MASSUTI, . In: Introducción al estudio del plancton marino.Diatomeas Cons. Sup. Inv. Cíent. Patronato Juan de la Cierva,(Ed.) Cons. Sup. Inv. Cíent. Patronato Juan de la Cierva,Barcelona1950.:80-102. MOREIRA, H. F., Bol. Univ. Fed. ParanáDiatomáceas no trato digestivo da Tegula viridula Gmelin. 1960.1-241: Bol. Univ. Fed. Paraná, Contribução as estudo das Bacillariophy- (Diatomáceas) no Agar-agar (gelosa) e Agaró-1966.1-55.16: Bol. Uñiv Fed. Paraná, Diatomáceas da Lagoa Olho D´Agua1968.1-15.21: MOREIRA, H. F. y M. B. KUITNER, Bol. Univ. Fed. Paran Contribução para o Conhecimento das Diatomáceas do Manguesal de Alexandra.,1962.1-24.4: MOREIRA, H. F., Y. MARUO Y I. M. MOREIRA, Bol. Univ. Fed. Paraná, Diatomáceas da Enseada de Porto Belo.1967.1-13.19: MOREIRA, H. F., I. M. MOREIRA, A. A. PAJARES y I. M. TRIPIA, Bol. Univ. Fed. Paraná,Diatomáceas do Pôrto Salaverry.1971.1-28. 26: MULLER-MELCHERS, F. y H. FERRANDO, Bol. Inst. Oceanogr. Univ. Sdo Paulo,Técnica para el estudio de las diatomeas.1956.152-160.7(1-2): ORTEGA, M. . Informe Depto. Cienc. del Mar y Limnol., Inst. Biol. Univ. Nal. Autón. México.: Informe de avance del Estudio de la vegetación sumergida en los Planes Piloto Yavaros-Escuinapa.1970.287-346 OSORIO-TAFAL, B., Ciencias Mex.,Hallazgo de la diatomea Bidulsinensis Greville, en aguas del Golfo de México.1943.225-230.4(8): PANE Y MOLTENI, Bol. Soc. mex. Geogr. Estad.Noticia geológica del pozo abierto.1958.19-28.6(1): PATRICK, R. y W. C. REIMER, The diatoms of the United States. Acad. nat. Sci. philad.,1966.1-668.13: QUINTANA-GONZÁLEZ, G., Tesis profesional Fac. Ciencias Univ. Nal. Autón. México. Estudio de las diatomeas fósiles de México en el microscopio electrónico y en el espectrómetro de rayos X.1961.79 p. ROUND, F. E., The phytoplankton of the Gulf of California. Part I. Its composition, distribution and contribution to the sediments.J. exp. mar. Biol. Ecol.,1967.76-97.1: SANTOYO-REYES, H., Tesis profesional Fac. Ciencias Univ. Nal. Autón. México.Variación estacional del fitoplancton y la hidrología en la Laguna de Yavaros, Sonora. 1972.71 p. Rev. Lat-amer. Microbiol.,Plancton de Lagunas Costeras. VI. Distribución esacional del fitoplancton en la Laguna de Yavaros, Sonora, México (1969-1970).1974a.49-58.16: Rev. Lat-amer. Microbiol., Fitoplancton otoñal en la región de San Blas, Nayarit (1971).1974b.155-161.16: SCHMIDT, A., Atlas der diatoma ceenunde.Leipzig,1873-1904. 460 láms. SILVA-BÁRCENAS, A., An. Inst. Geol. Univ. Nal. Autón. México, Sistemática y distribución de los géneros de diatomeas de la Laguna de Términos, Camp., México.1963.1-31.67 (2): SKVORTZOW, B. V., Diatoms from Yenisei River and tributaires, Middle part of Siberia, Western Asia.Philipp. J. Sci.,1969.57-113.98 (1): VAN-HEURCK, H., A treatise on the Diatomaceae. Weldom y Wesley, Ltd. Londres.1896.558 p. WOOD, F. E. J., Publs. Inst. mar. Sci. Univ. Tex A study of the diatoms flora of fresh sediments of the Texas Bays and adjacent waters.1963.237-310.9: LAMINAS
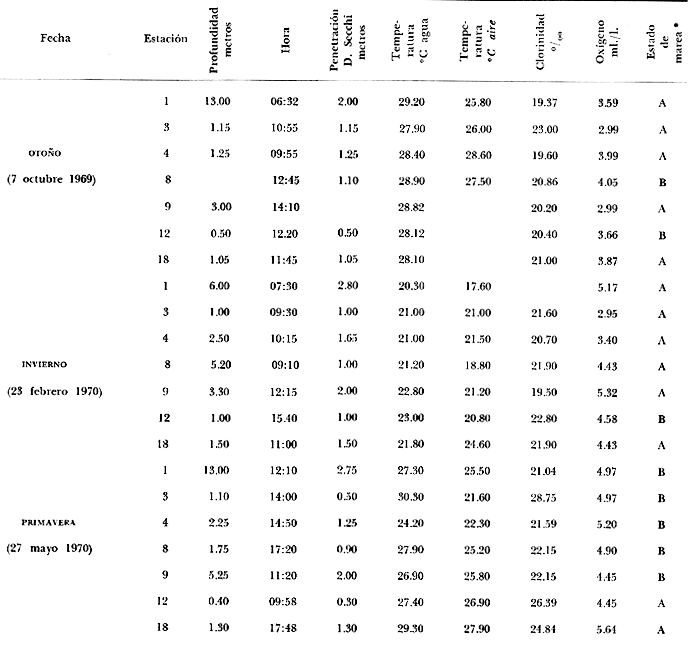 TABLA 1 DATOS HIDROLÓGICOS DE LAS ESTACIONES ESTUDIADAS. *A= alta B= baja 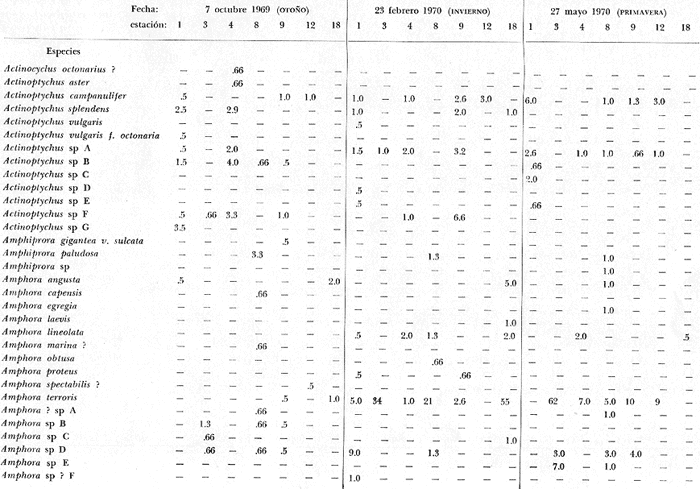 TABLA 2 DISTRIBUCIÓN Y ABUNDANCIA RELATIVA DE DIATOMEAS DE LA LAGUNA DE AGIABAMPO EN TRES ÉPOCAS DEL AÑO. 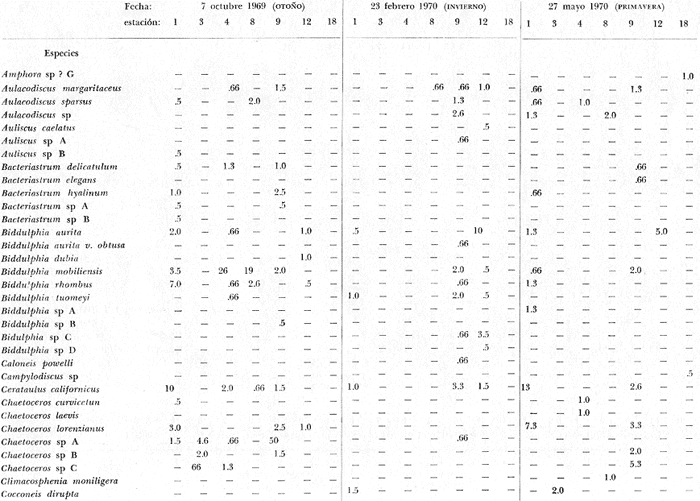 TABLA 2 (CONTINUACIÓN) 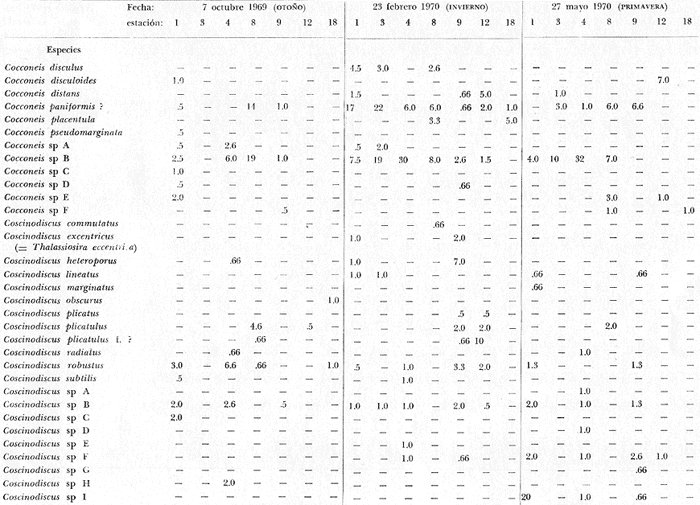 TABLA 2 (CONTINUACIÓN) 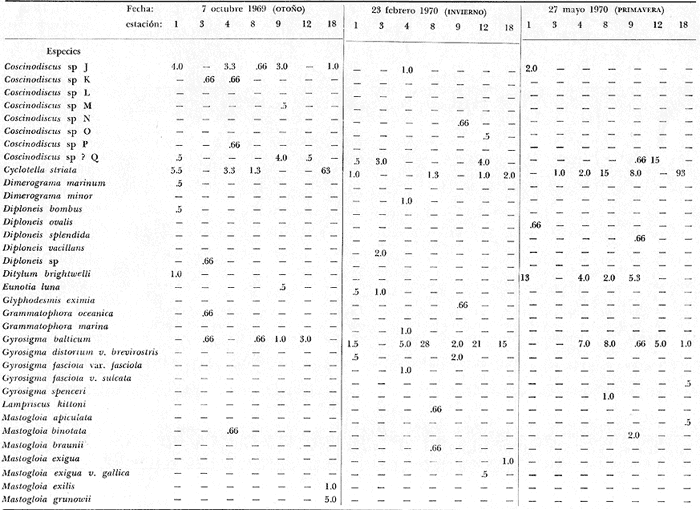 TABLA 2 (CONTINUACIÓN) 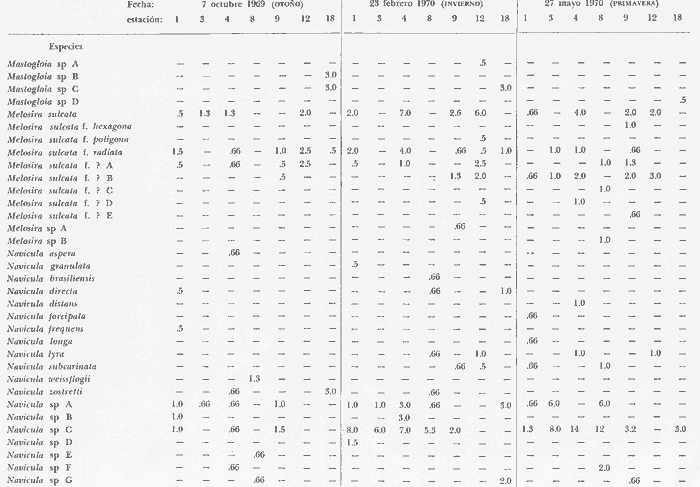 TABLA 2 (CONTINUACIÓN) 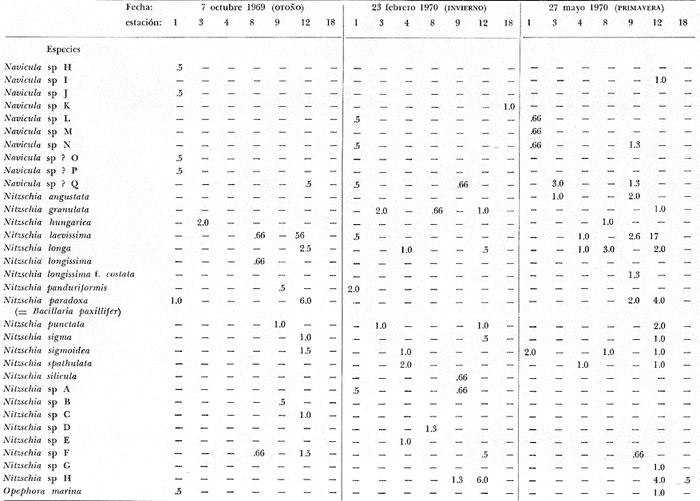 TABLA 2 (CONTINUACIÓN) 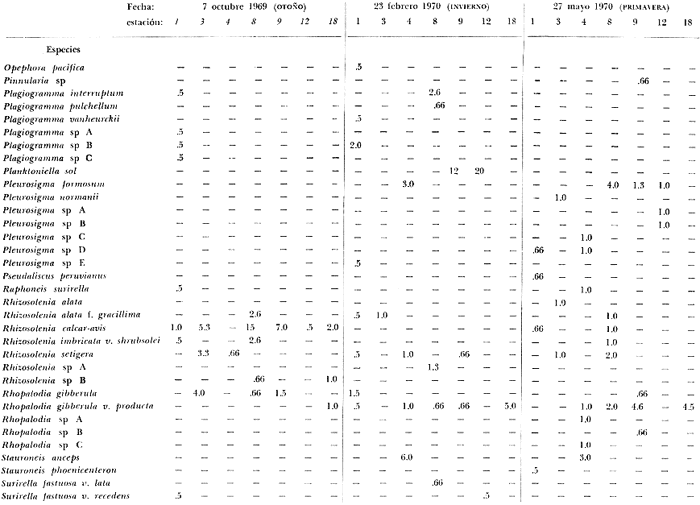 TABLA 2 (CONTINUACIÓN) 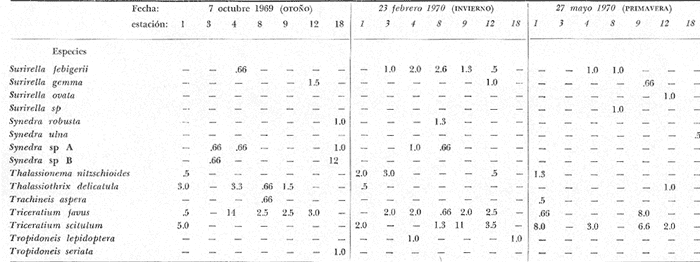 TABLA 2 (CONTINUACIÓN) 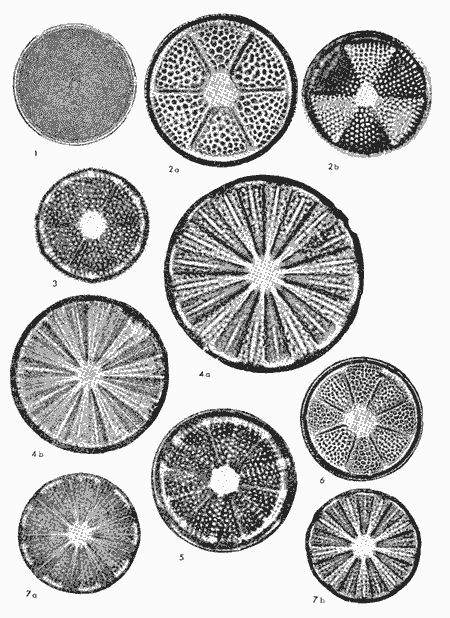 Lámina 1 Lám. 1 Figs. 1. Actinocyclus octonarius Ehrenberg (= Actinoptychus ehrenbergii Ralfs) diam. 85 µ. 2a, 2b. Actinoplychus aster Brun., diam. a: 83 µ., b: 91 µ 3. Actinoptychus campanulifer Sch., diam. 86 µ 4a, 4b. Actinoptychus splendens (Shadb.) Ralfs. diam. a: 126 µ b: 94 µ 5. Actinoptychus vulgaris Schm., diam. 88 µ 6. Actinoptychus vulgaris form. octonaria Ehr., diam. 94 µ 7a, 7b. Actinoptychus Ehr. sp. A, diam. a: 105 µ., b: 94 µ.  Lámina 2 Lám. 2. Figs. 1. Actinoptychus sp B, díam. 122 µ. 2. Actinoptychus sp C, diam. 98 µ. 3. Actinoptychus sp D, diam. 101. µ 4. Actinoptychus sp E, diam. 108 µ. 5a, 5b. Actinoptychus sp F, diam. a: 80 µ. b: 95. µ 6. Actinoptychus sp G, diam. 84 µ.  Lámina 3 Lám. 3. Figs. 1. Amphiprora gigantea var. sulcata (O'Meara) CI., long. 76. µ 2. Amphiprora. paludosa Sm., long. 85 µ. 3. Amphiprora sp long. 190 µ. 4. Amphora angusta (Greg.)CI., long. 63 µ. 5. Amphora capensis (Sch.) Cl., long. 48 µ 6. Amphora egregia Sch., long. 48 pt. 7. Amphora laevis Amphora laevis Greg., long. 52 µ. 8. Amphora lineolata (Ehr.) Kütz., long. 105 µ. 9. Amphora, arina? (Sm.) CI., long. 80 µ. 10. Amphora obtusa Greg., long. 140 µ. 11. Amphora proteus Greg., long. 45 µ. 12. Amphora spectabilis Greg., long. 90 µ. 13a, 13b. Amphora terrorris Ehr., long. 42 µ. 14. Amphora? sp A, long. 110 µ. 15. Amphora sp. B, long. 65 µ. 16. Amphora sp C, long. 56 µ. 17. Amphora sp C, long. 56 µ. 17. Amphora sp D, long. 37 µ. 18. Amphora sp E, long. 35 µ. 19. Amphora? sp F, long. 80 µ. 20. Amphora? sp G (vista cingular), long. 91 µ.  Lámina 4 Lám. 4. Figs. 1. Aulacodiscus margaritaceus Ralfs y Varr, diam. 130 µ. 2. Aulacodiscus sparsus Grev., diam. 77 µ. 3. Aulacodiscus sp, diam. 93 µ. 4. Auliscus caelatus Bail., diam. 130 µ. 5. Auliscus sp A, diam. 120 µ. 6. Auliscus sp B, diam. 108 µ. 7a, 7b. Bacteriastrum delicatulum CL., diam. a: 15 µ. b: 18 µ. S. Bacteriastrum elegans. Pav., diam. 17 µ.  Lámina 5 Lám. 5. Figs. 1. Bacteriastrum hyalinum Laud, diam. 20 µ 2. Bacteriastrum sp B, diam. a: 12 µ. b: 17 µ. 4a, 4b, 4c, 4d. Buddulphia aurita (Lyngb.) Breb y God., (vista cingular) , ancho a: 45 µ. b: 52 µ. c: 49 . d: 53 µ. 5. Biddulphia aurita var. obtusa (Kütz.) Hust., (vista cingular), ancho 60 µ. 6. Biddulphia dubia (Bright.) CI., (vista cingular), ancho 73 µ. 7a, 7b, 7c, 7d. Biddulphia mobiliensis (Bail.) Grun., (vista cingular), ancho a: 126 µ. b: 135 µ. c: 145 µ. d: 130. S. Biddulphia rhombus (Ekr.) Sm., (vista apical), long. 101 µ. 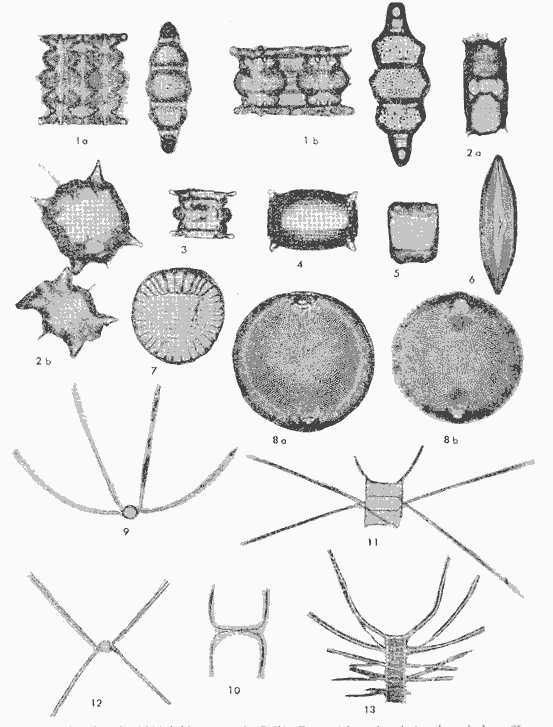 Lámina 6 Lám. 6. Figs. 1a, 1b. Biddulphia tuomeyi (Bail.) Rop., (vista cingular), eje apical a: 65 µ, b: 70 µ. 2a, 2b. Biddulphia sp A, (vista cingular) , eje apical a: 48 µ., b: 50 µ. 3. Biddulphia sp B, (vista cingular) , eje apical 66 µ. 4. Biddu1phía sp Q (vista cingular) , eje apical 75 µ. 5. Biddulphia sp D, (vista cingulair), eje apical 35 µ. 6. Caloneis powelli (Lew.) CI., diam. 97 µ. 7. Campylodiscus sp diam. 75 µ. 8a, Sh. Cerataulus californicus Sch., diam. a: 91 µ b: 68 µ. 9. Chaetoceros curvicetum CI., (vista cingular) , eje apical 18 µ. 10. Chaetoceros curvicetum CI., (vista cingular) eje, apical 18 µ. 10. Chaetoceros laevis Leud-Fortum (vista cingular) , eje apical 10 µ. 11. Chaetoceros lorenzianum Grun., (vista cingular) , eje pervalvar 23 µ. 12. Chaetoceros sp A, (vista cingular) , eje apical 24 µ. 13. Chaetoceros sp B, (vista cingular) , eje pervalvar 28 µ.  Lámina 7 Lám. 7. Figs. 1. Chaetoceros sp C, (vista cingular), eje pervalvar 26 µ. 2a, 2b. Climacosphenia moniligera Ehr., (vista cingular), eje apical, long. aprox 320 µ. 3. Cocconeis dirupta Greg., long. 48 µ. 4a, 4b. Cocconeis disculus (Schum) Cl., long. a: 25 µ. b: 28 µ. 5. Cocconeis disculoides Hust., long. 24 µ. 6a, 6b, 6c. Cocconeis distans Greg., long. a: 28 µ. b: 36 µ. c: 32 µ. 7 Cocconeis paniformis? Brun, long. 28 µ. 8. Cocconeis placentula (Ehr.) Hust., long. 32 µ. 9. Cocconeis pseudomarginata Greg., long. 29 µ. 10. Cocconeis sp A, long. 35 µ. 11. Cocconeis sp B, long. 28 µ. 12. Cocconeis sp C, long. 27 µ. 13. Cocconeis sp D, long. 23 µ. 14. Cocconeis sp E, long. 18 µ. 15. Cocconeis sp F, long. 22 µ. 16. Coscinodiscus conmutatus Grun., diam. 86 µ. 17. Coscinodiscus excentricus Ehr. (= Thalassiosira eccentrica, Cl.), diam. 73 µ. 18. Coscocinodiscus heteroporus Ehr. diam. 157 µ. 19. Coscinodiscus lineatus Ehr. diam. 58 µ. 20. Coccinodiscus marginatus Ehr., diam.  Lámina 8 Lám. 8. Figs. 1. Coscinodiscus obscurus Schum., diam. 90 µ. 2. Coscinodiscus Plicatus (Grun.) CI., diam. 140 µ. 3. Coscinodiscus plicatulus Grun., diam. 91 µ. 4. Coscinodiscus plicatulus Grun., forma ? diam. 85 µ. 5. Coscinodiscus radiatus Ehr., diam. 85 µ. 6. Coscinodiscus robustus Grev., diam. 136 µ. 7a, 7b. Coscinodiscus subtilis Ehr., diam. a: 90 µ. b: 85 µ. 8. Coscinodiscus sp A, diam, 130 µ. 9a, 9b. Coscinodiscus sp B, diam. a: 91 µ. b: 87 µ. 10. Coscinodiscus sp C, diam. 82 µ. 11. Coscinodíscus sp D, (región central).  Lámina 9 Lám. 9. Figs. 1 Coscinodiscus sp E, (Tegión central), 85 µ. 2. Coscinodiscus sp 128 µ. 3. Coscinodiscus sp G, diam. 170 µ. 4. Coscinodiscits sp H, diam. 110 µ. 5. Coscinodiscus sp I, diam. 106 µ. 6. Coscinodiscus sp J, (sección radial), diam. aprox. 185 µ.  Lámina 10 Lám. 10. Figs. 1. Coscinodiscus sp K, diam. 87 µ. 2. Coscinodiscus sp L, diam. 107 µ. 3. Coscinodíscus sp M, diam. 67 µ. 4. Coscinodiscus sp N, diam. 46 µ. 5. Coscinodiscus sp O, diam. 67 µ. 6. Coscinodiscus sp P, diam. 48 µ. 7. Coscinodiscus sp P Q, diam. 40 µ. 8a, 8b, 8c, 8d. Cyclotella striata (Kütz.) Grun., diam. a: 18 µ. b: 23 µ. e: 25 µ. d: 27 . 9. Dimerogramma marinum Ralfs, log. 60 µ. 10. Dimerogramma minor (Greg.) Ralfs, (vista cingular), eje apical 28 µ. 11. Diploneis bombus Ehr., log. 70 µ. 12. Diploneis ovalis (Hilse) CI., long. 80 µ. 13. Diploneis splendida (Greg.) CI., long. 136 µ. 14. Diploneis vacíllans (Sch.) CL., long. 57 µ. 15. Diploneis sp, long. 53 µ. 16. Ditylum brightwelli (West.) Grun., diam 55 µ. l7a, 17b, l7c. Eunotia luna Ehr., long. a: 60 µ. b: 75 µ. c: 53 µ. 18. G1yphodesmis eximia Grev., (vista cingular), eje apical 46 µ. 19. Grammatophora oceanica Ehr. (células en colonia), long. 56 µ 20. Grammatophora marina (Lyngb.) Kütz., (vista cingular), eje apical 66 µ.  Lámina 11 Lám. 11. Figs. la, lb. Gyrosigina balticum (Ehr.) CI., long. a: 300 µ. b: 236 µ. 2. Gyrosigma distortum (Sm.) CI., var. brevirostris Brok., long. 108 µ. 3. Gyrosigma fasciola var. fasciola (Ehr.) CI., long. 90 µ. 4. Gyrosigma fasciola var. sulcatum (Grun.) CI., long. 110 µ. 5. Gyrosigma spenceri (Quek.) CI., long. 150 µ. 6. Lampriscus kittoni Sch., long. 130 µ. 7. Mastogloia apiculata Sm., long. 38 µ. 8a, 8b. Mastogloia binotata (Grun.) CI., long. 43 µ. 9. Mastogloia braunii Grun., long. 42 µ. l0a, 10b. Mastogloia exigua Lew., long. 38 µ. IIa, IIb. Mastogloia exiguavar. gallica P. Pet., long. a y b: 45 µ. 12. Mastogloia exilis Hust., long. 32 µ. 13. Mastogloia grunowii ? Sch., long. 21 µ. 14. Mastogloia sp A, long. µ. 15. Mastogloia sp B, long. 46 µ. 16a 16 b. Mastogloia sp C, long. a y b: 28 µ. l7a, 17b. Mastogloia sp D, long. a y b: 52 µ.  Lámina 12 Lám. 12. Figs. la, lb, 1c, 1d. Melosira sulcata (Ehr.) Kütz., diam. a: 46 µ. b: 52 µ. c: 41 µ. d (células en colonia), eje apical 11 µ. 2a, 2b. Melosira sulcata form.hexagona Grun. diam. a: 38 µ. b: 36 µ. 3. Melosira sulcata form. poligona Grun., diam. 38 µ. 4. Melosira sulcata form.radiata Grun diam. 35 µ. 5. Melosira sulcata form. ? A, diam. 42 µ. 6. Melosira sulcata form. ? B, diam. 34 µ. 7. Melosira sulcata form. ? C, diam. 37 µ. 8.Melosira sulcata Form. ? D, diam. 42 µ. 9. Melosira sulcata form. ? E, diam. 46 µ. 10. Melosira sp A, diam. 45 µ. 11. Melosira sp B, diam. 20 µ.12. Navicula anphibola CI., long. 45 µ.13a, 13b. Navicula granulata (Bail.) Sm. long. a:65 µ. b: 58 µ. 14. Navicula brasiliensis (Weissft.) Grun., long. 87 µ.15a, 15b. Navicula directa (Sm.) Ral., long. a: 88 µ. b (vista cingular), 86. µ. 16. Navicula distans (Sm.) Ral., long. 98 µ. 17. Navicula forcipata Grev., long. 73. µ. 18. Navicula frequens Heurck, long. 80 µ. 19. Navicula longa (Greg.) Ralfs long. 120 µ. 20. Navicula lyra Ehr., long. 89 µ. 21. Navicula subcarinata Hend., long. 120 µ. 22. Navicula weissflogii (Grun.) CI., long. 62 µ. 23. Navicula zostreíti Grun., long. 68 µ. 24. Navicula sp A, long. 65 µ. 25. Navicula sp B, long. 80 µ.  Lámina 13 Lám. 13. Figs. la, lb, 1c, 1d. Navicula sp C, long. a: 48 µ. b: 65 µ. d: 57 µ. 2. Navicula sp D, long. 50 µ. 3, Navicula sp E, long. 85 µ. 4. Navicula sp F, long. 70 µ. 5a, 5b. Navicula sp G, long. a: 101 µ. b: 97 µ. 6. Navicula sp H, (vista cingular), eje apical 105 µ. 7. Navicula sp I, long. 92 µ. 8. Navicula sp J, long. 60 µ. 9. Navicula sp K, long. 56 µ. 10. Navicula sp L, long. 69 µ. 11. Navicula sp M, long. 78 µ. 12. Navicula sp N, (vista cingular) , eje apical 80 µ. 13. Navicula ? sp O, (vista cingular) , eje apical 67 µ. 14. Navicula ? sp P,(vista cingular) , eje apical 45 µ. 15. Navicula ? sp Q, (vista cingular) , eje apical 53 µ. 16. Nitzschia angustata (Sm.) Grun., long. 68 µ. 17. Nitzschia granulata Grun., long. 35 µ. 18. Nitzschia hungarica Grun., long. 60 µ. 19a, 19b. Nitzschia laevissima Grun., long. a: 140 µ. b: 158 µ. 20a, 20b. Nitzschia longa Grun., long. a: 209 µ. b: 287 µ. 21 Nitzschia longissima (Breb.) Ral., long. 225 µ. 22. Nitzschia longissima form. costata (Breb.) Ral., long. 197 µ. 23. Nitzschia panduriformis Greg., long. 95 µ. 24. Nitzschia Paradoxa (Gml.) Grun. (= Ba- cillaria paxillifer (Müller, Hendey, (células en colonia) , eje apical 94 µ.  Lámina 14 Lám. 14. Figs. 1. Nitzschia punctata (Sm.) Grun., long. 35 µ. 2. Nitzschia sigma (Kütz.) Sm., long. 210 µ. 3a, 3b. Nitzschia sigmoídea (Nitzsch.) Sm., long. a: 200 µ. b: 210 µ. 4. Nitzschia spathulata Breb., long. 60 µ. 5. Nitzschia silicula Hust., long. 40 µ. 6. Nitzschia sp A, long. 40 µ. 7. Nitzchia sp B, long. 38 µ. 8. Nitzschia sp C, long. 48 µ. 9. Nitzschia sp D, long. 183 µ. 10. Nitzschia sp E, long. 110 µ. lla, llb. Nitzschia Hass. sp F, long. a: 193 µ. b: 208 µ. 12. Nitzschia sp G, long. 128 µ. 13. Nitzschia sp H, long. 273 µ. 14. Opephora ma rina (Greg.) Pet., long. 48 µ. 15. Opephora pacifica (Grun.) Pet., long. 52 µ. 16. Pinnularia sp, long. 75 µ. 17. Plagiogramma interuptum Grove, (vista cingular) , eje apical 41 µ. 18. Plagiogramma pulchellum Grev., (vista cingular) , eje apical 53 µ. 19. Plagiogramma vanheurckii (vista cingular) , eje apical 45 µ. 20. Plagiograníma sp A, (vista cingular) , eje apical 48 µ. 21. Plagiogramma sp B, (vista cingular), eje apical 74 µ. 22. Plagiogramma sp C, (vista cingular) , eje apical 53 µ. 23. Planktoniella sol (Wall.) Schütt, diam. total 200 µ. 24. Pleurisigma formosum Sm., long. 320 µ. 25. Pleurosigma normanii Ral., long. 145 µ.  Lámina 15 Lám. 15. Figs. 1. Pleurosigma sp A, long. 293 µ. 2. Pleurosigina sp B, long. 287 µ. 3.Pleurosigma sp C, long. 210 µ. 4. Pleurosigma sp D, long. 197 µ. 5. Pleurosigma sp E, lon. 150 µ. 6. Pseudaliscus Peruvianus (Aul.) Grev., long. 112 µ. 7. Rhaphoneis surirella (Ehr.) Grun., long. 47 µ. 8. Rhizosolenia alata Brightw. (parte de una célula en vista lateral), diam. 15 µ. 9a, 9b. Rhizosolenia alata form. gracillima (CI.) Grun. diam. 10 µ. 10. Rhizosolenia calcar-avis Schulze, (parte de una célula mostrando bandas intercalares), diam. 38 µ. lla, llb. Rhizosolenia imbricata var. shrubsolei (CI.) Shröd. (vistas laterales), diam. 18 µ. 12. Rhizosolenia setigera Brightw. (parte de una célula), diam. 18 µ. 13. Rhizosolenia sp A, (parte de una célula), diam. 17 µ. l4a, 14b. Rhizosolenia sp B, diam. 18 µ. l5a, 15b. Rhopalodia gibberula (Ehr.) Müll., long. a: 48 µ b: 60 µ. 16. Rhopalodia gibberula var. producta (Grun.) Cleve-Euler, long. 53 µ. 17. Rhopalodia sp A, long. 80 µ. 18. Rhopalodia sp B, long. 52 µ. 19. Rhopalodia sp C, long. 49 µ.  Lámina 16 Lám. 16. Figs. 1. Stauroneis anceps Ehr., long. 66 µ. 2. Stauroncis phoenicenteron (Nitzsch.) Ehr., long. 98 µ. 3. Surirella fastuosa var. lata Ehr., long. 118 µ. 4. Surirella fastuosa var. (Sch.), long. 72 µ. 5. Surirella febigerii Lew., long. 190 µ. 6a, 6b. Surirella gemma Ehr., long. a: 94 µ. b: 83 µ. 7. Surirella ovala Kütz., long. 49 µ. 8. Surirella sp, long. 41 µ. 9a, 9b. Synedra robusta Ral., diam. 12 µ. 10. Synedra ulna (Nitzsch.) Ehr., long. 103 µ IIa, IIb. Synedra sp A, diam. 13 µ. 12a, 12b. Synedra sp B, diam. 10 µ. 13. Thalassionema nitzschioides Grun., long. 43 µ. 14. Thalassiothrix delicatula Cupp, diam. 6 µ. 15. Trachyneis aspera (Ehr.) CI., long. 126 µ. 16a, 16b. Triceratiurn favus Ehr., eje pervalvar, a: 60 µ. b: 46 µ. 7. Triceratium scitulum Brihtw eje pervalvar 67 µ. 18. Tropidoneis lepidoptera (Greg.) CI. (vista lateral) eje apical 198 µ. 19. Tropidoneis seriata CI., (vista lateral). eje apical. 280 µ.
|

